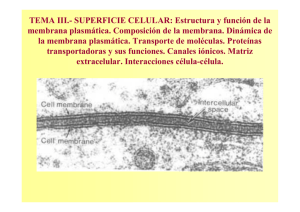
Tesis - Universidad de Colima
Anuncio

I D TU ES A LU CO LIMA T RA B AJ A DE A CH UNIVERSIDAD DE COLIMA MAESTRIA EN CIENCIAS FISIOLOGICAS ESTRUCTURA Y FUNCION DE LOS MICRODOMINIOS DE MEMBRANA. MONOGRAFIA QUE PARA OBTENER EL GRADO DE MAESTRO EN CIENCIAS FISIOLOGICAS CON ESPECIALIDAD EN FISIOLOGIA PRESENTA BIOL. EDGAR OCTAVIO BONALES ALATORRE ASESOR Dr. JOSE JESUS LARA CHAVEZ CO-ASESOR Dr. RICARDO ANTONIO NAVARRO POLANCO COLIMA, COL., OCTUBRE DE 2004 1 Índice Páginas Resumen 1 Abstract Introducción 1 2 ¿Qué es un microdominio de membrana? Esfingolípidos y Colesterol: bloques conformacionales de los microdominios de membrana. Fases de la membrana celular. Balsas Lípidicas. 4 4 7 12 Las Caveolas. Morfología de las caveolas. Tipos de Caveolina. 13 14 15 Estructura de la Caveolina. 17 Dominio de adhesión a la membrana. 19 Dominio de oligomerización. 20 Dominio de Andamiaje. 23 Microdominios y Señalización: traducción de señales. 24 Señalización con proteínas GPI de anclaje. 26 Señalización de respuestas inmunes. 26 Señalización de los factores de crecimiento. 30 Canales iónicos y lipid rafts. 31 Importancia de los microdominios en las enfermedades. 36 Conclusiones 41 Anexo 1 42 Anexo 2 43 Bibliografía 44 2 Índice de tablas y figuras Página Tabla 1 Propiedades físicas de algunos ácidos grasos. 8 Tabla 2 Componentes de señalización asociados con microdominios en células inmunes en estado de reposo y activado. 29 Tabla 3 Enfermedades en las cuales los microdominios y proteínas en microdominios se ven involucrados 36 Figura 1 Clasificación de los lípidos de membrana basada en su estructura. 6 Figura 2 Empaquetamiento de ácidos grasos. 9 Figura 3 Modelo de formación de los microdominios de membrana. 11 Figura 4 Clases de balsas lípidicas. 13 Figura 5 Definiciones Morfológicas y plasticidad de las Caveolas. 15 Figura 6 La caveola esta cubierta por caveolina. 16 Figura 7 Estructura y oligomerización de la caveolina. 18 Figura 8 Modelo de oligomerización de la caveolina-1. 22 Figura 9 Dominio de andamiaje. 23 Figura 10 Modos propuestos para la traducción de la señalización en microdominios de membrana. 25 Figura 11 Modelo para la señalización de MIRRs contenidos en microdominios de membranas. 27 Figura 12 La depleción del colesterol membranal altera el funcionamiento del canal Kv2.1. 34 3 Estructura y función de los microdominios de membrana. Resumen El modelo de mosaico fluido de la membrana plasmática ha evolucionado considerablemente desde su formulación original hace ya 30 años. Ahora se sabe que los lípidos de membrana no forman una fase homogénea consistente de fosfolípidos, donde las proteínas asociadas a la membrana se mueven aleatoreamente, si no que en un mosaico de dominios con una composición bioquímica singular, hecha con esfingolípidos y colesterol, las proteínas asociadas a la membrana parecen tener un movimiento especifico y no-aleatorio en la membrana. Estos dominios llamados microdominios de membrana o “lipid rafts” parecen tener un papel muy importante en la señalización celular, transcitosis, endocitosis de moléculas y patógenos, e incluso, recientes trabajos han demostrado que estos microdominios de membrana están involucrados en el funcionamiento de algunos canales iónicos. Además, debido al papel tan importante que los microdominios desempeñan en los procesos mencionados, las alteraciones, mutaciones, ausencia o presencia de estos microdominios de membrana puede ser factor de diversas enfermedades tales como Alzheimer, Parkinson, VIH, distrofias musculares, arritmias cardiacas, cáncer, entre otras. Abstract The fluid mosaic model of plasma membrane has evolved considerably since its original formulation 30 years ago. Now is known that membrane lipids do not form a homogeneous phase consisting of phospholipids, where membrane-associated proteins move randomly, but a mosaic of domains with unique biochemical composition made of sphigolipids and cholesterol, in this domains the membrane seems to have an specific and non-random movement in the membrane. This domains named membrane microdomains or “lipid rafts” seems to be involved in an important role in cell signalling, transcytosis, endocytosis of molecules and pathogens and even, recently works has demonstrated this lipid rafts are involved in ion channel function. Furthermore, cause the important role of lipid rafts in the processes mentioned, they can be involved in several diseases like, Alzheimer´s disease, Parkinson´s Syndrome, HIV, muscular dystrophies, cardiac arrhythmias, cancer and many more. 4 Introducción. Durante los últimos 30 años, el modelo de mosaico fluido de la membrana celular propuesto por Singer y Nicolson en 1972, ha provisto las bases fundamentales del entendimiento de la estructura y organización de la membrana. Este modelo propone funciona como un solvente neutro bidimensional, que que la bicapa lipídica tiene poca influencia en las funciones de las membranas (Fantini, Garmy, Mahfoud y Yahi, 2002, Pike, 2003, Simons y Toomre, 2000). Este modelo enfatiza la libre movilidad y autonomía de los lípidos y proteínas de la membrana. Sadava en 1992 dijo que este modelo carecía de una organización lateral lo que hacia pensar que las moléculas en difusión podían colisionar e interactuar en el plano de la membrana (Tang y Edidin, 2001). Ciertamente este modelo probo ser una hipótesis muy útil para explicar la estructura de la membrana, pero ahora se sabe, que la libertad de movimiento de las proteínas y los lípidos esta lejos de ser irrestringida y aleatoria. Una de las primeras evidencias de una distribución noaleatoria de las proteínas fue dada por el descubrimiento del “cocaping” hecho por Goding y Layton en 1976. Con el tiempo fueron emergiendo mas evidencias, como la existencia de grupos complejos de proteínas (“clusters”) y distintos tipos de dominios de membrana (Vereb y Damjanovich, 2003), además que en 1985 Thompson y Tillack demostraron el potencial de los glicoesfingolipidos para formar dominios (Dietrich, et al., 2001, Holthuis, Pomorski, Raggers, Sprong y Van Meer, 2001), lo que contradice lo propuesto por el modelo de Singer y Nicolson. Esto propicio la creación de otras hipótesis para explicar la organización de la membrana, una de estas dio origen a un segundo modelo de organización de la membrana, el cual ha venido desarrollándose e implementándose durante las dos décadas pasadas (Tang y Edidin, 2001), desde que van Meer y Simons en 1988 postularon que los microdominios de similar composición lipídica en el aparato de Golgi regulaba el ordenamiento de esfingomielina y glicoesfingolipidos en membranas de células epiteliales polarizadas (Anderson y Jacobson, 2002). Entonces, apoyándose en éste y algunos otros experimentos, fue cuando se empezó a hablar de la hipótesis de los “Lipid Rafts” llamados también “Balsas Lipidicas” o “Microdominios de Membrana” (en esta revisión es correcto referírseles de las tres maneras pero de preferencia se 5 les refirió como microdominios). Esta hipótesis propone que ciertos lípidos se agregan naturalmente en el plano de la membrana llevados solamente por distintas interacciones intermoleculares, incluyendo interacciones de Van der Waals entre las largas y saturadas cadenas de esfingomielina y glicoesfingolípidos, así como también ligaduras de hidrógeno entre los residuos glicosil adyacentes de los glicoesfingolipidos vecinos (Dietrich, et al., 2001). Hasta la fecha dichas interacciones y la formación de los microdominios no se conocen con exactitud por lo que los autores se limitan a decir que la hipótesis de los “Lipid Rafts” propone que el ensamblaje dinámico en la organización lateral de la membrana celular de colesterol con involucrados en esfingolípidos, da lugar a la formación de microdominios los cuales están la traducción de señales, transporte membranal y ordenamiento de las proteínas (Gaus, et al., 2003, Sowa, Pypaert y Sessa, 2001) entre otras funciones que se van descubriendo conforme avanzan los estudios sobre estas balsas lípidicas. La investigación hecha sobre los microdominios de membrana, junto con observaciones clínicas ha dado gran relevancia a este modelo, pues se ha visto que una gran variedad de enfermedades humanas afectan el almacenaje, transporte y traficó de esfingolípidos (Lai, 2003), pero también en los últimos años ha ocurrido una explosión de reportes publicados sobre la función que desempeñan los microdominios en procesos tan diversos como traducción de señales, endocitosis, exocitosis, motilidad celular y como estos procesos se ven involucrados en algunas enfermedades, igualmente importante se ha hecho el estudio de su estructura y el desarrollo de nuevas tecnologías que redefinen nuestro entendimiento de los microdominios, tanto como los aspectos que los involucran (Brown y Jacobson, 2001). En este trabajo se revisa la estructura y función de los microdominios de membrana, así como también los aspectos que se conocen de su participación en las vías de señalización, canales iónicos y enfermedades que los involucran. Además, esta revisión tiene el propósito de aprender bases fundamentales sobre los microdominios, para posteriormente realizar una tesis doctoral donde se utilicen herramientas electrofisiológicas y sustancias depletoras de colesterol para observar el posible efecto que la desorganización de los microdominios pueda tener sobre los canales de tejido cardiaco o neuronal. 6 ¿Que es un microdominio de membrana? Un dominio es una región distintiva marcada por algunas características que la diferencian del paisaje a su alrededor. Por lo tanto, un dominio en una membrana celular, es una región con características físicas y químicas que la diferencian de la membrana contigua (Anderson y Jacobson, 2002). Como sabemos las membranas celulares están compuestas por diversos arreglos de lípidos que adoptan como arquitectura central la bicapa; los lípidos que principalmente componen la membrana son (Fig.1): 1) Los glicerofosfolípidos (GPLs) la familia mas grande de lípidos membranales (también conocidos como fosfolípidos o fosfoglicéridos), en los cuales las regiones hidrofóbicas están compuestas por dos cadenas de ácidos grasos unidas al glicerol; 2) Los esfingolípidos (SLs) que componen la segunda familia más grande de lípidos membranales y al igual que los fosfolípidos tienen una cabeza polar (glucosa, fosfocolina, etc.) y dos colas no polares, pero a diferencia de estos no contienen glicerol, sino una molécula del amino alcohol de cadena larga denominada esfingosina o uno de sus derivados, una de sus colas es una molécula de ácido graso de cadena larga y saturada y la otra es una cadena hidrocarbonada que forma parte de la esfingosina y está unida a ella mediante un enlace glicosídico o fosfodiester. Y finalmente 3) Los esteroles que son compuestos caracterizados por un sistema rígido de cuatro anillos de hidrocarburos fusionados y su principal representante es el colesterol (Nelson y Cox, 2000). Esfingolípidos y Colesterol: bloques conformacionales de los microdominios de membrana. Cuando los esfingolípidos fueron descubiertos ya hace un siglo, por el fisicoquímico Johann Thudichum, su función biológica parecía tan enigmática como una esfinge de donde se origino su nombre, típicamente son encontrados en células eucariontes donde comprenden una pequeña, pero vital porción del 10 al 20% de los lípidos que componen la membrana. En humanos al menos se han identificado 60 esfingolípidos diferentes en membranas celulares (Holthuis, et al., 2001), muchos de estos sobresalen en la membrana plasmática de algunos tipos de células y solo algunos de estos son claramente sitios de reconocimiento en la superficie de la célula, pero para solo pocos de estos esfingolípidos se ha descubierto su función especifica; por ejemplo la parte carbohidrato de los SLs determina los grupos 7 sanguíneos humanos y por lo tanto confiere el tipo de sangre que un individuo puede recibir sin riesgo alguno en una transfusión (Nelson y Cox, 2000). Hay 3 clases de esfingolípidos, todos derivados de la ceramida (ácido graso unido por un enlace amino al segundo carbono de la esfingosina) pero son diferentes en sus cabezas polares, las esfingomielinas (SMs) son la primera clase, tienen fosfocolina o fosfoetanolamina como su cabeza polar, por lo que son los mas parecidos a los GPLs, la segunda clase son los glicoesfingolípidos (GSLs) tienen una cabeza polar compuesta por una o mas azucares conectadas directamente al –OH del primer carbono de la ceramida y no contienen el grupo fosfato, esta clase tiene dos subclases los Cerebrósidos y los Globósidos que usualmente son llamados glicolípidos neutrales ya que no tienen carga, los primeros tienen un azúcar sencilla ligada a la ceramida, aquellos con galactosa son característicamente hallados en la membrana de células provenientes de tejido neuronal, mientras que aquellos con glucosa provienen de membranas de células en tejidos no neuronales; los Globósidos son GSLs con dos o mas azúcares, que usualmente son D-glucosa, D-galactosa o N-acetil-D-galactosamina (Holthuis, et al., 2001, Nelson y Cox, 2000). La tercera clase son los Gangliósidos, tienen oligosacáridos como cabezas polares y uno o mas residuos de ácido N-acetilneuroaminico (Neu5Ac) también llamado ácido sálico- en la parte carbohidratada, dicho componente les confiere a los Gangliósidos la carga negativa a pH 7 (Fantini, 2003, Fantini, et al., 2002, Holthuis, et al., 2001, Nelson y Cox, 2000). Los esteroles también están presentes en la mayoría de las membranas de células eucariontas, están caracterizados por estructuras llamadas núcleos esteroideos consistentes de 4 anillos fusionados, 3 con 6 carbonos y 1 con 5, tal fusión de anillos no permiten rotación entre las ligaduras carbonono-carbono (C-C) y le confieren a la molécula una estructura rígida. El colesterol es el principal de los esteroles presente en las células, es amfipático con un grupo hidroxilo como cabeza polar en el C-3 del núcleo esteroideo y una cadena hidrocarbonada en C-17 (Nelson y Cox, 2000) como se puede ver en la figura 1. 8 Figura 1.- Clasificación de los lípidos de membrana basada en su estructura. Específicamente los lípidos membranales pueden categorizarse como glicerofosfolípidos (GPLs), Esfingolípidos (SLs) y Colesteroles. a) Los GPLs han sido erróneamente llamados fosfolípidos, su estructura base es el glicerol (verde). Los GPLs son los principales componentes de las membranas, su grupo alcohol es eterificado en el carbono 3 del glicerol, los principales alcoholes presentes en los GPLs son colina, etanolamina, serina, glicerol e inositol. El ácido graso (AG) en le C-1 (sn-1) del glicerol siempre tiene una cadena saturada con 16 o 18 átomos de carbono, en el C-2 (sn-2) el AG es generalmente más largo (al menos 18 carbones) y es siempre insaturado con una o más dobles ligaduras cis y C-3 (sn-3), con un grupo fosfato ligado a un alcohol. b) Los SLs formados a partir de una unidad de esfingosina –la cual ya tiene incorporada una cadena saturada de ácido graso- (verde) y una cadena saturada larga de ácido graso (negro) -de mas de 24 átomos de carbono- ligado a la esfingosina por un enlace amida, los 9 diferentes compuestos formados por la esfingosina acilada con las diferentes cadenas de ácidos grasos son llamados ceramidas (en negro y verde). Cuando un grupo fosfato ligado a un alcohol es ligado al primer -OH de la ceramida, resulta en una esfingomielina y cuando un azúcar o un oligosacárido se liga a través de un enlace glicosídico a la ceramida, resulta en un glicoesfingolípido (GSL) y los GSLs que contienen ácido sálico en su parte carbohidratada son llamados Gangliósidos. c) El grupo polar del colesterol es solo un -OH en el carbono 3 del núcleo esteroideo, mientras que la parte hidrofóbica esta compuesta por una cadena de carbonos iso-octil en el carbono 17 (modificado de Fantini 2002). Fases de la Membrana Celular. Los ácidos grasos (AG), componentes esenciales de los lípidos membranales son ácidos carboxílicos con cadenas hidrocarbonadas de 4 a 36 carbonos de largo. En algunos ácidos grasos esta cadena es completamente saturada es decir que no contiene doble ligaduras, en otros la cadena contiene una o más dobles ligaduras lo que hace que el ácido graso sea insaturado. Una nomenclatura simplificada especifica la longitud de la cadena y número de dobles ligaduras separado por dos puntos, así el ácido palmítico de 16 carbonos y cero dobles ligaduras se representa 16:0, mientras que el ácido oleico de 18 carbonos y una doble ligadura se representa 18:1, ahora, para indicar la posición de cualquier doble ligadura se especifica por números superescritos después de la letra griega (delta), de esta manera el ácido linoleico de 18 carbonos y con dos dobles ligaduras una entre los carbonos 9 = 10 y otra entre 12 = 13 se designa 18:2 ( 9,12 ) (Nelson y Cox, 2000). Las propiedades físicas de los ácidos grasos y los componentes que las contienen (tal es el caso de los lípidos de la membrana), están ampliamente determinadas por su grado de insaturación y la longitud de su cadena hidrocarbonada, por ejemplo su solubilidad en agua, mientras la cadena hidrocarbonada del ácido graso sea mayor, y menor su número de dobles ligaduras, menor es su solubilidad en agua (tabla 1). El punto de fusión también es influenciado por estas propiedades, ya que como se ha visto a temperatura ambiente (25ºC) los ácidos saturados de 12:0 a 24:0 carbonos tienen una consistencia cerosa mientras que los insaturados son líquidos aceitosos y como se nota en la tabla 1 su punto de fusión (Tm) también esta determinado por su longitud y grado de instauración, propiedades que influencian el grado de empaquetamiento de los ácidos grasos (Nelson y Cox, 2000). 10 Tabla 1.- Propiedades físicas de algunos ácidos grasos (modificada de Leningher). Nombre del Ácido Nomenclatura Tf (ºC) Solubilidad a 30 ºC (mg/g de H2 O) Laurico 12:0 44.2 0.063 Miristico 14:0 53.9 0.024 Palmítico 16:0 63.1 0.0083 Esteárico 18:0 69.6 0.0034 Araquídico 20:0 76.5 Lignocérico 24:0 86.0 Palmitoleico 16:1( 9 Oleíco 18:1( 9 Linoleico 18:2 ( á-Linoleico 18:3 ( Araquidónico 20:4 ( ) -0.5 ) 13.4 9,12 -5 ) 9,12,15 ) 5,8,11,14 ) -11 -49.5 De esta manera la diferencia en los puntos de fusión es debida a los diferentes grados de empaquetamiento de las moléculas de ácidos grasos (Fig.2). Los componentes completamente saturados, tienen su conformación más estable en su forma extendida de manera que, un grupo de solo AG completamente saturados pueden empacarse tan estrechamente y tan cerca que casi asemejan un arreglo sólido un tanto gelatinoso, ya que los átomos a lo largo de sus cadenas entran en contacto con fuerzas de atracción de Van der Waals con átomos de moéculas vecinas (Holthuis, et al., 2001, Moffett, Brown y Linder, 2000, Nelson y Cox, 2000). Por otra parte en los AG insaturados, una doble ligadura tipo cis presente en la cadena insaturada provoca un doblez de la misma (Fig. 2b), de modo que un grupo mixto de AG saturados e insaturados no puede empacarse tan estrechamente como si solo fueran AG saturados lo que provoca que las interacciones entre cadenas vecinas sean mas débiles (Figs. 2c, 2d) (Nelson y Cox, 2000). 11 Figura 2.- Empaquetamiento de ácidos grasos. La extensión de los AG depende del grado de saturación. a) dos tipos de representaciones de el ácido esteárico que es completamente saturado, cada línea segmentada del zigzag representa una ligadura sencilla entre carbonos adyacentes pertenecientes a la cadena hidrocarbonada del AG. b) La doble ligadura cis en el ácido oleico no permite rotación y origina una curva rígida en la cola hidrocarbonada. c) AG completamente saturados en forma extendida se empaquetan en forma sólida y estable. d) La presencia de una o más ligaduras cis interfiere con el empaquetamiento mencionado en (c), haciéndolo un agregado menos estable. Extrapolando los arreglos de los ácidos grasos previamente mencionados a arreglos de lípidos membranales obtenemos interacciones semejantes, donde se pueden diferenciar varias fases en el estado físico de la membrana. A temperaturas fisiológicas ≈ 36ºC, los lípidos que contienen largas y saturadas cadenas hicrocarbonadas tienden a existir en una fase parecida a un gel (Lβ), mientras que lípidos con dobles ligaduras en sus colas adoptan una existencia en estado líquido cristalino (fase fluida, Lc) y desordenada (Brown y London, 1998, Mukherjee y 12 Maxfield, 2000), de ahí que los dominios membranales formados por esfingolípidos coexisten en una fase Lβ y los formados por fosfolípidos en Lc a temperaturas fisiológicas. Como hemos mencionado los SLs difieren de los fosfolípidos biológicos en contener cadenas ácil largas y saturadas lo que les confiere una temperatura de transición de fase (Tm) más alta, todas estas propiedades les permite tener a los dominios conformados por SLs una fase en estado ordenado mientras que los dominios conformados por GPLs prevalecen a temperaturas fisiológicas en un estado desordenado (Fig.3) (Brown y London, 2000, Fantini, et al., 2002, Kronke, 1999). Además el colesterol tiene importantes efectos en el comportamiento de fase, por ejemplo es bien sabido que al adicionar colesterol a una bicapa de fosfolípidos éste le confiere a la membrana una fase intermedia como la que se daría en la temperatura de transición entre las fases Lβ y Lc (Fig.3a) dándole a estos dominios un carácter cuasiordenado. Al principio este efecto sugirió que los dominios en estados ordenados y desordenados no podían coexistir –debido a la presencia de puros dominios ordenados- en presencia de altas concentraciones de colesterol, pero después, evidencias experimentales mostraron que un diferente tipo de fase podía ocurrir en estas mezclas binarias de lípidos y colesterol, donde dominios en fase Lc coexiste con un nuevo estado, la fase liquida-ordenada (Lo) (Fig.3b) (Brown y London, 2000, de Almeida, Fedorov y Prieto, 2003, Fantini, et al., 2002), donde se observó, que las cadenas ácil de los lípidos en fase Lo son extendidas y estrechamente empacadas, al igual que en la fase gel Lβ, solo que con un mayor grado de movilidad lateral que en Lβ. Mas adelante se descubrió que estos dominios estaban compuestos por SPLs y colesterol, además que tenían un tamaño pequeño por lo que se llamaron microdominios de membrana (Brown y London, 2000, de Almeida, et al., 2003, Moffett, et al., 2000), Además, ya que el colesterol tiene un poco más afinidad por los esfingolípidos que por los fosfolípido, el colesterol libre prefiere interactuar, aunque no exclusivamente con los esfingolípidos (Li, Momsen, Smaby, Brockman y Brown, 2001), es por esto, que existen más interacciones colesterol-SPL que colesterol-GPL, como se puede apreciar en la figura 3b. 13 Figura 3.- Modelo de formación de los microdominios de membrana. a) En bicapas de GPLs por debajo de Tm las moléculas pueden estar empacadas de modo que las cadenas acil están inclinadas en la bicapa normal para formar una fase cristalina Lβ, pero a 37ºC por encima de la Tm, la bicapa se convierte a una fase fluida líquidacristalina (Lc, a veces referida como Lα). La adición de colesterol a estos dominios de GPLs anula la transición térmica normal de la fase Lβ a la fase Lc, dando a la membrana propiedades intermedias entre las dos fases. Sugiriendo una fase homogénea de los lípidos membranales a temperaturas fisiológicas. b) En contraste, un dominio de SPLs forma una fase gel Lβ a 37ºC, con un empaquetamiento estrecho de cadenas saturadas. El colesterol interactúa preferentemente (aunque no exclusivamente) con esfingolípidos y favorece la separación de fases entre SPLs y GPLs. En la membrana plasmática, los GPLs forman un dominio relativamente pobre en colesterol en fase Lc mientras que los SPLs forman una fase líquida ordenada Lo altamente enriquecida con colesterol. De ahí que los microdominios existen en una fase Lo o en un estado con propiedades similares (Modificada de Fantini 2002). 14 Balsas Lípidicas. Históricamente, las balsas lípidicas fueron definidas por su baja densidad y insolubilidad en el detergente Tritón X-100, lo que les hizo ganar muchos acrónimos, tales como: membranas resistentes a detergentes (DRM), membranas insolubles en tritón (TIM), fracciones flotantes insolubles en tritón (TIFF) (Pike, 2003) y membranas enriquecidas en glicolipidos insolubles a detergentes (DIG) (Brown y London, 1998, Simons y Ikonen, 1997) con tantos nombres propuestos para los microdominios uno debía prevalecer, entonces basándose en las características de la fase ordenada Lo de los dominios compuestos por esfingolípidos y colesterol, que es más estable en comparación a la fluida fase presentada por la membrana compuesta por fosfolípidos que esta presente en la mayor parte de la membrana celular, parecería que los pequeños dominios de esfingolípidos flotaran en un mar de fosfolípidos, de ahí el nombre balsas lípidicas (o en inglés lipid rafts) (Simons y Ikonen, 1997). En las balsas lípidicas los esfingolípidos generalmente se integran a la bicapa en la cara extracelular de la membrana, mientras que el colesterol puede estar presente en ambas caras de la membrana (citoplasmática y extracelular) funcionando como espaciador, la naturaleza de los fosfolípidos presentes en la cara citoplasmática (Fig.4) del microdominio de membrana es aún desconocida, pero probablemente también carguen cadenas de ácidos grasos saturados que optimicen el empaquetamiento (Simons y Ikonen, 1997). Morfológicamente se podrían distinguir dos clases de balsas lípidicas (Fig.4) las caveolares (caveolas) y las no caveolares. 15 Figura 4.- Clases de balsas lípidicas. Loa esfingolípidos se sitúan generalmente en la cara extracelular del microdominio de membrana, los fosfolípidos en la cara citoplasmática y el colesterol puede encontrarse en ambas caras de la bicapa. En A) se muestra una balsa lipídica no caveolar o lineal. En B) se muestra una balsa lipídica caveolar que a diferencia de las no caveolares tiene una proteína llamada caveolina. (Modificado de Razani, 2002). Las Caveolas. Mucho antes de la era de la biología molecular, los microscopistas electrónicos de los 50´s describieron los componentes estructurales de la célula. Entre estos componentes se encontraban caveolas intracelulares que se definieron como invaginaciones de la membrana plasmática de 50 a 100 nm de largo (Razani, Woodman y Lisanti, 2002). Estas estructuras en 1953 fueron descritas por George Palade en unas micrografías electrónicas de células endoteliales, dos años mas tarde utilizando células endoteliales de la vejiga Yamada describió 16 estructuras similares a las que nombro caveolae que significa “pequeña caverna”. A pesar de que Palade fue el primero en describirlas, y debido a que Yamada fue quien les puso nombre, a ambos se les considera como los primeros en descubrilas (Hnasko y Lisanti, 2003, Zajchowski y Robbins, 2002). Morfología de las caveolas. La definición clásica de las caveolas resulta ser inadecuada, ya que ahora se sabe que las caveolas son estructuras dinámicas que pueden ser invaginaciones o pueden ser planas, estas últimas no son detectables morfológicamente por lo que no son mencionadas en las primeras descripciones. Además las caveolas puede adquirir la forma de vesículas que han sido desplazadas desde la membrana al citoplasma, como se ha demostrado en algunas condiciones experimentales (Brown y London, 1998). Por otra parte, también se ha observado que las caveolas se pueden fusionar en grupos para formar estructuras en forma de racimos o rosetas, e incluso túbulos elongados o canales trans-celulares de tamaño significantemente más largo al tamaño de las caveolas más grandes de 100 nm (Fig. 5A) (Razani, et al., 2002, Smart, et al., 1999). Intrigantemente estas formas “no tradicionales” de caveolae son encontradas mas comúnmente que la forma tradicional en ciertos tejidos, por ejemplo: racimos de caveolas son muy abundantes en células musculares esqueléticas en desarrolló, las rosetas en adipositos y las vesículas caveolares en células endoteliales (Fig.5B) (Razani, et al., 2002), además se ha visto que las caveolas son comunes en células epiteliales pulmonares y recientes estudios revelan que formaciones parecidas a las caveolas están presentes en células del sistema nervioso (Smart, et al., 1999). Debido a tal dinámica en su morfología, las caveolas ya no pueden ser consideradas como invaginaciones estáticas, ya que como se ha observado pueden tomar formas tan variadas, aunque los procesos involucrados en el desarrollo de las formas caveolares son ampliamente desconocidos (Anderson, 1998, Razani, et al., 2002). 17 Figura 5.- Definiciones morfológicas y plasticidad de las caveolas. A) las caveolas pueden existir en muchas formas además de la forma tradicional. Pueden encontrarse con una forma vesícular o en agregados en racimos, rosetas o en túbulos, incluso los túbulos pueden elongarse a lo largo de la célula para formar canales transcelulalers. B) Dos micrografías electrónicas tomadas con una magnificación de 16,000x, a la izquierda un adiposito en los cuales se observan frecuentemente rosetas caveolares y a la derecha una célula endotelial donde se pueden observar caveolas en todos los estados de asociación a la membrana (modificado de Razani, et al., 2002). Tipos de Caveolina. Ya que la caveolae es considerada como una balsa lipídica, su estructura base esta formada fundamentalmente por colesterol y esfingolípidos como se menciono anteriormente, pero además, esta cubierta de ciertas proteínas que son especificas a caveolas (Fig. 6). También pueden formar dominios con fase liquido ordenada (Lo) resistente a la solubilidad inducida por detergentes. Los cuales pueden ser llamados dominios caveolares o dominios relacionados con caveolas (Smart, et al., 1999). 18 Figura 6.- La caveola esta cubierta por caveolina. A la izquierda, Micrográfica electrónica de un fibroblasto humano rico en caveolas (nótese la forma clásica de la caveola). En el fractal a la derecha, el esquema de una caveola cubierta en la parte citoplasmática por dímeros de caveolina (rojo). En el fractal a la derecha abajo, molécula de caveolina insertada en la membrana de la caveola, Hasta ahora solo se han identificado tres genes pertenecientes a la familia de las caveolas (modificado de (Parton, 2001). La superficie citoplasmática de la caveolae esta cubierta con proteínas integrales membranales pertenecientes a una familia de 21 a 25 kDa llamadas caveolinas (Fig.6). Se han identificado tres genes miembros de la familia de las caveolinas, el primero codifica para la Caveolina-1 (Cav-1), en humanos el gen precursor de esta proteína esta localizado en el brazo largo del cromosoma 7 en la banda 31.1 (7q31.1). Cav-1 fué identificada como proteína tirosina fósforilada de fibroblasto infectado con el virus Rous de sarcoma, más tarde se determinó que era un componente estructural de las caveolas. Cav-1 esta compuesto por tres exones, y al menos se han podido determinar dos isoformas Cav-1α y Cav-1β las cuales se expresan mediante splicing alternativo, la primera es la expresión de los 178 residuos de aminoácidos (aa) que componen esta proteína, mientras que Cav-1β es la expresión del residuo 32 al 178 debido a que hay una iniciación interna de la traducción en el residuo 32. El segundo codifica para caveolina-2 (Cav-2), en humano su gen precursor al igual que cav-1 se localiza en 7q31.1 y fué identificada en membranas ricas en adipositos, esta compuesta por tres exones que 19 codifican para 162 residuos de proteína, su secuencia es la mas divergente entre las tres (anexo1), no obstante a veces es coexpresada con Cav-1 y están distribuidas en células del mismo tipo de tejido. La expresión de los 162 residuos completos es Cav-2α; se han identificado dos isoformas adicionales Cav-2β y Cav-2γ que aun no han sido caracterizadas (Hnasko y Lisanti, 2003, Parton y Richards, 2003, Zajchowski y Robbins, 2002). El tercer gen de esta familia codifica para la caveolina-3 (Cav-3) la cual es músculo especifica (Zajchowski y Robbins, 2002), su gen precursor en humanos esta localizado en el brazo corto del cromosoma 3 en la banda 25 (3p25), se encuentra predominantemente en músculo esquelético y cardiaco (Parton y Richards, 2003), debido a su semejanza con la caveolina-1 (anexo1), fue identificada buscando genes homólogos de Cav-1; Cav-3 esta compuesta de dos exones que codifican para una proteína de 151 residuos. El grado mas alto de identidad entre los tres tipos de caveolina y sus isoformas en las especies analizadas fue una secuencia de nueve aminoácidos “FEDEVIAEP” (Hnasko y Lisanti, 2003, Razani, et al., 2002), que es conocida como “Marca motivo de las caveolinas”. La importancia funcional y estructural de esta secuencia motif permanece desconocida (Razani, et al., 2002). La presencia de la caveolina es tan esencial para la formación de caveolas de manera que en su ausencia no se observa formación caveolar, no obstante cuando se hace expresar caveolina en células que típicamente no presentan caveolas, la formación caveolar es inducida (Pelkmans y Helenius, 2002). Estructura de la Caveolina. Básicamente la estructura de las caveolinas está conformada por seis dominios y grupos palmitoilados (Fig.7A): Uno es el dominio de oligomerización (OD), que es mediante el cual la caveolina mantiene su asociación dimérica con otra caveolina (Hnasko y Lisanti, 2003), los dominios de adhesión, que son dos, uno es el dominio N-terminal de adhesión a la membrana (N-MAD) y el otro dominio C-terminal de adhesión a la membrana (C-MAD); el dominio de andamiaje (SD) el cual no esta compuesto por una parte de secuencia continua de caveolina, si no que su funcionamiento depende de una porción en la secuencia de OD, N-MAD y CMAD. 20 Figura 7.- Estructura y oligomerización de la caveolina. A) Debido a su dominio transmembranal (rojo) la caveolina es capaz de penetrar la membrana. La proteína esta también unida a la membrana por asociaciones con los dominios N-MAD y C-MAD. La oligomerización entre los monómeros de Cav es mediada por una región de 40 aa (residuos del 61-101) conocida como Dominio de Oligomerización (OD) la cual se traslapa con N-MAD. En púrpura el dominio terminal (TD) interactúa con oligómeros adyacentes para formar una cadena (Modificado de Razani,2002). B) Esquema de la oligomerización de la caveolina, de izquierda a derecha, un monomero de cualquiera de las caveolinas puede formar un dímero con caveolina del mismo tipo a excepción de Cav-1 que puede reclutar a Cav-2, formación de oligómeros, ya sean homo -oligomeros de Cav-1 o Cav-3, o heterooligomeros de Cav-1 con Cav-2. Unión de los oligomeros a través del dominio terminal para formar un filamento o red de caveolinas (Modificado de Gumbleton, 2000). 21 Otro dominio, el dominio terminal (TD) del cual no se sabe mucho, se creía que podía participar en la unión con la membrana o posiblemente como un lugar de señalización, aunque no se ha probado que participe en estas funciones, pero estudios recientes han demostrado su participación en la oligomerización. Y por último el dominio transmembranal (TM) que esta compuesto por 32 aminoácidos de la secuencia de la caveolina (residuos 102-134 en Cav-1), al principio se creyó que por su forma y hidrofóbicidad estaba relacionado en la inserción de la caveolina en la membrana, pero después se observo que su tamaño no era lo suficientemente largo como para completar un asa a través de la membrana lípidca, tal observación puso de vuelta la función de este dominio en un acertijo (Razani y Lisanti, 2001). Después de una serie de experimentos hechos por Kurzchalia y Parton (1999), simplificaron esta incógnita al descubrir que la Cav-1 es insertada a la membrana vía la translocación clásica del retículo endoplásmico (ER) y red trans-Golgi, además este proceso era dependiente de un residuo hidrofóbico de 32 aa correspondiente al dominio transmembranal, el cual actúa como péptido de señalización. Los grupos palmitoilados son tres por cada caveolina, estos colaboran en la asociación de la proteína con la membrana celular, en la Cav-1 están dispuestos en los residuos de cisteina 133, 143 y 156 (Razani y Lisanti, 2001). Dominio de adhesión a la membrana. A principios de los 90’s trabajos de Kurzchalia y Parton (1999) y del grupo de Sargiacomo (et al., 1995) demostraron que la caveolina es resistente a la extracción con carbonato de sodio, lo que es indicativo que la caveolina esta asociada integralmente con la membrana plasmática; Para entonces no se sabia como era esta asociación pues tal interacción proteína-membrana resulto un tanto no convencional ya que como ahora es bién aceptado los dominios C-MAD y N-MAD permanecen citoplasmáticos (como se puede ver en la Fig.7A) tal aseveración se demostró tras una serie de experimentos; primero utilizando anticuerpos que reconocen estos dominios de adhesión, se observo que solo se podían unir a sus blancos cuando la célula era solubilizada por detergentes, además poco tiempo después se identificaron sitios de fosforilación y palmitoilación en N-MAD y C-MAD respectivamente. Por otra parte subsecuentes análisis de la secuencia de las caveolinas demostraron que Cav-1 contenía solo una región hidrofóbica en los residuos 102-134, por lo tanto en la estructura de la caveolina esta era la única parte transmembranal la que se denomino dominio transmembranal y no 22 formaba parte de los dominios de adhesión, lo que confirmo que en efecto estos dominios permanecían en el citoplasma (Razani, et al., 2002). Posteriores análisis utilizando deleciónes y mutaciones en la secuencia de las caveolinas, demostraron que el dominio C-MAD dirigía la localización del aparato de Golgi cuando la caveolina era transportada, mientras que N-MAD dirigía específicamente la localización de las membranas caveolares y que además participaba en la oligomerización con otras caveolinas (Kurzchalia, Dupree y Monier, 1994, Razani y Lisanti, 2001). Dominio de oligomerización. Las proteínas de la caveolina interactúan entre ellas para formar homo- y hetero-oligomeros que se unen directamente al colesterol a través de su dominio TM; Los oligomeros de caveolina pueden incluso interactuar con glicoesfingolípidos. Estas interacciones proteínaproteína y proteína-lípido, se piensa que establecen la fuerza que conduce la formación de caveolas (Anderson, 1998, Okamoto, Ninomiya, Miwa y Masaki, 2000). La capacidad de Cav-1 para oligomerizar esta bien documentada, se ha determinado que hay dos aspectos para el proceso de oligomerización: 1) Un péptido de fusión, Glutation Stransferasa (GST) situado en el dominio N-MAD citoplasmático de Cav-1, forma oligomeros espontáneamente in vitro, pero cuando los aa 81-101 de la secuencia correspondiente a este péptido son removidos, no se observa oligomerización. Por otra parte 2) la oligomerización parece ser estabilizada por la palmitoilación de la cisteina en los residuos 133, 143 y 156, de hecho la deleción de los aa 134-154 debilita la oligomerización, asi como el transporte transGolgi de cav-1 a la superficie de la membrana (Fernandez, Ying, Albanesi y Anderso, 2002) lo que hace pensar que esta secuencia funciona como péptido de señalización. Hacia los finales de los 90’s se consideraba que la unidad estructural de la caveolina estaba conformada por 14 o 16 monómeros de esta proteína, los cuales se oligomerizaban formando una unidad de alto peso molecular (aprox. 400kDa), y consecuentemente estas unidades se unían para formar un filamento de caveolinas (Fig. 7B) (Gumbleton, Abulrob y Campbell, 2000). Ahora, recientes estudios han indicado que una secuencia N-terminal de los aa 1-101 23 de Cav-1, a través de una oligomerización in vitro, forman ensamblajes heptaméricos que parecen ser los bloques de construcción de cada filamento (Liu, Rudick y Anderson, 2002). Hasta la fecha se sabe que la Cav-1 y cav-3 son capaces de llevar un proceso de homooligomerización comprendiendo oligomeros de solo puros monómeros de Cav-1 o Cav-3, respectivamente, la Cav-2 existe solo en forma monomérica y homo-dimérica, sin participar en estructuras de alto peso molecular. Sin embargo, se ha observado que Cav-1 es capaz de reclutarla para formar complejos hetero-oligoméricos de alto peso molecular (Gumbleton, et al., 2000). La utilización de programas informáticos para predecir la estructura de las caveolinas, ha propiciado el desarrollo de modelos más acertados de la estructura e interacciones de estas moléculas, uno de los más recientes es el propuesto por Fernández y colaboradores, donde propone que la secuencia de los aa 79-96 de Cav-1 es muy parecida a una α helice (Fig. 8A) y al parecer los dominios comprendidos en la secuencia 1-79 interactuan junto con esta estructura secundaria para formar anillos heptaméricos de caveolina (Fig. 8B). Entonces la unión de estos anillos a través de sus dominios terminales que forman un filamento de 10 nm de ancho, el cual acoplado con otros filamentos terminaran formando la cubierta caveolar (Fig. 8C). 24 Figura 8.- Modelo de oligomerización de la caveolina-1. A) Los aa 79-96 de la secuencia de la caveolina conforman una α hélice. Se muestra una región envolviendo la hélice la cual esta conformada por los aa 1-80 de la secuencia de la cav-1, se sabe que ambas secuencias interactúan pero no se sabe ¿cómo? ni ¿para que? B) Evidencias dadas observando subunidades de los filamentos caveolina, sugieren que las subunidades corresponden a un anillo heptamérico formado por la interacción de las α hélices de 7 monómeros de Cav-1. C) Se muestra como podrían relacionarse los anillos heptamericos para conformar un filamento y a su vez como este puede estar predispuesto para formar la cubierta caveolar (Modificado de Fernández, 2002). 25 Dominio de Andamiaje. Tal vez este dominio sea el más estudiado debido a su importancia en la interacción con proteínas. Estudios de mapeo de la secuencia de la caveolina-1, revelaron que las diversas interacciones de esta con moléculas de señalización es mediado por una región de las caveolinas denominado dominio de andamiaje (Razani, Schlegel y Lisanti, 2000), definir este dominio en términos de que secuencia abarca es complicado, ya que en parte esta implícito dentro del dominio de oligomerización (Fig.9) el cual a su vez contiene el N-MAD, al mismo tiempo las ciertas regiones de C-MAD actúan como puente para permitir la interacción de las proteínas con el dominio de andamiaje comprendido en el dominio de oligomerización. Por lo tanto ambas regiones están participando en la formación de una plataforma en la cubierta caveolar, para que las proteínas puedan interactuar en eventos de señalización y endocitosis de moléculas especificas (Okamoto, Schlegel, Scherer y Lisanti, 1998, Razani, et al., 2000, Smart, et al., 1999). Figura 9.- Dominio de andamiaje. En la figura se puede observar la participación de los ácidos palmiticos de CMAD con los ácidos miristicos y palmiticos para la fijación de proteínas de señalización tales como: kinasas Src y Subunidades α de las proteínas G, al microdominio. Una vez fijadas estas proteínas pueden interactuar con el dominio de andamiaje incluido en dominio de oligomerización. 26 A través de estos dominios, las caveolinas pueden interactuar con subunidades α de proteínas G, H-Ras (que es un oncogeno), proteínas tirosina kinasas de la familia Scr, proteínas kinasas C (PKC), EGF-R (Receptor del factor de crecimiento epitelial), Enzima sintetasa de oxido nítrico (NOS o eNOS), etc. En muchos casos, la activación debida a una mutación inducida de estas moléculas de señalización (e.g. proteínas G, H-Ras y Kinasas Src) previene la interacción con la caveolina; y se ha observado que estas mismas mutaciones incluyendo variantes de H-Ras y proteínas G son encontradas en diversos canceres humanos (Harder y Engelhardt, 2004, Razani, et al., 2000). Microdominios y señalización: Traducción de señales. Análisis bioquímicos de las proteínas llevados a cabo en microdominios de membrana purificados pertenecientes a diversos tipos celulares, han mostrado una sorprendente concentración de moléculas de señalización contenidas dentro de estos (Zajchowski y Robbins, 2002). La existencia de diferentes clases de microdominios (Pike, 2003) y su organización lateral confiere una gran ventaja para la señalización (Harder y Engelhardt, 2004, Simons y Ikonen, 1997), ya que los diferentes tipos de proteínas o componentes de señalización pueden ser confinados a diferentes microdominios de membrana. Contrariamente, otros análisis han mostrado que los microdominios de membrana son muy pequeños, débiles y no son lo suficientemente específicos para organizar los ensamblajes con tales proteínas. Por eso proteínas de andamiaje que estabilizan estas interacciones (como: caveolina, flotillina, anexina II, proteínas GPI de anclaje, etc) entran en juego para formar una plataforma que soporte tales procesos celulares de señalización (Harder y Van Meer, 2003). De esta manera, a grosso modo, los microdominios de membrana pueden ser vistos como plataformas de señalización que sirven para colocalizar los componentes requeridos, facilitando su interacción y apoyando su señalización (Magee, Pirinen, Adler, Pagakis y Parmryd, 2002, Pike, 2003). Así, receptores, factores de acople, enzimas efectoras y substratos están colocalizados en un solo microdominio. De esta manera la traducción de activar con la unión de una señal (ya sea: hormona, péptido, transmisor, etc.) ocurrirá rápida y efectivamente, debido a la proximidad espacial de sus 27 componentes (Matko y Szollosi, 2002, Prior, Muncke, Parton y Hancock, 2003). La especificidad de la señalización puede ser restringida con la localización del receptor en cierta clase de microdominio, el cual contenga una disposición específica de los componentes de señalización. Por lo tanto esta restricción, limitará el acceso de la señal a los componentes o receptores correspondientes de cada diferente vía de señalización, de esta manera se impide la señalización no específica (Foster, De Hoog y Mann, 2003, Pike, 2003). En base a estas observaciones, se han propuesto varias maneras de modulación de la traducción de señales por microdominios de membranas (Fig. 10). Figura 10.- Modos propuestos para la traducción de la señalización en microdominios de membrana. A) El receptor puede estar incluido en el microdominio, iniciando la señalización ahí mismo. La señalización por proteínas GPI asociadas a proteínas como CD59 o efrina A5, vía microdominios relacionados con adaptadores transmembranales y kinasas Src probablemente ocurran de esta manera. Por otra parte, B) El receptor puede residir fuera del microdominio, pero se transloca hacia adentro del microdominio una vez que su ligando se une a el. Parece que la señalización de la proteína CD20 de las células B sucede de este modo. C) La unión de un ligando a un receptor situado en un raft, puede emitir una señal compartamentalizada en el raft que subsecuentemente es regulada a la baja cuando el complejo del receptor migra fuera del raft; este modelo es propuesto para la señalización de EGFR y PDGFR, al desacoplarse el ligando, el receptor puede migrar hacia 28 fuera del raft e interaccionar con moléculas no encontradas en el microdominio. D) El receptor no se encuentra incluso en el lipid raft, sin embargo al activarse puede comunicar una señal al interior del raft para iniciar una vía de señalización. En C) y D) SP representa cualquier proteína de señalización (kinasa Src, proteinas G, Calmodulina, MAPK, ENOS, etc.) que sea correspondiente a la traducción de la señal (Modificado de Zajchowski, 2002). Señalización con proteínas GPI de anclaje. En ciertos tipos de señalización los componentes y complejos de las vías de señalización están incluidos en los microdominios, asi responde eficiente y específicamente, este es el caso de las proteínas glicosilfosfatidilinositol de anclaje (proteína GPI de anclaje a la membrana) (Fig. 10A). Para lograr una asociación estable con la membrana, las proteínas requieren de un anclaje hidrofóbico, el cual es incorporado durante la traducción de la mayoría de las proteínas de los eucariontes, generalmente este anclaje esta compuesto por una secuencia de aa; pero para cierto grupo de proteinas (las GPI) un anclaje glicolipidico es adicionado justo después de la de la traducción, esto esta basado en el fosfatidilinositol, de ahí el nombre de las proteinas GPI de anclaje. Estas proteínas de anclaje pueden ser especificas para un vasto rango de proteínas de la superficie membranal, ya que estas se unen a su extremo C-terminal y son distribuidas a la membrana provistas de una base de fijación membranal (Field y Menon, 2001). Las proteínas que pueden unirse a la base de anclaje que es proporcionada en las proteínas GPI pueden ser exoenzimas (ej.fosfatasas alcalinas), moléculas de adhesión como NCAM y proteínas reguladoras como DAF (factor de decaimiento acelerado), tales combinaciones logran una gran heterogeneidad (Pike, 2004) para la señalización de este tipo. Señalización de respuestas inmunes. En ocasiones la translocación del receptor unido al ligando hacia dentro o fuera del microdominio puede controlar la capacidad de las células para responder a varios estímulos (Fig. 10B), esto es, que un receptor puede residir alrededor de los limites del microdominio pero al acoplarse con el ligando se transporta (no se sabe con exactitud como ocurre el movimiento de los receptores, pero estudios hechos por (Kanzaki y Pessin, 2002), han demostrado que hay asociación de las caveolinas en los microdominios con filamentos de actina) hacia dentro del microdominio para unirse al componente de señalización correcto, en este caso con una tirosin kinasa de la familia Scr (Zajchowski y Robbins, 2002). 29 Otro ejemplo de este tipo de señalización mediada por lipid rafts es el modelo propuesto por (Dykstra, Cherukuri, Sohn, Tzeng y Pierce, 2003) para los receptores MIRR (Receptores multicadena de reconocimiento inmune) (Tabla 2), a esta familia de receptores pertenecen los receptores de células B (BcR), los de células T (TcR) y los Fc epsilon R1 (FcεR1), los cuales no son modulados mediante proteínas GPI u otro proceso de traducción de señales asociado con microdominios de membrana (Matko y Szollosi, 2002). El principal dogma del modelo de Dykstra (Fig. 11), es que el microdominio (Md) sirve para proporcionar eficientemente una distribución espacial de los componentes de traducción en la membrana plasmática y lograr una eficaz iniciación y prolongación de la traducción (Dykstra, et al., 2003), ya sea debido a que en los microdominios se concentran diversas proteínas adaptadoras esenciales para la propagación fluida de la activación de la cascada de señalización o a la capacidad de agregación (por su capacidad de movimiento lateral en la membrana) que tienen estas balsas lípidicas (Alonso y Millan, 2001, Matko y Szollosi, 2002). Figura 11.- Modelo para la señalización de MIRRs contenidos en microdominios de membranas. Se describe la progresión desde la célula en estado de reposo, es decir que no ha detectado ningún ligando correspondiente a una respuesta inmunológica, pasando por la unión del ligando e iniciación de la cascada de señalización, donde se crea un estado de residencia, en el cual los receptores activados se internalizan en el microdominio (Md) 30 conllevando un oligomerización entre ellos, posteriormente los Md tienden a agruparse, y finalmente la agregación de los grupos de Md forman una sinapsis inmunológica (modificado de Dykstra, et al., 2003). En el modelo, al principio la célula se encuentra en reposo, es decir que no ha recibido ninguna señal de iniciación. En este estado los MIRRs están excluidos de los Md, por lo que no están en contacto o próximos a kinasas Src y componentes adicionales indispensables para la señalización, los cuales se encuentran concentrados por la cara citoplasmática de los microdominios. Aunque lo propone este modelo, la exclusión de los MIRRs monoméricos de los Md no es absoluta, si no que es usada para reflejar un equilibrio del receptor con el microdominio, con fines ilustrativos. Enseguida, al detectar la presencia de un ligando eventualmente los MIRRs se asocian con Mds. Sin embargo, la afinidad entre estos es muy débil como para permitir una residencia lo suficientemente larga para propagar la señal, no obstante la unión multivalente de los ligandos con los MIRRs induce la oligomerización entre los receptores activados. En este modelo se propone que el olígomero tiene una alta afinidad por los microdominios, haciendo de esta manera el tiempo de residencia mas largo 1 . Posteriormente si el oligomero es lo suficientemente estable, lo que depende de la afinidad y de la valencia del ligando como ya vimos, el receptor permanecerá residente el tiempo suficiente como para ensamblarse a un “señalosoma” (no se muestra en la figura) el cual esta asociado con filamentos de actina en el citoesqueleto y esta compuesto de adaptadores y otros componentes de señalización que contribuyen a la agrupación de microdominios. Si el receptor no es estable, se difundirá hacia fuera del Md y la señalización cesara (Dykstra, et al., 2003). Por ultimo, en recientes estudios se ha observado que en células T el acople con antígenos desencadena una dramática reorientación en los receptores TcR, moléculas de adhesión y moléculas de señalización en una estructura con un diámetro del orden de micrones llamada sinapsis inmunológica. Recientemente también se han descrito estructuras análogas para células B. Parece ser que estas estructuras son esenciales para la estabilidad y persistencia de la señalización necesaria para una activación completa (Dykstra, et al., 2003). 1 El modelo de Dykstra, no hace predicción del número receptores activados que se requieren para iniciar y sostener la señalización. 31 Debido a la trascendencia de tales hallazgos en el modelo se propone la formación de sinapsis inmunológicas, en el cual se asume que la formación de agrupaciones de microdominios precede a la formación de estas sinapsis. Sin embargo, el hecho de que los Mds jueguen un papel en la formación de estas estructuras inmunológicas o sean pieza clave para organizar los componentes de estas sinapsis todavía queda a ser demostrado (Dykstra, et al., 2003). Tabla 2.- Componentes de señalización asociados con microdominios en células inmunes en estado de reposo y activado. 2 , 3 (Modificada de Dykstra, 2003) MIRR REPOSO ACTIVADO BcR Lyn c-Abl Cbp Syk Btk Vav SHIP PLC-γ 2 PI3-K BLNK TcR Lck Fyn *Itk Rlk Syk *LAT Cbp Csk Cbl *PI3-K (algunas isoformas) Ras Grb-2 PKA PIP2 *ZAP-70 *Vav Slp-76 Shc *PLC-γ 1 SHP-1 Hpk-1 Gads *PKC α/θ *PI3-K (algunas isoformas) IKK *Grb-2 FcεR *Lyn LAT Rac1 *Syk PLC- γ1 Plc-γ 2 Vav1 PI3K Gab-2 Grb-2 Slp-76 2 En la tabla 3 solo se enlistan las moléculas que han sido estudiadas lo suficiente y se ha demostrado que están incluidas o son reclutadas por los microdominios pertenecientes a células T, B y Receptores Fcε. 3 Un asterisco indica que la molécula es encontrada fosforilada en rafts durante la activación. 32 Señalización de los factores de crecimiento. Se ha observado que componentes de diversas vías de señalización en cascada para los factores de crecimiento tales como EGF (Factor de crecimiento epitelial) (Smart, Ying, Mineo y Anderson, 1995), PDGF (Factor de crecimiento derivado de plaquetas) (Liu, Ying, Ko y Anderson, 1996) e insulina (Bickel, 2002), están concentrados en microdominios de membrana. Los lipid rafts se encuentran enriquecidos con receptores para EGF (EGFR) y para PDGF (PDGFR) en células no estimuladas y se puede observar la activación por la fosforilación en cascada de la tirosina cuando se tratan con EGF y PDGF. Las primeros eventos de señalización inducidos por EGF y PDGF, incluyendo la activación de la tirosina kinasa, la fosforilación de proteínas, y en el caso de la vía del EGF, el reclutamiento de proteínas adaptadoras y la activación MAPK (Proteína kinasa activada por mitogenos), ocurren dentro del microdominio (Anderson, 1998, Zajchowski y Robbins, 2002). Esto sugiere que la señalización vía EGF o PDGF es iniciada en los rafts, y que porciones significantes de las vías de señalización están organizadas y colocalizadas en los lipid rafts. La regulación a la baja de las señales que median a estos factores, junto con la disminución de receptores EGF y PDGF contenidos en los microdominios, sugieren un modelo en el cual la migración de receptores hacia fuera de los rafts, que ocurre después de la estimulación del factor de crecimiento, es requerida para la subsecuente internalización por endocitosis, la migración hacia fuera del raft capacita la asociación de los receptores con moléculas de activación no presentes en microdominios (Fig.10C). Por otra parte se ha observado que la estimulación de PDGFR en fracciones de los microdominios causa una fosforilación de la tirosina de EGFRs presentes en la misma fracción del microdominio, resultando en un marcada disminución en la capacidad de EGF para unirse a EGFR. En contraste, el tratamiento con EGF no causo una fosforilación reciproca de PDGFRs, estas observaciones sugieren que las interacciones regulatorias entre estas dos vías PDGFR y EGFR son especificas y unidireccionales, estos es facilitado por la colocalización de ambas vías de señalización (Zajchowski y Robbins, 2002). El tratamiento de FGF-2 (factor de crecimiento de fibroblasto 2) en células humanas LAN-1 con neuroblastoma, también resulta en una fosforilación de la tirosina de muchas proteínas presentes en los microdominios, como la activación de Fyn y Lyn, dos kinasas pertenecientes a la familia Src localizadas en microdoniminios. A pesar de que en las células LAN-1 se 33 expresa FGFR-2 (receptor para FGF-2), a la hora de hacer análisis de colocalización, ni este receptor ni otros tres de la familia de los FGFRs fueron encontrados en fracciones purificadas de microdominios. Esto sugiere que es posible que el desarrollo de la traduccion de la señal sea disparada por la unión de FGF-2 y FGFR-2, lo que genera una primera señal (señal 1) que interactuará con un receptor alterno que se transloca o reside habitualmente en el raft, consecuentemente tal unión podría iniciar la cascada de señalización y resultar una segunda señal (señal 2) (Fig. 10 D) (Zajchowski y Robbins, 2002). Canales iónicos y lipid rafts. Trabajos de colocalización con inmunoflorescencia y aislamiento de rafts, combinado con herramientas de análisis de biología molecular (western blot), han podido demostrar que hay canales iónicos asociados a las balsas lípidicas en forma tan diversa y en diferentes tejidos que resulta muy interesante la dinámica con la que interactúan canal con microdominio (Barbuti, et al., 2004, Frank, Woodman, Park y Lisanti, 2003, Martens, Sakamoto, Sullivan, Grobaski y Tamkun, 2001, Martens, et al., 2000, Yarbrough, Lu, Lee y Shibata, 2002b). Yarbrough y colaboradores (2002) demostraron que las caveolas están involucradas en la regulación de canales cardiacos de sodio (esenciales en el mantenimiento y propagación del impulso eléctrico cardiaco) por medio de un mecanismo que involucra la subunidad α de la proteína G heterotrimerica (Gs), vía estimulación del receptor β-adrenergico en la superficie celular. Dos años mas adelante Barbuti y colaboradores (2004) descubrieron que los canales marcapasos del nodo seno auricular (SAN) importantes en el origen y propagación de los potenciales de acción espontáneos, por lo tanto indispensables en la determinación del ritmo cardiaco, están localizados en microdominios de membrana, además demostraron que la disrupción de los rafts causa una modificación en la cinética del canal, dando como resultado un aumento en la despolarización diastólica. Por otra parte se ha encontrado que en células de ovario de hamster, el factor neuronal de adhesión molecular (NCAM), modula proteínas G que regulan canales rectificadores entrantes de K+ (Kir3) y se demostró que NCAM y Kir3 están localizados en microdominios de membrana (Delling, et al., 2002), También en células de ovario de hamster se demostró que la caveolina-3 junto con una proteína guanilato kinasa asociada a la membrana, forman un complejo de andamiaje que regula el canal dependiente de voltaje Kv1.5 localizado en un microdominio (Folco, Liu y Koren, 2004). 34 Entre otros canales que se asocian con lipid rafts: están los canales dependientes de nucleótidos cíclicos (CNG), los cuales son blancos primarios de señalizaciones inducidas por luz y odorantes en fotorreceptores y neuronas olfatorias, recientemente se reporto que la subunidad α de canales olfatorios CNG A2 presentes en células de epitelio olfatorio de rata, se encontraban asociados a microdominios de membrana, lo que deja la interrogante si otros canales CNG se encuentra asociados a microdominios de membrana (Brady, et al., 2004). También se demostró canales epiteliales de sodio (ENaC) presentes en el ducto colectivo del riñón, colon distal y pulmón, responsables de la reabsorción de sal y la regulación del volumen corporal, están presentes en microdominios de membrana y que además la disrupción de estos microdominios con ciclodextrina causa una redistribución de los canales ENaC afectando su funcionamiento (Hill, An y Johnson, 2002). En células humanas de cáncer de colon (Caco-2) y de pecho (MCF-7, T47D), se ha observado que canales aniónicos de regulación del volumen (VRACs) los cuales se expresan en la mayoría de tipos de células en mamíferos y que además están involucrados en funciones básicas de la célula como control del volumen celular y electrogénesis; La corriente evocada por estos canales, ICl,swell, se estudio en tres líneas celulares deficientes de Cav-1 (Caco-2, MCF-7 y T47D), donde los análisis electrofisiológicos mostraron que la corriente ICl,swell era muy pequeña, pero esta corriente se restauraba cuando se inducía la expresión de Cav-1β y no Cav-1α lo que indica que el efecto es especifico de la isoforma β de la caveolina-1, estos hallazgos llevaron a proponer a los autores que la caveolina incrementa la disponibilidad de los canales VRAC en la membrana plasmática o que alternamente la Cav-1β juega un papel importante en la cascada de señalización de los VRAC (Trouet, et al., 1999). Como se ha mencionado los canales iónicos juegan un papel muy importante en fisiología celular y aun que no todos se asocien con lipid rafts se han propuesto debido al dinamismo de las balsas lípidicas, que la asociación de canales con microdominios pueden estar involucrados en la regulación de la barrera funcional endotelial, debido a que los canales iónicos están involucrados en la regulación de permeabilidad celular, trancitosis, angiogénesis, respuesta al estrés (Frank, Woodman, Park y Lisanti, 2003) y apoptosis (Szabo, Adams y Gulbins, 2004). Algunos trabajos mas sobresalientes son los estudios hechos por Martens y colaboradores (2000) que demostraron que los canales de potasio voltaje dependiente Kv2.1 estan presentes 35 en microdominios no caveolares en células transfectadas y células de cerebro de rata, situación que no ocurre con el Kv4.2, para hacer estas conclusiones posibles, ellos utilizaron células de cerebro de rata que establemente expresaban los canales Kv2.1 y Kv4.2, dichas células (ver técnica de aislamiento de microdominios Anexo2) fueron solubilizadas con el detergente Triton X-100 al 1% (este detergente es capaz de disrumpir los fosfolípidos de la membrana dejando intactos los esfingolípidos que componen los microdominios y con ello los componentes de señalización y proteínas transmembranales que se encuentran incluidos en las balsas lípidicas), después con la técnica de gradiente de sucrosa (Anexo2), se aislaron las fracciones de la membrana pertenecientes a los rafts, los cuales fueron colectados del sobrenadante del tubo de ensayo donde se practico esta técnica, después se analizaron con western blot, donde se dividió en 20 columnas el gel y se determino que las columnas 4-8 pertenecían a rafts y se marco con anticuerpos para Kv2.1, Kv4.2 y caveolina. Se encontró que Kv2.1 y la caveolina se encontraban en columnas de rafts mientras que Kv4.2 no, esto hizo suponer que que el canal Kv2.1 se encontraba inserto en un microdominio de membrana, para demostrar si Kv2.1 se encontraba en un microdominio caveolar, Martens y colaboradores (2000), utilizaron técnicas de inmunoflorescencia para detectar si existía colocalización entre la caveolina y Kv2.1, estos experimentos mostraron que la colocalización entre ambos era incompleta, lo que sugiere que Kv2.1 esta localizado en un raft que no tiene caveolina, es decir en un microdominio no caveolar. Justificando estos resultados, los mismos experimentos fallaron para demostrar una asociación entre Kv2.1 y caveolina en celulas L y miocardiocitos de rata, en las cuales se ha demostrado que expresan ambas proteínas. Una vez que se demostró que Kv2.1 se localizaba en un microdominio no caveolar. Resultaba de gran importancia comprender como el microdominio estaba involucrado en le funcionamiento del canal. En un esfuerzo por contestar esta interrogante Martens et. al. (2000) trataron a las células que expresan establemente kv2.1 con 2% de 2-hidroxipropil-βciclodextrina durante 1 hr, este tratamiento depleta colesterol y como consecuencia desorganiza los microdominios y produce una alteración en la fluctuación del canal en la balsa lipídica. Las células tratadas fueron analizadas utilizando la técnica de patch clamp en su configuración de célula completa, para determinar el funcionamiento del canal. La densidad de corriente y cinética de activacion no se vieron afectadas (comparar Fig. 12 A y B). Incluso 36 la sensitividad al voltaje tampoco se vio afectada (Fig.12 C), sin embargo, el tratamiento con ciclodextrina altero significantemente el estado estable de la inactivación de Kv2.1, esto se evidencia en la figura 12D por un corrimiento hiperpolarizante a la derecha de 36 mV en la curva de inactivación. Es importante mencionar que los efectos de la ciclodextrina no fueron debidos a una interacción directa de la droga con el canal, ya que al aplicar directamente 2% de ciclodextrina al baño no se observo efecto en el funcionamiento del canal, lo que descarta cualquier interacción de las moléculas de ciclodextrina con las proteínas que conforman el canal. Por lo tanto, interesantemente, el tratamiento no modifica la apertura del canal ni la expresión del canal en la superficie membranal, si no que específicamente altera la inactivación (Martens, et al., 2000). Figura 12.- La depleción del colesterol membranal altera el funcionamiento del canal Kv2.1. A) registro de la corriente en células control que expresan establemente Kv2.1. B) Corriente de una célula tratada con 2% de ciclodextrina, no se muestran cambios con las células control. C) grafica mostrando la dependencia de voltaje de 37 la curva de activación de Kv2.1, determinado por la magnitud de corriente de cola, en el cuadro en blanco las células (n=13) control y el punto negro para las células (n=9) con el tratamiento de ciclodextrina, nótese que el tratamiento no altera la activación del canal. D) en la grafica se muestra la curva de inactivación, de células control (n=12) líneas con cuadro blanco y las células tratadas (n=5) líneas con puntos negros. Se observa claramente un corrimiento hiperpolarizante hacia la derecha causado por el tratamiento con la ciclodextrina. Un año después Martens y colaboradores (2001) demostraron que los canales Kv se insertan en distintas poblaciones de lipid rafts, ya que encontraron que Kv1.5 se encuentra específicamente en caveolas y que Kv2.1 se encuentra en rafts no caveolares como lo habían demostrado con anterioridad. También observaron que la depleción de colesterol y la inhibición de la sintésis de esfingolípidos alteraban la función del Kv1.5 ya que, interesantemente en este canal se inducía un cambio hiperpolarizante en la dependencia de voltaje de la activación y la inactivación. Se sabe que los canales Kv son modulados por la activación de varias vías de señalización y comúnmente contienen múltiples sitios de fosforilación, debido al conocimiento de que en los microdominios se localizan diversas proteínas de señalización, se propone que la asociación de canales con rafts sirva principalmente para agrupar moléculas de señalización con canales iónicos (Martens, et al., 2000), de esta manera eficientando el funcionamiento del canal. Además el hecho de que los canales Kv pueden ser específicos a un tipo de raft, sugiere que debe haber un mecanismo que diferencie la distribución de las diferentes isoformas de canales Kv a microdominios específicos (Martens, et al., 2001). Por otra parte, la localización de canales de potasio Kv1.3 en la sinapsis inmunológica (Panyi, et al., 2004) y el descubrimiento de la distribución no aleatoria de Kv1.3 (Panyi, et al., 2003) junto con el modelo que propuso Dykstra et al (2003) sugiere un posible asociación muy interesante (la cual no ha sido demostrada) de este canal con microdominios. En cuanto al crecimiento de nervios se ha demostrado que canales de sodio son importantes en la inserción de nueva membrana en el cono de crecimiento en los nervios (Wood, DeBin, Strichartz y Pfenninger, 1992), pero además se ha propuesto que los microdominios son requeridos para la migración de los conos de crecimiento de los nervios (Nakai y Kamiguchi, 2002) lo que hace suponer una asociación de canales de sodio con microdominios en la membrana de estos conos 38 de crecimiento nervioso. También se ha observado que al enriquecer las células aorticas endoteliales de bovino con colesterol provoca que la densidad de corriente en canales Kir disminuya, mientras que la depleción de colesterol causa un aumento, esto sugiere que puede existir una asociación entre balsas lípidicas y canales Kir (Romanenko, Rothblat y Levitan, 2002). También resulta importante notar que varios canales de calcio estan localizados en caveolas y como consecuencia pueden jugar un papel importante en la regulación de la activación de eNOS (Frank, et al., 2003). Otros canales que pueden estar asociados con microdominios son canales de cloro, canales mitocondriales, bombas de intercambiadoras de Na+/K+ (Szabo, et al., 2004) y bombas de Ca+ que juegan un papel importante en el control de calcio libre citoplasmático (Fujimoto, 1993). Importancia de los microdominios en las enfermedades. Redes complejas de señalización son responsables en el control de importantes funciones celulares, tales como desarrollo, diferenciación, adhesión, motilidad, etc. La regulación incorrecta de las señales puede ocasionar muchas enfermedades. No es sorpresa que los microdominios, debido a su importancia en la regulación de señales, estén involucrados en una amplia variedad de desordenes (tabla 3). Tabla 3.- Enfermedades en las cuales los microdominios y proteínas en microdominios se ven involucrados (Simons y Ehehalt, 2002). • Enfermedad de Alzheimer. • Enfermedad de Parkinson. Escherichia coli • Distrofias Musculares. Mycobacteria tuberculosis and bovis • Polineuropatias, enfermedades Campylobacter jejuni desmielizantes Vibrio cholerae Enfermedades autoinmunes, inflamación Clostridium difficile cronica, respuesta vacilar. (pseudomembranous colitis) • Respuesta de células B Clostridium tetani • Respuesta de células T Salmonella, Shigella • Asma y respuestas alérgicas • Neoplasias • Arteroesclerosis • • • Infecciones bacteriales Infecciones virales Virus de la influenza 39 • Hipertension, regulación hemodinámica HIV-1 • Diabetes Virus Measles • Hiperparatiroidismo Virus sincicial respiratorio • Osteoartritis Filoviridae (Ebolavirus, Marburgvirus) • Ulceraciones gastrointestinales Papillomaviridae and polyomaviridae • Hemoglobinuria paroxismal nocturna Virus de Epstein-Barr • Almasenaje lisosomal • Enfermedad de Niemann-Pick • Enfermedad de Tay-Sachs, Leucodistrofia metacromática • Enfermedad de Pilzaeus-Merzbacher • Desordenes en la biosíntesis de colesterol • Pore-forming toxins (gas gangrene) • Sepsis, choque séptico Echovirus 1 Otros patógenos Plasmodium (malaria) Trypanosoma (enfermedad del sueño) Leishmania Prions (Enfermedad Creutzfeldt-Jakob, Kuru, Sindrome Gerstmann-SträusslerScheinker) Toxoplasma gondii Deleciónes en la región q31 del cromosoma humano 7 (justo donde residen Cav-1 y Cav-2) implican la patogénesis de muchas formas diferentes de canceres humanos (Freeman y Solomon, 2004, Razani, et al., 2000, Stahlhut, Sandvig y van Deurs, 2000), tales deleciónes han sido detectadas usando marcadores microsatelitales con largas repeticiones de cisteinaadenosina C-A y pequeñas repeticiones cisteina-guanina C-G, de los cuales el D7S522 ha sido el más útil, ya que las deleciónes normalmente se distribuyen alrededor del locus donde marca D7S522, se ha observado que cuando se pierde este locus ocurre una amplia variedad de canceres epiteliales, incluyendo el cáncer primario de pecho, de próstata, ovario, colon y carcinomas renales. Además, D7S522 se empareja con un sitio muy frágil (FRA7G), que reside en 7q31.1; con estas bases y algunos estudios de carcinogénesis, se ha propuesto que un gen supresor de tumores reside en 7q31.1. Con este incentivo se realizaron estudios de mapeo genético en el DNA de Cav-1 y Cav-2 humano, revelando que D7S522 esta localizado más o menos a 67 kilobases (kb) rió arriba de Cav-2, y que Cav-2 esta más o menos a 19 kb rio arriba de Cav-1, esto da bases para proponer que Cav-1 y no Cav-2, debido a la superior dinámica mostrada por Cav-1 sobre Cav-2 en la estructuración de la cubierta caveolar como se menciono anteriormente, que Cav-1 es un gen supresor de tumores en el locus D7S522 del 40 cromosoma 7 humano (Razani, et al., 2000). No obstante todavía se desconoce cual es el mecanismo utilizado por la caveolina 1 para actuar de tal manera. Por otra parte, Cav-3 esta localizada en el sarcolema de tejidos esqueléticos, cardiacos y lisos. Su distribución coincide con la de otra proteína marcadora músculo-especifica de la membrana plasmática, la distrofina, incluso se ha demostrado que Cav-3 es capaz de formar complejos físicos con la distrofina y sus glicoproteínas asociadas (Song, et al., 1996), lo que sugiere que Cav-3 juega un papel esencial en la fisiología del músculo. Recientemente evidencias genéticas realzaron la importancia de Cav-3 en el funcionamiento muscular, cuando Minetti y colegas (1998) identificaron la forma autosomal dominante de distrofia muscular de la parte inferior del cuerpo (Limb girdle muscular disthrophy (LGMD)) la cual es debido a una deficiencia en la expresión de Cav-3 (Galbiati, et al., 2001), análisis de este DNA mostraron dos distintas mutaciones en Cav-3: la primera es una pequeña deleción de 9 pares de bases que remueve la secuencia de los aa del 63-65 correspondientes a TFT (treonina, fenilalanina, treonina) en el dominio de andamiaje; la segunda es una mutación sin sentido que cambia una prolina por una leucina en secuencia 105 (P105L) correspondiente al dominio transmembranal. Ambas mutaciones causan una perdida de un 95% de caveolina-3 (Razani, et al., 2000, Smart, et al., 1999). Una hipótesis para el padecimiento de LGMD es que la mutación en el dominio de andamiaje impide un ensamblaje correcto en la oligomerización de Cav-3, lo que conllevaría a esta proteína a una vía degradativa. Recientemente la localización de lipid rafts en tejidos cardiacos (Barbuti, et al., 2004, Feron, et al., 1996, Gratton, Bernatchez y Sessa, 2004) y vasculares,(Mason y Jacob, 2003) ha despertado un gran interés en el papel que tienen los microdominios en estas patologías. El nodo senoatrial (SAN) es la región del corazón de la cual potenciales de acción espontáneos se originan y propagan a determinado ritmo cardiaco, la reciente localización de Cav-3 en SAN hecha por Barbuti y colegas (2003) demostró que la disrupción de los microdominios hecha por metil-β-ciclodextrina (MβCD) causa un gran incremento en el declive y ritmo de la despolarización diastólica, incluso se demostró que la cinética de desactivación de HCN4 y canales f nativos se hizo mas lenta después de la desorganización de los microdominios, en conclusión este trabajo indica que los canales marcapasos residen en lipid raft y que la 41 desorganización de estas balsas lípidicas causa que los canales se redistribuyan en la membrana y modifiquen las propiedades de estos canales (Barbuti, et al., 2004). Los canales de sodio voltaje dependiente presentes en células miocárdicas, juegan un papel clave en la excitabilidad del miocardio y en la propagación del impulso cardiaco. Mutaciones observadas en este canal han sido ligadas a la patogénesis de ciertas cardiopatías como el síndrome QT largo y el síndrome de Brugada. Shibata y colegas (Yarbrough, Lu, Lee y Shibata, 2002a) demostraron que la aplicación de péptidos derivados de la subunidad α de la proteína Gs (Gα s ) (la cual regula la canales de sodio) potencia la corriente de sodio evocada por isoprotenol, lo cual se atribuye a un aparente incremento en canales funcionando, Shibata y colaboradores propusieron que la fuente de estos nuevos canales podría ser la caveola, ya que utilizando anticuerpos dirigidos a la Cav-3, estos investigadores fueron capaces de bloquear el efecto del isoproterenol en los canales de Na+. Interesantemente estos efectos son específicos, pues otros anticuerpos dirigidos a otros tipos de caveolina no tuvieron el mismo efecto. Por otra parte se ha documentado, que en miocitos cardiacos, parece ser que preferencialmente hay un enriquecimiento de canales de Na+ y Gα s en microdominios caveolares, estos datos llevaron a concluir que un incremento en la actividad del sistema nervioso simpático conlleva al reclutamiento de canales de Na+ de los microdominios caveolares hacia el sarcolema, de esta manera incrementando la corriente de Na+ (Feron y Kelly, 2002). Las caveolinas incluso regulan el nivel de colesterol intra- y extracelular. Animales genéticamente diseñados para que no expresen Cav-1, muestran marcados defectos en relajación arterial, tono biogénico e intolerancia al ejercicio como resultado de anormalidades en la señalización celular (Mason y Jacob, 2003) y en el metabolismo del NO (Frank, et al., 2003). La expresión de caveolina es marcadamente elevada en condiciones de hipercolesterolemia y en la arterosclerosis, se ha mostrado que los microdominios juegan un papel importante ya que la acumulación de colesterol en células vasculares tiene efectos depletorios en la función de la membrana, incluyendo el transporte iónico y la traducción de señales (Mason y Jacob, 2003). En células endoteliales, el excesivo incorporamiento de colesterol a la membrana durante un padecimiento de hiperlipidemia, puede interferir con el 42 transporte activo de aminoácidos, tales como L-arginina. Como resultado, la activación de eNOS provoca una sobreproducción de súper oxido, que puede ser factor de modulación de propiedades fisicoquímicas en los lípidos de membrana, el enriquecimiento de colesterol también disturba la función de otras proteínas de transporte, incluyendo canales sensibles a voltaje, como el canal de K+ activado por calcio, en el cual el enriquecimiento en colesterol favorece el estado cerrado del canal, resultando en un estrés estructural y energético del canal. Por otra parte, en la formación de microdominios precede cualquier evidencia de formación de cristales de colesterol extracelulares, lo que sugiere que los rafts pueden representar un papel fundamental en la génesis de estos cristales. Prevenir la formación de cristales de colesterol es una meta importante, ya que estas macromoléculas rígidas contribuyen en los mecanismos de lesión y muerte celular, incluyendo apoptosis (Mason y Jacob, 2003). A nivel neuronal los microdominios de membrana también se involucran en unos padecimientos, uno de los ejemplos mas estudiados es en la enfermedad de Alzheimer (AD), donde el péptido amiloide-Aβ (Aβ) se ha identificado como el componente patológico de esta enfermedad. Aβ provoca el disparo de una cascada de señalización que eventualmente conlleva a una neurodegeneración. AD es un padecimiento ligado a mutaciones en genes de la proteína precursora de amiloide (APP), presenilina-1 y presenilina-2, todas estas mutaciones resultan en el aumento en la producción de Aβ. Estudios han mostrado que el colesterol modula el procesamiento de APP en neuronas de hipocampo de rata. Se observó que producción y secreción de Aβ la se reducía dramáticamente si los niveles de colesterol eran reducidos utilizando estatinas solas o en combinación de MβCD, después se observó que se obtenía el mismo resultado solo utilizando MβCD. Lo que incito a estudiar si APP estaba relacionado con lipid rafts, recientes estudios mostraron que cierta parte del procesamiento de amiloides de APP se lleva acabo en rafts, pero interesantemente, el Aβ en los rafts parece promover la fibrilogénesis del Aβ soluble, lo que sugiere que Aβ asociado a rafts adopta una conformación diferente, aun que todavía no se sabe ¿Como los raft pueden cambiar la conformación de Aβ? (Simons, Keller, Dichgans y Schulz, 2001a, Simons, et al., 2001b)). 43 Conclusiones. Debido a que los conocimientos sobre las proteínas que interactúan con la membrana esta basado en el modelo de Singer-Nicolson del Mosaico fluido de la membrana, ya el modelo de los microdominios de membrana modifica a este ultimo, es lógico que los microdominios se encuentren interactuando en una vasta gamma de funciones celulares. El modelo original de Simons y Wandinger-Ness de los lipid rafts fue formulado para explicar el transporte de lípidos y glicoproteínas en las células polarizadas, fue tal su impacto que se extendió a procesos de traducción de señales, endocitosis (incluyendo la entrada de patógenos), regulación de canales iónicos, transporte trans-celular y transmembranal, etc. Sin embargo todavía queda mucho por comprender, desconocemos ciertas cosas de su estructura, tal es como ¿Qué diferencia a un microdominio de otro, para que este sea especifico a la distribución de ciertos tipos de proteínas? o ¿Cómo esta dirigida la inserción en la membrana de los esfingolípidos y el colesterol que conforman los microdominios?. Ya sea esta al azar o mediante vesículas específicamente dirigidas. Por otra parte todavía quedan isoformas de caveolina por identificar, además de otra nueva proteína que es específica a lipid rafts la flotillina. También es importante identificar que nuevas proteínas de señalización se asocian con lipid rafts y con que padecimientos puedan estar relacionadas estas asociaciones. Se han identificado muy pocos canales iónicos relacionados con lipid raft, pero la m i portancia que esta asociación tiene con padecimientos cardiacos, neuronales e incluso de muerte celular es un gran incentivo para un disparo en la producción de estudios en este tema. Además queda la parte practica ya que los canales iónicos en los microdominios parecen ser muy atractivos como blancos farmacológicos, lo que impulsa el desarrollo de fármacos que trabajen en padecimientos asociados a los microdominios. Y por último queda la pregunta de que ¿Si los medicamentos depletores de colesterol administrados en la actualidad, son benéficos? o ¿podrían empeorar las cosas? Ya que estos pueden desorganizar los microdominios, y con ello interrumpir las funciones que estos realizan. 44 Anexo 1 En el anexo se muestra las secuencias alineadas de la familia de genes de la caveolina. Se alinean la secuencia de la Cav-1, Cav-2 y Cav-3, los residuos idénticos son resaltados rojo, nótese que la caveolina 1 y 3 tinen un mayor grado de similitud, mientras que Cav-2 es mas divergente. Los sitios de iniciación están resaltados en un círculo púrpura. Además se resaltan las secuencias pertenecientes al dominio transmenbranal o segmemto que traspasa la membrana (verde), dominio de oligimerización (azul) y el dominio de andamiaje (azul con rallado negro). 45 46 Bibliografía. Alonso, M. A. y Millan, J. (2001). The role of lipid rafts in signalling and membrane trafficking in T lymphocytes. J Cell Sci. 114, 3957-3965. Anderson, R. G. (1998). The caveolae membrane system. Annu Rev Biochem. 67, 199-225. Anderson, R. G. y Jacobson, K. (2002). A role for lipid shells in targeting proteins to caveolae, rafts, and other lipid domains. Science. 296, 1821-1825. Barbuti, A., Gravante, B., Riolfo, M., Milanesi, R., Terragni, B. y DiFrancesco, D. (2004). Localization of pacemaker channels in lipid rafts regulates channel kinetics. Circ Res. 94, 1325-1331. Bickel, P. E. (2002). Lipid rafts and insulin signaling. Am J Physiol Endocrinol Metab. 282, E1-E10. Brady, J. D., Rich, T. C., Le, X., Stafford, K., Fowler, C. J., Lynch, L., Karpen, J. W., Brown, R. L. y Martens, J. R. (2004). Functional role of lipid raft microdomains in cyclic nucleotide-gated channel activation. Mol Pharmacol. 65, 503-511. Brown, D. A. y London, E. (1998). Functions of lipid rafts in biological membranes. Annu Rev Cell Dev Biol. 14, 111-136. Brown, D. A. y London, E. (2000). Structure and function of sphingolipid- and cholesterolrich membrane rafts. J Biol Chem. 275, 17221-17224. Brown, D. A. y Jacobson, K. (2001). Microdomains, lipid rafts and caveolae (San Feliu de Guixols, Spain, 19-24 May 2001). Traffic. 2, 668-672. de Almeida, R. F., Fedorov, Sphingomyelin/phosphatidylcholine/cholesterol phase A. y diagram: Prieto, boundaries M. and (2003). composition of lipid rafts. Biophys J. 85, 2406-2416. Delling, M., Wischmeyer, E., Dityatev, A., Sytnyk, V., Veh, R. W., Kars chin, A. y Schachner, M. (2002). The Neural Cell Adhesion Molecule Regulates Cell-Surface Delivery of G-Protein-Activated Inwardly Rectifying Potassium Channels Via Lipid Rafts. J. Neurosci. 22, 7154-7164. Dietrich, C., Bagatolli, L. A., Volovyk, Z. N., Thompson, N. L., Levi, M., Jacobson, K. y Gratton, E. (2001). Lipid rafts reconstituted in model membranes. Biophys J. 80, 1417-1428. 47 Dykstra, M., Cherukuri, A., Sohn, H. W., Tzeng, S. J. y Pierce, S. K. (2003). Location is everything: lipid rafts and immune cell signaling. Annu Rev Immunol. 21, 457-481. Fantini, J. (2003). How sphingolipids bind and shape proteins: molecular basis of lipidprotein interactions in lipid shells, rafts and related biomembrane domains. Cell Mol Life Sci. 60, 1027-1032. Fantini, J., Garmy, N., Mahfoud, R. y Yahi, N. (2002). Lipid rafts: structure, function and role in HIV, Alzheimers and prion diseases. Expert Rev Mol Med. 2002, 1-22. Fernandez, I., Ying, Y., Albanesi, J. y Anderso, R. G. W. (2002). Mechanism of caveolin filament assembly. Proc Natl Acad Sci U S A. 99, 11193-11198. Feron, O. y Kelly, R. A. (2002). Gainning Respectability: Membrane-Delimited, CaveolarRestricted Activation of Ion Channels. Circulation Research. 90, 369-370. Feron, O., Belhassen, L., Kobzik, L., Smith, T. W., Kelly, R. A. y Michel, T. (1996). Endothelial nitric oxide synthase targeting to caveolae. Specific interactions with caveolin isoforms in cardiac myocytes and endothelial cells. J Biol Chem. 271, 22810-22814. Field, M. C. y Menon, A. K. (2001). Glycosylphosphatidylinositol anchored proteins. Encyclopaedia of Molecular Medicine. (Creighton, T.E., ed), J. Wiley and Sons. Folco, E. J., Liu, G. X. y Koren, G. (2004). Caveolin-3 and SAP97 form a scaffolding protein complex that regulates the voltage-gated potassium channel Kv1.5. Am J Physiol Heart Circ Physiol. 287, H681-690. Foster, L. J., De Hoog, C. L. y Mann, M. (2003). Unbiased quantitative proteomics of lipid rafts reveals high specificity for signaling factors. Proc Natl Acad Sci U S A. 100, 5813-5818. Frank, P. G., Woodman, S. E., Park, D. S. y Lisanti, M. P. (2003). Caveolin, caveolae, and endothelial cell function. Arterioscler Thromb Vasc Biol. 23, 1161-1168. Freeman, M. R. y Solomon, K. R. (2004). Cholesterol and prostate cancer. J Cell Biochem. 91, 54-69. Fujimoto, T. (1993). Calcium pump of the plasma membrane is localized in caveolae. J Cell Biol. 120, 1147-1157. Galbiati, F., Engelman, J. A., Volonte, D., Zhang, X. L., Minetti, C., Li, M., Hou, H., Jr., Kneitz, B., Edelmann, W. y Lisanti, M. P. (2001). Caveolin-3 null mice show a loss of caveolae, changes in the microdomain distribution of the dystrophin-glycoprotein complex, and t-tubule abnormalities. J Biol Chem. 276, 21425-21433. 48 Gaus, K., Gratton, E., Kable, E. P., Jones, A. S., Gelissen, I., Kritharides, L. y Jessup, W. (2003). Visualizing lipid structure and raft domains in living cells with two-photon microscopy. Proc Natl Acad Sci U S A. 100, 15554-15559. Gratton, J. P., Bernatchez, P. y Sessa, W. C. (2004). Caveolae and caveolins in the cardiovascular system. Circ Res. 94, 1408-1417. Gumbleton, M., Abulrob, A. G. y Campbell, L. (2000). Caveolae: an alternative membrane transport compartment. Pharm Res. 17, 1035-1048. Harder, T. y Van Meer, G. (2003). Lipid-Based Membrane Domains: Physics Meets Immunology. Traffic. 4, 812-820. Harder, T. y Engelhardt, K. R. (2004). Membrane domains in lymphocytes - from lipid rafts to protein scaffolds. Traffic. 5, 265-275. Hill, W. G., An, B. y Johnson, J. P. (2002). Endogenously Expressed Epithelial Sodium Channel Is Present in Lipid Rafts in A6 Cells. J. Biol. Chem. 277, 33541-33544. Hnasko, R. y Lisanti, M. P. (2003). The biology of caveolae: lessons from caveolin knockout mice and implications for human disease. Mol Interv. 3, 445-464. Holthuis, J. C., Pomorski, T., Raggers, R. J., Sprong, H. y Van Meer, G. (2001). The organizing potential of sphingolipids in intracellular membrane transport. Physiol Rev. 81, 1689-1723. Kanzaki, M. y Pessin, J. E. (2002). Caveolin-associated Filamentous Actin (Cav-actin) Defines a Novel F-actin Structure in Adipocytes. The Journal of Biological Chemistry. 277, 25867-25869. Kronke, M. (1999). Biophysics of ceramide signaling: interaction with proteins and phase transition of membranes. Chem Phys Lipids. 101, 109-121. Kurzchalia, T. V. y Parton, R. G. (1999). Membrane microdomains and caveolae. Curr Opin Cell Biol. 11, 424-431. Kurzchalia, T. V., Dupree, P. y Monier, S. (1994). VIP21-Caveolin, a protein of the transGolgi network and caveolae. FEBS Lett. 346, 88-91. Lai, E. C. (2003). Lipid rafts make for slippery platforms. J Cell Biol. 162, 365-370. Li, X. M., Momsen, M. M., Smaby, J. M., Brockman, H. L. y Brown, R. E. (2001). Cholesterol decreases the interfacial elasticity and detergent solubility of sphingomyelins. Biochemistry. 40, 5954-5963. 49 Liu, P., Rudick, M. y Anderson, R. G. W. (2002). Multiple Funtions of Caveolin-1. The Journal of Biological Chemistry. 277, 41295-41298. Liu, P., Ying, Y., Ko, Y. G. y Anderson, R. G. (1996). Localization of platelet-derived growth factor-stimulated phosphorylation cascade to caveolae. J Biol Chem. 271, 1029910303. Magee, T., Pirinen, N., Adler, J., Pagakis, S. N. y Parmryd, I. (2002). Lipid rafts: cell surface platforms for T cell signaling. Biol Res. 35, 127-131. Martens, J. R., Sakamoto, N., Sullivan, S. A., Grobaski, T. D. y Tamkun, M. M. (2001). Isoform-specific localization of voltage-gated K+ channels to distinct lipid raft populations. Targeting of Kv1.5 to caveolae. J Biol Chem. 276, 8409-8414. Martens, J. R., Navarro-Polanco, R., Coppock, E. A., Nishiyama, A., Parshley, L., Grobaski, T. D. y Tamkun, M. M. (2000). Differential targeting of Shaker-like potassium channels to lipid rafts. J Biol Chem. 275, 7443-7446. Mason, P. R. y Jacob, R. F. (2003). Membrane Microdomains and Vascular Biology : Emerging Role in therogenesis. Circulation. 107. Matko, J. y Szollosi, J. (2002). Landing of immune receptors and signal proteins on lipid rafts: a safe way to be spatio-temporally coordinated? Immunol Lett. 82, 3-15. Moffett, S., Brown, D. A. y Linder, M. E. (2000). Lipid-dependent targeting of G proteins into rafts. J Biol Chem. 275, 2191-2198. Mukherjee, S. y Maxfield, F. R. (2000). Role of Membrane Organization and Membrane Domains in Endocytic Lipid Trafficking. Traffic. 1, 203 - 211. Nakai, Y. y Kamiguchi, H. (2002). Migration of nerve growth cones requires detergentresistant membranes in a spatially defined and substrate-dependent manner. J. Cell Biol. 159, 1097-1108. Nelson, D. L. y Cox, M. M. (2000). Lehninger Principles of Biochemistry. Worth Publishers. Third Edition. Okamoto, T., Schlegel, A., Scherer, P. E. y Lisanti, M. P. (1998). Caveolins, a Family of Scaffolding Proteins for Organaizing "Preassembled Signaling Complexes" at the Plasma Membrane. The Journal of Biological Chemistry. 273, 5419-5422. 50 Okamoto, Y., Ninomiya, H., Miwa, S. y Masaki, T. (2000). Cholesterol oxidation switches the internalization pathway of endothelin receptor type A from caveolae to clathrin-coated pits in Chinese hamster ovary cells. J Biol Chem. 275, 6439-6446. Panyi, G., Vamosi, G., Bacso, Z., Bagdany, M., Bodnar, A., Varga, Z., Gaspar, R., Matyus, L. y Damjanovich, S. (2004). Kv1.3 potassium channels are localized in the immunological synapse formed between cytotoxic and target cells. PNAS. 101, 1285-1290. Panyi, G., Bagdany, M., Bodnar, A., Vamosi, G., Szentesi, G., Jenei, A., Matyus, L., Varga, S., Waldmann, T. A., Gaspar, R. y Damjanovich, S. (2003). Colocalization and nonrandom distribution of Kv1.3 potassium channels and CD3 molecules in the plasma membrane of human T lymphocytes. PNAS. 100, 2592-2597. Parton, R. G. (2001). Cell biology. Life without caveolae. Science. 293, 2404-2405. Parton, R. G. y Richards, A. A. (2003). Lipid rafts and caveolae as portals for endocytosis: new insights and common mechanisms. Traffic. 4, 724-738. Pelkmans, L. y Helenius, A. (2002). Endocytosis via caveolae. Traffic. 3, 311-320. Pike, L. J. (2003). Lipid rafts: bringing order to chaos. J Lipid Res. 44, 655-667. Pike, L. J. (2004). Lipid rafts: heterogeneity on the high seas. Biochem J. 378, 281-292. Prior, I. A., Muncke, C., Parton, R. G. y Hancock, J. F. (2003). Direct visualization of Ras proteins in spatially distinct cell surface microdomains. J Cell Biol. 160, 165-170. Razani, B. y Lisanti, M. P. (2001). Caveolins and caveolae: molecular and functional relationships. Exp Cell Res. 271, 36-44. Razani, B., Schlegel, A. y Lisanti, M. P. (2000). Caveolin proteins in signaling, oncogenic transformation and muscular dystrophy. Journal of Cell Science. 113, 2103-2109. Razani, B., Woodman, S. E. y Lisanti, M. P. (2002). Caveolae: from cell biology to animal physiology. Pharmacol Rev. 54, 431-467. Romanenko, V. G., Rothblat, G. H. y Levitan, I. (2002). Modulation of Endothelial InwardRectifier K+ Current by Optical Isomers of Cholesterol. Biophysical Journal. 83, 3211-3222. Sargiacomo, M., Scherer, P. E., Tang, Z., Kubler, E., Song, K. S., Sanders, M. C. y Lisanti, M. P. (1995). Oligomeric structure of caveolin: implications for caveolae membrane organization. Proc Natl Acad Sci U S A. 92, 9407-9411. Simons, K. y Ikonen, E. (1997). Functional rafts in cell membranes. Nature. 387, 569-572. 51 Simons, K. y Toomre, D. (2000). Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 1, 31-39. Simons, K. y Ehehalt, R. (2002). Cholesterol, lipid rafts, and disease. J Clin Invest. 110, 597603. Simons, M., Keller, P., Dichgans, J. y Schulz, J. B. (2001a). Cholesterol and Alzheimer´s disease: Is there a link? Neurology. 57, 1089-1093. Simons, M., Schwarz, K., Kriz, W., Miettinen, A., Reiser, J., Mundel, P. y Holthofer, H. (2001b). Involvement of lipid rafts in nephrin phosphorylation and organization of the glomerular slit diaphragm. Am J Pathol. 159, 1069-1077. Smart, E. J., Ying, Y. S., Mineo, C. y Anderson, R. G. (1995). A detergent-free method for purifying caveolae membrane from tissue culture cells. Proc Natl Acad Sci U S A. 92, 1010410108. Smart, E. J., Graf, G. A., McNiven, M. A., Sessa, W. C., Engelman, J. A., Scherer, P. E., Okamoto, T. y Lisanti, M. P. (1999). Caveolins, Liquid-Ordered Domains, and Signal Transduction. Mol. Cell. Biol. 19, 7289-7304. Song, K. S., Scherer, P. E., Tang, Z. L., Okamoto, T., Chafel, M., Chu, C., Kohtz, D. S. y Lisanti, M. P. (1996). Expression of caveolin-3 in skeletal, cardiac and smooth muscle cells. Caveolin-3 is a component of the sarcolemma and co-fractiones with dystrophin and dystrophin associated glycoproteins. J. Biol. Chem. 271, 15160-15165. Sowa, G., Pypaert, M. y Sessa, W. C. (2001). Distinction between signaling mechanisms in lipid rafts vs. caveolae. Proc Natl Acad Sci U S A. 98, 14072-14077. Stahlhut, M., Sandvig, K. y van Deurs, B. (2000). Caveolae: uniform structures with multiple functions in signaling, cell growth, and cancer. Exp Cell Res. 261, 111-118. Szabo, I., Adams, C. y Gulbins, E. (2004). Ion channels and membrane rafts in apoptosis. Pflugers Arch. 448, 304-312. Tang, Q. y Edidin, M. (2001). Vesicle Trafficking and Cell Surface Membrane Patchiness. Biophysical Journal. 81, 196 - 203. Trouet, D., Nilius, B., Jacobs, A., Remacle, C., Droogmans, G. y Eggermont, J. (1999). Caveolin-1 modulates the activity of the volume-regulated chloride channel. J Physiol (Lond). 520, 113-119. 52 Vereb, G. y Damjanovich, e. a. (2003). Dynamic, yet structured: The cell membrane three decades after the Singer-Nicolson model. PNAS. 100, 8053 - 8058. Wood, M., DeBin, J., Strichartz, G. y Pfenninger, K. (1992). Plasmalemmal insertion and modification of sodium channels at the nerve growth cone. J. Neurosci. 12, 2948-2959. Yarbrough, T. L., Lu, T., Lee, H. C. y Shibata, E. F. (2002a). Localization of cardiac sodium channels in caveolin-rich membrane domains: regulation of sodium current amplitude. Circ Res. 90, 443-449. Yarbrough, T. L., Lu, T., Lee, H.-C. y Shibata, E. F. (2002b). Localization of Cardiac Sodium Channels in Caveolin-Rich Membrane Domains: Regulation of Sodium Current Amplitude. Circ Res. 90, 443-449. Zajchowski, L. D. y Robbins, S. M. (2002). Lipid rafts and little caves. Compartmentalized signalling in membrane microdomains. Eur J Biochem. 269, 737-752. 53