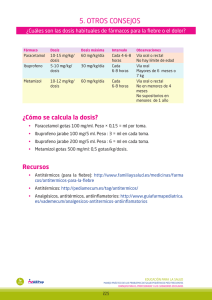
Monografía IliDap
Anuncio

U.S.A. 12555 Orange Drive Suite 259, Davie, FL 33330 Office Phone (954) 862-3600 Office Fax (954) 442-9591 MÉXICO Andrés Bello 10, Piso 6 y 7 Torres Fórum Colonia Polanco Chapultepec 11560 México D.F. Teléfono (5255)-36010600 (5255)-36010750 www.roderickla.net. COLOMBIA Cra. 15 No. 85-29 Of. 401 Tel: (571) 691 6303 • Fax: (571) 635 7956 Celular: (57) 310 373 8874 Bogotá, D.C., Colombia [email protected] www.lasma.net MONOGRAFÍA iliDap® (Ibuprofeno Lisinato IV) Inyección para uso intravenoso DESCRIPCIÓN iliDap es una solución transparente, estéril y sin preservantes de la sal l-lisinato de (±) Ibuprofeno. Ibuprofeno es un agente anti-inflamatorio no esteroide (Aine). L-lisinato se utiliza para crear una sal farmacéutica, soluble en agua, que es adecuada para administración intravenosa. Cada mL de iliDap contiene 17.1 mg de Ibuprofeno Lisinato (equivalente a 10 mg de Ibuprofeno) en agua para inyección. El pH ha sido ajustado a 7.0 . ® ® Fórmula estructural: CH3 (CH3)2 CHCH2 NH2 CHCOOH H2N (CH2)4 CHCOOH DOSIFICACIÓN Y ADMINISTRACIÓN iliDap esta expresado químicamente como un metil-4-(2-metil propil) acido bencenoacético sal lisina. Su fórmula empírica es C19H32N2O4. Se produce como un sólido cristalino de color blanco que es soluble en agua y ligeramente soluble en etanol. ® INDICACIONES iliDap está indicado en el tratamiento para cerrar el conducto arterioso permeable en bebés prematuros que pesan entre 500 y 1.500g y que no tengan más de 32 semanas de edad gestacional, cuando el tratamiento médico habitual (por ejemplo: restricción de líquidos, diuréticos, asistencia respiratoria, etc.) sea ineficaz. El ensayo clínico fue llevado a cabo entre bebés con CAP asintomático. Sin embargo, no se han evaluado las consecuencias resultantes después de 8 semanas de tratamiento por lo tanto, el tratamiento deberá ser reservado para lactantes con evidencia clínica significativa de CAP. ® Dosis Recomendada Un ciclo de tratamiento con iliDap es de tres dosis administradas por vía intravenosa (la administración a través de una línea arterial umbilical no ha sido evaluada). Una dosis inicial de 10 mg por kilogramo será seguida por dos dosis de 5 mg por kilogramo cada una, después de las 24 y 48 horas. Todas las dosis deberán estar basadas en el peso del bebé al nacer. Si anuria o una marcada oliguria (diuresis <0,6 ml / kg / h) se hacen evidentes a la hora programada para la segunda o tercera dosis de iliDap , no se deberá administrar ninguna dosis adicional hasta que los análisis de laboratorio indiquen que la función renal haya regresado a la normalidad. Si el ducto arterioso se cierra, o reduce significativamente su tamaño después de finalizar el primer ciclo de iliDap , entonces no será necesario administrar una dosis adicional. Por el contrario, si durante el tratamiento y monitoreo médico continuo, se observa que el ducto arterioso no se cierra o vuelve a abrirse, entonces deberá considerarse un segundo ciclo de iliDap ® ® ® ® Página 1 Indicaciones de uso Para administración Intravenosa únicamente. Los medicamentos parenterales deberán siempre ser inspeccionados visualmente, para detectar partículas antes de ser administrados siempre y cuando la solución y el envase lo permitan. Para su administración iliDap deberá diluirse a un volumen apropiado con dextrosa al 5% o solución salina de cloruro de sodio al 0,9%. iliDap debe ser administrado durante un período continuo de 15 minutos a través del puerto IV más cercano al sitio de inserción. Una vez suministrado el medicamento durante el tiempo indicado cualquier solución restante DEBERÁ SER DESECHADA ya que iliDap no contiene preservantes. ® ® ® iliDap es potencialmente irritante para los tejidos, por lo tanto debe administrarse con mucho cuidado para evitar la extravasación. ® iliDap no se debe administrar simultáneamente en la misma vía intravenosa en la que se está administrando la Nutrición Parenteral Total (NPT). Si es necesario, la NTP deberá ser interrumpida durante 15 minutos antes y 15 minutos después ® de la administración del medicamento. La fluidez de la línea intravenosa debe ser mantenida con dextrosa o solución salina. Presentación - Dosis iliDap (Ibuprofeno Lisinato Inyectable), se dispensa en viales de vidrio transparente; cada uno contiene 2 ml de solución estéril. La solución no es "Buffer" y no contiene preservantes. Cada mililitro contiene 17,1 mg / ml (±) Ibuprofeno Lisinato [equivalente a 10 mg / ml (±) Ibuprofeno] disuelto en agua para inyección, USP. iliDap se suministra en una caja de cartón que contiene 3 viales, cada una para un solo uso. ® ® Manejo y Almacenamiento Debe almacenarse a temperaturas entre 20 25°C (68 - 77°F). La solución reconstituida en dextrosa al 5% o solución salina de cloruro de sodio 0,9% es estable por 4 horas a temperatura inferior de 25º C y en condiciones de refrigeración (2 - 8º C). Protéjase de la luz en su envase y empaque originales hasta que su contenido sea utilizado. Efectos Secundarios Los efectos adversos más frecuentemente reportados se muestran en el cuadro 1. Cuadro 1. Resultados adversos durante 30 días de terapia, en Estudio Multicéntrico % Incidencia Eventos Adversos Ibuprofeno Lisinato Placebo Sepsis 43 37 Anemia 32 25 Sangrado Total ** 32 29 Página 2 Hemorragia Intraventricular, Grados ½ 15 13 Hemorragia Intraventricular, Grados ¾ 15 10 Otro Sangrado 6 13 Hemorragia Intraventricular , Todos los Grados 29 24 Apnea 28 26 Desordenes Gastrointestinales no- Enterocolitis Necrotizante 22 18 Eventos Renales Totales** 21 15 Fallos Renales 1 3 Insuficiencia Renal, Empareamiento 6 4 Reducción de la secreción de Orina 3 1 Aumento de la Creatinina en Sangre 3 1 Incremento de la Urea en Sangre con Hematuria 1 1 Incremento de la Urea en Sangre 7 4 Infección Respiratoria 19 13 Lesiones en la piel / irritación 16 6 Hipoglucemia 12 6 Hipocalcemia 12 9 Fallas Respiratorias 10 4 Infección en el tracto Urinario 9 4 Insuficiencia Adrenal 7 1 Hipernatremia 7 4 Edema 4 0 Atelectasia 4 1 *Dentro de un periodo de 30 días de terapia, con una rata de eventos mayor en Ibuprofeno que en placebo, y mayor que 2 eventos con ibuprofeno. **Cierto sujeto pudo haber experimentado más de un evento específico entre las categorías adversas. Solo los niveles más severos de HIV contaron para dicho sujeto. Página 3 FUNCIÓN RENAL PRECAUCIONES Comparado con placebo, hubo una pequeña disminución en la secreción urinaria en los grupos de Ibuprofeno en los días 2 - 6 de vida, con un incremento compensatorio de secreción urinaria en el día 9. En otros estudios, eventos clasificados como insuficiencias renales incluyendo oliguria, elevación de la urea en los niveles de sangre, creatinina elevada, o fallos renales fueron reportados en bebés prematuros tratados con Ibuprofeno. No existen evaluaciones a largo plazo de bebés tratados con Ibuprofeno (por un período de observación de más de 36 semanas de edad postgestacional). Los efectos de ibuprofeno en los resultados del desarrollo neurológico y el crecimiento, así como los procesos del desarrollo asociados a la prematurez, (tales como retinopatía del prematuro y enfermedades pulmonares crónicas), no han sido establecidos. iliDap puede alterar los signos usuales de infección. El médico deberá estar continuamente alerta y deberá usar el medicamento con extremo cuidado cuando haya infección controlada y en bebés con riesgo de infecciones. ® Eventos adversos adicionales. Los eventos adversos reportados en el estudio multicéntrico incluyen taquicardia, falla cardiaca, distensión abdominal, reflujo gastroesofágico, gastritis, obstrucción intestinal, hernia inguinal, reacciones en el sitio de la inyección, colestasis, infecciones varias, problemas de alimentación, convulsiones, hipotensión, ictericia y varias anomalías de laboratorio que incluyen neutropenia, trombocitopenia e hiperglicemia. Experiencia post-Mercadeo Las reacciones adversas citadas a continuación han sido recopiladas de distintos reportes post-mercadeo espontáneos o de algunas publicaciones: Perforación gastrointestinal y enterocolitis necrotizante. Debido a que estas reacciones han sido reportadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar confiadamente la frecuencia o establecer una relación directa con el uso del medicamento. INTERACCIONES DEL MEDICAMENTO La interacción de otros medicamentos con iliDap en neonatos, no ha sido evaluada. iliDap , al igual que otros agentes antiinflamatorios no esteroideos, puede inhibir la sumatoria de plaquetas. En bebés prematuros deben ser observados signos de sangrado. El Ibuprofeno ha mostrado que prolonga el tiempo de sangrado (dentro del rango normal) en adultos normales. Este efecto puede ser exagerado en pacientes con defectos hemostáticos subyacentes. (Ver CONTRAINDICACIONES). ® Desplazamiento de la Bilirrubina El Ibuprofeno ha demostrado que desplaza la bilirrubina de los sitios de unión de la albúmina, por lo que debe utilizarse con precaución en pacientes con niveles elevados de bilirrubina total. Forma de Administración iliDap debe ser administrado con precaución para evitar la inyección extravascular o fugas; así como también en solución puede irritar los tejidos. ® ® iliDap® ADVERTENCIAS Incluídas como parte de la sección de precauciones. SOBREDOSIS Los siguientes síntomas se han presentado en individuos (no necesariamente en bebés prematuros) al presentar una sobredosis de Ibuprofeno oral: Dificultades para respirar, coma, somnolencia, latido irregular del corazón, fallas en los riñones, baja presión en la sangre, convulsiones y vomito. No existen medidas Página 4 específicas para tratar una sobredosis aguda con Ibuprofeno Lisinato. El paciente debe ser monitoreado durante varios días debido a que puede presentarse ulceración gastrointestinal y hemorragias. CONTRAINDICACIONES iliDap está contraindicado en: ® · Bebés Prematuros con infecciones probadas o sospechadas que no hayan sido tratadas. · Bebés Prematuros con enfermedades del corazón congénitas, en los cuales la permeabilidad del conducto arterioso permeable es necesaria para el flujo satisfactorio pulmonar o del sistema sanguíneo (ej.: Atresia pulmonar, tetralogía de Fallot severa, coartación severa de la Aorta). · Bebés Prematuros con sangrados, especialmente aquellos con hemorragias intracraneales activas o con sangrado gastrointestinal. · Bebés Prematuros con trombocitopenia. · Bebés Prematuros con defectos de coagulación. · Bebés Prematuros que tengan o con sospechas de tener enterocolitis necrotizante. · Bebés Prematuros con deterioro en las funciones renales. iliDap ® Farmacología Clínica Mecanismo de Acción El mecanismo de acción por el cual Ibuprofeno causa el cierre del conducto arterioso permeable (CPA) en neonatos, se desconoce. En adultos, el Ibuprofeno es un inhibidor de la síntesis de prostaglandinas. Estudios de Biodisponibilidad y Farmacocinética Los datos farmacocinéticos fueron obtenidos de 54 bebes prematuros tratados con Ibuprofeno Lisinato, incluido uno dobleciego con placebo controlado y de manera aleatoria en estudios multicéntricos. Los bebés tenían menos de 30 semanas de edad gestacional y pesaban entre 500 y 1000 gr. Presentaban CAP asintomático y se enseñaba como evidencia ecocardiografía documentada de derivación ductal. La dosificación inicial fue de 10 mg/kg seguida por 5 mg/kg a las 24 y 48 horas. El promedio de la población y el volumen de distribución de los valores racémicos de ibuprofeno en los bebés prematuros fueron de 3 mL/kg/h y 320 mL/kg, respectivamente. La constante aumentó rápidamente durante la edad post-natal (en promedio incrementa aproximadamente 0.5 mL/kg/h por día). Interindividualmente, la variabilidad en la constante y el volumen de distribución fue de 55% y 14%, respectivamente. En general en los bebés prematuros la vida media es 10 veces mayor que en los adultos. El metabolismo y la excreción del ibuprofeno en los bebés prematuros todavía no ha sido estudiada. En adultos la eliminación vía renal de ibuprofeno es de sólo un 10 - 15% de la dosis. La excreción del Ibuprofeno y sus metabolitos ocurre rápidamente tanto en orina como en heces. Aproximadamente 80% de la dosis administrada vía oral es recuperada en la orina, como hidroxilos y metabolitos carboxílicos respectivamente, como una mezcla de formas conjugadas y no conjugadas. El Ibuprofeno es eliminado principalmente por metabolismo en el hígado, donde el CYP2C9 media las 2 y 3 hydroxilaciones de R- y S-ibuprofeno. El Ibuprofeno y sus metabolitos se transforman entonces en acil glucurónidos. Página 5 En neonatos, la función renal y las enzimas asociadas con el metabolismo de los medicamentos son subdesarrolladas al nacer y se incrementan substancialmente durante los días siguientes al nacimiento. Estudios Clínicos En un ensayo dobleciego multicéntrico de bebés prematuros con pesos entre 500 y 1000 gr, con edad post-concepción menor de 30 semanas y con evidencias ecocardiográficas de conducto arterioso permeable (CAP), fueron aleatoriamente estudiados con placebo e Ibuprofeno Lisinato. Estos bebés prematuros eran asintomáticos de conducto arterioso permeable en el momento de iniciar el tratamiento. El parámetro principal de eficacia fue la necesidad de terapia de rescate (indometacina, Ibuprofeno abierto o cirugía) para tratar un CAP hemodinámicamente significativo para el día 14, día del estudio. Un bebé fue rescatado al haber evidencia clínica de un CPA hemodinámicamente significativo que fue confirmado por medio de una ecocardiografía. Un conducto arterioso permeable hemodinámicamente significativo fue definido bajo los siguientes cinco criterios: pulso alterado, precordial hiperdinámico, edema pulmonar, incremento de la silueta cardíaca, o soplo sistólico o un hemodinámicamente significativo ductus tal como fue determinado por un neonatólogo. Ciento treinta y seis bebés prematuros recibieron ya sea placebo o Ibuprofeno Lisinato (10 mg/kg en la primera dosis y 5 mg/kg a las 24 y 48 horas). La edad media de nacimiento fue 1.5 días (rango: 4.6 - 73.0 horas), la media de edad gestacional fue de 26 semanas (rango: 23 - 30 semanas), y la media del peso fue 798 g (rango: 530 - 1015 g). Todos los bebés tenían un registro de CAP con evidencia del derivación ductal. Como se muestra en el Cuadro 2, 25% de los bebes tratados con Ibuprofeno Lisinato requirieron terapia de rescate en comparación al 48% de bebes prematuros tratados con placebo (p=0.003 de la logística de regresión para controlar el sitio). Cuadro 2. Resumen de la Eficacia de los Resultados, n (%) Ibuprofeno Lisinato N=68 Placebo N=68 Requerido el rescate a lo largo del estudio, día 14 Total 17 (25) 33 (48) Nacimiento a < 24 horas 3/14 (21) 8/16 (50) 24-48 horas 9/32 (28) 16/37 (43) > 48 horas 5/22 (23) 9/15 (60) Comprobado Ecocardiograficamente conducto arterioso permeable antes del rescate 17 (100) 32 (97) Por edad durante el tratamiento Razón para el Rescate Página 6 Un conducto arterioso permeable hemodinamicamente singnificativo determinado por el neonatólogo 14 (82) 25 (76) Pulso Alterado 6 (35) 12 (36) Soplo Sistólico 6 (35) 15 (45) Edema Pulmonar 3 (18) 5 (15) Hiperdinamica Precordial 2 (12) 3 (9) Incremento de la silueta cardiaca 1 (6) 5 (15) De los bebés que requirieron un rescate dentro de los primeros 14 días después de la primera dosis del medicamento, se observó una diferencia no significativa estadísticamente entre los grupos de Ibuprofeno Lisinato y el placebo para la edad promedio al inicio del primer tratamiento de rescate (8.7 días, rango 4-15 días, para el grupo de Ibuprofeno Lisinato y 6.9 días, rango 2-15 días, para el grupo de placebo). Los grupos fueron similares en número de muertes para el día 14, el número de pacientes con ventilador o que requerían oxigenación a partir del día 1, 4 y 14, el número de pacientes requiriendo una intervención quirúrgica de ligadura del CAP (12%), el número de casos de Hemorragias Pulmonares e Hipertensión Pulmonar para el día 14, y Displasia Broncopulmonar para el día 28. Adicionalmente, no se notaron diferencias significativas que incidieran durante la etapa 2 y 3 de Enterocolitis Necrotizante, en los grados 3 y 4 de la hemorragia intraventicular, Leucomalacia Periventricular y Retinopatía de Prematurez entre los grupos, como se determinó en las 36 ± 1 semana ajustada a la edad gestacional. Dos estudios de apoyo determinaron también que el ibuprofeno, ya sea profilácticamente (n=433, rango de peso: 400 - 2165 g) o en tratamiento (n=210, rango de peso: 400 - 2370 g), fue superior al placebo (o sin tratamiento) en prevenir la necesidad de la terapia de rescate para un conducto arterioso permeable (CAP) sintomático. Información del paciente General Las personas responsables de los pacientes deben ser informadas de los efectos de ibuprofeno en los bebés. "Resultados del desarrollo neurológico, crecimiento y proceso de la enfermedad con la prematuridad, no han sido evaluados en estudios a largo plazo". Infección iliDap puede alterar los signos de infección. Las personas responsables de los pacientes deben ser informadas, que el bebè se deberá controlar cuidadosamente para detectar cualquier signo de infección. ® Agregación Plaquetaria Los responsables del cuidado de los pacientes, deben ser informados que al igual que otros AINES, iliDap puede inhibir la formación de coágulos por lo que los bebés serán monitoreados para detectar cualquier signo de sangrado. ® Desplazamiento de la Bilirrubina Los responsables de los pacientes deben ser informados, de que la sangre de los bebés será analizada para establecer o no un aumento en los niveles de bilirrubina total. Página 7 Administración Los responsables de los pacientes deberán ser informados, de que la piel y los tejidos del bebé se supervisarán para establecer fugas o extravasación del medicamento en el momento de la administración, ya que este puede ser irritante para los tejidos. Fabricado por: Laboratorios Ryan de Colombia S. en C. NIT: 860.029.237-5 Carrera 71 D No. 50-05 • Teléfono: 263 17 04 • Bogotá - Colombia. Para: Marketing Lasma S.A.S. NIT: 900.202.926-7 • Carrera 15 No. 85-29 Of. 401 • Teléfono: 691 63 03 • Bogotá - Colombia. COLOMBIA Cra. 15 No. 85-29 Of. 401 Bogotá. • Tel: (571) 691 6303 Fax: (571) 635 7956 • Celular: (57) 310 373 8874. U.S.A. 12555 Oragen Drive, Suite 259, Davie, FL 33330. • Office Phone: 954 862 3600. • Office Fax: 954 416 1753. MÉXICO Andrés Bello 10. Piso 6 y 7, Torre Fórum Col. Chapultepec Morales, Ciudad de México, 11560.• Tel:(055) 3601 0750 PERÚ Calle Dean Valdivia 148 Edificio Platinun Plaza 1 Torre 1, Piso 11, San Isidro Lima, 27 Perú. Página 8