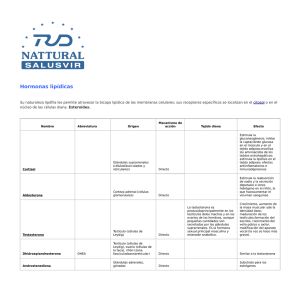
efecto de la cauterizacion del ducto insicivo del organo
Anuncio

EFECTO DE LA CAUTERIZACION DEL DUCTO INSICIVO DEL ORGANO VOMERONASAL SOBRE LA DENSIDAD OSEA Y TESTICULAR DE BOVINOS BOS INDICUS DE LA RAZA NELORE, EN LA CIUDAD DE JANAÚVA, ESTADO DE MINAS GERAIS-BRASIL Iván R. Rojas Cometa, William Vargas Tapias UNIVERSIDAD DE CIENCIAS AMBIENTALES APLICADAS UDCA PROGRAMA DE MEDICINA VETERINARIA Y ZOOTECNIA Bogotá D.C. 2010 OVN | 2 HOJA DE EVALUACIÓN NOMBRES: Iván R. Rojas Cometa, William H. Vargas Tapias TITULO: Efecto de la cauterización del ducto incisivo del órgano vomeronasal sobre la densidad ósea y testicular de bovinos bos indicus de la raza Nélore, en la ciudad de Janaúva, estado de Minas Gerais-Brasil Tesis presentada al programa de pregrado de Medicina Veterinaria y Zootecnia de la Universidad de Ciencias Aplicadas Ambientales para la obtención del título Medico Veterinario Zootecnista. Fecha:____/____/____ DOCENTES EVALUADORES Dr.__________________________ Institución_______________________ Firma________________________ Calificación______________________ Dr.__________________________ Institución_______________________ Firma________________________ Calificación______________________ OVN | 3 DEDICATORIA A nuestros padres y hermanos quienes siempre han sido nuestro apoyo fundamental y quienes han formado en nosotros un carácter ético y moral. Ustedes siempre fueron el pilar en el cual nos apoyamos para hoy llegar a la sima. OVN | 4 AGRACEDIMIENTOS A Dios por la vida, por iluminar nuestro camino y colocar personas maravillosas alrededor nuestro. A nuestros padres Rodrigo y Pedro por su amor ante todo y por que con su ejemplo de vida nos han dado las herramientas necesarias para salir adelante. A nuestras madres Eunice y Melba quienes con su constancia y perseverancia nunca nos permitieron desfallecer en los momentos de dificultad y nos enseñaron el valor de perseguir nuestros sueños. A nuestras hermanas Angélica y Jhoana y a nuestro hermano Darío por su paciencia y cariño incondicional. A nuestro director Prof. Dr. Germán Arturo Bohórquez Mahecha y su familia por todas sus enseñanzas científicas, profesionales, y personales, por sus consejos de vida y esa calidad humana que los caracteriza y que le permitió acogernos como dos miembros más de su familia. A nuestro codirector Prof. Leonardo Gaona por recibirnos y apoyarnos en nuestra ambición de ser profesionales. Al Dr. Lucas Luz Emerick por su disposición incondicional para colaborarnos en la parte científica. A nuestra colega y compañera Catalina Huertas, por su incansable trabajo y agradable compañía durante desarrollo experimental de la investigación. A nuestro gran amigo y también colega Guilherme Lamego, quién junto a su familia nos hicieron olvidar la nostalgia de estar lejos de nuestro país y nuestras familias. Marcia, Cesar, Carolina, Henrique y Gabriel, muchas gracias. A la facultad de Medicina Veterinaria y Zootecnia de la Universidad de Ciencias Aplicada Ambientales UDCA y la facultad de Medicina Veterinaria de la OVN | 5 Universidad Federal de Minas Gerais UFMG y los respectivos docentes de estos planteles. A nuestros amigos y colegas de pregrado por el apoyo y convivencia, especialmente a Paola Duarte, Diana Duarte, Laura Rodas, Claudia Medina, Pilar Cardenas, Miriam Murcia, Edilson Aredondo, Diego Martinez. A nuestros amigos de desconcentración Gelmo Borrero, Ivan Garzon, Julian Tibaduiza por las conversaciones y por los momentos alegres. OVN | 6 EFECTO DE LA CAUTERIZACION DEL DUCTO INSICIVO DEL ORGANO VOMERONASAL SOBRE LA DENSIDAD OSEA Y TESTICULAR DE BOVINOS BOS INDICUS DE LA RAZA NELORE, EN LA CIUDAD DE JANAÚVA, ESTADO DE MINAS GERAIS-BRASIL1 Germán A. Bohórquez Mahécha2 Leonardo Gahona3 Iván R. Rojas Cometa4 Willian H. Vargas Tapias5 2010 RESUMEN Para este estudio fueron empleados 30 toros, los cuales fueron sometidos a tres tratamientos distintos, 11 animales enteros con cauterización del ducto incisivo del OVN, 11 enteros sin cauterización y 8 castrados, todos con una edad promedio de 18 meses, y un peso aproximado de 333 Kg, con el fin de determinar los efectos de la cauterización del ducto incisivo del OVN sobre la producción de testosterona testicular y la densidad ósea. 6 meses después de realizados los tratamientos los animales fueron sacrificados. Posterior al sacrificio se colectaron muestras de hueso y testículo, para inclusión en metacrilato, consecutivamente los bloques fueron seccionados siguiendo técnicas clásicas de estudios morfomértricos, éstos fueron colocados sobre láminas histológicas, coloreadas con azul de toluidinaborato y analizadas en microscopia de luz. Fue medida la proporción volumétrica de las células de Leydig de los testículos de los toros tratados y los toros control, posteriormente estos datos fueron correlacionados entre los tres grupos, a la par con otros datos obtenidos como la densidad ósea y la ganancia de peso de los tres grupos; en donde se encontró que el grupo tratado presenta un volumen de células de Leydig menor a la grupo control, lo que evidencia una clara reducción en la producción de testosterona en los animales tratados, que es acorde a las marcadas tendencias de este grupo a ser animales intermedios en cuanto a ganancias de peso, producción de testosterona y densidad ósea. Palabras Clave: Órgano vomeronasal, densidad ósea, células de Leydig, ganancia de peso. Trabajo de grado en modalidad investigación. Financiado por UFMG. Departamento de Zootecnia 2 Director. Investigador Instituto de Ciencias Biológicas UFMG. 3 Codirector. Docente Carrera de Medicina Veterinaria y Zootecnia. 4 Estudiante último semestre, Carrera de Medicina Veterinaria y Zootecnia. 5 Estudiante último semestre, Carrera de Medicina Veterinaria y Zootecnia. 1 OVN | 7 LISTA DE FIGURAS Grafico – 1 Relación porcentual de ganancia de peso entre toros enteros (control), toros con cauterización del órgano vomeronasal (tratados), y novillos con castración por el método de orquiectomia bilateral (castrados). Belo Horizonte, 2009…………………………………………………………….55 Grafico – 2 Relación en kilogramos de la ganancia de peso entre toros enteros (control), toros con cauterización del órgano vomeronasal (tratados), y novillos con castración por el método de orquiectomia bilateral (castrados). Belo Horizonte, 2009……………………..……………………………………56 Grafico – 3 Relación en kilogramos en el peso de la canal entre toros enteros (control), toros con cauterización del órgano vomeronasal (tratados), y novillos con castración por el método de orquiectomia bilateral (castrados). Belo Horizonte, 2009……………………………………………………..……..57 Grafico – 4 Relación en la densidad ósea entre toros enteros (control), toros con cauterización del órgano vomeronasal (tratados), y novillos con castración por el método de orquiectomia bilateral (castrados) Belo Horizonte, 2009………….…………………………………………………………………….58 Grafico – 5 Relación en gramos en el peso de los testículos entre toros enteros (control), toros con cauterización del órgano vomronasal (tratados) Belo Horizonte, 2009…………………………………….……………………..59 Grafico – 6 Relación volumétrica del núcleo de las células de leydig los testículos entre toros enteros (control), toros con cauterización del órgano vomeronasal (tratados). Belo Horizonte, 2009………………………………60 OVN | 8 Gráfico 7- Relación entre el volumen de las células de leydig (µm 3) y peso testicular (gr) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009…………………………………………………65 Gráfico 8- Relación entre el volumen de las células de leydig (µm 3) y densidad ósea (Kg/m3) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009…………………………………………65 Gráfico 9- Relación entre el volumen de las células de leydig (µm3) peso de la carcasa (Kg) y para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009……….…………………65 Gráfico 10- Relación entre el volumen de las células de leydig (µm3) ganancia de peso y (%) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009…………………………………………65 Gráfico 11 - Relación entre el la densidada osea (Kg/m3 ) y ganacia de peso (Kg) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009…………………………………………………65 OVN | 9 LISTA DE TABLAS Tabla 1 - Deshidratación de las muestras en series decrecientes de etanol con tiempos establecidos, para iniciar el proceso de preinfiltracion de las muestras. Belo Horizonte, 2009………………………………………………67 Tabla 2 – promedio de los datos tomados para peso canal, volumen de células de Leydig, peso testicular, ganancia de peso, de los tres grupos experimentales. Belo Horizonte, 2009…………………………………….…68 Tabla 3 – Peso en canal, volumen de células de Leydig, peso testicular, ganancia de peso, y densidad ósea de cada uno de los grupos experimentales. Belo Horizonte, 2009………………………………………….68 OVN | 10 LISTA DE ABREVIATURAS Y SIMBOLOS OVN órgano vomeronasal SOP sistema olfatorio principal cm centímetros GnRH hormona liberadora de gonadotropina SOA sistema olfatorio accesorio Km kilómetros μm micras SVN sistema vomeronasal g gramos T° temperatura mm milímetros ICSH hormona estimulante de las células intersticiales ATP adenosin trifosfato ADN acido desoxinucleico MG Minas Gerais BH Belo Horizonte ICB Instituto De Ciencias Biológicas UFMG Universidad De Minas Gerais Kg kilogramos ml milímetros OVN | 11 C° centígrados PVC policloruro de vinilo ANOVA análisis múltiple de varianza nm nanómetros REα receptores de estrógeno alfa REβ receptores de estrógeno beta DMO densidad mineral ósea TGF factor de crecimiento transformador IGFs factor de crecimiento semejante a insulina PTH paratormona IL- interleuquina E2 prostaglandina FGF factor de crecimiento fibroblastico OPG osteoprotegerina OVN | 12 INDICE Paginas 1.0. INTRODUCCION………………………………………………………….14 1.1. 2.0. Objetivos…………………………………………………………..20 Revisión de literatura….………………………………………………..21 2.1. Introducción del órgano vomeronasal………………………21 2.1.1. Anatomía del órgano vomeronasal…………………..23 2.1.2. Histología del órgano vomeronasal…………………25 2.1.3. Funciones del órgano vomeronasal…….…………..26 2.2. Testículos ………………………………………………………..29 2.2.1. Introducción de los Testículos...…….……………… 29 2.2.2. Anatomía de los testículos ……….…………………..31 2.2.3. Funciones de los testículos….……………………….33 2.2.4. Histología testicular.…………………………………...36 2.2.5. Espermatogénesis……………………………………...40 2.3. 3.0. Andrógenos y hueso…………….…………………………….45 MATERIAL Y METODOS……...……………………………………….51 3.1. Lugar y ejecución del proyecto……………………………... 51 3.2. Animales experimentales y criterios de selección.……….51 3.3. Toma de muestras…………………………………………..….52 3.3.1. Peso de los animales en la edad de sacrificio……..53 3.3.2. Toma de muestras de fragmento de hueso………...53 3.3.3. Toma de muestras de testículo……………………….54 3.4. Criterio de exclusión…………………………………………...54 3.5. Determinación densidad ósea…………………………….....55 OVN | 13 3.6. Histología de hueso y testículo……………………………….56 3.6.1. Datos histológicos de hueso………...........................58 3.6.2. Datos histológicos de testículo……………………….60 3.7. Determinación de la producción de testosterona…………61 3.7.1. Volumen de las células de leady……………………..61 3.8. Análisis de datos obtenidos ………………………………….62 3.8.1. Análisis estadístico..…………………………………...63 4.0. Resultados……………………………………………………………….64 4.1. Resultados descriptivos………………………………………64 4.2. Resultados estadísticos………………………………………70 5.0. Discusión ………………………………………………………………. 71 6.0. Conclusiones …………………………………………………………...79 7.0. Referencias.......................................................................................81 OVN | 14 1. INTRODUCCION En el mercado de ganado destinado a la ceba y el sacrificio hoy en día se tiene principalmente dos tipos de manejo, La ceba de novillos castrados y la de novillos enteros, cada uno de ellos con sus ventajas y desventajas. La ceba de novillos enteros dificulta su manejo, acarreando problemas para el productor; debido a su conducta sexual y agresiva dentro del rebaño. Los animales castrados destinados a sacrificio tienen un comportamiento mucho más dócil, pero un desarrollo corporal más lento que el de los animales enteros, debido a la ausencia de la testosterona testicular que tiene funciones bien definidas en la expresión de los rasgos masculinos y por ende en la proporción de musculo, hueso y grasa (Restle, et AL, 2000), siendo en estos mayor la cantidad de grasa en la canal debido a su extrema quietud, haciendo de ellos unos animales más leves. Por otra parte, se han realizado estudios de los efectos de los andrógenos sobre el hueso, demostrando así, que existe una alta correlación entre los niveles de andrógenos y la densidad ósea, siendo que a mayor cantidad de andrógenos mayor densidad ósea. Lo cual quiere decir que el tener animales más pesados es posible si se mantienen altos los niveles de andrógenos, que en el caso de los machos bovinos el más importante es la testosterona producida en los testículos, es decir, debido al efecto de la OVN | 15 testosterona producida en los testículos, los animales enteros son animales que tienen un mejor desempeño productivo y alcanzan el peso de sacrificio más prontamente en relación con los animales castrados, a demás de ser animales con menor cantidad de grasa y por el contrario mayor cantidad de musculo y hueso, lo que representa unos animales más pesados (Bavera y Peñafort. 2006) Pero en este punto es donde se evidencian los problemas de manejo, ya que esa testosterona también despierta en los animales conductas territoriales que finalmente se ven representadas en una actitud más agresiva que dificulta su manejo. Por esto es que se utiliza actualmente la castración en rebaños de engorde, ya que retirando los testículos se pierde la mayor fuente de producción de testosterona, y juntamente las conductas agresivas de los animales (Azambuja, et al, 2007). Pero no solo se retiran o se pierden la testosterona testicular y la agresividad de los machos, también se pierde el efecto de la testosterona sobre el desarrollo tanto muscular como esquelético de los animales, y por ende gran parte de su capacidad productiva. El método de la castración por orquiectomia bilateral, realizada en este tipo de animales, aparte de generar pérdidas fisiológicas en el desarrollo futuro del animal, sugiere un periodo de ganancia de peso negativa en los días posteriores a la castración, debido al traumatismo causado por el procedimiento (Redvet, 2009). OVN | 16 La castración tiene como atractivo principal, que muchas veces se vuelve el factor decisivo, facilitar el manejo, ya que vuelve a los animales más dóciles, permite mezclar machos y hembras elimina conductas de agresividad sexual (Azambuja, et al, 2007). Otra ventaja observada es que las características cárnicas de los animales castrados son de mejor calidad y de mayor aceptación en el mercado que las de los animales enteros, ya que los últimos presentan una carne con menos contenido de grasa, más oscura, más dura y de menor palatabilidad. (Vaz, Restle, 2000) Los bovinos enteros, por su parte presentaran mayor velocidad de ganancia de peso y serán más eficientes en la transformación de los alimentos ofrecidos en peso vivo, producen cerca de 10% más de peso que los castrados. Cuando las canales de bovinos enteros y castrados son comparadas, los resultados han demostrado que los animales enteros son superiores en peso y conformación, así como presentan mayor proporción de musculo. (Bavera y Peñafort. 2006). Entretanto, estas ventajas, pierden valor comercial por la calidad de la canal, principalmente, en función de la deficiencia de grasa de cobertura. OVN | 17 Con la falta de cobertura de grasa, la canal de los bovinos enteros durante el enfriamiento, desarrolla un oscurecimiento de la parte externa de los músculos, que perjudica el aspecto y, consecuentemente, deprecia el valor comercial. Esto justifica, en parte, el descuento que los mataderos acostumbran imponer sobre el valor en el sacrificio de los animales enteros. (Severin, et al, 2006) Los efectos de la castración dependen del momento en que esta se realice. Si se realiza antes de la pubertad ocasionara una completa interrupción del desarrollo de las características sexuales secundarias, por falta de las hormonas producidas por los testículos, lo que convierte al novillo en un animal bien diferente del toro. Si la castración fuese realizada después de la pubertad los efectos son menos pronunciados, causando apenas la regresión de algunas características sexuales secundarias, alteraciones de comportamiento y variaciones en el desempeño. El mercado del ganado de carne hoy está necesitando de una nueva alternativa que le permita al productor generar animales pesados en poco tiempo y de fácil manejo. Trabajando con machos enteros logramos animales pesados y precoces, pero el manejo se dificulta debido su temperamento, con animales castrados logramos animales dóciles pero perdemos en peso. OVN | 18 Indiferentemente de los parámetros genéticos y raciales, uno de los factores que influencia el peso de los animales es la distribución de sus distintos componentes tales como musculo, vísceras, grasa y hueso, siendo finalmente musculo y hueso los más importantes. Lo anterior aplica para los animales que son comercializados en pie ya que el parámetro de negociación es el peso vivo, lo cual incluye los pesos tanto de musculo, grasa, vísceras y hueso. Por tales razones es que se debe buscar la manera de obtener animales que alcancen los niveles productivos de los animales enteros con la mansedumbre de los animales castrados. Para lograr esto se propone el uso de una técnica que a demás de ser novedosa y sencilla tiene un fundamento científico y fisiológico bastante amplio, se trata de la cauterización del ducto incisivo del órgano vomeronasal. El sistema vomeronasal es un sistema que no solo se encarga de la percepción de feromonas, este sistema se conecta al hipotálamo y a otros centros nerviosos del encéfalo, para desencadenar respuestas endocrinas relacionadas con las conductas sexuales y/o grupales de los individuos, así como también sobre las gónadas a través del eje hipotálamo-hipófisisgónadas (Halpern 1987). OVN | 19 Con la cauterización del ducto incisivo del órgano vomeronasal en los animales enteros lo que se busca es poner en el mercado animales con una buena ganancia de peso, más dóciles y de fácil manejo para los productores, ya que lo que se espera es que con la cauterización los animales disminuyan el lívido y las actitudes agresivas de conducta grupal, pero que su desempeño productivo sea tan bueno como el de los animales enteros. Teniendo en cuenta que la densidad ósea está directamente relacionada con el peso vivo de los animales, podemos usar este dato como parámetro para comparar los niveles productivos de los animales tratados con los animales enteros y los animales castrados. OVN | 20 1.1 OBJETIVOS Objetivo general Evaluar los efectos de la cauterización del ducto incisivo del órgano Vomeronasal sobre la densidad ósea, la conformación testicular y la producción de testosterona. Objetivos específicos a. Obtener datos como densidades Oseas, proporciones volumétricas del testículo, niveles de testosterona y medición de los núcleos de las células de leydig en bovinos castrados, enteros y sometidos a bloqueo del órgano Vomeronasal. b. Realizar un estudio estadístico que nos permita analizar el comportamiento productivo, reproductivo y de ganancia de peso en cada uno de los grupos de bovinos a estudiar. c. Realizar un análisis de resultados que nos permita comparar las densidades óseas, proporción de los compartimentos intersticial en los testículos. d. Obtener una serie de resultados que nos llevaran a descartar o confirmar la hipótesis que existe sobre el OVN y su función. OVN | 21 2.0 REVISION DE LITERATURA 2.1 Introducción En el año 1809 se reportó la descripción de un órgano situado en la cavidad nasal de los mamíferos conocido en nuestros días como órgano vomeronasal (OVN) o de Jacobson. (Ludwig Jacobson 1783-1843, anatomista). Jacobson dibujo la cabeza de un cuervo demostrando la posición del órgano y los nervios a lo largo del septo nasal conduciendo el órgano vomeronasal al bulbo olfatorio. Su descripción original fue basada principalmente en animales domésticos en los cuales estaban perros, cerdos, caballo, vacas y ovejas y otros como león marino, búfalo, camello y tigre. El órgano está ausente en algunos peces y en todas las aves, no se encuentra en cocodrilos y camaleones sin embargo está presente en serpientes donde está muy bien desenvuelto. (DOVING, K. B.; TROTIER, D 1998). Jacobson describió un órgano que presentaba serosas y una doble inervación con abundantes glándulas una irrigación sanguínea característica, y fue nombrado órgano vomeronasal de Jacobson por el Anatomista. Después de eso Jacobson asumió que descubrió un órgano con función secretora y lo clasifico como un órgano secretorio, por esto sospechaba que también fuera un órgano sensitivo. TROTIER, D. 1998). (DOVING, K.B.; OVN | 22 Hasta en el siglo XIX se descubrió que el órgano tenia funciones sensitivas y quimiorreceptoras por y fue desenvuelto en tejidos olfatorios de embriones de cobras. (DOVING, K.B.; TROTIER, D. 1998). Los vertebrados poseen un sistema olfatorio el cual esta divido en dos sistemas los cuales difieren en su anatomía como en su función. Los dos sistemas anteriormente citados son sistema olfatorio principal (SOP) y sistema olfatorio accesorio (SOA) o sistema vomeronasal (SVN) (MENDOZA 1993) El sistema olfatorio principal (SOP) es capaz de responder y reconocer una grandísima gama de olores de diferentes tipos en los cuales están olores del ambiente, olores ecológicos y olores sociales. (GUILLAMÓN, A; SEGÓVIA 1997) El sistema olfatorio accesorio (SOA) o sistema vomeronasal (SVN) tiene la capacidad de responder a olores volátiles como a los no volátiles. El sistema olfatorio accesorio (SOA) está directamente ligado a las estructuras límbicas del cerebro las cuales son transmitidas para el desarrollo y expresión de comportamientos primarios como son el comportamiento sexual, el comportamiento agresivo, el comportamiento maternal y en la activación de vías neuroendocrinas reproducción (POWER, J. B.; WINAS, S. 1975). utilizadas en la OVN | 23 2.1.1 Anatomía del Órgano Vomeronasal El órgano vomeronasal está situado en la base del septo nasal con estructuras tubulares a lo largo de la porción anterior del septo nasal que se abre en una extremidad y forma un fondo de saco. La localización de esa abertura varía de acuerdo a la especie, en bovinos se abre directamente en la cavidad oral. El órgano vomeronasal consiste en un par de divertículos tubulares, revestidos por una membrana mucosa y situados en la superficie de la cavidad nasal en los dos lados del septo nasal. Este se encuentra relacionado con los procesos palatinos del hueso incisivo y con el hueso vómer. (KEVERNE, E. B. 1999). En los carnívoros, ungulados y primates este órgano desemboca en el canal incisivo el cual llega a la cavidad bucal atreves de un estrecho foramen. (BARONE, R.; LOMBARD, M. 1996) (KEVERNE, E.B. 1999). Los túbulos del órgano vomeronasal están separados del resto de la mucosa olfatoria por una capsula formada por un cartílago hialino o por el propio hueso vómer. Por dentro de la capsula, generalmente es encontrado un parénquima con sangre. (KEVERNE, E.B 1999). El órgano vomeronasal posee una parte cóncava y otra convexa esta última es dotada de un epitelio pseudoestratificado ciliado convexa por un epitelio y la parte neuro-sensitivo especializado de este son proyectados axones del nervio vomeronasal para el bulbo olfatorio teniendo OVN | 24 conexiones directas con el hipotálamo medio basal, órgano vomeronasal está íntimamente conectado nervioso central más específicamente responsable por la variación de esa forma el con áreas del sistema con el sistema límbico que es del comportamiento de reconocimiento materno y reproductivo. (HALPERN, M. 1987). En los bovinos aparece como un órgano par, tubular, hueco y que mide entre 18 Y 25cm de acuerdo al tamaño y edad de la raza, el extremo posterior de la luz del tubo es ciego y el anterior es abierto en forma de hendidura que se comunica con la cavidad nasal y con la cavidad oral. La luz del órgano está recubierta de un epitelio quimiosensorial constituido por dos tipos de neuronas bipolares especializadas. La cara externa está cubierta de células ciliadas no sensoriales. La cara interna de la cavidad es cóncava y en ella se ubican las neuronas sensoriales que con sus largos axones forman el nervio terminal vomeronasal, esas fibras forman dos o tres troncos que entran al cráneo y terminan en el bulbo olfatorio accesorio o bulbo vomeronasal, desde allí se conectan al hipotálamo y a otros centros nerviosos del encéfalo, incluso con mecanismos de retroalimentación, para desencadenar respuestas endocrinas, reproductivas y conductuales específicas a través del eje hipotálamo-hipófisis-gónadas. (POWERS, J.B.; WINANS, S.S 1975.) (HALPERN, M. 1987). OVN | 25 2.1.2 Histología del Órgano Vomeronasal La organización histológica del (OVN), los receptores de neuronas primarios del órgano presentan axones largos que penetran en la cavidad encefálica a través de los forámenes de la lamina cribiforme subetmoide terminando en el bulbo olfatorio accesorio. (DOVING, K. B.; TROTIER, D. 1998). El lumen con forma creciente es revestido internamente por receptores de neuronas y generalmente se encuentra lleno de fluidos provenientes de las glándulas vomeronasales, las cuales se encuentran en las paredes dorsal y ventral del lumen. (KEVERNE, E. B. 1999). Estas glándulas presentan cortos ductos secretorios. Lateralmente al lumen de estos túbulos son encontrados grandes vasos sanguíneos los cuales están inervados por fibras del sistema nervioso autónomo que induce la vasodilatación o vasoconstricción. (KEVERNE, E. B. 1999). En la superficie convexa del órgano se encuentra una fila de células ciliadas no sensoriales. En la parte inferior del órgano se encuentra un tejido cavernoso que fue llamado de ¨Cuerpo de Cogumelo¨ (DOVING, K. B.; TROTIER, D. 1998). OVN | 26 2.1.3 Funciones del Órgano Vomeronasal El órgano vomeronasal hace parte de un conjunto de estructuras anatómicofuncionales, ubicadas en la cavidad nasal de los mamíferos, para detectar distintas sustancias químicas provenientes del medio, como es el caso de las feromonas. Así como el epitelio olfatorio, El órgano septal de Masera, El órgano septal Gruneberg, y El sistema guanidilciclasa tipo D, El órgano vomeronasal o de Jacobson tiene una función específica que es realizar la detección de feromonas emitidas por otros individuos de la misma especie. En 1987 ya se empieza a hablar sobre que el sistema vomeronasal era importante el cual tenía efectos quimiorreceptores mediados por feromonas en la regulación endócrina y comportamiento sexual, también fue demostrado en serpientes que el sistema vomeronasal era muy importante en la respuesta a las sustancias químicas de la presa. En los últimos años al órgano vomeronasal le han descrito algunas funciones, los puntos más importantes; 1) se dice que hay una variedad de tipos de señales químicas, que van desde las feromonas clásicas a la cualidad de las señales de olor las cuales son muy importantes para la comunicación. OVN | 27 2) El órgano vomeronasal es primariamente responsable por la mediación de respuestas de algunas más no todas las señales suministradas por las feromonas. 3) Los sistemas vomeronasal y olfatorio generalmente integrados para mediar respuestas de señales odoríferas. (JOHNSTON, 1998). Johnston en 2000 y posteriormente en 2001 definió señales químicas como compuestos o misturas liberadoras por un individuo que afecta un segundo individuo de la misma especie, y sugiere que ese término debe ser usado como un término genérico para olores envueltos en la comunicación. En las cuales se encuentran feromonas (compuestos químicos simples que tiene efectos de señales químicas), mistura de feromonas (mistura de péquenos números de compuestos que son efectivos solamente en proporciones precisas), grupos de olores (mezcla de grandes números de compuestos que tiene efectos de señales químicas). El órgano vomeronasal en los mamíferos tiene un papel importante en el comportamiento reproductivo y sexual, también no se descarta la posibilidad de otras funciones como la detección de algunos tipos de sustancias odoríferas, característicos por bajo peso molecular. (SALAZR, I.; QUINTEIRO, P.S; CIFUENTES, J.M. 1995). Las moléculas entran en el órgano vomeronasal a través de un mecanismo bombeador inervado por los nervios eferentes del nervio naso palatino que succiona las moléculas y las disuelve en el moco además de eso OVN | 28 algunos mecanismos comportamentales están envueltos en el transporte de sustancias para el órgano vomeronasal. (DOVING, K. B.; TROTIER, D. 1998). Algunos de estos mecanismos son: 1) El reflejo de Flehmen que ocurre durante la interacción sexual después de la percepción de olores en que el animal eleva la cabeza y el labio superior y para de respirar por un momento. (DOVING, K. B.; TROTIER, D. 1998). 2) La lambida es otro mecanismo utilizado por los toros después de detectar las hembras en celo, el toro usa la lengua con el fin de comprimir el paladar duro causando alteración en la presión del órgano vomeronasal y por ese medio las sustancias químicas son impulsadas para dentro del órgano. (DOVING, K. B.; TROTIER, D. 1998). 3) Hay otro mecanismo descrito en el hámster, en el cual se cree que hay una estimulación en las neuronas noradrenérgicas por las sustancias odorantes presentes en la orina y fluidos vaginales, el cual se encuentra situado en el hipotálamo provocando la inhibición de la secreción de prolactina por la hipófisis anterior. La prolactina por ser luteotrópica reduce la vida media del cuerpo lúteo, y con esto generar una reducción de los niveles de progesterona permitiendo un aumento en los niveles de GnRH, siendo permisivo el retorno del crecimiento folicular. (DOVING, K. B.; TROTIER, D. 1998). OVN | 29 2.2 TESTICULOS 2.2.1 INTRODUCCION Los testículos son órganos pares, contenidos en la cavidad del escroto. Poseen como los ovarios una función gametogenica y una función endocrina. La función gametogenica consiste en la producción de gametos masculinos o espermatozoides, la estructura que está a cargo son los túbulos seminíferos. La función hormonas sexuales endocrina masculinas comprende la secreción de (andrógenos), principalmente la testosterona por células denominadas intersticiales o de Leyding. El término griego para testículo es orchis, del cual se derivaron varios términos como orquite (inflamación del testículo), orquiectomia (extirpación del testículo), mesorquio, etc. Los testículos en el toro deben ser similares en tamaño, aproximadamente pesan de 350 a 400g y en su evaluación además de la palpación se tiene en cuenta el diámetro testicular y se complementa con el análisis espermático en el toro el testículo se halla dividido incompletamente por el mediastino que actúa como un tabique parcial, la longitud de los túbulos seminíferos en los toros se han calculado de 4,8 km donde cada túbulo tiene aproximadamente 200 micras de diámetro y se considera que el 80% del peso del testículo del toro está constituido por los túbulos seminíferos. (DAVID, O. P.; MARIO, D. 2000). OVN | 30 En los toros cada testículo se origina de una gónada indiferenciada localizada en la región abdominal del embrión, a medida que avanza la gónada se transforma en un testículo, el peritoneo que recubre la cavidad abdominal se protruye y forma una invaginación en la región del gubernaculo de aspecto gelatinoso y abultado, se dirige hacia el escroto allí por el proceso vaginal pasa al testículo el cual arrastra una porción de peritoneo en el descenso hacia el escroto, el testículo del toro pasa por el anillo inguinal profundó del canal inguinal, estos anillos poco a poco se cierran y evitan que el testículo regrese nuevamente al abdomen, cuando el canal inguinal no se cierra podemos encontrara que el testículo regresa y nos dará origen a la criptorquidia, sin embargo esta no es la única alteración que podemos encontrar durante el descenso de los pueden configurarse inflamaciones testículos, ya que de las venas o varicoceles, también puede organizarse verdaderos sacos de agua o hidrocele. Cuando los testículos permanecen dentro del abdomen del toso es infecundo a causa de que se inhibe la espermatogenesis por el incremento de la T°, sin embargo las células intersticiales siguen produciendo hormona masculina, esto quiere decir que la retención de los testículos no impide la presentación de las características masculinas solo que el semental no produciría espermatozoides, en el caso de que en el toro descienda solamente un testículo se le conocerá como criptorquido unilateral generalmente el toro es fértil pero no se recomienda su empleo como semental, ya que se considera esta alteración como un defecto de herencia. (DAVID, O. P.; MARIO, D. 2000). OVN | 31 2.2.2 Anatomía de Los Testículos En los rumiantes los testículos están posicionados verticalmente en el escroto, posee una forma ovoide y alargada. En el toro adulto miden 10.0 a 12.0 cm de largura y 6,0 a 8,0 cm de diámetro, presentan un peso medio de 300 g, tales valores están sujetos a variaciones raciales siendo en los testículos de bovinos europeos consistentemente mayores y más pesados que los bovinos cebús, en los cuales el peso medio esta en torno de 250 g. Los testículos provienen de la diferenciación del sexo gonadal ene l individuo (después de la diferenciación de sexo genético) por que las células germinativas primordiales (gonocitos) van migrando para la crista gonadal donde, por multiplicación y sobre influencia del TDF (Factor De Diferenciación Testicular), darán origen a los cordones sexuales primarios, en este caso los cordones testiculares. (VALE FILHO, V.R 1997. 2v) Los testículos están cubiertos por una capa de tejido conectivo dicha capa es de aspecto blanquecino y muy resistente, se la conoce anatómicamente como túnica vaginal visceral encontramos la túnica albugínea la cual colabora también en el sostén de los testículos en su mayor parte el testículo está compuesto de túbulos seminíferos y de células intersticiales. (DAVID, O. P.; MARIO, D. 2000) OVN | 32 Cada testículo presenta dos extremidades, extremidad apical y extremidad caudal, y dos faceas, facea lateral y facea medial, y dos bordes, borde libre y borde epididimal. Las dos extremidades receben el nombre de capitata y caudata debido a ser relacionadas respectivamente con la cabeza y la cauda del epidídimo. En los rumiantes la extremidad capitata esta girada dorsalmente y la extremidad caudata ventralmente, las faceas lateral y medial son convexas, pero la facea medial, esta girada para el septo escrotal. Esta presenta una convexidad menos acentuada que la facea lateral. El testículo del toro es oval y alargado, se encuentra suspendido dentro de la bolsa escrotal por el cordón espermático, está compuesto de la arteria espermática enrollada en forma de sinuosa por las venas espermáticas que forman e l plexo por el plejo o plexo pampiniforme y por el musculo cremaster interno, el extremo distal del testículo se encuentra fijo al escroto por el denominado ligamento escrotal, los testículos descienden del abdomen al escroto en un periodo de tiempo de gestación. (DAVID, O. P.; MARIO, D. 2000) cuatro meses de OVN | 33 2.2.3 Funciones Testiculares El toro tiene un par de testículos que se encuentran en posición vertical uno al lado del otro dentro del escroto, los testículos tienen dos funciones que son la de producir espermatozoides y la otra es la producción de la hormona sexual masculina. Los testículos poseen dos funciones básicas, y controladas por las hormonas gonadotroficas de la hipófisis las cuales son: - Función exocrina o citogenética que es ejercida por los túbulos seminíferos y correspondiente a la producción de gametos masculinos: los espermatozoides - Función endocrina que consiste en la producción de hormonas sexuales (por ejemplo: la testosterona producida por las células intersticiales de leydig). (HAFEZ, E.S.E; 1982 720p) El testículo en el toro es pendular con su eje longitudinal en posición vertical, actualmente en el toro se utiliza la medida de la dimensión testicular la cual es esta muy correlacionada con la medida del órgano después de que este ha sido extirpado, esto permite entender que existe una elevada correlación entre el diámetro testicular del testículo. (DAVID, O. P.; MARIO, D. 2000) y el peso propiamente OVN | 34 La función de los testículos consiste en la formación de las células germinativas masculinas (espermatozoides) y testosterona, bajo la influencia de la la secreción de la testosterona ocurre un desenvolvimiento de las características sexuales secundarias masculinas y el estimulo para la formación de semen. En las glándulas sexuales accesorias la testosterona estimula la formación de substancias (glucosa, fructosa, citrato) que son importantes para la capacidad de locomoción de los espermatozoides y para la capacidad de tampón en el esperma. (HAFEZ, E.S.E; 1982 720p). La formación de los espermatozoides se da en los canalículos seminales (túbulos seminíferos) los cuales presenta un trayecto acentuadamente curvilíneo y que final mente desembocan en la rete testis. Entre los canalículos seminales se encuentran las células intermediarias (células de leydig) en las cuales se procesa la formación de testosterona bajo la influencia de ICSH. Los canalículos seminales de disposición lobular, presentan un trayecto acentuadamente curvilíneo, a partir de la capsula hasta la rete testis. Através de las curvas de los canalículos se obtiene un enorme aumento de la superficie de tejido formador de esperma. A partir de la rete testis salen los ductos deferentes testiculares, através de los cuales se da el transporte de los espermatozoides hasta el epidídimo y en los cuales ocurren los proceso de maduración de los espermatozoides. Los canalículos seminales consisten en varias camadas celulares sobrepuestas, que se delimitan para afuera con una membrana basal. Las OVN | 35 células inmediatamente próximas a la membrana (espermatogonias) se dividen y forman los espermatocitos de primera línea, que pasan por medio de una nueva división, a espermatocitos de segunda línea. Los espermatocitos de segunda línea finalmente forman las espermátides (pre-espermátides), que se transforman en espermatozoides. Durante maduración de las epermatides la el tamaño de las células se reduce, formándose la cola de los espermatozoides, la porción de la unión contiene las mitocondrias la cual fornece ATP para el propio movimiento del espermatozoide después de la eyaculación. Entre las espermatogonias se localiza las células basales de Sertoli, que con sus prolongaciones entran profundamente en el interior de los canalículos seminales y llevan espermatozoides en su superficie. Las células basales presentan una función trófica para los espermatozoides y forman una proteína capaz de ligar la testosterona, con cuya ayuda la testosterona es transportada de los testículos para el epidídimo. (E. KOLB,1984) OVN | 36 2.2.4 Histología Testicular El ciclo del epitelio seminífero es la progresión através de una completa serie de modificaciones celulares de localización definida en forma de camadas escalonadas gradualmente, a lo largo del túbulo seminífero. El tiempo requerido para esta progresión les la duración del ciclo del epitelio seminífero y es único para cada especie, por ejemplo, en un toro es en torno de 61 días. (Senger, 2003) Dentro de cualquier sección para evaluación microscópica se puede observar cuatro a cinco camadas de células germinativas, o sea, en un corte donde se ven en un determinado estadio, se pueden observar cuatro a cinco generaciones de espermatogonias. Se debe resaltar que el tipo celular mas inmaduro se encuentra próximo a la membrana basal y los estadios más avanzados están localizados en la periferia de la célula de sertoli. (Senger, 2003) Los túbulos seminíferos comienzan en el fondo del saco, son retorcidos y meden cerca de de 0,2 mm de diámetro por 30 a 70 cm largura. Ellos terminan en la región posterior del testículo, en los túbulos rectos que se anastomosan en una red de túbulos, que es llamada de red testicular de donde parten de 8 a 15 ductos deferentes cefálica del epidídimo. que penetran en la porción OVN | 37 Evaluando cortes histológicos de toros (raza Angus con 12 mese de edad) con normal proceso de gametogénesis, se encontró 10.8% de túbulos seminíferos seccionados sin la presencia de ninguna célula germinativa, 2,5% de espermatogonia A1 5,5 % de espermatocitos en la fase de paquiteno, 37,5% de espermátides arredondeadas, 33% de espermátides alongadas y 10% de las secciones con espermátides maduras. En toros con espermiogenesis imperfecta observaron que 90% de las secciones de los túbulos no poseían ninguna célula germinativas y existían apenas algunas espermatogonias A1, revelando la eficiencia de los cortes histológicos en detectar animales con espermiogenesis imperfecta. (Moura. ; Erickson, 2001) El número de células de sertoli por testículo no diferido con la gametogénesis normal y anormal entre tanto el número de células de leydig por testículo y el diámetro de los testículos de los animales normales fueron mayores en cuanto el número de células de leyding por grama de parénquima, fue menor para los animales normales comparados con los animales que tenían espermatogenesis imperfecta. (Moura e Erickson, 2001) Los niveles hormonales no diferían entre los animales, animales con espermiogenesis normal tenían niveles más bajos de testosterona y de la misma forma algunos con la gametogenesis anormal tenían niveles elevados de esa hormona, reforzando la idea de la alta variabilidad de esta, se tomo otro hecho de relevancia, es que tales resultados pueden ser explicados por el hecho de que son necesarios bajo niveles de testosterona OVN | 38 para mantener la gametogénesis normal. De esa forma con base en esos números observados parece probable que la causa de la reducción de fertilidad en toros sea preferiblemente debido a los factores localizados en el testículo que de la síntesis hormonal hipotálamo-hiposiario-gonadal en toros maduros. (Moura e Erickson, 2001) El peso testicular, el numero de receptores de andrógenos intracitoplasmatico, el numero y volumen de las células de Leydig, el diámetro de los túbulos seminiferos, el volumen y el tamaño del núcleo de las células de sertoli, como el numero de espoermatogonias A1 y el numero de espermatocitos primarios son características que son significativamente correlacionadas entre sí, y además demostraron súbitas elevaciones en el periodo pre puberal, y también se vio observado aumento de la testosterona, tales resultados sugieren que la testosterona ejerce un control positivo en sus propios receptores actuando como acción local en ese periodo.(MonetKuntz.;1984. Bagu.;2006). Contando, tanto la testosterona intracelular como la sérica no fue altamente correlacionada con características asociadas gametogénesis en conejos maduros, como: con la eficiencia el diámetro de del túbulo seminífero, numero de células de sertoli por túbulo, la proporción de células germinativas (espermatogonia, espermatocitos primarios y espermátides arredondeada y alargada) y la razón de células de sertoli y las células germinativas. Solamente el porcentual de volumen nuclear de las células de leydig (r = 0,82) y el número de células de leydig por gama de testículo OVN | 39 (r=0,83) fue altamente relacionada con los niveles de testosterona sérica intratesticular. Los resultados soportan la idea de que a partir de cierta concentración de testosterona adquirida en el evento de la pubertad (=25% de la cantidad normal) es necesario bajo nivel de la hormona para mantener la espermatogenesis normal del conejo. (Castro.;2002). Los túbulos seminíferos consisten en una túnica de tejido conjuntivo, una alamina basal y una camada interna formada por un epitelio especial, el cual es un epitelio germinativo o seminífero, donde se originan los espermatozoides. El tejido conjuntivo que envuelve los túbulos seminíferos contiene las células mióides con características de células de musculatura lisa. OVN | 40 2.2.5 Espermatogenesis La espermatogenesis constituye una secuencia de transformaciones por las cuales la espermatogonia pasa hasta dar origen a una célula complexa y altamente especializada, el espermatozoide. La espermatogenesis ocurre en un ambiente único criado por los testículos. El testículo de los mamíferos consiste de dos distintos compartimentos: - Un compartimento intersticial con contenido de células de leydig, macrófagos, vasos sanguíneos, linfáticos y células semejantes a los fibroblastos. - El otro compartimento de túbulos seminíferos, el cual es delimitado por células peritubulares mioides, las células de sertoli, en las cuales en su citoplasma ocurre la espermatogenesis. (Castro,1955). El epitelio germinativo es constituido por las células de Sertoli y las células que constituyen el linaje espermatogenico o seminal. Las células del linaje seminal se disponen de cuatro a ocho camadas, las cuales ocupan el especio entre la lamina basal y la luz del túbulo semiínfero, esas células se dividen varias veces y se diferencian en espermatozoides. (E. KOLB, 1984) OVN | 41 El proceso de la espermatogenesis puede ser divido en tres distintas fases: (1) La fase espermatogonial, durante la cual la espermatogenesis prolifera y origina un espermatocito primario, en cuanto mantenga la populación espermatogonial necesaria para la continuación del proceso conocido como renovación de las células del tronco o del linaje germinativo. (2) La fase meiotica, envolviendo divisiones de espermatocitos y formación de espermátides (células haploides). (3) La fase de diferenciación o fase espermatogenica, en la cual espermátides se transforman en células altamente especializadas o espermatozoides. (Castro,1995). El proceso se inicia con la célula germinativa primitiva la espermatogonia, la cual es una célula que se localiza próximo a la membrana basal. Las espermatogonias se dividen por mitosis y las células neoformadas pueden seguir dos caminos: (a) continúan semejantes a la célula madre y sufren nuevas mitosis, portando una fuente de espermatogonias; (b) paran de dividirse y crecen, tornándose mayores que las espermatogonias siendo llamadas de espermatócitos de primera orden o citos I. Estas últimas células entran en meiosis, un proceso reduccional de numero de cromosomas que consiste en dos divisiones celulares, habiendo síntesis de DNA solamente antes de la primera división. Al iniciarse la primera división meiotica, o cito I tiene 46 cromosomas mas el doble de la cuantidad OVN | 42 de DNA (4N). Como la profase de esa división es muy demorada, pasando por las fases de leptóteno, zigóteno, paquíteno e diplóteno, la mayoría de los citos vistos en preparados histológicos están en esa fase (primera profase de la meiosis). Los citos I son las mayores células del linaje espermatogenica caracterizan por y se la presencia de cromosomas en diferentes fases de condensación. De esa primera división meiótica resultan células menores llamadas espermatogonias de segundo orden o citos I, los cuales poseen 23 cromosomas cada uno. Por lo cual ocurre una disminución del número de cromosomas por célula, por eso cada cromosoma es duplo, de modo que el núcleo del espermatocito II tiene la cantidad de DNA típica de la especie (2N). Los citos II están más próximos de la luz de los túbulos seminíferos y es difícil observarlos en cortes histológicos, ya que entran después en la segunda división meiotica. De esta resultan las espermátides con 23 cromosomas y apenas la mitad del DNA de la especie, (N) ya que en la segunda división meiotica no hay síntesis de DNA. Las espermatides se caracterizan por presentar un pequeño tamaño, nucleó con zonas de cromatina condensada, y por eso se localizan casi en la luz de los túbulos seminiferos. Las espermátides termina la fase de las divisiones celulares de la espermatogenesis. De ahí para adelante cada espermatide sufrirá unos procesos de modificaciones complejas, llamadas espermiogenesis, que lleva a la formación de los espermatozoides. OVN | 43 La espermatogenesis puede ser resumida de la siguiente forma: (1) El complejo de Golgi produce una vesícula que contiene una partícula densa, el acrosoma. Esa estructura vesicular se mueve junto con el complejo de Golgi, en dirección al núcleo, ligándose a este y cubriendo parte de su superficie, formando el capuz cefálico o acrosomico. (2) Simultáneamente los centriolos migran y se modifican, de uno de ellos surge un flagelo que formara la cauda del espermatozoide. El otro forma un anillo en torno de la cauda. (3) Al mismo tiempo, el citoplasma se disloca en dirección asía flagelo, cubriendo parte de este. A medida el que los procesos avanzan, partes del citoplasma se destacan de la célula, reduciendo considerablemente su volumen. (4) Gradualmente, las mitocondrias se dirigen para el flagelo, colocándose como un espiral en torno de la parte inicial del espermatozoide, esa localización de las mitocondrias es un ejemplo de concentración de esos organelos en lugares relacionados con el movimiento celular y el grande consumo de energía. (5) El núcleo se achata y toma una forma de almendra. En consecuencia del procesos descrito, el espermatozoide maduro presenta una presencia de varias enzimas, entre ellas hialorunidasa, fosfatas acida, neuraminidasa y proteasa. OVN | 44 (6) Los espermatocitos y células subsecuentes de la línea espermatogenica, resultantes de la división de una espermatogonia, no se separan totalmente, estando unidas por puentes citoplasamaticos. Esos puentes intercelulares tienen importancia en la coordinación de la espermatogenesis, posibilitando el tránsito de moléculas informacionales entre esas células. (7) El flagelo del espermatozoide tiene función motora y la localización de las mitocondrias está relacionado con el fornecimiento de la energía para el movimiento flagelar. La fuente de esa energía son los glicosidos, principalmente fructuosa, producida por las glándulas anexas. (8) La espermatogenesis no es sincronizada en toda la extensión del túbulo seminífero, pero ocurre como si fuese por ondas, a lo largo de cada túbulo. Eso explica porque se ven a lo largo de esos túbulos regiones con fases diferentes de la espermatogenesis. OVN | 45 2.3. ANDROGENOS Y HUESO El dimorfismo sexual asumido por el hecho de que los hombres poseen un esqueleto mas fuete y denso con mayor masa muscular que el de las mujeres sugiere la hipótesis de que, por lo menos en parte, sea debido al mayor nivel de andrógeno circulante en los hombres (Clarke e Khosla, 2008). Tal hecho llega a sugerir que La diferencia en peso corporal de animales enteros en relación a los castrados sea también, aunque no solamente, a su efecto directo o indirecto sobre los huesos. Los andrógenos son esteroides caracterizados como hormonas anabólicas, con efectos en varios tejidos incluso el cerebro, el sistema inmune, el cardiovascular, el músculo, el tejido adiposo, el hígado y el hueso. Entretanto, los efectos específicos de los andrógenos en el esqueleto permanecen probablemente caracterizados y entendidos. La osteoporosis es frecuentemente asociada con el hipogonadismo tanto en hombre como en mujer, siendo que en ellas, tal enfermedad es bastante frecuente después de la menopausia, de esa forma los esteroides están envueltos en la manutención de la salud del esqueleto. Aunque el estradiol como los andrógenos estén circulante en hombres y mujeres, en diferentes niveles, la influencia de cada uno en el esqueleto es distinta. De esa forma terapias combinadas de estrógenos asociados con andrógenos en mujeres después OVN | 46 de la menopausia fue más efectivo que la utilización de solo estradiol (Leder et al., 2003). Estudios con inmunohistoquimica tienen detectado que receptores de andrógeno están presentes en todas las capas de de las placas de crecimiento de las epífisis de los huesos en todas las edades tanto en machos como en hembra, pero en los ratones tales receptores están presentes solo en animales adultos e viejos, siendo que en los machos se presento en mayor numero comparado con las hembras. De esa forma, es probable que los andrógenos estén envueltos directamente en el crecimiento longitudinal del hueso durante el inicio de la pubertad y en el cierre de las placas epifisiarías en el final de la pubertad. Con todo esto, la expresión de los receptores de estrógenos α e β (REα e REβ), respectivamente presentes en las placas epifisiarias en humanos revelan que los andrógenos también actúan indirectamente vía aromatización en el crecimiento puberal en el cierre de las placas de crecimiento epifisiario de los huesos largos (Nillson et al., 1999; Bord et al., 2001). Los estrógenos actúan en el mantenimiento de la masa ósea en adultos a través de la inhibición de la reabsorción ósea por los osteoclastos, protegiendo el esqueleto de la perdida de matriz ósea. Andrógenos no aromatizables como la 5α-dihidrotestosterona han sido reportados como agentes anabólicos aumentando la formación de la densidad mineral del hueso (DMO) (Kenny e Raisz, 2002). OVN | 47 Dando soporte al efecto de la testosterona en el hueso, no ha sido demostrada correlación positiva entre DMO y tal hormona en hombres viejos. Tratamientos a base de esa hormona redicen la perdida ósea durante el envejecimiento. Pero tal efecto fue observado solamente en hombres con bajos niveles de andrógenos (ej: terapia de reducción de testosterona en individuos portadores de cáncer de próstata), sugiriendo que el tratamiento a base de testosterona solamente presenta efecto en personas con bajos niveles Bouloux, 2005). Con todo esto, existe una controversia en la literatura al respecto de la real importancia de los andrógenos en la homeostasis del tejido esquelético. Es decir, si los efectos de los andrógenos en el hueso son debidos a la acción directa ó si es por la acción en tejidos que están asociados a la salud del hueso, por ejemplo, los músculos, siendo así, el hueso se adaptaría aumentando la DMO en respuesta a un mayor fortalecimiento muscular. Otro hecho que soporta la idea del mecanismo indirecto es el hecho de que la testosterona sirve como precursor para la síntesis de estradiol a través de la enzima aromataza, de ese modo los andrógenos ejercerían su función el hueso actuando sobre los receptores de estrógenos. Entretanto, el hueso ha sido caracterizado por ser un tejido alvo de acción directa de la testosterona ya que fueron observados receptores de andrógenos en el estroma mesenquimal, en los osteoblastos, osteocitos y osteoclastos (Wiren et al., 2008). OVN | 48 Los andrógenos también pueden actuar de forma indirecta regulando, por mecanismos paracrinos y autocrinos, la síntesis de citoquinas y de factores de crecimiento tales como: el factor de crecimiento transformador (TGF)- β y el factor de crecimiento semejante a insulina (IGFs) los cuales estimulan la síntesis ósea y la interleuquina-1 (IL)-6 la cual estimula la osteoclastogenesis (Kasperk et al., 1997). Los andrógenos inhiben la paratormona (PTH) y la síntesis de prostaglandina E2 inducida por la interleuquina-1 (IL-1) y estimulan la producción de interleuquina-1 β (IL-β) potencializando el efecto mitogénico del factor de crecimiento fibroblastico (FGF) en osteoblastos cultivados. La dihidrotestosterona provoca reducción en los niveles de osteoprotegerina (OPG), en lo cual incrementa la actividad de los osteoclastos (Bellido et al., 1995). La orquiectomia estimula la proliferación y diferenciación de los osteoclastos. De esa manera, hay una rápida perdida ósea asociada con la reducción de los sitios trabeculares y cortinas con aumento de los marcadores bioquímicos de reabsorción ósea, lo cual fue observada en individuos después de la orquiectomia (Clarke e Khosla, 2009). Frente a la complejidad del tejido óseo, la administración sistémica de andrógenos ha demostrado ha demostrado diferentes respuestas en los distintos compartimientos esqueléticos (las porciones corticales, trabeculares, e intermembranosas). En individuos hipogonadales una respuesta benéfica a la terapia de andrógenos fue observada en el compartimiento trabecular resultado en el aumento de la masa ósea, tal OVN | 49 hecho fue explicado por la inhibición de la reabsorción ósea, con modificaciones en la microarquitectura traducido en aumento de área trabecular y no en densidad ósea (Moverare et al., 2003). Los andrógenos parecen ejercer una importante función en la formación ósea intermembranosa. Estudios que evaluaron los efectos de los andrógenos en el hueso reportan incremento de la masa ósea cortical como consecuencia de aumento en el espesor y expansión de la superficie periostal (Turner et al., 2004). Tratamientos con altas dosis de testosterona durante dos años en mujeres transexuales resulto en aumento de la DMO en la cabeza del fémur, siendo que, en esta condición el estradiol descendió a niveles semejantes a aquellos pos menopausia. Juntamente con tales hechos fue observado que en hombres con atraso en la pubertad la expansión periosteal fue perjudicada (Yap et al., 2004). Estos estudios indican que los andrógenos actúan in vivo en el mantenimiento de la masa ósea trabecular a través de la inhibición de la actividad de los osteoclastos y en la expansión cortical del hueso en la superficie periosteal (Wiren et al., 2008). Entretanto, el aumento de la formación ósea a través de la activación de los osteoblastos y osteocitos maduros permanecen sin ser totalmente lucido, sin embargo algunos autores sugieren que la testosterona actúe inhibiendo la apoptosis de los osteocitos y osteoblastos y también en la diferenciación de estos últimos. (Clarke e Khosla, 2008). En estudios con ratones Wiren et al., (2008), observaron que la activación de receptores androgenicos conducía a una reducción “turnover” de la OVN | 50 población de osteoblastos maduros (osteositos), reducirían la formación y reabsorción ósea en el área trabecular para aumentar el volumen trabecular y promover una significante reducción en el área cortical de hueso debido a la inhibición de la formación ósea en la superficie endocortical por los osteoblastos/osteocitos resultando en pérdidas de la calidad de la matriz, en la competencia bioquímica y en la resistencia total del hueso. Entretanto la estimulación de los receptores de andrógenos aumenta la formación ósea en los sitios periosteales y el crecimiento óseo en los sitios intramenmbranosos. Análisis moleculares permitirían afirmar que la reducción en la síntesis de colágeno y de osteocalcina (proteína que une el calcio a la matriz ósea) en los osteoblastos y osteocitos fueron los causantes de esa pérdida de calidad en la matriz en detrimento de la geometría o de la masa ósea en la presencia de altos niveles de testosterona. En estudios realizados por Pederson et al., 1999, los autores sugieren que los andrógenos pueden actuar directamente en los osteoclastos inhibiendo la reabsorción ósea y/o reduciendo la respuesta de tales células frente a los estímulos de la paratormona. OVN | 51 3.0 MATERIALES Y METODOS 3.1 Lugar de ejecución del proyecto Este proyecto se desarrollo en una finca particular en el municipio de Janaúva, Minas Gerais (MG) y dentro del laboratorio de biología de la reproducción del Instituto de Ciencias Biológicas (ICB) de la Universidad Federal de Minas Gerais (UFMG) 3.2 Animales experimentales y criterios de selección Los animales del experimento se seleccionaron de un grupo de trescientos animales machos bajo los siguientes criterios: Examen clínico general, evaluación andrológica, edades de nacimiento, peso y raza, para de esta manera obtener un grupo experimental lo más saludable y homogéneo posible en cuanto a las características anteriormente mencionadas. Después del pesaje, evaluación andrológica y pruebas de comportamiento sexual, se seleccionaron los animales que cumplieron con los requisitos del experimento La muestra seleccionada para el experimento fue de 30 toros (Bos Indicus) de raza Cebú Nelore 11 con cauterización del ducto incisivo del órgano OVN | 52 vomeronasal, 11 sin cauterización, enteros (control) y 8 los cuales se les someterá a una orquiectomia bilateral, los cuales tenían una edad al inicio del proyecto promedio 20 meses con un peso de 268 Kg en promedio, estos serán mantenidos en potrero con forrajes Brachiaria decumbens y Brachiaria brizantha y sal mineralizada a voluntad. Los animales seleccionados se distribuyeron en los tres grupos anteriormente mencionados de manera aleatoria y finalmente quedaran de la siguiente manera: Grupo 1. Animales enteros, este grupo de animales se utilizaron como grupo control. Grupo 2. Animales sometidos a cauterización del órgano vomeronasal con la utilización de un hierro caliente en el ducto incisivo. Grupo 3. Animales sometidos al proceso de castración por el método de orquiectomia bilateral con emasculador. Estos animales se pesaron al inicio del experimento y al final en el momento de alcanzar la edad de sacrificio, al rededor de los 480kg. 3.3 Toma de muestras Todas las muestras necesarias fueron tomadas el día en el que los animales sean sacrificados de la siguiente manera: OVN | 53 3.3.1 Peso de los animales en la edad de sacrificio: Los animales fueron pesados de manera individual dentro de una balanza electrónica, haciendo las anotaciones simultáneas de los datos arrojados por el mecanismo. 3.3.2 Toma de muestra de fragmento de hueso: Una vez abatidos todos los animales, se realizo un corte transversal para retirar el órgano vomeronasal se aprovechará para obtener un fragmento de la mandíbula disecada y cortada transversalmente en el local de mayor diámetro. Este corte se realizo en forma segmentaria, en la porción rostral de la calavera específicamente a nivel de la escotadura nasoinsiciva (se cortan las apófisis nasales del incisivo), porción laterorostral del maxilar y por ventral apófisis palatinas del incisivo. Posterior a esto se realizo la identificación de cada pieza con papel plastificado e hilo de nilón y las muestras se transportaron en una solución de formol al 10% hasta el laboratorio. Una vez las muestras en el laboratorio, se procedió a tomar un fragmento del hueso maxilar de aproximadamente 5mm de espesura de cada una de OVN | 54 las muestras, estos fragmentos fueron puestos individualmente en solución de alcohol al 70%. Dentro de frascos plásticos de 50ml debidamente identificados. 3.3.3 Toma de muestras de testículo: En el momento del sacrificio se extrajeron los testículos de los animales. A partir de allí se tomaron muestras de 5cm aproximadamente, las cuales fueron perfundidas en una solución salina para lavarlas y posteriormente inmersas en formol a 10% para la conservación de las estructuras celulares del parénquima testicular en frascos de 50 ml los cuales fueron debidamente identificados. 3.4 Criterios de exclusión: Una vez tomadas las muestras de los animales y antes de iniciar el procesamiento de las mismas, se realizo la exclusión de los animales en los cuales los procedimientos anteriormente descritos no fueron exitosos. Se determinara como no exitoso el proceso de la cauterización del ducto incisivo del órgano vomeronasal cuando al realizar la prueba de perfusión del órgano esta de positiva. Esta prueba se realizara inyectando agua destilada a través del ducto nasal del órgano vomeronasal y evaluando si hay o no salida de liquido por el ducto incisivo; en el caso que haya salida de OVN | 55 liquido se tomara la prueba como positiva y por tal motivo éste animal y sus datos serán excluidos del análisis. 3.5 Determinación de densidad ósea a. La densidad ósea se determino a partir de los fragmentos de hueso maxilar, previamente obtenidos, aplicando la formula básica de la densidad en donde se tiene que densidad es equivalente a masa sobre volumen (D=M/V). Esto se realizo de la siguiente manera: b. Extracción mecánica del periostio, para garantizar la medición única de hueso y no alterar los datos con fragmentos de otro tejido. c. Posteriormente se procedió a realizar el pesaje de cada fragmento de forme individual en una balanza analítica de precisión (Master) para determinar la masa (gr) de la muestra. d. Una vez obtenida la masa de cada fragmento se procedio a obtener el volumen de cada muestra a través del método de peso de volumen desplazado, en donde se tiene un Becker con un “x” volumen de agua el cual es pesado en una balanza analítica de precisión, inmediatamente obtenido el volumen uno, se procede a introducir el fragmento dentro del Becker de tal manera que permanezca suspendido dentro del agua para no alterar la lectura de la balanza y se toma el volumen dos. OVN | 56 Ya obtenidos volumen uno y dos se procede a restar al volumen dos el volumen uno y de esta manera se obtiene el volumen total desplazado por el hueso, que en este caso sería equivalente al volumen del hueso. e. Adquiridos los datos de masa y volumen da cada una de las muestras se procedió a aplicar la formula de la densidad y a tomar nota de los resultados obtenidos. 3.6 Histología del hueso y testículo. Antes que nada, para realizar cualquier tipo de proceso histológico con muestras de hueso es preciso realizar la descalcificación del mismo, atendiendo a esto la descalcificación de las muestras se realizo poniéndolas dentro de de solución Perenji* durante un periodo aproximado de 21 días en frascos de plástico individuales de 50ml. De acuerdo con los recursos en el laboratorio de trabajo se determinó realizar el proceso de histología de las muestras de hueso y testículo en metacrilato. Una vez con las muestras de hueso descalcificadas se procedió con el siguiente protocolo: a. Corte de muestras de tamaño histológico (4mm Aproximadamente), teniendo en cuenta con el hueso de tomar dentro de la misma muestra parte de hueso esponjoso y parte de hueso compacto. OVN | 57 b. Lavado de las muestras con alcohol 70% para quitar residuos de acido (solamente para hueso). c. Poner las muestras, con el nuevo tamaño, en los tubos de deshidratación pre infiltración. d. Deshidratación de las muestras, para metacrilato, con alcohol de manera creciente (alcohol 75%/60minutos, alcohol 85%/60minutos, alcohol 95%/45minutos, alcohol 95%/30minutos, alcohol absoluto/30minutos y alcohol absoluto/30minutos). (Tabla 1) Tabla 1 - Deshidratación de las muestras en series decrecientes de etanol con tiempos establecidos, para iniciar el proceso de preinfiltracion de las muestras. Belo Horizonte, 2009. e. Pre infiltración en metacrilato: inmersión de muestras en una solución de 50% metacrilato y peróxido de dibenzoile (100ml/1gr respectivamente) y 50% de alcohol absoluto durante 24 horas a 4 Cº. f. Infiltración en metacrilato: las muestras son retiradas de los tubos de pre infiltración para ser secadas rápidamente con papel filtro y posteriormente puestas en los moldes de infiltración, donde se ubica la OVN | 58 muestra de manera centrada y es cubierta por completo de una solución de metacrilato con solución polimerizadora JB-4 Plus Polysciences. Posterior a esto se sobreponen los bloques de PVC que soportaran la muestra en el momento del corte. g. Secado de las muestras: una vez infiltradas todas la muestras se ponen para secar en la estufa por 12 horas h. Con los bloques de metacrilato secos se prosigue a realizar los cortes correspondientes de cada muestra en un micrótomo ultramicrótomo Reichert-Jung, de cada bloque se pretenden sacar tres láminas cada una con por lo menos 4 cortes de 3nm. i. Coloración: la coloración de las laminas se realizará con una solución de 5% de Azul de toludina y 1% de Borato de sodio, sumergiendo las laminas durante un minuto en esta solución y posteriormente realizando el enjuague de estas con agua durante 12 minutos para evitar la sobre coloración. j. Una vez secas las laminas se procedió a cubrir los corte con lamínulas y Entelan (NEW MERCK). 3.6.1 Datos histológicos del hueso (Densitometría) El análisis que se realizo fue un análisis que permitió evaluar la densidad del hueso un poco más de cerca determinando las proporciones entre hueso OVN | 59 compacto y esponjoso comparando los datos de los animales de los tres grupos. Para lograr lo anterior se procederá a tomar doce (12) fotos digitales con aumento de 10x de las láminas obtenidas de cada animal, de las doce (12) fotos seis (6) serán de hueso esponjoso y seis (6) de hueso compacto. El paso a seguir es realizar la impresión de estas fotos las cuales una vez impresas serán usadas para realizar el conteo proporcional de puntos; el cual consiste en sobre poner una cuadricula de 400 puntos sobre la foto, así obtendremos 400 espacios de los cuales unos coincidirán con espacio ocupado por el tejido y otros coincidirán con intersticio o espacios vacíos, esto en el caso de el hueso esponjoso. En el caso de hueso compacto tendremos la misma cuadricula con 400 puntos pero esta vez lo que se pretende contar son aquellos puntos en donde la cuadricula coincida con núcleos celulares. Una vez realizado el conteo finalmente tendremos un total de 2400 puntos contados de cada muestra para hueso esponjoso y un tanto igual para hueso compacto, este número de datos obtenidos par cada muestra nos permitirá realizar un análisis de proporción. OVN | 60 3.6.2 Datos histológicos de Testículo Morfometria testicular: Para lograr lo anterior se procedio a tomar cuatro (4) fotos digitales con aumento de 10x de las láminas obtenidas de cada animal. Una vez con estas fotos se procedió a imprimirlas. Se procede a estimar el área correspondiente a cada uno de los tejidos, en los cuales se opta por medir el espacio intersticial y el área de la porción de los túbulos seminíferos. Esto se realizara tomando una cuadricula con 400 intersecciones dibujada en una acetato trasparente la cual es colocada sobre la fotografía del tejido testicular y se cuentan las intersecciones que coincidan con cada una de las estructuras histológicas a determinar (Intersticio y Túbulos seminíferos) La cuadricula utilizada para estimar las proporciones del área ocupada por cada uno de los tejidos es de un formato homogéneo compuesta por 20 líneas verticales y 20 líneas intersecciones. horizontales dando un total de 400 OVN | 61 3.7 Determinación de producción de testosterona: Se procedio a realizar unas observaciones sobre las laminas de tejido testicular directamente en un microscopio de luz Nikon, utilizando una lente de inmersión (100x aumento de magnificación) y un ocular con reglilla que nos permita determinar el diámetro de los núcleos de las células de leydig en el intersticio, las cuales están estrechamente relacionadas con la producción de testosterona. (Abercrombie., 1945) y (Lennox., 1979 ) 3.7.1 Determinación del volumen de las células de leidyg: El volumen de las células de leidyg fue calculado mediante una fórmula de volumen de (esfera maciza): 4π x R3 V= ------------------- 3 π x D x d2 V= --------------------------- 6 OVN | 62 Donde: V = Volumen π = Pi R = Radio D = Diámetro mayor de la célula de leidyg d = Diámetro menor de la célula de leidyg (Baracat et al., 1991), (Zirking et al., 1988). (Lennox et al., 1979) 3.8 ANALISIS DE DATOS OBTENIDOS Los datos obtenidos se analizaron a través de un estudio de comparación entre los datos de los grupos. Utilizando las siguientes variables de análisis: a) Media de densidad ósea de los tres grupos. b) Media de pesos de los testículos de los grupos 1 y 2. c) Media de los diámetros de las células de Leydig. d) Medias de ganancia de peso. Posterior mente se realizo un análisis de correlación entre los datos de densidad y otros datos tales como, el peso y la producción estimada de testosterona testicular de los animales. OVN | 63 3.8.1 Análisis estadístico. Los datos se analizaron utilizando el paquete de recursos computarizados del software R. Se realizo la comprobación de supuestos para análisis parámetricos con el 99% de confianza encontrando que todas las variables con excepción de células de Leydig cumplían con dichos supuestos. Se realizo un Análisis de varianza (ANOVA) para cada grupo animal y cada una de las diferentes variables a evaluadas. Para la variable volumen de células de Leydig se realizó la prueba de Kruskall-Walis que es una prueba de distribución libre, ya que ésta no presento normalidad. OVN | 64 RESULTADOS Y DISCUCIÓN El análisis comparativo de los tres grupos presento los siguientes resultados: 4.1 RESULTADOS DESCRIPTIVOS A partir de los datos obtenidos se determino que el peso de canal de los animales del grupo control fue de 268,91 ± 6,70 kg, según el peso mínimo de 231,2 kg y el máximo de 300,4 kg. El peso de canal de los animales del grupo tratado fue de 266,04 ± 9,10 kg, según el peso mínimo de 254,2 kg y el máximo de 277,6 kg. El peso de canal de los animales del grupo castrado fue de 259,68 ± 6,70 kg, según el peso mínimo de 251,2 kg y el máximo de 271,4 kg. Para ésta variable, se observo que no hay evidencia de diferencias estadísticamente significativas entre los grupo evaluados con una confianza del 95% (Gráfico 1.) OVN | 65 350 300 Peso (kg) 250 200 150 100 50 0 Castrado Control Tratado Grupo Gráfico 1. Peso en canal dado en kilogramos para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. Por otra parte el porcentaje de ganancia de peso de los animales del grupo control fue de 43,06 ± 5,60 %, según el porcentual mínimo de 33,23 %y el máximo de 50,64 %. El porcentaje de ganancia de peso de los animales del grupo tratado fue de 43,1 ± 2.25 %, según el porcentual mínimo de 38,23 % y el máximo de 51,11 %. El porcentaje de ganancia de peso de los animales del grupo castrado fue de 41,71 ± 3,77 %, según el porcentual mínimo de 35,41 % y el máximo de 46,45 %. Para ésta variable, se observo que no hay evidencia de diferencias estadísticamente significativas entre los grupo evaluados con una confianza del 95% (Grafico 2) y (Gráfico 3). OVN | 66 60,00% Porcentaje 50,00% 40,00% 30,00% 20,00% 10,00% 0,00% Castrado Control Tratado Grupo Gráfico 2. Porcentaje de ganancia de peso para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. 180 160 140 Peso (kg) 120 100 80 60 40 20 0 Castrado Control Tratado Grupo 3. Ganancia de peso en kilogramos para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. Gráfico OVN | 67 De manera similar se comporto la variable densidad ósea donde para los animales del grupo control presento una media de 1,54 ± 0,086 kg/m3, según la densidad mínima de 1,43 kg/m3 y la máxima de 1,65 kg/m3. La media de densidad ósea de los animales del grupo tratado fue de 1,54 ± 0,041 kg/m3, según la densidad mínima de 1,48 kg/m3 y la máxima de 1,61 kg/m3. La media de densidad ósea de los animales del grupo castrado fue de 1,52 ± 0,041 kg/m3, según la densidad mínima de 1,44 kg/m3 y la máxima de 1,57 kg/m3 (Gráfico 4). 1,8 1,6 Densidad (gr) 1,4 1,2 1 0,8 0,6 0,4 0,2 0 Castrado Control Tratado Grupo 3 Gráfico 4. Densidad ósea expresada en kg/m para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. OVN | 68 En la variable peso testicular el promedio de los animales del grupo control fue de 326,36 ± 69,82 gr, según el peso mínimo de 225 gr y el máximo de 425 gr. El peso testicular promedio del grupo tratado fue de 303,82 ± 48,73 gr, según el peso mínimo de 230 gr y un máximo de 365 gr. Para ésta variable, se observo que no hay evidencia de diferencias estadísticamente significativas entre los grupo evaluados con una confianza del 95% (Gráfico_5). 450 400 350 Peso (gr) 300 250 200 150 100 50 0 Control Tratado Grupo Gráfico 5. Peso testicular dado en gramos para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. OVN | 69 A diferencia de todas la variables anteriores la variable volumen de células de Leydig si presento una diferencia estadística significativa, donde el promedio del volumen de células de Leydig para el grupo control fue de 205,19 ± 4,65 µm3, según el peso mínimo de 196,86 µm3 y el máximo de 211, 62 µm3. El promedio del volumen de células de Leydig para el grupo control fue de 140,66 ± 7,39 µm3, según el peso mínimo de 126,78 µm 3 y el máximo de 151,52 µm3 (Gráfico 6). 250 Volumen (nm) 200 150 100 50 0 Control Tratado Grupo 3 Gráfico 6. Volumen de las células de Leydig expresado en µm para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. OVN | 70 4.2 RESULTADOS Usando la prueba de ANOVA para comparar valores de los grupos control, tratado y castrado encontramos que Pr(>F) = 0.3012 para peso de canal, Pr(>F) = 0.7794 para porcentaje de ganancia de peso, Pr(>F) = 0.6276 para densidad ósea, Pr(>F) = 0.3903 para peso testicular; Mostrando así que no existe diferencias significativas entre los tres grupos estudiados para las variables anteriormente mencionadas. Para la variable volumen de celulas de Leydig se aplico la prueba KruskalWallis donde P-value = 0.0001571, demostrando así que hay diferencia significativa entre el grupo control y el castrado. Tabla 2. Datos tomados para peso canal, volumen de células de Leydig, peso testicular, ganancia de peso, para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. Tabla 3 – Peso en canal, volumen de células de Leydig, peso testicular, ganancia de peso, y densidad ósea de cada uno de los grupos experimentales. Belo Horizonte, 2009. OVN | 71 4.3. DISCUSIÓN En este estudio experimental se busco analizar las posibles alteraciones de desarrollo productivo en toros cebuinos de raza Nélore, a partir de la exposición a tres tratamientos distintos, Evaluando 5 diferentes variables, donde las variables peso de canal, ganancia de peso, densidad ósea, peso testicular no presentaron diferencia estadísticamente significativa. Por el contrario la variable volumen de células de Leydig si evidencio una diferencia significativa, Sabiendo que este volumen ésta directamente relacionado con la producción de testosterona producida por los testículos como fue mencionado por Santos (2008) y Zirkin (1988). Se puede deducir que la producción de testosterona testicular del grupo tratado fue significativamente menor que la del otro grupo control contra el cual fue comparado. Esta diferencia en la producción de testosterona testicular se puede explicar a partir de la cauterización del ducto incisivo del OVN, ya que a través de esta técnica lo que se produce es una obstrucción del ducto, impidiendo así, una correcta recepción de algunas hormonas, las cuales generan un estimulo sobre la producción de testosterona testicular; al reducirse la presencia de estas hormonas lógicamente la producción de testosterona también se verá disminuida. Ya que el órgano vomeronasal es un sistema que no solo se encarga de la percepción de feromonas, este se conecta al hipotálamo y a otros centros nerviosos del encéfalo, para desencadenar OVN | 72 respuestas endocrinas relacionadas con las conductas sexuales y/o grupales de los individuos, así como también sobre las gónadas a través del eje hipotálamo-hipófisis-gónadas (Halpern 1987). Si bien, esta diferencia en la producción de testosterona testicular parece no afectar estadísticamente la producción de los animales de ninguno de los grupos, pero al revisar el análisis descriptivo se evidencian una serie de tendencias que nos indican algún posible tipo de alteración productiva cuando comparamos las variables de tipo productivo con el volumen de las células de Leydig. La variable de peso de canal muestra una correlación directa entre la producción de testosterona testicular (volumen de células de leydig) y los desempeños en canal de cada uno de los grupos, poniendo en el primer lugar al grupo control, seguido por el grupo tratado y dejando por último al grupo castrado. Bavera y Peñafort (2006) mencionaron que las carcasas de bovinos enteros y castrados son comparadas, y los resultados han demostrado que los animales enteros son superiores en peso y conformación, así como presentan mayor proporción de musculo. Por ende nuestro grupo tratado comparado con el grupo castrado nos muestra un mejor desempeño en su canal debido a que con la cauterización del ducto incisivo del órgano vomeronasal no se presenta la remoción de gónadas y con ello no hay a ausencia de las hormonas testiculares. Por ende el aspecto en gano de peso y eficiencia alimenticia, manifiesta una OVN | 73 superioridad de los afirmado por animales enteros frente a los castrados, como fue Restle (1999) atribuido a la acción de las hormonas y andrógenos producidos en los testículos. Se atribuyo a la acción de las horrmonas y andrógenos producida en los testículos, el mayor rendimiento de la canal y mayor proporción de musculo en la canal de los animales enteros, presentando una mejor conformación que los castrados (Restle 1999), (Ribeiro 2004). Teniendo en cuenta que las hormonas y andrógenos provenientes de los testículos parecen tener mayor efecto en la fase en que los animales tienen mayor incremento de peso. (Lee 1990). Si enfrentamos nuestro grupo tratado con el grupo control notamos una no muy marcada diferencia en peso de la canal, lo cual nos lleva a deducir que por el efecto de la cauterización del ducto incisivo del órgano vomeronasal, la recepción de feromonas se ve afectada, por lo cual no va desencadenar respuestas endocrinas relacionadas con conductas sexuales, ni sobre las gónadas a través del eje hipotálamo-hipófisis-gónadas como fue citado por Halpern (1987), generando unos niveles de testosterona menores y con esto una menor pero no muy marcada ganancia de peso en canal. Esta tendencia también se repite para la variable peso testicular (Grafico 7 y 8). OVN | 74 270 250 268 Peso (kg) 264 150 262 100 260 258 Volumen (µm³) 200 266 Canal Celulas de Leydig 50 256 254 0 Castrado Control Tratado Grupo 3 Gráfico 7. Relación entre el volumen de las células de leydig (µm ) y peso de canal (Kg) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. 250 330 325 320 315 150 310 100 305 Volumen (µm³) Peso (g) 200 Peso Testicular Celulas de Leydig 300 50 295 0 290 Control Tratado Grupo 3 Gráfico 8. Relación entre el volumen de las células de leydig (µm ) y peso testicular (gr) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. OVN | 75 La variable densidad ósea muestra una tendencia muy atrayente, ya que los valores de los grupo tratado y control se muestran muy similares en cuanto a densidad ósea pese a una marcada diferencia en el volumen de células de Leydig, Mientras que el grupo castrado se encuentra por debajo debido a que su producción de testosterona testicular es igual a cero (Grafico 9). Se han realizado estudios de los efectos de los andrógenos sobre el hueso, demostrando así, que existe una alta correlación entre los niveles de andrógenos y la densidad ósea, siendo que a mayor cantidad de andrógenos mayor densidad ósea. Lo cual quiere decir que el tener animales más pesados es posible si se mantienen altos los niveles de andrógenos, que en el caso de los machos bovinos el más importante es la testosterona producida en los testículos como fue comprobado por Bavera y Peñafort (2006). Indicando así que la resistencia esquelética de los animales con cauterización del ducto incisivo del OVN es muy similar a la de los animales enteros y superior a la de los castrados esto puede ser debido al mayor nivel de andrógeno circulante en los machos como fue argumentado por Clarke e Khosla (2008). OVN | 76 18 250 16 Kg/m³ 12 150 10 8 100 6 4 Volumen (µm³) 200 14 Densidad osea Celulas de Leydig 50 2 0 0 Castrado Control Tratado Grupo 3 Gráfico 9 Relación entre el volumen de las células de Leydig (µm ) y densidad ósea 3 (Kg/m ) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. Por otra parte, la variable ganancia de peso muestra un comportamiento positivo para el grupo tratado pese a que la diferencia entre grupo control y tratado fue muy mínima, mientras la diferencia del grupo castrado frente a los otros dos grupos si fue bastante evidente (Grafico 11). Esta tendencia también se repite para la variable de ganancia de peso en relación con la densidad ósea. (Grafico 10). El comportamiento de esta variable se explica a partir de la influencia de los andrógenos, en especial la testosterona, sobre el desarrollo corporal de los machos; lo cual hace que los animales castrados por la ausencia de los testículos se vean perjudicados en cuanto a esto. A demás esa mínima diferencia entre grupos control y tratado, a favor del tratado, se puede OVN | 77 atribuir al menor gasto energético de los animales tratados debido a 44% 250,000 43% 200,000 43% 150,000 42% 100,000 42% 50,000 41% 0,000 Castrado Control Volumen (µm³) Porcentaje docilidad. Ganancia de peso Celulas de Leydig Tratado Grupo 3 Gráfico 10- Relación entre el volumen de las células de leydig (µm ) y ganancia de peso (%) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. 1,545 146 1,54 Kg/m³ 1,53 142 1,525 140 1,52 1,515 Peso (kg) 144 1,535 138 1,51 Densidad osea Ganancia de peso 136 1,505 1,5 134 Castrado Control Tratado Grupo 3 Gráfico 11 Relacion entre el la densidada osea (Kg/m ) y ganacia de peso (Kg) para animales sometidos a diferentes tratamientos en la evaluación del efecto de la cauterización del ducto incisivo del OVN en toros. Belo Horizonte (Brasil), 2009. OVN | 78 A pesar que los resultados estadísticos de este estudio solo evidenciaron diferencias estadísticamente significativas para la variable volumen de células de Leydig, el análisis descriptivo si muestra una tendencia marcada en la cual el grupo tratado supera en todos los aspectos al grupo castrado y se acerca en gran manera a los desempeños productivos del grupo control. Lo cual lleva a pensar que si en un periodo de seis meses de tratamiento los grupos muestran una clara tendencia, con un periodo más prolongado de exposición a los distintos tratamientos se podría llegar a encontrar diferencias estadísticamente significativas en los parámetros productivos de los animales estudiados, ya que la variación en cuanto a la producción de testosterona testicular si es evidente. OVN | 79 6. CONCLUCIONES A partir de los resultados obtenidos para toros de la raza Nélore, se concluye que los animales sometidos a la cauterización del ducto incisivo del OVN presentan un menor volumen de células de Leydig que los animales enteros sin cauterización y por ende se deduce que la producción de testosterona testicular se comporta de igual manera. Lo anterior se ve reflejado en que los animales sometidos a la cauterización del ducto incisivo del OVN presentan cierta tendencia a ser animales de condiciones productivas intermedias entre los animales enteros y los castrados, es decir, presentan un desempeño mejor que los animales castrados y menor que los animales enteros, a pesar que estas diferencias sean prácticamente imperceptible y sin diferencias estadísticamente significativas para los siguientes aspectos: Porcentaje de ganancia de peso. Densidad ósea. Peso de la canal. Peso testicular. Los animales cauterizados evidencian reducciones en la producción de testosterona suficientes para generar animales mas dóciles pero no tan basales para alterar su productividad, mostrando una seria tendencia a ser superiores productivamente a los animales castrados. OVN | 80 8. REFERENCIAS ABERCROMBIE, M. Estimation of nuclear population from microtome sections. Anat. Rec. , v. 49, p. 238- 248, 1946. AZAMBUJA, R. C, et al. Desempenho e rendimento de carcaça de novilhos nelore e braford submetidos a diferentes idades de castração. Universidade Federal de Pelotas, Faculdade de Veterinária - Departamento de Clínicas Veterinária, Núcleo de Pesquisa, Ensino e Extensão em Pecuária (NUPEEC). 2007. BARONE, R.; LOMBARD, M. ; MORAND, M. Organe de Jacobson, nerf vomeronasal et nerf terminal du chien. Bulletin de la Societe des Sciences Veterinaries de Lyon, v. 68, n. 3, p. 257-270, 1966. BARACAT, E.C.; SIMÕES, M.J.; NOVO, N.F.; JULIANO, Y.; LIMA, G.R.; LIMA, F.O.A.; KULAY, J.L. Morphologic and morphometric aspects of the uterine tube epithelium during the menstrual cycle. Revista Paulista de Medicina, v. 109, n. 5, p. 204-212, 1991. BAVERA, G; PEÑAFORT. Cursos de Producción Bovina de Carne, FAV UNRC. 2006. BELLIDO, T.; JILKA, R. L.; BOYCE, B. F.; et al.. Regulation of interleukin-6, osteoclastogenesis, and bone mass by androgens. J. Clin. Invest.. V. 95, p. 2886–2895, 1995. BOULOUX, P.. Testim 1% testosterone gel for the treatment of male hypogonadism. Clin. Ther.. V. 27, p. 286–298, 2005. CLARKE, B. L.; KHOSLA, S.. Androgens and bone. Steroids. V. 74, p. 296-305, 2009. DOVING, K.B.; TROTIER, D. Structure and function of the vomeronasal organ. The Journal of Experimental Biology, v.201 , p. 2913-2925, 1998. E. KOLB.; Fisiologia Veterinaria 4 Ed Rio de Janeiro: Guanabara Koogan p 378- 388,1984. OVN | 81 GUILLAMON, A.; SEGOVIA, S. Sex differences in the vomeronasal system. Brain Research Bulletin, v.44, n. 4, p. 377-382,1997. HAFEZ, E.S.E. Reprodução animal. 6 ed. Rio de Janeiro: Guanabara Koogan. p.59-94, 1995. HALPERN, M. The organization and function of the vomeronasal system. Annual Review of Neuroscience, v. 10, p. 325-362, 1987. HALPERN, M.; MARCOS, A. M. Structure and function of the vomeronasal system: an update. Progress in Neurobiology, v. 70, n. 3, p. 245-318, 2003. H. P. GODINHO.; F. M. CARDOSO; A. C. CASTRO: Anatomia Dos Rumiantes Domesticos 1 ed. Belo Horizonte - Minas Gerais , p 255 -262, 2006. JOHNSTON, R.E. Pheromones, the vomeronasal system, and communication. From hormonal responses to individual recognition. Annals of the New York Academy Science, v. 855, p. 333-348, 1998. JOHNASTON, R.E Chemical communication and pheromnones: the types of chemical signals and the role of the vomeronasal system. The Neurobiology of taste and smell , second ed. Wiley, New York,2000, p. 101-127. K. M. DYCE; W. O. SACK.; C. J. WENSING.; Tratado De Anatomia Veterinaria 3 ed. Rio de Janeiro; Elsevier Editorial Ltda. p 182 – 186, 691 – 698, 2004. KASPERK, C. H.; WAKELY, G. K.; HIERL, T.; et al.. Gonadal and adrenal androgens are potent regulators of human bone cell metabolism in vitro. J. Bone Miner. Res.. V. 12, p. 464–471, 1997. KENNY, A.; RAISZ, L.. Mechanisms of bone remodeling: implications for clinical practice. J. Reprod. Med.. V. 47, p. 63–70, 2002. OVN | 82 KEVERNE, E.B. The vomeronasal organ. Science, v. 286, p. 716-20, 1999. KEVERNE, E. B. The accessory olfactory system and its role in pheromonally mediated changes in prolactin, in; Olfation and Endocrine Regulation, London: IRL press, 1982, p. 127-140. L. D. RUSELL.; A. H. PAYNE.; M. P. HARDY: The Leydig Cell. 1 ed. Vienna: Cache River Press. p 46- 87,1996. L. C. JUNQUEIRA. CARNEIRO; Histología Basica 9 Ed Rio de Janeiro: Guanabara Koogan p 355- 358, 1999. LEE, C.Y.; HENRICKS, D.M. et al. Growth and hormones response of intact and castrate male cattle to trenbolone acetate and estradiol. Journal of Animal Science, v.68, n.9, p.2682-2689, 1990. LEDER, B; LEBLANC, K; SCHOENFELD, D.; et al.. Differential effects of androgens and estrogens on bone turnover in normal men. J. Clin. Endocrinol. Metab. V. 88, p. 204–210, 2003. LENNOX. B.; LOGUE. D. N,; Tubule length and Leydig cell volume in the normal bull testis. The Veterinary Record. V. 104, p. 431-433, 1979. MENDOZA, A.S. Morphological studies on the rodent main and accessory olfactory systems: the region olfactoria and vomeronasal organ. Annals of Anatomy. v. 175, p 425-446, 1993. MOVERARE, S.; VENKEN, K.; ERIKSSON, A.; et al.. Differential effects on bone of estrogen receptor alpha and androgen receptor activation in orchidectomized adult male mice. Proc. Natl. Acad. Sci.. V. 100, p. 573– 578, 2003. NILSSON, L. O.; BOMAN, A.; SAVENDAHL, L.; et al.. Demonstration of estrogen receptor immunoreactivity in human growth plate cartilage. J. Clin. Endocrinol. Metab.. v. 84, p. 370–373, 1999. OVN | 83 PEDERSON, L.; KREMER, M.; JUDD, J.; et al.. Androgens regulate bone resorption activity of isolated osteoclastos in vitro. Proc. Natl. Acad. Sci.. V. 96, p. 505-510, 1999. POWERS, J.B.; WINANS, S. S. Vomeronasal organ: critical role in mediating sexual behavior in the male hamster. Science, v. 187, p, 961-963, 1975. REDVET. Revista electrónica de Veterinaria. ISSN: 1695-7504, 2009 Vol. 10, Nº 7 RESTLE, J.EIFERT, E, C; ALVES FILHO, D. C.; VAZ, F. N.; BRONDANI, I. L.; PASCOAL, L. L. Características da carne de novilhos terminados em diferentes sistemas de alimentação. In: Reunião anual da sociedade brasileira de zootecnia, 37, 2000 RESTLE, J. et al. Machos não-castrados para produção de carne. Confinamento, pastagens e suplementação para a produção de bovinos de corte. Santa Maria: UFSM. Cap.10, p.215-231, 1999. RIBEIRO, E.L.A. et al. Growth and carcass characteristics of pasture fed LHRH immunocastrated, castrated and intact Bos indicus bulls. Meat Science, Exeter, v.68, p.285-290, 2004. SANTOS, M.; KLEYTON , B.; PORTILHO, C.; MENDES, J.; FREITAS, S.; COSTA, S.; SIMÕES, M. Testes morphology and sperm quality of Nelore bulls fed a gossypol-enriched diet. R. bras. Ci. Vet., v. 15, n. 3, p. 134-139, 2008 SALAZAR, I.; QUINTEIRO, P.S.; CIFUENTES, J. M. Comparative anatomy of the vomeronasal cartilage in mammals: mink, cat, dog, pig, cow and horse. Annals of Anatomy, v. 177, p 475-481, 1995. TURNER, A.; CHEN, T.; BARBER, T.; et al.. Testosterone increases bone mineral density in female-to-male transsexuals: a case series of 15 subjects. Clin. Endocrinol.. V. 61, p. 560–566, 2004. WIREN, K. M.; SEMIRALE, A. A.; ZHANG, X. W.; et al.. Targeting of androgen receptor in bone reveals a lack of androgen anabolic action and inhibition of osteogenesis: a model for compartment-specific androgen action in the skeleton. Bone. V. 43, p. 440-451, 2008. OVN | 84 YAP, F.; HOGLER, W.; BRIODY, J.; et al.. The skeletal phenotype of men with previous constitutional delay of puberty. J. Clin. Endocrinol. Metab.. V. 89, p. 4306–4311, 2004 ZIRKIN B. R.; EWING L. L. Comparison of Components of the Testis Interstitium With Testosterone Secretion in Hamster, Rat, and Guinea Pig Testes Perfused In Vitro. The American Journal Of Anatomy. V. 181, p. 12-22, 1988.