RSA Consolidado de consulta Pública perfec 2
Anuncio
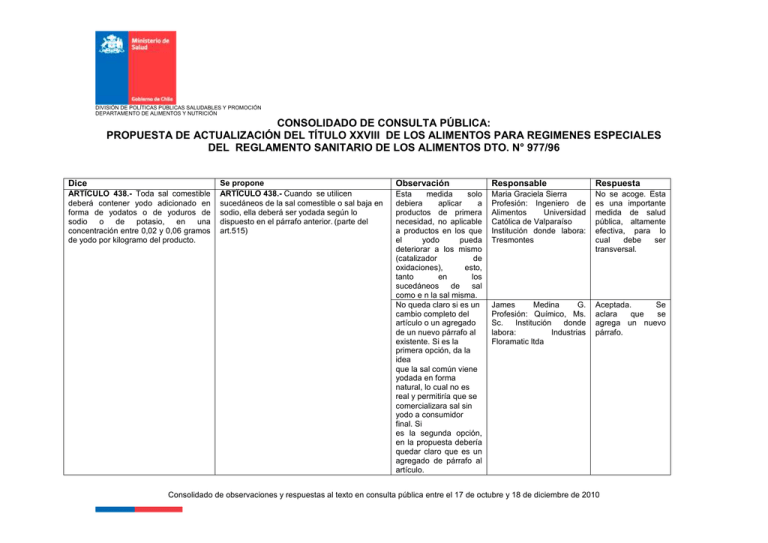
DIVISIÓN DE POLÍTICAS PÚBLICAS SALUDABLES Y PROMOCIÓN DEPARTAMENTO DE ALIMENTOS Y NUTRICIÓN CONSOLIDADO DE CONSULTA PÚBLICA: PROPUESTA DE ACTUALIZACIÓN DEL TÍTULO XXVIII DE LOS ALIMENTOS PARA REGIMENES ESPECIALES DEL REGLAMENTO SANITARIO DE LOS ALIMENTOS DTO. N° 977/96 Dice ARTÏCULO 438.- Toda sal comestible deberá contener yodo adicionado en forma de yodatos o de yoduros de sodio o de potasio, en una concentración entre 0,02 y 0,06 gramos de yodo por kilogramo del producto. Se propone ARTÏCULO 438.- Cuando se utilicen sucedáneos de la sal comestible o sal baja en sodio, ella deberá ser yodada según lo dispuesto en el párrafo anterior. (parte del art.515) Observación Responsable Respuesta Esta medida solo debiera aplicar a productos de primera necesidad, no aplicable a productos en los que el yodo pueda deteriorar a los mismo (catalizador de oxidaciones), esto, tanto en los sucedáneos de sal como e n la sal misma. No queda claro si es un cambio completo del artículo o un agregado de un nuevo párrafo al existente. Si es la primera opción, da la idea que la sal común viene yodada en forma natural, lo cual no es real y permitiría que se comercializara sal sin yodo a consumidor final. Si es la segunda opción, en la propuesta debería quedar claro que es un agregado de párrafo al artículo. Maria Graciela Sierra Profesión: Ingeniero de Alimentos Universidad Católica de Valparaíso Institución donde labora: Tresmontes No se acoge. Esta es una importante medida de salud pública, altamente efectiva, para lo cual debe ser transversal. James Medina G. Profesión: Químico, Ms. Sc. Institución donde labora: Industrias Floramatic ltda Aceptada. Se aclara que se agrega un nuevo párrafo. Consolidado de observaciones y respuestas al texto en consulta pública entre el 17 de octubre y 18 de diciembre de 2010 CONSOLIDADO DE CONSULTA PÚBLICA: PROPUESTA DE ACTUALIZACIÓN DEL TÍTULO XXVIII DE LOS ALIMENTOS PARA REGIMENES ESPECIALES DEL REGLAMENTO SANITARIO DE LOS ALIMENTOS DTO. N° 977/96 Dice ARTÍCULO 495.La fórmula de iniciación reconstituida deberá presentar la siguiente composición básica: Otras sustancias Ingredientes facultativos Mín. Máx. Taurina (mg) -12 Ac. Docosahexaenoico (% de ácidos grasos) 0,5 Cuando se use ácido docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar por lo menos la misma concentración que el DHA. Mín. Máx. Nucleótidos: mg/100 kcal -- 16 Aditivos Se propone ARTÍCULO 495.- La fórmula de iniciación reconstituida deberá presentar la siguiente composición básica: ..// Otras sustancias Se propone que: se elimine este subtítulo, ya que da la idea de que las otras sustancias no fuesen parte de la composición básica y si lo son. h) Ingredientes facultativos Mín. Máx. i)Taurina (mg) -12 ii) Ac. Docosahexaenoico -0,5 (% de ácidos grasos) Cuando se use ácido docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar por lo menos la misma concentración que el DHA. Mín. Máx. iii) Nucleótidos: mg/100 kcal -16 iv)Aditivos sólo se podrán usar los siguientes aditivos en las cantidades señaladas Observación Responsable Respuesta Se reorganizan las letras, ya que al parecer están desconfiguradas. Daniela Isabel Flores Durán Profesión: Ing. en Alimentos Institución donde labora: Abbott Laboratories de Chile Ltda. En Chile sólo se pueden usar los aditivos oficialmente aceptados en los listados positivos del RSA, su uso es facultativo. En la sección aditivos, creemos que es muy restrictivo el limitar la lista del RSA, ya que hay muchas fórmulas que se producen a nivel mundial que están en cumplimiento con CODEX y no necesariamente con este listado, lo cual puede producir un eventual desabastecimiento del país. Hay ciertos aditivos que se ha comprobado el beneficio para los bebés y que no están necesariamente listados en el RSA Consolidado de observaciones y respuestas al texto en consulta pública entre el 17 de octubre y 18 de diciembre de 2010 2 CONSOLIDADO DE CONSULTA PÚBLICA: PROPUESTA DE ACTUALIZACIÓN DEL TÍTULO XXVIII DE LOS ALIMENTOS PARA REGIMENES ESPECIALES DEL REGLAMENTO SANITARIO DE LOS ALIMENTOS DTO. N° 977/96 Dice ARTÍCULO 495.La fórmula de iniciación reconstituida deberá presentar la siguiente composición básica: Otras sustancias Ingredientes facultativos Mín. Máx. Taurina (mg) -12 Ac. Docosahexaenoico (% de ácidos grasos) 0,5 Cuando se use ácido docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar por lo menos la misma concentración que el DHA. Mín. Máx. Nucleótidos: mg/100 kcal -- 16 Aditivos Se propone ARTÍCULO 495.- La fórmula de iniciación reconstituida deberá presentar la siguiente composición básica: ..// Otras sustancias Se propone que: se elimine este subtítulo, ya que da la idea de que las otras sustancias no fuesen parte de la composición básica y si lo son. h) Ingredientes facultativos Mín. Máx. i)Taurina (mg) -12 ii) Ac. Docosahexaenoico -0,5 (% de ácidos grasos) Cuando se use ácido docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar por lo menos la misma concentración que el DHA. Mín. Máx. iii) Nucleótidos: mg/100 kcal -16 iv)Aditivos sólo se podrán usar los siguientes aditivos en las cantidades señaladas Observación Responsable Respuesta g) Otras sustancias por cada 100kcal ..// Ingredientes facultativos Gloria Vera Profesión: Farmacéutico Se acoge la propuesta para mejorar la compresión Químico . a)Taurina (mg) por cada 100kcal Mín. Max -12 b) Ac. Docosahexaenoico 0,5 (% de total de lípidos) Cuando se use ácido docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar por lo menos la misma concentración que el DHA. c)Nucleótidos: mg/100 kcal Mín. Máx. -16 d)Aditivos Sólo se podrán usar los siguientes aditivos en las cantidades señaladas Consolidado de observaciones y respuestas al texto en consulta pública entre el 17 de octubre y 18 de diciembre de 2010 3 CONSOLIDADO DE CONSULTA PÚBLICA: PROPUESTA DE ACTUALIZACIÓN DEL TÍTULO XXVIII DE LOS ALIMENTOS PARA REGIMENES ESPECIALES DEL REGLAMENTO SANITARIO DE LOS ALIMENTOS DTO. N° 977/96 Se propone Dice ARTICULO 505.- Además de lo dispuesto para etiquetado general y para regímenes especiales las preparaciones comerciales de alimentos infantiles deberán indicar en su etiqueta lo siguiente: a)“para niños mayores de seis meses”; b)fecha de elaboración y fecha de vencimiento; c)instrucciones sobre su preparación y uso, así como su almacenamiento y conservación antes y después de abrir el envase. En este tipo de productos, no deberán incorporarse en los rótulos ni publicidad de los mismos, declaraciones de propiedades saludables. ARTICULO 521.- Si el producto se presenta como sustituto de una o más comidas de la dieta diaria deberá aportar como mínimo 200 kcal y como máximo 400 kcal por comida, esto referido al producto tal como se comercializa ARTICULO 524.- Las grasas no deberán aportar más del 30% de la energía disponible en el alimento. No menos del 3% de la energía disponible deberá ser aportada como ácido linoleico en forma de glicérido Agregar al final Los alimentos infantiles no deberán formularse con hierbas que induzcan el sueño en los menores o con el propósito de reducir el meteorismo o dolores abdominales o hinchazón, ni otros fines terapéuticos Si el producto se presenta como sustituto de una o más comidas de la dieta diaria deberá aportar como mínimo 200 kcal y como máximo 400 kcal por comida, esto referido al producto tal como se comercializa. Estos alimentos deberán cumplir con el descriptor bajo en grasa y no deberán aportar más del 30% de la energía disponible en el alimento. No menos del 3% de la energía disponible deberá ser aportada como ácido linoleico en forma de glicérido. Observación Responsable Respuesta Los alimentos infantiles no deberán formularse con hierbas o sus extractos u otros componentes que induzcan el sueño. El concepto de fines terapéuticos ya está abordado en el Art. 110 del RSA, por lo que talvez sería redundante señalarlo nuevamente aquí. Con respecto al concepto de “otros componentes”, creemos que debiese ser más claro éstos “otros” ya que existen actualmente en el Mercado formulaciones con diferentes ingredientes En el caso de productos deshidratados esta indicación debería ser en el producto reconstituido de acuerdo a las instrucciones del elaborador. Daniela Isabel Flores Durán Profesión: Ing. en Alimentos Institución donde labora: Abbott Laboratories de Chile Ltda. Se acoge agregar “o sus extractos. Se ha considerado necesario explicitar esta restricción, especialmente en este tipo de alimentos. En alimentos infantiles los ingredientes son sólo los permitidos en los artículos específicos. Maria Graciela Sierra Profesión: Ingeniero de Alimentos Universidad Católica de Valparaíso Institución donde labora: Tresmontes No se acoge, en la rotulación general como específica, se debe rotular el producto tal como se comercializa, facultativamente puede agregarse una tercera columna con la preparación sugerida Sin observaciones Consolidado de observaciones y respuestas al texto en consulta pública entre el 17 de octubre y 18 de diciembre de 2010 4 CONSOLIDADO DE CONSULTA PÚBLICA: PROPUESTA DE ACTUALIZACIÓN DEL TÍTULO XXVIII DE LOS ALIMENTOS PARA REGIMENES ESPECIALES DEL REGLAMENTO SANITARIO DE LOS ALIMENTOS DTO. N° 977/96 Dice ARTICULO 525.- Cuando un alimento se presente como sustitutivo de todas las comidas de un día, deberá contener al menos el 100% de las cantidades de vitaminas y minerales especificadas a continuación: Vitamina A 600mcgequiv. tinol Vitamina D 2,5 mcg Vitamina E 10 mg Vitamina C 60 mg Tiamina 0,8 mg Riboflavina 1,2 mg Niacina 11 mg Vitamina B6 2 mg Vitamina B12 1 mcg Acido fólico 200 mcg Calcio 500 mg Fósforo 500 mg Hierro 16 mg Yodo 140 mcg Magnesio 50 mg Cobre 1,5 mg Zinc 6 mg Potasio 1,6 g Sodio 1,0 g Estos alimentos deberán contener un mínimo de 13 g de fibra dietética total. El límite superior de vitaminas y minerales deberá ser igual a las Dosis Diaria de Referencia establecidas en el presente reglamento. Se podrán incluir otros nutrientes esenciales no especificados en esta lista para las que exista Dosis Diaria Recomendada o Valores de Referencia Diaria Se propone Observación Responsable Respuesta Cuando un alimento se presente como sustitutivo de todas las comidas de un día, deberá contener al menos el 100% de las cantidades de vitaminas y minerales especificadas a continuación, en el producto tal como se comercializa: Vitamina A 600 mcg equiv. retinol Vitamina D 2,5 mcg Vitamina E 10 mg Vitamina C 60 mg Tiamina 0,8 mg Riboflavina 1,2 mg Niacina 11 mg Vitamina B6 2 mg Vitamina B12 1 mcg Acido fólico 200 mcg Calcio 500 mg Fósforo 500 mg Hierro 14 mg se adecua a la DDR Yodo 140 mcg Magnesio 300 mg se adecua a la DDR Cobre 1,5 mg Zinc 6 mg Potasio 1,6 g Sodio 0,6 g se propone disminuirlo, basado en la estrategia de la OMS Estos alimentos que se presenten como sustitutivo de todas las comidas de un día deberán contener un mínimo de 13 g de fibra dietética total. Estos alimentos que se presenten como sustitutos de todas las comidas de un día deberán contener un mínimo de 13 g de fibra dietética total. Las cantidades por cada tiempo de comida, deberán ajustarse a una cantidad que corresponda al 33% ó 25% del total señalado, según si el número de porciones recomendadas por día es de 3 ó 4, respectivamente, lo que corresponde a 4,3 g o 3,3 g de fibra dietética/porción, según si son 3 0 4 porciones por día. Gloria Vera Profesión: Químico Farmacéutico Se acoge propuesto lo El límite superior de vitaminas y minerales deberá ser igual a las Dosis Diaria de Referencia establecidas en el presente reglamento. Se podrán incluir otros nutrientes esenciales no especificados en esta lista para los que exista Dosis Diaria Recomendada o Valores de Referencia Diaria, la sumatoria o concentración final de ellos en el producto, no deberá ser superior al 100% de la Dosis Diaria de Referencia establecida para el nutriente en particular. Consolidado de observaciones y respuestas al texto en consulta pública entre el 17 de octubre y 18 de diciembre de 2010 5