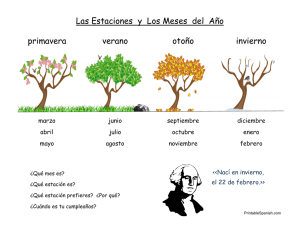
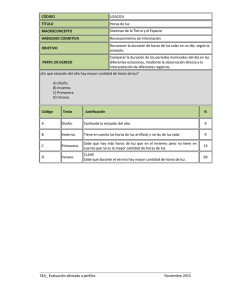
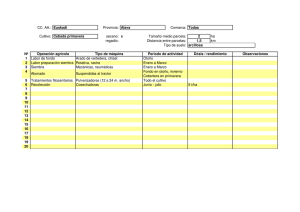
universidad nacional de mar del plata facultad de
Anuncio

UNIVERSIDAD NACIONAL DE MAR DEL PLATA FACULTAD DE CIENCIAS EXACTAS Y NATURALES CARACTERÍSTICAS FÍSICO-QUÍMICAS DE LOS SEDIMENTOS DEL GOLFO SAN JORGE Y SU RELACIÓN CON LOS ORGANISMOS BENTÓNICOS DEL SECTOR MÓNICA FERNÁNDEZ Director: Dr. José Ignacio Carreto Co-directora: Dra. Ana Marta Roux TESIS PARA OPTAR AL TÍTULO DE DOCTORA EN CIENCIAS BIOLÓGICAS 2006 UNIVERSIDAD NACIONAL DE MAR DEL PLATA FACULTAD DE CIENCIAS EXACTAS Y NATURALES CARACTERÍSTICAS FÍSICO-QUÍMICAS DE LOS SEDIMENTOS DEL GOLFO SAN JORGE Y SU RELACIÓN CON LOS ORGANISMOS BENTÓNICOS DEL SECTOR MÓNICA FERNÁNDEZ Director: Dr. José Ignacio Carreto Co-directora: Dra. Ana Marta Roux TESIS PARA OPTAR AL TÍTULO DE DOCTORA EN CIENCIAS BIOLÓGICAS 2006 1 A mis padres 2 Agradecimientos A mis Directores, a mis compañeros, al Lic. Daniel Bertuche responsable del Proyecto Langostino del Instituto Nacional de Investigación y Desarrollo Pesquero, al Dr. Jorge Caló del Departamento de Sedimentología de la Universidad Nacional del Sur y a su equipo de trabajo, Ángel, Elba y Héctor y muy especialmente a mi compañero de trabajo de campo y amigo Daniel Cucchi Colleoni. Gracias 3 RESUMEN La presente tesis doctoral consiste en un estudio sobre la caracterización físico - química de los sedimentos superficiales y del agua de fondo del Golfo San Jorge durante los períodos: primavera de 1999 – invierno de 2000 (primer período de estudio), otoño de 2001 – verano de 2002 (segundo período de estudio) e invierno de 2003 (tercer período de estudio), en base a muestreos realizados en Campañas de Investigación del Instituto Nacional de Investigación y Desarrollo Pesquero. Se analizaron las variables ambientales: temperatura, salinidad, densidad, contenido de oxígeno y de clorofila a del agua de fondo y fracciones granulométricas, concentración de materia orgánica total, carbono orgánico total, nitrógeno total, fósforo total, clorofila a y feopigmentos en sedimentos. El origen y el valor nutricional de la materia orgánica sedimentada también fue contemplado. Asimismo, se vinculan las variables estudiadas con los patrones de distribución y abundancia del macrobentos de mayor representación en las comunidades bentónicas del golfo y con el del langostino, éste último en el área sur del golfo donde se concentra el stock que sustenta a la pesquería. Se aplicaron tests paramétricos, no paramétricos y análisis multivariante (Análisis de Componentes Principales, Análisis de Correspondencia y Análisis de Correlación Canónica) para el tratamiento numérico de los datos. El estudio tuvo como objetivos principales: caracterizar desde el punto de vista físico-químico el contexto bentónico del Golfo San Jorge, establecer las posibles relaciones entre las características físico-químicas del ambiente bentónico y la distribución y abundancia del macrobentos y definir las vinculaciones existentes entre las características del ambiente bentónico citadas y los patrones de distribución del langostino. La distribución espacial de las variables definió tres sectores en el Golfo San Jorge correspondientes a un Ambiente Deposicional, un Ambiente de Flujo o Erosivo y un Ambiente Transicional. Diferentes asociaciones bentónicas se vinculan con los ambientes definidos. La distribución del langostino responde a un gradiente de los valores de abundancia en sentido oeste – este de acuerdo al aumento de tallas. Se encontró una relación entre la disposición espacial de los adultos de langostino con las variables profundidad y concentración de carbono orgánico total. 4 TABLA DE CONTENIDOS Pág. 1.- INTRODUCCIÓN 7 1.1.- ANTECEDENTES 12 1.2.- CARACTERÍSTICAS DEL ÁREA DE ESTUDIO 13 2.- MATERIALES Y MÉTODOS 19 2.1.- ESTRATEGIAS DE MUESTREO 20 2.2.- TÉCNICAS DE TRABAJO EN EL MAR 24 2.3.- METODOLOGÍA DE TRABAJO EN EL LABORATORIO 28 2.4.- TRATAMIENTO NUMÉRICO DE LOS DATOS 36 3.- RESULTADOS 48 3.1.- GOLFO SAN JORGE EN SU TOTALIDAD. PRIMAVERA DE 1999 – INVIERNO DE 2000. (Primer período de estudio) 49 3.1.1.- CARACTERIZACIÓN DE LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO 49 3.1.1.1.- Variables hidrográficas del agua de fondo 49 3.1.1.2.- Variables sedimentológicas 52 A.-Caracterización física de los sedimentos 52 B.- Caracterización química de los sedimentos 53 3.1.1.3.- Clasificación y ordenación de las variables ambientales 55 3.1.2. – CARACTERIZACIÓN BIOLÓGICA DEL SISTEMA BENTÓNICO 58 3.1.2.1.- Análisis faunístico 58 3.1.2.2.- Caracterización biocenótica. Variabilidad espacial 65 3.1.2.3.- Clasificación y ordenación de las especies 66 3.2.- PRINCIPALES ÁREAS DE CONCENTRACIÓN DEL RECURSO LANGOSTINO EN EL GOLFO SAN JORGE. OTOÑO DE 2001 – VERANO DE 2002. (Segundo período de estudio) 69 3.2.1.- CARACTERIZACIÓN DE LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO 69 3.2.1.1.- Variables hidrográficas del agua de fondo 69 5 3.2.1.2.- Variables sedimentológicas 71 Caracterización química de los sedimentos 3.2.1.3.- Clasificación y ordenación de las variables ambientales 72 74 3.3.- SUR DEL GOLFO SAN JORGE . AREA DONDE SE LOCALIZAN LAS MAYORES CONCENTRACIONES DE LANGOSTINO. INVIERNO DE 2003. (Tercer período de estudio) 76 3.3.1.- CARACTERIZACIÓN DE LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO 76 3.3.1.1.- Variables hidrográficas del agua de fondo 76 3.3.1.2.- Variables sedimentológicas 78 A.-Caracterización física los sedimentos 78 B.- Caracterización química de los sedimentos 79 3.3.1.3.- Clasificación y ordenación de las variables ambientales 3.3.2.- CARACTERIZACIÓN DE LAS CONCENTRACIONES 81 DE LANGOSTINO 82 3.3.2.1.- Análisis de las concentraciones de langostino 83 3.3.2.2.- Clasificación y ordenación de las variables biológicas 85 3.3.3.- RELACIÓN ENTRE LAS VARIABLES AMBIENTALES Y LAS VARIABLES BIOLÓGICAS. Análisis de correlación canónica 88 3.4.- ANÁLISIS COMPARATIVO DE LAS VARIALBLES AMBIENTALES DEL SISTEMA BENTÓNICO DEL ÁREA SUR DEL GOLFO SAN JORGE, ENTRE EL PRIMER Y SEGUNDO PERÍODO DE ESTUDIO 4.- DISCUSIÓN 89 90 5. CONCLUSIONES 124 6.- REFERENCIAS BIBLIOGRAFICAS 128 7.- APÉNDICE 148 Tablas 149 Figuras 189 Láminas 303 6 INTRODUCCIÓN Golfo San Jorge, Patagonia Argentina 7 1.- INTRODUCCIÓN El Golfo San Jorge constituye, como parte integrante de la plataforma continental argentina, un sector de gran importancia económica por ser área de cría y desove de diversas especies de peces y crustáceos, siendo además caladero de especies de gran interés comercial entre las que se destacan el langostino Pleoticus muelleri (Bertuche et al., 1999, 2000) y la merluza común Merluccius hubbsi (Aubone et al., 2000). En el marco del Proyecto Langostino del Instituto Nacional de Investigación y Desarrollo Pesquero dada la vinculación existente entre el sistema bentónico y el recurso langostino en las diferentes etapas de su ciclo de vida ya sea por alimentación y/o refugio, se iniciaron a partir del año 1992 (Fernández & Bertuche, 1995) como parte de la actividad "Monitoreo del contexto ambiental de la pesquería de langostino del litoral patagónico", diferentes estudios orientados al conocimiento de los factores físico-químicos del agua, de los sedimentos superficiales así como de las comunidades bentónicas en los fondos de distribución del langostino (Roux et al., 1995; Roux & Fernández, 1997). La columna de agua y el sustrato que tapiza el fondo marino son dos medios que parecen oponerse irremediablemente debido a la movilidad del primero y el estatismo del segundo. La consideración del movimiento continuo de las partículas de agua al ritmo de las corrientes y la fosilización de las partículas sedimentarias a la escala de las eras geológicas, no inducen a la evaluación de las interacciones que pueden existir entre los dos sistemas. Sin embargo, aunque la extensión de la superficie de conexión entre ambos medios es ínfima en relación a los volúmenes totales de los mismos, es en estas superficies donde tienen lugar los intercambios esenciales para el equilibrio de los ecosistemas marinos (Hily, 1984). La interfase agua-sedimento es la zona donde los dos medios se unen. La masa de agua es la zona explotada por la epifauna bentónica y el sedimento es la capa embebida de un agua intersticial movilizable por los movimientos naturales de las masas de agua adyacentes. La movilidad de los organismos de la fauna bentónica detritívoros y sedimentívoros en la columna sedimentaria contribuirá a aumentar las dimensiones de la interfase, facilitando el tránsito del agua intersticial y favoreciendo su descenso en profundidad provocando una mejor oxigenación del medio y la liberación de los productos de degradación de la materia orgánica. Asimismo, todos los organismos tubícolas favorecen químicamente los intercambios aguasedimento en profundidad. La bioturbación aumenta el flujo de nitrógeno y fósforo inorgánicos hacia las masas de agua, también acelera la desnitrificación al introducir nitrato y oxígeno en las 8 zonas anaerobias del sedimento, lo cual acelera la degradación de los residuos orgánicos por las bacterias. Los compuestos orgánicos liberados son una fuente de carbono para la desnitrificación. La bioturbación ejerce también un efecto modificador de las características físicas del sedimento (Aller, 1982; Taghon et al., 1978). La trama que crean multitud de tubos de anélidos poliquetos sobrepasando la superficie del sedimento, actúa como un peine donde quedan atrapadas las partículas en tránsito por el agua sobrenadante. Esto contribuye a una modificación de la granulometría del sedimento al aumentar el porcentaje de partículas finas. También tienen un papel en la mecánica del sustrato, los tubos enterrados en gran densidad a varios centímetros de profundidad, que actúan poniendo freno a la erosión, teniendo así el papel de estabilizadores del sedimento. En relación a la importancia del sustrato en sí, es un hecho ampliamente aceptado que el sustrato constituye uno de los reguladores fundamentales de la distribución de los organismos bentónicos, habiéndose establecido fuertes correlaciones entre el tipo de sustrato y las asociaciones biológicas que en él se desarrollan (Sanders, 1958; Buchanan et al., 1978; Eleftheriou y Basford, 1989; Etter & Grassle, 1992; Seiderer & Newell, 1999). Asimismo, en diversas pesquerías de peneidos se ha identificado una correlación significativa entre los índices de abundancia de las especies con dos características de los sedimentos: 1) el tamaño de las partículas, de importancia desde el punto de vista de protección y refugio y 2) el contenido de carbono orgánico, considerado una medida indirecta de la disponibilidad de alimento. Esta correlación ha sido estudiada para las pesquerías de peneidos del Golfo de México (Williams, 1958; Grady, 1971), de la Bahía de Mobile, Alabama, USA (Loesch, 1965), de la costa Sudanesa del Mar Rojo (Branford, 1981) y del Golfo de Carpentaria, Australia (Jones, 1987; Somers, 1987), entre otras. Con respecto a los estudios de la macrofauna de invertebrados del sistema bentónico marinos, los mismos son de gran importancia ya que permiten apreciar las diferencias espaciotemporales a las que se encuentra sometido ese medio así como el impacto de las perturbaciones naturales o provocadas por el hombre, sobre los organismos marinos (Moreira Da Rocha, 2003). Para la comprensión de los mecanismos adaptativos de las especies, grupos de especies, poblaciones y comunidades a las condiciones del medio, se hace necesario integrar en un mismo estudio la dimensión espacial y temporal. Sólo así es posible establecer las diferencias y evaluar la variabilidad de la fauna bentónica; esta variabilidad viene determinada por la heterogeneidad espacial, las fluctuaciones estacionales y la evolución de la misma a corto y medio plazo, principalmente. 9 Las modificaciones a que se encuentran sujetos los ecosistemas bentónicos después de una perturbación natural o artificial sólo pueden ser evaluadas cuando la importancia de la variabilidad natural ha sido previamente estimada, constituyendo la resultante de los parámetros bióticos y abióticos del sistema. La adaptación de las poblaciones al medio tienden hacia una gestión óptima de los recursos disponibles. De este modo, la variabilidad natural del medio en el tiempo y en el espacio conlleva fluctuaciones de las poblaciones para optimizar esta gestión. Los factores ambientales sufren variaciones climáticas o variaciones debidas a la heterogeneidad espacial, actuando sobre los organismos vivos, los cuales dejan sentir estas variaciones en el esfuerzo de reproducción, crecimiento, competición espacial y depredación. A la variabilidad natural de los organismos bentónicos se suman las modificaciones del medio ligadas a las perturbaciones del ambiente. Por un lado, las perturbaciones mecánicas, como son las modificaciones de los parámetros físicos del sustrato, los cuales destruyen el equilibrio entre las poblaciones y el medio, y que pueden ser de origen natural: tormentas, aumento o pérdida estacional de nutrientes, resuspensión de sedimentos, o de origen antropogénico: dragados, trabajos de ordenación costera de playas y puertos, etc. Por otro lado, las perturbaciones químicas, que pueden ser de origen natural, como falta de oxígeno en sedimentos, pero que la mayor parte de las veces se trata de perturbaciones artificiales provocadas por el aporte de sustancias al medio, sustancias que o bien no existen en ese medio en condiciones normales, o bien se encuentran presentes en dosis mucho más pequeñas: efluentes industriales y urbanos, metales pesados, minerales, hidrocarburos, productos detergentes, etc. Estos contaminantes actúan sobre los organismos vivos directamente provocando toxicidad o indirectamente enriqueciendo el medio artificialmente en materia degradable. Este segundo fenómeno recibe el nombre de hipertrofización, del cual se distinguen dos tipos según Hily (1984): procesos de eutroficación, cuando la degradación de la materia orgánica se efectúa en condiciones anaerobias y procesos de fertilización cuando la oxigenación es suficiente y el aporte orgánico es benéfico para el ecosistema. La hipertrofización de un medio es el resultado de un proceso continuo, mientras que las perturbaciones mecánicas se encuentran limitadas en el tiempo. En ambos casos, las modificaciones de las propiedades físico-químicas del sustrato provocan cambios estructurales entre comunidades o dentro de una comunidad, que se traducirán en variaciones cuantitativas en el seno de la macrofauna. La presente tesis doctoral consiste en un estudio sobre la caracterización físico - química de los sedimentos superficiales y del agua de fondo del Golfo San Jorge durante los períodos: 10 primavera de 1999 – invierno de 2000, otoño de 2001 – verano de 2002 así como durante el invierno de 2003. Asimismo, se vinculan las variables estudiadas con los patrones de distribución y abundancia del macrobentos de mayor representación en las comunidades bentónicas del golfo y con el del langostino, éste último en el área sur del golfo donde se concentra el stock que sustenta a la pesquería. Este estudio tuvo como objetivos principales: • Caracterizar desde el punto de vista físico-químico el contexto bentónico del Golfo San Jorge mediante un análisis espacio-temporal de los factores físico – químicos del agua de fondo y de los sedimentos. • Establecer las posibles relaciones entre las características físico-químicas del ambiente bentónico y la distribución y abundancia del macrobentos de mayor representación en las comunidades bentónicas del golfo, caracterizando la heterogeneidad espacial de la fauna. • Definir las vinculaciones existentes entre las características físico-químicas del ambiente bentónico y los patrones de distribución del langostino en el área sur del Golfo San Jorge donde se concentra el stock que sustenta a la pesquería del litoral patagónico, a los efectos de contribuir en la definición de acciones relacionadas con el manejo y las estrategias de conservación del recurso. 11 1.1.- ANTECEDENTES Los estudios sedimentológicos de los fondos marinos del Atlántico Sudoccidental como así también los de índole faunística, se iniciaron en nuestro país en la década del 60. Si bien estas líneas de investigación se iniciaron simultáneamente su desarrollo no resultó convergente, siendo mucho menor el desarrollo de los aspectos sedimentológicos. Bastida et al. (1981) realizaron un amplio relevamiento de los sedimentos marinos, cómo así también de las comunidades bentónicas de la plataforma continental argentina (Bastida et al., 1992, en prensa). En este estudio no se incluyó el Golfo San Jorge, excepto por unas pocas estaciones ubicadas en el extremo sur (Cabo Tres Puntas) y en la boca del mismo. Los estudios granulométricos de los sedimentos superficiales del Golfo San Jorge, realizados hasta el momento, comprendieron la caracterización del sustrato en función de la fracción granulométrica predominante (Roux et al., 1995). A través de este estudio se definieron dos áreas con características propias. Una de ellas comprende el extremo norte y sur del golfo (Cabo Dos Bahías y Tres Puntas, respectivamente) y presenta granulometría gruesa con predominio de grava y arena así como, fracción carbonática biogénica representada fundamentalmente por restos de valvas de pelecípodos y cirripedios. La otra área comprende los sectores norte, sur y boca del golfo, y está caracterizada por un marcado predominio de la fracción fango-arenosa, con componentes carbonáticos nulos. De acuerdo a los estudios de Bastida et al. (1992) sobre las comunidades bentónicas, las pertenecientes al golfo estarían constituídas por especies de estirpe magallánica. Roux et al. (1995) y Roux y Fernández (1997), desarrollaron estudios sobre la distribución espacial y la abundancia relativa de las especies integrantes de las comunidades bentónicas en los fondos de pesca de langostino patagónico en el Golfo San Jorge y en el resto del litoral de Chubut, señalando dos áreas con grupos faunísticos característicos. Relevamientos posteriores de las comunidades bentónicas realizados desde el año 1998 en los fondos del Golfo San Jorge por Roux (2000 a y b, 2003, 2005), Roux y Bertuche (1998), Roux y Piñero (1999, 2001, 2003, 2004, 2005 a, b, c, d, en prensa) Roux et al. (1999, 2002, 2003, 2004, en prensa) constituyen un registro de la evolución de estas comunidades enmarcándose los estudios en un contexto ambiental amplio que permite brindar herramientas para el correcto manejo de la pesquería del langostino del Golfo San Jorge. 12 1.2.- CARACTERIZACIÓN DEL AREA DE ESTUDIO Aspecto topográfico y geológico El Golfo San Jorge (Figura 1 A y B) es una cuenca semiabierta del Mar Argentino ubicada aproximadamente entre las latitudes 45º y 47º S (desde el Cabo Dos Bahías hasta el Cabo Tres Puntas) y el meridiano 65º 30’ W y la costa, que ocupa una superficie de 39.340 km2. El golfo presenta en su sector norte un umbral de 250 km con profundidades comprendidas entre 80 y 95 m, el cual se eleva progresivamente en dirección NE – SW, alcanzando hacia el extremo sur de la costa valores comprendidos entre 50 y 30 m. Este importante accidente topográfico (denominado pared o murallón) restringe al sector norte del umbral, el intercambio de las aguas de fondo del golfo con la plataforma adyacente. Las mayores profundidades del golfo (< 110 m) se registran en la región central donde la isobata de 90 m presenta un contorno elíptico con su eje mayor en dirección NE - SW. Con excepción del área sur del Fondo Mazarredo, la costa del golfo es abrupta y declina rápidamente a profundidades comprendidas entre 50 y 75 m (Akselman, 1996). Desde un punto de vista geológico y de acuerdo a la división en tres grandes zonas (Buenos Aires, Patagonia y Tierra del Fuego), relacionadas con las principales unidades morfoestructurales de este sector de América del Sur (planicie pampeana, meseta patagónica y cordillera fueguina), el sector estudiado corresponde a una cuenca cretácica, siendo su evolución vinculada con los movimientos relativos entre las placas Sudamericana, Africana, Antártica y de Nazca. El relleno es fundamentalmente continental aunque se conocen esporádicas transgresiones marinas (Sanagua et al., 2002). La costa es de acantilados de variada altitud conformados en sedimentitas marinas del Terciario superior (Formación Patagonia) y playas fósiles cuaternarias (Isla et al., 2002). Aspecto climático Según Isla et al. (2002), el Golfo San Jorge posee un clima árido a semiárido con precipitaciones anuales de escasos 244 mm (estadísticas entre 1941 y 1990), que se habrían duplicado entre 1941 y 1980 y disminuido en la década 1981 – 1990. Otoño e invierno son las estaciones más lluviosas. La temperatura media anual es de 12,7 ºC. Los vientos promedio superan los 20 km/h siendo más fuertes durante el fin de la primavera y principios del verano (noviembre a enero). Los vientos predominantes son del oeste (43 %) con velocidades medias de 41 km/h, y ráfagas que superan fácilmente los 100 km/h. Durante el lapso 1958 – 1994 estas velocidades superaron los 200 km/h (del O y ONO) siendo más importantes estas ráfagas durante la primavera. Entre 1981 y 1990 estos efectos máximos promedio se redujeron significativamente 13 por debajo de 150 km/h, demostrando los efectos del desarrollo urbano-canópeo en la estación Comodoro Rivadavia. De los vientos predominantes de cuadrantes dominados por el mar se destacan los del NE (5,6%) que soplan con una velocidad promedio de 22 km/h. Un análisis de las principales variables metereológicas registradas en el área costera de Comodoro Rivadavia (“CR” 45º 47’S – 67º 30’W) sobre la base de la estadística del período 1993 – 2003, según datos brindados por el Servicio Metereológico Nacional, indica que: 1) El promedio anual de la velocidad del viento fue de 22 km/h , con un rango total de 19 – 26 km/h para los promedios mensuales. 2) El promedio del período 1993 – 2003 para las precipitaciones anuales fue de 227 mm. 3) Con respecto a los valores medio de temperatura mensual, los máximos y mínimos se observaron entre noviembre y febrero (15,8 ºC – 19,2 ºC) y entre junio y agosto (6,5 ºC – 8,2 ºC), respectivamente. Los análisis realizados por Akselman (1996) para la década 1971 – 1980, también indican los máximos y mínimos promedio de temperatura entre diciembre y febrero (22,8 ºC y 25,4 ºC) y entre junio y agosto (1,9 ºC y 3,6 ºC), respectivamente. Aspecto hidrográfico Las aguas del golfo pertenecen a la denominada Agua de Plataforma (33,2 < S > 33,8 ups) modificada por los aportes de Aguas Costeras (S < 33,2 ups), cuya salinidad resulta espacial y temporalmente variable entre 33,0 y 33,6 ups. Las Aguas Costeras consisten un una mezcla de agua subantártica procedente de la Corriente del Cabo de Hornos con agua que entra al Atlántico por el Estrecho de Magallanes diluidas por aportes continentales (Brandhorst & Castello, 1971). Las Aguas Costeras fluyen desde el Estrecho de Magallanes pegadas a la costa de la Provincia de Santa Cruz, bifurcándose su flujo a la altura del Cabo Tres Puntas en dos ramas principales. Una de las ramas ingresa al golfo por su extremo sudeste y ejerce una notable influencia en esa región durante todo el año. La otra rama se aleja de la costa en dirección N-NE, afectando en toda su extensión a la región del umbral del golfo (Bianchi et al. ,1982). Las Aguas de Plataforma son el resultado de la mezcla del Agua Costera con la de la corriente del Cabo de Hornos y con el Agua de Malvinas (Bianchi et al., 1982). La renovación del agua de fondo del golfo, debido al limitado intercambio con las aguas de plataforma, parece estar fundamentalmente regulada por la interacción mar – atmósfera (Baldoni, 1990), a diferencia de los golfos norpatagónicos San Matías y Nuevo, en los que serían igualmente importantes tanto el forzamiento atmosférico como el intercambio con el mar abierto 14 (Akselman, 1996). Baldoni (op. cit.) identifica en la zona profunda del SW del golfo un giro de circulación horaria con un eje NE-SW impuesto por la batimetría. En los extremos del golfo de menor profundidad, la mezcla vertical accionada por los vientos (Baldoni, 1990) y las mareas (Glorioso, 1985; Piola & Rivas, 1997) generan frentes de marea de desarrollo estacional y permanencia durante la primavera y fines del otoño (Carreto et al., 1985, 1986; Glorioso, 1987; Glorioso & Flather, 1997; Guerrero & Piola, 1997). Además, las Aguas Costeras que ingresan al Golfo San Jorge provenientes del Estrecho de Magallanes generan en su extremo sur un intenso frente termohalino de permanencia estacional y de posición variable desarrollándose en el sector sur en invierno, primavera y verano y desplazado hacia el norte en otoño (Guerrero & Piola, op. cit.; Akselman, 1996). Según Akselman (op. cit.) las áreas frontales de la plataforma al igual que las del talud continental, son conocidas por su elevada producción primaria y secundaria y por ser asiento de importantes caladeros de pesca. Cabe indicar con respecto a las mareas, que en la plataforma patagónica la amplitud de las mismas es de las más altas del mundo, generando fuertes corrientes que se constituyen en la componente más energéticas del flujo (Piola & Rivas,1997). En el Golfo San Jorge, según Isla et al. (2002) las mareas semidiurnas son macromareales con rangos de sicigias medias de 4,94 m y de cuadratura de 3,30 m. En relación a la concentración de nutrientes inorgánicos (nitratos, fosfatos y silicatos) en el agua del Golfo San Jorge, según estudios de los años 1984 y 1985 realizados por Akselman (1996), la evolución estacional de la concentración de nutrientes sigue el conocido ciclo registrado en regiones templadas y observado en golfos norpatagónicos y otras áreas de la plataforma continental argentina. En el invierno las concentraciones son elevadas y distribuidas de manera aproximadamente uniforme entre la superficie y los estratos más profundos, situación indicativa de la elevada mezcla vertical de la columna de agua. A comienzos de la primavera, cuando la columna de agua empieza a estabilizarse y se activa el proceso de productividad por parte del fitoplancton, se detecta una gradual diferencia en las concentraciones entre la superficie y el fondo, evento que al progresar la estación culmina en la formación de dos capas diferenciadas en las que la superior (comprendida entre la superficie y los 30 m) presenta una notable reducción general en el tenor de nutrientes respecto de la capa más profunda. Esta situación se mantiene al menos hasta comienzo del otoño, período a partir del cual las condiciones se revierten hasta las descriptas para el invierno. Según Akselman (1996) el nivel de las concentraciones de nitratos y fosfatos en el Golfo San Jorge coincide en general con los valores estimados durante el ciclo anual en los golfo norpatagónicos, y con los estimados para el Golfo San Jorge y el área norte adyacente en la serie de campañas “Pesquerías”. 15 Aspecto biológico El desarrollo fitoplanctónico en el Golfo San Jorge según los estudios realizados por Akselman (1996) presenta una secuencia estacional típica de regiones templadas. Los grupos taxonómicos preponderantes corresponden a las diatomeas y los dinoflagelados. En invierno las poblaciones son reducidas; el grupo de diatomeas presenta una neta preponderancia sobre el de los dinoflagelados, constituyendo Paralia sulcata, Thalassionema nitzschioides, Pleurosigma normanii, Navicula sp. y representantes de los géneros Thalassiosira y Coscinodiscus, las especies de mayor importancia tanto por su densidad poblacional como por la amplitud de su distribución en el golfo. Durante el florecimiento primaveral se observan los valores más elevados del ciclo asociados a la diatomea Thalassiosira auguste-lineata, y a los dinoflagelados Alexandrium tamarense, Heterocapsa triquetra y Prorocentrum micans. En verano decrece abruptamente la concentración de fitoplancton, predominando los dinoflagelados, siendo las especies de mayor relevancia Alexandrium tamarense, Prorocentrum micans, Ceratium lineatum y Heterocapsa triquetra. Durante el otoño se produce un incremento de los niveles de fitoplancton, presentando las diatomeas los niveles poblacionales más elevados. Akselman (1996) en sus estudios del fitoplancton coincide con estudios faunísticos efectuados sobre copépodos, así como con los análisis estacionales de otros grupos zooplanctónicos como los quetognatos y los pterópodos eutecosomados, que señalan que la totalidad del Golfo San Jorge se halla comprendida en una región “costera templada” o “nerítica interna” que puede ser considerada como un sistema claramente diferenciado de su entorno y que abarca –dentro del mar epicontinental argentino- la plataforma continental desde el norte de la provincia de Buenos Aires hasta el sur del golfo, siguiendo en el sector patagónico la isobata de los 100 m aproximadamente. Esta área concuerda asimismo con el “ecosistema de la plataforma intermedia bonaerenese y norte patagónico” propuesto por Carreto (1983) considerando la capacidad de producción de materia orgánica, la concentración de nutrientes y la estabilidad de las masas de agua, y con la delimitación regional del conjunto pesquero denominado como de “plataforma interna bonaerense y norte-patagónica” por Angeluscu y Prenski (1987). En relación a los estudios de zooplancton del Golfo San Jorge, los mismos han tratado el área en forma específica o como parte de investigaciones regionales de mayor amplitud, y han comprendido análisis de distribución, abundancia y/o variación estacional de diversos grupos faunísticos. Estos estudios han señalado que existe una clara tendencia al incremento de la abundancia y de la biomasa a partir de los meses invernales hasta el verano en el marco de un ciclo típico de aguas templado-frías (Akselman, 1996). Los copépodos como componente 16 importante de la comunidad zooplanctónica en el golfo (Akselman, op. cit.) exhiben una estructura de tamaño poblacional dominada por pequeñas especies del suborden Calanoida (Fernández Aráoz, 1994). Estudios sobre la abundancia numérica y la biomasa de zooplancton en el golfo realizados por Pérez Seijas et al. (1987) y Viñas et al. (1992) señalan que durante la primavera y el verano se observan los máximos valores numéricos de copépodos en la columna de agua, así como de eufáusidos, misidáceos y larvas de estomatópodos. Esto concuerda con los análisis de contenidos estomacales de peces en la región costera patagónica realizados por Angelescu y Prenski (1987) que indican que la mayor concentración de alimento zooplanctónico se verifica durante la primavera y el verano. Con respecto al ictioplancton, el golfo se conoce, asimismo, como el sector integrante del área de desove de Merluccius hubbsi (Aubone et al., 2000), de Engraulis anchoita (Hansen, 2000) y de más de 30 especies de peces entre los que se pueden mencionar Genyptherus blacodes, Salilota austalis, Pinguipes semifasciatus, Percophis brasilianus, Xystreuris rasile, Paralichtys isósceles, Acanthistius brasileanus, Squalus acanthias, Mustelus schmitii y Callorhynchus calorhynchus, entre otros (Roux, et al., en prensa) Con respecto a las comunidades bentónicas se puede decir que presentan una epifauna caracterizada fundamentalmente por crustáceos y equinodermos y una infauna en la que encontramos moluscos, poliquetos, y una gran variedad de grupos taxonómicos. Se definen asociaciones faunísticas claras en los distintos sectores del Golfo, dominadas por especies como Munida subrugosa en la zona costera, Nuculana sulculata y Trypilaster philippi en la zona sur, Eugyrioides polyducta en la boca del golfo, Renilla sp. en el sector norte y Pseudechinus magellanicus, en el centro del golfo (Roux, 2000 a y b, 2003, 2005), (Roux & Piñero, 1999, 2001, 2003, 2004, 2005 a, b, c, d, en prensa) y (Roux et al., 1995, 1999, 2002, 2003, 2004, en prensa) (Láminas II a IV). Recursos pesqueros Desde un punto de vista pesquero, el Golfo San Jorge alberga importantes pesquerías entre las que se destaca sobremanera la del langostino Pleoticus muelleri (Bate, 1888) (Bertuche et al. 1999, 2000) seguida por la de la merluza común Merluccius hubbsi (Aubone et al., 2000). La pesquería del langostino es una de las más importantes y rentables de la ZEE de Argentina ya que representa un importante porcentaje del valor total de sus exportaciones pesqueras. Esta pesquería que tiene su inicio a principios de la década del 80 con un desembarco de 2.616 toneladas, alcanza en el año 2000 las 36.822,5 toneladas alcanzando las exportaciones 17 de ese año cifras cercanas a los U$S 250.000.000. En el año 2001 el desembarco declarado alcanzó un record histórico de 78.797,97 toneladas (SAGPyA, 2001). Otras actividades antropogénicas En el Golfo San Jorge, cabe destacarse, la importancia del desarrollo de la explotación petrolera, la cual constituye el principal recurso económico en la Patagonia Central. La zona litoral del golfo esta sujeta a potencial contaminación por hidrocarburos relacionada principalmente con la explotación y transporte de petróleo crudo. La presencia de puertos en los cuales se realiza la carga de crudo, abastecimiento de combustible y otras operaciones inherentes a la actividad, constituyen fuentes probables de derrames puntuales o aportes crónicos al ambiente marino y costero. Estudios realizados por Esteves et al. (1993) y Commendatore et al., (2000) demostraron la presencia de contaminación por hidrocarburos derivados del petróleo en sedimentos del intermareal en algunas zonas del golfo como Faro Aristizabal, Caleta Olivia, Caleta Córdova, Comodoro Rivadavia y Rada Tilly. Estudios posteriores realizados por Commendatore y Esteves (2004) en sedimentos infralitorales del golfo indican concentraciones de hidrocarburos inferiores a los hallados en sedimentos de la zona intermareal, caracterizando a los mismos en situación de no contaminación por hidrocarburos. 18 MATERIALES Y MÉTODOS 19 2.-MATERIALES Y MÉTODOS 2.1.- ESTRATEGIAS DE MUESTREO 2.1.1- Elección de los sistemas de muestreo y limitaciones ligadas a la elección La elección de la técnica de muestreo constituye uno de los primeros problemas que encuentra el ecólogo marino al salir al mar, y el rigor del estudio ulterior depende de la utilización de un sistema adecuado de muestreo (McIntyre et al., 1984). Las principales características de los factores bióticos y abióticos del ecosistema de estudio serán estimadas a partir de las muestras recogidas. Así, la inferencia efectuada de la población muestreada a la población estadística conlleva siempre un error, ya que las muestras por lo general no son más que una representación reducida más o menos sesgada de la población real. La Figura 2, adaptada de Legendre y Legendre (1979) indica las interrelaciones entre las diferentes fases de investigación en ecología y la importancia de la planificación del muestreo. El problema planteado en un estudio de estas características es el de adaptar el plan de muestreo a los objetivos buscados, debiendo escuadrar bien los límites del estudio. La elección de los parámetros a estudiar y las escalas de observación de las variables depende de los conocimientos generales previos sobre la organización de las comunidades biológicas y de sus relaciones con los factores abióticos, además de la propia intuición del investigador (Legendre & Legendre, 1984). Frontier (1983) distingue tres tipos de limitaciones inherentes a cada plan de muestreo: naturales, técnicas y matemáticas. Las limitaciones naturales se encuentran ligadas a la variabilidad de las escalas a las que se estudian los fenómenos: los parámetros físico-químicos o biológicos pueden describir fluctuaciones que forzosamente no tienen porqué ser observadas sobre una escala espacial y temporal idéntica. Estas contrariedades se ven ligadas al grado de heterogeneidad de las poblaciones y comunidades muestreadas: heterogeneidad espacial correspondiente a la dispersión por “agregados”, heterogeneidad temporal correspondiente a la variabilidad de los parámetros estructurales y finalmente la heterogeneidad estructural que concierne a la diversidad morfológica y etológica de las especies presentes. Las limitaciones técnicas se refieren al dominio y período de estudio, además de las técnicas de muestreo y de separación de las muestras. Las técnicas de muestreo dependen de la accesibilidad de la zona estudiada; cuanto más profunda y expuesta, más específicos y sofisticados habrán de ser los medios de muestreo utilizados en el mar. Los problemas técnicos se aplican también a la disponibilidad de material, ya se trate de medios en el mar o de 20 muestreadores adecuados efectivos; e igualmente al costo global de las operaciones de muestreo y posterior trabajo en el laboratorio: problemas temporales de análisis, costo financiero de las campañas en mar y análisis de muestras y datos. Finalmente, también se aplican al potencial informático: disponibilidad y accesibilidad a computadoras y programas informáticos. Las limitaciones matemáticas están muy relacionadas con la naturaleza de los datos obtenidos. Para poder estimar con precisión los parámetros estructurales de una población o el empleo de métodos de ordenación de las muestras, es necesario un conjunto de datos lo más homogéneo y completo posible, con el fin de poder definir a partir de los muestreos realizados una imagen estática o dinámica de la situación real de la población, lo menos errónea posible. El diseño de muestreo para este trabajo se realizó en función de las limitaciones técnicas tales como extensión del área de estudio, tiempo de campaña y costo de las mismas, considerando los antecedentes en el conocimiento del área de estudio en relación a los factores físicos-químicos y biológicos del sistema bentónico del Golfo San Jorge. 2.1.2.- Muestreadores Muesteadores de sedimentos El análisis de sedimentos es un manera de cuantificar el resultado de un proceso esencialmente dinámico a partir de una muestra tomada en un instante en el tiempo. La naturaleza de un sedimento esta determinada por la compleja interacción de un gran número de factores, que se clasifican en tres categorías: los que determinan el origen y la fuente del material sedimentario; los que determinan el transporte del mismo; los que determinan su depositación y los cambios que ocurren después de la deposición y que son de origen principalmente biogénico, como por ejemplo la biodeposición y la bioturbación. Si la interacción entre estos factores permanece estable por un período de tiempo, se puede esperar que el ambiente sedimentario y por lo tanto la naturaleza del sedimento permanecerá substancialmente inalterado. Si por el contrario, se producen cambios en períodos cortos o largos en algunos de los citados factores, habrá una correspondiente alteración de los sedimentos (Buchanan, 1984). De todo ello se deduce que las factores edáficos son de una importancia capital en cualquier estudio bentónico; de ellos el tamaño de grano del sedimento es considerado como el principal responsable de la distribución de las especies (Chardy & Glémarec, 1974), si bien otros autores como Cognetti (1982) creen que en medios imprevisibles estos factores pierden su importancia. 21 La cantidad de muestra requerida y el medio de obtener ésta, dependerá de la naturaleza del análisis contemplado. En algunos casos puede ser suficiente retener una pequeña cantidad de sedimento desde una muestra tomada al azar, de la parte de los sedimentos menos perturbada y antes de la separación de los organismos. Las submuestras pueden ser obtenidas mediante extracción manual usando secciones cortas (10 – 15 cm) de tubos como los descriptos en el párrafo siguiente, o con la ayuda de una cuchara (150 ml de material). Este muestreo tiene como ventaja la seguridad de que ambos, organismos y sedimentos, provienen del mismo sitio; y como desventaja, que los sedimentos se perturban, la natural estratificación de los mismos se destruye y que parte del material fino que los constituye se pierde por el movimiento del agua durante el ascenso de la muestra. En los casos que sea necesaria la obtención de muestras de sedimentos no perturbados y con la estratificación natural de los mismos, ya que interesa estudiar la distribución de una propiedad con la profundidad, las muestras deberán ser obtenidas mediante un buceador en aguas costeras o con un extractor mecánico, en zonas profundas. En estos casos las muestras se retienen en el interior de tubos de acrílico transparente o de material plástico. La obtención de muestras de sedimentos de fondo implica el uso de una variedad de extractores: extractores de tubo, extractores a resorte, dragas y rastras. Los extractores de tubo son fundamentalmente tubos de acero que penetran en el fondo del mar por acción de la gravedad. Un típico extractor de tubo está formado por tubos de acero intercambiables, un cuerpo principal formado por pesos de plomo y una cola de aletas cuya función es hacer que el extractor caiga verticalmente al fondo (Guzmán, 1958; Stirn, 1981). Los extractores a resorte constan de un pistón que es colocado sobre la pieza de retención de la muestra (“testigo”). Cuando el tubo del extractor desciende al fondo del mar, la fricción ejercerá un esfuerzo hacia abajo en el “testigo”, el cual será resistido por la presión hidrostática que actúa en el lecho marino. La presión hidrostática no permitirá que se forme un vacío entre el pistón y el extremo superior del “testigo”. A medida que el tubo del extractor penetre en el suelo submarino la fricción creada causará debajo del pistón una disminución de la presión con respecto a la presión hidrostática. La diferencia de presión entre la boca del tubo y la parte alta del “testigo” balanceará la resistencia friccional del “testigo” dando como resultado una representación verdadera de la columna de sedimentos “in situ”. El pistón al quedar detenido cerca de la superficie del fondo mientras el extractor sigue introduciéndose por la fuerza de la gravedad, produce la succión que vence las fuerzas friccionales que actúan entre la muestra de sedimento y la pared interior del tubo extractor (Guzmán, 1958; Stirn, 1981). 22 Las dragas, constan de dos gajos o quijadas las cuales son mantenidas en posición de “abierto” mientras bajan hacia la profundidad, luego sobre el fondo se activan dispositivos que liberan las quijadas, las que al cerrarse con fuerza retienen los sedimentos superficiales. En general, las dragas tienen una mordida o penetración de 10 cm y cubren una superficie entre 0,1 a 0,2 m2, dependiendo del tamaño. Las rastra, constan de una boca y de una red que envuelve y protege a un saco interno, y se arrastran a una velocidad mínima (1,5 nudos) o a la deriva, por un tiempo de no menos de 15 minutos (Stirn, 1981). Muestreadores de agua Las muestras de agua de mar de distintas profundidades se obtienen por medio de botellas especiales. Las diferentes instituciones oceanográficas de todo el mundo han perfeccionado y utilizado más de 50 clases distintas de botellas. En la actualidad, sin embargo los tipos de botellas de uso general han sido reducidos a unos pocos diseños simples pero resistentes. El Servicio de Hidrografía de la República Argentina usa botellas Nansen modificadas y botellas Niskin. La botella es un recipiente metálico o plástico de 1,25 l. de capacidad. Está provista de una válvula cónica de tapón en cada extremo y es descendida por medio del cable oceanográfico con ambas válvulas en la posición de abiertas, de modo que permite libre circulación de agua a través de ella durante el descenso. Cuando la botella ha llegado a la profundidad establecida, un mensajero de bronce es lanzado desde el buque. Este mensajero que se desliza a través del cable oceanográfico, sirve para desconectar del cable la parte superior de la botella. La botella, entonces, se invierte, iniciando un arco de 180º con el cable. Con esta inversión se produce el cierre de las dos válvulas , obteniéndose así, la muestra de agua de la profundidad deseada. Cada botella de inversión está provista de un marco para instalar dos termómetros de inversión de gran profundidad. Transcurrido el tiempo necesario para que la botella se haya invertido, se comienza el izado de la misma. Una vez situada a la altura de la plataforma del buque, se saca el mensajero que se encuentra en la parte superior y se retira del cable oceanográfico para ser llevada a su soporte cuidando de que el transporte se efectúe manteniéndola vertical. Luego se envasan las muestras de agua en sus correspondientes frascos de vidrio. Las muestras se utilizan para efectuar análisis de componentes tales como salinidad, contenido de oxígeno disuelto y nutrientes (Guzmán, 1958). 23 Muestreador para el recurso langostino La toma de muestras de langostino, se realiza de la captura de los lances de pesca. Los lances se efectuan con una red de arrastre de fondo tipo “tangonera”. La citada red está formada por un cuerpo esencialmente redondo hecho de malla sintética (largo de red = 35,0 m, largo de relinga superior = 30,0 m, largo de relinga inferior = 28,2 m, abertura vertical = 1,5 m) con una luz de red de 45 a 50 mm al igual que las alas, al final del cuerpo se encuentra el copo, el cual está delimitado al frente por la horca de virada. El copo está confeccionado por lo regular de mallas más resistentes que el cuerpo con la misma luz de malla. El arte completo incluye dos portones, por lo regular de madera con bordes de hierro, aproximadamente de 300 a 500 kilos de peso cada uno, los cuales están unidos por cuerdas a las alas de la red. Cada lance de pesca dura, como norma, 30’ y el arrastre se realiza a una velocidad promedio de 3,5 nudos (Roux, et al., en prensa) En el presente trabajo, se han muestreado los fondos del Golfo San Jorge para el análisis sedimentológico con dos tipos de muestreadores: la rastra tipo Picard para fondos duros y el extractor de gravedad Phleger para fondos blandos. A la vez, se realizó con botellas tipo Niskin, el muestreo de la columna de agua para la obtención de las muestras de agua de fondo como complemento del estudio sedimentológico. El muestreo biológico en relación al recurso langostino se realizó con red tangonera convencional con camisa interna de Pezzale (mallero con luz de malla de 20 mm ) en el copo. 2.2.- TÉCNICAS DE TRABAJO EN EL MAR En el diagrama de la Figura 3 se detalla el procedimiento de muestreo en el Golfo San Jorge efectuado para la obtención de las muestras utilizadas en el presente trabajo. 2.2.1.- Golfo San Jorge en su totalidad. Primavera de 1999 – invierno de 2000. (Primer período de estudio). Las estaciones Para el relevamiento espacio-temporal del Golfo San Jorge en su totalidad, durante el período primavera de 1999 – invierno de 2000, las muestras fueron obtenidas durante las campañas de investigación del BIP “Capitán Oca Balda” del Instituto Nacional de Investigación y Desarrollo Pesquero: OB-06/99, OB-01/00, OB-03/00 y OB-07/00 - OB-10/00, llevadas a cabo 24 durante la primavera de 1999 (noviembre), el verano (enero), el otoño (mayo) y el invierno de 2000 (agosto-septiembre), respectivamente. El diseño de muestreo se realizó sobre la base de estudios previos (Roux et al, 1995; Roux & Fernández, 1997) y comprendió seis transecciones con sentido NE - SW, sumando un total de 39 estaciones en la campaña de primavera. Durante las campañas verano, otoño e invierno, el número de estaciones varió por razones operacionales en 26, 37 y 29 estaciones, respectivamente. La distancia entre las estaciones fue de 12 millas. (Tabla 1 y Figura 4). Técnicas de muestreo y tratamiento de las muestras a bordo Sedimentos La muestra de sedimento y su réplica fue obtenida con extractor de gravedad Phleger o Rastra tipo Picard, según el tipo de sustrato. El extractor de gravedad Phleger fue utilizado para la obtención de muestras de sedimentos de fondos blandos. Este extractor ha sido diseñado para obtener muestras estratificadas (de hasta 1,20 m de penetración en sedimentos) y su cuerpo principal esta formado por el tubo extractor, el lastre y la cola. Además del cuerpo principal son necesarios para operar el Phleger: 1) un tubo de material plástico de la misma longitud que la del tubo extractor y cuya finalidad es retener y permitir la conservación de la muestra, 2) una pieza de retención de la muestra que se coloca en el interior del extremo inferior del tubo de material plástico, 3) un anillo cortador que sostiene el tubo de material plástico y la pieza de retención de la muestra en el interior del tubo, y que posee un borde cortante que facilita la penetración del extractor en el fondo, y 4) un mecanismo disparador desde el cual el extractor es suspendido y disparado para caer libremente hasta el fondo. Liberado el instrumental hacia el fondo del mar, el tubo extractor penetra en el interior de los sedimentos por acción de la gravedad quedando retenida la muestra en el interior del tubo de material plástico (Guzmán, 1958; Stirn, 1981). Para este estudio se utilizó un Phleger con un tubo extractor de 80 cm de largo y diámetro externo de 45 mm, utilizándose para la toma de muestras, tubos de plástico de PVC de 40 mm de diámetro externo (Figura 5 A). Una vez producida la operación de muestreo del extractor de gravedad Phleger y ya a bordo, el mismo se mantuvo en posición vertical para la extracción de la muestra. Luego de retirado el anillo de corte y la pieza de retención, se extrajo el tubo y se colocaron tapas en su parte posterior e inferior (Figura 5 B y C). Posteriormente, los tubos rotulados se guardaron en posición vertical en cajas de transporte de madera a – 25ºC, para su posterior análisis en tierra (Guzmán, 1958; Stirn, 1981). El número de réplicas correspondientes a cada unidad de muestra 25 fue de tres, siendo destinas las dos primeras al estudio químico de los sedimentos mientras que la tercera , al estudio granulométrico. Rastra: una rastra Charcot modificada en la versión Picard con boca de 23 cm x 60 cm y copo de tela plástica y red de protección de 180 cm de largo (Figura 6) fue utilizada para la obtención de muestras de sedimentos de fondos duros (Sanders, 1958; Holme & McIntyre, 1984). Para cada operación de muestreo la rastra era descendida al fondo y arrastrada durante 5 minutos a una velocidad de 2 nudos o a la deriva. Después de izar la rastra a bordo, se abrió su copo y se procedió a recoger una muestra homogénea de sedimento (250 ml) y su réplica, las cuales fueron retenidas en recipientes de plástico y guardadas a –25ºC para su posterior análisis en el laboratorio. Aguas En la columna de agua las mediciones de presión, temperatura y conductividad se realizaron con un CTD “SBE” (SEA-BIRD ELECTRONIC) MODELO XIX, (Figura 7) con fluorómetro (Seapoint Chlorophyll Fluorometer) adosado para la determinación “in situ “ de los perfiles verticales de fluorescencia del fitoplancton “in vivo”. La toma de muestras para los análisis hidrológicos (determinación de oxígeno disuelto y clorofila a ) se realizó con ayuda de botellas tipo Niskin, (Guzmán, 1958) tomándose muestras de agua de superficie, profundidad media (arriba de la termoclina) y fondo (a 0,50 m del fondo) (Figura 8). Las muestras de agua fueron retenidas en frascos de vidrio de 500 ml con tapa esmerilada. Las determinaciones de oxígeno disuelto se realizaron mediante el método de Winkler modificado (Yodometría). Para la aplicación del método de Winkler las muestras se trataron con sulfato de manganeso SO4Mn (1 ml) y solución alcalina de yoduro de potasio IK - OHNa (1 ml), lo que desencadenó la formación de un precipitado de Mn4 (HO)2 donde el O2 disuelto se oxidó rápidamente y en cantidad equivalente al manganeso divalente formándose hidróxidos básicos de manganeso de valencia superior. Luego de la sedimentación del precipitado se adicionó ácido sulfúrico concentrado (1 ml) y se mezcló la solución hasta que el precipitado se disolvió; al acidificarse la solución, el Mn vuelve a su estado de oxidación, oxidando el yoduro a yodo en cantidad equivalente al oxígeno contenido en la muestra. A partir de una alícuota de 50 ml de solución, el yodo producido es titulado con una solución valorada de tiosulfato (S2O3Na2), utilizando una solución de almidón como indicador del punto final. Los valores de oxígeno se expresan en ml O2/l en condiciones normales de presión y temperatura (Strickland & Parsons, 1965).Para las determinaciones de clorofila a, a bordo, las muestras de agua de mar fueron filtradas a través de filtros de fibra de 26 vidrio (Whatman GF/F), conservándose los filtros a –20°C hasta su tratamiento en el laboratorio (Strickland & Parsons, 1965). 2.2.2.- Principales áreas de concentración del recurso langostino en el Golfo San Jorge. Otoño de 2001 – Verano de 2002. (Segundo período de estudio). Las estaciones Para el relevamiento de las principales áreas de concentración del recurso langostino en el Golfo San Jorge, durante el período otoño de 2001 – verano de 2002, las muestras fueron obtenidas durante las campañas de investigación del BIP “Capitán Oca Balda” del INIDEP, OB06/01, OB-11/01, OB-13/01 y OB-01/02 llevadas a cabo durante el otoño (abril-mayo), el invierno (septiembre) y la primavera (noviembre) de 2001; así como el verano (febrero) de 2002, respectivamente (Tabla 2 y Figura 9). El diseño de muestreo se realizó sobre la base de estudios previos (Roux et al, 1995; Roux & Fernández, 1997) y comprendió 3 transecciones con sentido NE – SW y una de sentido E-O (norte del golfo), sumando un total de 17 estaciones en la campaña de otoño, 19 en la de invierno y 20 en las de primavera y verano. Técnicas de muestreo y tratamiento de las muestras a bordo Tanto las técnicas de muestreo de sedimentos y agua, como el tratamiento de las muestras a bordo, se realizó de la misma forma que en el relevamiento correspondiente al muestreo espacio-temporal del Golfo San Jorge en su totalidad, durante la primavera de 1999 – invierno de 2000. 2.2.3.- Sur del Golfo San Jorge. Área donde se localizan las mayores concentraciones de langostino. Invierno de 2003. (Tercer período de estudio). Las estaciones Para el relevamiento del área sur del Golfo San Jorge donde se localizan las mayores concentraciones de langostino que sustentan parte de la pesquería del litoral patagónico, durante el invierno de 2003, las muestras fueron obtenidas durante la campaña de investigación del BIP “Capitán Oca Balda” del INIDEP OB-05/03, llevada a cabo durante el invierno (junio) de 2003. 27 El diseño de muestreo se realizó sobre la base de estudios previos (Boschi,1989; Bertuche et al., 2000) y comprendió 46 estaciones generales (Tabla 3 y Figura 10) distribuidas uniformemente. Técnicas de muestreo y tratamiento de las muestras a bordo Las técnicas de muestreo de sedimentos y agua, como así también el tratamiento de las mismas a bordo se realizó de la misma forma que en los dos relevamientos previos. Durante este relevamiento se realizó el muestreo del recurso langostino; para el mismo, después de izar la red tangonera (Figura 11) , se procedió a abrir su copo y a recoger al azar de la captura una muestra de langostino de 10 kilos . En los casos de pesca reducida se medió la totalidad de los ejemplares obtenidos. Los muestreos de langostino (Figura 12 A y B) consistieron en la separación de los ejemplares por sexo, midiendo el largo de caparazón (en mm, desde el seno orbitario hasta el borde posterior del cefalotórax). También se consignó el estado de madurez sexual, siguiendo para todo ello los métodos de Angelescu y Boschi (1959). A continuación se presenta la relación morfométrica largo total – largo de caparazón (Ltot – Lcap) para transformar la información de talla registrada en nuestro estudio a talla total. Para hembras Ltot = 16,962 + 3,4818 x Lcap; para machos Ltot = 16,008 + 3,7135 x Lcap (Fischbach, com. per.) 2.3.- METODOLOGÍA DE TRABAJO EN EL LABORATORIO 2.3.1.- Estudio hidrográfico Como ya fue indicado previamente, los datos de temperatura (T), salinidad (S), densidad (D) y concentración de oxígeno disuelto en agua (O) se registraron y determinaron a bordo. En cuanto a las determinaciones de clorofila a (Cl a (AF)) en las muestras de agua de fondo, los registros de fluorescencia obtenidos a bordo fueron transformados a concentración de clorofila a empleándose los factores de conversión obtenidos a partir del análisis de las muestras discretas tomadas con botellas. Para dicho análisis, en el laboratorio los filtros de fibra de vidrio resultantes de las muestras de agua filtradas a bordo, fueron tratados con acetona al 90% y ultrasonido (a 0°C durante 30 minutos). El extracto de pigmentos resultante fue centrifugado para eliminar partículas y restos celulares. La concentración de clorofila a fue determinada por espectrofluorometría, antes y después de acidificar el extracto (Holm-Hansen et al., 1965). Como complemento del análisis de clorofila a en agua se incorpora la información obtenida durante los 28 estudios realizados por Cucchi Colleoni y Carreto (2001, 2002) de clorofila a en la totalidad de la columna de agua. 2.3.2.- Estudio sedimentológico En el laboratorio las muestras de sedimento de cada estación fueron fraccionadas según el tipo de análisis al que serían sometidas. Para las determinaciones de materia orgánica total (MOT), carbono orgánico total (COT), nitrógeno total (NT) y fósforo total (FT) y para la estimación del valor nutricional y el origen de la materia orgánica (relación C:N), se utilizaron los primeros 2 cm de muestra; mientras que, para la determinación clorofila a (Cl a (S)) y feopigmentos (Feop (S)) sólo los primeros 0,5 cm. Para los análisis granulométricos se utilizaron de las muestras obtenidas con extractor de gravedad Phleger los primeros 20-25 cm de sedimentos superficiales (aproximadamente 100 gramos) mientras que de las muestras obtenidas con rastra se trabajó con aproximadamente 250 gramos de material. Para las determinaciones en sedimentos, de materia orgánica total (MOT), carbono orgánico total (COT), nitrógeno total (NT), fósforo total (FT) y para la estimación del valor nutricional y el origen de la materia orgánica (relación C:N), clorofila a (Cl a (S)) y feopigmentos (Feop (S)), el material obtenido fue homogeneizado manualmente y posteriormente fraccionado para los diferentes análisis. Las submuestras fueron secadas a 100ºC por 24 horas (Buchanan & Kain, 1971), luego tamizadas (tamiz de 2 mmm) con el objeto de eliminar la fracción gruesa que se considera que no transporta material orgánico (Garmendia Etxandi, 1997). Para cada determinación se tomó un alícuota de 1 gramo del sedimento molido. 2.3.2.1.- Granulometría Para el análisis granulométrico de los sedimentos se siguió el método descrito por Buchanan (1984). Las muestras destinadas a estos análisis fueron secadas a 100°C, luego la muestra global fue homogeneiza durante cinco minutos; de la misma se obtiene una parte mediante la técnica de cuarteo (se divide la muestra en cuatro partes iguales y se toma una de ellas). Esta submuestra se homogeiniza nuevamente durante otros cinco minutos, posteriormente una fracción de la misma se tamiza durante 20 minutos en un vibrador Retsch, haciendo pasar la muestra sobre una columna de tamices con luces de malla de 4, 2.8, 2, 1.,4, 1, 0.71, 0.50, 0.35, 0.25, 0.18, 0.125, 0.090 y 0.063 mm. A continuación se pesó el contenido de cada tamiz y se transformó a porcentaje. 29 La fracción menor de 0,062 mm, que incluye limo y arcilla, denominada generalmente "fango o pelita", fue tratada con el método de decantación, basado en la Ley de Stokes. Para llevar a cabo este análisis se efectuó previamente el tamizado en húmedo por lo cual se conoce el peso total de la fracción pelítica en cada muestra de sedimento; posteriormente se procedió de la siguiente manera: - se pesa una cantidad de muestra que contenga proporcionalmente al menos 20 g de pelitas. Este cálculo se estima a partir del porcentaje total de pelitas obtenido previamente de la granulometría de arenas. - Se pone a agitar en una botella de agitación con una solución de agua y calgón (6,2 g./l) durante 24 horas para deshacer mecánicamente los agregados formados. - Esta muestra se pone en una probeta y se enrasa con agua hasta 1 litro. - Tras agitación de la muestra se toman las siguientes submuestras: A 00’ 58’’ 20 ml de la disolución a 20 cm de profundidad - A 03’51’’ 20 ml de la disolución a 20 cm de profundidad – A 15’09’’ 20 ml de la disolución a 20 cm de profundidad – A 1h 00’42’’ 20 ml de la disolución a 20 cm de profundidad A 4h 44’49’’ 20 ml de la disolución a 20 cm de profundidad – A 7h 19’17’’ 10 ml de la disolución a 10 cm de profundidad - En la primera submuestra se incluye todo el material pelítico < 0,0625 mm, en la segunda submuestra el material < 0,0313 mm en la tercera submuestra el material < 0,0156 mm en la cuarta submuestra el material < 0,0078 mm en la quinta submuestra el material < 0,0039 mm en la sexta submuestra el material < 0,0020 mm hallándose los pesos de los diferentes finos por diferencia de peso de las submuestras: peso de la muestra (20 g) - peso de la 1ª submuestra (SM) = limo grueso (Φ 4) peso 1ª SM - peso 2ª SM = limo medio (Φ 5) peso 2ª SM - peso 3ª SM = limo fino (Φ 6) peso 3ª SM - peso 4ª SM = limo muy fino (Φ 7) peso 4ª SM - peso 5ª SM = arcilla gruesa (Φ 8) 30 peso 5ª SM - peso 6ª SM = arcilla mediana (Φ 9) peso de la muestra – suma de peso de submuestras = arcilla fina y muy fina (Φ 10) Los limos y arcillas fueron pesados en una balanza de 0,0001 g de precisión. Se utilizó la escala Wentworth (Buchanan & Kain, 1971) para la clasificación de gravas, arenas, limos y arcillas.. Con vistas a la expresión de los resultados, se utiliza esta escala granulométrica en unidades “Φ” (phi) propuesto por Wenthworth ( Holme & McIntyre, 1984) donde la relación entre Φ y el diámetro de grano en mm es la siguiente: “Φ” = - log 2 D (D es el diámetro de la partícula en mm) La serie de tamices utilizados para las fracciones grava y arena, como así también el tamaño del clasto en mm, el tamaño expresado en “Φ” y la denominación de los clastos y de la fracción sedimentaria, se indican en la Tabla 4 a. Los resultados del análisis de la fracción menor de 0,062 mm, se presentan en la Tabla 4 b. Los tipos sedimentarios se definieron en función de los porcentajes de gravas, arenas y fango o pelitas (limo y arcilla) (Buchanan, 1984). La determinación de los parámetros granulométricos (tamaño medio del grano o media granulométrica, grado de selección, y asimetría), se realizó gráficamente, siguiendo la metodología de Folk y Ward (1957) y la nomenclatura de Wentworth (1922), mediante la representación de las curvas granulométricas acumulativas correspondientes, representando en ordenadas el peso acumulado en porcentaje y en abscisas el diámetro de grano traducido en unidades “Φ” con el fin de obtener una serie aritmética de enteros. Media granulométrica Media: Φ 16 + Φ 50 + Φ 84 3 Los valores se obtienen a partir de la curva acumulativa. Se toman los valores de Φ correspondiente a los porcentajes en la ordenada. Para la determinación de este parámetro, se utiliza el valor de Φ correspondiente al 16 %, el correspondiente al 50% y el correspondiente al 84%. 31 Selección S0 = Φ 84 – Φ 16 + Φ 95 – Φ 5 4 6,6 El grado de selección de las muestras, está fuertemente influenciada por los tamaños de granos disponibles. Una pobre selección indica que el sedimento está constituído por varias poblaciones de tamaño de grano (grueso, medio y fino). ESCALA DE VALORES DE FOLK Y WARD > 2,60 extremadamente mal seleccionado 2,60 a 2,00 muy pobremente seleccionado 2,00 a 1,40 pobremente seleccionado 1,40 a 0,80 moderadamente seleccionado 0,80 a 0,50 moderadamente bien seleccionado 0,50 a 0,35 bien seleccionado < 0,35 muy bien seleccionado Asimetría Este parámetro mide la simetría de la distribución y está determinada por la formula: Sk1= Φ 16 + Φ 84 – (2 x Φ 50) + Φ 5 + Φ 95 – (2 x Φ 50) 2 (Φ 84 – Φ 16) 2 (Φ 95 – Φ 5) Cuando las curvas son simétricas Sk1 = 0,00, cuando la asimetría se hace más extrema el valor de Sk1 = 1,00 o – 1,00. Las asimetrías están reflejando la presencia de modas secundarias. Una asimetría positiva está significando que hay cantidades relativamente importantes (normalmente mayores del 5 %) de tamaños más finos que el medio. Cuando las curvas son asimétricas negativas, significa que hay cantidades relativamente importantes (o que la distribución tiene una cola) de granos más gruesos que la media. Este parámetro granulométrico también indica ligeras diferencias en la forma de transporte del material o en la variación de la energía del agente de transporte. 32 ESCALA DE VALORES DE FOLK Y WARD - 1,00 a - 0,30 muy negativa - 0,30 a - 0,10 negativa - 0,10 a 0,10 cercanamente simétrica 0,10 a 0,30 positiva 0,30 a 1,00 muy positiva. 2.3.2.2.- Carbonato de calcio (Bioclastos) Se determinó el porcentaje de carbonatos referido al total de la muestra mediante ataque con ácido clorhídrico, sin discriminar fracción granulométrica alguna (Bastida et al., 1981). El mismo se calculó por diferencia de los pesos de la muestra, antes y después del tratamiento. La muestra tratada fue lavada con agua destilada y secada a 100ºC por 24 horas. 2.3.2.3.-Materia orgánica total (MOT) La materia orgánica se calculó por medio del análisis de pérdida de peso por ignición, sometiendo cada muestra por duplicado, en alícuotas de 1 g de peso, a un secado de 95ºC durante 24 horas. Posteriormente se calcinaron las muestras a 550 ºC por 12 horas (Sargent et al., 1983). Paralelamente se aplicó a este tratamiento a 3 muestras de 1 g de Ca CO3 puro para determinar la pérdida de carbono inorgánico durante el proceso (Hirota & Szyper, 1975). Los resultados se expresan en porcentaje (referido al total de la muestra). 2.3.2.4.- Carbono orgánico total (COT) La determinación de carbono orgánico se efectuó siguiendo el método de Gaudette et al. (1974) modificado por El-Rayis (1985). Esta determinación está basada en el método de Walkley-Black (Nelson & Sommers, 1982) y consiste en la oxidación de la muestra con dicromato de potasio en medio ácido (ácido sulfúrico concentrado) y la valoración del exceso de oxidante (K2Cr2O7) con una solución 0,5 N de sulfato ferroso amónico (sal de Morh). La diferencia entre la cantidad de sustancia oxidante presente en el blanco y en la muestra, nos indica la cantidad de oxidante consumido por el carbono orgánico existente en la muestra. Los resultados se expresan en porcentaje y se calculan por medio de la ecuación: % C orgánico = 10 x (1-T/S) x (1,0 N x (0,003) x (100/W) ) Donde: 33 T = ml de solución ferrosa utilizados en la valoración de la muestra. S = ml de solución ferrosa utilizados en la valoración de la solución patrón. 0,003 = 12/4.000 + meq. En peso de carbono. 1,0 N = Normalidad del dicromato potásico. W = peso en gramos de la muestra de sedimento. 2.3.2.5.- Nitrógeno total (NT) El contenido de nitrógeno total se obtuvo aplicando el método de Kjeldhal (Bremner & Mulvaney, 1982). La determinación consta de tres etapas: digestión, destilación y titulación. En la digestión los compuestos que contienen nitrógeno de la muestra son descompuestos por calentamiento con ácido sulfúrico concentrado en presencia de un catalizador, produciéndose una reacción de oxidación y de reducción, siendo el nitrógeno retenido como sulfato de amonio SO4(NH4)2. En la destilación el amonio se libera por acción del hidróxido de sodio Na(OH) 0,01 N, liberándose amoníaco (NH3), que es arrastrado por una corriente de vapor de agua y recibido en una solución de ácido bórico (H3BO3) (que contiene un indicador) formándose borato de amonio (NH4 H2BO3). En la titulación el amonio se titula con CLH (0,01N). La diferencia de equivalentes entre la cantidad de ácido clorhídrico presente en el blanco y presente en la muestra, permite calcular los gramos de nitrógeno presentes en la misma. Cada ml de ácido clorhídrico 0,01 N equivale a 0,00014 gramos de nitrógeno. Los resultados se expresan en porcentaje (referido al total de la muestra). 2.3.2.6.-Relación carbono – nitrógeno (C:N) A través de la relación entre contenido de carbono orgánico total y nitrógeno total (C:N) fue definido el valor nutricional de la materia orgánica así como el posible origen o procedencia de la misma. Según Stein (1991) los valores de la relación C:N menores a 10, revelan un componente orgánico que es estrictamente de origen marino. Valores de C:N cercanos a 10, representan componentes orgánicos de origen marino y terrestre. Valores superiores a 10, indican el predominio de materia orgánica de origen terrestre. Además valores mayores a 15, indican la presencia de detritos ricos en celulosa originados en la vegetación terrestre (Bordovsky, 1965; Majeed, 1987) Según Parsons et al. (1977) y Sargent et al. (1983) la materia orgánica con una relación C:N entre 6 y 7, proveniente del fitoplancton así como de partículas de materia fecal y de otros materiales orgánicos fácilmente degradables, es de alto valor nutricional. Valores de 10 o 34 superiores a 10, que indican material orgánico de origen terrígeno o material orgánico planctónico residual en un avanzado estado de mineralización difícilmente atacable por las bacterias, es de bajo valor nutricional. 2.3.2.7.- Fósforo total (FT) El contenido de FT se determinó por espectrofotometría, previa digestión de la muestra con peróxido de hidrógeno (Nelson & Sommers, 1982; Rosell et al., 2001). Los resultados se expresan en porcentaje (referido al total de la muestra) y fueron realizados en el LANAIS N-15 (Laboratorio Nacional de Investigaciones y Servicios del N-15, CONICET- UNS, Bahía Blanca). 2.3.2.8.- Clorofila a (Cl a (S)) y feopigmentos (Feop (S)) Los análisis de clorofila a y feopigmentos (productos de la degradación de la clorofila a) en sedimentos se realizaron según la técnica fluorométrica descripta por Riaux-Gobin et al. (1987), donde las muestras (homogeneizadas) son tratadas con acetona 90% y conservadas a 4 ºC y en oscuridad durante 24 horas. El extracto de pigmentos resultante fue centrifugado durante 30 minutos a 2000 rpm. La concentración de clorofila a fue determinada por espectrofluorometría, antes y después de acidificar el extracto (Holm-Hansen et al., 1965). Los resultados se expresan en μg/g (de sedimento seco). Cabe indicar, que esta técnica en general sobrestima en un 30 % las concentraciones de feopigmentos al no diferenciar todos los derivados de la degradación de la molécula de clorofila a. La representación cartográfica de las diferentes variables físicas y químicas se realizó utilizando el programa gráfico Surfer, versión 7.0 (Golden Software, 1995), empleando para la interpolación el método kriging (Joumel & Huiybnegts, 1978). Se agrega un listado de las abreviaturas utilizadas correspondientes a las variables físicoquímicas de agua y sedimentos analizadas en el presente trabajo: • T = temperatura del agua de fondo • S = salinidad del agua de fondo • D = densidad del agua de fondo • O = oxígeno del agua de fondo • Cl a (AS) = clorofila a del agua de superficie • Cl a (CM) = clorofila a de la capa de mezcla 35 • Cl a (AF) = clorofila a del agua de fondo • MOT = materia orgánica total • COT = carbono orgánico total • NT = nitrógeno total • FT = fósoforo total • C:N = relación carbono / nitrógeno • Cl a (S) = clorofila a en sedimentos • Feop (S) = feopigmentos en sedimentos • P = profundidad de las estaciones de muestreo 2.4.- TRATAMIENTO NUMÉRICO DE LOS DATOS 2.4.1.- TESTS NO PARAMÉTRICOS Para los análisis estacionales del presente estudio, dado el número reducido de observaciones que componen la muestra y ante la imposibilidad, por lo tanto, de evaluar las características distribucionales de las variables bajo estudio, se aplicaron técnicas estadísticas no paramétricas. Las mismas no exigen asumir ningún tipo de distribución particular en las variables que componen la muestra, como por ejemplo la normalidad y la igualdad de varianzas, así como no requieren la estimación de parámetros como la media, varianza, proporción, etc, de la población. Cabe indicar que estas técnicas son más fáciles de aplicar que las alternativas paramétricas al no exigir ninguna condición suplementaria a la muestra sobre su proveniencia de una población con cierto tipo de distribución. En las técnicas no paramétricas juega un papel fundamental la ordenación de los datos, hasta el punto de que en gran cantidad de casos ni siquiera es necesario hacer intervenir en los cálculos las magnitudes observadas, sino sólo poder establecer una relación de menor a mayor entre las mismas, esto es, definir un orden entre los valores (Zar, 1996). Test de Kruskal Wallis El test de Kruskall-Wallis sirve para contrastar la hipótesis de que k muestras cuantitativas han sido obtenidas de la misma población. La única exigencia versa sobre la aleatoriedad en la extracción de las muestras, no haciendo referencia a ninguna de las otras condiciones adicionales 36 de homocedasticidad y normalidad necesarias para la aplicación del correspondiente test paramétrico ANOVA. Al igual que las demás técnicas no paramétricas, ésta se apoya en el uso de los rangos asignados a las observaciones (Zar, 1996). Test de Dunn El test de Dunn es un test de comparaciones múltiples, que permite comparar K muestras cuantitativas de diferentes tamaño (Zar, 1996), comparando los pares de muestras entre sí. El tratamiento estadístico de los datos se realizó utilizando el programa de análisis estadístico Statistica, versión 6,0 (Statistica Software, 1988). 2.4.2.- TESTS PARAMÉTRICOS Test de comparación de dos distribuciones En el caso particular del tercer período de estudio se aplicó el test parámetrico de comparación de dos distribuciones a partir del estadístico GH de homogeneidad (Sokal & Rohlf, 1979) para la comparación de las clases texturas correspondientes al agrupamiento de las estaciones coincidentes por su proximidad, de la primavera de 1999 (estaciones generales 494, 495, 496, 497, 498, 499, 509, 510, 511, 512, 521 y 522) e invierno de 2003 (estaciones generales 104, 107, 112, 114, 120, 125, 130, 131, 135, 138, 142 y 169). 2.4.3.- ANÁLISIS MULTIVARIANTE En la Figura 13 se esquematizan los pasos seguidos en el análisis multivariante (Clarke, 1993) efectuado en la presente tesis. Primeramente, se realizaron los análisis de los datos ambientales y bióticos completamente separados utilizando los métodos de clasificación (UPGMA) y ordenación (ACP y AC);y luego simultáneamente, mediante el análisis de correlación canónica (ACC). 2.4.3.1.- VARIABLES AMBIENTALES 37 Con respecto al tratamiento de los datos ambientales, a partir de la matriz de los valores de las variables físico-químicas del sistema bentónico por estaciones de muestreo, se realizaron los correspondientes análisis previa transformación de los datos. Las variables fueron estandarizadas para homogeneizar la escala de variación de las distintas variables incluidas en el análisis. La fórmula utilizada para la estandarización fue: x = (x-promedio)/desviación estándar Los análisis de clasificación y ordenación en base a una matriz de datos se realizaron en modo “q” o análisis normal, que representa los agrupamientos de estaciones en función de sus variables ambientales, y en modo “r” o análisis inverso, que determina el grado de afinidad entre las variables. Clasificación Para la clasificación de las variables ambientales, se aplicó el Indice de Similtud de BrayCurtis; efectuándose los análisis considerando la técnica de ligamiento promedio UPGMA (Unweighed Pair Group Average Linkage) (Sokal & Michener, 1958; Lance & Williams, 1967; Sneath & Sokal, 1973). Indice de Similtud de Bray-Curtis Existen gran variedad de medidas de distancia, correlación, similitud y disimilitud. La mayoría de estas medidas y sus propiedades son resumidas en Crisci (1983). A menudo muchas variables están ausentes en la mayoría de las estaciones de muestreo, así que generalmente más de la mitad de las entradas en la matriz de datos son valores cero. La transformación de datos no altera este hecho. De este modo las medidas que tienen en cuenta las ausencias colectivas (múltiples), no son lo suficientemente robustos para que puedan ser aplicados en general. En esta tesis se ha adoptado la medida utilizada por Bray-Curtis (Bray & Curtis, 1957, Beals, 1984, Clarke & Warwick,1993) debido a la respuesta que presenta con matrices con alta proporción de datos de valor cero. A la vez, a este índice no le afectan las ausencias múltiples (Field & McFarlane, 1968). La notación del índice de Bray-Curtis es: δjk = Σ i=1 n | Yij – Yik | / Σ i=1 n ( Yij + Yik ) 38 Siendo Yij = valor de la variable j en la estación de muestreo i, Yik = valor de la variable k en la estación de muestreo i y δjk = disimilitud entre las variables j y k sumando para todas las estaciones de muestreo. δjk = varía entre 0 (cuando los valores para todas las variables fuesen idénticos en ambas muestras) y 1 (cuando las muestras comparadas no tienen ninguna variable en común) y es el complemento de la similaridad Sjk Sjk = 1- δjk El índice de Bray-Curtis es algebraicamente equivalente al coeficiente de Czekanowski, tal como lo utilizaron Fiel y McFarlane (1968) y Day et al., (1971). Se puede utilizar para toda clase de datos; para datos presencia-ausencia se reduce al coeficiente de Dice (Sneath & Sokal, 1973). La aplicación del índice resulta en una matriz triangular en la que se comparan todas las muestras entre sí. Esta matriz se podría representar gráficamente de varias formas (Crisci, 1983) pero es mas visual si se representa en forma de dendrograma o por medio de una ordenación. Dendrogramas La representación de los análisis de clasificación se efectuó por medio de la técnica de ligamiento promedio UPGMA (Unweighed Pair Group Average Linkage) (Sokal & Michener, 1958; Lance & Williams, 1967; Sneath & Sokal, 1973). Esta representación en dendrograma maximiza la correlación cofenética es decir, la relación entre las disimilaridades de entrada y las implicadas en el dendrograma resultante. Las estrategias de separación jerárquica que existen para generar un dendrograma a partir de la matriz de similitud son descritas en Clifford y Stephenson (1975). Los dendrogramas tienen la ventaja de la simplicidad: las muestras son agrupadas por afinidad o diferencia, aunque los niveles de corte son arbitrarios y dependen de la conveniencia. Sin embargo, pese a su simplicidad, existen desventajas en la representación en dendrograma, que aconseja utilizarlo en conjunción con métodos de ordenación con el objeto de contrastar los resultados obtenidos en aquel. Las desventajas son: 39 1- La jerarquía es irreversible: una vez que una muestra es emplazada en un grupo pierde su identidad. 2- Los dendrogramas sólo muestran las relaciones entre grupos, el nivel de similaridad indicado es el valor medio entre grupos. 3- La secuencia de muestras en un dendrograma es arbitraria y dos muestras adyacentes no son necesariamente las más similares. 4- Los dendrogramas tienden a subrayar las discontinuidades. Los dendrogramas se efectuaron con ayuda del Programa Statistica, versión 6,0 (Statistica Software, 1988). Ordenación Análisis de componentes principales (ACP) Se utilizó el análisis de componentes principales para estudiar la disposición de las estaciones de muestreo frente a los factores medioambientales así como para discriminar cuales de ellos eran los responsables de la ordenación de las estaciones de muestreo e indirectamente, de los organismos (Teer Braak, 1988). El ACP, permite obtener nuevas variables, combinación de las anteriores, independientes entre sí. El número de estas variables o factores o componentes extraídos con este tratamiento estadístico, es significativamente menor que el de las variables de partida y por lo tanto sin perder información, el análisis global resulta más sencillo. Los factores obtenidos explican un porcentaje de varianza total. En general, de este conjunto de factores de acuerdo con el criterio propuesto por Morrison (1976) y Bonilla Ruíz et al. (1998), se eligen aquellos capaces de explicar más de 60% de la variabilidad total, considerando sólo las variables con una carga factorial mayor a 0,50 (valor absoluto). Para el ACP, se utilizó el paquete estadístico Statistica versión 6,0 (Statistica Software, 1988). Descripciones más detalladas de estos análisis se encuentran en Teer Braak (1988), Sneath y Sokal (1973) y Legendre y Legendre (1979. 2.4.3.2.- VARIABLES BIOLÓGICAS A.- COMUNIDADES BENTÓNICAS. OTOÑO DE 2000. 40 En los estudios desarrollados sobre las comunidades bentónicas del Golfo San Jorge por Roux, (2000 a y b, 2003 y 2005), Roux y Fernández (1997), Roux y Piñero (1999, 2001, 2003, 2004, 2005 a, b, c y d y en prensa) y Roux et al. (1995, 1999, 2002, 2003, 2004 y en prensa), se han considerado parámetros de riqueza y estructura de una comunidad tales como abundancia, densidad, riqueza específica, Indice de Diversidad Específica de Shannon-Wiener (H’) y el Indice de Importancia Relativa (IR) de Bucher y Herrera (1981), entre otros. A la vez se desarrollaron los análisis de clasificación (en modo “q” y “r”) mediante la utilización del Indice de Similitud de Bray-Curtis y la técnica de agrupamiento UPGMA, según recomendaciones del Plymonth Marine Laboratory (1993) Para la presente tesis, se focalizó el análisis en la campaña realizada en otoño de 2000, correspondiente al primer período de estudio, por ser la que presentaba de todas las campañas analizadas el relevamiento macrobentónico más completo. Se trabajó con los cuatro grupos faunísticos más representativos de la misma: Equinodermos, Moluscos, Crustáceos y Anélidos Poliquetos (Roux & Piñero, 2001). Se estimaron conforme a lo indicado por Roux et al. (1995, 1999, 2002, 2003 y 2004), parámetros de riqueza de una comunidad (abundancia, densidad, riqueza específica, abundancia relativa y frecuencia de aparición) y parámetros de estructura (Índice de Diversidad Específica de Shannon-Wiener (H’), Uniformidad (J’) e Índice de Importancia Relativa (IR); a la vez se realizó el análisis de clasificación correspondiente así como el de ordenación mediante la aplicación de un análisis de correspondencia (AC), este último conforme a lo indicado por Sánchez Mata (1996). Parámetros poblacionales Abundancia La abundancia de una especie en una estación de muestreo es el número de individuos de esa especie presente en dicha estación de muestreo. Densidad La densidad de una coumunidad es el número de individuos de todas las especies por unidad de superficie. Igualmente la densidad de una especie es el número de individuos de dicha especie por unidad de superficie. Para nuestro estudio, la densidad se calculó para el área barrida del instrumental utilizado equivalente a 0,00025 mn2 (millas náuticas cuadradas). 41 Riqueza específica Número de especies presentes en una estación o conjunto de estaciones. Abundancia relativa La abundancia relativa de una especie en una estación de muestreo es la relación en porcentaje entre el número de individuos xij de una especie i en una estación de muestreo j y el número total de individuos de todas las especies en una estación de muestreo (Nj). Dij = (xij / Nj) 100 Frecuencia de aparición La frecuencia de aparición de una especie i en una población j, viene definido por la relación establecida entre el número de estaciones de la población donde existe dicha especie (Pij) y el número total de estaciones efectuadas sobre esta población (Pj), expresada en porcentaje. Fij = (Pij/Pj) x 100 Fij = Frecuencia de la especie i en la población j. Pij = Número de estaciones de muestreo en las que se encuentra la especie i en la población j. Pj = Número total de estaciones muestreadas en la población j. Según el valor del índice distinguimos: Especies raras: menos del 12 % Especies poco comunes entre 13 y 25 % Especies comunes entre 26 y 50 % Especies muy comunes entre 51 y 75 % Especies constantes entre 76 y 100 % Índice de Diversidad Específica La diversidad es una función del número de especies y de la distribución del número de individuos entre estas especies, de acuerdo con Margalef (1982), que dice...Un número de especies y las abundancias relativas de las mismas encuentran su expresión en la diversidad. Es un parámetro de la estructura de la comunidad, que depende de las especies y de sus abundancias. 42 El cálculo del índice de diversidad ofrece posibilidades de evaluación de la riqueza faunística de un medio determinado y de comparación de la fauna de diferentes medios a partir de las muestras tomadas, aunque estas no tengan el mismo número de individuos (Amouroux, 1974). El índice de Shannon-Wiener (Shannon & Weaver, 1963) es el que más se adapta a la Ecología Marina, ya que parece estar dotado de una mayor sensibilidad frente a las perturbaciones del medio (Perkins, 1983). Derivado de la teoría de la información, el índice de Shannon-Wiener se expresa como: H’= - ∑ i pi log2 (pi ) pi = ni / N Donde ni es el número de individuos de la especie i en la muestra, N el número total de individuos de la muestra y pi es la frecuencia relativa de las especies (cociente entre la abundancia de cada especie y el número total de individuos del muestreo). Este índice se mide en “bits”o unidades de información, y toma valores desde 0 (cuando todos los individuos pertenecen a la misma especie) hasta un número positivo más o menos elevado y teóricamente infinito (cuando los individuos están repartidos en especies distintas). Uniformidad (J’) Uniformidad, equitatividad o regularidad de una muestra (J’) es la relación de la diversidad real (H) a la diversidad máxima (log 2 (S)). Puede considerarse como un complemento del índice de diversidad, ya que nos indica la homogeneidad o estabilidad de la muestra en cuestión (Schejter, 2005). La Uniformidad se expresa mediante la fórmula: J’ = H’ / H’máx = H’ / log 2 S Donde S es riqueza específica. Es decir, J’ se expresa como el cociente entre la diversidad de una muestra y la diversidad máxima para el mismo número de especies (misma abundancia para todas las especies) (Legendre & Legendre, 1984). Este cociente analiza la repartición equitativa de las especies en cuanto a su número de individuos. Sus valores oscilan entre 0 y 1; valores débiles indican la dominancia de una o más especies, siendo la población poco estable o heterogénea; mientras que 43 si se tiende al valor máximo 1, los efectivos están más repartidos entre sus especies, siendo una población más estable u homogénea (ya sea en abundancia o biomasa). Tanto la diversidad como la equitatividad pueden referirse a densidad o a biomasa; en nuestro trabajo solo lo hemos abordado respecto del primer concepto. Índice de Importancia Relativa (IR) Este índice considera en forma conjunta la abundancia relativa y la frecuencia de aparición y se expresa como IR= (Ni/Nt) x (Mi/Mt) x 100 Donde Ni es el número de individuos observados de la especie i a lo largo de todas las muestras, Nt es el total de individuos de todas las especies, Mi es el número de muestras en las que estaba presente la especie i y Mt es el total de las muestras (Bucher & Herrera, 1981). Este índice determina el lugar relativo de cada especie en el interior de una unidad de población considerada y permite definir la o las especies dominantes así como las especies acompañantes de cada unidad que se denominarían asociaciones bentónicas y también visualizar las afinidades entre las diferentes unidades de población (Sánchez Mata, 1996). Clasificación Para la clasificación de las especies y las estaciones, se analizó la matriz de datos de 43 especies y 36 estaciones de muestreo expresada en valores de densidad (previa transformación de los datos a raíz cuarta) aplicando el Indice de Similtud de Bray-Curtis; efectuándose la representación de los análisis por medio de la técnica de ligamiento promedio UPGMA (Unweighed Pair Group Average Linkage) (Sokal & Michener, 1958; Lance & Williams, 1967; Sneath & Sokal, 1973). La transformación de raíz cuarta utilizada en este estudio, tiene un efecto de reducir los valores de las especies muy abundantes de forma que no minoriza los demás datos; pero además presenta la ventaja que cuando la similitud se obtiene por el índice de Bray-Curtis, el coeficiente de similitud es invariable a un cambio de escala, es decir, no importa si los valores se expresan en cm2 o en m2 (Plymonth Marine Laboratory, 1993). Ordenación 44 Las 36 estaciones de muestreo se compararon en base a su composición específica (matriz especies-estaciones). La ordenación espacial de las especies obtenidos en cada estación de muestreo, fue efectuada mediante el paquete estadístico Statistica versión 6,0 (Statistica Software, 1988), utilizando el análisis de correspondencia (AC). El AC ordena las estaciones a lo largo de los ejes, en función de la similitud en la composición específica (Hill, 1979). Este análisis permite establecer agrupaciones de localidades en base a composiciones faunísticas similares, a la vez que la observación complementaria de la variación temporal de la composición específica en un determinado punto de muestreo. El AC es una variante del análisis de componentes principales (ACP), cuya propiedad fundamental es la posibilidad de representar simultáneamente las variables y las observaciones, partiendo de una tabla de frecuencias o tablas de contingencia donde se definen categorías clasificadas cualitativamente en función de ciertas variables. En general los métodos de inercia u ordenación indican el grado de independencia entre las variables (especies) y las categorías (estaciones de muestreo) permitiendo conocer las relaciones entre especies y/o muestras reduciendo las dimensiones del espacio original, acumulando la mayor parte de la varianza en el sentido de unos pocos ejes o dimensiones principales. Un valor de inercia bajo indicaría cierta homogeneidad en la distribución de las especies. Las estaciones de muestreo y/o especies pueden proyectarse en los planos definidos por cada par de ejes, obteniéndose una nube de puntosestaciones de muestreo o puntos-especies que aparecen agrupados conforme a una estructura lógica, sujeta a una interpretación ecológica (Junoy, 1988). Se aplicó este análisis a la matriz de especies considerando datos estandarizados de abundancia, sin subvalorar las especies raras. B.- RECURSO LANGOSTINO. INVIERNO DE 2003. Las variables estimadas para el análisis correspondiente del recurso langostino fueron procesadas de las bases de datos Puente y Muestra mediante la utilización del programa DATOFOX (INIDEP). De cada lance de pesca (46) sobre la base de la información de la muestra (número de individuos por clase de talla y sexo y peso de la muestra) y las millas náuticas navegadas, se calcularon las variables biológicas previa estandarización de la captura a la unidad de esfuerzo pesquero (1 hora de arrastre). Las variables estimadas fueron: 1) densidad del total de individuos en peso (tn/mn2) y en número (miles de individuos/mn2). 45 2) densidad de las siguientes categorías o rangos de tallas (Boschi, 1989; Bertuche et al., 2000), en peso (tn/mn2) y en número (miles de individuos/mn2): - Individuos entre 4 y 24 mm de largo de caparazón (Lcap); individuos juveniles en proceso de reclutamiento; - Individuos entre 25 y 30 mm Lcap; individuos subadultos; - Individuos entre 31 y 40 mm Lcap; individuos adultos; - Individuos mayores de 41 mm Lcap; individuos adultos. 3) Talla media y dispersión del total de individuos y por sexo. 4) Porcentaje de machos y hembras. Los análisis de clasificación y ordenación en base a una matriz de datos (estacionescategorías de langostino) se realizaron en modo “q” y “r” . Para el análisis de clasificación de las variables biológicas: individuos juveniles, individuos subadultos, individuos adultos entre 31-40 mm Lcap e individuos adultos mayores a 41 mm Lcap y las 46 estaciones, se aplicó el Indice de Bray-Curtis (previa transformación de los datos de densidad a raíz cuarta) y la técnica de agrupamiento UPGMA, antes detallados. La ordenación espacial de las variables biológicas en cada muestra, fue efectuada mediante el paquete estadístico Statistica versión 6,0 (Statistica Software, 1988), utilizando el análisis de correspondencia (AC). Las muestras estudiadas para cada una de las 46 estaciones de muestreo se compararon en base a los datos de abundancia estandarizados de las categorías citadas (matriz categorías-estaciones). 2.4.3.3.- RELACIÓN ENTRE LAS VARIABLES AMBIENTALES Y LAS VARIABLES BIOLÓGICAS. Para definir las interacciones de los organismos con los parámetros físico-químicos en las muestras se realizó el Análisis de Correlación Canónica (ACC). El mismo sólo se aplicó en el estudio del recurso langostino. El análisis de correlación canónica suministra una descripción integrada de las relaciones entre las especies y las variables medioambientales asumiendo por un lado un modelo de respuesta que es común a todas las especies y por otro, la existencia de un único conjunto de gradientes medioambientales a los cuales responden todas las especies. Este modelo es común a todas las técnicas de ordenación; lo que hace a el ACC una técnica muy útil en la descripción de una comunidad es el hecho de que se centra en las relaciones entre especies y variables físico46 químicas proporcionando una interpretación automática de los ejes de ordenación (Cassie, 1972, Sánchez Mata, 1996). Las técnicas de ordenación canónica detectan las tendencias de variación en los datos que han sido mejor explicadas por las variables ambientales observadas. El diagrama de ordenación resultante expresa tanto la tendencia de variación en la composición específica como las relaciones principales entre las especies y cada una de las variables ambientales, combinando aspectos de una ordenación normal con aspectos de una regresión. El ACC selecciona la combinación lineal de las variables ambientales que tenga máxima correlación con la correspondiente combinación lineal de las variables biológicas (Teer Braak, 1987). El análisis ACC efectuado con la matriz variables-estaciones se llevó a cabo con el paquete estadístico Statistica versión 6,0 (Statistica Software, 1988). Para la confección de la matriz se consideraron 1) las variables ambientales: profundidad, temperatura, salinidad, concentración de oxígeno y clorofila a en agua de fondo, porcentaje de arena, limo, arcilla, carbono orgánico total, relación C:N en sedimentos y 2) las variables biológicas: abundancia de individuos juveniles (4-24 mm Lcap), individuos subadultos (25-30 mm Lcap), individuos adultos (31-40 mm Lcap) y individuos adultos (> 41mm Lcap). 47 RESULTADOS 48 3.- RESULTADOS 3.1.-GOLFO SAN JORGE EN SU TOTALIDAD. PRIMAVERA DE 1999 – INVIERNO DE 2000. Primer período de estudio (Figura 4). 3.1.1.- CARACTERIZACION DE LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO. 3.1.1.1.- Variables hidrográficas del agua de fondo Temperatura (T) Un corte vertical de los registros de temperatura del Golfo San Jorge de sentido SW - NE (Figura 14) permite observar la formación de una termoclina en primavera, la cual se acentúa en verano (a 40 - 50 m de profundidad) y desciende en otoño (a 70 m de profundidad); registrándose una total homogeneidad de la columna de agua en invierno con valores de 7,5 ºC. La estratificación de la columna de agua, define una capa superficial homogénea de aproximadamente 11,5 ºC en primavera, 16,0 ºC en verano y 11,5 ºC en otoño, con una termoclina estacional y una capa de fondo fría con temperaturas que oscilan entre 8,04 ºC - 11,43 ºC, 8,31 ºC - 15,37 ºC y entre 8,94 ºC - 12,35 ºC en primavera, verano y otoño, respectivamente. El ciclo estacional de la distribución horizontal de la temperatura de fondo (Figura 14) presenta una elevada amplitud, con máximos valores durante el verano (15,37 ºC) y mínimos (5,66° C) en invierno (Tabla 5). En primavera, verano y otoño se observan gradientes térmicos horizontales entre los 46º S y 47º S de 3,39 ºC, 7,06 ºC y 3,41 ºC, respectivamente; lo que correspondería a 0,056 ºC/mn, 0,12 ºC/mn y 0,057 ºC/mn. Los valores mínimos se registran en el sector central, más profundo del golfo y los máximos hacia la costa. En invierno el gradiente térmico es de 2,36 ºC (0,039 ºC/mn), registrándose los valores mínimos en el sector sur del golfo. El análisis estadístico estacional (Tabla 5, Figura 15) indicó diferencias altamente significativas (P < 0.01) entre invierno y primavera, invierno y verano e invierno y otoño, como así también entre primavera y otoño. Salinidad (S) Los resultados indican que el ciclo estacional de la distribución de la salinidad en el agua de fondo (Figuras 16) presenta escasa amplitud, con registro de valores extremos en invierno (valor máximo de 33,80 ups en el norte del golfo y mínimo de 33,07 ups, en el extremo sur) 49 (Tabla 5). En los períodos analizados la distribución horizontal de la variable siguió un patrón de valores bajos en el sur del golfo con mínimos en el cuadrante SE (33,26 ups en primavera y 33,30 ups en verano; y S < 33,20 ups en otoño e invierno) y una prolongación de baja salinidad hacia el norte y por el exterior del golfo en forma de lengua con un gradiente rápido de incremento de isohalinas desde el sector sur con valores de hasta 33,64 ups en primavera, 33,62 ups en verano, 33,58 ups en otoño y 33,73 ups en invierno. Los perfiles estacionales de salinidad permiten diferenciar salinidades inferiores a 33,50 ups en el sector próximo a la costa y, en especial en otoño, núcleos superficiales de baja salinidad (entre 33,00 ups y 33,50 ups) en la boca del golfo. El análisis estadístico estacional (Tabla 5, Figura 15) indicó diferencias altamente significativas (P < 0,01) entre invierno y otoño. Densidad (D) Desde el punto de vista estacional, la distribución de la densidad del agua de fondo está caracterizada por valores máximos durante el invierno (26,369 kg/m3 y mínimos 24,681 kg/m3) durante el verano (Figuras 17), observándose un descenso de los valores desde primavera hasta otoño; y un aumento en invierno (Tabla 5). En primavera, verano y otoño se observan gradientes horizontales entre los 46º S y 47º S de 0,71 kg/m3 , 1,448 kg/m3 y 0,786 kg/m3, respectivamente; lo que correspondería a 0,012 kg/m3/mn, 0,024 kg/m3/mn y 0,013 kg/m3/mn. Los valores máximos se registran en el sector central y profundo del golfo y los mínimos hacia la costa. En invierno el gradiente fue de 0,3342 kg/m3 (0,0056 kg/m3/mn), registrándose los valores mínimos en el sector sur y sudeste, y los máximos hacia el centro del golfo. Los perfiles verticales de densidad (Figura 17) permiten observar la formación de una picnoclina en primavera, que se acentúa en el verano y se profundiza en otoño, con una homogeneidad de la columna de agua en invierno. El análisis estadístico estacional (Tabla 5, Figura 15) indicó diferencias altamente significativas (P < 0.01) entre invierno y primavera, invierno y verano e invierno y otoño, así como entre primavera y otoño. Concentración de oxígeno (O) La distribución horizontal de la concentración de oxígeno en agua de fondo (Figuras 18) permite observar los valores máximos en invierno (6,82 ml O2/l) y los mínimos en otoño (1,82 ml O2/l). 50 En general, se observa una disminución progresiva de los valores desde primavera hasta otoño y un aumento significativo en invierno (Tabla 5). En primavera, verano y otoño se registran gradientes horizontales entre los 46º S y 47º S de 1,96 ml O2/l , 3,86 ml O2/l y 4,21 ml O2/l , respectivamente; lo que correspondería a 0,033 ml O2/l/mn, 0,064 ml O2/l/mn y 0,070 ml O2/l/mn. Los valores mínimos se registran en el sector central y profundo del golfo y los máximos en el sector sudeste próximo a Cabo Tres Puntas. En invierno el gradiente es de 0,48 ml O2/l (0,008 ml O2/l/mn) lo que indica una homogenización en la concentración de oxígeno en el agua de fondo con un valor medio del orden de 6,56 ml O2/l y un valor máximo de 6,84 ml O2/l en el extremo sudeste del golfo. El análisis estadístico estacional (Tabla 5, Figura 15) indicó diferencias altamente significativas (P < 0.01) entre los períodos analizados, excepto entre verano y otoño. Concentración de clorofila a (Cl a (AF)) El ciclo estacional de la distribución de concentración de clorofila a en agua de fondo (Figura 19) presenta los valores máximos en verano (2,16 mg/m3) y en otoño (2,11 mg/m3) (Tabla 5). Considerando el valor medio para todo el golfo, se observa una leve disminución de la concentración de clorofila a desde primavera hasta otoño y un aumento significativo en invierno. En primavera, las máximas concentraciones (superiores a 0,80 mg/m3 ) se observaron en el sector sur y en el sector costero oeste; mientras que en verano y otoño, en el sector sur, sudeste y este (boca) del golfo. En invierno la distribución de clorofila a se observa más uniforme y con un gradiente positivo desde el sur hacia el norte del golfo. El análisis estadístico estacional (Tabla 5, Figura 20) indicó diferencias altamente significativas (P < 0,01) entre invierno y primavera, invierno y verano, y entre invierno y otoño. Considerando los registros de concentración de clorofila a en agua superficial y en la capa de mezcla (Cucchi Colleoni & Carreto, 2001), se observan las máximas concentraciones, en otoño en el agua superficial (valores entre 0,36 y 3,38 mg/m3, valor medio de 1,08 mg/m3 ); mientras que en la capa de mezcla, en verano y otoño (valores medios de 0,97 y 1,04 mg/m3 , respectivamente) (Tabla 5). El análisis estadístico estacional (Tabla 5, Figura 20) indicó diferencias significativas entre otoño y primavera y entre otoño y verano; y diferencias altamente significativas entre otoño e invierno, en la concentración de clorofila a en agua superficial. El análisis estadístico de concentración de clorofila a en la capa de mezcla indicó que las diferencias detectadas no fueron significativas. 51 3.1.1.2.- Variables sedimentológicas A.-Caracterización física del sedimentos Los resultados de los análisis granulométricos realizados en los sedimentos superficiales del Golfo San Jorge, indican 20 clases texturales, con un rango de tamaño de grano entre grava (valor de Φ > -2 o canto rodado > de 4 mm) y arcilla fina - muy fina (valor de Φ = 10 o partículas < a 0,001 mm) (Tabla 6 ). El área de estudio se caracteriza por la presencia de dos fracciones granulométricas claramente definidas espacialmente: gravas y arenas y fango (limo y arcilla) (Figuras 21 y 22). La fracción grava y arena que se localiza en las zonas costeras y en los extremos del golfo, Cabo Tres Puntas y Cabo Dos Bahías, representa el 18 % de las estaciones analizadas (6 estaciones). La fracción fango (limo y arcilla), predominante en el resto de la zona relevada, representa el 82 % de las estaciones (33 estaciones). De las 6 estaciones caracterizadas por la fracción grava y arena dos presentaron predominio de grava, una de ellas ubicada próxima a Cabos Tres Puntas y la otra al norte de la cuidad de Comodoro Rivadavia (estaciones generales 493 y 523, respectivamente); mientras que las restantes cuatro estaciones, situadas próximas a la costa, se caracterizaron por el predominio de arena (estaciones generales 495, 494, 511 y 531). Cabe mencionar que los bioclastos (carbonato de calcio de origen biogénico) se presentan asociados a la fracción grava y arena, estando presentes en porcentajes que oscilaron entre 4,52 % y 12,09 %. Las 33 estaciones con predominio de la fracción fango, presentan como componente principal la partícula limo con valores entre 42,83% y 90,02% y un valor medio de 61,55%, destacándose el predominio del limo grueso, seguido por el limo mediano con valores medios de 18,97% y 17,24%, respectivamente. Del grupo de 33 estaciones, seis de ellas, al norte del Cabo Tres Puntas presentaron valores de limo que oscilaron entre 47,56 % y 76,26 %, siendo el segundo componente en importancia la arena, con valores entre 17,66 % y 45,87 %. Las estaciones ubicadas en la zona central del golfo (20 estaciones) se caracterizaron por un contenido de limo que osciló entre 60,98 % y 90,02 %, siendo el segundo componente en importancia la arcilla, con valores entre 7,25 % y 38,53 %. Las estaciones frente a Comodoro Rivadavia (estación general 522) y al Cabo Aristizábal (estación general 526), presentaron características particulares. La primera de ella, reunió porcentajes semejantes de arena y limo (48,95% y 46,55%, respectivamente). La segunda, también costera, se clasificó como eminentemente limosa (82,53% de limo) (Tabla 2). 52 Los tipos sedimentarios que encuentran representación en el golfo son: grava, grava arenosa, arena gravosa, arena limosa, limo, limo arenoso, limo arcilloso y arcilla limosa; observándose una predominancia en el golfo del tipo limo arcilloso (Tabla 7, Figura 23). En las figuras 24, 25 y 26 se presentan una serie de cartografías que permiten visualizar espacialmente las variaciones sedimentarias, en función de los resultados obtenidos de los parámetros granulométricos: tamaño medio del grano o media granulométrica, grado de selección y asimetría. El tamaño medio del grano o la media granulométrica (Figura 24) aumenta desde el interior (Φ 6 = 0,0156 mm, limo fino) hacia la zona costera o litoral (Φ 3,5 = 0,090 mm, arena muy fina) y hacia los extremos del Golfo San Jorge (Φ 0 = 1mm, arena gruesa). Los valores más frecuentes corresponden a limos, limitados a la zona interna o central y a la zona sudoeste del golfo; quedando las arenas restringidas al sector litoral y a los extremos próximos a los Cabos Dos Bahías y Tres Puntas. El grado de selección de las muestras (Figura 25) está fuertemente influenciada por los tamaños de los granos disponibles. Una pobre selección indica que el sedimento está constituido por varias poblaciones de tamaño de grano (grueso, medio y fino). En nuestro caso en particular, la pobre selección que se observa en la zona interna del golfo, refleja que la mayoría de las muestras de la zona presentan como tamaño medio predominante el limo (ya sea grueso, medio, fino o muy fino) y otras pequeñas modas en tamaños más finos (arcillas finas a muy finas), como así también en tamaños más gruesos (arenas muy finas). El patrón que se observa en la distribución de la asimetría (Figura 26), refleja el predominio de muestras con valores positivos a muy positivos en la zona interna del golfo. Lo que está significando la presencia de cantidades relativamente importantes (normalmente mayores del 5%) de tamaños más finos que el medio (limo). En otras palabras, el limo, tamaño medio predominante de la zona interna, está acompañado de cantidades importantes de arcilla. B.- Caracterización química de los sedimentos Materia orgánica total (MOT) El ciclo estacional de la distribución de la concentración de MOT (Figura 27) presenta una gran amplitud, con valores máximos en invierno (14,24 %) y mínimos (0,59%) en primavera (Tabla 5). Considerando el valor medio, se observa una disminución de la concentración de MOT de primavera a verano (de 7,34 % a 6,71 %), con un leve incremento en otoño (7,42 %) y un aumento significativo en invierno (10,00 %). En todos los períodos de estudio se observaron los 53 valores máximos (superiores a 12 %) en el sector central, más profundo del golfo de sentido SWNE y los valores mínimos hacia la costa, principalmente en el sector costero oeste y en los extremos del golfo. El análisis estadístico estacional (Tabla 5, Figura 38) indicó diferencias altamente significativas (P < 0,01) entre invierno y primavera, invierno y verano, y entre invierno y otoño. Carbono orgánico total (COT) La distribución horizontal de la concentración de COT expresada en porcentaje (Figura 29) permite observar, desde el punto de vista estacional (considerando los valores medios), los registros máximos en invierno y en verano (2,03 y 2,02 %, respectivamente) y los mínimos, en primavera y otoño (1,56 y 1,71 %, respectivamente) (Tabla 5). En todos los meses de estudio, los valores máximos se localizaron en el sector central, más profundo del golfo de sentido SW-NE y los valores mínimos hacia la costa, principalmente en el sector costero oeste y en los extremos del golfo. El análisis estadístico estacional (Tabla 5, Figura 28) no indicó diferencias significativas entre los períodos de estudio. Nitrógeno total (NT) El ciclo estacional de la distribución de la concentración de NT (Figura 30) presenta valores máximos en invierno (0,77 %) y mínimos (0,01%) en verano. Considerando el valor medio para todo el golfo, se observa una disminución de la concentración de NT de primavera a verano (0,15 a 0,10%), un leve incremento en otoño (0,16 %) y un aumento significativo en invierno (0,33 %) (Tabla 5). En todos los meses de estudio se observaron los valores máximos en el sector central, más profundo del golfo de sentido SW-NE y los valores mínimos hacia la costa, principalmente en el sector costero oeste y en los extremos del golfo. El análisis estadístico estacional (Tabla 5, Figura 28) indicó diferencias altamente significativas (P < 0,01) entre invierno y primavera, invierno y verano, y entre invierno y otoño. Relación C:N (C:N) En los sedimentos superficiales del Golfo San Jorge, los valores de la relación C:N oscilaron entre 2,41 y 69,48. Desde el punto de vista estacional, considerando los valores medios para todo el golfo, se puede decir que la misma, es mínima en invierno (7,43) y que aumenta a partir de primavera (10,67), registrándose un incremento significativo de primavera a verano (23,75) (Tabla 5). La distribución espacial de la variable durante los períodos de estudio no define un claro patrón (Figura 31). Se destacan los valores de la relación C:N inferiores a 10, 54 concentrados en núcleos en el sector central, más profundo del golfo de sentido SW-NE en otoño e invierno; mientras que en primavera, los valores inferiores a 10, se registran en el sector sur, con un gradiente positivo de este a oeste. En verano los valores de la relación C:N, son superiores a 11,45, y se registran valores extremos (entre 30,00 y 69,48) en el sector sudeste del golfo. El análisis estadístico estacional (Tabla 5, Figura 28) indicó diferencias altamente significativas (P < 0,01) entre invierno y primavera, invierno y verano, invierno y otoño; y entre verano y primavera y verano y otoño. Clorofila a (Cl a (S)) El ciclo estacional de la distribución de la concentración de clorofila a en sedimentos (Figura 32) presenta valores máximos en invierno (5,02 µg/g) y mínimos (0,01µg/g) en primavera. El valor medio aumenta de primavera a invierno (de 0,26 a 1,54 µg/g), siendo significativo el incremento de invierno. En otoño e invierno los valores máximos se localizaron en núcleos; mientras que en verano, en el sector costero oeste. En primavera, la distribución espacial de los valores se presentó más uniforme. El análisis estadístico estacional indicó diferencias altamente significativas (P < 0,01) entre invierno y primavera, invierno y verano y entre invierno y otoño (Tabla 5, Figura 28). Feopigmentos (Feop (S)) La variación estacional de feopigmentos (Figura 33), muestra los valores máximos en invierno (95,78 µg/g) y los mínimos en otoño (0,06 µg/g). El valor medio aumenta de primavera a invierno (de 11,86 a 24,77 µg/g), con un descenso no significativo en otoño y un incremento significativo en invierno. En relación a la distribución horizontal de este parámetro, se observa que en general los valores máximos se ubican en el sector central del golfo principalmente hacia la costa oeste. El análisis estadístico estacional indicó diferencias altamente significativas (P < 0,01) entre invierno y primavera, invierno y verano, y entre invierno y otoño (Tabla 5, Figura 28). 3.1.1.3.- Clasificación y ordenación de las variables ambientales y las estaciones Clasificación Los análisis de agrupamiento estacionales de las 33 variables físico-químicas (Figura 34) revela la existencia de dos asociaciones importantes (grupos 1 y 2). En primavera, verano y otoño, el grupo 1 esta definido por una granulometría de gravas a arenas finas (Φ -2 a Φ 3), la 55 concentración de carbonatos en sedimentos, la temperatura, la concentración de oxígeno y la concentración de clorofila a en agua de fondo. El grupo 2, se define por una granulometría de limo grueso a arcilla muy fina (Φ 4 a Φ 10), la concentración de MOT, COT, NT, clorofila a y feopigmentos en los sedimentos, la salinidad y densidad del agua de fondo y la profundidad de las estaciones. En invierno se mantienen los grupos mencionados con la diferencia que las variables temperatura, concentración de oxígeno y de clorofila a en agua de fondo del grupo 1, se integran al grupo 2. Las variables: relación C:N, y arenas muy finas (Φ 3,5 y Φ 3,9) se relacionan en forma indistinta a uno u otro grupo. Los análisis de agrupamiento estacionales de los sitios muestreados (Figure 35) definen tres agrupaciones importantes. La agrupación 1, integrada por la estaciones ubicadas en el interior del golfo, la agrupación 2 por aquellas ubicadas próximas a los extremos norte y sur, mientras que la agrupación 3 por las estaciones situadas en la zona litoral y en el sector sudeste del golfo. Se observa que la agrupación 3 se presenta más afín a la agrupación 1 que a la 2. Ordenación El ACP define para el primer componente que es el que tiene la varianza más alta (primavera: 36,91 %, verano: 51,54: otoño: 39,92 % e invierno: 41,73%) y por lo tanto la mayor capacidad explicativa de los datos, un contraste entre las variables con signo negativo: gravas, arenas muy gruesas, arenas gruesas, arenas medianas, arenas finas (Φ -2, -1,5, -0,5, 0, 0,5, 1, 1,5, 2, 2,5), concentración de carbonatos, temperatura y concentración de oxígeno del agua de fondo; y las variables con signo positivo: limo fino, limo muy fino, arcilla mediana, arcilla fina, arcilla muy fina (Φ 6, 7, 8, 9, 10), concentración de MOT, COT, NT y feopigmentos en sedimentos, salinidad y densidad del agua de fondo y profundidad de las estaciones. En el segundo componente, que explica entre un 13,24% y un 14,99% de la varianza, se destacan las variables arenas muy finas (Φ 3,5 y 3,9) con valores negativos en primavera, otoño e invierno y valores positivos en verano. Mientras que en el tercer componente se observa una bipolaridad entre las variables Φ –1,5, -0,5, 0 y la variable Φ 2,5 en primavera; entre las variables Φ 0 y Φ 2,5 en otoño; y entre las variables Φ 7, 9 y 10 y las variables densidad, concentración de oxígeno y de clorofila a en agua de fondo, en invierno (Tabla 8). La ordenación de las variables físicas y químicas de los diferentes períodos de estudio, en el primer plano principal se presenta en la figura 36. La ordenación de las estaciones de muestreo (Figura 37) revela en los períodos de estudio, tres agrupaciones asociativas. La agrupación 1 está formada por las estaciones ubicadas en el centro del golfo, la agrupación 2 por las estaciones próximas a los Cabos Tres Puntas y Dos 56 Bahías y la agrupación 3, por las estaciones costeras y las del sector sudeste, sobre el accidente topográfico conocido como murallón o pared. Los análisis estadísticos (análisis de agrupamiento y análisis de componentes principales) han permitido identificar para el Golfo San Jorge tres sectores con características particulares (Figura 38), correspondientes a las agrupaciones de estaciones de muestreo 1, 2 y 3. El Sector 1 presenta profundidades superiores a los 80 m y sedimentos superficiales con fracciones granulométricas finas limo grueso a arcilla muy fina (valor medio de 96,42 %) y elevadas concentraciones de MOT (5,38 % a 14,24 %), COT (1,31 % a 3,98 %), NT (0,10 % a 0,77 %) y feopigmentos (1,28 a 95,78 µg/g), oscilando los valores de la relación C:N entre 2,76 y 29,59 y los de concentración de oxígeno en agua de fondo entre 1,82 a 6,70 ml O2/l. Los valores medios registrados de MOT, COT, NT, clorofila a, feopigmentos y de la relación C:N en los sedimentos, fueron en primavera de 9,82 %, 2,17 %, 0,21 %, 0,29 µg/g, 15,85 µg/g y 10,61, respectivamente; en verano de 8,92 %, 2,74 %, 0,14 %, 0,56 µg/g, 15,47 µg/g y 20,19; en otoño de 9,66 %, 2,10 %, 0,21 %, 0,68 µg/g, 9,24 µg/g y 9,96; y en invierno de 11,69 %, 2,35 %, 0,40 %, 1,78 µg/g, 30,28 µg/g y 7,13. Considerando la concentración de clorofila a en agua superficial y en agua de fondo, la misma presentó en primavera, valores medios de 0,57 mg/m3 y 0,38 mg/m3, respectivamente; en verano de 0,30 mg/m3 y 0,40 mg/m3; en otoño de 1,08 mg/m3 y 0,26 mg/m3; y en invierno de 0,62 mg/m3 y 1,03 mg/m3. Las variables oceanográficas analizadas indican para el sector, una estratificación de la columna de agua de primavera a otoño y una homogenización de la misma en invierno. El Sector 2, que comprende las zonas próximas a los extremos del golfo (Cabos Tres Puntas y Dos Bahías) presenta profundidades entre 36 y 53 m y sedimentos superficiales con fracciones granulométricas gruesas gravas (valor medio de 29,39 %) y arenas muy gruesas a finas (valor medio de 41,03 %), así como, bajas concentraciones de MOT (0,96 % a 7,96 %), COT (0,32 % a 2,53 %), NT (0,01 % a 0,32 %) y feopigmentos (0,06 µg/g a 23,04 µg/g), con valores de la relación C:N entre 6,03 y 69,48 y valores de concentración de oxígeno en el agua de fondo superiores a 6,00 ml O2/l. Los valores medios registrados de MOT, COT, NT, clorofila a, feopigmentos y de la relación C:N en los sedimentos fueron en primavera de 3,73 %, 0,70 %, 0,13 %, 0,53 µg/g, 3,64 µg/g y 7,29, respectivamente; en verano de 1,08 %, 0,46 %, 0,01 %, 0,19 µg/g, 2,29 µg/g y 61,32; en otoño de 1,28 %, 0,83 %, 0,02 %, 0, 06 µg/g, 0,26 µg/g y 47,11; y en invierno de 6,57 %, 1,18 %, 0,14 %, 0,70 µg/g, 8,17 µg/g y 8,12. Los registros de clorofila a fueron casi homogéneos de superficie a fondo, siendo los valores medios de 0,86 mg/m3 en primavera, de 1,72 mg/m3 en verano, de 0,82 mg/m3 en otoño y de 0,65 mg/m3 en invierno. Desde el punto de vista oceanográfico, se observa la ausencia de una estatificación en la columna de 57 agua. El Sector 3, que comprende la zona costera y el sudeste del golfo, presenta profundidades entre 21 y 91 m y sedimentos superficiales con fracciones granulométricas de tamaño intermedio principalmente arenas muy finas (valor medio de 20,69 %) y limos (valor medio de 55,74 %) así como moderadas concentraciones de MOT (0,59 % a 10,81 %), COT (0,43 % a 1,31 %), NT (0,04 % a 0,21 %) y feopigmentos (0,34 a 34,06 µg/g), con valores de la relación C:N entre 7,19 y 28,98 y de concentración de oxígeno en agua de fondo entre 3,20 y 6,82 ml O2/l. Los valores medios registrados de MOT, COT, NT, clorofila a, feopigmentos y de la relación C:N en los sedimentos, fueron en primavera de 5,98 %, 1,22 %, 0,10 %, 0,25 µg/g, 10,80 µg/g y 12,25, respectivamente; en verano de 4,51 %, 1,17%, 0,07%, 0,32 µg/g, 9,15 µg/g y 17,17; en otoño de 5,26 %, 1,31 %, 0,10%, 0,35 µg/g, 6,60 µg/g y 13,80; y en invierno de 6,70 %, 1,11 %, 0,12 %, 1,13 µg/g, 14,31 µg/g y 9,16. La concentración de clorofila a en agua superficial y en agua de fondo, presentó valores medios en primavera de 0,42 mg/m3 y 0,26 mg/m3, respectivamente; en verano de 0,66 mg/m3 y 0,40 mg/m3; en otoño de 1,12 mg/m3 y 0,61 mg/m3 ; y en invierno de 0,63 mg/m3 y 0,66 mg/m3 . Desde el punto de vista oceanográfico se observa en el sector, una estratificación de la columna de agua de primavera a otoño y una homogenización de la misma en invierno, excepto en aquellas estaciones del sudeste del golfo más próximas a la costa con profundidades entre 21 y 58 m. En la tabla 9 se presentan de las variables analizadas los valores estacionales: máximo, mínimo, promedio y desviación estándar. 3.1.2.- CARACTERIZACIÓN BIOLÓGICA DEL SISTEMA BENTÓNICO 3.1.2.1.- Análisis faunístico El análisis de los cuatro grupos faunísticos más representativos del Golfo San Jorge: Equinodermos, Moluscos, Crustáceos y Anélidos Poliquetos, fue efectuado según información de 36 estaciones de la campaña realizada en otoño de 2000. Se registró un total de 40.898 individuos, representados en 43 taxa los cuales fueron identificados 36 a nivel específico y 7 a nivel genérico. Los Equinodermos, estuvieron representados con 1 especie de asteroideo, 1 especie de ofuiroideo, 4 especies de equinoideos y 1 especie de holoturoideo, sumando un total de 136, 4.076, 11.970 y 1 individuos, respectivamente; lo que representa el 0,33 %, 9,97 %, 29,32 % y 0,002 % de la fauna total. Los Moluscos estuvieron representados con 4 especies de gasterópodos, 3 especies de cefalópodos y 8 especies de bivalvos, sumando un total de 68, 37 y 14.324 individuos; lo que representa el 0,20 %, 0,09 % y 35,02 %, respectivamente, del total de la fauna. Con respecto a los Crustáceos, los mismos estuvieron representados con 16 especies 58 sumando un total de 9.151 individuos lo que representa el 22,37 % de la fauna total. Los Anélidos estuvieron representados con cinco especies de poliquetos sumando un total de 1.113 individuos lo que representa el 2,72 % del total de la fauna (Tabla 10, Láminas I, II, III y IV). A continuación se presenta el listado de taxa considerados en este análisis: LISTADO FAUNISTICO Phylum Annelida Clase Polychaeta Orden Phyllodocida Familia Sigalionidae Leanira quatrefagesi Orden Capitellida Familia Maldanidae Asychis amphiglypta Orden Eunicida Superfamilia Eunicea Familia Eunicidae Eunice magellanica Familia Lumbrineridae Lumbrinereis sp Orden Terebellida Familia Pectinariidae Cistenides ehlersi Phylum Mollusca Clase Gastropoda Subclase Prosobranchia Orden Archaeogastropoda Superfamilia Trochacea Familia Trochidae Calliostoma modestulum Photinula blackei Superfamilia Naticoidea Familia Naticidae Falsilunatia soluta Subclase Heterobranchia Orden Nudibranchia Suborden Doridoidea 59 Superfamilia Eudoridoidea Familia Discodorididae Anisodoris sp Clase Cephalopoda Subclase Coleoidea Orden Sepiida Suborden Sepiina Familia Sepiolidae Semirossia tenera Orden Teuthida Suborden Myopsida Familia Loliginidae Loligo gahi Orden Octópoda Suborden Incirrata Superfamilia Octopodoidea Familia Octopodidae Octopus tehuelchus Clase Bivalvia Subclase Protobranchia Orden Solemyoida Superfamilia Nuculoidea Familia Nuculidae Nucula puelcha Superfamilia Nuculanoidea Familia Nuculanidae Nuculana sulculata Familia Malletidae Malletia cumingii Subclase FTeromorpha Orden Mytiloida Familia Mytilidae Mytilus platensis Orden Limoidea Familia Limoidea Limatula pigmaea Orden Ostreoida Suborden Pectinina 60 Familia Pectinidae Zygoclamys patagonicus Subclase Heterodonta Orden Veneroida Superfamilia Veneroidea Familia Veneridae Pitar rostratus Subclase Anomalodesmata Orden Pholadomyoida Superfamilia Pandoroidea Familia Pandoridae Kennerleya patagonica Phylum Arthropoda Superclase Crustacea Clase Malacostraca Subclase Hoplocarida Orden Stomatopoda Suborden Unipeltata Superfamilia Squilloidea Familia Squillidae Pterygosquilla armata armata Subclase Peracarida Orden Isopoda Suborden Flabellifera Familia Cirolanidae Cirolana sp Familia Serolidae Serolis schytei Familia Sphaeromatidae Sphaeroma sp Suborden Valvífera Familia Arcturidae Antarcturus sp Orden Amphipoda Suborden Gammaridea Familia Gammaridae Gammarus sp Subclase Eumalacostraca Superorden Eucarida 61 Orden Decapoda Suborden Dendrobranchiata Superfamilia Sergestoidea Familia Sergestidae Peisos petrunkevitchi Suborden Pleocyemata Infraorden Caridea Superfamilia Alpheoidea Familia Alpheidae Alpheus puapeba Superfamilia Pandaloidea Familia Pandalidae Austropandalus grayi Superfamilia Crangonoidea Familia Crangonidae Pontocaris boschii Infraorden Thalassinidae Superfamilia Thalassinoidea Familia Callianassidae Callianassa brachyophthalma Infraorden Anomura Superfamilia Paguroidea Familia Lithodidae Lithodes santolla Superfamilia Galatheoidea Familia Galatheidae Munina subrugosa Infraorden Brachyura Superfamilia Majoidea Familia Majidae Eurypodius latreillei Leurocyclus tuberculosus Superfamilia Cancroidea Familia Atelecyclidae Peltarion spinosulum 62 Phylum Echinodermata Clase Asteroidea Orden Forcipulata Familia Asteriinae Diplasterias brandti Clase Ophiuroidea Orden Ophiurida Familia Ophiuridae Ophiura sp Clase Echinoidea Orden Cidaroidea Familia Cidaridae Austrocidaris canaliculata Orden Arbacioida Familia Arbaciidae Arbacia dufresnii Orden Temnopleuroida Familia Temnopleuridae Pseudechinus magellanicus Orden Spatangoida Familia Schizasteridae Trypilaster philippii Clase Holothuroidea Orden Dendrochirotida Familia Cucumariidae Hemiodema spectabilis En la tabla 10 se presenta de cada especie, el número de individuos y los valores de densidad, abundancia relativa (AR), frecuencia de aparición (FA) e Indice de Importancia Relativa (IR). Analizando la frecuencia de aparición de los grupos considerados se observa el valor máximo para los Crustáceos (97,22 %), seguido por los Equinodermos (86,11 %), Moluscos (77,78 %) y Poliquetos (75 %). En el grupo Crustáceos se encuentran las especies “constantes” del Golfo San Jorge, ellas son Austropandalus grayi y Munida subrugosa. A la vez se observa en este grupo, 3 especies “muy comunes” Pterygosquilla armata armata, Callianassa brachyophthalma y Peltarion spinosulum y 1 especie “común”, Peisos petrunkevitchi. Mientras 63 que las restantes especies de crustáceos se ubican en su mayoría en la categoría de “raras” u ocasionales como Gammarus sp., Sphaeroma sp. Eurypodius latreillei, entre otros. Los siguientes grupos de importancia según la frecuencia de aparición de sus taxa son los equinodermos, con una especies “muy común” Pseudechinus magellanicus, ubicándose las restantes especies en la categoría “poco comunes”. Los Moluscos presentan 4 especies “comunes” Nucula puelcha, Nuculana sulculata , Kennerleya patagonica y Semirossia tenera y los Poliquetos 3 especies “comunes” Cistenides ehlersi, Leanira quatrefagesi y Asychis amphiglypta. Considerando el Indice de importancia relativa (IR) de los 4 grupos analizados, los Equinodermos presentan un valor de 41,11 seguidos por los Moluscos, Crustáceos y Poliquetos con valores de 27,15, 14,10 y 2,13, respectivamente. Las especies de mayor IR en los Equinodermos son Pseudechinus magellanicus y Ophyura sp, en los Moluscos Nuculana sulculata, Nucula puelcha y Kennerleya patagonica; en los Crustáceos, Munida subrugosa y Austropandalus grayi y en los Poliquetos, Cistenides ehlersi y Asychis amphiglypta. Parámetros poblacionales Densidad y abundancia relativa En la Figura 39 y en la tabla 11 se ilustran de los grupos taxonómicos considerados, las densidades faunísticas (ind./0,00025 mn2) y las abundancias relativas correspondientes a cada estación de muestreo de los fondos del Golfo San Jorge. Las mayores densidades se localizan en la zona sudeste del área de estudio y corresponden a concentraciones de los moluscos bivalvos Nuculana sulculata (1.548 - 12.457 ind./0,00025 mn2), Nucula puelcha (513 - 561 ind./0,00025 mn2) y Kennerleya patagonica (311 - 2194 ind./0,00025 mn2), y de los equinodermos Ophiura sp (259 - 20.477 ind./0,00025 mn2 ) y Pseudechinus magellanicus (4.543 - 9.851 ind./0,00025 mn2) (estaciones 252, 259 y 258). Los valores mínimos de densidad (114 - 922 ind./0,00025 mn2) están presentes en las estaciones del sur y centro del golfo (estaciones 244, 246, 277, 247, 256, 278, 253, 276, 269 y 268). Las densidades en función de la abundancia de los grupos faunísticos se presentan en la Figura 40. El grupo faunístico que presenta las mayores densidades en toda el área de estudio es el de los equinodermos, seguido por el de los moluscos; con dominancias o abundancia relativas respecto al total de 47,74% y 34,91% respectivamente. Las dominancias han sido registradas en los equinodermos en su mayor parte en las especies Pseudechinus magellanicus y Ophiura sp y en los moluscos, en la especie Nuculana sulculata. 64 El tercer grupo en importancia numérica son los crustáceos con valores de densidad entre 21,56 y 2.855,74 ind./0,00025 mn2 y con dominancias de 14,51 % respecto al total; las especies responsables de los máximos de densidad son Munida subrugosa, Austropandalus grayi y Pterygosquilla armata armata. Los poliquetos presentan densidades entre 1,44 y 1.918,82 ind./0,00025 mn2, siendo las especies con mayores densidades Cistenides ehlersi y Asychis amphiglypta. Riqueza específica (S) En la figura 41 se observa un elevado número de especies, que oscila entre 10 y 17 en el sector sudoeste costero del área de estudio (estaciones 244, 271, 243, 261 y 270). También se observa una riqueza específica de 12 en una estación del norte del golfo (estación 278) y 16 en una estación del extremo sur del golfo (estación 250). El menor número de especies se observa hacia la región central norte del golfo. En cuanto a las dominancias de los grupos faunísticos considerados (Figura 42), los crustáceos seguidos por los moluscos son los de mayor riqueza específica en el área de estudio. Diversidad (H’) y Uniformidad (J’) Se utilizó la función de información de Shannon-Wiener H’, dado que es sensible tanto al número de especies presentes como a la repartición de los individuos entre las especies y además presenta la característica crítica de un buen índice de diversidad, que consiste en ser relativamente independiente del tamaño de muestras (Sanders, 1958). Los valores de diversidad específica obtenidos a partir del índice de Shannon para la abundancia de especies consideradas y su promedio de distribución en el Golfo san Jorge se presenta en la tabla 11 y en la figura 43. Los máximos valores de H’ se observan en las estaciones 278 y 277 del norte del golfo (2,02 y 1,52, respectivamente) así como en el sector sudoeste costero del área de estudio (estaciones 243, 244, 246, 261, 271 269) (de 1,82 a 1,17). Los valores mínimos de H’ se presentan en la zona sudeste del área de estudio donde se registra un elevado número de individuos de Nuculana sulculata, Nucula puelcha, Kennerleya patagonica y de los equinodermos Pseudechinus magellanicus y Ophiura sp. Una tendencia similar a la de la diversidad ocurre con la Uniformidad (J’), cuyos valores se presentan en la tabla 11. Los máximos valores aparecen en las estaciones 246 y 243 del sector sudoeste costero del área de estudio así como en las estaciones 276, 277 y 278 del norte del golfo. 3.1.2.2.- Caracterización biocenótica. Variabilidad espacial. 65 En la Figura 44 se representa gráficamente el Índice de Importancia Relativa (IR) de los grupos considerados: Equinodermos, Crustáceos, Moluscos y Poliquetos y en la Figura 45, el de las especies “constantes”, “muy comunes” y “comunes” en función de los tipos sedimentarios definidos para el golfo. La tabla 12 presenta el IR de los grupos y la tabla 13 el de las especies. Considerando los ambientes sedimentarios y las asociaciones presentes en ellas, se observa que en los fondos de granulometría fina del tipo limo arenoso y limo arcilloso las asociaciones faunísticas están caracterizadas por las mismas especies Leanira quatrefagesi, Asychis amphyglipta, Cistenides ehlersi, Nuculana sulculata, Nucula puelcha, Kennerleya patagonica, Pterygosquilla armata armata, Austropandalus grayi Callianassa brachyophthalma, Munida subrugosa y Pseudechinus magellanicus, siendo diferentes las especies dominantes. En el tipo sedimentario limo arenoso domina Nuculana sulculata seguida por Nucula puelcha y Kennerleya patagonica, mientras que en tipo limo arcilloso domina Psuedechinus magellanicus seguido por Nuculana sulculata y Munida subrugosa . Respecto a los fondos de granulometría gruesa los tipos grava arenosa y arena gravosa presentan una asociación faunística integrada por Nuculana sulculata, Nucula puelcha, Kennerleya patagonica, Pterygosquilla armata armata y Munida subrugosa con dominio de Nuculana sulculata con valores sensiblemente menores a los registrados en los fondos limo arenosos y limo arcillosos (Tabla 13). El tipo sedimentario grava presenta una asociación integrada fundamentalmente por Leanira quatrefagesi, Semirossia tenera, Peisos petrunkevitchi, Austropandalus grayi, Munida subrugosa y Pseudechinus magellanicus, con el dominio de este último. 3.1.2.3.- Clasificación y ordenación de las especies Clasificación Los análisis de agrupamiento de especies (Figura 46) revela la existencia de dos asociaciones importantes (grupos 1 y 2). El grupo 1 que esta caracterizado por los Equinodermos Ophiura sp, Pseudechinus magellanicus y Trypilaster phylippii, los Moluscos Nucula puelcha, Nuculana sulculata, Malletia cumingii, Pitar rostratus y Kennerleya patagonica, los Crustáceos Pterygosquilla armata armata, Gammarus sp, Peisos petrunkevitchi, Austropandalus grayi, Callianassa brachyophthalma, Munida subrugosa y Peltarion spinosulum y los Poliquetos Leanira quatrefagesi, Asychis amphiglyta, Lumbrinereis sp y Cistenides ehlersi y el grupo 2, por los Equinodermos Diplasterias brandti, Austrocidaris canaliculata, Arbacia dufresnii y 66 Hemiodema spectabilis, los Moluscos Calliostoma modestulum, Photinula blackei, Semirossia tenera, Octopus tehuelchus, Mytilus platensis, Limatula pigmaea y Zygoclamys patagonicus, los Crustáceos Cirolana sp, Serolis schijtei, Sphaeroma sp, Antarcturus sp, Alpheus puapeba, Pontocaris boschi y Lithodes santolla y el Poliqueto Eunice magellanica. Los análisis de agrupamiento de estaciones (Figure 47) definen 3 agrupaciones importantes. La agrupación 1, integrada por la estaciones ubicadas en el interior del golfo, la agrupación 2 por aquellas ubicadas en la zona litoral (costa y extremo este correspondiente al Cabo Tres Puntas) y el sector sudeste del umbral del golfo San Jorge y la agrupación 3, integrada por estaciones aisladas, ubicadas en el sudoeste y norte del golfo y que se integran a ambos grupos con bajos valores de similitud. Ordenación La tabla 14 muestra los autovalores, la inercia y la inercia acumulada para las tres primeras dimensiones. Las dos primeras dimensiones acumularon un 50,78 % de la inercia total y por lo tanto son los que tienen la mayor capacidad explicativa de los datos. La tercera dimensión que explica un 11,96 % de la varianza total no es considerada en la representación de los datos por no aportar información complementaria. En la Figura 48 aparece la disposición de las especies y estaciones respecto a las dimensiones 1 y 2. En la Figuras 48 y 49 A y B se observa que, dentro del gradiente de variación indicado por las dimensiones 1 y 2 en el plano definido por el extremo positivo del primer eje se localizan las especies (Pseudechinus magellanicus, Gammarus sp, Callianassa brachyophthalma, Munida subrugosa, Leanira quatrefagesi, Peisos petrunkevitchi, Octopus tehuelchus, Anisodoris sp y Eurypodius latreillei) presentes en las estaciones ubicadas en el interior del golfo, claramente enfrentadas a otro tipo de especies (Ophiura sp, Kennerleya patagonica, Nucula puelcha, Nuculana sulculata, Falsilunatia soluta, Pitar rostratus, Lumbrinereis sp y Asychis amphiglypta) localizadas hacia la parte negativa del primer eje, que han aparecido en estaciones ubicadas en la zona litoral (costa y extremo este correspondiente al Cabo Tres Puntas) y en el sector sudeste del umbral del Golfo San Jorge. El segundo eje se encuentra asociado negativamente con las especies (Cirolana sp, Calliostoma modestulum, Austropandalus grayi, Photinula blackei, Lithodes santolla, Zygochlamys patagonicus, Serolis schytei, Diplasterias brandti, Austrocidaris canaliculata, Sphaeroma sp, Eunice magellanica, Malletia cumingii, Mytilus platensis, Pterygosquilla armata armata, Antarcturus sp, Alphues puapeba, Pontocaris boschii, Limatula pigmaea, Hemiodema spectabilis, Trypilaster phylippi, Arbacia dufresnii y Loligo gahi) distribuidas principalmente en 67 estaciones aisladas ubicadas en el sudoeste y norte del golfo y positivamente por la especie Cystenides ehlersi presente en estaciones tanto del sector interno como de la zona litoral y del sector sudeste del umbral del Golfo San Jorge. En la dimensión 3 se ubican las especies Leurocyclus tuberculosus, Peltarion spinosulum y Semirossia tenera, presentes en estaciones tanto del sector interno como de la zona litoral y del sector sudeste del umbral del Golfo San Jorge. De manera general, se define en el área de estudio considerando la distribución de las especies una disposición espacial de las estaciones desde la zona más interna y profunda del golfo (1) hacia la zona litoral y el sector sudeste del umbral de golfo (2) como así también hacia el sudoeste y norte del golfo (3). El análisis de los parámetros poblacionales y los análisis multivariante (análisis de agrupamiento y análisis de correspondencia) han permitido identificar para el Golfo San Jorge tres sectores con características particulares (Figura 50), correspondientes a las agrupaciones de estaciones de muestreo 1, 2 y 3. El Sector 1 que es el más extenso y se ubica en el interior del golfo presenta densidades entre 170 y 10.321 ind./0,00025 mn2, una riqueza específica entre 5 y 12 especies, siendo el valor promedio de diversidad y uniformidad de 0,78 y 0,38, respectivamente. El grupo con mayor IR es el de los Equinodermos (75,35) seguido por el de los Crustáceos (17,73) y los Poliquetos (2,03). Considerando las especies con mayor IR, en el grupo Equinodermos se destaca el equinoideo Pseudechinus magellanicus (70,83), en los Crustáceos Munida subrugosa (13,13), Austropandalus grayi (0,93) y Callianassa brachiophthalma (0,81) y en los Poliquetos la especie Cystenides ehlersi (1,01) (Tablas 15 y 16). El Sector 2 comprende la zona litoral (costa y extremo sudeste correspondiente al Cabo Tres Puntas) y el sector sudeste del umbral del golfo San Jorge. Este sector presenta densidades entre 114 y 36.444 ind./0,00025 mn2, una riqueza específica entre 6 y 17 especies, siendo el valor promedio de diversidad y uniformidad de 1,14 y 0,50, respectivamente. El grupo con mayor IR es el de los Moluscos (60,56) seguido por el de los Equinodermos (20,70) y los Crustáceos (6,21). Considerando las especies con mayor IR, en el grupo Molusco se destacan los bivalvos Nuculana sulculata (52,52), Nucula puelcha (4,47) y Kennerleya patagonica (3,19), en los Equinodermos el ofuiroideo Ophuira sp, y en los Crustáceos Munida subrugosa (3,46) y Pterygosquilla armata armata (1,10) (Tablas 15 y 16). El Sector 3 comprende estaciones aisladas, ubicadas en el sudoeste y norte del golfo. Este sector presenta densidades entre 1.740 y 3.983 ind./0,00025 mn2, una riqueza específica entre 10 68 y 16 especies, siendo el valor promedio de diversidad y uniformidad de 1,34 y 0,51, respectivamente. El grupo con mayor IR es el de los Crustáceos (82,35) seguido por el de los Equinodermos (17,38) y los Moluscos (10,85). Considerando las especies con mayor IR, en el grupo Crustáceos se destacan Austropandalus grayi (55,81), Munida subrugosa (14,32) y Serolis schytei (1,06), en los Equinodermos el asteroideo Diplasterias brandti (13,47) y en los Moluscos Mytilus platensis (2,07), Calliostoma modestulum (1,25) y Photinula blackei (1,18) (Tablas 15 y 16). 3.2.- PRINCIPALES ÁREAS DE CONCENTRACIÓN DEL RECURSO LANGOSTINO EN EL GOLFO SAN JORGE. OTOÑO DE 2001 – VERANO DE 2002. Segundo período de estudio (Figura 9). 3.2.1.- CARACTERIZACIÓN DE LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO. 3.2.1.1.- Variables hidrográficas del agua de fondo Temperatura (T) El ciclo estacional de la distribución de la temperatura del agua de fondo presenta una elevada amplitud, con máximos valores en el verano (15,25 ºC) y mínimos en el invierno (5,83 ºC). En otoño, en primavera y en verano se observan gradientes térmicos horizontales entre los 46º S y 47º S de 4,00 ºC, 3,25 ºC y 7,00 ºC, respectivamente; lo que correspondería a 0,067 ºC/mn, 0,054 ºC/mn y 0,117 ºC/mn. Los valores mínimos se registran en el sector central más profundo del golfo de sentido SW-NE y los máximos hacia la costa. En el invierno se observa el comportamiento inverso (Figura 51) Un corte vertical de temperatura del Golfo San Jorge de sentido SW - NE (Figura 51) permite observar la presencia de una termoclina en primavera, cuyo gradiente se acentúa en verano a una profundidad de 40-50 m y disminuye en el otoño, para registrarse una total homogeneidad de la columna de agua durante el invierno (con valores costeros de 6,05 ºC y 8,00 ºC en la zona más profunda. La estratificación de la columna de agua, define una capa superficial homogénea de aproximadamente 10,49 ºC en otoño, 11,04 ºC en primavera y 14,32 ºC en verano, como así también una termoclina estacional y una capa de fondo con temperaturas que oscilan entre 8,19 ºC - 11,32 ºC en otoño, 8,00 ºC - 8,16 ºC en primavera y 8,85 ºC - 13,67 ºC en verano. 69 Las diferencias de temperatura observadas entre las estaciones fueron altamente significativas (P < 0,01) entre invierno y el resto de las estaciones y significativas (0,01 < P < 0,05) entre primavera y verano (Tabla 17, Figura 52). Salinidad (S) Los resultados indican que el ciclo estacional de la distribución de la salinidad del agua de fondo presenta escasa amplitud, con máximos valores en otoño (33,826 ups) y mínimos en invierno (33,057 ups) y primavera (33,220) (Tabla 17 , Figura 53). En los períodos analizados se observa la existencia de un gradiente horizontal entre los 46º S y 47º S. Los mismos fueron de 0,257 ups, 0,486 ups, 0,342 ups y 0,168 ups, para otoño, invierno, primavera y verano, respectivamente; lo que correspondería a 0,0043 ups/mn, 0,0081ups/mn, 0,0057 ups/mn y 0,0028 ups/mn. En el sector sur próximo a la costa, los perfiles estacionales de salinidad muestran salinidades inferiores a 33,40 ups. El análisis estadístico estacional indicó diferencias no significativas (P > 0,05) (Tabla 17, Figura 52). Densidad (D) Desde el punto de vista estacional, la distribución de la densidad del agua de fondo (Figuras 54) está caracterizada por valores máximos durante el invierno (26,134 kg/m3) y mínimos (24,708 kg/m3) durante el verano, observándose un descenso de los valores desde primavera hasta otoño, aumentando luego en invierno (Tabla 17). Los perfiles verticales de densidad (Figura 54) muestran una picnoclina en primavera, que se acentúa en el verano y se profundiza en otoño, con una homogeneidad total de la columna de agua en invierno. El análisis estadístico estacional indicó diferencias altamente significativas (P < 0.01) entre invierno y primavera e invierno y verano (Tabla 17, Figura 52). Concentración de oxígeno (O) La distribución horizontal de la concentración de oxígeno en agua de fondo (Figura 55) durante el período de estudio indica que los valores máximos se presentan en invierno (7,33 ml O2/l) y los mínimos en otoño (2,69 ml O2/l). En general se observa una disminución de los valores desde primavera hasta otoño y un aumento notorio en invierno (Tabla 17). En otoño, primavera y verano se observan gradientes 70 horizontales entre los 46º S y 47º S de 3,20 ml O2/l, 1,30 ml O2/l y 2,46 ml O2/l, respectivamente; lo que correspondería a 0,053 ml O2/l/mn, 0,022 ml O2/l/mn y 0,041 ml O2/l/mn. Los valores mínimos se registran en el sector central y profundo del golfo y los máximos en los sectores costeros de menor profundidad. En invierno el gradiente es de 0,79 ml O2/l (0,013 ml O2/l/mn), lo que indica una homogenización en la concentración de oxígeno en el agua de fondo con un valor medio del orden de 6,73 ml O2/l y un valor máximo de 7,33 ml O2/l en el extremo sudeste del golfo. La variabilidad estacional observada fue altamente significativa (P < 0.01) entre invierno y el resto de las estaciones y significativa (0,01 < P < 0,05) entre primavera y verano (Tabla 17, Figura 52). Concentración de clorofila a (Cl a (AF)) La concentración de clorofila a en el agua de fondo (Figura 56) presenta variaciones estacionales con valores máximos en invierno (4,40 mg/m3) y primavera (2,64 mg/m3). También, se observa una disminución de los valores medios desde la primavera hasta el otoño (de 0,58 a 0,28 mg/m3) y un aumento significativo en invierno (1,63 mg/m3). En los períodos analizados la distribución horizontal de clorofila a muestra las máximas concentraciones en el sector sur del golfo (1,26 mg/m3 en otoño, 4,40 mg/m3 en invierno, 2,64 mg/m3 en primavera y 2,92 mg/m3 en verano) y las mínimas hacia el sector central más profundo del golfo (0,03 mg/m3 en otoño, 0,74 mg/m3 en invierno, 0,03 mg/m3 en primavera y 0,03 mg/m3 en verano) . Las diferencia observadas fueron altamente significativas (P < 0,01) entre invierno y el resto de las estaciones. (Tabla 17, Figura 52). Los registros de concentración de clorofila a en agua superficial y en la capa de mezcla (Cucchi Colleoni & Carreto, 2002) muestran las máximas concentraciones en primavera (Tabla 17). El rango de valores para el agua superficial fue de 0,18 a 8,72 mg/m3 con un valor medio de 1,64 mg/m3 ; mientras que para la capa de mezcla, el rango fue de 0,36 a 11,66 mg/m3 con un valor medio de 3,33 mg/m3 . El análisis estadístico estacional (Tabla 17, Figura 52) indicó para el agua superficial diferencias significativas (0,01 < P < 0,05) entre primavera y el resto de las estaciones; y para la capa de mezcla, diferencias altamente significativas (P < 0,01) entre primavera y otoño, primavera y verano, invierno y otoño e invierno y verano. 3.2.1.2.- Variables sedimentológicas 71 Caracterización química de los sedimentos Materia orgánica total (MOT) El ciclo estacional de la concentración de MOT (Figura 57) presenta una gran amplitud (1,66 % a 10, 24%). La variación estacional de los valores medios muestra que los valores máximos se presentaron en otoño (5,86 %) y primavera (5,68 % )y el valor mínimo en invierno (5,13 %) (Tabla 18). En todos los períodos de estudio, los valores máximos (9,24 % en otoño, 9,03 % en invierno, 10,24 % en primavera y 9,59 % en verano) se observaron en el sector central más profundo del golfo y los valores mínimos en la costa, principalmente cerca del extremo sur (2,94 % en otoño, 1,66 % en invierno, 1,96 % en primavera y 1,91 % en verano) y de la boca o umbral del golfo (4,37 en otoño, 3,05 % en invierno, 3,47 % en primavera y 4,41 % en verano). El análisis estadístico estacional (Tabla 18, Figura 58) no indicó diferencias estacionales. Carbono orgánico total (COT) La distribución horizontal de los valores medios de la concentración de COT (Figura 59), muestra variaciones estacionales con un máximo en otoño (1,59 %) y un mínimo en invierno (1,11 %) (Tabla 18 ). En todos los períodos de estudio, excepto en otoño, los valores máximos (2,07 % en invierno, 2,16 % en primavera y 2,36 % en verano) se observaron en el sector central más profundo del golfo y los valores mínimos en la costa, principalmente hacia el cuadrante SE (0,09 % en invierno, 0,28 % en primavera y 0,29 % en verano) y en la boca o umbral del golfo (0,73 % en invierno, 0,85 % en primavera y 0,80 % en verano). En otoño los máximos valores (1,89 a 4,64 %) se presentaron en el sur del golfo. El análisis estadístico estacional (Tabla 18, Figura 58) no indicó diferencias significativas entre los períodos de estudio. Nitrógeno total (NT) El ciclo estacional de la distribución de la concentración de NT (Figura 60) presenta valores máximos (0,51 %) y mínimos (0,05 %) en primavera. Los valores medios de la concentración de NT presentan un incremento de invierno a verano (0,17 a 0,21 %) (Tabla 18). En el otoño, invierno y primavera los máximos valores (entre 0,20 y 0,41 % en otoño, 0,23 y 0,36 % en invierno y 0,24 a 0,51 % en primavera) se agruparon en forma de núcleos en el sector de mayores profundidades del sur del golfo, como así también en la sección norte del umbral del 72 golfo con valores de 0,37 % en otoño, 0,33% en invierno y 0,25 % en primavera. En verano se observó el valor máximo (0,51 %) en el norte del golfo, pero en general el patrón de distribución horizontal de los valores responde a un incremento de valores desde el cuadrante SE hacia el centro del golfo donde los valores alcanzan la magnitud de 0,26 %. El análisis estadístico estacional (Tabla 18, Figura 58) no indicó diferencias significativas entre los períodos de estudio. Relación C:N (C:N) En los sedimentos superficiales del Golfo San Jorge, los valores de la relación C:N variaron entre 1,20 y 20,13. Los valores medios de la relación C:N muestra variaciones estacionales con un máximo en otoño (8,09) y un mínimo en primavera (6,16) (Tabla 18). La distribución espacial de la variable durante los períodos de estudio no define un claro patrón (Figura 48). En el otoño, invierno y verano se destacan valores de la relación C:N superiores a 7, concentrados en núcleos en el sector sur del golfo; mientras que en primavera se registran valores inferiores a 7 en el sector sur, con un gradiente negativo hacia el interior del golfo, y valores superiores a 7 en el sector norte del golfo (Figura 61). El análisis estadístico estacional (Tabla 18, Figura 58) no indicó diferencias significativas entre los períodos de estudio. Fósforo total (FT) La distribución horizontal de los valores medios de la concentración de FT (Figura 62), muestra variaciones estacionales, con un máximo en otoño (0,062 %) y un mínimo en verano (0,040 %) (Tabla 18 ). En todos los períodos de estudio los valores máximos (0,060 a 0,071 % en otoño, 0,063 a 0,076 % en invierno, 0,037 a 0,058 % en primavera y 0,044 a 0,071 % en verano) se observaron en núcleos en el sector sur, como así también en la sección norte del umbral del golfo (0,072 % en otoño, 0,064 % en invierno, 0,056 % en primavera y 0,044 % en verano). El análisis estadístico estacional (Tabla 18, Figura 58) indicó diferencias altamente significativas (P < 0,01)entre otoño y primavera, otoño y verano, invierno y primavera e invierno y verano. Clorofila a (Cl a (S)) El ciclo estacional de la distribución de la concentración de clorofila a (Figura 63) presenta valores máximos en invierno (8,65 µg/g) y primavera (8,27 µg/g) y mínimos (0,09 µg/g) 73 en invierno. El valor medio aumenta de manera significativa de otoño a primavera (de 1,05 a 2,33 µg/g), para luego descender levemente en el verano (2,29 µg/g). Este descenso no fue significativo. En otoño e invierno los valores máximos se localizaron en el sector sur del golfo (1,16 a 1,79 µg/g en otoño y 1,44 a 8,65 µg/g en invierno), en primavera en el cuadrante SE (1,21 a 8,23 µg/g ); mientras que en el verano, en núcleos en la sección norte de la boca o umbral del golfo (1,73 a 7,25 µg/g ). El análisis estadístico estacional indicó diferencias significativas (0,01 < P < 0,05) entre invierno y primavera, invierno y verano y entre invierno y otoño (Tabla 18, Figura 58). Feopigmentos (Feop (S)) La distribución horizontal de los valores medios de la concentración de feopigmentos muestra variaciones estacionales (Figura 64), con un valor máximo en primavera (60,53 µg/g) y un mínimo en invierno (0,08 µg/g). El valor medio aumenta de otoño a primavera (de 24,22 a 28,08 µg/g), para luego descender en verano (18,32 µg/g). En relación a la distribución horizontal de los valores de feopigmentos, se observa que en general en todos los períodos de estudio los valores máximos se presentan en el sector central más profundo del golfo (22,59 a 40,99 µg/g en otoño, 15,27 a 33,39 µg/g en invierno, 23,67 a 60,53 µg/g en primavera y 15,77 a 34,57 µg/g en verano) y los valores mínimos en el extremo sur del golfo (10,90 µg/g en otoño, 0,08 µg/g en invierno, 24,03 µg/g en primavera y 9,68 µg/g en verano) y en la boca o umbral del golfo (13,66 µg/g en invierno, 15,99 µg/g en primavera y 9,42 µg/g en verano). El análisis estadístico estacional (Tabla 18, Figura 58) no indicó diferencias entre los períodos. 3.2.1.3.- CLASIFICACIÓN Y ORDENACIÓN DE LAS VARIABLES AMBIENTALES. Clasificación Los análisis de agrupamiento de las 13 variables físico-químicas para las estaciones analizadas (Figuras 65) revelan la existencia de 2 asociaciones importantes (grupos 1 y 2 ). El grupo 1 está caracterizado por las variables concentración de MOT, COT, NT y Feop (S) en sedimentos, salinidad y densidad del agua de fondo y profundidad de las estaciones. El grupo 2, asocia las variables temperatura, concentración de oxígeno y concentración de Cl a (AF) en agua 74 de fondo, integrándose a éste grupo la variable relación C:N en otoño, las variables FT y Cl a (S) en invierno y las variables relación C:N y Cl a (S) en la primavera. La clasificación de las estaciones se presenta gráficamente en la Figura 66. Se observa tres asociaciones de muestras ordenadas espacialmente y que corresponden en líneas generales a distintas zonas del golfo. Por un lado se separan las muestras ubicadas en la zona más interna y profunda del golfo (grupo 1, profundidades entre 68 m y 92 m); y por otro, las estaciones costeras del sur del golfo (grupo 2, profundidades entre 23 m y 66 m) y las estaciones situadas en la boca del Golfo San Jorge (grupo 3, profundidades entre 57 m y 93 m), incorporándose en la primavera y el verano al grupo 3 las estaciones ubicadas en el norte de la zona interna del golfo. Ordenación La ordenación de las variables ambientales se ilustra en la Figura 67, donde se presentan los ejes o componentes 1 y 2. La varianza total explicada por estos dos ejes en el análisis de componentes principales se observa en la Tabla 19. Para los períodos analizados excepto para el otoño de 2001, el primer componente que es el que tiene la varianza más alta (entre un 35,12 % y un 47,28 % de la varianza total) y por lo tanto la mayor capacidad explicativa de los datos, viene determinado por la fuerte carga positiva de las variables profundidad, salinidad, densidad, materia orgánica total, carbono orgánico total y nitrógeno total, frente a la carga negativa de las variables del agua de fondo temperatura, contenido de oxígeno y clorofila a . El segundo componente que explica entre un 16,70 % y un 23,92 % de la varianza, se relacionó positivamente en invierno de 2001 con la densidad; y en primavera de 2001con la concentración de oxígeno; mientras que en el verano de 2002 con NT y negativamente con la relación C:N en sedimentos. Este segundo factor de variación viene a incidir sobre la separación efectuada por el primer componente poniendo aún más en evidencia la importancia del componente sedimentario de origen orgánico en el análisis. Para otoño de 2001, el primer eje viene determinado por la fuerte carga positiva de las variables profundidad, salinidad, densidad y Feop (S) frente a la carga negativa de las variables del agua de fondo temperatura, contenido de oxígeno y clorofila a ; mientras que el segundo componente se relacionó positivamente con las variables MOT, COT, NT, FT y Cl a (S). La representación de las estaciones de muestreo teniendo en cuenta las variables medidas en cada una de ellas, en los dos primeros ejes (Figura 68), indica una disposición espacial de las mismas en función del primer factor de variación, desde la zona más interna y profunda del golfo (1) hacia la zona litoral del golfo (específicamente sur del golfo) (2) pasando por un sector de transición conformado por el sector de la boca del golfo en otoño, invierno de 2001 y por el sector de la boca y el sector costero norte en la primavera de 2001 y el verano de 2002 (3). Las 75 asociaciones se forman tanto en función de las características que presentan los sedimentos y el agua de fondo como de la ubicación o profundidad de las muestras en los sectores del golfo (interno, litoral, extremos del golfo) tal como se puede ver en el diagrama. Los análisis estadísticos de clasificación y ordenación han permitido identificar para el Golfo San Jorge tres sectores en el período comprendido entre el otoño de 2001 y el verano de 2002 con características particulares correspondientes a las agrupaciones de las estaciones de muestreo categorizadas como 1, 2 y 3 (Figuras 69). Las características que definen los sectores 1, 2 y 3 se presentan en las Tablas 20 y 21 . 3.3.- SUR DEL GOLFO SAN JORGE . AREA DONDE SE LOCALIZAN LAS MAYORES CONCENTRACIONES DE LANGOSTINO. INVIERNO DE 2003. (Tercer período de estudio, Figura 10). 3.3.1.- CARACTERIZACIÓN DE LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO. 3.3.1.1.- Variables hidrográficas del agua de fondo Temperatura (T) El rango de variación de la temperatura del agua de fondo fue de 8,39 °C a 9,76 ºC (Tabla 22 y 23). La distribución horizontal de la temperatura (Figura 70) presenta un gradiente latitudinal positivo en sentido norte entre los 46º 30’ S y 47 º 00’S de 0,89 ºC (0,0296 ºC/mn). En el sector costero sur, las isotermas se bifurcan en una rama costera oeste y otra hacia la plataforma. La distribución vertical de la temperatura (Figura 70) presenta una columna de agua prácticamente homogénea entre superficie y fondo. En la figura 10 se presenta la ubicación de la transección seleccionada para el registro del perfil de temperatura. Salinidad (S) La salinidad determinada en el área, estuvo comprendida entre 33,134 a 33,558 ups (Tablas 22 y 23). La distribución horizontal de la salinidad (Figura 71) siguió un patrón caracterizado por: 1) bajos valores en el sector costero sur con mínimos en el cuadrante SE (33,134 ups), 2) una prolongación de baja salinidad en sentido norte por el exterior del golfo en forma de lengua, 3) un incremento rápido de isohalinas desde el sector sur hacia el área central 76 con valores de hasta 33,558 ups y 4) un incremento de isohalinas desde el sector sur hacia el área costera oeste con valores de hasta 33,501 ups. La distribución en profundidad (Figura 71) denota ausencia de haloclina y una disminución de la salinidad desde la costa hacia el sector central del umbral del golfo con valores inferiores a 33,30 ups . En la figura 10 se presenta la ubicación de la transección utilizada para mostrar el perfil de salinidad. Densidad (D) La distribución horizontal de la densidad presenta un rango de variación estrecho comprendido entre 25,674 kg/m3 y 26,848 kg/m3 (Tablas 22 y 23). Las isolíneas (Figura 72) indican un patrón caracterizado por presentar valores crecientes desde el cuandrante SE hacia el interior y litoral costero oeste del golfo. En la figura 10 se presenta la ubicación de la transección utilizada para mostrar el perfil de densidad. Este perfil permite observar una disminución de la densidad desde la costa hacia el sector central del umbral del golfo (Figura 72). Concentración de oxígeno (O) El rango de valores determinado para esta variable fue de 1,30 ml O2/l a 6,27 ml O2/l (Tabla 22 y 23). La distribución horizontal de la concentración de oxígeno (Figura 73) indica un gradiente latitudinal positivo entre los 46º 30’ S y 47º 00’ S de 4,14 ml O2/l (0,138 ml O2/l/mn), con valores mínimos en el sector central y profundo del golfo (entre 2,95 ml O2/l y 2,13 ml O2/l) y máximos en los sectores costeros de menor profundidad (entre 5,72 ml O2/l a 6,27 ml O2/l ). Concentración de clorofila a (Cl a (AF)) La concentración de clorofila a (Tablas 22 y 23) presenta un rango de variación comprendido entre 0,02 mg/m3 y 0,91 mg/m3 con un valor medio de 0,43 mg/m3 . La distribución horizontal de esta variable (Figura 74) muestra un patrón de: 1) valores altos en el sector costero sur (0,65 mg/m3 a 0,91 mg/m3) y en el cuadrante SE (0,56 mg/m3 a 0,71 mg/m3), 2) un gradiente decreciente hacia el interior del golfo (con valores entre 0,02 mg/m3 y 0,15 mg/m3 ) y 3) un gradiente decreciente hacia el sector costero oeste con registro de valores mínimos (entre 0,02 y 0,05 mg/m3). En las tablas 22 y 23 se presentan los registros de concentración de clorofila a en agua superficial y en la capa de mezcla. El rango de valores para el agua superficial fue de 0,37 mg/m3 a 1,04 mg/m3 con un valor medio de 0,73 mg/m3. Para la capa de mezcla, el rango fue de 0,16 mg/m3 a 5,37 mg/m3, con un valor medio de 1,01 mg/m3 . La distribución horizontal de las 77 variables (Figuras 75 y 76) no sigue un patrón definido, en general los valores máximos se localizan en núcleos en el sector costero sur y en el cuadrante SE (valores entre 1,02 mg/m3 y 1,04 mg/m3) en relación a la concentración de clorofila a en el agua de superficie y hacia la zona central e interna del golfo (4,18 mg/m3 y 5,37 mg/m3) en relación a la concentración de clorofila a en la capa de mezcla. 3.3.1.2.- Variables sedimentológicas A.-Caracterización física del sedimentos Los resultados de los análisis granulométricos realizados en los sedimentos superficiales del sector sur del Golfo San Jorge (Figura 10), indican 15 clases texturales, con un rango de tamaño de grano entre arena muy gruesa (valor de Φ = 0 o grano de 1mm) y arcilla fina y muy fina (valor de Φ = 10 o partículas < a 0,001 mm) (Tabla 22 y 24). Considerando la composición porcentual en peso de las clases texturales arena, limo y arcilla, la mayor participación se concentra en la clase arcilla . El área de estudio se caracteriza por la presencia de dos fracciones granulométricas claramente definidas espacialmente, la arena y el fango (limo y arcilla) (Figura 77). La fracción arena como clase textural dominate se localiza en el sector sudeste del golfo (estaciones generales 106, 112 y 116) y representa el 6% de las estaciones analizadas. La fracción fango (limo y arcilla), predominante en el resto de la zona relevada, representa el 94% de las estaciones (42 estaciones), de las cuales 21 estaciones (46 %) presentan como componente principal la partícula limo con porcentajes entre 30,62% y 65,93% y 22 estaciones (48%), la partícula arcilla, con porcentajes entre 40,86% y 73,88%. Si bien estas estaciones presentan predominio de limo o arcilla, en 23 estaciones la arena estuvo presente en porcentajes que oscilaron entre 1,02% y 49,52% en aquellas estaciones ubicadas en el sudeste del golfo (estaciones generales 104, 107, 109, 110, 111, 114, 117 a 120, 147 a 151, 153, 155, 169 y 170) y en el sector costero sudoeste (estaciones generales 126, 127, 130 y 144). Cabe indicar que las 20 estaciones con dominancia del 100% de fango, se localizaron en el sector central del área relevada (estaciones generales 98 a 103, 122 a 125, 129, 131 a 135, 138, 140, 142 y 152 ) Los análisis estadísticos realizados comparando la estructura porcentual de las clases texturales presentes durante nuestro período de estudio con la resultante de primavera de 1999 (Tabla 1, Figura 4) correspondiente al agrupamiento de estaciones localizadas en el sur del golfo, indicó diferencias significativas (P < 0,05). Durante nuestro estudio no se registró la clase textural grava, se observó un porcentaje mayor de arena muy gruesa (28,27 %), arena gruesa 78 (3,41 %) y arena mediana (6,14 %), un menor porcentaje de arena fina (2,93 %), arena muy fina (6,08 %), limo grueso (8,47 %), limo mediano (4,09 %), limo fino (6,48 %) y limo muy fino (6,94 %) y un mayor porcentaje de arcilla gruesa (10,51 %) y arcilla mediana (5,24 %)(Figura 78). Las clases texturales en que han sido agrupadas las estaciones de muestreo responden a los tipos sedimentarios definidos por Buchanan (1984) para sedimentos marinos, siendo los tipos sedimentarios que encuentran representación en el sur del golfo las: arenas limosas, arenas arcillosas, limos arenosos, limos arcillosos, arcillas limosas y arcilla arenosa, observándose una predominancia en el golfo del tipo arcilla limosa (Tabla 24, Figura 79). En las figuras 80, 81 y 82 se presentan una serie de cartografías que permiten visualizar espacialmente las variaciones sedimentarias, en función de los resultados obtenidos de los parámetros granulométricos: tamaño medio del grano, grado de selección y asimetría. El tamaño medio del grano (Figura 80) aumenta desde el sector interno (Φ 8 y 7 = 0,0039 mm arcilla gruesa y 0,0078 mm, limo muy fino) hacia la zona costera frente a la cuidad de Comodoro Rivadavia (Φ 5 = 0,031 mm, limo medio) y hacia la zona externa del Golfo San Jorge (Φ 2 = 0,250 mm, arena mediana). Los valores más frecuentes corresponden a arcillas gruesas, limitados a la zona interna, quedando las arenas restringidas al sector próximo a Cabos Tres Puntas. El grado de selección de las muestras (Figura 81) indica una pobre selección en la zona interna del área de estudio; la mayoría de las muestras de la zona presentan como tamaño medio predominante la arcilla (ya sea gruesa, media, fina o muy fina) y otras pequeñas modas en tamaños más gruesos (principalmente limos muy finos y finos). El patrón que se observa en la distribución de la asimetría (Figura 82), refleja el predominio de muestras con valores positivos a muy positivos en el sector interno del golfo; la arcilla gruesa, tamaño medio predominante de la zona, está acompañada de cantidades importantes de arcilla mediana a muy fina. Los valores negativos y muy negativos se registran en el sector externo y frente a Comodoro Rivadavia, donde se ubicaron cantidades relativamente importantes de granos más gruesos que el medio, como arenas y limos que acompañan a la partícula arcilla gruesa. B.- Caracterización química de los sedimentos 79 Materia orgánica total (MOT) El rango de valores determinado para esta variable en los sedimentos del sur del Golfo San Jorge fue de 0,78% a 11,85% (Tabla 22 y 23). La distribución horizontal de la concentración de MOT (Figura 83) presenta un gradiente positivo desde el extremo sudeste del golfo (2,01%) hasta la zona interna del área de estudio donde se observan valores comprendidos entre 8,56% y 9,38%. El valor máximo se registró en la estación 103 ubicada en el sur del golfo. Carbono orgánico total (COT) La concentración de COT en los sedimentos del área de estudio (Tablas 22 y 23) presenta un rango de variación comprendido entre 0,34% y 1,53%, con un valor medio de 0,97%. La distribución horizontal de esta variable (Figura 84) presenta un aumento de los valores desde el extremo sudeste del golfo (valores comprendidos entre 0,34 y 0,51%) hasta la zona interna del área de estudio donde se observan valores cercanos a 1,40%. Nitrógeno total (NT) El rango de valores determinado para la concentración de NT en los sedimentos fue de 0,05% a 0,27% (Tabla 22 y 23). La distribución horizontal de esta variable (Figura 85) presenta un aumento de los valores desde el sector sur y sudeste del golfo (con valores de 0,06%) hasta la zona interna del área de estudio (valores comprendidos entre 0,20% y 0,26%). El valor máximo se registró en la estación general 142 ubicada en el oeste del golfo próxima a la cuidad de Comodoro Rivadavia. Relación C:N (C:N) En los sedimentos superficiales del sur del Golfo San Jorge, los valores de la relación C:N variaron entre 4,73 y 8,54, siendo el valor medio de 6,68 (Tabla 22 y 23). La distribución horizontal de esta variable no define un claro patrón (Figura 86). Los valores de la relación C:N superiores a 7 se localizan en el sector externo del golfo mientras que los inferiores a 7 en el sector interno del golfo. Fósforo total (FT) La concentración de FT en los sedimentos del área de estudio (Tablas 22 y 23) presenta un rango de variación comprendido entre 0,03% y 0,09%, con un valor medio de 0,05%. La distribución horizontal de esta variable (Figura 87) presenta un aumento de sus valores desde la 80 zona litoral sur del golfo (valores comprendidos entre 0,03% y 0,04 %) hasta la zona interna del área de estudio (valores entre 0,05 % y 0,09 %), respectivamente. Clorofila a (Cl a (S)) La concentración de clorofila a en los sedimentos del área de estudio (Tablas 22 y 23) presenta un rango de variación entre 0,20 µg/g y 9,90 µg/g, con un valor medio de 1,31 µg/g. La distribución horizontal de esta variable (Figura 88) no define un claro patrón, en general la distribución se observa muy uniforme, localizándose el registro máximo en la estación general 140 ubicada en el sector costero oeste. Feopigmentos (Feop (S)) La concentración de feopigmentos en los sedimentos del área de estudio (Tablas 22 y 23) presenta un rango de variación entre 1,74 µg/g y 43,19 µg/g, con un valor medio de 11,98 µg/g. La distribución horizontal de esta variable (Figura 89) presenta un aumento de sus valores desde el extremo sudeste del golfo (valores comprendidos entre 1,74 µg/g y 3,05 µg/g) hasta el área costera oeste, alcanzando allí valores superiores a 43,00 µg/g, 3.3.1.3.- Clasificación y ordenación de las variables ambientales. Clasificación Los análisis de agrupamiento de las 27 variables físico-químicas para las estaciones analizadas (Figura 90) revelan la existencia de 2 agrupaciones importantes (grupos 1 y 2 ). El grupo 1 está caracterizado por las variables sedimentológicas arena gruesa a arena muy fina (Φ 0, a Φ 3,5), limo grueso (Φ 4) y relación C:N así como la temperatura, la concentración de oxígeno y la concentración de clorofila a en agua de fondo. El grupo 2 lo definen las variables limo mediano a arcilla muy fina (Φ 5 a Φ 10), la concentración de MOT, COT, NT, FT, clorofila a y feopigmentos en sedimentos, la salinidad del agua de fondo y la profundidad de las estaciones. La clasificación de las estaciones se presenta gráficamente en la Figura 91. Se observan dos agrupaciones de muestras ordenadas espacialmente y que corresponden en líneas generales a distintas zonas del área sur golfo. Por un lado se separan las muestras ubicadas en la zona interna del área de estudio (grupo 1) y por otro, las estaciones situadas en el sector externo del área y la estación costera ubicada frente a la cuidad de Comodoro Rivadavia (grupo 2). 81 Ordenación La ordenación de las variables ambientales se ilustra en la Figura 92, donde se presentan los ejes o componentes 1 y 2. La varianza total explicada por estos dos ejes en el análisis de componentes principales se observa en la Tabla 25. El primer componente que es el que tiene la varianza más alta (31,99 %) y por lo tanto la mayor capacidad explicativa de los datos, está determinado por la carga positiva de las variables arena fina (Φ 3 a Φ 2,5), frente a la fuerte carga negativa de las variables limo fino (Φ 6), limo muy fino (Φ 7), arcilla gruesa (Φ 8), arcilla mediana (Φ 9), arcilla fina a muy fina (Φ > 10), MOT, COT, NT, FT, clorofila a y feopigmentos en sedimentos. El segundo componente que explica un 19,62 % de la varianza, se relacionó positivamente con la arena muy fina (Φ 3,5) y el limo grueso (Φ 4) y negativamente con las variables arena muy gruesa (Φ 0), arena gruesa (Φ 0,5 - Φ 1) y arena mediana (Φ 1,5 - Φ 2). La representación de las estaciones de muestreo teniendo en cuenta las variables medidas en cada una de ellas, en los dos primeros ejes (Figura 93), indica una disposición espacial de las mismas en función del primer factor de variación, desde la zona interna del área de estudio (1) hacia en el sector externo del área (incluyendo la estación costera ubicada frente a la cuidad de Comodoro Rivadavia) (2). Las agrupaciones se forman tanto en función de las características que presentan los sedimentos y el agua de fondo, como de la ubicación o profundidad de las muestras en los sectores del golfo. Los análisis estadísticos de clasificación y ordenación han permitido identificar para el sur del Golfo San Jorge dos sectores en el período de estudio con características particulares correspondientes a las agrupaciones de las estaciones de muestreo clasificadas como 1 y 2 (Figura 94). Las características que definen los sectores 1 y 2 se presentan en la Tabla 26. Considerando las variables que definieron los sectores, el sector 1 presenta una profundidad entre 43 m y 89 m, con un sustrato constituido principalmente por la clase textural arcilla (ξ =55,48%) seguido por el limo (ξ =43,04%) y concentraciones elevadas de MOT (ξ =8,37%), COT (ξ=1,22%), NT (ξ=0,19%), clorofila a en sedimentos (ξ=1,68 μg/g) y feopigmentos (ξ =16,01μg/g). Mientras que el sector 2 se caracteriza respecto del sector 1 por presentar una profundidad entre 31 m y 91 m, sustratos constituidos principalmente por limo (ξ=38,83%) y arena (ξ =36,73%) y valores inferiores de concentración de MOT (ξ=3,99%), COT (ξ=0,62%), NT (ξ=0,09%) clorofila a (ξ=0,79 μg/g) y feopigmentos (ξ= 6,25 μg/g) en sedimentos. 3.3.2.- CARACTERIZACIÓN DE LAS CONCENTRACIONES DE LANGOSTINO. 82 Ubicación taxonómica del langostino del Mar Argentino: Phylum Arthropoda Superclase Crustacea Clase Malacostraca Subclase Eumalacostraca Superorden Eucarida Orden Decapoda Suborden Dendrobranchiata Superfamilia Penaeoidea Familia Solenoceridae Pleoticus muelleri (Bate, 1888) 3.3.2.1. – Análisis de las concentraciones de langostino. Para este estudio se analizaron las concentraciones de langostino del Golfo San Jorge al sur de 46º S, área donde se localizan las mayores concentraciones y se realizan estimaciones de biomasa relativa vulnerable y accesible (al arte de pesca) de langostino, a los efectos de contribuir al conocimiento del estado de la pesquería del litoral patagónico. La abundancia relativa de langostino surge del agrupamiento de los valores de densidad obtenidos a partir de 46 lances de pesca, efectuados en las estaciones generales correspondientes, previa estandarización de la captura a la unidad de esfuerzo pesquero. Estructura de tallas La estructura de talla del total de individuos y por sexo de la fracción estimada de abundancia relativa de langostino en el área, puede observarse en la Figura 95. El rango de tallas para el total de individuos osciló entre 13 mm y 55 mm Lcap, con una talla media de 29,69 mm Lcap y una talla modal de 27 mm Lcap. Para el caso de los machos y de las hembras, el rango osciló entre 18 mm y 39 mm Lcap y 13 mm y 55 mm Lcap, respectivamente, con una talla media de 28,27 mm para los machos y 31,03 mm Lcap para las hembras. La talla modal para machos fue de 27 mm Lcap, mientras que para las hembras, las mismas fueron de 27 mm, 29 mm y 31 83 mm Lcap,. La estructura de talla de los machos maduros se ubicó entre 28 mm y 39 mm de Lcap, con un valor medio de 33,03 mm Lcap y un valor de moda de 32 mm Lcap (Tabla 27). Considerando los valores de talla media para el total de individuos por lance, los mismos fluctuaron entre 23,20 mm y 38 mm Lcap (Tabla 22), concentrándose los valores inferiores en el sur (23,50 mm Lcap) y en el sector costero oeste (26,76 mm y 29,52 mm Lcap), mientras que los superiores en el este del área de estudio (30,13 mm a 32,79 mm Lcap) (Figura 96 y Tabla 28). En congruencia, en estos dos últimos sectores se ubicaron los mayores valores de la desviación estándar de talla media (Tabla 28). La distribución horizontal de las isolíneas de los valores de talla media tanto para machos como para hembras coincide con lo anteriormente descrito, con la concentración de valores mínimos en el sur (23,50 mm Lcap para machos y 27,48 mm Lcap para hembras) y en el sector costero oeste (entre 26,08 mm y 28,74 mm Lcap y 27,48 mm y 30,66 mm Lcap, respectivamente) y concentración de valores máximos en el sector este (entre 28,46 mm y 31,19 mm Lcap y 31,58 mm y 35,89 mm Lcap, respectivamente) (Tabla 28, Figuras 97 y 98). El valor de talla media 38 mm Lcap se localizó en la estación general 144 ubicada próxima a Comodoro Rivadavia y corresponde a machos. Densidad relativa En la Figura 99 puede observarse la composición porcentual en peso y número de la biomasa estimada en el área en términos de las categorías de estudio. La mayor participación en número se concentra en la categoría que agrupa a los individuos subadultos (tallas entre 25 – 30 mm Lcap) seguida por la categoría de adultos (tallas entre 31- 40 mm Lcap), con un 55,58% y 32,50% respectivamente; mientras que en peso, la situación se invierte, con la mayor participación de adultos (52,66%) seguida por la categoría subadultos (41,41%). Los juveniles y adultos mayores de 41 mm Lcap presentaron valores en número de 10,72% y el 1,21% respectivamente, y en peso de 1,97% y 3,96%, respectivamente. La densidad relativa de langostino para el área de estudio, fue de 142.401 miles de indiv./mn2 .Los valores mínimos, máximos, promedio y desviación estándar de densidad relativa en peso y número de cada categoría analizada y del total de individuos se indican en la tabla 22. Los valores de densidad relativa en peso y número de cada categoría por estación general (lance de pesca) se presentan en la tabla 28. En la Figura 100 se presentan las isolíneas de densidad relativa de langostino, mientras que en las Figuras 101, 102, 103 y 104 las correspondientes a los individuos juveniles (4-24 mm 84 Lcap), subadultos (25-30 mm Lcap), adultos (31-40 mm Lcap) y adultos > 41 mm Lcap, respectivamente. Para los análisis de distribución espacial de los valores de densidad, la estación 99 fue excluida. Esta estación concentra el máximo valor de densidad de 27.335 miles de indiv/mn2 como así también de individuos juveniles, subadultos y adultos que alcanzan los 4.293, 16.265 y 6.777 miles de individuos/mn2 La mayor densidad de langostino (Figura 100 y Tabla 28), se localiza en los sectores este con valores entre 4.266 y 11.615 miles de individuos/mn2 y costero sudoeste con valores entre 3.138 y 7.066 miles de individuos/mn2. En relación a la densidad de las categorías analizadas (Figuras 101, 102, 103 y 104), los mayores valores de individuos juveniles se localizan en el sector costero oeste (707 y 1.302 miles de indiv/mn2), de los individuos subadultos en los sectores este (4.266 y 11.615 miles de individuos/mn2 ) y costero sudoeste (3.138 y 7.066 miles de individuos/mn2 ) y de los individuos adultos (31-40 mm Lcap), al igual que la categoría anterior, en los sectores este (2.117 y 4.026 miles de individuos/mn2 ) y costero sudoeste (1.020 y 2.739 miles de individuos/mn2); mientras que las mayores densidad de los adultos mayores de 41 mm Lcap, se ubicaron en el sector este con valores entre 104 y 321 miles de individuos/mn2. Con respecto a la estructura sexual de la abundancia estimada, el 51,44% de los ejemplares muestreados fueron hembras y consecuentemente el 48,46% fueron machos. El 9,88% de los machos presentaba signos de madurez, en términos macroscópicos, no hallándose hembras maduras. Considerando la distribución porcentual de hembras y de machos por lance los valores oscilaron entre 0% y 58,33% (valor medio de 45,99%) para machos y entre 41,67% y 100% (valor medio de 54,01%) para hembras (Tabla 22 y 28). La distribución horizontal de los valores en el área de estudio permite observar los porcentajes de hembra superiores a 50% en el sector central con un porcentaje de 100% en la estación 104 ubicada en el sector costero sur y los inferiores a 50% en el sector costero oeste (entre 41,67% y 49,26%) y en sector este (entre 47,05% y 49,82%). En consecuencia en los machos se observa el comportamiento inverso (Figuras 105 y 106). 3.3.2.2. – Clasificación y ordenación de las variables biológicas Clasificación 85 Los análisis de agrupamiento de las 4 categorías de langostino: individuos juveniles, subadultos, adultos (31 y 40 mm Lcap) y adultos mayores a 41mm de Lcap para las muestras analizadas (Figura 107) revela una asociación importante integrada por los individuos subadultos y adultos entre 31 y 40 mm Lcap.a un nivel de 92% de similitud, a los cuales se une la categoría juveniles a un 78%. La clasificación de las estaciones se presenta gráficamente en la Figura 108. Se observan dos agrupaciones, la primera, que a su vez se divide en dos subagrupaciones, una de ellas integrada principalmente por estaciones ubicadas en los sectores este y costero sudoeste y otra por estaciones ubicadas principalmente en el norte del área de estudio. La segunda agrupación comprende estaciones ubicadas principalmente en sectores costeros del sur y oeste de área de estudio. Los análisis estadísticos de clasificación han permitido identificar para el sur del Golfo San Jorge dos agrupaciones de estaciones de muestreo clasificadas como 1 y 2 (Figura 109). Las características que definen las agrupaciones 1 y 2 se presentan en la Tabla 29, donde se observa que la agrupación 1 incluye las estaciones generales con valores de densidades altas para las cuatro categorías consideradas, con un valor de densidad media de 3.842 miles de individuos/mn2, un valor promedio de talla media de 30,09 mm Lcap, y un rango de talla media amplio entre 27,45 mm y 33,40 mm Lcap , localizándose el valor mínimo en el litoral sudoeste (estación general 132) y el máximo en el noreste (estación general 151). La agrupación 2, presenta valores de densidades mínimas (42 a 1.835 miles de individuos/mn2), rango de talla media más acotado entre 26,76 mm y 30,86 mm y un valor promedio de talla media inferior (29,33 mm Lcap). El valor mínimo de talla media se localizó en el oeste (estación general 129) y el máximo en el centro (estación general 112). La relación de sexo de machos y hembras, en porcentaje se mantuvo semejante (~1:1) en ambas agrupaciones. Ordenación Para este análisis no se consideraron las estaciones generales 104 y 144 por presentar un comportamiento anómalo en la distribución de la información presentando las densidades más bajas de langostino. La tabla 30 muestra los autovalores, la inercia y la inercia acumulada correspondiente a cada dimensión. La primera dimensión acumula un 86,66 % de la inercia total y por lo tanto es la que tienen la mayor capacidad explicativa de los datos. El hecho de que la primera dimensión concentre casi el total de la inercia debe interpretarse como consecuencia del patrón de 86 distribución de los datos que responde a un gradiente de los valores de abundancia de las categorías analizadas en una dirección. En la Figura 110 aparece la disposición de las categorías y las estaciones respecto a las dimensiones 1 y 2. En la representación se observa que, dentro del gradiente de variación indicado por las dimensiones 1 y 2 en el plano definido por el extremo positivo del primer eje se localizan los individuos adultos mayores a 41 mm Lcap y adultos con tallas entre 31 y 40 mm Lcap, presentes en las estaciones ubicadas en el sector noreste del golfo, claramente enfrentadas a los individuos juveniles (en la parte negativa del primer eje) que han aparecido en estaciones ubicadas en el sector costero oeste, diferenciándose entre los juveniles y adultos, los individuos subadultos presentes en las estaciones ubicadas en el resto del área de estudio (sector central y sudeste) De manera general, la distribución de las categorías de langostino indica una disposición espacial de las estaciones desde el sector noreste (1) hacia el sector costero oeste (2) pasando por el sector central y sudeste (3), que corresponden a tres sectores con características particulares (Figura 111). El primero se caracteriza por presentar: • el mayor valor medio de densidad de individuos adultos entre 31 mm y 40 mm Lcap (2.054,00 miles de individuos/mn2) y de adultos mayores de 41 mm Lcap (103,00 miles de individuos/mn2), • el menor valor medio de densidad de juveniles (37,80 miles de individuos/mn2), • el mayor valor promedio de talla media (30,86 mm Lcap). El segundo, se caracteriza por presentar: • el mayor valor medio de abundancia de individuos juveniles (653,00 miles de individuos/mn2), • el menor valor medio de abundancia de individuos adultos mayores de 41 mm Lcap (4,00 miles de individuos/mn2) y de individuos adultos entre 31 y 40 mm Lcap (395.75 miles de individuos/ mn2), • el menor valor promedio de talla media (27,29 mm Lcap); El tercer sector que comprende el área definida entre los dos primeros sectores, se caracteriza por presentar: • el mayor valor medio de abundancia de individuos subadultos (1.924,06 miles de individuos/mn2) más allá de los valores mínimos y máximos de densidad total (39,00 y 27.656,00 miles de individuos/mn2), 87 • valores intermedios de los valores promedio de abundancia de individuos juveniles (355,54 miles de individuos/mn2) como así también de adultos entre 31 y 40 mm Lcap (982,40 miles de individuos/mn2) y adultos mayores a 41 mm Lcap (33,97 miles de individuos/mn2). • un valor promedio de talla media de 29,67 mm Lcap, valor intermedio a los observados para el sector 1 y 2 (Tabla 31). 3.3.3.- RELACIÓN ENTRE LAS VARIABLES AMBIENTALES Y LAS VARIABLES BIOLÓGICAS. Análisis de correlación canónica. Los resultados del análisis de correlación canónica (ACC), para definir las relaciones entre el recurso langostino (según las categorías dispuestas por rangos de tallas) y los parámetros físico-químicos, se presentan en la tabla 32. Los valores de los cuatro coeficientes de correlación canónica resultantes y su grado de significación estadística se presentan en la citada tabla; si bien, la primera correlación canónica resulta ser estadísticamente significativa, su valor de 0,642 estaría indicando una relación débil entre las categorías adultos y la profundidad y concentración de COT en sedimentos. En tabla 33 se presenta la matríz de correlación entre las variables biológicas y ambientales, y en la tabla 34 se observan de las cuatro variables canónicas o componentes (biológicas y ambientales), la varianza explicada y los factores de carga de cada variable que definen los componentes. También se presenta en la Figura 112, la distribución canónica tridimensional de cada punto muestreado en función de las variables canónicas: ambiental 1 (definido por las variables profundidad y COT en sedimentos), ambiental 2 (definido por las variables salinidad y concentración de oxigeno disuelto en agua de fondo) y biológica 1 (definido por las variables adultos entre 31-40 mm Lcap y adultos > a 41 mm Lcap). El examen de posición de cada punto muestreado permite diferenciar el grupo de estaciones (116, 119, 120, 147, 148, 149, 150, 151, 169 y 170) ubicadas en el noreste del área de estudio, que concentra los valores positivos de la variable canónica ambiental 1 y la variable canónica biológica 1. Este grupo de estaciones se caracteriza en su conjunto respecto al resto, por presentar las mayores profundidades (entre 73 m y 91 m), los menores valores de COT en sedimentos (ξ = 0,64%) así como los mayores valores de densidad de adultos entre 30 mm - 40 mm Lcap (ξ = 2.160,7 miles de individuos/mn2). y adultos > 41 mm Lcap (ξ = 122,5 miles de individuos/mn2). 88 El resto de las estaciones reúnen profundidades entre 31m y 87 m y valores promedio de COT de 1,06%, densidad de adultos entre 30 mm - 40 mm Lcap de 684,28 individuos/mn2 y densidad de adultos > 41 mm Lcap de 13,81 miles de individuos/mn2. 3.4.- ANÁLISIS COMPARATIVO DE LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO DEL AREA SUR DEL GOLFO SAN JORGE ENTRE EL PRIMER Y SEGUNDO PERÍODO DE ESTUDIO. Se compararon las siete variable hidrográficas y las seis variables sedimentológicas analizadas durante el primer y segundo período de estudio, en el sector sur del Golfo San Jorge (Tabla 35). Considerando las variables hidrográficas, el análisis comparativo entre estaciones semejantes sólo indicó diferencias altamente significaticas (P < 0,01) en la concentración de clorofila a en agua de superficie entre las primaveras, en agua de mezcla entre los inviernos y entre las primaveras, y en agua de fondo entre los inviernos (Tablas 36 y 37, Figuras 113 a 125). Los análisis de las variables sedimentológicas, indicaron diferencias altamente significaticas (P < 0,01) en la concentración de NT entre los inviernos, entre las primaveras y entre los veranos, en la relación C:N entre los veranos y entre los otoños, en la concentración de clorofila a en sedimentos entre los inviernos, entre las primaveras y entre los veranos, y en el contenido de feopigmentos en sedimentos entre los otoños, entre los inviernos y entre las primaveras. 89 DISCUSIÓN 90 4.- DISCUSIÓN 4.1.- LAS VARIABLES AMBIENTALES DEL SISTEMA BENTÓNICO DEL GOLFO SAN JORGE 4.1.1.- PRIMER Y SEGUNDO PERÍODO DE ESTUDIO (Primavera 1999 – invierno 2000 y otoño 2001 – verano 2002, respectivamente) Variables hidrográficas del agua de fondo Temperatura El rango de temperatura observado en el agua de fondo durante ambos períodos de estudio, al igual que la distribución horizontal y vertical de esta variable, son similares a los observados previamente por Reta (1986), Baldoni (1990), Akselman (1996) y Cucchi Colleoni y Carreto (2001). La distribución vertical de los valores muestra la existencia de un ciclo estacional típico de aguas templadas caracterizado por la formación durante la primavera y ruptura durante el invierno de la termoclina estacional (Akselman, 1996). Durante la primavera, con el aumento de la radiación solar comienza a formarse la termoclina, que alcanza su máxima expresión en el verano. Durante el otoño, como consecuencia tanto de la convección generada en superficie por enfriamiento del agua superficial como de la mezcla turbulenta producida por los vientos la termoclina se profundiza. Este proceso continua durante el invierno en que se alcanza la homogeneidad de toda la columna de agua. Según Cucchi Colleoni y Carreto (2001), la dinámica de la formación y ruptura de la termoclina en las regiones costeras difiere de la observada en las regiones centrales del golfo de mayor profundidad. En las regiones costeras de menor profundidad, el proceso de formación de la termoclina está retrasado respecto de las aguas más profundas. La ruptura está adelantada y ocurre durante el otoño, por lo que la temporada de estratificación de estas regiones tiene menor duración. Similarmente a lo observado por Baldoni (1990) la distribución horizontal de la temperatura del agua de fondo parece responder a la batimetría de la región, siendo mínima en la zona de mayor profundidad con eje de sentido SW – NE. 91 Sanilinidad El rango de salinidad observado en el agua de fondo es similar al registrado por otros autores (Reta, 1986; Baldoni, 1990; Akselman, 1996; Cucchi Colleoni & Carreto, 2001). Dichos rangos indican la existencia de dos tipos de aguas: 1) las denominadas Aguas de Plataforma y 2) las Aguas Costeras. Las Aguas Costeras se originan como consecuencia de la mezcla de agua subantártica procedente de la Corriente del Cabo de Hornos con agua que entra al Atlántico por el Estrecho de Magallanes diluidas por aportes continentales (Brandhorst & Castello, 1971; Bianchi et al., 1982). Las Aguas de Plataforma son el resultado de la mezcla del Agua Costera con la de la corriente del Cabo de Hornos y con el Agua de Malvinas (Bianchi et al., op. cit.). La distribución horizontal muestra en general un gradiente de salinidad positivo de sentido sur a norte que refleja la influencia de las Aguas Costeras que fluyen desde el Estrecho de Magallanes próximas a la costa de la Provincia de Santa Cruz, y cuyo flujo, a la altura del Cabo Tres Puntas se bifurca en dos ramas principales (Bianchi et al., 1982). Una de las ramas ingresa al golfo por su extremo sudeste y ejerce una notable influencia en esa región durante todo el año. La otra, se aleja de la costa en dirección N-NE, afectando en toda su extensión al umbral del golfo. En cuanto a la variabilidad estacional de la extensión con que las Aguas Costeras ingresan al golfo, Cucchi Colleoni y Carreto (2001) sugieren la existencia de un máximo en primavera y mínimo en verano. Las variaciones por ellos registradas, coinciden con las variaciones estacionales esperadas para el flujo de aguas diluidas provenientes del Estrecho de Magallanes, con un aumento de invierno a primavera, asociado posiblemente al mayor aporte continental durante esta última estación (Guerrero y Piola, 1997). Sin embargo, durante el presente estudio, la máxima influencia se observó en otoño e invierno de 2000 y en invierno de 2001, reforzando el concepto de que las variaciones observadas podrían ser el resultado de procesos dinámicos de corta duración que escapan a la escala temporal de observación (Cucchi Colleoni & Carreto, 2001). Densidad Los valores calculados de densidad son similares a los observados en estudios previos (Reta, 1986; Baldoni, 1990; Akselman, 1996; Cucchi Colleoni & Carreto, 2001). La variación estacional de la densidad del agua de fondo está principalmente determinada por las variaciones anteriormente descriptas para la temperatura, pero cabe considerar el efecto de la salinidad ya que el ingreso de las Aguas Costeras genera en el sector sur del golfo un frente termohalino. Este frente presenta una posición variable, detectándose en el extremo sur en invierno, primavera y 92 verano y desplazándose hacia el norte en otoño (Akselman, 1996; Cucchi Colleoni & Carreto, 2001; Glorioso, 1987; Glorioso & Flather, 1995). La distribución horizontal de densidad coincide en general con la distribución de la temperatura, la que a su vez parece dependiente de la batimetría del golfo. Concentración de oxígeno disuelto Los valores de concentración de oxígeno para el agua de fondo se encuentran dentro de los rangos citados para ambientes neríticos oxigenados (Bernd & Simoneit, 1978). La excepción son dos valores (1,82 ml O2/l y 2,69 ml O2/l) registrados en el agua de fondo en el otoño de 2000 y el otoño de 2001, respectivamente. Esta situación de hipoxia que compromete la supervivencia de los organismos, se ha definido por el rango de concentración comprendido entre 0,2 y 2,0 ml O2/l (Simunovic et al., 1999). Las máximas concentraciones de oxígeno disuelto se presentan durante el invierno. Luego se observa un descenso gradual durante la primavera y verano, alcanzándose valores mínimos en el otoño, principalmente en el sector central del golfo, de mayor profundidad. Esta variabilidad está directamente relaciona con la formación y ruptura de la termoclina, anteriormente discutida. En la primavera y el verano, como consecuencia del gasto de oxígeno (por oxidación de materia orgánica, procesos de respiración y aislamiento de la capa profunda) la concentración disminuye llegando a valores mínimos en el otoño. Con la ruptura de la termoclina y mezcla vertical se produce un aumento de la concentración de oxígeno en el agua de fondo, por el suministro de oxígeno desde las capas superficiales bien oxigenadas por intercambio con la atmósfera. La presencia de agua fondo de bajo contenido de oxígeno que llega a condiciones de hipoxia en el sector central del golfo durante el otoño, parece ser la consecuencia de la descomposición u oxidación del material orgánico en situación de sedimentación y/o acumulación. Estudios sedimentológicos realizados por Fernández y Roux (1999) revelan para este sector elevadas concentraciones de materia orgánica en los sedimentos. Resultados semejantes han sido observado en la Bahía de San Vicente, Chile (Carrasco & Carvajal, 1995). En este caso la presencia de aguas de bajo contenido de oxígeno en la región interior de la bahía, de mayor profundidad, es consecuencia de la descomposición de la materia orgánica sedimentada. En el Golfo San Jorge no se observó ningún ambiente anóxico (< 0,5 ml O2/l) en el cual la biomasa bentónica comienza significativamente a disminuir (Damaison & Moore, 1980). Sin embargo para Rosemberg (1980) el valor de 2 ml O2/l parece ser el límite mínimo de tolerancia para un gran número de especies que integran las biocenosis de fondo. 93 Concentración de clorofila a Cucchi Colleoni y Carreto (2001) han establecido que las variaciones estacionales de biomasa fitoplanctónica en el Golfo San Jorge pueden describirse por el característico ciclo bimodal de aguas templadas, con un máximo principal durante la primavera (octubre) y otro secundario durante el otoño (abril). En el verano, la producción fitoplanctónica estaría limitada por la disponibilidad de nutrientes en la capa de mezcla. En el invierno, la limitación estaría impuesta por la baja disponibilidad de luz que resulta no sólo de la disminución de la radiación luminosa incidente, sino también, del incremento de la mezcla turbulenta, especialmente en las regiones más profundas del golfo. Durante la formación (primavera) y el inicio del proceso de ruptura (otoño) de la picnoclina estacional, la disponibilidad de nutrientes y la mayor estabilidad de la capa superficial bien iluminada, son las responsables de los florecimientos detectados en primavera y en otoño. Cucchi Colleoni y Carreto (2001, 2003) también indican que, sobrepuesto a este ciclo general característico del golfo en su conjunto, hay otros factores que modifican la estabilidad de la columna de agua y la disponibilidad de nutrientes, ejerciendo un efecto importante en su capacidad productiva. Entre los factores se destacan: 1) la formación de sistemas frontales en la estación estival, resultantes de la mezcla vertical producida por mareas que aportan nutrientes y que determina la existencia de áreas productivas en el sector costero y principalmente en el extremo sudeste del golfo y 2) el efecto de las Aguas Costeras que ingresan al golfo por el extremo sur y sudeste del mismo generando frentes termohalinos de permanencia estacional y de posición variable con importantes concentraciones de clorofila a en primavera y otoño. Los estudios realizados por Akselman (1996) muestran: 1) durante el invierno un valor promedio de clorofila a de 0,83 mg/m3 siendo notable la homogeneidad en su distribución vertical y horizontal, 2) durante la primavera, una distribución en dos capas; la superior desarrollada entre la superficie y los 30 m de profundidad, con valores mayores (ξ = 3,16 mg/m3) que los de la capa inferior (ξ = 1,15 mg/m3); además se observan importantes núcleos de concentración (valores máximos de 7,.96 y 16,11 mg/m3) y 3) durante el verano y el otoño, se mantiene la distribución vertical en dos capas, pero en la capa superior las concentraciones son menores (2,07 mg/m3 en verano y 2,66 mg/m3 en otoño). Las concentraciones de clorofila a en agua de superficie y capa de mezcla durante la primavera de 2001 indicarían el desarrollo de un florecimiento; mientras que las moderadas concentraciones registradas durante la primavera de 1999 y los otoños de 2000 y 2001 indicarían 94 el desarrollo de un escenario posterior al de los florecimientos en las citadas estaciones, comparado con el ciclo descrito por Akselman (1996). En relación a los florecimientos fitoplanctónicos primaverales, merecen destacarselos resultados obtenidos por Pérsico (1986) en un sector de la plataforma patagónica que comprendió el Golfo San Jorge. Estos estudios indicaron en el golfo dos zonas de mayor biomasa situadas en los extremos norte y sur, con máximos en superficie de hasta 4,38 y 7,97 mg/m3 de clorofila a respectivamente. Por otra parte, Carreto et al. (1981 a) observaron en primavera en las cercanías de este golfo un importante florecimiento con una distribución vertical de pigmentos bastante uniforme (valores de hasta 12,5 mg/m3 de clorofila a) en un área aún no estratificada térmicamente. En cuanto a la concentración de clorofila a en el agua de fondo, nuestros resultados indican un incremento significativo de las concentraciones en invierno. Posiblemente la ruptura de la termoclina ha ya favorecido la exportación de material orgánico de origen fitoplanctónico hacia el fondo, tal como se discutirá más adelante. Variables sedimentológicas Caracterización física del sedimentos La distribución de los sedimentos en el golfo permite diferenciar: 1) la zona interna con profundidades mayores a 53 m con sedimentos fangosos con alto contenido en limos y arcillas y 2) la zona litoral y el sudeste del golfo con profundidades comprendidas entre los 21 y 53 m con un sustrato constituido por arenas. En esta última zona se diferencia en el extremo sur del golfo, una distribución de elementos gruesos, principalmente grava y arenas, con una aporte conchífero medianamente importante. Según Folk (1980), Ríos y Cisternas (1998) y Velazco Castillo (1999), los parámetros granulométricos en especial el tamaño medio de las partículas de sedimento y la asimetría reflejarían las condiciones hidrodinámicas (energéticas) que actuaron en el transporte y depositación de las mismas. Generalmente, las partículas más gruesas están asociadas a un mayor nivel de energía ya sea por influencia de las olas, corrientes de marea y corrientes oceanográficas del ambiente. Estos ambientes donde los agentes dinámicos actúan en los procesos de erosión del particulado, se consideran como ambientes en estado de flujo o erosivo. En cambio las partículas finas, se encuentran en sectores con menor hidrodinámica, lo que permite su decantación, 95 conociéndose los procesos que aquí actúan como depositacionales, y a estos ambientes, como ambientes deposicionales. Conforme a lo expuesto en el párrafo anterior, podríamos decir en relación al Golfo San Jorge que la disposición de los sedimentos atiende a tres factores: el sistema de corrientes de marea, la influencia oceánica y la batimetría. No siendo de importancia el aporte continental, ya que en el golfo no se registran aportes de aguas continentales (Baldoni, 1990) ni es importante la acción de las lluvias en el lavado del terreno, considerándose las mismas escasas en la Patagonia (Akselman, 1996) con un valor medio anual de precipitación de 244 mm en Comodoro Rivadavia (Isla et al., 2002). Las corrientes de marea en el golfo así como la entrada de aguas oceánicas de origen magallánico denominadas Aguas Costeras, que se produce por el margen sur, definirían un gradiente decreciente de la fracción gruesa desde la zona litoral hacia el interior del golfo, arrastrando material sedimentario fino hacia la zona más profunda del golfo definida por la isobata de 90 m (Baldoni,1990). Esta cuenca sedimentaria presenta porcentajes muy elevados de partículas finas (pelitas) y materia orgánica (Sanagua et al., 2002). Considerando los tipos sedimentarios podríamos decir que la estructura sedimentaria del golfo, muestra una composición de los fondos en el que predomina el tipo sedimentario limo arcilloso. Los diferentes tipos sedimentarios definidos en el golfo siguen un gradiente espacial y batimétrico desde la costa y el sector SE del umbral del golfo hacia la zona central y profunda, dónde se pueden diferenciar en el extremo sur, los tipos grava, grava arenosa y areno gravosa, en la costa sur el tipo areno limoso, en la costa oeste y umbral el tipo limo arenoso y en el sector interno central y más profundo, los tipos limo, limo arcilloso y arcillo limoso. Esto concuerda con los estudios granulométricos de los sedimentos superficiales del Golfo San Jorge, realizados por Roux et al. (1995), que comprendieron la caracterización del sustrato en función de la fracción granulométrica predominante. A través de este estudio se definieron dos áreas con características propias. Una de ellas comprende el extremo norte y sur del golfo (Cabo Dos Bahías y Tres Puntas, respectivamente) y presenta granulometría gruesa con predominio de grava y arena así como, fracción carbonática biogénica representada fundamentalmente por restos de valvas de pelecípodos y cirripedios. La otra área comprende los sectores norte, sur y boca del golfo, y está caracterizada por un marcado predominio de la fracción fango-arenosa, con componentes carbonáticos nulos. 96 Caracterización química de los sedimentos Materia orgánica total El mayor aporte de materia orgánica a los sedimentos se produce por los detritos orgánicos y los cuerpos de organismos muertos provenientes de la zona eufótica, que sedimentan en la interfase agua - sedimento (Bordovsky, 1965). Damaison y Moore (1980) también señalan la importancia del aporte de materia orgánica procedente del continente. Para estos autores, son variados los factores biológicos y físicos que influyen en la acumulación de la materia orgánica en los sedimentos. Entre los factores biológicos incluyen la productividad biológica primaria y la degradación bioquímica de la materia orgánica muerta por acción de metazoos y microorganismos. Entre los factores físicos citan el tamaño de la partícula y la velocidad de sedimentación. La velocidad de sedimentación de la materia orgánica particulada (MOP) es extremadamente lenta y varía entre 0,10 a 5 m por día según el tamaño y la forma. El tiempo de residencia de la MOP en la columna de agua está inversamente relacionada con su preservación; por lo tanto, es dependiente de la cantidad y calidad del material orgánico, del tamaño de la partícula, de la estratificación de la columna de agua y de la profundidad. Para el Golfo San Jorge, los valores obtenidos de MOT durante los períodos de estudio superan, sólo durante el ciclo anual primavera 1999 – invierno 2000, las concentraciones señaladas como normales para sedimentos marinos (entre 0,1% - 10%) (Establier et al., 1984) . Los valores superiores a 12 % señalan que los sedimentos se encuentran enriquecidos orgánicamente pero que no alcanzan los valores típicos de ambientes contaminados (Carrasco & Carvajal, 1995; Farias et al., 1996; Graco et al., 2001). En general, la distribución y abundancia de MOT se corresponde con lo indicado por Bordovsky (1965), quien observó que la concentración de MOT aumenta a medida que decrece el tamaño del grano dada la mayor capacidad de absorción que presentan los sedimentos finos y la baja actividad bacteriana de los sedimentos por la restringida difusibilidad de oxígeno. Las concentraciones máximas se localizan en el sector central del golfo, de mayor profundidad, de granulometría fina y de baja hidrodinámica. Los valores mínimos se localizan en los extremos del golfo, de menor profundidad, de granulometría gruesa, de elevada hidrodinámica, caracterizados por mayor flujo, y en el sector costero este donde predominan las arenas finas y características hidrodinámicas intermedias. Los resultados estacionales muestran que los máximos valores de MOT se presentan en invierno del primer período de estudio y en otoño del segundo período de estudio, correspondiéndose con la ruptura de la termoclina en invierno y la profundización de la misma en 97 otoño. Este proceso permitiría que la MOP producto de la producción primaria y secundaria que está retenida en la picnoclina, alcance el fondo. La importancia de la estratificación de la columna de agua con formación de picnoclina como agente reductor de la velocidad de sedimentación, fue desarrollo por Qasim & Sankaranarayanan (1972). Los mencionados autores, observaron que la haloclina actuaba como una barrera para la sedimentación del detrito, en un estuario tropical. Cuando prevalecen las condiciones homogéneas en la columna de agua, el material particulado en suspensión es mezclado, incrementando la sedimentación de los detritos; esto también fue observado para las aguas profundas del Mar de Irlanda (Trimmer et al., 1999). En general, en zonas costeras existe una relación directa entre la concentración de la materia orgánica particulada (MOP) depositada en el piso marino y la intensidad de los procesos productivos que ocurren en la columna de agua (Wassmann, 1985). En aguas costeras alrededor de un 25 a 50% de su productividad primaria logra depositarse en el fondo. Por ello la situación más frecuente en zonas de alta producción primaria, es que los sedimentos contengan altas concentraciones de compuestos orgánicos (Nelson et al. 2001). Esta situación no fue observada en el Golfo San Jorge durante la primavera del año 1999. La escasa concentración de MOT en sedimentos parece estar relacionada, tal como se discutió anteriormente, con el desarrollo de un escenario posterior al de los florecimientos primaverales en noviembre de 1999. Sin embargo, cabe señalar que según Sargent et al. (1983) la variabilidad estacional de la producción primaria no siempre se refleja en la cantidad y calidad de la materia orgánica de los sedimentos, ya que variados factores como aporte terrígeno, velocidad de sedimentación, degradación por microorganismos y pastoreo del zooplancton, podrían alterar la composición y el contenido orgánico de las partículas que están sedimentando, lo que llevaría a suavizar o eliminar los picos de materia orgánica sedimentada asociados con los pulsos de producción de la zona eufótica. Circunstancia semejante a las citadas han sido señaladas para otros ambientes con características comparables a nuestra área de estudio, como lo son: el fiordo de Balsfjorden, Noruega (Gulliksen, 1982; Sargent et al.,1983), la Bahía Beatriz de Nueva Zelandia (Gibbs et al., 2002) y la zona nerítica del noroeste del Mar Mediterráneo (Cahet et al., 1972). Gulliksen (op. cit.) observó en los sedimentos del fiordo, una cantidad de MOP proveniente de la zona eufótica tres veces superior en primavera - verano (después del bloom fitoplanctónico) que en otoño – invierno, postulando que una cantidad sustancial de materia orgánica fotosintetizada alcanzaría los sedimentos después de primavera. Estudios posteriores realizados por Sargent et al. (op. cit.) en la misma zona, señalaron que el principal regulador es el pastoreo zooplanctónico. El pastoreo, fundamentalmente por el zooplancton es probable que sea el principal mecanismo de regulación de la población de fitoplancton en primavera y verano en latitudes medias y altas. Es bastante 98 factible que una reducción de la cosecha de fitoplancton, siguiendo los florecimientos en estos mares, sea el resultado del pastoreo del zooplancton en lugar del efecto de un déficit de nutrientes No obstante, en aguas altamente productivas (expresada en término de clorofila a, concentraciones de 10 a 40 mg/m3) el pastoreo puede ser insuficiente para producir un efecto apreciable sobre la cosecha de fitoplancton (McAllister, 1970; Peinert et al., 1982). Carbono orgánico total Todos los valores de carbono orgánico total registrados para los sedimentos superficiales del Golfo San Jorge para el primer y segundo período de estudio, superan a los encontrados por Premuzic et al. (1982) en los sedimentos de la Plataforma Continental Argentina (valores entre 0,25% y 2,00%). En general, son comparables a los observados en otros ambientes semejantes como el Golfo de St. Lawrence, Canadá (valores entre 1,73% y 3,78%) (Pocklington, 1976), el Golfo de Carpentaria, Australia, (valores entre 0,86% a 2,12%) (Somers, 1987), el Golfo de California, USA, (ξ = 2,91%) (Calvert, 1976), el Golfo de Guayaquil, Ecuador, (ξ = 1,00%) (Rowe & Gilbert, 1977), la Bahía de Santa Bárbara, USA (ξ = 3,20%) (Calvert, op. cit) y la Bahía de Cádiz, España, (ξ = 1,48%) (Establier et al., 1984) y la región central de los fiordos y canales australes de Chile (valores entre 0,03 y 2,92%) (Nelson et al., 2001). Según lo postulado por Stein (1991), los valores más bajos de COT registrados en el sector costero y en los sectores próximos a los extremos del golfo, se encontrarían dentro del rango de valores que caracteriza a los sedimentos de tipo oceánico o de plataforma (valores menores a 1%). En relación a los resultados estacionales, los máximos valores de COT de invierno del ciclo primavera 1999 – invierno 2000, y de otoño del ciclo otoño 2001 – verano del 2002, se corresponderían con la ruptura de la termoclina en invierno y la profundización de la misma en otoño, lo que permite que la MOP producto de la producción primaria y secundaria que está retenida en la picnoclina, alcance el fondo. El patrón de distribución espacial se ajusta a lo descrito para MOT. Cabe aclarar, en relación con los valores de COT de la Plataforma Continental Argentina, que Degens y Mopper (1976), consideran a la misma rica en carbono orgánico y relacionan el relativo alto contenido orgánico con la alta productividad primaria del agua superficial resultante del "upwelling" en el área de la convergencia suptropical. 99 Nitrógeno total Los valores de nitrógeno total registrados en los sedimentos superficiales del golfo para el primer y segundo período de estudio, superan el rango de valores (0,06% a 0,20%) citado por Premuzic et al. (1982) para la Plataforma Continental Argentina. Los valores son también superiores a los observados en otros ambientes semejantes como el Golfo de Carpentaria, Australia, (valores entre 0,04% y 0,12%) (Somers, 1987), el Golfo de Lions, Francia, (valores entre 0,049% y 0,134%) (Buscail & Germain, 1997), y el Golfo de Cambay, India, (valores entre 0,030% y 0,084%) (Calvert, 1976), con predominio en todos ellos, de aporte de material orgánico de origen terrígeno hacia el sistema. Las concentraciones registradas pueden compararse con las observadas en el Golfo de St. Lawrence, Canadá, (valores entre 0,066% y 0,335%) (Pocklington, 1976), la Ría de Ares-Betanzos, España, (valores entre 0,02% a 0,25%) (Sánchez-Mata et al., 1999) y la región central de los fiordos y canales australes de Chile (valores entre 0,01 y 0,51%) (Nelson et al., 2001); sistemas caracterizados por un importante aporte de material orgánico de origen marino planctónico. Según lo indicado por Stein (1991), los valores de nitrógeno total observados para los sedimentos del Golfo San Jorge se encontrarían dentro del rango de valores esperable para sedimentos enriquecidos orgánicamente. En relación a los resultados estacionales, los máximos valores de NT de invierno del ciclo primavera 1999 – invierno 2000, se corresponden con la ruptura de la termoclina durante este período, lo que permite que la MOP producto de la producción primaria y secundaria retenida en la picnoclina, alcance el fondo. Los máximos valores de NT registrados en la primavera del ciclo otoño 2001 – verano 2002 podrían relacionarse con la sedimentación de material autóctono que, conjuntamente con el desarrollo de procesos vinculados a la acción de los vientos y de ciertas condiciones hidrodinámicas que rompieron la picnoclina, alcanzaron el fondo. Este material orgánico altamente nitrogenado, sería resultante del florecimiento primaveral registrado para este período (noviembre de 2001) como así también originado por la producción secundaria. Situaciones semejantes han sido registradas por Olesen y Lundsgaard (1995) en la bahía de Kattegat (Mar del Norte) al estudiar la sedimentación de material autóctono a través de la picnoclina, por Cailliau et al. (1999) en el Océano Índico y Pesant et al. (2002) en la plataforma este de Groenlandia, donde registraron que entre el 21% y el 60% de la producción primaria fue exportada hacia la profundidad favorecida por la acción de los vientos. Con respecto a la producción secundaria en el Golfo San Jorge y su contribución en el aporte de material orgánico al sistema bentónico y a los sedimentos, los estudios realizados por Pérez Seijas et al. (1987) y Viñas et al. (1992) en relación a la abundancia numérica de zooplancton, señalan que durante la primavera y el verano se observan los máximos valores de 100 copépodos, eufáusidos, misidáceos y larvas de estomatópodos en la columna de agua. Estos organismos, según trabajos sobre el rol del zooplancton en el ecosistema (Al-Mutairi & Landry, 2001; Turner, 2002; Schnetzer & Steinberg, 2002; Froneman et al., 2002; Anderson, 2003), podrían aportar hacia los sedimentos del golfo durante las estaciones citadas, partículas de rápida sedimentación como cuerpos o restos de organismos muertos y “faecal pellets” (mediante transporte pasivo), así como carbono y nitrógeno orgánico particulado productos de la respiración, excreción y degradación (mediante transporte activo por migración vertical). A la vez Beklemishev (1962) señaló la importante contribución del zooplancton en el aporte de material orgánico nitrogenado, en condiciones de un florecimiento de fitoplancton donde el zooplancton consume más fitoplancton del que puede asimilar. Durante este período los animales excretan fitoplancton en un estado de semidigestión, esto contribuye una cantidad considerable de material nutritivo al detritus. La distribución espacial de los valores presenta patrones semejantes a los de MOT y COT para el ciclo primavera 1999 – invierno 2000 relacionado con la batimetría, la granulometría y el hidrodinamismo; mientras que para el ciclo otoño 2001 – verano de 2002, dicho patrón se vincula en el sur del golfo en primavera, con áreas frontales que determinan áreas productivas. En el área sur del Golfo San Jorge como ya fue indicado, son de importancia el desarrollo de frentes de marea durante la estación primaveral y estival así como el frente termohalino de permanencia estacional y de posición variable (en el sector sur en invierno, primavera y verano y desplazado hacia el norte en otoño). Los sistemas frontales mediante el aporte de nutrientes determinarían la existencia de áreas productivas en primavera, verano y otoño, con importantes concentraciones de material orgánico altamente nitrogenado de origen planctónico. Relación C:N La relación C:N, fue enunciada en los primeros estudios sedimentológicos realizados por Trask (1932) para explicar el origen planctónico de la materia orgánica de los depósitos marinos. Considerando los cambios que se originan en el componente orgánico durante el proceso de sedimentación y los de mineralización del carbono y nitrógeno (Blackburn, 1986), la relación C:N da una indicación aproximada acerca del origen o procedencia de la materia orgánica presente en los sedimentos. Según Redfield et al. (1963), los sedimentos con una relación C:N de alrededor de 6,6 tienen un origen planctónico. Bordovsky (1965) y Majeed (1987) indican que una relación C:N de 15 indicaría un origen terrestre de los depósitos marinos. De acuerdo a Emery (1969) los valores C:N superiores a 15 se deben al alto contenido de carbono originado de la presencia de detritos de celulosa de la vegetación terrestre. Según Stein (1991), valores de C:N 101 menores a 10, revelan un componente orgánico en los sedimentos que es estrictamente marino en su origen, valores de C:N de 10, representan componentes orgánicos de origen marino y terrestre, mientras que, valores de C:N entre 10 y 30 indican materia orgánica predominantemente de origen terrígeno. Parsons et al (1977), a través de la relación C:N, no sólo define los orígenes de la materia orgánica sino también el valor nutricional de la misma. Para Parsons et al (op.cit.) y para Sargent et al (1983), la materia orgánica con una relación C:N entre 6 y 7, proviene del fitoplancton, de pellets fecales y de otros materiales orgánicos fácilmente degradables y se considera de alto valor nutricional. Los valores de la relación C:N de 10 o superiores a 10, indican material orgánico de origen terrígeno o material orgánico acumulativo, ("viejo") y muy mineralizado, difícilmente atacable por las bacterias y de bajo valor nutricional. Este material orgánico es conocido con el nombre de material refractario. Los valores de la relación C:N registrados para los sedimentos superficiales del Golfo San Jorge según lo señalado por Parsons et al. (1977) y Sargent et al. (1983) indican diferentes orígenes de la materia orgánica sedimentada en el golfo. Desde el punto de vista estacional y espacial, la materia orgánica de los sedimentos del golfo, estaría constituída, donde los valores de la relación C:N fueron menores a 10, por material de origen planctónico autóctono, producto de la producción primaria y secundaria del sistema, de alto valor nutricional, y donde los valores fueron superiores a 10, por material orgánico acumulativo o material de procedencia terrígena, alóctono, de bajo valor nutricional (empobrecidos). En el Golfo San Jorge no se registran aportes de aguas continentales según Baldoni (1990), ni es importante la acción de las lluvias en el lavado del terreno, considerándose las mismas escasas en la Patagonia (Akselman, 1996; Isla et al., 2002). Tampoco se han detectado afloramientos naturales de petróleo (Secretaría de Energía de la República Argentina). Los valores superiores a 10, indicarían material del tipo orgánico acumulativo más que material de procedencia terrígena. Cabe indicar que los valores de invierno de 2000 (ξ = 7,43) y primavera de 2001 (ξ = 6,16) reflejarían la presencia de material nitrogenado de origen planctónico en los sedimentos por sedimentación de los mismos desde la zona eufótica; los valores de verano de 2000 (ξ = 23,75) y otoño de 2001 (ξ = 8,08) evidenciarían el agotamiento de dicho material y la permanencia en los sedimentos del material del tipo acumulativo, caracterizado por compuestos bioquímicos estables de alto contenido en carbono, tal como lo indicara Bordovsky (1965). En cuanto a los máximos valores registrados durante el verano de 2000 en el extremo sur del golfo, los mismos responden a las bajas concentraciones de COT y NT. Fósforo Total (FT) 102 Sobre la concentración de fósforo total en sedimentos no se conocen estudios previos para la Plataforma Argentina. En el trabajo de Robles (1984) realizado en el Río de la Plata, se indican valores de fósforo absorbido en sedimentos en suspensión entre 0,01 y 0,16 %. Los valores registrados en nuestro estudio, fueron inferiores a los registrados en ambientes caracterizados por procesos de eutroficación y contaminación por aporte de efluentes de ciudades, como en la Bahía de Concepción, Chile, con valores de FT entre 0,134 y 1,145 % (Rudolph et al., 1984), como así también a los registrados en ambientes influenciados por el aporte de agua proveniente del lavado del terreno con importante carga de fosforados por actividad agrícola, como el lago costero de Manzalah del Mar Mediterráneo, Egipto, con valores de FT entre 0,019 y 0,158% (El Sabrouti et al., 1997). Los valores observados fueron semejantes a los de la Bahía de Pomerania, Mar Báltico (entre 0,005 a 0,065 %), sistema sin indicios de contaminación y donde se observa un florecimiento fitoplanctónico primaveral y dos secundarios, uno durante el verano y otro en el otoño (Burska et al., 1999). Desde el punto de vista espacial, las mayores concentraciones de FT se observaron en el zona sur del golfo de mayores profundidades, hecho que se relaciona con la granulometría fina del sector. Las partículas finas determinan fuertes asociaciones del fósforo bajo la forma de fosfato con minerales arcillosos según lo indicado por Price (1976) en sus estudios sobre química de los sedimentos. Desde el punto de vista estacional las mínimas concentraciones se registraron en primavera 2001 y en verano 2002, posiblemente como consecuencia de una demanda de fósforo en el sistema (por un incremento de la actividad biológica) que podría haber provocado la liberación del fósforo desde los sedimentos. Según estudios realizados en lagos de Dinamarca por Sondergaard et al. (2003), la retención de fósforo en los sedimentos exhibe un patrón estacional: retención positiva durante el invierno, independientemente del nivel de eutroficación y retención negativa durante el verano. En la mayoría de los lagos también se observó una fuerte retención negativa en mayo, lo que sugiere, según los citados autores, que el inicio de un incremento de la actividad biológica durante la primavera, es un disparador para la liberación de parte del fósforo retenido en los sedimentos durante el invierno. Clorofila a En relación a los pigmentos en sedimentos, los mismos provienen de diferentes fuentes: 1) del microfitobentos (vivo o detrital) in situ, 2) de la sedimentación del fitoplancton degradado y; 3) del material detrítico alóctono (de macrofitas, pellets fecales, partículas continentales o ribereñas). Las máximas concentraciones, se localizan en la capa superficial, hallándose 103 concentraciones menores en las capas profundas, lo que demuestra su rápida mineralización y reciclaje en otros compuestos orgánicos (Riaux - Gobin et al., 1987). En el Golfo San Jorge la clorofila a en sedimento proviene fundamentalmente de la sedimentación de material fitoplanctónico desde la zona eufótica, siendo de escasa importancia el aporte procedente de las macroalgas (Carreto, com, pers.). La distribución de las macroalgas se limita a la zona litoral del golfo (Boraso & Piriz, 1975; Boraso de Zaixso & Quartino, 1993). Su contribución en el aporte de clorofila a podría considerarse en las estaciones costeras del sector sur según lo registrado en los estudios de las comunidades bentónicas por Roux et al. (1995). En general los valores de clorofila a registrados para el Golfo San Jorge en el ciclo anual primavera 1999 – invierno 2000 y otoño 2001 – verano 2000 son semejantes a los observados durante la primavera en la Plataforma Continental de Creta, donde el valor medio de clorofila a fue de 2,5 µg/g a una profundidad de 40 m, 1,8 µg/g a una profundidad de 70 m, de 0,5 µg/g a una profundidad de 100 m y de 0,2 µg/g a profundidades entre 130 y 190 m, destacándose una correlación negativa entre la concentración de clorodila a y la profundidad, consecuencia de las características de la molécula de clorofila que rápidamente se degrada después de la citolisis o en ausencia de la luz (Karakassis & Eleftheriou, 1998). En relación al incremento de invierno de 2000 el mismo se correspondería con la ruptura de la picnoclina que permite que el material orgánico retenido, alcance el fondo. Los máximos valores registrados en la primavera del ciclo otoño de 2001 – verano de 2002 podrían relacionarse -tal como se indico para la variable NT- con la sedimentación de material fitoplanctónico que conjuntamente con el desarrollo de procesos vinculados a la acción de los vientos y de ciertas condiciones hidrodinámicas que rompieron la picnoclina alcanzaron el fondo. Dicho material orgánico sería resultante del florecimiento primaveral registrado para este período (noviembre de 2001) Situaciones semejantes han sido registradas para otros ambientes por Olesen y Lundsgaard (1995), Cailliau et al. (1999) y Pesant et al. (2002) y también discutidas en párrafos anteriores. En cuanto a los mayores valores de clorofila a registrados en los sedimentos durante la primavera de 2001 los mismos pueden ser consecuencia no sólo de la sedimentación de material fitoplanctónico desde la zona eufótica, sino también de productos de degradación de clorofila a que provienen del proceso digestivo del zooplancton herbívoro y de organismos bentónicos filtradores y alimentadores de depósitos (Riaux-Gobin et al. , 1987; Sun et al., 1994), los cuales podrían estar estimándose como pigmento, dada la técnica utilizada en nuestro estudio para analizar clorofila a. 104 Con respecto a la distribución espacial de los valores de concentración de clorofila a en los sedimentos del golfo durante el ciclo primavera 1999 – invierno 2000, no se reconoce un patrón estacional definido. En otoño y en invierno las concentraciones máximas se dieron en el sector central del golfo. En el ciclo otoño 2001 – verano 2002 el patrón de distribución de concentración de clorofila a es semejante a la de concentración de NT. Estudios sobre las variaciones estacionales de clorofila a en sedimentos, realizados para golfos y bahías de escasa profundidad y leve estratificación superficial de la columna de agua, relacionan la misma con los blooms fitoplanctónicos de primavera y otoño. Banta et al. (1995), quienes analizaron las concentraciones de clorofila a y feopigmentos en sedimentos de la Bahía de Buzzards, Massachussets (caracterizada por una profundidad de aproximadamente 15 m) observaron que los picos de clorofila a en sedimentos ocurrían al mismo tiempo o un poco después del incremento de clorofila a en la columna de agua, (después del bloom fitoplanctónico primaveral); mientras que el incremento en la concentración de feopigmentos, a fines del verano. Tal variación estacional fue también citada, por Danovaro et. al, (1994), para los sedimentos del Golfo de Marconi (10 m de profundidad) del Mar de Liguria, Italia, donde las concentraciones de clorofila a oscilaron entre 0,14 y 2,87 µg/g; con máximos durante los blooms fitoplanctónicos de primavera (valores de clorofila a de 2,36 µg/g) y otoño (valores de 1,82 µg/g). Lo mismo fue registrado para sedimentos del Golfo de Fos, Mar Mediterráneo, por Plante et al. (1986) con picos de clorofila a durante la primavera de 4,91 µg/g y el otoño de 0,91 µg/g. Los estudios comentados en el párrafo anterior, refuerzan el concepto de que la estratificación de la columna de agua y por consiguiente la formación de termoclina es una barrera que retrasa o limita los precesos de sedimentación de material orgánico producido en la zona eufótica hacia los sedimentos, tal como lo indicó Damaison y Moore (1980) Feopigmentos La concentración de feopigmentos en sedimentos, según Riaux-Gobin et al. (1987) son cuantitativamente importantes y en general pueden ser sobrestimadas en un 30 % usando como técnica de determinación la fluorométrica. En el Golfo San Jorge, tal como ya fuera referido para la clorofila a, los feopigmentos en sedimento, provienen fundamentalmente del material fitoplanctónico degradado, siendo de escasa importancia el aporte procedente de las macroalgas (Carreto, com, pers.). Los valores de feopigmentos registrados para el Golfo San Jorge, aumentan de primavera a invierno para el ciclo primavera 1999 a invierno 2000; y de otoño a primavera para el periodo otoño 2001 – verano 20002; siendo los mismos superiores a los observados para la Plataforma 105 Continental de Creta, donde el valor medio de feopigmentos fue de 6 µg/g (valor máximo = 12 µg/g) para profundidades entre 40 y 100 m y de 4 µg/g (valor máximo = 6 µg/g), para profundidades entre 130 y 190 m (Karakassis & Eleftheriou, 1998). El incremento de invierno de 2000 correspondería con la ruptura de la picnoclina que permite que el material orgánico retenido, alcance el fondo. Los máximos valores registrados en la primavera de 2001 podrían relacionarse tal como se indicó para las variables NT y clorofila a, con la sedimentación de material fitoplanctónico que conjuntamente con el desarrollo de procesos vinculados a la acción de los vientos y de ciertas condiciones hidrodinámicas que rompieron la picnoclina alcanzaron el fondo. Dicho material orgánico sería resultante del florecimiento primaveral registrado para este período (primavera de 2001) Situaciones semejantes han sido registradas para otros ambientes por Olesen y Lundsgaard (1995), Cailliau et al. (1999) y Pesant et al. (2002) y tambien discutidas en párrafos anteriores. La distribución horizontal de los valores durante los periodos primavera 1999 – invierno 2000 y otoño 2001 – verano 2002, se ajusta en general a lo descrito para MOT, donde los valores máximos se ubican hacia en el sector central más profundo del golfo. CLASIFICACIÓN Y ORDENACIÓN DE LAS VARIABLES AMBIENTALES. Los resultados obtenidos empleando técnicas estadísticas multivariantes basadas en la distribución espacial de las fracciones granulométricas, la composición química de los sedimentos superficiales, y la composición físico - química del agua de fondo así como de sus variaciones estacionales, han permitido caracterizar en el Golfo San Jorge para el ciclo “Primavera 1999 – invierno 2000”, tres sectores bien diferenciados. El Sector 1 es el de mayor extensión y profundidad y comprende el interior del golfo delimitado por la isobata de 80 m. El sistema desde el punto de vista hidrográfico presenta un ciclo estacional típico de aguas templadas (Akselman, 1996; Cucchi Colleoni & Carreto, 2001). Según Folk, (1980), Ríos y Cisternas (1998) y Velazco Castillo (1999) dadas las características granulométricas tanto físicas como químicas de los sedimentos del sector (granulometría fina y elevadas concentraciones de material orgánico) el mismo correspondería a un Ambiente Deposicional, caracterizado por condiciones hidrodinámicas bajas y estables que favorecen la depositación de elementos granulométricos finos provenientes de los ambientes menos profundos del golfo y de material orgánico suspendido en la columna de agua. 106 Los valores de MOT, COT, NT, clorofila a, feopigmentos y los de la relación C:N registrados en los sedimentos superficiales de este sistema, presentan una clara variación estacional relacionada con el ciclo de estabilización y ruptura de la termoclina. Los máximos valores de invierno, se corresponderían con la ruptura de la termoclina durante este período, lo que permite que la MOP alcance el fondo. Este acople entre el sistema pelágico y el bentos unido a la menor actividad biológica impuesta por la baja temperatura imperante, está de acuerdo con la mayor abundancia y calidad nutritiva de la materia orgánica asociada a dichos sedimentos durante el invierno. Los mínimos valores de MOT y NT que se presentan durante el verano y la consecuente disminución del oxígeno disuelto observada en el agua de fondo desde la primavera al verano indican que en este último período, la utilización biológica del material orgánico en la columna de agua es elevada y sólo permanece en los sedimentos la materia orgánica refractaria de alto contenido relativo de carbono (Bordovsky 1965). Durante la primavera y el otoño, no se observaron elevadas concentraciones de clorofila a en el agua de superficie, atribuible, de acuerdo a lo discutido anteriormente, al desarrollo durante los citados períodos de un escenario posterior al de los florecimientos. Sin embargo, los sedimentos de la región para la primavera y el otoño presentaron moderadas concentraciones de MOT, COT y NT y valores intermedios de la relación C:N, lo que hace suponer que el flujo de carbono hacia los sedimentos no está sincronizado con los pulsos estacionales de producción primaria en la capa superficial, tal como lo indicara Wassmann (1985). Esta falta de sincronismo sugiere que los compuestos lábiles de carbono han sido degradados por los heterótrofos en la capa superficial limitada por la termoclina y que sólo una pequeña proporción compuesta por grandes partículas alcanza a depositarse en los sedimentos. El Sector 2 comprende las zonas próximas a los extremos del golfo: Cabo Tres Puntas y Cabo Dos Bahías. Según Folk (1980), Ríos y Cisternas (1998) y Velazco Castillo (1999) dadas las características granulométricas tanto físicas como químicas de los sedimentos del sector (granulometría gruesa y bajas concentraciones de material orgánico) el mismo corresponde a un Ambiente de Flujo o Erosivo, caracterizado por el flujo o movimiento continuo de agua que genera una elevada energía cinética y la erosión de las partículas granulométricas. Este flujo estaría dado por la acción de las corrientes de marea (Glorioso, 1985; Isla et al., 2002) y principalmente en el extremo sur del golfo por el ingreso de las Aguas Costeras provenientes del Estrecho de Magallanes (Bianchi et al., 1982). 107 En este sistema no se observa la formación de una termoclina dada la continua turbulencia del medio. Esto favorece la homogenización y suspensión de la MOP en la columna de agua dificultando la sedimentación de la misma, lo que concuerda con los bajos valores de concentración de componentes orgánicos registrados en los sedimentos. La MOP en suspensión autóctona y/o alóctona podría ser transportada hacia otros sectores de menor energía. El sistema según Ríos y Cisternas (1998) y Damaison y Moore (1980) corresponde a un sistema ventilado dado los altos niveles de concentración de oxígeno en agua, producto principalmente del continuo aporte del mismo desde las capas superficiales. En relación a las variaciones estacionales de MOT, COT y NT, los mínimos valores se presentan en el verano, mientras que los máximos en primavera, determinando un valor de la relación C:N próximo a 6. Este valor indica un aporte fitoplanctónico (Stein, 1991) a la composición de la materia orgánica de los sedimentos, que concuerda con los máximos valores de clorofila a y feopigmentos registrados en ellos. Los valores de clorofila a en agua fueron superiores a los observados para el sector 1. No; se observaron concentraciones elevadas durante la primavera y el otoño según lo indicado por Akselman (1996) para este período. Esto indicaría al igual que lo señalado para el sector 1, un escenario posterior al de los florecimientos; situación que se relaciona con los máximos valores de concentración de material orgánico observados en los sedimentos del sector durante la primavera. Podría decirse que en este sector, a diferencia del sector 1, el flujo de carbono hacia los sedimentos estaría sincronizado con los pulsos estacionales de producción fitoplanctónica de la capa eufótica, tal como lo indicara Wassmann (1985), posiblemente como consecuencia de la menor profundidad del sector y la falta de barreras físicas en la columna de agua. El Sector 3 comprende la zona costera y el sudeste del golfo. Este sector corresponde a un Ambiente Transicional con características intermedias a las citadas para los sectores 1 y 2. El sector presenta, 1) en su parte más litoral, características del sector 2 tales como menor profundidad y elevado hidrodinamismo que no permite la estratificación de la columna de agua, y 2) en su parte más profunda, características del sector 1, bajo hidrodinamismo y termoclina estacional. Estas particularidades hidrográficas permiten la formación de sistemas frontales (frentes de marea) de variabilidad espacial marcada, caracterizados por una productividad sostenida durante primavera y verano. Los citados frentes costeros son de gran importancia en el sector sudeste del golfo, dada la amplitud de las mareas aquí imperantes. A la vez este sector está bajo la influencia de las Aguas Costeras de origen magallánico que generan un frente termohalino 108 de permanencia estacional y variabilidad espacial marcada (Carreto et al., 1985, 1986; Glorioso, 1987; Glorioso & Flather, 1997; Guerrero & Piola,1997). Los sedimentos del sector constituidos por arenas muy finas, presentan concentraciones moderadas de MOT, COT, NT y feopigmentos, que pueden considerase concentraciones intermedias con respecto a las registradas para el sector 1 y 2, determinándose un gradiente positivo que se incrementa con el aumento de la profundidad y la disminución de la energía cinética. En cuanto a la producción fitoplanctónica, los valores de concentración de clorofila a en agua fueron intermedios a los observados para el sector 1 y 2, no registrándose durante la primavera y el verano concentraciones relativamente elevadas como consecuencia del desarrollo de los sistemas frontales. Sin embargo, los estudios de imágenes satelitales de clorofila-a Sea WIFS del año 2000 (Proyecto de Telemetría Satelital e Imágenes, INIDEP) para el Golfo San Jorge señalan para la primavera y el verano concentraciones relativamente elevadas y sostenidas de clorofila a relacionadas con el desarrollo de los citados sistemas frontales. En relación al contenido orgánico de los sedimentos durante la primavera, el verano y el otoño, los mismos presentaron moderadas concentraciones de MOT, COT y NT, lo que sugiere al igual que lo observado para el sector 1 que el flujo de carbono hacia los sedimentos no está sincronizado con los pulsos estacionales de producción primaria. Los máximos valores de MOT, COT y los mínimos valores de la relación C:N al igual que el sector 1, se observaron en invierno, siendo la concentración de clorofila a en agua durante esta estación relativamente baja y homogénea, lo que indica que la ausencia de termoclina parece ser la responsable del máximo estacional de clorofila a observado durante esta estación en el agua de fondo y de clorofila a y feopigmentos en los sedimentos del sector. Nuevamente se evidencia en invierno, al igual que en el sector 1, un acople entre el sistema pelágico y el bentos representado por la mayor abundancia y calidad nutritiva de la materia orgánica de los sedimentos. Los mínimos valores de MOT, COT y NT y de concentración de oxígeno en agua de fondo observados en el verano, podrían relacionarse con los procesos de oxidación del material orgánico sedimentado, característica también observada para el sector 1. Dado lo expuesto, se puede decir que este sector que corresponde a un Ambiente Transicional, presenta características mas afín al sector 1 con características de ambiente deposicional que al sector 2 correspondiente a un ambiente de flujo o erosivo. Para el ciclo otoño 2001 – verano 2002, los sectores definidos presentan algunas diferencias respecto al ciclo antes analizado. En primavera, mayores concentraciones de clorofila 109 a en agua de superficie y en la capa de mezcla así como y mayores concentraciones de MOT, NT, Cl a y feopigmentos en sedimentos. Los valores de clorofila a en agua de superficie registrados estarían indicando un escenario de florecimientos en la primavera de 2001 en el golfo ya que los valores observados coinciden con los señalados por Akseman (1996). A su vez las mayores concentraciones de material orgánico registradas en los sedimentos indicarían, conjuntamente con el valor de la relación C:N, una mayor cantidad de componente marino de origen planctónico altamente nitrogenado y de importante valor nutricional constituyendo la materia orgánica de los sedimentos durante la primavera de 2001. Este material orgánico sería producto tanto de la producción primaria como de la secundaria y en el Sector 1 y 3 (Ambiente Deposicional y Transicional, respectivamente) alcanzaría el fondo como consecuencia de la sedimentación y del desarrollo de procesos vinculados a la acción de los vientos y de ciertas condiciones hidrodinámicas que rompen la picnoclina favoreciendo su exportanción hacia la profundidad (Olesen & Lundsgaard, 1995; Cailliau et al., 1999; Pesant et al., 2002). Mientras que en el sector 2 (Ambiente de Flujo o Erosivo) la escasa profundidad y la ausencia de termoclina permiten el flujo del material autóctono de la capa eufótica hacia los sedimentos. El Sector 2, como consecuencia de sus particularidades oceanográficas, presenta un mayor desarrollo areal, ya que se extiende siguiendo el litoral desde el extremo sur (Cabo Tres Puntas) hacia el oeste, hasta aproximadamente Bahía Lángara. 4.1.2.- TERCER PERÍODO DE ESTUDIO (Sur del Golfo San Jorge, Invierno de 2003). Variables hidrográficas del agua de fondo Temperatura El rango de temperatura observado en el agua de fondo para el sur del Golfo San Jorge es superior al registrado por Akselman (1996) para el invierno de 1984 y al observado durante el presente estudio para el invierno de 2000 y de 2001. Este incremento de la temperatura concuerda con los estudios de anomalía promedio de la temperatura de agua de superficie del Golfo San Jorge desde enero de 1982 a julio de 2005, donde las mismas se desvían de la media (con valores superiores al valor promedio) en forma sostenida a partir del año 1997 (Proyecto Langostino, 2005). imágenes satelitales de clorofila-a Sea WIFS del año 2000 110 Sanilinidad El rango de salinidad observado en el agua de fondo es similar al registrado por Akselman (1996) para el invierno de 1984 y al observado para el invierno de 2000 y de 2001. Dicho rango indica, (como ya fue mencionado en el item 4.1.1) la existencia de dos tipos de aguas: 1) las denominadas Aguas de Plataforma y 2) las Aguas Costeras (Brandhorst & Castello, 1971; Bianchi et al., 1982). La distribución horizontal muestra en general un gradiente de salinidad positivo de sentido sur a norte que refleja la influencia de las Aguas Costeras (Bianchi et al., 1982). Densidad Los valores calculados de densidad coinciden con lo observado por Akselman (1996), observándose inferiores a los registrados para el invierno de 2000 y de 2001. La distribución horizontal y vertical de la variable refleja en el sector sur hacia el sector central del umbral del golfo el frente termohalino (Glorioso, 1987; Glorioso & Flather, 1995; Akselman, 1996; Cucchi Colleoni & Carreto, 2001) ya indicado para los anteriores periodos de estudio. Concentración de oxígeno disuelto Los valores de concentración de oxígeno para el agua de fondo se observan inferiores a los registrados durante el invierno de 2000 y de 2001. A excepción de cuatro registros con valores entre 1,30 y 2,95 ml O2/l localizados en el sector central y profundo del golfo que indican condiciones de hipoxia, los valores se encuentran dentro de los parámetros normales citados para ambientes de plataforma continental oxigenados con valores de oxígeno disuelto superiores a 3 ml O2/l (Bernd & Simoneit, 1978). La presencia de agua fondo de bajo contenido de oxígeno llegando a condiciones de hipoxia que compromete la supervivencia de los organismos, respondería a deficiencias locales de oxígeno, ya que estudios sedimentológicos realizados por Fernández y Roux (1999) revelan para este sector, importantes niveles de concentración de materia orgánica en sedimentos en proceso de oxidación. Concentración de clorofila a Según lo indicado en el item 4.1.1. las variaciones estacionales de biomasa fitoplanctónica en el Golfo San Jorge, presentan el característico ciclo bimodal de aguas templadas, con un 111 máximo principal durante la primavera y otro secundario durante el otoño, observándose según Akselman (1996) durante la etapa invernal una homogeneidad en la distribución vertical y horizontal de los valores de clorofila a. Durante el invierno del año 2003, los valores promedio de clorofila a en la columna de agua fueron inferiores a los registrados por Akselman (1996) en invierno de 1984 y a los registrados durante el presente estudio en el invierno de 2000 y 2001 en agua de fondo. Variables sedimentológicas Caracterización física del sedimentos La cartografía sedimentaria en el invierno de 2003 respecto a la confeccionada para el primer período de estudio de esta tesis (primavera de 1999) presentó un mayor porcentaje de granulometría fina, posiblemente consecuencia de la dinámica del sector así como de la actividad pesquera que provoca la resuspensión de los sedimentos (Bertuche et. al, 1999, 2000; Roux, 2000 a) Los tipos sedimentarios del sur golfo muestran una composición de los fondos en el que predomina el tipo sedimentario arcilla limosa. Los diferentes tipos sedimentarios definidos siguen un gradiente espacial y batimétrico desde la costa y el sector SE (umbral del golfo) hacia la zona central y profunda del mismo. Esto concuerda de manera general con la disposición de los tipos sedimentarios diferenciados en el Golfo San Jorge durante la primavera de 1999, donde se observaron los tipos arena limosa y limo arenoso en el sector sur del umbral del golfo y el tipo sedimentario limo arcilloso como dominante en el sur. Caracterización química de los sedimentos Materia orgánica total Para el sur del Golfo San Jorge, los valores obtenidos de MOT fueron semejantes a los observados para los inviernos 2000 y 2001. Al igual que lo indicado para el primer y segundo periodo de estudio, los valores superan las concentraciones señaladas como normales para sedimentos marinos (entre 0,1% - 10%) (Establier et al., 1984). Los valores superiores a 12 % señalan que los sedimentos se encuentran enriquecidos orgánicamente pero que no alcanzan los valores típicos de ambientes contaminados (Carrasco & Carvajal, 1995; Farias et al., 1996; Graco et al., 2001). 112 La distribución de los valores está en concordancia con los sectores definidos para el sur del golfo, sobre la base de las características granulométricas y la hidrodinámica del ambiente. Las concentraciones máximas se localizan en el sector interno del golfo, de mayor profundidad, de granulometría fina, de baja hidrodinámica y con características deposicionales y los valores mínimos en el sector SE del umbral del golfo, de menor profundidad, de granulometría más gruesa y de mayor hidrodinámica . Carbono orgánico total Los valores de carbono orgánico total registrados para el sur del Golfo San Jorge concuerdan con los encontrados por Premuzic et al. (1982) para los sedimentos de la Plataforma Continental Argentina; siendo los mismos levemente inferiores a los registrados para los inviernos de 2000 y 2001. El patrón de distribución espacial se ajusta a lo descrito para MOT. Nitrogeno total Los valores de nitrógeno total registrados para los sedimentos superficiales del sur del golfo al igual que lo observado para los inviernos de 2000 y 2001 superan levemente el rango de valores (0,06% a 0,20%) citado por Premuzic et al. (1982) para la Plataforma Continental Argentina, siguiendo el patrón de distribución espacial lo descrito para MOT. Relación Carbono:Nitrogeno Los valores de la relación C:N registrados para los sedimentos superficiales del Golfo San indican según lo señalado por Parsons et al. (1977) y Sargent et al. (1983) que la materia orgánica de los sedimentos estaría fundamentalmente constituida por material de origen planctónico autóctono, derivado de la producción primaria y secundaria del sistema y de alto valor nutricional. Los valores de la relación C:N próximos a 7 reflejarían la presencia de material nitrogenado de origen planctónico en los sedimentos por sedimentación de los mismos desde la zona eufótica. Fósforo Total Los valores de fósforo total registrados para los sedimentos superficiales del sur del golfo al igual que lo observado para el invierno de 2001 y conforme a lo discutido en el item 4.1.1., fueron inferiores a los registrados en ambientes caracterizados por procesos de eutroficación y contaminación (Rudolph et al., 1984) como así también a los registrados en ambientes influenciados por el aporte de agua proveniente del lavado del terreno con importante carga de 113 fosforados por actividad agrícola (El Sabrouti et al., 1997). Los valores fueron semejantes a los observados en la Bahía de Pomerania, Mar Báltico sistema sin indicios de contaminación y donde se observa un florecimiento fitoplanctónico primaveral y dos secundarios, uno durante el verano y otro en el otoño (Burska et al., 1999). El patrón de distribución espacial se ajusta a lo descrito para MOT. Clorofila a Los valores de clorofila a registrados para el sur del Golfo San Jorge fueron superiores a los observados en invierno de 2000 e inferiores los registrados en invierno de 2001 siendo los mismos comparables con los registrados durante la primavera en la Plataforma Continental de Creta, donde el valor medio de clorofila a fue de 2,5 µg/g a una profundidad de 40 m, 1,8 µg/g a una profundidad de 70 m., de 0,5 µg/g a una profundidad de 100 m y de 0,2 µg/g a profundidades entre 130 y 190 m (Karakassis & Eleftheriou, 1998). Feopigmentos El valor promedio de feopigmentos registrado para el sur del Golfo San Jorge fue inferior al observado en los inviernos de 2000 y 2001, siendo los mismos superiores a los observados para la Plataforma Continental de Creta, donde el valor medio de feopigmentos fue de 6 µg/g (valor máximo = 12 µg/g) para profundidades entre 40 y 100 m y de 4 µg/g (valor máximo = 6 µg/g), para profundidades entre 130 y 190 m (Karakassis & Eleftheriou, 1998). 1La distribución horizontal de los valores se ajusta en general a lo descrito para MOT. CLASIFICACIÓN Y ORDENACIÓN DE LAS VARIABLES AMBIENTALES. Los resultados obtenidos empleando técnicas estadísticas multivariantes basadas en la distribución espacial de las fracciones granulométricas, la composición química de los sedimentos superficiales, y la composición físico - química del agua de fondo así como de sus variaciones estacionales, han permitido caracterizar en el sur Golfo San Jorge dos sectores bien diferenciados. El Sector 1, que es el de mayor extensión y comprende el interior del golfo y el Sector 2 que comprende la zona externa, ubicada sobre el umbral del golfo. De acuerdo a Folk, (1980), Ríos y Cisternas (1998) y Velazco Castillo (1999), el Sector 1 dadas las características granulométricas tanto físicas como químicas de los sedimentos (fracciones granulométricas finas y elevadas concentraciones de MOT, COT, NT y clorofila a y feopigmentos) corresponde al Ambiente Deposicional; el sector 2 (con granulometría mediano 114 fina y bajas concentraciones de MOT, COT, NT, clorofila a y feopigmentose en sedimentos) corresponde al Ambiente Transicional, coincidiendo con lo ya descrito en los períodos previos de estudio. 4.2.- COMUNIDADES MACROBENTÓNICAS DEL GOLFO SAN JORGE. OTOÑO DE 2000. Los sectores definidos en el Golfo San Jorge para otoño de 2000, considerando los cuatro grupos faunísticos más representativos del área: los Equinodermos, Moluscos, Crustáceos y Anélidos Poliquetos, (Roux & Fernández 1997; Roux et al., 1995, 2000) y conforme a los resultados obtenidos empleando técnicas estadísticas multivariante utilizadas por gran número de investigadores del sistema bentónico (Basford et al., 1989; Clarke & Ainsworth, 1993; Eleftheriou & Basford, 1989; Hosie & Cochran, 1994; Warwick & Clarke, 1991), corresponden a los ambientes ya definidos en base a las variables físico-químicas de los sedimentos y agua de fondo. El sector 1 y 3 (centro del golfo y sudoeste y norte del golfo, respectivamente) corresponderían al Ambiente Deposicional, mientras que el sector 2 correspondería tanto al Ambiente de Flujo o Erosivo (en el sector próximo al extremo sur) como al Ambiente Transicional (en el sector litoral y sudeste del umbral del golfo). Los sectores 1 y 3 presentan bajos valores de densidad diferenciándose entre si en su riqueza especifica, diversidad y uniformidad; siendo estos parámetros poblacionales mayores en el sector 3. En el sector 1 el grupo dominante es el de los Equinodermos con la especie Pseudechinus magellanicus, seguido por los Crustáceos con Munida subrugosa y los Poliquetos con Cystenides ehlersi. En este sector 3, el grupo dominante es el de los Crustáceos con la especie Austropandalus grayi, seguido por el de los Equinodermos con el asteroideo Diplasterias brandti y los Moluscos con Mytilus platensis. Este ambiente Deposicional (sector 1 y 3) de tipo sedimentario limo arenoso y limo arcilloso, presenta dos asociaciones importantes, ambas compuestas por las mismas especies Leanira quatrefagesi, Asychis amphyglipta, Cistenides ehlersi, Nuculana sulculata, Nucula puelcha, Kennerleya patagonica, Pterygosquilla armata armata, Austropandalus grayi Callianassa brachyophthalma, Munida subrugosa y Pseudechinus magellanicus, siendo diferentes las especies dominantes. En el tipo sedimentario limo arenoso domina Nuculana 115 sulculata mientras que en tipo limo arcilloso Psedechinus magellanicus seguido por Nuculana sulculata . El sector 2 presenta altos valores de densidad, riqueza específica, diversidad y uniformidad. El grupo dominante es el de los Moluscos con Nuculana sulculata, seguido por el de los Equinodermos con Ophuira sp y los Crustáceos con la especie Munida subrugosa. En el Ambiente de Flujo o Erosivo (sector próximo al extremo sur), con los tipos sedimentarios grava arenosa y arena gravosa, se destaca una asociación integrada por Nuculana sulculata, Nucula puelcha, Kennerleya patagonica, Pterygosquilla armata armata y Munida subrugosa con dominio de Nuculana sulculata, en bajas abundancias. En el Ambiente Transicional, en el tipo sedimentario grava (costero al norte de Comodoro Rivadavia) se deferencia una asociación integrada fundamentalmente por Leanira quatrefagesi, Semirrosia tenera, Peisos petrunkevitchi, Austropandalus grayi, Munida subrugosa y Pseudechinus magellanicus, con el dominio de Pseudechinus magellanicus; mientras que en el tipo sedimentario arena limosa (costero sur y sudeste del umbral del golfo) se registra una asociación integrada por Nuculana sulculata, Nucula puelcha, y Munida subrugosa con dominio de Nuculana sulculata Los menores valores de densidad que se observan en el sector 1 y 3 del golfo de sedimentos finos homogéneos pueden ser atribuidos a la historia reciente del sector (1998-2001), muy afectada por diversos tipos de actividades antropogénicas tales como actividades y prospecciones petroleras, pesca, cercanía de centros urbanos, etc. (Roux, 2000; Roux & Bertuche, 1998; Roux et al. 1999). Este situación no coincidiría con lo señalado por Roux y Fernández (1997) quienes caracterizan estos tipos sedimentarios por altas densidades de individuos de diversas especies, una fuerte dominancia y una baja riqueza específica. Desde este punto de vista muchos han sido los estudios realizados sobre áreas sometidas a distinto grado de perturbación pesquera y su consecuencia sobre las comunidades bentónicas; destacándose que la magnitud y duración de estas perturbaciones depende de muchos factores entre los que se destacan el tipo de sustrato y la vulnerabilidad de los organismos bentónicos (Thrush et al., 1995; Tuck et al., 1998). La mayor diversidad que se observa en el sector 2 se debe a la naturaleza heterogénea del sedimento que favorece la diversidad de especies debido al mayor número de nichos ecológicos facilitados por la diversidad del sustrato. Sin embargo este tipo de sustrato dificulta la proliferación del número de individuos, resultando en bajos valores de densidad según Sánchez Mata (1996), hecho que no se observa en nuestro estudio debido a la influencia de dos tipos de ambientes. Según McNaughton (1978) se puede interpretar que este sector al tener una alta diversidad es el más estable, aunque se debe tener en cuanta la estructura de las comunidades en 116 el sector de estudio. De acuerdo con esto, Connell (1978) describe de qué manera en arrecifes de corales, la inestabilidad medioambiental puede jugar un papel importante en el mantenimiento de una diversidad en “no equilibrio” que depende de la frecuencia de perturbación (Kaiser & Spencer, 1996; Lindley et al., 1995; Lindeboom & de Groot, 1998). Lo presentado anteriormente concuerda con los diversos aspectos ecológicos de las diferentes especies consideradas, tal como fuera analizado para los crustáceos por Roux y Piñero (en prensa), para los moluscos bivalvos por Piñero y Roux, (2001) y para los poliquetos por Bremec y Roux, (1995), en estudios donde se analiza la ecología trófica, la distribución, los hábitos y comportamientos de estas especies en el Golfo San Jorge. Desde un punto de vista trófico se observa una distribución de las especies coincidiendo con los distintos tipos sedimentarios tal como fuera observado por Sánchez Mata (1993 b) en la ría de Ares-Betanzos. Es así que en los fondos de granulometría fina se destacan las especies de hábitos depositívoros como: Asychis amphyglipta y Cistenides ehlersi, suspensívoros tales como: Nuculana sulculata, Nucula puelcha y Kennerleya patagonica, y facultativos como Callianassa brachyophthalma, Munida subrugosa, entre otros. En ambientes caracterizados por granulometría mediana, predominan especies de hábitos carnívoros-omnívoros como las especies Leanira quatrefagesi, Semirrosia tenera, Peisos petrunkevitchi, Austropandalus grayi. En fondos del tipo sedimentario grava arenosa y arena gravosa, se registran crustáceos carnívoros tales como Pterygosquilla armata armata, Munida subrugosa y carroñeros Peltarion spinosulum. Este aspecto ha sido observado en diferentes estudios que indican que las comunidades bentónicas infaunales se encuentran organizadas estructural y funcionalmente en base a gradientes de enriquecimiento orgánico, siendo la disponibilidad de las fuentes de alimento uno de los factores que subyacen a la composición y distribución faunística del bentos, modificado por la interacción de los factores ambientales los que deben ser considerados tal como lo subraya Kaiser (1998) en sus estudios sobre disturbios en fondos de pesca. Los organismos heterótrofos del bentos marino son predominantemente suspensívoros y detritívoros a excepción de algunas especies de alimentación facultativa. La segregación de los grupos tróficos considerando la distribución e interrelación trófica entre los organismos bentónicos y las características sedimentológicas del medio que habitan ha sido analizada en diferentes estudios bentónicos de amplio rango latitudinal: como en la Bahía de Delaware, USA (Maurer et al., 1979, en las costas bretonas, Francia (Hily, 1984), en la Bahía de Santander, España (Lastra et al., 1991) y en la Ría de Ares-Betanzos, Galicia, España (Sánchez Mata et al., 1993 a y b). Sánchez Mata (1996) en la Ría de Ares Betanzos identificó una sucesión espacial de grupos dados sus hábitos tróficos, donde los depositívoros de superficie se establecen en interacción con los suspensívoros en los 117 fondos de fracción fina de la mayor parte de la ría, con una distribución en estos fondos marcada por la preferencia en arenas finas orgánicamente enriquecidas (poliquetos, crustáceos y equinodermos depositívoros superficiales) en arenas finas con menores niveles de materia orgánica (moluscos depositívoros superficiales y suspensívoros) y en fondos de fracción gruesa del área externa sometidos a fuerte hidrodinamismo y con mínimos aportes orgánicos (carnívoros como equinodermos asteroideos y crustáceos decápodos). Con respecto a las especies de mayor importancia de los grupos considerados en el golfo durante el periodo de estudio, teniendo en cuenta su abundancia relativa y frecuencia de aparición, se destaca la total dominancia del equinodermo Pseudechinus magellanicus seguida por la de los Moluscos Nuculana sulculata, Nucula puelcha, los Crustáceos, Munida subrugosa y Austropandalus grayi y los Poliquetos Cistenides ehlersi y Asychis amphiglypta. Este alto predominio de P. magellanicus tiene su origen en los procesos de defaunación y recolonización de los fondos del golfo de acuerdo a lo indicado por Roux y Bertuche (1998). Este proceso de defaunación ha llevado a una disminución en el número de especies en general, siendo en los grupos analizados, de 68 % para los equinodermos, de 63 % para los moluscos, de 24 %, para los crustáceos y de 69 % para los poliquetos considerando los datos registrados en los primeros relevamientos realizados en 1992 (Roux & Fernández, 1997; Roux et al., 1995). Roux y Bertuche (1998) describen las alteraciones o disturbios que se producen en los fondos, ya sean de origen físico o químico que tienen como efecto más notable una reducción de la riqueza específica, el desarrollo de grandes poblaciones monoespecíficas, el aumento de la biomasa de estas especies, la simplificación de la estructura trófica y finalmente el establecimiento de poblaciones inestables, en otras palabras, una reducción de la biodiversidad. Las primeras especies que desaparecen son las más características de la comunidad, es decir las más adaptadas. Este sería el caso de la desaparición casi total de las especies dominantes en el sector central del Golfo San Jorge, Nuculana sulculata y Nucula puelcha, tal como fuera observado durante los relevamientos realizados durante en 1997 y 1998 (Roux & Bertuche, 1998). Estos aspectos han sido observados por otros autores que sostienen además que se detecta una reducción de la biomasa y una desestructuración del ecosistema bentónico (Gislason, 2003). Kaiser (1998) trata en trabajos de revisión detalles sobre las perturbaciones causadas en ambientes bentónicos por la pesca de fondo. Posiblemente en nuestro caso nos encontramos, en el período de estudio analizado en la presente tesis, en la situación de recolonización que conduce al desarrollo de grandes poblaciones, tal como lo plantearan Cabioch et al. (1980), Planas y Mora (1987) y Mora et al. 118 (1994, 2003) en sus estudios sobre comunidades bentónicas de zonas fuertemente alteradas por actividades urbanas, industriales y extractivas. Pseudechinus magellanicus a través de una gran ampliación de su distribución hacia el sector central del golfo San Jorge, área en la cual no se registrara gran abundancia antes de 1998 (Roux et al., 1995) y con un incremento de ejemplares juveniles a partir principios de 1999, sería la especie indicadora y representante de los procesos que se observaron. Durante estos procesos su densidad alcanzó valores que, en algunas estaciones superaron los 27.000 ind./0,00025 mn2, con un valor medio de 1.240 ind./0,00025 mn2; su distribución geográfica se extendió ampliamente a casi la totalidad del Golfo San Jorge. 4.3. CONCENTRACIONES DE LANGOSTINO DEL SUR DEL GOLFO SAN JORGE. INVIERNO DE 2003. El langostino (Pleoticus muelleri) del Mar Argentino es un crustáceo decápodo del suborden Dendrobranchiata, superfamilia Penaoidea, familia Solenoceridae, que agrupa a los crustáceos que de manera generalizada se los denomina camarones penaeoideos (Boschi, 1989). Los límites latitudinales de su distribución son: las costas de Santa Cruz (50º 00’S) y Río de Janeiro, Brasil (23º 00’S). Se lo captura en profundidades que oscilan entre 3 y 100 m. El langostino argentino es una especie de aguas templado-frías, exclusivamente marina y de hábitos demersal-bentónicos, integrándose con las comunidades bentónicas tanto por su hábitat como por su alimentación, ya que ingiere principalmente invertebrados bentónicos (crustáceos, poliquetos, pelecípodos, etc) como así también detritos, verificándose una fuerte tendencia a la predación más que a la ingesta pasiva de detrito (Boschi, 1989; Albertó et al., 1993; Roux, et al., 2002). El sustrato, principalmente de fondos blandos constituidos por arena fina y fango tienen un papel importante en las distintas etapas de su ciclo de vida entre otros aspectos brindándole refugio durante los períodos de mayor luminosidad solar y cuando mudan (Boschi, 1989). Presenta un ciclo de vida corto, considerado anual en términos pesqueros, una tasa de crecimiento alta y variable espacio-temporalmente y un gran potencial reproductivo. La fecundidad relativa media del langostino del litoral patagónico, durante el período de máxima actividad reproductiva, es de un orden de magnitud de 35 veces superior a la de cualquiera de los peces que soportan explotación pesquera (ej. merluza, corvina) (Machi et al., 2005). La temporada de pesca del langostino patagónico se inicia en el sur del Golfo San Jorge y se mantienen en esta área durante todo el primer semestre. En el segundo semestre la flota trabaja 119 en aguas exteriores del golfo, principalmente al sur de 46º 00’S. A partir de octubre parte de la flota tangonera opera en el área norte del golfo sobre las concentraciones que ingresaron nuevamente a las aguas interiores del mismo (Bertuche et al., 2000). La densidad media relativa de las concentraciones de langostino del sur del Golfo San Jorge durante el invierno de 2003 como así también la composición porcentual en peso y número de la biomasa estimada en el área en términos de las categorías de estudio concuerdan con los estudios de evaluación del recurso langostino realizados por Fischbach (2003) en junio de 2003 en la totalidad del Golfo San Jorge, que indican para el área sur del golfo una densidad media relativa de langostino de 101.583 miles de individuos/mn2 (1.718ton/mn2) según una estimación por el método de área barrida, localizándose las concentraciones máximas tanto en el sector costero oeste como en el noreste. Según este autor la mayor composición porcentual en número de la biomasa estimada en términos de categorías comerciales (ejemplares/kg) se ubica en la categoría 41-60 ejemplares/kg, 61-80 ejemplares/kg y más de 81 ejemplares/kg, con valores de 32,23%, 32,33% y 24,74%, respectivamente. Estas categorías comerciales corresponden a individuos de largo de caparazón entre 30 y 34 mm Lcap , entre 27 y 29 mm Lcap y entre 24 y 26 mm Lcap, respectivamente; individuos principalmente subadultos (25 – 30 mm Lcap). De manera general, se observa una disposición de las categorías de langostino en el área siguiendo un patrón oeste-este del golfo, localizándose los individuos juveniles hacia el litoral oeste y los adultos en máximas densidades hacia el noreste, concentrándose en el resto del área las principales concentraciones de subadultos y adultos (entre 31 – 40 mm Lcap), categorías predominantes que constituye las concentraciones de langostino durante este período de estudio como ya fue mencionado anteriormente. En relación a las mayores concentraciones de individuos adultos localizados en el noreste del área de estudio, se observa coincidencia con los resultados obtenidos por De La Garza & Fischbach (2000, 2002) en sus estudios de distribución espaciotemporal de concentraciones de langostino patagónico y con los resultados del programa de marcación y recaptura del langostino marcado implementado por el INIDEP desde el año 2000 (Piñero & Roux, 2000 a y b; Piñero et al., 2001 a y b, 2002, 2003 a y b, 2004 a y b). De la Garza y Fischbach (2000) en sus estudios realizados en relación a la producción de la flota tangonera en el primer semestre del año 2000 en el Golfo San Jorge, indican que las categorías comerciales 31-40 ejemplares/kg (35 mm - 38 mm Lcap) y 41-60 ejemplares/kg (30 mm – 34 mm Lcap) se localizaron en la boca del golfo y en aguas al noreste del mismo, y en particular durante el mes de junio en el sur de la boca del golfo (46º 00’S - 47º 00”S y 65º 20’W – 66º 13’W). Mientras que en sus estudios del segundo semestre de años 1998, 2000 y 2001, señalan que la tendencia de tallas durante todos los meses analizados presenta un comportamiento 120 homogéneo, localizándose las tallas más grandes (> 37 mm Lcap para machos y 44 mm Lcap para hembras) hacia el norte-noreste y en aguas exteriores del Golfo San Jorge (boca del golfo) mientras que las tallas menores a (< 36 mm Lcap y 43 mm Lcap , para machos y hembras respectivamente) en las aguas interiores del golfo (De la Garza & Fischbach, 2002). Piñero y Roux, (2000 a y b) y Piñero et al. (2001 a y b, 2002, 2003 a y b, 2004 a y b) en sus estudios de marcación y recaptura del langostino marcado en el Golfo San Jorge, indican un desplazamiento de los cardúmenes de langostino adulto desde el área sur del golfo en sentido principalmente estenoreste. Los autores antes mencionados relacionan este desplazamiento con la dinámica propia del recurso. Considerando la vinculación entre la distribución y abundancia de las categorías de langostino con las variables físico-química del agua de fondo y de los sedimentos, se encontró una relación entre las categorías adultos localizadas en el noreste del área de estudio con las variables: profundidad y concentración de carbono orgánico total en sedimentos. Esto ha sido registrado también en diversas pesquerías de peneidos donde se han identificado correlaciones significativas entre la distribución de los organismos y ciertas variables ambientales. En general una correlación significativa entre los índices de abundancia de las especies con dos características de los sedimentos: 1) el tamaño de las partículas, de importancia desde el punto de vista de protección y refugio y 2) el contenido de carbono orgánico, considerado una medida indirecta de la disponibilidad de alimento. Esta correlación ha sido observada en pesquerías de peneidos del Golfo de México (Williams, 1958; Grady, 1971), de la Bahía de Mobile, Alabama, USA (Loesch, 1965), de la costa Sudanesa del Mar Rojo (Branford, 1981), y del Golfo de Carpentaria, Australia (Somers, 1987), entre otras. Williams (1958)1 estudió la relación entre la distribución de Penaeus setiferus, P. aztecus y P. duorarum con cinco tipos de sustrato (arena gruesa, arena fina, arena fangosa, fango arenoso y fango) de manera experimental. Los resultados de sus esperimentos indicaron que la distribución de los peneidos en los sustratos no es casual. P. duorarum se relacionó con el sustrato constituido por arena, mientras que P. aztecus y P. setiferus con aquellos más fangosos. Según este autor tanto el tipo sustrato como el contenido alimenticio de las partículas fueron los factores que condicionaron la distribución de las especies. Grady (1971), estudió la asociación de los adultos del genero Penaeus en función de los tipos sedimentarios y el contenido de carbono orgánico de los sedimentos en los fondos de pesca de la plataforma de Florida y Galveston, USA. Encontró que las mayores capturas estaban 1 Los géneros que se citan a continuación corresponden a los años de publicación. Actualmente la nómina de géneros a cambiado. 121 asociadas a los tipos sedimentarios arena limosa y arena limo arcillosa con alto contenido de materia orgánica. Loesch (1965), analizó la distribución y crecimiento de los organismos juveniles de los peneidos Penaeus fluviatilis, P. aztecus y P. duorarum de la Bahía de Mobile, Alabama, USA; llegando a la conclusión que la mayor abundancia se ubicó en agua de baja profundidad (0,60 m – 1 m) con vegetación y grandes cantidades de detrito orgánico. Branford (1981), estudió la distribución de Penaeus semisulcatus, P. latisulcatus y Metapenaeus monoceros, del Mar Rojo Sudanes, y observó que la mayor abundancia de los peneidos se incrementaba a medida que se incrementaba la finura de los sedimentos y el contenido de carbono orgánico; indicando que el tamaño de las partículas es importante para enterrarse (por protección o refugio) y por el contenido de carbono orgánico que retienen como una medida indirecta de disponibilidad de alimento. Somers (1987) investigó sobre el tipo sedimentario, el contenido de carbono orgánico de los sedimentos y la profundidad como factores condicionantes de la distribución de las especies comerciales de peneidos del Golfo de Carpentaria (Penaeus esculentus, P. semisulcatus, Metapenaeus ensis, M. endeavouri, P. Latisulcatus, P. Longistylus, P. merguiensis y Solenocera australiana). La profundidad se considera la causante de la mayor variación de la captura por unidad de esfuerzo pesquero. El porcentaje de fango es un factor significante para todas las especies excepto para P. Merguiensis. Tres especies P. semisulcatus, Metapenaeus ensis, y Solenocera australiana mostraron preferencia por sedimentos con un alto contenido de fango, mientras que la abundancia de P. Esculentus, M. endeavouri y P. latisulcatus tuvieron una correlación negativa con el porcentaje de fango. P. longistylus mostró una fuerte interacción con el fango de profundidad siendo encontrado en gran parte sobre sedimentos entre 40%-60% de fango, en profundidades de 40 m –50 m. La distribución de la captura por unidad de esfuerzo pesquero de todas las especies comerciales fueron relativamente uniformes y no mostraron correlación con el tipo de sedimento, con el porcentaje de fango, ni con la concentración de carbono orgánico; sólo el 13 % de la variación puede ser explicada por una preferencia dl rango de profundidad. A diferencia de los adultos, los juveniles se hallaron en agua costeras (< 20m). Sin embargo, los experimentos de marcación realizados sobre la mayoría de las especies comerciales demostraron la preferencia de P. esculentus y P. semisulcatus por diferentes tipos de sedimentos. Los individuos de P. semisulcatus recapturados estaban en áreas con sedimentos finos (>75% de fango) mientras que los de P. esculentus estaban asociados con sedimentos más gruesos (50-75% de fango). 122 En relación a la distribución de los peneidos y su vinculación con las variables hidrográficas, se destacan los estudios realizados por Ye et al. (1999) y Hass et al. (2001). Ye et al. (1999) realizaron un análisis de las preferencias ambientales de Penaeus semisulcatus, Metapenaeus affinis y Penaeus stylifera en aguas de Kuwait, encontrando que cada especie tiene distintas preferencias con la temperatura, salinidad y profundidad. La profundidad fue la variable determinante en la distribución de estos peneidos. Hass et al. (2001) modelaron la abundancia del camarón café Penaeus aztecus asociada a factores biológicos y ambientales usando herramientas estadísticas como regresión múltiple y modelos aditivos generalizados. De las variables analizadas sólo la temperatura y la salinidad mostraron una correlación positiva con la abundancia de este camarón. 123 CONCLUSIONES 124 5. CONCLUSIONES Considerados en su conjunto los períodos y aspectos analizados en la presente tesis, se desprenden las siguientes conclusiones: 1. Las características hidrográficas registradas en el Golfo San Jorge reflejan la existencia de un ciclo estacional típico de aguas templadas caracterizado por la formación y ruptura de la termoclina estacional. La dinámica de la formación y ruptura de la termoclina en las regiones costeras difiere de la observada en las regiones centrales del golfo de mayor profundidad. En las regiones costeras de menor profundidad, el proceso de formación de la termoclina está retrasado respecto de las aguas más profundas, donde la ruptura está adelantada y ocurre durante el otoño. 2. El ritmo de producción fitoplanctónica se corresponde con el ciclo bimodal de mares templados, con un máximo principal durante la primavera y otro secundario durante el otoño. Sobrepuesto a este ciclo general característico del Golfo San Jorge en su conjunto, hay otros factores que modifican la estabilidad de la columna de agua y la disponibilidad de nutrientes, ejerciendo un efecto importante en la capacidad productiva del golfo. Entre estos factores se destacan: 1) la formación de sistemas frontales en la estación estival y 2) el efecto de las Aguas Costeras que ingresan al golfo por el extremo sudeste generando frentes termohalinos de permanencia estacional y de posición variable con importantes concentraciones de clorofila a en primavera y otoño. 3. Las concentraciones de materia orgánica total, carbono orgánico total y nitrógeno total en los sedimentos superficiales del Golfo San Jorge se encuentran dentro de los parámetros normales siendo superiores al rango de valores conocido para los sedimentos de la Plataforma Continental Argentina pero semejantes a los registrados en ambientes similares del mundo. 4. La relación C:N indica que la materia orgánica en los sedimentos del Golfo San Jorge es de origen fitoplanctónico y de procedencia acumulativa, presentando los sedimentos condiciones de enriquecimiento orgánico en el sur del golfo pero sin alcanzar en general condiciones reductoras. 5. Las variaciones estacionales de la concentración de oxígeno en agua de fondo y de MOT, COT, NT, FT, clorofila a y feopigmentos en sedimentos así como la relación C:N se 125 relaciona con el ciclo de estabilización y ruptura de la termoclina. Los máximos valores concentración de oxígeno en agua de fondo se registran en invierno mientras que los máximo valores de MOT, COT , NT, FT, clorofila a y feopigmentos, ocurren tanto en primavera como en invierno. 6. El flujo de carbono hacia los sedimentos podría estar sincronizado con los pulsos estacionales de producción primaria de la zona eufótica. 7. En la composición de los fondos predomina el tipo sedimentario limo arcilloso. Los diferentes tipos sedimentarios definidos en el golfo siguen un gradiente espacial y batimétrico desde la costa y el sector SE (umbral del golfo) hacia la zona central y profunda. En el extremo sur, dominan la grava, grava arenosa y areno gravosa, en la costa sur el tipo areno limoso, en la costa oeste y umbral el tipo limo arenoso y en el sector interno central y más profundo del golfo, los tipos fangosos (limo, limo arcilloso y arcillo limoso). 8. La distribución espacial de las fracciones granulométricas, la composición química de los sedimentos superficiales, y la composición físico - química del agua de fondo así como de sus variaciones estacionales, han permitido caracterizar en el Golfo San Jorge tres sectores bien diferenciados correspondientes a un Ambiente Deposicional, a un Ambiente de flujo o Erosivo y a un ambiente Transicional. El primero se localiza en el interior del golfo, el segundo en las zonas próximas a los extremos, mientras que el tercero comprende la zona costera y sudeste del golfo. Las concentraciones máximas de materia orgánica en los sedimentos se localizan en el Ambiente Deposicional. Las concentraciones mínimas de materia orgánica se ubican principalmente en el Ambiente de Flujo o Erosivo, mientras que las concentraciones intermedias se hallan en el Ambiente Transicional. 9. En el Golfo San Jorge para otoño de 2000, los cuatro grupos faunísticos más representativos del área fueron: Equinodermos, Moluscos, Crustáceos y Anélidos Poliquetos, cuyo número de especies y distribución espacial han permitido caracterizar tres sectores bien diferenciados. El Sector 1 que se ubica en el interior o centro del golfo, el sector 2 que comprende la zona litoral y el sector sudeste del umbral del golfo y el Sector 3 que se ubica en el suroeste y norte del golfo. El sector 1 y 3 corresponden al Ambiente Deposicional, mientras que el 2 corresponde en el sector próximo al extremo sur al Ambiente de Flujo o Erosivo y en el sector litoral y sudeste del umbral del golfo al Ambiente Transicional. El Ambiente 126 Deposicional, presenta dos asociaciones importantes, ambas compuestas por las especies Leanira quatrefagesi, Asychis amphyglipta, Cistenides ehlersi, Nuculana sulculata, Nucula puelcha, Kennerleya patagonica, Pterygosquilla armata armata, Austropandalus grayi Callianassa brachyophthalma, Munida subrugosa y Pseudechinus magellanicus (siendo diferentes las especies dominantes). En el tipo sedimentario limo arenoso domina Nuculana sulculata mientras que en tipo limo arcilloso domina Pseudechinus magellanicus seguido por Nuculana sulculata. El Ambiente de flujo o Erosivo se caracteriza donde predomina el tipo sedimentario grava arenosa y areana gravosa, por una asociación integrada fundamentalmente por Nuculana sulculata, Nucula puelcha, Kennerleya patagonica, Pterygosquilla armata armata y Munida subrugosa con dominio de Nuculana sulculata en bajas densidades. En el Ambiente Transicional dominado por la grava se diferencia una asociación integrada por Leanira quatrefagesi, Semirrosia tenera, Peisos petrunkevitchi, Austropandalus grayi, Munida subrugosa y Pseudechinus magellanicus, con el dominio de Pseudechinus magellanicus; mientras que en el tipo sedimentario arena limosa se destaca una asociación integrada por Nuculana sulculata, Nucula puelcha y Munida subrugosa con dominio de Nuculana sulculata. 10. Las especies bentónicas de mayor importancia, teniendo en cuenta su abundancia relativa y frecuencia de aparición fueron el equinodermo Pseudechinus magellanicus seguido por los Moluscos Nuculana sulculata, Nucula puelcha, los Crustáceos, Munida subrugosa y Austropandalus grayi y los Poliquetos Cistenides ehlersi y Asychis amphiglypta. 11. En relación a las concentraciones de langostino del sur del Golfo San Jorge durante el invierno de 2003, las mayores densidades se ubicaron en la categorías subadultos y adultos (3140 mm Lcap), seguida por las categorías juveniles y adultos mayores de 41 mm Lcap. Se reconoció una disposición de las categorías de langostino en el área siguiendo un patrón oeste-este del golfo, localizándose los individuos juveniles hacia el litoral oeste y los adultos en máximas densidades hacia el noreste, concentrándose en el resto del área las principales concentraciones de subadultos y adultos (31-40 mm Lcap). Se encontró una relación entre las disposición espacial de los categorías adultos de langostino en el sur del Golfo San Jorge con las variables profundidad y concentración de carbono orgánico total. 12. Los cambios interanuales observados durante el presente estudio deben ser atribuidos a la dinámica y variabilidad propias del sistema del Golfo San Jorge. 127 REFERENCIAS BIBLIOGRÁFICAS 128 7.- REFERENCIAS BIBLIOGRÁFICAS AKSELMAN, R. 1996. Estudios ecológicos en el Golfo San Jorge y adyacencias (Atlántico sudoccidental). Distribución, abundancia y variación estacional del fitoplancton en relación a factores físico-químicos y a la dinámica hidrográfica. Tesis Doctoral, Universidad de Buenos Aires, Buenos Aires, Argentina. 234 pp. ALBERTÓ, E., SEROSATI, R. A. & DÍAZ, G. A. 1993. Alimentación del langostino Pleoticus muelleri (Crustacea, Decapoda) del Golfo San Jorge, Argentina. Gayana Zool., 57 (2): 279-284. ALLER, R. C. 1982. The effects of macrobenthos on chemical properties of marine sediment and overlying water. En: McCALL, P. & TEVESZ, M. J. S. (Eds.). Animal-Sediment relations. The Biogenic alterations of sediments. Plenum Press:53-100. AL-MUTAIRI, H. & LANDRY, M. R. 2001. Active export of carbon and nitrogen at station ALOHA by diel migrant zooplankton. Deep-Sea Res. II, 48:2083-2103. AMOUROUX, J. M. 1974. Etude des peuplements infralittoraux de la cote du Roussillon. Vie et Milieu, 24 (2B):321-354. ANDERSON, T. R. 2003. Zooplankton and the biological pump in the ocean. En: 3rd International Zooplankton Production Symposium “The Role of Zooplankton in Global Ecosystem Dinamics: Comparative studies from the world oceans” Gijón, España, Resumen 1:95. ANGELESCU, V. & BOSCHI, E. E. 1959. Estudio biológico pesquero del langostino de Mar del Plata en conexión con la operación nivel medio. Serv. Hidrog. Naval. Arg., H 1017:1-135. ANGELESCU, V. & PRENSKI, L. B. 1987. Ecología trófica de la merluza común del Mar argentino (Merlucciidae, Merluccius hubssi). Parte 2. Dinámica de la alimentación analizada sobre la base de las condiciones ambientales, la estructura y las evaluaciones de los efectivos en su área de distribución. Contrib. Inst. Nac. Invest. Des. Pesq., 561,205 pp. AUBONE, A., BEZZI, S., CASTRUCCI, R., DATO, C., IBÁÑEZ, P., IRUSTA, G., PEREZ, M., RENZI, B., SANTOS, B., SCARLATO, N., SIMONAZZI, M., TRINGALLI, L. & VILLARINO, F. 2000. Merluza (Merluccius hubbsi). En: Síntesis del estado de las Pesquerías Marítimas Argentinas y de la Cuenca del Plata. Años 1997-1998, con la actualización de 1999. BEZZI, S., AKSELMAN, R. & BOSCHI, E. E. (Eds.), INIDEP, Mar del Plata, Argentina :29-39. BANTA, G., GIBLIN, A., HOBBIE, J. & TUCKER, J. 1995. Benthic respiration and nitrogen release in Buzzards Bay, Massachusetts. J. Mar. Res., 5: 107-135. 129 BALDONI, A. 1990. Renovación del agua de fondo del golfo San Jorge. Tesis de Grado. Instituto Tecnológico de Buenos Aires, Buenos Aires, Argentina. 37 pp. BASFORD, D. J., ELEFTHERIOU, A. & RAFFAELLI, D. 1989. The epifauna of the Northern North Sea (56º-61º). J. Mar. Biol. Ass. U. K., 69:387-407. BASTIDA, R., ROUX, A. & MARTINEZ, D. 1992. Benthic communities of the Argentine Continental Shelf. Oceanol. Acta, 15 (6):687-698. BASTIDA, R., URIEN, C. M., LICHTSCHEIN, V., ROUX, A. & ARIAS, P. 1981. Investigaciones sobre Comunidades Bentónicas. Características Generales del Sustrato (Campañas IV, V, X y XI del B/I “SHINKAI MARU”. Contrib. Inst. Nac. Invest. Des. Pesq., 383:318 – 339. BASTIDA, R., ZAMPONI, M., BREMEC, C., ROUX, A. GENZANO, G. & ELIAS, R. En prensa. Las Comunidades Bentónicas. En: El Mar Argentino y sus Recursos Pesqueros, Tomo V: Ecosistema Marino. CARRETO, J. I. & BREMEC, C.(Eds.). Instituto Nacional de Investigación y Desarrollo Pesquero, Argentina. BEALS, E. W. 1984. Bray-Curtis ordination: an effective strategy for analysis of multivariate ecological data. Adv. Ecol. Res., 14:1-49. BEKLEMISHEV, C. W. 1962. Superfluous feeding of marine herbivorous zooplakton. Rapp. Proc. Verb., Cons. Perm. Int. Expl. Mer., 153:108-113. BERND, R. & SIMONEIT, T. 1978. The organic chemistry of marine sediments. En: Chemical Oceanography, 7. RILEY, J. P. & CHESTER, R. (Eds.), 2nd ed., Academic Press, London:234-311 BERTUCHE, D., FISCHBACH, C., ROUX, A. & FERNANDEZ, M. 1999. Langostino (Pleoticus muelleri). En: Diagnóstico de los Recursos Pesqueros. CAJAL, J. & PRENSKI, B. (Eds.), INIDEP, Mar del Plata, Argentina:110-120. BERTUCHE, D., FISCHBACH, C., ROUX, A., FERNÁNDEZ, M. & PIÑERO, R. 2000. Langostino (Pleoticus muelleri). En: Síntesis del estado de las Pesquerías Marítimas Argentinas y de la Cuenca del Plata. Años 1997-1998, con la actualización de 1999. BEZZI, S., AKSELMAN, R. & BOSCHI, E. E. (Eds.). INIDEP, Mar del Plata, Argentina:179-190. BIANCHI, A., MASONNEAU, M. & OLIVIERA, R., 1982. Análisis estadístico de las características T-S del sector austral de la plataforma continental argentina. Acta Oceanogr. Argentina, 3:93-118. BLACKBURN, T. H. 1986. Nitrogen cycle in marine sediments. Ophelia, 26:65-76. BONILLA RUÍZ, J., FERMÍN, J. S. & CASTRO GONZÁLEZ. 1998. Análisis Estadístico 130 Multivariante aplicado al grado textural y a los aspectos geoquímicos de los sedimentos del ecosistema marino costero de José, Estado Anzoátegui, Venezuela. Bol. Inst. Oceanogr. Venezuela, Univ. Oriente, 37 (1 y 2):53-62. BOSCHI, E.E. 1989. Biología Pesquera del langostino del litoral patagónico de Argentina (Pleoticus muelleri). Ser. Contrib. INIDEP, Mar del Plata, 646:1-71. BORASO, A. L. & PIRIZ, M. L. 1975. Las especies del género Codium (Chlorophyta) en el litoral argentino. Physis sec. A 69: 245-256. BORASO de ZAIXSO, A.L. & QUARTINO, M. L. 1993. Estudios sobre algas marinas bentónicas en Argentina. Naturalia patagónica. Ser. Cs. Biológicas. 1: 35-57. BORDOVSKY, O., 1965. Accumulation of organic matter in botton sediments. Marine Geology, 3:33-82. BRANDHORST, W. & CASTELLO, J. P. 1971. Evaluación de los recursos de anchoíta (Engraulis anchoita) frente a la Argentina y Uruguay. Proy. Des. Pesquero (FAO), Ser. Inf. Téc., 29:63 pp. BRANFORD, J. R. 1981. Sediment and the Distribution of Penaeid Shrimp in the Sudanese Red Sea. Estuarine, Coastal and Shelf Science, 13:349-355. BRAY, J. R. & CURTIS, J. T. 1957. An ordination of the upland forest communities of Southern Wisconsin. Ecol. Monogr., 27:325-349. BREMEC, C. & ROUX, A. 1997. Benthic Polychaetes of San Jorge Gulf, Argentina. V International Polychaetes Conference. Bull. Mar. Sc., 60 (2):609. BREMNER, J.M. & MULVANEY, C. 1982. Nitrogen Total. En: Methods of soil analysis. Part. 2. Chemical and microbiological properties. PAGE, A.L.(Ed.). Wisconsin, USA:539-579. BUCHANAN, J. B., SHEADER, M. & KINGSTON, P. F. 1978. Sources of variability in the benthic macrofauna off the south Northumberland coast, 1971-1976. J. Mar. Biol. Ass. U. K., 58:191-209. BUCHANAN, J. B. 1984. Sediment analysis. En: Methods for the study of marine benthos. HOLME, N. A. & MC INTYRE, A. D. (Eds). Blackwell Scientific Publications, Oxford: 41-65. BUCHER, E. & HERRERA, G. 1981. Comunidades de aves acuáticas de la laguna de Mar Chiquita (Córdoba, Argentina). Ecosur, 8 (15): 91-120. BURSKA, D., FRANKOWSKI, L. & BOLALEK, J. 1999. Temporal variability in the chemical composition of bottom sediments in the Pomeranian Bay (southern Baltic). Oceanologia, 41 (3):445-459. BUSCAIL, R. & GERMAIN, C. 1997. Present-day organic matter sedimentation on the NW 131 Mediterranean margin: Importance of off-shelf export. Limnol. Oceanogr., 42 (2):217229. CABIOCH, L., DAUVIN, J. C., MORA, J. & RODRÍGUEZ BABO, C. 1980. Effects de la marée noire de l’ “Amoco Cadiz” sur le benthos sublittoral du nord de la Bretagne. Helgo. Meeres., 33:192-208. CAHET, G., FIALA, M., JACQUES, M. & PANOUSE, M. 1972. Primary production at the thermocline level in the neritic zone of the north west Mediterranean. Mar. Biol., 14 (1): 32-42. CAILLIAU, C., BELVISO, S., GOUTX, M., BEDO, A., PARK, Y. & CHARRIAUD, E. 1999. Sedimentation pathways in the Indian sector of the Southern Ocean during a production regime dominated by regeneration. Mar. Ecol. Prog. Ser., 190:53-67. CALVERT, S. E. 1976. The mineralogy and geochemistry of near-shore sediments. En: Chemical Oceanography. RILEY, J. P. & CHESTER, R. (Eds.). 2 nd ed. Academic Press, London:187-280. CARRASCO, F. & CARVAJAL, W. 1995. Enriquecimiento orgánico de los sedimentos y el tamaño de los organismos macrobentónicos de la Bahía de San Vicente, Chile central. Gayana Oceanol., 3 (2):89-98. CARRETO, J. I. 1983. Los ecosistemas del Mar Argentino. MS. Archivo INIDEP, Mar del Plata. CARRETO, J. I., NEGRI , R. M. & BENAVIDES, H. R. 1981. Fitoplancton, pigmentos y nutrientes. Resultados Campañas III y VI del B/I “Shinkai Maru”, 1978. Contrib. Inst. Nac. Inv. Des. Pesq., 383:181-201. CARRETO, J. I., NEGRI , R. M., BENAVIDES, H. R. & AKSELMAN, R. 1985. Toxic dinoflagellate blooms in the Argentine Sea. En: Toxic dinoflagellates. ANDERSON, WHITE & BADEN (Eds.). Elsevier Sci. Publ. Co., N. Y.:147-152. CARRETO, J. I., BENAVIDES, H. R. , NEGRI , R. M. & GLORIOSO, P. D. 1986. Toxic Red tide in the Argentine Sea.Phytoplankton distribution and survival of the toxic dinoflagellate Gonyaulax excavata in a frontal area. J. Plankton Res., 8 (1):15-28. CASSIE, R. M. 1972. Fauna and sediments of an intertidal mud-flat: an alternative multyvariate analysis. J. Exp. Mar. Biol. Ecol., 9:55-64. CHARDY, P. & GLÉMARE, M. 1974. Contribution au probleme de l’étagement des communautes benthiques du plateau continental Nord-Gascogne. C. R. Acad. Sc. Paris, 278 (Série D):213:216. CLARKE, K. R. 1993. Non-parametric multivariate analysis of changes in community styructure. Austr. J. Ecol., 18:117-143. 132 CLARKE, K. R. & AINSWORTH, M. 1993. A methods of linking multivariate community structure to environmental variables. Mar. Ecol. Prog. Ser., 92:205-219. CLARKE, B. & WARWICK, R. 1993. Environmental effects on benthic communities. Training Workshop on « Multivariate Analysis of Benthic Community Data ». Lecture Notes for SEAS/EPOSII Wokshop, Plymouth Marine Laboratory, 144 pp. CLIFFORD, H. T. & STEPHENSON, W. 1975. An introduction to numerical classification. Academic Press, N. Y., 230 pp. COGNETTI, G. 1982. Aspects de la colonisation des milieux imprevisibles. Symbioses, 14 (4): 205-219. COMMENDATORE, M. G., ESTEVES, J. L. & COLOMBOS, J. C. 2000. Hydrocarbons in Coastal Sediments of Patagonia, Argentina : Levels and Probable Sources. Marine Pollution Bulletin, 40 (11):989-998. COMMENDATORE, M. G. & ESTEVES, J. L . 2004. Hidrocarburos en sedimentos del Golfo San Jorge. Informe Interno Centro Nacional Patagónico, Puerto Madryn, Chubut. 12 pp. CONNELL, J. H. 1978. Diversity in tropical rainforest and coral reefs. Science, 1999:13021310. CRISCI, J. C. 1983. Introducción a la teoría y práctica de la taxonomía numérica. Washington, OEA:132 pp. CUCCHI COLLEONI, D. &. CARRETO, J.I., 2001. Variación estacional de la Biomasa Fitoplanctónica en el Golfo San Jorge. Resultados de las campañas de investigación OB01/00, OB-03/00, OB-07/00, OB-10/00 y OB-12/00. Informe Técnico Interno DNI INIDEP Nº 49/01, 30 pp. CUCCHI COLLEONI, D. & CARRETO, J. I. 2002. Variación estacional de la Biomasa Fitoplanctónica en el Golfo San Jorge. Resultados de las campañas de investigación OB01/01, OB-06/01, OB-11/01 y OB-13/01. Informe Técnico Interno DNI INIDEP Nº 108/02, 39 pp. CUCCHI COLLEONI, D. &. CARRETO, J. I. 2003. Variabilidad espacio temporal de la biomasa fitoplanctónica en el Golfo San Jorge. V Jornadas Nacionales de Ciencias del Mar. Mar del Plata, Argentina, Resúmenes:94. DAMAISON, G. .J. MOORE, G. T. 1980. Anoxic Environments and oil Source Bed Genesis. Organic Geochemistry, 2:9-31. DANOVARO, R., FABIANO, M. & BOYER, M. 1994. Seasonal changes of benthic bacteria in a seagrass bed (Posidonia oceanica) of the Ligurian Sea in relation to origin, composition and fate of the sediment organic matter. Marine Biology., 119:489-500. 133 DAY, J. H., FIELD, J. G. & MONTGOMERY, M. P. 1971. The use of numerical methods to determine the distribution of the benthic fauna across the continental shelf of North Carolina. J. Anim. Ecol., 40:93-126. DEGENS, E. T. & MOPPER, K. 1976. Factors controlling the distribution and early diagenesis of organic material in marine sediments. En: Chemical Oceanography. RILEY, J. P. & CHESTER, R. (Eds.) London:59-113. DE LA GARZA, J. 2003. Modelo topográfico digital del Golfo San Jorge. Aplicaciones de las herramientas de información geográfica (SIG) en la pesquería de langostino. Informe Técnico Interno DNI INIDEP Nº 30/03, 8 pp. DE LA GARZA, J. & FISCHBACH, K. 2000. Langostino patagónico: la producción de la flota tangonera en el primer semestre del 2000. Informe Técnico Interno DNI INIDEP Nº 22/00,14 pp. DE LA GARZA, J. & FISCHBACH, K. 2002. Distribución espacio-temporal y estructura de las tallaa del langostino patagónico durante los meses de agosto a noviembre de los años 1998, 2000 y 2001.Informe Técnico Interno DNI INIDEP Nº 45/02,14 pp. EL-RAYIS, O. A. 1985. Re-assessment of the tritration method for determination of organic carbon in recent sediments. Rapp. Comm. Int. Mer Médit., 29 (7):45-47. EL SABROUTI, M. A., ABAZA, K. H. & MAHMOUD, B.A. 1997. Organic matter, phosphorus and sulfur distribution in the surficial sediments of Manzalah lagoon, Egypt. Fresenius Envir. Bull, 6:403-409. ELEFTHERIOU, A. & BASFORD, D. J. 1989. The macrobenthic infauna of the offshore northern North Sea. J. Mar. Biol. Ass. U. K., 69:123-143. EMERY, K. O. 1969. A coastal pond studied by oceanography methods. New York, Elsevier. ESTABLIER, R., BLASCO, J., GOMEZ, A. & ESCOBAR, D. 1984. Materia orgánica en los sedimentos de la Bahía de Cádiz y sus zonas de marismas y salinas. Investigación Pesquera, 48 (2):285-301. ESTEVES, J. L ., COMMENDATORE, M. G., SOLIS, M., GIL, M. & OLIVIERA, N. 1993. Investigación en las costas del Atlántico Sur. En : Petrotecnia (Instituto Argentino del Petróleo) Año XXXXIV, 3 :26-32. ETTER, R. J. & GRASSLE, J. 1992. Patters of species diversity in the deep sea as a function of sediment particle size diversity. Nature 360:576-578. FARIAS, L., CHUECAS, L., & DURÁN, A. 1996. Reactividad y Remineralización de Carbono Orgánico Total y Nitrógeno Total en sedimentos anóxicos de Bahía Concepción, Chile. Guayana Oceanológica, 4 (2):117-127. 134 FERNÁNDEZ, M. & BERTUCHE, D. 1995. Relevamiento del estado de los sedimentos de los fondos de pesca de la pesquería de langostino patagónico. Año 1992 y 1993. Informe Técnico Interno DNI INIDEP Nº 5/95:1-16. FERNÁNDEZ, M. & ROUX, A. 1999. Variaciones en el contenido de materia orgánica de los sedimentos de los fondos de pesca del langostino Pleoticus muelleri en el Golfo San Jorge, Argentina. Años 1992–1998. En: VIII COLACMAR. Libro de Resúmenes Ampliados. Tomo I. TRESIERRA AGUILAR & CULQUICHICÓN MALPICA (Eds.),. Trujillo, Perú:62-64. FERNÁNDEZ ARAOZ, N. C. 1994. Estudios sobre la biomasa de Copepoda (Crustacea) con especial énfasis en Calanoida, del atlántico Sudoccidental. Tesis Doctoral. Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata, Argentina, Partes I (92 pp) y II (110 pp). FIELD, J. G. & McFARLANE, G. 1968. Numerical methods in marine ecology. I. A quantitative similarity analysis of rocky shore samples in False Bay, South Africa. Zool. Afr., 3:119-138. FISCHBACH, K. 2003. Informe de Campaña OB-05/03. Proyecto Langostino. Inf. Camp. INIDEP.,18 pp. FOLK, R. L. 1980. Petrology of sedimentary rocks. Hemphill, Austin, Texas, 182 pp. FOLK, R. L. & WARD, W. C. 1957. Brazos river bar : a study in the significance of grain size Parameters. J. Sed. Petrol., 23 (1):3-26. FRONEMAN, P. W., PAKHOMOV, E. A., GURNEY, & HUNT, B. 2002. Predation impact of carnivorous macrozooplankton in the vicinity of the Prince Edward Island archipelago (Southern Ocean) in austral autumn 1998. Deep-Sea Res., 49 (16):3243-3254 . FRONTIER, S. 1983. Reflexión pour une théorie des écosystemes. Bull. Ecol., 8 (4):445-464. GARMENDIA ETXANDI, A. 1997. El macrozoobentos submareal de la Ría de Ares y Betanzos II. Tesis Doctoral, Universidad de Santiago de Compostela, Santiago de Compostela, España: 540 pp. GAUDETTE, H. E., FLIGHT, W. R., TONER, L. & FOLGER, D. W. 1974. An inexpensive titration method for the determination of organic carbon in recent sediments. J. Sed. Petrol., 44 (1):249-253. GIBBS, M., ROSS, A. & DOWNES, M. 2002. Nutrient cycling and fluxes in Beatrix Bay, Pelorus Sound, New Zeland. N. Z. J. Mar. Freshwat. Res., 36 (4):675-697. GISLASON, H. 2003. The effects of fishing on non-target species and ecosystem structure and function. En: Responsible Fisheries in the Marine Ecosystem. SINCLAIR, M & 135 VALDIMARSSON, G. (Eds.) Responsible Fisheries in the marine Ecosystem. FAO:255274. GLORIOSO, P. D. 1985. Características hidrográficas de la zona exterior del Golfo San Jorge. Campaña H-01/82, 20 pp. GLORIOSO, P. D. 1987. Temperature distribution related to shelf-sea fronts on the Patagonian Shelf. Continental Shelf Res., 7 (1):27-34. GLORIOSO, P. D. & FLATHER, R A. 1997. The Patagonia shefl Tides. Prog. Oceanog., 40: 263-283. GOLDEN SOFTWARE. 1995. Surfer Programme (Win 32), Version 7. GRACO, M., FARÍAS, L., MOLINA, V., GUTIERREZ, D. & NIELSEN, L. 2001. Massive developments of microbial mats following phytoplankton blooms in a naturally eutrophic bay : Implications for nitrogen cycling. Limnol. Oceanogr., 46 (4):821- 832. GRADY, J.R. 1971. The distribution of sediment properties and shrimp catch on two shrimping grounds on the continental shlef of Mexico. Proc. Gulf. Caribb. Fish. Inst., 23: 39-48. GUERRERO, R. & PIOLA, A. R., 1997. Masas de agua en la Plataforma Continental. En: El Mar Argentino y sus Recursos Pesqueros. Tomo 1. Antecedentes históricos de las exploraciones en el mar y las características ambientales. BOSCHI, E. E. (Ed.) INIDEP,. Mar del Plata, Argentina:107-118. GULLIKSEN, B. 1982. Sedimentation close to a near vertical rocky wall in Balsfjorden, northern Norway. Sarsia, 67:21-27. GUZMÁN, J. M. 1958. Manual de instrucciones para observaciones oceanográficas. Serv. Hidrog. Naval. Arg., Público H 601, 222 pp. HANSEN, J. E. 2000. Anchoíta (Engraulis anchoita). En: Síntesis del estado de las Pesquerías Marítimas Argentinas y de la Cuenca del Plata. Años 1997-1998, con la actualización de 1999. BEZZI, S., AKSELMAN, R. & BOSCHI, E. E. (Eds.). INIDEP, Mar del Plata, Argentina:205-216. HASS, H. E., LAMON, E. C., ROSE, K. A. & SHAW. 2001. Environmental and biological factors associated with the stage-specific abundance of brown shrimp (Penaeus aztecus) in Louisiana, applying a new combination of statistical techniques to long term monitoring date. Can. J. Fish. Aquat. Sci., 58:2258-2270. HILL, M. O. 1979. A fortran program for correspondence analysis and reciprocal averaging. Cornell University, Ithaca, New York. 52 pp. HILY, C. 1984. Variabilité de la macrofaune benthique dans les milieux hiper-trophiques de la 136 rade de Brest. These Doctoral, Univ. Bretagne. Occidentale, 1, 359 pp. HIROTA, J. & SZYPER, J. 1975. Separation of total particulate carbon into organic components. Limnol. Oceanogr., 20:896-900. HOLME, N. & MC INTYRE, 1984. Methods for the study of marine benthos. IBP Handbook. Blackwell Sci. Publ., N. HOLME & A. MC INTYRE (Eds.) Oxford, (16), 334 pp. HOLM-HANSEN, O., LORENZEN, C. J., HOLMES, B. W. & STRICKLAND, J. D., 1965. Fluorometric determination of chlorophylls. Journal du Conseil, Conseil International pour l’ Exploration de la Mer, 30:3-15. HOSIE, G. W. & COCHRAN, T. G. 1994. Mesoscale distribution patterns of macrozooplancton communities in Prydz Bay, Antarctica – January to February 1991. Mar. Ecol. Prog. Ser., 106:21-39. ISLA, F. I. , LANTANOS, N. & ESTRADA, R. 2002. Playas reflectivas y disipativas macromareales del Golfo san Jorge, Chubut. AAS Revista, 9 (2):155-164. JONES, M. R. 1987. Surficial Sediments of Western Gulf of Carpentaria, Australia. Aust. J. Mar. Freshw. Res., 38:151-167. JOUMEL, A.G. & HUIYBNEGTS, CH. I. 1978. Mining Geostatistics. Academic Press, 600 pp. JUNOY, J. M. 1988. Estudio de la fauna intermareal de sustrato blando de la Ría de Foz (Lugo). Tesis Doctoral, Universidad de Alcalá de Henares, España: 619 pp. KAISER, M. J. 1998. Significance of bottom –fishing disturbance. Cons. Biol., 12 (6):12301235. KAISER, M. J. & SPENCER, B. E. 1996. Behavioral responses of scavengers to beam trawl disturbance. En: Aquautic predators and their prey. Chapter 16. GREENSTREET, S. P. R. & TASKER, M. L. (Eds.). Liverpool: Liverpool University Press:169-218 KARAKASSIS, I. & ELEFTHERIOU. 1998. The continental shelf of Creta: the benthic enviroment. Marine ecology, 19 (4):263-277. LANCE, G. N. & WILLIAMS, W. T. 1967. A general theory of classificatory sorting strategies. I. Hierarchical systems. Computer J., 9:373-380. LASTRA, M., PALACIO, J., SANCHEZ MATA, A. & MORA, J. 1991. Esructura trófica infralitoral de la Bahía de Santander. Cha. Biol. Mar., 32. LEGENDRE, L. & LEGENDRE, P. 1979. Ecologie numerique. Tome I: Le traitement múltiple des dones écologiques. Tome II: La structure des dones écologiques. MASSON (Ed.). Paris, 14. 197 pp. LEGENDRE, L. & LEGENDRE, P. 1984. Le traitement múltiple des dones écologiques. MASSON (Ed.) Paris. 259 pp. 137 LINDEBOOM & DE GROOT, 1998. Impact-II: The effects of different types of fisheries on the North Sea and Irish Sea benthic ecosystems. Nios-rapport 1998-1, RIVO-DLO Report C003/98. 404 pp. LINDLEY, J. A., GAMBLE, J. C. & HUNT, H. G. 1995. A change in the zooplancton of the central North Sea (55º to 58º N) : a possible consequence of changes in the benthos. Mar Ecol. Prog. Ser., 119:299-303. LOESCH, L. 1965. Distribution and Growth of penaeid shrimp in Mobile Bay, Alabama. Publications of the Institute of Marine Science. University of Texas. Port Aransas, Texas. PARKER, P. & COPELAND, B. J. (Eds.). 453 pp. MACCHI, G., PÁJARO, M. & MADIROLA, A. 2005. Can a change in the spawning pattern of Argentine hake (Merluccius hubbsi) affect its recruitment?. Fish. Bull. 103:445-452. McALLISTER, C. D. 1970. Zooplankton ration, phytoplankton mortality and de estimation of marine produccion. En: Marine Food Chains. STEELE, J. H. (Ed.). University of California Press. Berkeley and Los Angeles:419-457. McNAUGHTON. 1978. Stability and diversity of ecological communities. Nature, 274 (5668): 251-252. McINTYRE, A. D., ELLIOT, J. M. & ELLIS, D. V. 1984. Introduction : Design of sampling programmes. En : Methods for the study of Marine Benthos. HOLME, N. A. & McINTYRE, A. D. (Eds.). International Biological Programme Handbook, 2nd ed., Blackwell Scientific Publications, Oxford. 387 pp. MAURER, D., WATLING, L., LEATHEM, W. & KINNER. P. 1979. Seasonal changes in feeding types of estuarine benthic invertebrates from Delaware Bay. J. Exp. Mar. Bio. Ecol., 36:125-155. MAJEED, S. A., 1987. Organic matter and biotic indices on the beaches of north Brittany. Marine Pollution Bulletin, 18:490-495. MARGALEF, R. 1982. Ecología. Ed. Omega S. A. Barcelona. 951 pp. MORA, J., ABELLA, E., CURRÁS, A., GARCÍA, M. A., GARMENDIA, J . M . GÓMEZ, J. L., LASTRA, M., PALACIO, J., PARADA, J. M. & SÁNCHEZ MATA, A. 1994. Perturbaciones ocasionadas por los hidrocarburos vertidos en el naufragio de Aegean Sea. Estudio de la fauna bentónica. 1. Estudio de la macrofauna submareal de la Ría de Ares y Betanzos. Informe Técnico Ministerio de Obras Públicas y Transporte. España. 587 pp. MORA, J., LASTRA, M., SÁNCHEZ MATA, A. & GARCÍA GALLEGO, M. A. 2003. Efecto de vertidos de hidrocarburos sobre los fondos blandos: intermareales y submareales. En : El impacto del Prestige. Análisis y evaluación de los daños causados por el accidente del 138 Prestige y dispositivos para la regeneración medioambiental y recuperación económica de Galicia. Instituto de Estudios Económicos de Galicia, Fundación Pedro Barrié de la Maza. CD. MOREIRA DA ROCHA, J. 2003. La fauna bentónica de la Ensenada de Baiona, Galicia, Península Ibérica. Densidad, Análisis de las comunidades, Dinámica de poblaciones y distribución vertical. Tesis Doctoral, Universidad de Santiago de Compostela, Santiago de Compostela, España. 676 pp. MORRISON, J. 1976. Multivariate Statistical Methods. Mc Graw Hill Kogakusha Ltd. 415 pp. NELSON, D. & SOMMERS, L., 1982. Total Carbon, Organic Carbon and Organic Matter. En: Methods of soil analysis. Part. 2. Chemical and microbiological properties. PAGE,. A. L. (Ed.), Wisconsin, USA: 539-579. NELSON, S., DE VITS, V. & SEPÚLVEDA, J. 2001. Materia orgánica, C y N, su distribución y estequiometría en sedimentos superficiales de la región central de los fiordos y canales australes de Chile (Crucero Cimar-Fiordo 2). Ciencia y Tecnología Marinas, 24:23-40. OLESEN, M. & LUNDSGAARD, C. 1995. Seasonal sedimentation of autochthonous material from the euphotic zone of a coastal system. Estuar. Coast. Shelf. Sci., 41 (4):475-490. PARSONS, T.R., TAKAHASHI, M. & HARGREAV, B. 1977. Biological Oceanographic Processes,2nd ed., Oxford, Pergamon Press. 490 pp. PEINERT, R., SAURE, A., STEGMANN, P., STIENEN, C., HAARDT, H. & SMETACEK. 1982. Dynamics of primary production and sedimentation in a coastal ecosystem. Netherlands Journal of Sea Research, 16: 276-289. PÉREZ SEIJAS, G. M., RAMÍREZ, F. C & VIÑAS, M D. 1987. Variaciones de la abundancia numérica y biomasa del zooplancton de red en el Golfo San Jorge (Año 1985). Rev. Invest. Des. Pesq., 7:5-20. PERKINS, J. L. 1983. Bioassay evaluation of diversity and community comparison indices. J. WPCF, 55 (5):522-530. PÉRSICO, M. M. 1986. Biomasa fitoplanctónica en la plataforma norpatagónica durante el florecimiento primaveral. Seminario de Licenciatura, MS, Fac. Cs. Exactas y Nat., Univ. Nac. De Mar del Plata. 25 pp. PESANT, S., LEGENDRE, L., GOSSELIN, M., BAUERFEIND, E. & BUDEUS, G. 2002. Wind-triggered events of phytoplankton downward flux in the Northheast Water Polynya. J. Mar. Syst., 31 (4):261-278. PIÑERO, R. & ROUX, A. 2000 a. Plan de marcación de langostino patagónico. I. Resultados de la experiencia piloto de marcado y supervivencia realizada durante la campaña de 139 investigación OB-03/00. Informe Técnico Interno DNI INIDEP N°49/00, 12 pp. PIÑERO, R. & ROUX, A. 2000 b. Plan de marcación de langostino patagónico. I. Resultados de la experiencia piloto de marcado y supervivencia (campaña de investigación OB-03/00). IV Jornadas Nacionales de Ciencias del Mar. Puerto Madryn, 11-15 septiembre de 2000. Resúmenes:103. PIÑERO, R. & ROUX, A. 2001. Composición de la dieta de Nuculana sulculata (Cothouy,1852), Nucula puelcha D'Orbigny, 1842 y Malletia cummingi (Hanley, 1860), Moluscos Bivalvos Protobranquios del Golfo San Jorge, Argentina. IX COLACMAR, San Andrés, Colombia. Setiembre 2001. Resumen Expandido N° 007. PIÑERO, R., ROUX, A. & DE LA GARZA, J. 2001 a. Plan de marcación de langostino patagónico. III. Inicio de la actividad de marcación y liberación de langostino patagónico (Pleoticus muelleri) en concentraciones del Golfo San Jorge, durante la campaña de investigación OB-06/01. Informe Técnico Interno DNI INIDEP N° 39/01, 12 pp. PIÑERO, R., ROUX, A. & DE LA GARZA, J. 2001 b. Plan de marcación de langostino patagónico. IV. Reporte de las tareas de marcado y liberación desarrolladas durante la Campaña de Investigación OB-11/01. Septiembre 2001. Informe Técnico Interno DNI INIDEP N° 89/01, 7 pp. PIÑERO, R., ROUX, A. & DE LA GARZA, J. 2002. Plan de marcación del langostino patagónico. Informe de avance y actualización de los datos de recaptura. Período setiembre de 2001 - julio de 2002. Informe Técnico Interno DNI INIDEP Nº 73/02, 13 pp. PIÑERO, R., ROUX, A. & DE LA GARZA, J. 2003 a . Plan de marcación de langostino patagónico. Informe de avance y actualización de los datos de recaptura. Período agosto – diciembre 2002. Informe Técnico Interno DNI INIDEP Nº 17/03, 5 pp. PIÑERO, R., ROUX, A. & DE LA GARZA, J. 2003 b. Plan de marcación de langostino patagónico. VI. Reporte de las tareas de marcado y liberación desarrolladas durante la Campaña de Investigación OB-05/03. Informe Técnico Interno DNI INIDEP Nº 83/03, 5 pp. PIÑERO, R., ROUX, A. & DE LA GARZA, J. 2004 a. Plan de marcación de langostino patagónico. Actualización de los datos de recaptura: Período julio 2003 - febrero 2004 y reporte de las tareas de marcado y liberación desarrolladas durante la campaña OB – 01/04. Informe Técnico Interno DNI INIDEP Nº 26/04, 8 pp. PIÑERO, R., ROUX, A. & DE LA GARZA, J. 2004 b. Plan de marcación de langostino patagónico. Actualización de las recapturas realizadas por la flota tangonera durante el período marzo-julio 2004 y reporte de las tareas de marcado y liberación desarrolladas 140 durante la campaña OB-04/04. Informe Técnico Interno DNI INIDEP Nº 082/04, 9 pp. PIOLA, A. R. & RIVAS, A. L. 1997. Corrientes en la plataforma continental. En: El Mar Argentino y sus recursos pesqueros. Tomo 1. Antecedentes históricos de las exploraciones en el mar y las características ambientales. BOSCHI, E. E. (Ed), INIDEP, Mar del Plata, Argentina:119-132. PLANAS, M. & MORA, J., 1987. Estado del conocimiento actual del bentos en zonas orgánicamente enriquecidas. Thalassas , 5 (1):125-134. PLANTE, R., PLANTE-CUNY, M. R. & REYS, J. P. 1986. Photosynthetic pigments of sandy sediments on the north Mediterranean coast: their spatial distribution and its effect sampling strategies. Mar. Ecol. Prog. Ser., 34:133-141. PLYMOUTH MARINE LABORATORY. 1993. Environmental effects on benthic communities. Training Workshop on “Multivariate Análisis of Benthic Community data”. Lecture Notes for SEAS/EPOSII Workshop, Plymouth, 144 pp. POCKLINGTON, R. 1976. Terrigenous organic matter in surface sediments from the Gulf of St. Lawrence. Journal of Fisheries Research Board of Canada, 33:93-97. PREMUZIC, E.T., BENCOVITZ, C., GAFFNEY, J. & WALSH, J. 1982. The nature and distribution of organic matter in the surface sediments of world oceans and seas. Organic Geochemistry, 4:63-77. PRICE, B. 1976. Chemical Diagenesis in Sediments. En: Chemical Oceanography 6. RILEY J. P. & CHESTER, R. (Eds.). 2nd ed. Academic Press, New York, USA:1-51. PROYECTO LANGOSTINO. 2005. Informe presentado a la Consultora Serman & Asociados S.A. INIDEP, 162 pp. PROYECTO DE TELEMETRÍA SATELITAL E IMÁGENES, INIDEP. 2000. Imágenes satelitales de clorofila-a Sea WIFS del año 2000. QASIM, S. Z & SANKARANARAYANAN, V. N. 1972. Organic detritus of a tropical estuary. Marine Biology, 15:193-199. REDFIELD, A.C., KETCHUM B. & RICHARDS, F. 1963. The influence of organisms on the composition of sea water. En: The Sea. HILL, M. N. (Ed.), London: Academic Press. 123-135. RETA, R. 1986. Aspectos oceanográficos y biológico-pesqueros del Golfo San Jorge. Seminario de Grado de Licenciatura en Oceanografía. Universidad Nacional del Sur, Bahía Blanca, Argentina. 135 pp. RIAUX-GOBIN, C., LLEWLLYN, C. & KLEIN, B. 1987. Microphytobenthos from two subtidalsediments from North Brittany. II Variations of pigment compositions and 141 concentrations determined by HPLC and conventional techniques. Marine Ecology Progress Series, 40:275-283. RÍOS, F. & CISTERNAS, M. 1998. Uso de Parámetros sedimentológicos en el reconocimiento de ambientes hidrodinámicos en los canales y fiordos adyacentes a “Campos de Hielo Sur”. Chile. Invest. Mar., Valparaíso, 26:21-30. ROBLES, C. 1984. Distribución de fósforo, nitrógeno y silicio disueltos en el Río de la Plata. Serv. Hidrog. Naval. Arg., Público H 625:1-57. ROSELL, R. A., GASPARONI, J. C. & GALANTINI, J.A. 2001. Soil Organic Matter Evaluation. En: Assesment Methods for Soil Carbon. LAL, R. (Ed.). Lewis Publ., Boca Raton, USA:311-322. ROSEMBERG, R . 1980. Effect of oxygen deficiency on bentonic macrofauna. En: Freeland. FARMER, J.H. & LEVINGS, C. D. (Eds.). Fjord Oceanography plenum. Publ.Corp., New York:499-514. ROUX, A. 2000 a. Evaluación del Impacto Pesquero a través del análisis de la fauna bentónica acompañante en la pesquería de langostino (Pleoticus muelleri) del Golfo San Jorge y litoral de Chubut, Argentina. Frente Marítimo, 18:143-149. ROUX A. 2000 b. Captura incidental de invertebrados bentónicos en la pesquería de langostino patagónico del Golfo San Jorge. Año 1999. Informe Técnico Interno DNI INIDEP N° 52/00, 13 pp. ROUX, A. 2003. Fauna acompañante de la pesquería de langostino. Invertebrados bentónicos registrados en buques de la flota tangonera. Informe Técnico Interno DNI INIDEP Nº 13/03, 8 pp. ROUX, A. 2005. Invertebrados bentónicos acompañantes de la captura de langostino patagónico (Pleoticus muelleri). Resultados de la campaña de investigación OB-01/05. Enero-febrero 2005. Informe Técnico Interno DNI INIDEP Nº 53/05, 10 pp. ROUX, A. & FERNÁNDEZ, M., 1997. Caracterización de los fondos de pesca del langostino Pleoticus muelleri en el Golfo San Jorge y litoral de la provincia de Chubut. Argentina. Informe Técnico Interno INIDEP, 13, 28 pp. ROUX, A. & BERTUCHE, D. 1998. Breve reseña de las evidencias de contaminación con petróleo detectadas en el Golfo San Jorge y de los posibles efectos sobre el recurso langostino. Julio de 1998. Informe Técnico Interno DNI INIDEP N° 97/98, 8 pp. ROUX, A. & PIÑERO, R. 1999. El estado de los fondos del Golfo San Jorge. Resultados de la Campaña OB-01/99. Informe Técnico Interno DNI INIDEP N° 29/99, 12 pp. ROUX, A. & PIÑERO, R. 2001. Cambios en la estructura de la comunidad bentónica del Golfo 142 San Jorge y áreas asociadas a los fondos de pesca del langostino patagónico. Informe Técnico Interno DNI INIDEP N° 107/01, 10 pp. ROUX, A. & PIÑERO, R. 2003. Crustáceos decápodos y estomatópodos asociados a la pesquería de langostino patagónico (Pleoticus muelleri) del Golfo San Jorge. Informe Técnico Interno DNI INIDEP Nº 84/03, 12 pp. ROUX, A. & PIÑERO, R. 2004. Estado de los fondos de distribución de langostino patagónico. Resultados de la campaña de investigación OB-01/04. Febrero 2004. Informe Técnico Interno DNI INIDEP Nº 50/04, 8 pp. ROUX, A. & PIÑERO, R. 2005 a. Invertebrados bentónicos acompañantes de la captura de langostino patagónico (Pleoticus muelleri). Resultados de la campaña de investigación OB-09/04. Noviembre-diciembre 2004. Informe Técnico Interno DNI INIDEP Nº 14/05, 13 pp. ROUX, A. & PIÑERO, R. 2005 b. Estado de los fondos de distribución de langostino patagónico. Año 2004. Informe Técnico Interno DNI INIDEP Nº 54 /05, 18 pp. ROUX, A. & PIÑERO, R. 2005 c. Invertebrados bentónicos acompañantes de la captura de langostino patagónico (Pleoticus muelleri). Resultados de la campaña de investigación OB-05/05, mayo-junio 2005. Informe Técnico Interno DNI INIDEP Nº 79/05, 13 pp. ROUX, A. & PIÑERO, R. 2005 d. Invertebrados bentónicos acompañantes de la captura de langostino patagónico (Pleoticus muelleri). Resultados de la campaña de investigación OB-05/05, mayo-junio 2005. Informe Técnico Interno DNI INIDEP Nº 95/05, 9 pp. ROUX, A. & PIÑERO, R. (En prensa). Crustáceos decápodos y estomatópodos asociados a la pesquería de langostino patagónico Pleoticus muelleri (Bate, 1888), Argentina. Rev. Invest. Desarr. Pesq. N° 18. ROUX, A., FERNÁNDEZ, M. & BREMEC, C. 1995. Preliminary survey of the benthic communities of patagonian shrimp fishing grounds in San Jorge Gulf (Argentina). Ciencias Marinas, 21 (3):295-310. ROUX, A., FERNANDEZ, M. & PIÑERO, R. 1999. Breve reseña del estado actual de los fondos del Golfo San Jorge. Informe Técnico Interno DNI INIDEP N° 21/99, 5 pp. ROUX, A., PIÑERO, R. & DE LA GARZA, J. 2002. La pesquería de langostino patagónico. Catálogo de la fauna asociada a la especie objetivo en las capturas de la flota tangonera. Informe Técnico Interno DNI INIDEP Nº 42/02, 29 pp. ROUX, A., PIÑERO, R. & MORIONDO, P. 2003. Invertebrados bentónicos acompañantes de la captura de langostino patagónico (Pleoticus muelleri). Resultados de la campaña de investigación OB-05/03. Informe Técnico Interno DNI INIDEP Nº114/03, 8 pp. 143 ROUX, A., PIÑERO, R. & MORIONDO, P. 2004. Pesquería de Langostino patagónico. Ecología alimentaria del langostino patagónico (Pleoticus muelleri). Informe Técnico Interno DNI INIDEP Nº 43/04, 19 pp. ROUX, A., PIÑERO, R. & DE LA GARZA, J. (En prensa). Guía para la identificación de la fauna asociada a la pesquería del langostino patagónico. Publicaciones Especiales INIDEP. ROWE, T. & GILBERT, T. 1977. Los ciclos del nitrógeno y del carbono en los sedimentos del Golfo de Guayaquil. CUEA Newsletter, 7 (1):31-42. RUDOLPH, A., AHUMADA, R. & HERNÁNDEZ, S. 1984. Distribución de la materia orgánica, carbono orgánico, nitrógeno orgánico y fósforo total en los sedimentos recientes de la Bahía de Concepción, Chile. Biología Pesquera, 13:71-82. SAGPyA. 2001. Capturas Marítimas Totales 2001. Secretaría de Agricultura, Ganadería, Pesca y Alimentación. Argentina. 8 pp. SAGPyA. 2001. Capturas Marítimas Totales 2001. Secretaría de Agricultura, Ganadería, Pesca y Alimentación. Argentina. 8 pp. SANAGUA, J., HLEBSZEVITSCH, J. & SUÁREZ, F. 2002. Los reservorios del flanco oeste. En: Rocas Reservorios de las cuencas productivas de la Argentina. Simposio del V Congreso de Explotación y Desarrollo de Hidrocarburos, Mar del Plata. SCHIUMA, M., HINTERWIMMER, G. & VERGANI, G. (Eds.). Instituto Argentino del Petróleo y del Gas, Buenos Aires:175-198. SÁNCHEZ MATA, A. 1996. El macrozoobentos submareal de la Ría de Ares y Betanzos: estructura biosedimentaria y dinámica poblacional; impacto de la marea negra del Aegean Sea. Tesis Doctoral, Universidad de Santiago de Compostela, Santiago de Compostela, España: 631 pp. SÁNCHEZ MATA, A., MORA, J., GARMENDIA, J. M. & LASTRA, M. 1993 a. Estructura trófica del macrozoobentos submareal de la ría de Ares-Betanzos. I: Composición y distribución. Publ. Esp. Inst. Esp. Oceanogr., 11:33-40. SÁNCHEZ MATA, A., LASTRA, M., CURRAS, A. & MORA, J. 1993 b. Estructura trófica del macrozoobentos submareal de la ría de Ares-Betanzos. II: Ordenación y clasificación de categorías tróficas en relación a los factores medioambientales. Publ. Esp. Inst. Esp. Oceanogr., 11: 41-47. SÁNCHEZ MATA, A., GLEMAREC, M. & MORA, J. 1999. Physico-chemical structure of de benthic environment of Galicia ría (Rìa de Ares-Betanzos, noth-west, Spain). J. Mar. Biol. Ass. U. K., 79:1-21. 144 SANDERS, H. 1958. Benthic studies in Buzzard Bay. I. Animal-sedoment relationship. Limnol. Oceanogr., 3 (3):245:258. SARGENT, J., HOPKINS, C., SEIRING, J. & YOUNGSON, A., 1983. Partial characterization of organic material in surface sediments from Balsfjorden, northern Norway, in relation to its origin and nutritional value for sediment-ingesting animals. Marine Biology, 76:87-94. SCHEJTER, L. 2005. Asociaciones bentónicas en bancos de viera patagónica (Zygochlamys patagonica) en el Mar Argentino. Tesis para optar al Título de Doctor en Ciencias Biológicas. Unversidad Nacional de Mar del Plata. 216 pp. SCHNETZER, A. & STEINBERG, D. K. 2002. Active transport of particulate organic carbon and nitrogen by vertically migrating zooplankton in the Sargasso Sea. Mar. Ecol. Prog. Ser., 234:71-84. SECRETARIA DE ENERGÍA DE LA REPÚBLICA ARGENTINA. Contenidos didácticos: Hidrocarburos. (http://energia3.mecon.gov.ar/contenidos/). (Consulta: 27 de abril de 2006) SEIDERER, I. J. & NEWELL. 1999. Analysis of the relationship between sediment composition and benthic community structure in coastal deposits. ICES Journal of Marine Science, 56: 757-765. SHANNON, C. E. & WEAVER, W. 1963. The mathematical theory of communication. Univ. Illinois Press, Urba. 117 pp. SIMUNOVIC,A., PICCINETTI, C. & ZORE-ARMANDA, 1999. Kill of benthic organims as a response to an anoxic state in the northern Adriatic (a critical review). Acta Adriat. 40 (1):37-64. SMETACEK, V. 1985. Role on sinking in diatom life-history cycles: ecological, evolutionary and geological significance. Marine Biology, 84:239-252. SNEATH, P. H. & SOKAL, R. R. 1973. Numerical taxonomy. W. H. Freeman, San Fransisco. 235 pp. SOKAL, R.R. & MICHENER, C. D. 1958. A statistical methods for evaluating systematic relationships. Univ. Kansas Sci. Bull., 38:1409-1438. SOKAL,, R.R. & ROHLF, F.J. 1979. Biometría. Principios y metodologías estad isticas en la investigación biológica. H. Blume edición. Rosario, Madrid . 832 pp. SOMERS, I. F. 1987. Sediment type as a factor in the distribution of the commercial prawn species of the western Gulf of Carpentaria, Australia. Aust. J. Mar. Freshw. Res., 38:133149. SONDERGAARD, M., JENSEN, J. P & JEPPESEN, E. 2003. Role of sediment and internal 145 loadingof phosphorus in shallow lakes. Hidrobiología, 506-509:135-145. STATISTICA SOFTWARE. 1998. Statistica Software, versión 6. STEIN, R., 1991. Acumulation of organic carbon in marine sediments. Berlin: SpringerVerlang.(Lecture Notes in Earth Sciences). 46 pp. STIRN, J. 1981. Manual of methods in acuatic environment reserch. Part 8. Ecological assessment of pollution effects (guidelines for the FAO GFCM/UNEP Joint Coordinated Proyect on Pollution in the Mediterranean). Fao. Fish. Tech. Pap. 209. 70 pp. STRICKLAND, J. H. D. & PARSONS, T. R. 1965. A manual of sea water analysis. Fisheries Research Board of Canada. Bull Nº 125. 212 pp. SUN, M., ALLER, R. & LEE, C. 1994. Spatial and temporal distributions of sedimentary Chloropigments as indicators of benthic processes in Long Island Soud. J. Mar. Res., 52 (1):149-176. TAGHON, G. L., SELF, R. F. & JUMARS, P.A. 1978. Predicting particle selection by deposit feeders : A model and its implications. Limnol. Oceanogr., 23 (4):752-759. TEER BRAAK, C. J. F. 1988. A Fortran program for canonical community ordination by partial detrended canonical correspondence analysis, principal components analysis and redundancy analysis. Agricultural Mathematics Group, Ministry of Agriculture and Fisheries. Ithaca. New York. 95 pp. TRASK, P.D. 1932. Origen and environment of source sediments of petroleum. Houston: Houston Gulf Publications. TRIMMER, M., GOWEM, R. J., STEWART, B. M. & NEDWELL, D. B. 1999. The spring bloom and its impact on benthic mineralisation rates in western Irish sea sediments. Mar. Ecol. Prog. Ser., 185:37-46. THRUSH, S. F., HEWITT, J. E., CUMMINGS, V. J. & DAYTON, P. K. 1995. The impact of habitat disturbance by scallop dredging on marine benthic communities: what can be predicted from the results of experiments?. Mar. Ecol. Prog. Ser., 129:141-150. TUCK, I. D. HALL, S. J., ROBERTSON, M. R., ARMSTRONG, C. & BASFORD, D. J. 1998. Effects of physical trawling disturbance in a previously unfished sheltered Scottish Sea Loch. Mar. Ecol., 162:227-242. TURNER, J. T. 2002. Zooplankton fecal pellets, marine snow and sinking phytoplankton blooms. Aquat. Microb. Ecol., 27 (1):57-102 VELAZCO CASTILLO, F. 1999. Caracterización sedimentológica de la Bahía del Callao y la Zona Frente a Ventanilla. Perú. VIII COLACMAR. Libro de Resúmenes Ampliados. Tomo II. TRESIERRA AGUILAR & CULQUICHICÓN MALPICA (Eds):629-630. 146 VIÑAS, M. D., RAMÍREZ, F., SANTOS, B.A. & PÉREZ SEIJAS, G. 1992. Zooplancton distribuido en el área de desove y de crianza norpatagónica de la merluza (Merluccius hubbsi). Frente Marítimo, 11 (A):105-113. WARWICK, R. M. & CLARKE, K. R. 1991. A caparison of some methods for analysing changes in benthic community structure. J. Mar. Biol. Ass. U. K., 71:225-244. WASHINGTON, H. G. 1984. Diversity, biotic and similarity index, a review with special relevance to aquatic ecosystems. Water Res., 18 (6):653-694. WASSMANN, P. 1985. Sedimentation of particulate material in two shallow, land locked fjords in western Norway. Sarsia, 70:317-331. WENTWORTH, C. K. 1922. A scale of grade and class terms for clastic sediments. J. Geol., 30: 377-392. WILLIAMS, A. B. 1958. Substrates as a factor in shrimp distribution. Limnology and Oceanography, 3:283-290. YE, Y., MOHAMMED, H. M. A. & BISHOP, J. P. 1999. Depth, temperature and salinity preferences of newly recruit penaeid shrimps in Kuwait waters. Fish. Oceanogr., 8 (2): 128-138. ZAR, J. 1996. Biostatistical Analysis. 3rd ed. New Jersey: Prentice Hall. 662 pp. 147 APÉNDICE 148 TABLAS 149 Tabla 1. Ubicación geográfica de las estaciones de muestreo. Código de las estaciones generales, longitud, latitud y profundidad. Estaciones generales de las campañas de investigación OB-06/99, OB-01/00, OB-03/00 y OB-07/00 - OB-10/00, primavera de 1999 y verano, otoño e invierno de 2000, respectivamente. Estación general Código Longitud (ºW) Latitud (ºS) Profundidad (m) PRIMAVERA 1999 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 66º 49,9’ 67º 00,0’ 67º 09,8’ 67º 19,9’ 67º 29,9’ 67º 19,8’ 67º 10,1’ 67º 01,2’ 66º 50,2’ 66º 39,9’ 66º 29,9’ 66º 19,8’ 66º 09,8’ 65º 39,9 64º 49,9’ 65º 59,8’ 66º 09,6’ 66º 19,8’ 66º 29,9’ 66 39,8’ 66º 49,9’ 67º 00,0’ 66º 09,9’ 66º 49,9’ 66º 40,0’ 66º 30,3’ 66º 20,3’ 66º 10,2’ 66º 00,2’ 65º 50,0’ 65º 40,1’ 65º 40,0’ 65º 50,0’ 65º 59,8’ 66º 09,8’ 66º 19,9’ 66º 29,8’ 66º 02,0’ 65º 50,2’ 45º 20,0’ 45º 30,0’ 45º 40,1’ 45º 49,8’ 45º 59,9’ 46º 19,9’ 46º 10,2’ 46º 00,4’ 45º 49,7’ 45º 39,9’ 45º 30,0’ 45º 19,9’ 45º 10,0’ 45º 10,4’ 45º 20,1’ 45º 29,9’ 45º 40,0’ 45º 50,0’ 46º 00,1’ 46º 09,9’ 46º 19,9’ 46º 30,1’ 46º 39,9’ 46º 50,0’ 46º 40,0’ 46º 30,1’ 46º 19,8’ 46º 10,0’ 46º 00,2’ 45º 49,9’ 45º 40,0’ 46º 10,1’ 46º 20,5’ 46º 30,0’ 46º 40,0’ 46º 50,2’ 47º 00,0’ 46º 59,9’ 46º 50,0’ 68 74 63 37 59 83 86 88 86 86 87 86 69 83 87 90 91 92 92 89 87 83 31 66 80 92 93 95 95 92 89 93 91 89 75 58 21 53 36 526 525 524 523 522 521 520 519 518 517 527 528 529 531 530 502 503 516 515 514 513 512 511 510 509 508 507 506 505 504 501 500 499 498 497 496 495 494 493 VERANO 2000 OTOÑO INVIERNO 2000 2000 Estaciones generales 276 275 274 273 272 68 271 69 270 80 269 84 268 267 90 277 278 91 279 92 265 89 266 264 85 263 79 262 70 261 67 243 64 244 65 245 66 246 71 260 78 259 86 258 255 88 256 257 254 87 253 77 252 72 251 73 247 74 248 75 249 76 250 522 553 554 555 556 557 558 559 560 561 562 563 564 565 523 524 525 526 566 567 568 569 570 571 529 528 527 531 530 150 Tabla 2. Ubicación geográfica de las estaciones de muestreo de cada campaña de investigación. Campaña de investigación OB-06/01 (otoño de 2001). Código de las estaciones generales, longitud y latitud; estaciones generales de las campañas de investigación, OB-11/01, OB-13/01 y OB-01/02, invierno y primavera de 2001 y verano de 2002, respectivamente. Segundo período de estudio. OTOÑO 2001 Estación Longitud Latitud Prof Estación Longitud (ºW) (m) general (ºS) (ºW) general Código 256 66º 35’ 46º 44’ 67 1 66º 00’ 259 66º 38’ 46º 44’ 67 2 66º 30’ 261 67º 06’ 46º 42’ 54 3 66º 50’ 278 66º 60’ 46º 34’ 82 4 67º 10’ 282 66º 42’ 46º 38’ 79 5 67º 00’ 288 66º 13’ 46º 51’ 72 6 66º 30’ 292 66º 13’ 46º 51’ 73 7 66º 40’ 295 66º 00’ 46º 33’ 86 8 66º 20’ 297 67º 03’ 46º 26’ 89 9 66º 10’ 300 66º 28’ 46º 28’ 90 10 66º 00’ 329 65º 57’ 46º 26’ 80 11 65º 50’ 331 65º 55’ 46º 19’ 80 12 65º 40’ 334 65º 38’ 46º 11’ 92 13 65º 30’ 339 65º 28’ 46º 01’ 78 14 65º 20’ 342 65º 19’ 45º 51’ 84 15 65º 05’ 350 65º 25’ 45º 37’ 87 16 66º 50’ 352 65º 53’ 45º 07’ 67 17 66º 20’ 18 65º 50’ 19 65º 20’ 20 64º 50’ INVIERNO 2001 Latitud Prof .(m) (ºS) 47º 00’ 47º 00’ 46º 50’ 46º 40’ 46º 30’ 46º 30’ 46º 40’ 46º 50’ 46º 40’ 46º 30’ 46º 20’ 46º 10’ 46º 00’ 45º 50’ 45º 35’ 45º 20’ 45º 20’ 45º 20’ 45º 20’ 45º 20’ 42 23 66 27 83 91 80 57 77 88 91 92 83 85 82 68 83 86 91 89 PRIMAVERA 2001 VERANO 2002 Número real de las estaciones 695 696 697 698 699 700 701 702 703 704 705 706 707 713 712 708 709 710 711 - 952 951 972 971 970 974 973 947 969 977 980 981 982 983 984 990 989 988 986 985 34 67 53 45 48 57 56 69 71 77 43 78 79 80 81 89 85 84 83 82 151 Tabla 3. Ubicación geográfica de las estaciones generales (lances de pesca). Campaña de investigación OB-05/03, invierno de 2003. Tercer período de estudio. ESTACIÓN GENERAL 98 99 100 101 102 103 104 106 107 109 110 111 112 114 116 117 118 119 120 122 123 124 125 126 127 129 130 131 132 133 134 135 138 140 142 144 147 148 149 150 151 152 153 155 169 170 LANCE LATITUD LONGITUD (ºS) (ºW) 1 2 3 4 5 6 7 8 9 11 12 13 14 15 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 36 38 40 42 43 44 45 46 47 48 49 50 51 52 46º 44,0’ 46º 47,9’ 46º 51,4’ 46º 54,0’ 46º 52,6’ 46º 56,6’ 46º 58,0’ 46º 56,2’ 46º 50,7’ 46º 47,1’ 46º 48,4’ 46º 53,0’ 46º 55,4’ 46º 30,1’ 46º 39,5’ 46º 36,2’ 46º 41,3’ 46º 45,8’ 46º 42,4’ 46º 44,0’ 46º 42,9’ 46º 47,4’ 46º 49,0’ 46º 45,0’ 46º 40,8’ 46º 31,4’ 46º 36,4’ 46º 30,1’ 46º 36,5’ 46º 39,0’ 46º 33,9’ 46º 37,8’ 46º 24,3’ 46º 17,2’ 46º 07,1’ 45º 57,5’ 46º 33,7’ 46º 32,4’ 46º 38,0’ 46º 40,8’ 46º 37,0’ 46º 38,9’ 46º 42,9’ 46º 52,4’ 46º 23,7’ 46º 23,3’ 66º 30,3’ 66º 37,4’ 66º 36,1’ 66º 39,3’ 66º 44,0’ 66º 45,1’ 66º 37,6’ 66º 26,9’ 66º 24,4’ 66º 18,2’ 66º 11,2’ 66º 16,8’ 66º 06,6’ 65º 53,7’ 65º 54,8’ 66º 01,2’ 66º 03,3’ 66º 08,3’ 66º 12,9’ 66º 36,1’ 66º 47,3’ 66º 43,9’ 66º 51,7’ 66º 58,9’ 67º 02,1’ 67º 17,9’ 67º 10,1’ 66º 59,0’ 66º 57,2’ 66º 51,3’ 66º 46,2’ 66º 41,8’ 67º 21,0’ 67º 19,4’ 67º 29,8’ 67º 24,5’ 66º 24,5’ 66º 12,4’ 66º 07,0’ 66º 14,0’ 66º 17,6’ 66º 28,4’ 66º 22,4’ 66º 51,0’ 65º 55,2’ 65º 47,9’ 152 Tabla 4. Clasificación sedimentaria. A: gravas y arenas, B: limos y arcillas. A TAMAÑO DEL CLASTO (mm) 4 TAMIZ Nº 5 -2 2,8 7 -1,5 ARENA 2 10 -1 CLASIFICACIÓN CLASTO CLASIFICACIÓN SEDIMENTO Canto rodado GRAVA (G) Grano PHI “Φ” MUY 1,4 14 -0,5 GRUESA (AMG) 1 18 0 ARENA 0,710 25 0,5 GRUESA (AG) 0,500 35 1 ARENA 0,350 45 1,5 MEDIANA (AM) 0,250 60 2 ARENA 0,180 80 2,5 FINA (AF) 0,125 120 3 ARENA MUY 0,090 170 3,5 FINA (AMF) 0,063 230 3,9 CLASIFICACION SEDIMENTO Tamaño del clasto (mm) “Φ” LIMO GRUESO (LG) 0,062 4 LIMO MEDIO (LM) 0,031 5 LIMO FINO (LF) 0,0156 6 LIMO MUY FINO (LMF) 0,0078 7 B CLASIFICACION CLASTO Partícula Partícula PHI ARCILLA GRUESA (ArG) 0,0039 8 ARCILLA MEDIANA (ArM) 0,002 9 A. FINA A MUY FINA (ArF MF) < 0,001 10 153 Tabla 5. Estadística descriptiva de las variables sedimentológicas y del agua de fondo. Variables valores Temperatura mínimo (ºC) máximo “T” Promedio Agua de fondo Desv. estand. Salinidad mínimo (ups) máximo “S” Promedio Agua de fondo Desv. estand. Densidad mínimo 3 (kg/m ) máximo “D” Promedio Agua de fondo Desv. estand. Concentración de mínimo Oxígeno (ml O2/l ) máximo “O” Promedio Agua de fondo Desv. estand. Clorofila a mínimo (mg/m3) máximo Agua de Promedio superficie Desv. estand. Clorofila a mínimo 3 (mg/m ) máximo Capa de Promedio mezcla Desv. estand. Clorofila a mínimo (mg/m3) máximo ‘Cl a (AF)” Promedio Agua de fondo Desv. estand. Materia orgánica mínimo total (%) máximo “MOT” Promedio Sedimentos Desv. estand. Carbono orgánico mínimo total (%) máximo “COT” Promedio Sedimentos Desv. estand. Nitrógeno mínimo total (%) máximo “NT” Promedio Sedimentos Desv. estand. Relación mínimo Carbono/nitrógeno máximo “C:N” Promedio Sedimentos Desv. estand. Clorofila a mínimo (μg/g) máximo “Cl a (S)” Promedio Sedimentos Desv. estand. Feopigmentos mínimo (μg/g) máximo “Feop (S)” Promedio Sedimentos Desv. estand. *0,01< P < 0,05 - ** P < 0,01 – ns P > 0,05 PRIMAVERA 1999 “P” 8,04 11,43 9,10 0,79 33,26 33,69 33,59 0,10 25,470 26,180 25,997 0,16 4,65 6,61 5,56 0,53 0,10 2,21 0,57 0,40 0,19 1,31 0,70 0,33 0,06 1,66 0,42 0,38 0,59 13,33 7,34 3,08 0,32 3,18 1,56 0,74 0,03 0,27 0,15 0,07 0,13 20,29 10,67 3,67 0,01 0,89 0,26 0,25 0,24 34,06 11,86 8,77 VERANO 2000 “V” 8,31 15,37 10,23 2,22 33,30 33,64 33,55 0,10 24,681 26,129 25,761 0,48 2,57 6,43 4,50 0,86 0,11 2,37 0,57 0,52 0,26 3,15 0,97 0,59 0,18 2,16 0,55 0,47 1,04 10,48 6,71 3,07 0,42 3,98 2,02 1,00 0,01 0,18 0,10 0,05 11,45 69,48 23,75 13,40 0,05 2,75 0,47 0,60 1,15 35,28 12,34 8,20 OTOÑO 2000 “O” 8,94 12,35 10,23 1,23 33,13 33,75 33,52 0,13 25,297 26,083 25,754 0,24 1,82 6,03 3,93 1,47 0,36 3,38 1,08 0,67 0,36 3,05 1,04 0,74 0,07 2,11 0,40 0,40 1,17 12,73 7,42 3,13 0,76 2,86 1,71 0,61 0,02 0,32 0,16 0,07 6,22 53,36 13,52 9,04 0,01 2,96 0,51 0,69 0,06 22,20 7,68 6,13 INVIERNO 2000 “I” 5,66 8,02 7,49 0,57 33,07 33,80 33,59 0,18 26,035 26,369 26,242 0,09 6,34 6,82 6,56 0,11 0,43 0,94 0,59 0,13 0,62 1,32 0,91 0,18 0,39 1,39 0,89 0,28 1,58 14,24 10,00 3,77 0,42 3,74 2,03 0,88 0,05 0,77 0,33 0,19 2,76 18,09 7,43 3,46 0,15 5,02 1,54 1,16 0,52 95,78 24,77 19,15 TEST DE DUNN P-V ns P-O ** P-I ** V-O ns V-I ** O-I ** P-V ns P-O * P-I * V-O ns V-I * O-I ** P-V ns P-O ** P-I ** V-O * V-I ** O-I ** P-V ** P-O ** P-I ** V-O ns V-I ** O-I ** P-V ns P-O * P-I ns V-O * V-I ns O-I ** P-V ns P-O ns P-I ns V-O ns V-I ns O-I ns P-V ns P-O ns P-I ** V-O ns V-I ** O-I ** P-V ns P-O ns P-I ** V-O ns V-I ** O-I ** P-V ns P-O ns P-I ns V-O ns V-I ns O-I ns P-V ns P-O ns P-I ** V-O ns V-I ** O-I ** P-V ** P-O ns P-I ** V-O ** V-I ** O-I ** P-V ns P-O ns P-I ** V-O ns V-I ** O-I ** P-V ns P-O ns P-I ** V-O ns V-I ** O-I ** 154 Tabla 6. Composición granulométrica (%), parámetros granulométricos (media, selección y asimetría en unidades Φ) y carbonatos (%) de las estaciones generales de la campaña de investigación de noviembre de 1999. E S T A C I O N E S G E N E R A L E S Part Grava Grava Arena muy gruesa Arena muy gruesa Arena muy gruesa Arena gruesa Arena gruesa Arena media Arena media Arena fina Arena fina Arena muy fina Arena muy fina Limo grueso Limo medio Limo fino Limo muy fino Arcilla gruesa Arcilla media Arcilla fina y muy fina mm 4 2,8 2 1,4 1 0,71 0,5 0,355 0,250 0,180 0,125 0,090 0,063 0,062 0,031 0,0156 0,0078 0,0039 0,002 <0,001 -2 -1,5 -1 -0,5 0 0,5 1 1,5 2 2,5 3 3,5 3,9 4 5 6 7 8 9 70,08 32,95 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 2,69 9,36 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 1,56 4,21 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 1,06 0,86 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 1,07 0,20 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,01 0,08 0,00 0,00 0,00 0,00 0,00 0,00 1,48 0,18 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,01 0,05 0,00 0,00 0,00 0,00 0,00 0,00 1,35 0,44 0,00 0,06 0,00 0,01 0,00 0,00 0,00 0,00 0,00 0,02 0,00 0,06 0,16 0,00 0,01 0,01 0,00 0,00 0,02 2,07 10,10 0,00 0,08 0,17 0,04 0,08 0,05 0,00 0,03 0,00 0,03 0,15 0,09 0,43 0,03 0,04 0,01 0,00 0,02 0,02 15,35 25,58 0,17 0,08 0,45 0,05 0,18 0,06 0,00 0,16 0,00 0,06 0,10 0,21 0,87 0,24 0,05 0,03 0,08 0,02 0,03 2,78 3,78 0,85 0,08 0,66 0,13 0,23 0,08 0,00 0,33 0,00 0,03 0,08 0,26 1,22 0,31 0,05 0,02 0,26 0,03 0,05 0,30 1,65 61,53 0,18 1,77 1,52 1,47 0,40 0,00 0,52 0,00 0,12 0,35 1,03 2,33 0,62 0,05 0,06 4,56 0,12 0,09 0,14 1,02 13,31 4,06 24,62 29,29 21,28 9,23 0,00 0,73 0,00 0,38 1,02 3,25 5,39 1,06 0,10 0,08 58,58 0,30 0,14 0,07 1,16 2,70 13,13 8,75 14,83 11,17 16,28 0,00 0,51 0,00 1,05 1,40 6,32 6,41 0,98 0,17 0,28 12,15 0,35 0,15 0,01 1,90 14,71 14,22 17,77 9,19 29,08 16,39 4,10 6,47 47,33 5,68 10,03 14,67 10,94 22,93 4,13 13,24 11,36 3,20 36,42 0,00 1,05 0,86 16,99 6,77 18,39 9,05 28,25 17,50 9,06 13,60 7,40 18,00 23,47 42,99 17,73 3,68 9,16 2,86 1,91 11,07 0,00 2,07 1,05 20,73 16,71 12,53 8,72 6,85 26,13 25,97 23,80 12,46 20,49 9,94 1,35 22,33 24,26 8,61 2,05 26,47 13,26 0,00 1,19 0,82 15,11 5,32 4,18 4,85 4,20 16,73 16,54 5,30 22,12 15,94 19,39 0,74 3,94 19,11 12,39 1,24 27,39 11,00 0,00 0,65 1,33 6,18 6,09 3,26 4,41 2,97 13,98 11,02 2,72 18,61 5,91 6,74 3,64 12,99 12,22 17,59 0,05 1,77 10,50 0,00 0,55 1,04 2,55 3,35 2,81 2,36 2,89 7,35 5,06 0,40 5,46 8,55 6,68 6,02 5,83 11,45 13,36 1,45 8,15 5,20 PHI (φ) 493 494 495 496 497 498 499 500 501 502 503 504 504 506 507 508 509 510 511 512 513 10 Media granulomé trica (φ) Selección (φ) Asimetría (φ) Carbonatos % 0,00 1,08 1,66 6,57 7,57 3,76 7,10 12,36 14,23 23,59 6,85 26,59 17,98 7,86 17,38 11,01 24,68 25,17 5,36 30,26 12,06 1,03 2,40 5,10 4,00 3,60 3,10 4,70 6,28 6,80 4,20 7,09 6,00 5,06 3,52 5,69 5,80 7,90 2,75 5,85 5,20 0,68 2,34 0,75 1,65 2 1,52 1,7 1,98 1,9 2,03 1,99 2,22 1,95 2,44 1,97 1,87 2,24 1,1 1,83 2,1 -0,14 0,66 0,343 0,7 0,6 0,79 0,61 0,34 0,15 0,04 0,16 0,47 0,62 0,42 0,15 -0,22 0,58 0,28 0,45 9,65 7,82 4,52 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 155 Tabla 6 (Continuación). Composición granulométrica (%), parámetros granulométricos (media, selección y asimetría en unidades Φ) y carbonatos (%) de las estaciones generales de la campaña de investigación de noviembre de 1999. O B 0 6 9 9 Part Grava Grava Arena muy gruesa Arena muy gruesa Arena muy gruesa Arena gruesa Arena gruesa Arena media Arena media Arena fina Arena fina Arena muy fina Arena muy fina Limo grueso Limo medio Limo fino Limo muy fino Arcilla gruesa Arcilla media Arcilla fina y muy fina mm 4 2,8 2 1,4 1 0,71 0,5 0,355 0,250 0,180 0,125 0,090 0,063 0,062 0,031 0,0156 0,0078 0,0039 0,002 <0,001 10 Media granulomé trica (φ) Selección (φ) Asimetría (φ) Carbonatos % 5,24 5,21 7,89 5,27 5,27 7,13 1,48 4,91 1,12 0,00 1,95 4,25 1,66 6,54 6,14 0,85 9,00 1,79 13,88 9,91 16,43 22,69 7,04 17,43 5,64 19,35 2,45 0,00 4,54 11,70 5,29 21,68 10,76 2,27 12,06 3,18 4,37 5,50 5,45 6,46 4,58 5,58 3,31 5,19 3,98 0 3,20 5,10 3,60 6,00 4,78 3,78 0 0,18 2,13 1,96 2,27 2,61 1,95 2,24 1,65 2,28 1,05 1,45 1,43 2,21 1,87 1,12 2,35 1,71 0,64 0,26 0,12 -0,03 0,33 0,2 0,88 0,35 0,06 0,81 0,4 0,12 0,28 0,62 -0,02 0,37 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 12,09 0,00 0,00 0,00 0,00 0,00 0,00 9,90 5,38 4,52 11,52 PHI (φ) 514 515 516 517 518 519 520 521 522 523 524 525 526 527 528 529 530 531 -2 -1,5 -1 -0,5 0 0,5 1 1,5 2 2,5 3 3,5 3,9 4 5 6 7 8 9 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 86,8 0,00 0,00 0,00 0,00 0,00 0,00 0,00 3,72 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,03 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,01 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,59 0,00 0,00 0,00 0,00 0,00 0,00 0,26 1,86 0,00 0,03 0,00 0,00 0,00 0,02 0,00 0,00 0,01 0,41 0,01 0,00 0,00 0,00 0,00 0,11 0,29 1,23 0,00 0,04 0,00 0,04 0,00 0,06 0,03 0,00 0,01 0,81 0,18 0,00 0,00 0,00 0,00 0,06 0,44 1,97 0,01 0,11 0,00 0,61 0,15 0,19 2,92 0,08 0,39 1,67 0,82 0,00 0,07 0,08 0,00 0,11 0,93 3,96 0,09 0,19 0,00 2,16 0,39 0,43 0,21 0,20 1,68 2,41 2,47 0,00 0,21 0,17 0,00 0,23 2,38 17,75 0,18 0,33 3,83 3,09 0,50 0,45 0,29 0,39 4,91 2,03 4,43 0,00 0,22 0,31 0,21 0,41 3,28 36,57 0,31 0,63 3,22 3,88 0,64 0,59 0,32 1,04 12,13 2,23 8,51 0,00 0,51 0,73 0,29 0,81 3,98 14,96 0,64 1,54 2,68 4,36 0,60 0,75 0,34 2,75 18,38 1,45 9,74 0,00 1,67 1,20 0,86 9,71 2,50 2,27 0,37 1,16 0,61 1,92 1,01 0,53 0,17 4,61 11,43 0,98 6,77 0,00 4,93 0,93 2,33 9,19 1,47 0,83 40,73 18,28 5,89 2,35 29,13 18,98 56,11 35,65 31,08 0,51 28,67 15,55 18,48 7,49 8,88 32,19 10,81 1,48 14,76 22,94 18,85 13,72 22,12 16,22 13,30 3,39 10,43 0,00 18,70 33,43 42,92 18,04 23,31 24,49 17,26 1,40 8,24 17,90 19,88 14,25 13,39 15,47 7,27 7,18 2,90 0,00 7,31 17,65 13,72 13,01 26,82 10,97 7,69 3,07 8,98 9,89 7,71 12,51 10,78 10,06 4,98 10,14 2,14 0,00 4,64 8,42 7,41 16,35 11,32 7,16 15,16 1,78 6,57 11,85 13,00 13,16 8,97 11,69 6,92 10,32 0,93 0,00 1,26 9,00 2,91 13,47 9,08 1,45 12,50 2,19 total 4,96 0,31 0,15 0,05 0,10 0,10 0,15 0,65 1,92 1,86 3,42 6,04 3,77 16,82 14,74 12,63 9,15 7,13 156 Tabla 7. Tipos sedimentarios de las estaciones de muestreo de las campañas de investigación de primavera de 1999 y verano, otoño e invierno de 2000. Primer período de estudio. Estació n general Codigo Longitud (ºW) Latitud (ºS) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 66º 49,9’ 67º 00,0’ 67º 09,8’ 67º 19,9’ 67º 29,9’ 67º 19,8’ 67º 10,1’ 67º 01,2’ 66º 50,2’ 66º 39,9’ 66º 29,9’ 66º 19,8’ 66º 09,8’ 65º 39,9 64º 49,9’ 65º 59,8’ 66º 09,6’ 66º 19,8’ 66º 29,9’ 66 39,8’ 66º 49,9’ 67º 00,0’ 66º 09,9’ 66º 49,9’ 66º 40,0’ 66º 30,3’ 66º 20,3’ 66º 10,2’ 66º 00,2’ 65º 50,0’ 65º 40,1’ 65º 40,0’ 65º 50,0’ 65º 59,8’ 66º 09,8’ 66º 19,9’ 66º 29,8’ 66º 02,0’ 65º 50,2’ 45º 20,0’ 45º 30,0’ 45º 40,1’ 45º 49,8’ 45º 59,9’ 46º 19,9’ 46º 10,2’ 46º 00,4’ 45º 49,7’ 45º 39,9’ 45º 30,0’ 45º 19,9’ 45º 10,0’ 45º 10,4’ 45º 20,1’ 45º 29,9’ 45º 40,0’ 45º 50,0’ 46º 00,1’ 46º 09,9’ 46º 19,9’ 46º 30,1’ 46º 39,9’ 46º 50,0’ 46º 40,0’ 46º 30,1’ 46º 19,8’ 46º 10,0’ 46º 00,2’ 45º 49,9’ 45º 40,0’ 46º 10,1’ 46º 20,5’ 46º 30,0’ 46º 40,0’ 46º 50,2’ 47º 00,0’ 46º 59,9’ 46º 50,0’ Profun PRIMAVE didad RA (m) 1999 68 74 63 37 59 83 86 88 86 86 87 86 69 83 87 90 91 92 92 89 87 83 31 66 80 92 93 95 95 92 89 93 91 89 75 58 21 53 36 526 525 524 523 522 521 520 519 518 517 527 528 529 531 530 502 503 516 515 514 513 512 511 510 509 508 507 506 505 504 501 500 499 498 497 496 495 494 493 VERANO 2000 OTOÑO 2000 68 69 80 84 90 91 92 89 85 79 70 67 64 65 66 71 78 86 88 87 77 72 73 74 75 76 276 275 274 273 272 271 270 269 268 267 277 278 279 265 266 264 263 262 261 243 244 245 246 260 259 258 255 256 257 254 253 252 251 247 248 249 250 INVIERNO 2000 522 553 554 555 556 557 558 559 560 561 562 563 564 565 523 524 525 526 566 567 568 569 570 571 529 528 527 531 530 TIPO SEDIMENTARIO Limo Limo arcilloso Limo arenoso Grava Limo arenoso Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Arena limosa Limo arenoso Limo arcilloso Limo Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Arena limosa Arcilla limosa Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Limo arcilloso Arcilla limosa Limo arcilloso Limo arenoso Limo arenoso Limo arenoso Limo arenoso Limo arenoso Arena limosa Arena gravasa Grava arenosa 157 Tabla 8. Factores o componentes obtenidos del Análisis de Componentes Principales, de las campañas de investigación de primavera de 1999 y verano, otoño e invierno de 2000. PRIMAVERA 1999 Variables Código Grava G Φ -2 Grava G Φ –1,5 Arena muy gruesa AMG Φ -1 Arena muy gruesa AMG Φ -0,5 Arena muy gruesa AMG Φ 0 Arena gruesa AG Φ 0,5 Arena gruesa AG Φ 1 Arena mediana AM Φ 1,5 Arena mediana AM Φ 2 Arena fina AF Φ 2,5 Arena fina AF Φ 3 Arena muy fina AMF Φ 3,5 Arena muy fina AMF Φ 3,9 Limo grueso LG Φ 4 Limo medio LM Φ 5 Limo fino LF Φ 6 Limo muy fino LMF Φ 7 Arcilla gruesa ArG Φ 8 Arcilla mediana ArM Φ 9 Arcilla fina a muy fina ArF MF Φ 10 Carbonatos C Profundidad P Materia orgánica total MOT Nitrógeno total NT Carbono orgánico total COT Relación Carbono:Nitrógeno C:N Concentración de Oxígeno O Temperatura T Salinidad S Densidad D Clorfila a (Sedimentos) Cl a (S) Feopigmentos (Sedimentos) Feop (S) Clorofila a (Agua de fondo) Cl a (AF) Porcentaje de la varianza Porcentaje de la varianza acumulada Valores absolutos > 0,5 VERANO 2000 OTOÑO 2000 INVIERNO 2000 Factor 1 Factor 2 Factor 3 Factor 1 Factor 2 Factor 3 Factor 1 Factor 2 Factor 3 Factor 1 Factor 2 Factor 3 -0,6838 -0,5977 -0,6948 -0,6988 -0,7396 -0,7550 -0,6805 -0,8108 -0,4757 -0,3836 -0,1413 -0,0585 0,3249 0,4029 0,6377 0,5986 0,6284 0,6124 0,6658 -0,7883 0,6367 0,7474 0,5414 0,7574 0,4028 -0,6561 -0,7331 0,6326 0,8427 0,1503 0,5060 -0,3458 36,91 36,91 0,2570 0,1710 0,2595 0,4017 0,3932 0,3992 0,2367 0,3288 0,2726 -0,2258 -0,7414 -0,8107 -0,3836 -0,2672 0,2579 0,4134 0,5150 0,4972 0,4995 0,2941 0,2068 0,4327 0,5688 0,4061 -0,3228 0,0687 0,0130 -0,0477 -0,0322 -0,0753 0,0017 0,2230 13,24 50,16 -0,1304 -0,6408 -0,5003 0,5268 0,3393 0,4491 -0,2950 -0,1370 0,6667 0,1966 0,0058 0,0446 0,1385 0,1013 -0,1319 -0,1866 -0,0762 -0,1173 -0,1620 0,0115 0,2099 0,2136 0,0231 -0,0788 -0,1839 -0,1065 0,2277 0,6387 0,0731 -0,0371 0,0397 -0,0405 9,24 59,60 -0,7202 -0,8659 -0,7443 -0,7214 -0,7871 -0,6431 -0,8294 -0,7791 -0,1402 -0,0674 0,5905 0,5375 0,6043 -0,8092 0,6345 0,8364 0,8345 0,7778 -0,8319 -0,8381 -0,8096 0,8841 0,8331 0,2433 0,5642 -0,8612 51,54 51,54 -0,2895 -0,3974 -0,4067 -0,3778 -0,4248 -0,2994 -0,3655 -0,3410 0,8396 0,8317 -0,1316 -0,3157 -0,3673 -0,3233 -0,2912 -0,4358 -0,3879 -0,4700 -0,2664 0,3061 0,3401 -0,1296 -0,3001 0,0956 -0,1183 -0,1333 14,99 66,53 0,3731 0,0774 -0,2752 -0,2905 -0,2439 0,3501 0,2270 -0,0544 -0,0331 -0,1245 -0,1057 0,1829 0,2813 -0,1196 -0,3407 -0,0007 0,2316 0,1289 -0,0285 0,1761 0,2870 -0,2499 -0,2886 0,6193 0,5934 -0,0466 7,23 73,77 -0,7630 -0,6362 -0,7754 -0,7603 -0,7231 -0,8027 -0,6093 -0,7627 -0,4962 -0,2535 -0,2349 -0,1858 0,2613 0,3738 0,6440 0,6223 0,6547 0,6322 0,6553 -0,8407 0,7115 0,8569 0,8189 0,7135 -0,8263 -0,6976 -0,5987 0,4248 0,7282 0,2665 0,4140 -0,4600 39,92 39,92 0,3568 0,4316 0,5208 0,4118 0,4085 0,4135 0,3957 0,4719 0,0716 -0,3979 -0,6886 -0,7563 -0,2997 -0,2075 0,2549 0,3419 0,4078 0,3692 0,3843 0,3077 0,1981 0,3508 0,3513 0,3930 0,3330 -0,3694 -0,3833 -0,3539 0,1928 0,0912 0,0260 -0,3547 14,60 54,52 -0,0041 -0,1041 0,4781 -0,5442 -0,3821 -0,4686 0,3692 0,1782 -0,6073 -0,3091 0,0269 0,0447 0,0231 0,0241 0,1085 0,0991 0,0302 0,0433 0,0802 0,0181 -0,3512 -0,1166 -0,0423 -0,2027 -0,0906 0,4653 0,3994 -0,1796 -0,4258 0,3379 0,2260 0,2512 7,46 61,98 -0,7557 -0,8934 -0,7526 -0,7210 -0,8074 -0,6888 -0,8531 -0,5294 -0,2248 -0,1333 0,6193 0,5569 0,5074 0,5522 -0,9068 0,6726 0,7732 0,6220 0,7148 -0,0816 0,3203 0,7057 0,8407 0,7430 0,4656 0,5674 0,4221 41,73 41,73 0,3681 0,4146 0,3329 0,3071 0,3480 0,3568 0,4132 0,4359 -0,7437 -0,7292 0,1437 0,1079 0,0799 0,1649 0,3080 0,3647 0,3082 0,4233 0,3818 -0,2511 0,1751 0,0383 0,1200 0,1566 0,4538 0,4668 0,3503 13,34 55,07 -0,0058 -0,0379 -0,0422 -0,0245 -0,0204 0,0544 -0,0084 0,2243 0,2754 0,2881 -0,2876 -0,5899 -0,6140 -0,6573 0,0314 0,1049 0,1084 -0,1581 -0,0929 -0,0528 0,7635 0,0112 0,3400 0,5378 0,1230 0,1313 0,6899 11,16 66,23 158 Tabla 9. Estadística descriptiva de las variables sedimentológicas y del agua de fondo de cada sector definido. PRIMAVERA 1999 Variables Valores Temperatura (ºC) Salinidad (ups) Densidad (kg/m3) Concentración de oxígeno (ml O2/l) Agua de fondo Clorifila a (mg/m3) Agua de superficie Clorifila a (mg/m3) Capa de mezcla Clorifila a (mg/m3) Agua de fondo Materia orgánica total (%) Sedimentos Carbono orgánico total (%) Sedimentos Nitrógeno total (%) Sedimentos mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. S1 S2 8,04 9,09 8,72 0,36 33,570 33,640 33,611 0,02 25,990 26,180 26,075 0,06 4,83 5,68 5,28 0,24 0,13 2,21 0,57 0,48 0,31 1,31 0,77 0,34 0,10 1,66 0,38 0,42 8,42 13,33 9,82 1,10 1,38 3,18 2,17 0,46 0,12 0,27 0,21 0,04 9,55 11,43 10,52 0,68 33,260 33,690 33,504 0,17 25,470 25,865 25,692 0,14 5,67 6,61 6,24 0,30 0,40 1,21 0,87 0,37 0,71 1,19 0,97 0,24 0,35 1,01 0,75 0,39 0,96 7,96 3,73 2,47 0,32 1,23 0,70 0,34 0,03 0,32 0,13 0,09 S3 8,38 9,27 8,89 0,29 33,480 33,660 33,611 0,04 25,930 26,150 26,049 0,06 4,65 6,35 5,60 0,58 0,10 0,79 0,42 0,18 0,19 0,86 0,51 0,22 0,06 0,63 0,26 0,18 0,59 8,72 5,98 2,23 0,54 1,77 1,22 0,42 0,04 0,18 0,10 0,04 VERANO 2000 OTOÑO 2000 S1 S2 S3 S1 S2 8,31 9,33 8,80 0,34 33,580 33,640 33,610 0,01 25,974 26,129 26,062 0,06 2,57 4,62 4,01 0,56 0,11 0,84 0,30 0,18 0,26 3,15 0,99 0,68 0,18 0,88 0,40 0,21 5,38 10,48 8,92 1,24 2,12 3,98 2,74 0,50 0,10 0,18 0,14 0,03 13,76 15,37 14,68 0,83 33,300 33,440 33,353 0,08 24,681 24,937 24,770 0,15 5,75 6,43 6,06 0,34 1,27 2,37 1,64 0,63 1,30 2,26 1,78 0,48 1,33 2,16 1,75 0,59 1,04 1,12 1,08 0,06 0,42 0,49 0,46 0,05 0,01 0,01 0,01 0,00 9,02 13,78 11,23 1,78 33,420 33,620 33,518 0,07 25,014 26,023 25,569 0,38 4,12 5,63 4,85 0,53 0,20 1,30 0,66 0,38 0,40 1,35 0,79 0,37 0,23 0,70 0,40 0,17 4,07 4,83 4,51 0,27 1,10 1,46 1,17 0,14 0,04 0,08 0,07 0,01 8,94 11,40 9,36 0,54 33,470 33,650 33,542 0,05 25,550 26,083 25,921 0,11 1,82 5,36 2,84 0,71 0,36 2,17 1,08 1,09 0,36 2,34 0,92 0,67 0,07 0,99 0,26 0,22 6,30 12,73 9,66 1,45 1,31 2,86 2,10 0,46 0,15 0,32 0,21 0,04 10,90 11,60 11,23 0,53 33,130 33,240 33,185 0,08 25,297 25,300 25,299 0,002 5,88 6,03 5,96 0,10 0,49 0,77 0,63 0,20 0,42 1,21 0,81 0,39 0,36 1,65 1,01 0,91 1,17 1,38 1,28 0,15 0,81 0,84 0,83 0,02 0,02 0,02 0,02 0,00 INVIERNO 2000 S3 9,24 12,35 11,28 1,05 33,180 33,750 33,543 0,14 25,328 29,926 25,592 0,18 3,20 6,02 5,06 1,09 0,56 3,38 1,12 0,75 0,51 3,05 1,20 0,84 0,10 2,11 0,61 0,52 1,79 9,68 5,26 2,21 0,76 2,24 1,31 0,41 0,04 0,17 0,10 0,04 S1 S2 7,05 8,02 7,68 0,29 33,570 33,800 33,688 0,06 26,205 26,369 26,290 0,04 6,34 6,70 6,56 0,08 0,43 0,80 0,62 0,11 0,80 1,32 0,98 0,16 0,39 1,39 1,03 0,23 5,99 14,24 11,69 2,00 1,33 3,74 2,35 0,66 0,11 0,77 0,40 0,15 5,66 7,63 6,88 0,88 33,070 33,570 33,350 0,25 26,035 26,202 26,133 0,09 6,42 6,79 6,61 0,16 0,44 0,60 0,51 0,07 0,69 1,02 0,86 0,14 0,57 0,68 0,60 0,05 1,58 13,06 6,57 5,34 0,42 2,53 1,18 0,97 0,05 0,26 0,14 0,09 S3 6,24 8,00 7,16 0,91 33,180 33,560 33,398 0,18 26,054 26,206 26,130 0,06 6,54 6,82 6,61 0,06 0,49 0,94 0,63 0,21 0,62 0,93 0,74 0,13 0,50 1,06 0,66 0,26 2,10 10,71 6,70 3,63 0,43 2,09 1,11 0,79 0,05 0,21 0,12 0,08 159 Tabla 9 (Continuación). Estadística descriptiva de las variables sedimentológicas y del agua de fondo de cada sector definido. PRIMAVERA 1999 Variables Valores Carbono orgánico total (%) Sedimentos Nitrógeno total (%) Sedimentos Relación Carbono/ nitrógeno Sedimentos Clorofila a (μg/g) Sedimentos Feopigmentos (μg/g) Sedimentos Estratificación mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. S1 S2 1,38 3,18 2,17 0,46 0,12 0,27 0,21 0,04 5,50 20,24 10,61 3,13 0,01 0,89 0,29 0,30 6,83 30,54 15,85 8,28 si 0,32 1,23 0,70 0,34 0,03 0,32 0,13 0,09 0,13 13,58 7,29 4,72 0,04 2,41 0,53 0,84 0,24 9,56 3,64 3,61 no S3 0,54 1,77 1,22 0,42 0,04 0,18 0,10 0,04 7,69 20,29 12,25 3,27 0,03 0,81 0,25 0,21 2,91 34,06 10,80 8,37 si/no VERANO 2000 OTOÑO 2000 S1 S2 S3 S1 S2 2,12 3,98 2,74 0,50 0,10 0,18 0,14 0,03 11,45 29,59 20,19 3,96 0,09 2,75 0,56 0,71 7,47 35,28 15,47 8,41 si 0,42 0,49 0,46 0,05 0,01 0,01 0,01 0,00 53,15 69,48 61,32 11,55 0,05 0,33 0,19 0,20 1,15 3,42 2,29 1,61 no 1,10 1,46 1,17 0,14 0,04 0,08 0,07 0,01 17,34 28,98 17,17 4,77 0,13 0,68 0,32 0,22 5,81 8,55 9,15 1,19 yes/no 1,31 2,86 2,10 0,46 0,15 0,32 0,21 0,04 6,22 12,75 9,96 1,99 0,04 2,96 0,68 0,87 1,28 22,20 9,24 6,12 si 0,81 0,84 0,83 0,02 0,02 0,02 0,02 0,00 40,85 53,36 47,11 8,85 0,01 0,10 0,06 0,06 0,06 0,46 0,26 0,28 no INVIERNO 2000 S3 0,76 2,24 1,31 0,41 0,04 0,17 0,10 0,04 7,19 23,19 13,80 4,48 0,01 1,11 0,35 0,35 0,34 18,48 6,60 5,77 si/no S1 S2 1,33 3,74 2,35 0,66 0,11 0,77 0,40 0,15 2,76 18,09 7,13 3,95 0,51 5,02 1,78 1,30 10,57 95,78 30,28 20,01 no 0,42 2,53 1,18 0,97 0,05 0,26 0,14 0,09 6,03 9,72 8,12 1,56 0,15 1,16 0,70 0,44 0,52 23,04 8,17 10,10 no S3 0,43 2,09 1,11 0,79 0,05 0,21 0,12 0,08 8,52 10,18 9,16 0,75 0,87 1,29 1,13 0,20 2,97 23,00 14,31 8,32 no 160 Tabla 10. Poliquetos, moluscos, crustáceos y equinodermos identificados en la campaña de investigación OB-03/00 (otoño de 2000). Número de individuos, porcentaje, densidad, abundancia relativa (AR), frecuencia de aparición (FA) e Índice de Importancia Relativa (IR). Phyla Clase Especies Annelida Polychaeta Leanira quatrefagesi Asychis amphiglypta Eunice magellanica Lumbrinereis sp Cistenides ehlersi Leanira quatrefagesi Mollusca Gastropoda Calliostoma modestulum Photinula blackei Falsilunatia soluta Anisodoris sp Semirossia tenera Loligo gahi Octopus tehuelchus Nucula puelcha Nuculana sulculata Malletia cumingii Mytilus platensis Limatula pigmaea Zygoclamys patagonicus Pitar rostratus Kennerleya patagonica Cephalopoda Bivalvia Arthropoda Crustacea Pterygosquilla armata armata Cirolana sp Serolis schytei Sphaeroma sp Antarcturus sp Gammarus sp Peisos petrunkevitchi Alpheus puapeba Austropandalus grayi Pontocaris boschii Callianassa brachyophthalma Lithodes santolla Munida subrugosa Eurypodius latreillei Leurocyclus tuberculosus Peltarion spinosulum Echinodermata Asteroidea Ophiuroidea Echinoidea Diplasterias brandti Ophiura sp Austrocidaris canaliculata Arbacia dufresnii Pseudechinus magellanicus Trypilaster phylippii Hemiodema spectabilis Holothuroidea Nº individuos 90 418 1 24 580 90 1,113 39 19 7 3 33 1 3 2,154 11,273 35 23 3 5 12 819 14,429 781 11 13 1 6 1 207 2 992 2 300 9 6,761 2 9 54 9,151 136 4,076 2 6 11,970 14 1 16,205 Densidad % Indiv/0,00025mn2 0,220 1,022 0,003 0,058 1,418 0,220 2,72 0,095 0,081 0,017 0,007 0,081 0,002 0,007 5,267 27,560 0,086 0,056 0,007 0,012 0,029 0,095 35,31 1,910 0,027 0,032 0,002 0,015 0,002 0,506 0,005 2,426 0,005 0,734 0,022 16,531 0,005 0,022 0,132 22,37 0,333 9,966 0,005 0,015 29,268 0,035 0,002 39,62 257,26 1.630,73 20 79,10 2.039,10 257,26 4.026,19 138,81 87,28 8,92 3 98,73 1 6,97 3.678,69 42.054,30 63,18 460 36,76 28,33 16,85 2.794,41 49.477,28 1.275,58 32,63 117,51 20,00 89,03 3,64 244,34 32,26 4.936,15 4,19 871,91 45,77 12.584,36 2,00 81,53 218,13 20.559,02 1.035,76 23.608,7 40,00 62,60 42.876,3 18,86 12,26 67.654,47 AR FA % % 0,18 1,15 0,01 0,06 1,44 0,18 2,84 0,1 0,06 0,01 0 0,07 0 0 2,6 29,67 0,04 0,32 0,03 0,02 0,01 1,97 34,91 0,90 0,02 0,08 0,01 0,06 0,00 0,17 0,02 3,48 0,00 0,62 0,03 8,88 0,00 0,06 0,15 14,51 0,73 16,66 0,03 0,04 30,25 0,01 0,01 47,74 50,00 44,44 2,78 13,89 52,78 50,00 75,00 5,56 8,33 2,78 2,78 38,89 2,78 8,33 44,44 38,89 25 2,78 2,78 8,33 19,44 36,11 77,78 75 11,11 5,56 2,78 5,56 2,78 30,56 5,56 80,56 5,56 69,44 16,67 86,11 5,56 5,56 52,78 97,22 22,22 13,89 2,78 5,56 66,67 16,67 2,78 86,11 IR 0,091 0,511 0,000 0,008 0,759 0,091 2,13 0,005 0,005 0 0 0,027 0 0 1,154 11,54 0,011 0,009 0,001 0,002 0,002 0,712 27,15 0,675 0,003 0,005 0,000 0,003 0,000 0,053 0,001 2,806 0,000 0,427 0,005 7,647 0,000 0,003 0,081 14,10 0,162 2,314 0,001 0,002 20,17 0,002 0 41,11 161 Tabla 11. Densidad, abundancia relativa (AR), número de especies (S), Índice de Diversidad (H’) y Uniformidad (J’), de los grupos taxonómicos considerados (poliquetos, moluscos, crustáceos y equinodermos) en su conjunto, de la campaña de investigación OB-03/00 (otoño de 2000), por estación de muestreo. Estaciones Densidad generales (Indiv/0,00025mn2) 243 1.740 244 114 245 1.536 246 170 247 362 248 4.569 249 3.348 250 1.526 251 2.581 252 36.444 253 508 254 1.717 255 5.033 256 418 257 1.464 258 4.842 259 10.321 260 1.471 261 1.096 262 2.802 263 2.407 264 4.391 265 2.003 266 2.513 267 5.284 268 922 269 580 270 2.439 271 3.983 272 6.439 273 3.081 275 4.277 276 566 277 262 278 501 279 20.007 AR (%) 1,44 0,09 1,27 0,14 0,30 3,77 2,76 1,26 2,13 30,08 0,42 1,42 4,15 0,35 1,21 4,00 8,52 1,21 0,90 2,31 1,99 3,62 1,65 2,07 4,36 0,76 0,48 2,01 3,29 5,31 2,54 3,53 0,47 0,22 0,41 16,51 S 15 17 10 5 8 12 11 16 7 10 9 8 6 7 15 9 8 13 13 8 9 7 9 10 6 9 10 9 16 11 7 6 8 9 12 6 H' 1,82 1,81 0,26 1,38 1,22 0,78 0,29 1,39 1,18 1,03 1,00 0,48 0,56 0,45 1,28 0,33 0,25 1,23 1,47 0,92 0,84 0,39 0,45 1,04 0,56 0,76 1,15 0,63 1,17 1,71 0,88 0,76 1,41 1,52 2,02 0,04 J’ 0,67 0,64 0,11 0,86 0,59 0,31 0,12 0,50 0,61 0,45 0,45 0,23 0,31 0,23 0,47 0,15 0,12 0,48 0,57 0,44 0,38 0,20 0,21 0,45 0,31 0,35 0,50 0,29 0,42 0,71 0,45 0,43 0,68 0,69 0,81 0,02 162 Tabla 12. Índice de Importancia Relativa de los grupos taxonómicos considerados, en función de los tipos sedimentarios definidos para el Golfo San Jorge. Grava Grava arenosa Arena gravosa Arena limosa Limo arenoso Limo Limo arcilloso Arcilla limosa POLIQUETOS 3,00 1,00 - MOLUSCOS CRUSTACEOS EQUINODERMOS 7,00 3,00 13,00 3,00 26,00 1,00 10,00 6,00 31,00 2,00 25,00 3,00 16,00 27,00 16,00 27,00 13,00 - Tabla 13. Índice de Importancia Relativa de las especies “constantes”, “muy comunes” y “comunes”, en función de los tipos sedimentarios definidos para el golfo. Grava Leanira quatrefagesi Asychis amphiglypta Cistenides ehlersi Semirossia tenera Nucula puelcha Nuculana sulculata Kennerleya patagonica Pterigosquilla armata Peisos petrunkevitchi Austropandalus grayi Callianassa brachyophthalma Munida subrugosa Peltarion spinosulum Pseudechinus magellanicus 0,1 0,1 0,1 0,2 4,6 7,0 Grava Arena arenosa gravosa 1,5 0,2 0,9 6,2 0,1 0,2 0,1 0,1 - Arena limosa 0,1 4,7 2,1 - Limo arenoso 0,1 1,2 1,6 2,3 18,9 2,5 0,2 0,1 0,2 0,5 2,5 Limo 0,2 0,2 1,7 3,3 - Limo Arcilla arcilloso limosa 0,1 0,3 1,0 0,1 0,5 1,4 10,1 0,1 1,1 0,1 6,1 0,1 0,7 8,8 3,6 0,2 61,2 - Tabla 14. Análisis de Correspondencia. Autovalores, inercia e inercia acumulada para las tres primeras dimensiones del análisis aplicado a los grupos taxonómicos considerados. Inercia acumulada Dimensión 1 Dimensión 2 Dimensión 3 Autovalor Inercia % % 0,920 0,770 0,496 32,206 18,571 11,963 32,206 50,777 62,740 163 Tabla 15. Valores de densidad, abundancia relativa (AR), número de especies (S), diversidad (H’) y Uniformidad (J’) de los grupos taxonómicos considerados, en los tres sectores definidos para el Golfo San Jorge. Densidad Indiv/0,00025mn2 AR (%) S H' J' valor mínimo máximo promedio mínimo máximo promedio mínimo máximo promedio mínimo máximo promedio mínimo máximo promedio SECTOR 1 170 10.321 2.675 0,14 8,52 2,21 5 12 8 0,25 2,02 0,78 0,10 0,90 0,38 SECTOR 2 114 36.444 6.153 0,09 30,08 5,08 6 17 11 0,04 1,81 1,14 0,10 0,70 0,50 SECTOR 3 1.740 3.983 2.745 1,44 3,29 2,27 10 16 14 1,04 1,82 1,34 0,40 0,70 0,51 164 Tabla 16. Valores de densidad, abundancia relativa (AR), frecuencia de aparición (FA) e Índice de Importancia Relativa (IR) de las especies por sector. SECTOR 1 SECTOR 2 DENSIDAD AR (%) FA (%) IR Indiv/0,00025mn2 Indiv/0,00025mn2 DENSIDAD AR (%) SECTOR 3 FA (%) IR DENSIDAD AR (%) FA (%) IR Indiv/0,00025mn2 0,09 POLIQUETOS 1.355,19 2,53 80,00 2,03 2.651,00 3,31 76,92 2,55 20,00 0,27 33,33 Leanira quatrefagesi Asychis amphiglypta Eunice magellanica Lumbrinereis sp Cistenides ehlersi 147,14 0,28 50,00 0,14 110,13 0,14 61,54 0,08 - - - - 365,57 0,68 45,00 0,31 1.265,16 1,58 53,85 0,85 - - - - 829,52 1,55 65,00 1,01 1.209,58 1,51 46,15 0,70 - - - - MOLUSCOS 224,94 0,42 60,00 0,25 48.447,31 60,56 100,00 60,56 805,02 10,85 100,00 10,85 Calliostoma modestulum Photinula blackei Falsilunatia soluta Anisodoris sp Semirossia tenera Loligo gahi Octopus tehuelchus Nucula puelcha Nuculana sulculata Malletia cumingii Mytilus platensis Limatula pigmaea Zygoclamys patagonicus Pitar rostratus Kennerleya patagonica - - - - - - - - 138,81 1,87 66,67 - - - - - - - - 87,28 1,18 100,00 - - - - 8,93 0,01 7,69 0,00 - - - - 4,79 0,01 10,00 0,00 - - 100,38 0,19 15,00 0,03 3.578,31 4,47 34,50 0,06 5,00 0,00 42.019,79 52,52 14,38 0,03 10,00 0,00 36,55 - - - - - - - - - 16,85 0,02 53,85 0,01 - - - - 25,84 0,05 10,00 0,00 2.768,56 3,46 92,31 3,19 - - - - CRUSTACEOS 9.485,03 17,73 100,00 17,73 4.964,28 6,21 100,00 6,21 6.109,72 82,35 100,00 82,35 Pterygosquilla armata Cirolana sp Serolis schytei Sphaeroma sp Antarcturus sp Gammarus sp Peisos petrunkevitchi Alpheus puapeba 372,81 0,70 65,00 0,45 882,78 1,10 100,00 1,10 20 0,27 33,33 0,09 9,07 0,02 5,00 0,00 2,55 0,00 7,69 0,00 21,01 0,28 66,67 0,19 - - - - - - - - 117,51 1,58 66,67 1,06 - - - - - - - - 20,00 0,27 33,33 0,09 - - - - - - - - 89,03 1,20 66,67 0,80 3,64 0,01 5,00 0,00 - - - - - - - - 190,94 0,36 30,00 0,11 53,40 0,07 115,38 0,08 - - - - - - - - - - - - 32,26 0,43 66,67 0,29 - - - - - - - - 20,00 0,27 33,33 12,97 0,02 10,00 0,00 66,13 0,08 23,08 0,02 - - - 0,09 - 1,25 1,18 3 0,01 5,00 0,00 - - - - - - - 40,23 0,08 35,00 0,03 15,31 0,02 30,77 0,01 43,20 0,58 100,00 - - - - 1,00 0,00 0,00 0,00 - - - - - 2,19 0,03 33,33 100,00 4,47 - - - - 100,00 52,52 - - - - 0,05 46,15 0,02 12,26 0,17 33,33 0,06 - - - 460,00 6,20 33,33 2,07 0,58 0,01 - - - - - - - - 36,77 0,50 33,33 0,17 1,82 0,00 5,00 0,00 2,00 0,00 7,69 0,00 24,51 0,33 33,33 0,11 165 Tabla 16 (Continuación) . Valores de densidad, abundancia relativa (AR), frecuencia de aparición (FA) e Índice de Importancia Relativa (IR) de las especies por sector. SECTOR 1 Austropandalus grayi Pontocaris boschii Callianassa brachyophthalma Lithodes santolla Munida subrugosa Eurypodius latreillei Leurocyclus tuberculosus Peltarion spinosulum EQUINODERMOS Diplasterias brandti Ophiura sp Austrocidaris canaliculata Arbacia dufresnii Pseudechinus magellanicus Trypilaster phylippii Hemiodema spectabilis SECTOR 2 SECTOR 3 AR (%) FA (%) IR 213,26 0,27 76,92 2,00 0,00- 7,69 0,81 153,37 0,19 15,00 - 3,68 13,82 95,00 13,13 0,00 0,00 0,00 0,15 10,00 0,02 DENSIDAD AR (%) FA (%) IR Indiv/0,00025mn2 582,40 1,09 85,00 0,93 - - - - 718,54 1,34 60,00 5,32 0,01 7.392,05 1,00 81,53 DENSIDAD AR (%) FA (%) IR Indiv/0,00025mn2 0,21 4.140,48 55,81 100,00 55,81 0,00 2,19 0,03 33,33 0,01 23,08 0,04 - - - - 0,00 15,38 0,00 36,77 0,50 33,33 0,17 3.598,62 4,50 76,92 3,46 1.593,70 21,48 66,67 14,32 1,00 0,00 7,69 0,00 - - - - - - - - - - - - DENSIDAD Indiv/0,00025mn2 127,74 0,24 55,00 0,13 53,62 0,07 53,85 0,04 36,77 0,50 33,33 0,17 42.427,51 79,31 95,00 75,35 23.925,18 29,91 69,23 20,70 1.289,53 17,38 100,00 17,38 30,60 0,06 5,00 0,00 5,94 0,01 23,08 0,00 999,22 13,47 100,00 13,47 285,97 0,53 10,00 0,05 23.242,73 29,05 15,38 4,47 80,00 1,08 33,33 0,36 - - - - - - - - 40,00 0,54 33,33 0,18 1,31 0,00 5,00 0,00 - - - - 61,28 0,83 33,33 0,28 42.101,79 78,71 90,00 70,83 665,49 0,83 30,77 0,26 109,03 1,47 66,67 0,98 7,83 0,01 10,00 0,00 11,02 0,01 30,77 0,00 - - - - - - - - - - - - 12,26 0,17 33,33 0,06 166 Tabla 17. Estadística descriptiva de las variables del agua de fondo, correspondientes al segundo período de estudio analizado. Variables Temperatura (ºC) Agua de fondo Valores OTOÑO 2001 “O” mínimo máximo Promedio Desv. estand. INVIERNO 2001 “I” PRIMAVERA 2001 “P” VERANO 2002 “V” TEST DE DUNN 8,07 11,69 9,76 1,44 5,83 8,18 7,36 0,75 7,21 11,41 8,59 1,07 7,96 15,25 10,61 2,48 O-I ** O-P ns O-V ns I-P * I-V ** P-V * Salinidad (ups) Agua de fondo mínimo máximo Promedio Desv. estand 33,293 33,826 33,498 0,15 33,057 33,604 33,437 0,14 33,220 33,562 33,457 0,09 33,303 33,723 33,498 0,11 O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns Densidad (kg/m3) Agua de fondo mínimo máximo Promedio Desv. estand 25,810 25,394 26,185 0,31 26,134 25,990 26,297 0,09 25,968 25,323 26,238 0,23 24,708 25,650 26,214 0,49 O-I ** O-P ns O-V ns I-P ns I-V ** P-V ns 2,69 6,04 4,32 1,45 6,54 7,33 6,73 0,26 5,36 6,66 5,68 0,27 3,43 5,89 4,36 0,71 O-I ** O-P ns O-V ns I-P ** I-V ** P-V * 0,31 2,25 0,89 0,53 0,41 2,33 0,93 0,56 0,18 8,72 1,64 2,00 0,13 3,29 1,00 0,75 O-I ns O-P * O-V ns I-P * I-V ns P-V * 0,06 2,33 0,86 0,64 0,92 7,65 2,19 1,73 0,36 11,66 3,33 3,01 0,12 1,03 0,37 0,25 O-I * O-P ** O-V ns I-P ns I-V ** P-V ** 0,03 1,26 0,28 0,36 0,40 4,40 1,63 0,98 0,03 2,64 0,58 0,75 0,03 2,92 0,36 0,64 O-I ** O-P ns O-V ns I-P ** I-V ** P-V ns Concentración mínimo de Oxígeno máximo (ml O2/l) Promedio Agua de Desv. estand fondo Clorofila a (mg/m3) Agua de superficie mínimo máximo Promedio Desv. estand Clorofila a (mg/m3) Capa de mezcla mínimo máximo Promedio Desv. estand Clorofila a (mg/m3) Agua de fondo mínimo máximo Promedio Desv. estand *0,01< P < 0,05 - ** P < 0,01 – ns P > 0,05 167 Tabla 18. Estadística descriptiva de las variables sedimentológicas, correspondientes al segundo período de estudio analizado. Variables Materia orgánica total (%) Carbono orgánico total (%) Nitrógeno total (%) Relación Carbono: Nitrógeno Valores mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. mínimo máximo Promedio Desv. estand. OTOÑO 2001 “O” INVIERNO 2001 “I” PRIMAVERA 2001 “P” VERANO 2002 “V” TEST DE DUNN 2,94 9,24 5,83 1,93 1,66 9,03 5,13 2,25 1,96 10,24 5,68 2,04 1,91 9,59 5,28 1,78 O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns 0,79 4,64 1,59 0,94 0,09 2,07 1,11 0,56 0,28 2,16 1,18 0,50 0,29 2,36 1,35 0,59 O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns 0,10 0,41 0,21 0,10 0,06 0,36 0,17 0,09 0,05 0,51 0,22 0,12 0,11 0,51 0,21 0,09 O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns 3,60 20,13 8,09 3,95 1,42 11,10 6,61 2,35 2,06 11,98 6,16 2,54 1,20 11,88 7,18 2,98 O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns 0,052 0,072 0,062 0,005 0,004 0,076 0,056 0,018 0,036 0,058 0,047 0,007 0,016 0,071 0,040 0,011 O-I ns O-P ** O-V ** I-P ** I-V ** P-V ns Fósforo total (%) mínimo máximo Promedio Desv. estand. Clorofila a (μg/g) mínimo máximo Promedio Desv. estand. 0,25 1,79 1,05 0,43 0,09 8,65 1,54 1,80 0,50 8,27 2,33 1,83 0,49 7,25 2,29 1,79 O-I * O-P ns O-V ns I-P * I-V * P-V ns Feopigmentos (μg/g) mínimo máximo Promedio Desv. estand. 7,09 40,99 24,22 10,65 0,08 33,59 20,50 9,02 11,92 60,53 28,08 13,40 1,91 34,57 18,32 9,78 O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns *0,01< P < 0,05 - ** P < 0,01 – ns P > 0,05 168 Tabla 19. Factores o componentes obtenidos del Análisis de Componentes Principales, de las campañas de investigación de otoño, invierno y primavera de 2001 y verano de 2002. OTOÑO 2001 Variables código Profundidad P Temperatura T Salinidad S Densidad D Concentración de Oxígeno O Materia orgánica total MOT Carbono orgánico total COT Nitrógeno total NT Relación Carbono:Nitrógeno C:N Fósforo total FT Clorofila a (Sedimentos) Cl a (S) Feopigmentos (Sedimentos) Feop (S) Clorofila a (Agua de fondo) Cl a (AF) Porcentaje de la varianza Porcentaje de la varianza acumulada Valores absolutos > 0,5 INVIERNO 2001 PRIMAVERA 2001 VERANO 2002 Factor 1 Factor 2 Factor 3 Factor 1 Factor 2 Factor 3 Factor 1 Factor 2 Factor 3 Factor 1 Factor 2 Factor 3 0,783 -0,953 0,582 0,904 -0,948 0,357 -0,139 0,023 -0,238 -0,077 0,368 0,611 -0,847 38,82 38,82 -0,022 0,101 -0,456 -0,078 0,092 0,757 0,781 0,777 0,123 0,463 0,653 0,638 0,245 23,92 62,73 -0,139 0,179 -0,100 -0,060 0,196 -0,338 -0,434 0,266 -0,839 0,537 0,337 0,044 -0,379 13,30 76,03 0,886 0,674 0,811 0,243 -0,859 0,814 0,872 0,662 0,599 -0,218 -0,456 0,703 -0,695 47,28 47,28 -0,346 -0,608 0,040 0,791 0,405 0,421 0,362 0,487 -0,293 -0,157 0,536 0,523 0,178 19,46 66,74 0,040 0,261 0,522 0,361 -0,195 -0,280 -0,167 -0,362 0,387 -0,013 0,454 0,128 0,566 11,09 77,82 0,822 -0,849 0,918 0,917 -0,132 0,780 0,770 0,652 0,002 0,195 -0,499 0,586 -0,778 45,85 45,85 0,170 -0,390 0,131 0,320 0,581 -0,335 -0,464 -0,437 0,096 -0,409 -0,624 -0,715 -0,364 18,20 64,05 0,176 0,218 0,089 -0,118 0,349 -0,200 -0,296 0,539 -0,909 0,610 -0,137 -0,181 -0,084 14,60 78,65 0,828 -0,901 0,383 0,904 -0,566 0,773 0,485 0,355 0,107 0,276 0,061 0,547 -0,675 35,12 35,12 -0,082 0,195 -0,122 -0,193 0,523 0,244 -0,128 0,821 -0,814 -0,062 0,192 0,546 -0,219 16,70 51,82 0,152 -0,083 -0,519 0,029 -0,457 -0,174 -0,735 -0,345 -0,491 0,257 0,128 -0,170 -0,577 14,49 66,31 169 Tabla 20. Estadística descriptiva de las variables físico-químicas del agua (AS=agua de superficie, CM=capa de mezcla y AF=agua de fondo) en la totalidad del área (AT) y en cada sector definido (S), en otoño, invierno y primavera de 2001 y en verano de 2002. Valores T (ºC) AF Mínimo Máximo Promedio S (ups) AF Mínimo Máximo Promedio D (kg/m3) AF Mínimo Máximo Promedio O (ml/l) AF Mínimo Máximo Promedio Cl a (mg/m3) AS Mínimo Máximo Promedio Cl a (mg/m3) CM Mínimo Máximo Promedio Cl a (mg/m3) AF Mínimo Máximo Promedio Desv.estand Desv.estand Desv.estand Desv.estand Desv.estand Desv.estand Desv.estand AT OTOÑO 2001 (O) S2 S1 S3 AT INVIERNO 2001 (I) S1 S2 S3 AT PRIMAVERA 2001 (P) S1 S2 S3 AT VERANO 2002 (V) S1 S2 S3 8,07 11,69 9,76 1,44 8,07 10,90 9,09 1,09 11,07 11,69 11,38 0,44 8,19 11,65 9,88 1,67 5,83 8,18 7,36 0,75 6,52 7,79 7,29 0,42 5,83 6,16 6,17 0,35 6,38 8,18 7,82 0,57 7,21 11,41 8,59 1,07 7,76 9,15 8,33 0,72 8,69 11,41 10,22 1,39 7,21 10,01 8,30 0,76 7,96 15,25 10,61 2,48 7,96 8,91 8,38 0,40 12,07 15,21 14,13 1,71 8,00 15,21 10,37 2,15 33,293 33,826 33,498 0,15 33,293 33,627 33,484 0,14 33,369 33,420 33,394 0,04 33,344 33,826 33,573 0,16 33,057 33,604 33,437 0,14 33,472 33,604 33,515 0,10 33,057 33,383 33,236 0,16 33,226 33,529 33,442 0,09 33,220 33,562 33,457 0,09 33,421 33,562 33,510 0,08 33,220 33,416 33,288 0,11 33,428 33,560 33,483 0,04 33,303 33,723 33,498 0,11 33,544 33,723 33,589 0,08 33,390 33,499 33,462 0,06 33,303 33,651 33,477 0,11 25,810 25,394 26,185 0,31 25,511 26,185 25,913 0,28 25,394 25,966 25,680 0,40 25,439 26,130 25,773 0,35 25,990 26,134 26,297 0,09 26,146 26,297 26,209 0,05 26,039 26,208 26,138 0,09 25,990 26,163 26,075 0,06 25,968 25,323 26,238 0,23 25,859 26,181 26,053 0,17 25,323 25,973 25,573 0,31 25,775 26,238 26,034 0,13 25,650 24,708 26,214 0,49 25,992 26,214 26,116 0,09 24,708 25,409 24,963 0,39 24,879 26,313 25,689 0,41 2,69 6,04 4,32 1,45 2,69 5,59 3,60 1,24 5,68 6,03 5,86 0,25 3,25 5,96 4,50 1,45 6,54 7,33 6,73 0,26 6,54 7,02 6,66 0,17 7,12 7,33 7,24 0,11 6,54 6,80 6,66 0,08 5,36 6,66 5,68 0,27 5,37 5,61 5,47 0,12 5,60 5,81 5,70 0,11 5,36 6,66 5,72 0,30 3,43 5,89 4,36 0,71 3,67 5,63 4,43 0,86 4,50 5,89 5,35 0,75 3,43 5,04 4,09 0,46 0,31 2,25 0,89 0,53 0,31 1,80 0,73 0,49 0,74 1,20 0,97 0,33 0,42 2,25 1,08 0,68 0,41 2,33 0,93 0,56 0,47 1,74 1,12 0,59 0,56 2,33 1,40 0,89 0,41 0,85 0,62 0,19 0,18 8,72 1,64 2,00 0,80 8,72 4,08 4,13 0,31 4,12 1,94 0,97 0,18 3,25 1,06 0,92 0,13 3,29 1,00 0,75 0,46 1,11 0,79 0,28 0,13 2,57 1,17 1,26 0,52 3,29 1,06 0,78 0,06 2,33 0,86 0,64 0,06 1,95 0,69 0,68 - 0,32 2,33 0,97 0,73 0,92 7,65 2,19 1,73 0,98 7,65 2,60 2,47 - 0,92 3,23 1,87 0,89 0,36 11,66 3,33 3,01 0,84 11,66 4,72 6,02 - 0,36 6,65 3,04 2,24 0,12 1,03 0,37 0,25 0,18 0,55 0,35 0,16 - 0,14 1,03 0,41 0,27 0,03 1,26 0,28 0,36 0,03 0,20 0,09 0,07 0,25 0,93 0,59 0,48 0,04 0,61 0,28 0,25 0,40 4,40 1,63 0,98 0,40 1,35 1,02 0,51 2,00 4,40 2,97 1,26 0,88 2,87 1,65 0,76 0,03 2,64 0,58 0,75 0,10 1,91 0,73 1,02 0,09 2,64 1,52 1,30 0,08 1,48 0,35 0,37 0,03 2,92 0,36 0,64 0,05 0,19 0,10 0,06 0,09 2,92 1,22 1,49 0,09 0,64 0,26 0,22 *0,01< P < 0,05 - ** P < 0,01 – ns P > 0,05 170 Test de Dunn O-I ** O-P ns O-V ns I-P ** I-V ** P-V * O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns O-I ** O-P ns O-V ns I-P ns I-V ** P-V ns O-I ** O-P ns O-V ns I-P ** I-V ** P-V * O-I ns O-P * O-V ns I-P * I-V ns P-V * O-I * O-P ** O-V ns I-P ns I-V ** P-V ** O-I ** O-P ns O-V ns I-P ** I-V ** P-V ns Tabla 21. Estadística descriptiva de las variables químicas de los sedimentos en la totalidad del área (AT) y en cada sector definido (S), en otoño, invierno y primavera de 2001 y en verano de 2002. MOT (%) Valores AT OTOÑO 2001 (O) S1 S2 Mínimo Máximo Promedio 2,94 9,24 5,83 1,93 5,16 9,24 7,08 1,45 0,79 4,64 1,59 0,94 Desv.estand COT (%) Mínimo Máximo Promedio Desv.estand NT (%) Mínimo Máximo Promedio Desv.estand C:N Mínimo Máximo Promedio Desv.estand FT (%) Mínimo Máximo Promedio Cl a (S) (μg/g) Mínimo Máximo Promedio Feop (S) (μg/g) Mínimo Máximo Promedio Desv.estand Desv.estand Desv.estand INVIERNO 2001 (I) S1 S2 S3 AT 5,50 7,44 6,47 1,37 2,94 4,58 3,74 0,62 1,66 9,03 5,13 2,25 6,41 9,03 7,57 0,96 1,09 2,35 1,72 0,46 1,28 2,01 1,65 0,52 0,79 1,05 0,90 0,10 0,09 2,07 1,11 0,56 0,10 0,41 0,21 0,10 0,12 0,37 0,25 0,09 0,10 0,28 0,19 0,13 0,10 0,22 0,14 0,04 3,60 20,13 8,09 3,95 3,95 9,62 7,35 2,44 4,52 20,13 12,32 11,04 0,052 0,072 0,062 0,005 0,058 0,072 0,064 0,005 0,25 1,79 1,05 0,43 7,09 40,99 24,22 10,65 PRIMAVERA 2001 (P) S1 S2 S3 AT 1,66 2,66 2,02 0,56 3,05 5,97 4,28 0,96 1,96 9,20 5,68 2,04 7,32 9,20 8,51 1,37 1,15 2,07 1,69 0,30 0,09 0,31 0,23 0,13 0,72 1,27 0,95 0,17 0,28 2,16 1,18 0,50 0,06 0,36 0,17 0,09 0,16 0,36 0,24 0,08 0,06 0,08 0,07 0,01 0,10 0,33 0,15 0,07 3,60 9,94 7,12 2,45 1,42 11,10 6,61 2,35 4,89 11,10 7,40 1,90 1,42 4,34 3,22 1,57 0,060 0,065 0,063 0,003 0,052 0,069 0,060 0,006 0,004 0,076 0,056 0,018 0,004 0,068 0,050 0,030 0,98 1,63 1,29 0,19 0,75 1,79 1,27 0,73 0,25 1,08 0,63 0,32 0,09 8,65 1,54 1,80 25,58 40,99 33,80 5,37 22,59 22,72 22,65 0,09 7,09 19,43 13,42 4,43 0,08 33,59 20,50 9,02 VERANO 2002 (V) S1 S2 Test de Dunn S3 AT S3 1,96 4,43 3,16 1,24 3,94 6,94 5,16 0,95 1,91 9,19 5,28 1,78 5,87 8,54 7,47 1,41 1,91 4,89 3,33 1,49 3,47 9,19 5,22 1,41 1,74 2,16 1,96 0,21 0,28 0,81 0,49 0,28 0,85 1,97 1,15 0,32 0,29 2,36 1,35 0,59 1,88 2,26 2,15 0,20 0,39 1,84 0,92 0,80 0,80 1,97 1,28 0,31 0,05 0,51 0,22 0,12 0,17 0,51 0,33 0,17 0,05 0,10 0,07 0,03 0,10 0,41 0,23 0,09 0,11 0,51 0,21 0,09 0,24 0,51 0,31 0,13 0,12 0,26 0,18 0,07 0,11 0,26 0,17 0,06 3,44 9,79 7,12 1,91 2,06 11,98 6,16 2,54 3,84 10,26 6,93 3,21 4,72 7,95 6,72 1,75 2,06 11,98 5,87 2,66 1,20 11,88 7,18 2,98 3,70 10,00 7,75 2,81 1,52 11,88 5,99 5,32 3,38 10,10 7,79 1,98 0,052 0,063 0,060 0,010 0,051 0,064 0,060 0,010 0,036 0,058 0,047 0,007 0,047 0,058 0,051 0,006 0,036 0,049 0,043 0,006 0,036 0,058 0,046 0,007 0,016 0,071 0,040 0,011 0,016 0,071 0,043 0,022 0,026 0,046 0,036 0,010 0,031 0,052 0,040 0,070 1,86 1,19 1,45 0,23 0,09 8,25 3,50 4,54 0,51 1,84 0,95 0,50 0,50 8,27 2,33 1,83 2,55 4,23 3,12 0,97 3,49 8,27 5,59 2,44 0,50 2,61 1,47 0,66 0,49 7,25 2,29 1,79 0,49 2,41 1,85 1,14 1,66 2,86 2,20 0,61 0,89 7,25 2,44 2,24 33,29 32,89 28,66 3,43 13,56 15,27 9,64 8,32 9,50 33,59 17,77 6,80 11,92 60,53 28,08 13,40 40,35 60,53 52,40 10,64 11,92 24,03 19,87 6,89 14,96 37,66 24,62 8,54 1,91 34,57 18,32 9,78 21,48 34,22 29,31 5,65 5,07 11,47 8,74 3,30 1,91 29,64 15,69 7,35 O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns O-I ns O-P ** O-V ** I-P ** I-V ** P-V ns O-I ns O-P * O-V * I-P ns I-V ns P-V ns O-I ns O-P ns O-V ns I-P ns I-V ns P-V ns *0,01< P < 0,05 - ** P < 0,01 – ns P > 0,05 171 Tabla 22. Estadística descriptiva de la totalidad de las variables analizadas. Campaña de Investigación OB-05/03 (invierno de 2003). Variables Arena muy gruesa (%) Arena gruesa (%) Arena gruesa (%) Total arena gruesa a muy gruesa (%) Arena mediana (%) Arena mediana (%) Total arena mediana (%) Arena fina (%) Arena fina (%) Total arena fina (%) Arena muy fina (%) TOTAL ARENA (%) Limo gruesa (%) Limo medio (%) Limo fino (%) Limo muy fino (%) TOTAL LIMO (%) Arcilla gruesa (%) Arcilla mediana (%) Arcilla fina a muy fina (%) TOTAL ARCILLA (%) Media granulométrica (Φ) Selección (Φ) Asimetría (Φ) Profundidad (m) Temperatura (ºC) Salinidad (ups) Densidad (kg/m3) Concentración de Oxígeno (mlO2/l) Clorofila a (Agua de superficie) (mg/m3) Clorofila a (Capa de mezcla) (mg/m3) Clorofila a (Agua de fondo) (mg/m3) Materia orgánica total (%) Carbono orgánico total (%) Nitrógeno total (%) Fósforo total (%) Relación Carbono:Nitrógeno Clorofila a (Sedimentos) (μg/g) Feopigmentos (Sedimentos) (μg/g) Juveniles (4-24 mm Lcap) (tn/mn2) Subadultos (25-30 mm Lcap) (tn/mn2) Subadultos (31-40 mm Lcap) (tn/mn2) Adultos (> 41 mm Lcap) (tn/mn2) Total de individuos (tn/mn2) Juveniles (4-24 mm Lcap)(miles de indiv./mn2) Subadultos (25-30 mm Lcap) (miles de indiv./mn2) Subadultos (31-40 mm Lcap) (miles de indiv./mn2) Adultos (> 41 mm Lcap) (miles de indiv./mn2) Total de individuos (miles de indiv./mn2) Porcentaje de hembras Porcentaje de machos Talla media (Lcap en mm) Desviación estándar de talla media Talla media de machos (Lcap en mm) Desviación estándar de talla media machos Talla media de hembras (Lcap en mm) Desviación estándar de talla media hembras Valor mínimo 44,95 3,04 2,39 50,38 3,26 2,94 2,94 0 0 0 0 0 0,92 0,03 1,19 2,1 9,68 0,875 0,97 2 10,15 2,00 1,12 -0,75 31,00 8,39 33,13 25,674 1,30 0,37 0,16 0,02 0,78 0,34 0,05 0,03 4,73 0,20 1,74 0,01 0,25 0,05 0,15 0,01 3,00 21,00 2,00 3,00 2,00 41,67 0 23,20 0,00 23,50 0 27,48 0 Valor máximo 44,95 3,04 2,39 50,38 3,26 10,1 13,36 12,05 48,89 51,92 40,29 79,16 47,31 19,59 31,65 20,29 65,93 61,25 18,35 58,575 73,875 8,30 2,61 1,07 91,00 9,76 33,56 26,084 6,27 1,04 5,37 0,91 11,85 1,53 0,27 0,09 8,54 9,90 43,19 12,41 190,79 172,88 16,54 376,08 4.293,00 16.265,00 6.777,00 321,00 27.335,00 100,00 58,33 38,00 4,59 38,00 3,90 35,89 5,35 Valor promedio 44,95 3,04 2,39 50,38 3,26 6,52 8,15 0,53 4,12 4,64 9,64 15,73 13,50 6,51 10,30 11,03 41,34 16,71 8,33 17,89 42,93 6,18 2,03 0,19 69,76 9,10 33,39 25,848 4,81 0,73 1,01 0,43 6,56 0,97 0,15 0,05 6,68 1,31 11,98 0,96 20,17 25,64 1,93 48,70 331,48 1.719,22 1.005,24 37,43 3.093,37 54,01 45,99 29,64 3,52 28,51 2,63 31,20 3,88 Desviación estándar 5,06 7,37 1,92 9,32 10,04 13,08 21,70 9,03 4,72 5,80 5,39 12,20 13,92 4,56 11,94 18,85 1,34 0,34 0,48 14,84 0,36 0,08 0,109 1,17 0,14 0,96 0,25 2,83 0,35 0,06 0,01 1,07 1,45 8,04 1,95 30,69 33,79 3,43 65,38 673,40 2.616,00 1.324,64 66,54 4.438,88 10,97 10,85 2,27 0,92 1,97 0,57 1,82 1,03 172 Tabla 23. Temperatura (T), salinidad (S), densidad (D) y concentración de oxígeno (O) en agua de fondo; clorofila a en agua de superficie, capa de mezcla y agua de fondo (Cl a AS, CM, AF); materia orgánica total (MOT), carbono orgánico total (COT), nitrógeno total (NT), fósforo total (FT), relación carbono-nitrógeno (C:N), clorofila a (Cl a S) y feopigmentos (Feop S) en sedimentos, de cada estación de muestreo. Campaña de investigación OB-05/03 (Invierno de 2003). Estación General T ºC S ups D Kg/m3 O ml/l Cl a (AS) mg/m3 Cl a (CM) mg/m3 Cl a (AF) mg/m3 MOT % COT % NT % FT % C:N Cl a (S) µg/g Feop (S) µg/g 98 99 100 101 102 103 104 106 107 109 110 111 112 114 116 117 118 119 120 122 123 124 125 126 127 129 130 131 132 133 134 135 138 140 142 144 147 148 149 150 151 152 153 155 169 170 9,07 9,44 9,07 9,13 8,82 8,99 8,51 9,22 9,33 9,20 9,37 8,97 8,60 9,13 9,52 9,29 9,49 9,40 9,42 9,29 9,12 9,42 8,59 9,03 8,65 9,76 8,67 8,90 8,87 9,65 8,39 8,57 9,63 8,87 8,97 9,68 8,55 8,62 9,34 8,93 8,57 9,32 9,28 9,10 9,34 9,30 33,415 33,346 33,374 33,417 33,459 33,388 33,401 33,330 33,324 33,394 33,348 33,326 33,134 33,422 33,333 33,395 33,345 33,341 33,357 33,365 33,426 33,342 33,385 33,431 33,477 33,324 33,471 33,456 33,447 33,309 33,558 33,526 33,317 33,423 33,501 33,329 33,515 33,510 33,366 33,449 33,514 33,336 33,318 33,401 33,377 33,399 25,867 25,757 25,841 25,874 25,949 25,871 25,942 25,775 25,753 25,830 25,766 25,735 25,720 25,864 25,727 25,816 25,745 25,756 25,766 25,827 25,674 25,754 25,917 25,891 25,985 25,692 25,976 25,938 25,702 25,872 26,084 26,038 25,724 26,066 25,980 25,724 26,014 26,014 25,784 25,924 26,021 25,766 25,757 25,853 25,857 25,819 4,45 5,48 5,16 4,02 3,41 4,81 5,52 5,58 5,56 4,56 5,18 5,17 6,27 3,81 5,12 4,26 4,98 5,19 4,96 4,85 5,14 5,26 5,38 3,89 3,05 5,82 3,62 5,71 5,74 6,20 2,13 5,73 5,85 5,72 1,30 5,70 2,74 2,90 5,88 3,81 2,95 5,64 5,86 4,68 6,08 6,09 0,56 0,73 0,82 1,04 1,02 0,81 0,71 0,82 0,73 0,81 0,86 0,84 0,65 0,74 0,68 1,02 0,62 0,59 0,61 0,73 0,37 0,49 0,73 0,70 0,73 0,85 0,78 0,87 0,83 0,54 0,64 0,56 0,54 0,72 0,85 0,76 0,74 0,79 0,70 0,74 0,62 0,67 0,61 0,58 0,88 0,91 0,48 0,64 0,73 0,98 0,85 0,70 0,74 0,68 0,68 0,81 0,77 0,42 0,65 0,90 0,75 1,04 0,32 0,37 0,66 0,77 1,24 0,62 0,74 0,86 0,73 0,82 0,89 0,75 0,95 0,58 0,78 5,37 0,56 3,49 1,48 0,78 1,44 0,16 1,34 0,69 4,18 0,19 0,68 0,54 1,14 1,63 0,38 0,60 0,60 0,47 0,30 0,64 0,77 0,75 0,91 0,49 0,74 0,56 0,70 0,25 0,51 0,32 0,15 0,25 0,28 0,25 0,46 0,36 0,44 0,29 0,19 0,79 0,24 0,15 0,83 0,24 0,02 0,48 0,65 0,05 0,03 0,63 0,14 0,03 0,74 0,17 0,53 0,12 0,68 0,43 0,46 0,71 6,58 7,32 6,64 10,65 6,92 11,85 2,91 3,05 4,04 4,48 4,21 4,30 2,01 3,59 3,49 3,87 3,43 2,99 4,21 9,13 10,65 9,73 9,35 10,48 7,63 9,12 8,39 8,97 0,78 9,96 9,46 9,16 8,56 9,38 8,93 2,91 8,27 5,30 5,35 4,38 6,34 8,49 6,49 8,94 4,14 4,93 1,16 1,31 1,15 1,06 1,08 1,03 0,34 0,35 0,89 0,79 0,73 0,58 0,51 0,62 0,66 0,95 0,84 0,50 0,83 1,24 1,26 1,37 1,33 1,13 1,10 1,32 1,13 1,47 1,35 1,40 1,43 1,38 1,50 1,46 1,53 0,44 0,79 0,60 0,47 0,60 0,77 1,17 0,88 0,87 0,50 0,65 0,16 0,20 0,17 0,19 0,18 0,14 0,05 0,07 0,11 0,13 0,10 0,07 0,06 0,08 0,08 0,13 0,11 0,06 0,11 0,20 0,20 0,21 0,20 0,17 0,17 0,24 0,19 0,22 0,20 0,21 0,22 0,26 0,20 0,26 0,27 0,09 0,14 0,11 0,10 0,11 0,14 0,20 0,14 0,11 0,08 0,14 0,049 0,043 0,046 0,042 0,046 0,043 0,039 0,035 0,039 0,043 0,041 0,035 0,036 0,048 0,042 0,047 0,047 0,043 0,049 0,060 0,058 0,057 0,057 0,052 0,054 0,054 0,053 0,056 0,063 0,068 0,056 0,064 0,054 0,054 0,089 0,071 0,056 0,056 0,049 0,056 0,056 0,067 0,053 0,047 0,046 0,051 7,09 6,56 6,94 8,39 7,59 7,25 6,37 5,40 7,78 6,28 7,48 8,39 8,26 7,85 8,51 7,55 7,47 8,40 7,71 6,08 6,90 6,52 6,63 6,62 6,61 5,62 6,12 6,73 6,70 6,52 6,56 5,27 8,54 5,67 6,08 4,73 5,63 5,46 4,94 5,39 5,46 5,81 6,36 7,94 6,25 4,81 1,62 1,06 1,70 0,76 0,70 3,35 0,56 0,67 1,91 1,07 1,14 0,54 1,07 0,50 1,77 0,33 1,10 0,58 0,98 2,39 1,24 1,85 0,65 1,21 0,87 0,75 0,90 0,80 1,75 1,34 0,65 0,49 1,19 9,90 0,52 0,21 2,01 0,74 1,48 0,67 1,14 1,75 2,62 1,27 0,20 0,21 21,76 13,02 4,53 9,41 11,87 14,12 3,05 2,57 8,34 7,14 7,46 4,44 1,74 6,13 6,66 4,60 8,48 4,17 8,70 16,43 18,29 14,65 12,22 15,72 14,31 14,50 18,36 13,72 32,83 17,64 15,08 9,88 11,93 43,19 8,45 2,62 19,81 5,23 11,72 10,96 14,29 27,39 12,86 11,91 5,06 3,62 173 Tabla 24. Composición granulométrica (%), parámetros granulométricos (media, selección y asimetría en unidades Φ), tipo sedimentario y profundidad, de cada estación de muestreo. Campaña de Investigación OB-05/03 (Invierno de 2003). Tipo sedimentario Profundidad (m) 0,03 limo arcilloso 68 0,02 limo arcilloso 58 2,2 0,07 limo arcilloso 53 7,25 1,81 0,07 arcilla limosa 51 8,87 6,33 1,57 0,32 arcilla limosa 58 8,80 19,72 6,30 2,23 0,11 limo arcilloso 43 3,02 1,51 5,62 4,22 1,46 -1,02 limo arenoso 31 4,18 3,78 2,10 4,84 4,03 1,79 -0,69 arena limosa 31 10,90 10,19 8,96 6,39 14,80 5,70 2,39 -0,51 limo arcilloso 49 17,67 14,92 12,23 10,03 5,22 13,03 5,58 2,03 -0,69 limo arcilloso 70 25,40 10,07 11,82 8,05 7,52 4,54 9,31 5,03 2,13 -0,65 limo arenoso 74 9,55 14,53 8,60 9,47 9,24 4,42 7,14 9,33 4,97 2,25 -0,59 limo arenoso 48 2,28 1,09 2,75 2,38 1,75 2,80 3,81 3,58 3,77 2,00 2,61 -0,69 arena arcillosa 55 0,33 8,50 36,93 18,18 7,43 3,42 4,48 5,53 5,75 9,45 4,90 2,25 -0,77 arena limosa 86 - 3,03 48,89 12,73 7,03 3,65 1,19 3,36 14,11 1,53 4,48 4,28 2,14 -0,76 arena arcillosa 77 - - 0,22 10,86 32,03 16,87 5,81 6,47 6,44 18,33 0,97 2,00 4,77 1,84 -0,71 arena limosa 84 - - - 0,22 9,05 32,65 16,43 4,88 7,00 6,57 10,94 6,45 5,81 4,90 2,07 -0,74 arena limosa 76 - - - - - 9,12 40,29 17,47 5,91 4,78 6,43 5,46 3,48 7,06 4,23 2,05 -0,79 arena limosa 76 - - - - 0,26 3,39 28,57 18,87 7,33 7,85 6,91 6,46 5,06 15,30 5,42 2,42 -0,72 limo arenoso 76 ArM Φ9 ArF MF Φ <10 Media Granulométrica (Φ) Selección (Φ) Asimetría (Φ) 16,95 8,87 23,47 6,97 1,97 17,15 10,02 21,20 7,38 1,91 15,45 13,91 8,22 19,47 6,67 17,15 20,29 16,20 10,83 23,93 8,15 17,73 18,97 40,35 4,10 14,76 6,51 15,87 18,79 15,55 24,22 47,31 5,38 7,57 2,27 25,63 35,69 15,92 3,61 3,49 - 1,21 4,58 23,38 19,59 - - 1,21 4,58 21,11 - - - 1,86 21,43 - - - 1,29 26,43 3,04 2,39 3,26 10,10 12,05 - - - - - 116 - - - - 117 - - - 118 - - 119 - 120 - Estación General AMG Φ0 AG Φ 0,5 AG Φ1 AM Φ 1,5 AM Φ2 AF Φ 2,5 AF Φ3 AMF Φ 3,5 LG Φ4 LM Φ5 LF Φ6 LMF Φ7 ArG Φ8 98 - - - - - - - - 4,52 13,51 16,05 16,63 99 - - - - - - - - 4,60 9,38 18,87 18,77 100 - - - - - - - - 11,62 13,76 17,57 101 - - - - - - - - 6,28 5,32 102 - - - - - - - - 1,82 103 - - - - - - - - 104 - - - - - 1,24 1,86 106 - - - - - 0,76 107 - - - - - 109 - - - - 110 - - - 111 - - 112 44,95 114 174 Tabla 24. (Continuación) Composición granulométrica (%), parámetros granulométricos (media, selección y asimetría en unidades Φ), tipo sedimentario y profundidad, de cada estación de muestreo. Campaña de Investigación OB-05/03 (Invierno de 2003). Tipo sedimentario Profundidad (m) 0,09 arcilla limosa 66 0,11 arcilla limosa 73 0,01 arcilla limosa 64 1,68 0,19 arcilla limosa 65 7,08 2,18 0,14 arcilla limosa 56 24,69 6,75 2,24 0,12 limo arcilloso 71 11,87 29,14 8,08 1,99 0,17 arcilla limosa 71 13,90 11,15 29,84 8,07 2,18 0,23 arcilla limosa 64 11,75 61,25 6,20 6,43 8,20 1,76 0,39 arcilla limosa 79 11,03 18,43 51,02 7,00 7,50 8,13 1,12 0,42 arcilla limosa 77 2,85 14,15 12,90 35,43 15,78 10,50 8,00 2,03 0,29 arcilla limosa 79 5,48 5,27 5,37 15,18 57,35 4,90 6,45 8,02 1,21 0,34 arcilla limosa 87 7,47 4,13 4,30 13,77 33,53 18,35 18,45 8,57 1,73 1,07 arcilla limosa 85 LMF Φ7 ArG Φ8 ArM Φ9 ArF MF Φ <10 Media Granulométrica (Φ) Estación General AMG Φ0 AG Φ 0,5 AG Φ1 AM Φ 1,5 AM Φ2 AF Φ 2,5 AF Φ3 AMF Φ 3,5 LG Φ4 LM Φ5 LF Φ6 122 - - - - - - - - 3,77 8,48 31,65 2,10 19,55 15,35 19,10 7,30 1,83 123 - - - - - - - - 1,65 3,25 11,78 17,47 24,58 18,32 22,95 8,03 1,38 124 - - - - - - - - 0,92 5,90 16,88 17,42 27,75 17,67 13,45 8,05 1,65 125 - - - - - - - - 2,98 2,60 14,45 17,38 17,65 11,67 33,28 7,77 126 - - - - - - 0,46 0,77 12,13 5,45 14,98 13,10 16,00 9,97 27,14 127 - - - - - - 0,34 0,68 16,44 10,21 10,10 13,69 16,07 7,78 129 - - - - - - - - 11,57 2,72 9,60 16,82 18,28 130 - - - - - - 0,36 1,25 9,88 9,32 11,70 12,60 131 - - - - - - - - 7,80 0,37 6,20 132 - - - - - - - - 2,60 2,43 133 - - - - - - - - 8,40 134 - - - - - - - - 135 - - - - - - - - Selección (Φ) Asimetría (Φ) 175 Tabla 24 (Continuación). Composición granulométrica (%), parámetros granulométricos (media, selección y asimetría en unidades Φ), tipo sedimentario y profundidad, de cada estación de muestreo. Campaña de Investigación OB-05/03 (Invierno de 2003). Estación General AMG Φ0 AG Φ 0,5 AG Φ1 AM Φ 1,5 AM Φ2 AF Φ 2,5 AF Φ3 AMF Φ 3,5 LG Φ4 LM Φ5 LF Φ6 LMF Φ7 ArG Φ8 ArM Φ9 ArF MF Φ <10 Media Granulométrica (Φ) Selección (Φ) Asimetría (Φ) Tipo sedimentario Profundidad (m) 138 - - - - - - - - 8,47 0,08 8,35 15,05 1,08 16,20 50,77 8,25 1,92 140 - - - - - - - - 9,82 0,03 6,65 13,20 0,88 10,85 58,57 8,30 1,92 0,75 arcilla limosa 80 0,71 arcilla limosa 142 - - - - - - - - 8,45 4,73 11,00 15,02 20,18 14,55 26,08 8,00 80 2,1 0,17 arcilla limosa 144 - - - - 2,94 4,09 22,39 20,10 16,08 7,08 3,99 3,47 4,23 4,26 11,37 81 4,68 2,42 -0,65 arena limosa 147 - - - - - - 0,37 2,21 18,95 7,69 9,87 8,92 11,37 6,94 66 33,68 6,88 2,44 -0,27 arcilla limosa 148 - - - - - - 0,86 14,25 27,82 0,54 8,90 6,99 29,25 89 3,99 7,40 5,77 1,97 -0,05 limo arcilloso 149 - - - - - 0,27 3,02 25,55 19,18 0,48 11,02 4,92 86 12,82 7,89 14,85 5,75 2,42 -0,39 limo arcilloso 150 - - - - - 0,31 0,92 16,70 20,32 0,26 10,99 76 5,47 11,88 8,78 24,37 6,32 2,55 -0,16 arcilla limosa 151 - - - - - - 0,47 5,41 26,74 12,20 73 9,89 9,54 9,67 7,90 18,18 5,40 2,15 -0,38 limo arcilloso 152 - - - - - - - - 8,13 82 9,55 15,30 15,82 16,65 11,58 22,98 7,00 2,07 -0,06 arcilla limosa 153 - - - - - - 0,93 7,45 81 17,91 7,26 1,69 10,92 10,88 7,84 35,12 6,92 2,46 -0,22 arcilla limosa 155 - - - - - - 0,55 76 4,48 16,14 16,11 11,29 12,23 12,55 8,80 17,85 6,35 2,3 -0,13 limo arcilloso 169 - - - - - - 56 2,13 31,66 27,32 11,30 6,47 5,20 2,84 3,56 9,52 4,67 1,86 -0,77 limo arenoso 170 - - - - - - 91 6,43 28,48 15,82 0,26 2,26 5,89 9,37 9,66 21,83 5,38 2,49 -0,71 arcilla arenosa 91 176 Tabla 25. Factores o componentes obtenidos del Análisis de Componentes Principales. Campaña de Investigación OB-05/03 (Invierno de 2003). Variables Código Arena muy gruesa AMG Φ 0 Arena gruesa AG Φ 0,5 Arena gruesa AG Φ 1 Arena mediana AM Φ 1,5 Arena mediana AM Φ 2 Arena fina AF Φ 2,5 Arena fina AF Φ 3 Arena muy fina AMF Φ 3,5 Limo grueso LG Φ 4 Limo medio LM Φ 5 Limo fino LF Φ 6 Limo muy fino LMF Φ 7 Arcilla gruesa ArG Φ 8 Arcilla mediana ArM Φ 9 Arcilla fina a muy fina ArF MF Φ 10 Materia orgánica total MOT Carbono orgánico total COT Nitrógeno total NT Fósforo total FT Relación Carbono-Nitrógeno C:N Clorofila a (Sedimentos) Cl a (S) Feopigmentos (Sedimentos) Feop (S) Profundidad P Temperatura T Salinidad S Concentración de Oxígeno O Clorofila a (Agua de fondo) Cl a (AF) Porcentaje de la varianza Porcentaje de la varianza acumulada Valores absolutos > 0,5 Factor 1 0,6662 0,6662 0,6662 0,6662 0,6731 0,7764 0,4651 0,5401 0,3460 0,0229 -0,4833 -0,6907 -0,4797 -0,6458 -0,5276 -0,7433 -0,7845 -0,8289 -0,5806 0,2776 -0,2690 -0,6361 -0,2790 0,0895 -0,6302 0,3265 0,4224 31,99 31,99 Factor 2 -0,7241 -0,7241 -0,7241 -0,7241 -0,6932 -0,5596 0,3629 0,6682 0,6455 0,2154 -0,1598 -0,3657 -0,2294 -0,4138 -0,2648 -0,3583 -0,4844 -0,4609 -0,1904 -0,1094 -0,2542 -0,3355 0,0538 0,2449 0,2486 -0,1077 0,0479 19,62 51,61 Factor 3 0,1318 0,1318 0,1318 0,1318 0,1311 0,1079 -0,0788 0,1193 0,1410 -0,2600 -0,3408 -0,2445 0,3763 -0,2511 -0,2612 -0,1139 -0,1002 0,0085 0,3588 -0,2998 -0,2644 -0,0831 0,4866 -0,6309 0,6267 -0,6372 -0,5750 10,14 61,75 177 Tabla 26. Estadística descriptiva de las variables físico-químicas de los sedimentos y del agua de fondo, en los sectores definidos. Campaña de Investigación OB-05/03 (Invierno de 2003). Sector 1 variables Arena muy gruesa (Φ 0) (%) Sector 2 valor Valor valor desviación mínimo máximo promedio estándar 0 0 0 0 valor mínimo 0 Valor valor desviación máximo promedio estándar 44,95 2,37 10,31 Arena gruesa (Φ 0,5) (%) 0 0 0 0 0 3,04 0,16 0,70 Arena gruesa (Φ 1) (%) 0 0 0 0 0 2,39 0,13 0,55 A, gruesa a A, muy gruesa (%) 0 0 0 0 0 50,38 2,65 11,56 Arena mediana (Φ 1,5) (%) 0 0 0 0 0 3,26 0,17 0,75 Arena mediana (Φ 2) (%) 0 0 0 0 0 10,10 0,69 2,38 Arena mediana (%) 0 0 0 0 0 13,36 0,86 3,10 Arena fina (Φ 2,5) (%) 0 0 0 0 0 12,05 1,34 2,90 Arena fina (Φ 3) (%) 0 1,21 0,16 0,31 0,47 48,89 9,75 12,64 Arena fina (%) 0 1,21 0,16 0,31 0,47 51,92 11,02 13,37 Arena muy fina (Φ 3,5) (%) 0 7,45 0,79 1,83 1,09 40,29 22,21 11,79 Total arena (%) 0 8,38 0,95 2,12 5,79 79,16 36,73 19,42 Limo grueso (Φ 4) (%) 0,92 23,38 9,11 5,85 2,75 47,31 19,74 9,17 Limo medio (Φ 5) (%) 0,03 19,59 6,84 4,86 0,26 17,67 6,04 4,61 Limo fino (Φ 6) (%) 1,69 31,65 12,61 5,89 1,19 14,92 7,01 3,81 Limo muy fino (Φ 7) (%) 2,10 20,29 14,55 3,85 2,27 12,23 6,02 2,51 Total limo (%) 26,13 64,06 43,04 9,55 9,68 65,93 38,83 14,97 Arcilla gruesa (Φ 8) (%) 0,88 61,25 22,04 15,32 2,84 29,25 9,13 6,48 Arcilla media (Φ 9) (%) 4,10 18,35 10,74 4,11 0,97 9,66 4,91 2,55 Ar. fina a muy fina (Φ10) (%) 6,43 58,57 23,16 12,26 2,00 24,37 10,40 6,18 Total arcilla (%) 30,15 73,88 55,48 10,63 10,15 45,03 25,36 11,13 Media granulométrica (Φ) 5,70 8,57 7,42 0,77 2,00 6,32 4,86 0,92 Selección (Φ) 1,12 2,46 1,94 0,35 1,46 2,61 2,15 0,30 Asimetría (Φ) -0,51 1,07 0,17 0,32 -1,02 -0,05 -0,63 0,23 Profundidad (m) 43,00 89,00 68,89 12,65 31,00 91,00 71,00 17,80 0,35 Temperatura (ºC) 8,39 9,76 9,05 0,36 8,51 9,68 9,15 Salinidad (ups) 33,31 33,56 33,41 0,07 33,13 33,51 33,37 0,08 Densidad (kg7m3) 25,67 26,08 25,87 0,12 25,72 26,02 25,82 0,09 Concentración Oxígeno (ml O2/l) 1,30 6,20 4,71 1,28 2,90 6,27 4,95 1,00 Clorofila a (AS) (mg/m3) 0,37 1,04 0,71 0,15 0,59 1,02 0,75 0,12 Clorofila a (CM) (mg/m3) 0,19 5,37 1,06 1,04 0,16 4,18 0,95 0,86 Clorofila a (AF) (mg/m3) 0,02 0,91 0,40 0,25 0,03 0,77 0,48 0,24 Materia orgánica total (%) 0,78 11,85 8,37 2,21 2,01 6,34 3,99 1,04 Carbono orgánico total (%) 0,79 1,53 1,22 0,21 0,34 0,95 0,62 0,17 Nitrógeno total (%) 0,11 0,27 0,19 0,04 0,05 0,14 0,09 0,03 Fósforo total (%) 0,04 0,09 0,05 0,01 0,03 0,07 0,05 0,01 1,36 Relación C:N 5,27 8,54 6,69 0,83 4,73 8,51 6,67 Clorofila a (S) (μg/g) 0,49 9,90 1,68 1,78 0,20 1,77 0,79 0,44 Feopigmentos (S) (μg/g) 4,53 43,19 16,01 7,95 1,74 14,29 6,25 3,39 178 Tabla 27. Número de individuos (en miles) por talla. Campaña de Investigación OB-05/03 (Invierno de 2003). Lcap (mm) Totales Machos Hembras 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 Total Talla media Desviación estándar 0 0 0 4 0 0 0 111 77 196 554 862 2.552 3.837 7.064 9.726 11.743 16.597 15.387 14.096 11.608 11.501 9.425 7.671 4.635 3.892 2.842 2.467 1.923 1.097 810 442 495 126 171 103 161 98 8 46 51 0 5 0 0 18 0 0 0 0 0 142.401 29,69 4,17 0 0 0 0 0 0 0 18 24 126 345 467 1.659 2.187 4.829 6.344 7.220 10.156 9.076 7.707 5.910 5.101 3.827 2.002 935 536 371 226 67 18 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 69.151 28,27 3,05 0 0 0 4 0 0 0 93 53 70 209 399 893 1.652 2.234 3.385 4.522 6.441 6.309 6.396 5.695 6.398 5.598 5.666 3.701 3.356 2.469 2.242 1.856 1.079 810 442 495 126 171 103 161 98 8 46 51 0 5 0 0 18 0 0 0 0 0 73.254 31,03 4,62 Machos maduros 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 4 166 497 1.420 1.985 1.412 756 485 316 112 67 18 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 7.238 33,03 1,78 Hembras maduras 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 - 179 Tabla 28. Número (en miles de indiv./mn2) y peso (en tn/mn2) de los individuos por categorías, porcentaje de hembras (H) y machos (M), talla media del total de individuos y por sexo (Lcap en mm), de cada estación de muestro. Campaña de Investigación OB-05/03 (Invierno de 2003). Estación General Juveniles 4-24 mm Lcap tn/mn2 Subadultos 25-30 mm Lcap tn/mn2 Adultos 31-40 mm Lcap tn/mn2 Adultos >41mm Lcap tn/mn2 Total de Individuos tn/mn2 Juveniles 4-24 mm Lcap miles de Indiv./mn2 Subadultos 25-30 mm Lcap miles de indiv./mn2 Adultos 31-40 mm Lcap miles de Indiv./mn2 Adultos >41mm Lcap miles de Indiv./mn2 Total de Individuos miles de Indiv./mn2 H (%) M (%) Talla Media Desviación Estándar Lcap en mm Talla Talla media media Machos Hembras 98 1,86 19,94 22,14 1,70 45,65 644 1,700 868 33 3.245 54,18 45,82 28,92 4,59 27,58 30,05 99 12,41 190,79 172,88 0,00 376,08 4.293 16.265 6.777 0 27.335 54,82 45,18 28,46 3,73 27,2 29,5 100 0,23 2,89 3,29 0,15 6,56 78 246 129 3 456 52,63 47,37 28,86 3,90 28,21 29,45 101 0,10 4,50 6,89 0,46 11,95 33 384 270 9 696 56,75 43,25 30,59 4,14 29,13 31,69 102 0,11 2,32 1,76 0,15 4,35 39 198 69 3 309 57,28 42,72 28,99 4,08 27,23 30,3 103 0,02 0,25 0,38 0,00 0,65 6 21 15 0 42 57,14 42,86 30,00 4,31 29,5 30,38 104 0,01 0,00 0,00 0,00 0,01 3 0 0 0 3 100,0 - 23,50 - 23,5 - 106 0,00 0,25 0,46 0,00 0,71 0 21 18 0 39 46,15 53,85 30,58 2,26 29,5 31,83 107 0,55 18,87 22,78 1,39 43,59 190 1.609 893 27 2.719 52,19 47,81 29,72 3,80 28,27 31,05 109 0,32 10,38 14,59 2,32 27,62 112 885 572 45 1.614 61,59 38,41 30,32 4,28 28,18 31,64 110 0,46 12,67 13,24 1,29 27,65 158 1.080 519 25 1.782 58,08 41,92 29,66 3,89 28,14 30,74 111 0,15 4,21 5,48 0,00 9,84 51 359 215 0 625 52,80 47,20 29,90 3,97 28,33 31,32 112 0,03 2,56 4,54 0,36 7,49 11 218 178 7 414 61,35 38,65 30,86 3,79 28,83 32,13 114 0,06 4,61 7,24 0,21 12,12 20 393 284 4 701 49,36 50,64 30,58 3,13 29,3 31,9 116 0,57 28,59 54,00 5,51 88,67 196 2.437 2.117 107 4.857 49,82 50,18 31,07 3,97 29,45 32,71 117 0,08 4,41 3,57 0,00 8,06 28 376 140 0 544 44,85 55,15 29,51 3,05 28,34 30,96 118 1,28 37,70 48,55 4,69 92,21 442 3.214 1.903 91 5.650 53,58 46,42 30,13 4,33 28,46 31,58 119 2,46 49,99 47,40 6,80 106,66 852 4.262 1.858 132 7.104 51,70 48,30 29,37 4,26 27,81 30,84 120 0,17 5,68 17,22 3,35 26,42 60 484 675 65 1.284 53,74 46,26 2,32 0,06 30 34,3 122 0,23 7,10 10,46 0,93 18,72 81 605 410 18 1.114 60,14 39,86 30,16 4,10 28,38 31,35 123 0,82 10,76 13,37 0,31 25,26 285 917 524 6 1.732 56,06 43,94 29,10 4,18 27,34 30,47 124 1,36 26,32 27,60 0,62 55,90 471 2.244 1.082 12 3.809 53,74 46,26 29,11 3,53 27,69 30,33 31,85 125 0,29 21,70 29,97 0,72 52,68 99 1.850 1.175 14 3.138 43,59 56,41 30,40 3,42 29,28 126 0,98 45,38 69,87 5,15 121,39 338 3.869 2.739 100 7.046 45,10 54,90 30,59 3,53 29,46 31,96 127 3,08 44,67 31,30 0,93 79,97 1.065 3.808 1.227 18 6.118 53,99 46,01 28,21 3,85 26,6 29,58 129 1,67 12,68 4,46 0,00 18,82 579 1.081 175 0 1.835 48,45 51,55 26,76 3,31 26,08 27,48 130 3,76 39,64 26,02 0,00 69,42 1.302 3.379 1.020 0 5.701 50,03 49,97 27,65 3,66 26,46 28,85 180 Tabla 28 (Continuación). Número (en miles de indiv./mn2) y peso (en tn/mn2) de los individuos por categorías, porcentaje de hembras (H) y machos (M), talla media del total de individuos y por sexo (Lcap en mm), de cada estación de muestro. Campaña de Investigación OB-05/03 (Invierno de 2003). Juveniles 4-24 mm Lcap tn/mn2 Subadultos 25-30 mm Lcap tn/mn2 Adultos 31-40 mm Lcap tn/mn2 Adultos >41mm Lcap tn/mn2 Total de Individuos tn/mn2 Juveniles 4-24 mm Lcap miles de indiv./mn2 Subadultos 25-30 mm Lcap miles de indiv./mn2 Adultos 31-40 mm Lcap miles de indiv./mn2 Adultos >41mm Lcap miles de indiv./mn2 Total de Individuos miles de indiv./mn2 H (%) 0,29 6,26 6,89 0,26 13,70 99 534 270 5 908 58,48 132 2,04 22,62 9,44 0,82 34,92 707 1.928 370 16 3.021 49,26 50,74 133 0,09 2,76 3,11 0,00 5,96 31 235 122 0 388 56,44 43,56 134 0,22 9,31 10,33 0,21 20,07 76 794 405 4 1.279 50,43 49,57 135 0,05 2,25 2,96 0,00 5,26 16 192 116 0 324 54,32 138 0,25 6,17 2,76 0,00 9,18 88 526 108 0 722 49,17 140 0,07 0,89 0,79 0,00 1,75 25 76 31 0 132 142 0,07 1,29 0,46 0,00 1,82 24 110 18 0 144 0,00 0,00 0,05 0,00 0,05 0 0 2 0 147 0,06 12,01 40,92 3,50 56,49 20 1.024 1.604 148 0,01 9,17 28,70 1,55 39,43 5 782 149 0,55 26,92 44,29 2,27 74,03 191 2.295 150 1,02 29,70 40,82 5,36 76,90 354 151 0,23 19,67 103,90 14,43 138,24 152 1,27 21,01 16,30 1,39 39,97 153 0,55 12,11 7,96 0,67 21,29 155 2,21 44,36 26,50 0,88 169 0,07 14,98 71,25 3,81 170 1,95 77,32 102,70 16,54 Estación General 131 M (%) Talla Media Desviación Estándar Lcap en mm 41,52 29,52 Talla Talla media media Machos Hembras 3,73 27,9 30,66 27,45 3,51 26,27 28,65 29,63 3,55 28,6 30,41 29,84 3,51 28,5 31,17 45,68 30,12 3,26 28,69 31,32 50,83 28,30 2,98 27,93 28,67 41,67 58,33 28,61 3,09 28,74 28,46 152 51,32 48,68 27,95 2,77 26,6 29,19 2 100,0 0,00 38,00 2,12 38 - 68 2.716 55,89 44,11 32,53 4,10 30,2 34,37 1.125 30 1.942 48,46 51,54 32,36 3,46 30,62 34,21 1.736 44 4.266 51,05 48,95 30,69 4,03 29,26 32,05 2.532 1.600 104 4.590 43,14 56,86 30,17 4,27 29,05 31,65 80 1.677 4.073 280 6.110 50,03 49,97 33,40 4,19 30,92 35,89 439 1.791 639 27 2.896 50,62 49,38 28,75 3,71 27,66 29,81 191 1.032 312 13 1.548 48,71 51,29 28,56 3,60 27,4 29,78 73,96 766 3.782 1.039 17 5.604 50,79 49,21 28,20 3,50 26,9 29,46 90,11 24 1.277 2.793 74 4.168 47,05 52,95 32,79 3,27 31,19 34,59 198,53 676 6.592 4.026 321 11.615 48,49 51,51 30,51 4,22 28,82 32,31 181 Tabla 29. Estadística descriptiva de las categorías de langostino, del porcentaje de machos y hembras y de la talla media de los individuos, de cada agrupación definida, según análisis de clasificación. Juveniles (4-24 mm Lcap) (miles indiv./mn2) valor mínimo 5,00 valor valor Desviación máximo promedio estándar 1.302,00 354,39 341,87 Subadultos (25-30 mm Lcap) (miles indiv./mn2) 484,00 6.592,00 2.085,11 1.431,89 270,00 4.073,00 1.341,93 1.031,88 - 321,00 60,57 77,18 2 Adultos (31-40 mm Lcap) (miles indiv./mn ) 2 Adultos (> 41 mm Lcap) (miles indiv./mn ) Agrupación 1 2 Total de Individuos (miles indiv./mn ) 908,00 Porcentaje de machos 38,41 56,86 48,22 4,59 Porcentaje de hembras 43,14 61,59 51,78 4,59 Talla media (Lcap en mm) 27,45 33,40 30,09 1,96 Talla media de machos (Lcap en mm) 26,27 31,19 28,49 1,32 28,65 35,89 31,50 1,83 6,00 579,00 73,50 147,39 21,00 1.081,00 315,36 260,58 15,00 284,00 133,57 85,41 0,00 9,00 1,86 2,98 Total de Individuos (miles indiv./mn ) 42,00 1.835,00 524,29 436,35 Porcentaje de machos 38,65 58,33 47,60 5,37 Porcentaje de hembras 41,67 61,35 52,40 5,37 Talla media (Lcap en mm) 26,76 30,86 29,33 1,16 Talla media de machos (Lcap en mm) 26,08 29,50 28,25 1,00 Talla media de hembras (Lcap en mm) 27,48 32,13 30,26 1,42 Talla media de hembras (Lcap en mm) 2 Juveniles (4-24 mm Lcap) (miles indiv./mn ) 2 Subadultos (25-30 mm Lcap) (miles indiv./mn ) 2 Adultos (31-40 mm Lcap) (miles indiv./mn ) 2 Adultos (> 41 mm Lcap) (miles indiv./mn ) Agrupación 2 2 11.615,00 3.842,00 2.434,33 182 Tabla 30. Autovalores, inercia e inercia acumulada para las tres primeras dimensiones del análisis de correspondencia. autovalor Dimensión 1 0,110 Dimensión 2 0,012 Dimensión 3 0,005 Inercia % 86,658 9,190 4,151 Inercia acumulada (%) 86,658 95,849 100,000 Tabla 31. Estadística descriptiva de las categorías de langostino y de la talla media de los individuos, de cada sector definido según el análisis de correspondencia. Sectores Del G. San Jorge Costero oeste Noreste Central y sudeste Juveniles valores mínimo máximo promedio desviación estándar mínimo máximo promedio desviación estándar mínimo máximo promedio desviación estándar Subadultos Adultos Adultos (4-24 mm Lcap) (25-30 mm Lcap) (31-40 mm Lcap) (>41 mm Lcap) miles de miles de miles de miles de individuos/mn2 individuos/mn2 individuos/mn2 individuos/mn2 Total talla media miles de individuos/mn2 (Lcap mm) 579,00 1.302,00 653,00 524,48 1.081,00 3.379,00 1.624,50 1.385,58 175,00 1.020,00 395,75 440,37 0,00 16,00 4,00 8,00 1.835,00 5.701,00 2.677,25 2.334,35 26,76 27,65 27,29 0,47 5,00 80,00 37,80 31,05 484,00 1.677,00 1.048,80 457,58 675,00 4.073,00 2.054,00 1.377,47 30,00 280,00 103,40 100,21 1.284,00 6.110,00 3.244,00 1.928,95 23,20 32,79 30,86 4,30 6,00 4.293,00 355,54 726,91 21,00 16.265,00 1.924,06 2.886,90 15,00 6.777,00 982,46 1.328,46 3,00 321,00 33,97 60,81 39,00 27.656,00 3.296,03 4.881,69 23,50 38,00 29,67 1,90 Tabla 32. Valores de los coeficientes de correlación canónica y su correspondiente grado de significación estadística. Coeficiente de correlación canónica 1 2 3 4 Coeficiente de correlación Canónica VALORES 0,642 0,297 0,235 0,102 Significación estadística ** ns ns ns ** altamente significativo, P < 0,01 ns no significativo 183 Tabla 33. Matriz de correlación entre las variables biológicas y ambientales según análisis de correspondencia canónica. Limo Arcilla COT C:N Profundidad Temperatura Salinidad Concentración Oxígeno Clorofila a (AF) Juveniles Subadultos Adultos Adultos (4-24 mm Lcap) (25-30 mm Lcap) (31-40 mm Lcap) (> 41 mm Lcap) 0,021 0,110 0,176 -0,016 -0,083 0,145 -0,047 0,059 0,070 0,029 0,072 0,051 -0,051 0,003 0,167 -0,044 0,069 0,070 0,061 0,004 -0,135 -0,172 0,174 0,087 0,065 -0,020 0,047 0,045 -0,066 -0,335 -0,211 0,334 0,020 0,129 -0,064 0,035 184 Tabla 34. Varianza explicada y factores de carga de las variables que definen los componentes canónicos. Variables Limo Arcilla COT Relación C:N Profundidad Temperatura Salinidad Concentración Oxígeno Clorofila a (AF) varianza explicada Componente ambiental 1 0,084 -0,169 -0,593 -0,363 0,561 -0,116 0,282 -0,194 -0,010 10,71 Componente Componente ambiental 2 ambiental 3 -0,149 -0,029 -0,227 -0,335 -0,445 -0,127 0,435 0,130 -0,087 -0,112 0,380 -0,825 -0,566 0,248 0,516 -0,394 -0,043 -0,391 13,35 10,45 Componente ambiental 4 0,455 -0,239 -0,222 -0,510 -0,073 0,084 -0,014 -0,077 -0,271 7,40 Variables Juveniles (4-24 mm Lcap) Subadultos (25-30 mm Lcap) Adultos (31-40 mm Lcap) Adultos (> 41 mm Lcap) varianza explicada Componente biológico 1 -0,306 -0,055 0,433 0,900 27,35 Componente Componente biológico 2 biológico 3 -0,334 -0,810 -0,106 -0,884 -0,163 -0,685 0,055 -0,423 3,80 22,17 Componente biológico 4 0,372 0,452 0,563 -0,088 16,68 185 Tabla 35. Estaciones de muestreo del primer y segundo período de estudio comparadas. PRIMAVERA VERANO OTOÑO INVIERNO OTOÑO INVIERNO PRIMAVERA VERANO 1999 2000 2000 2000 2001 2001 2001 2002 494 64 243 531 256 695 947 34 495 65 244 527 259 696 951 67 496 66 245 525 261 697 952 69 497 67 246 524 278 698 969 53 498 71 247 523 282 699 970 56 499 72 250 566 288 700 971 57 500 73 251 526 292 701 972 45 508 74 252 528 295 702 973 48 509 75 253 529 297 703 974 71 510 77 254 300 977 77 511 87 259 329 980 43 512 260 331 981 261 334 - 186 Tabla 36. Estadística descriptiva de las variables físico-químicas del agua (AS=agua de superficie, CM=capa de mezcla y AF=agua de fondo) comparadas entre el primer y segundo período de estudio. VERANO OTOÑO INVIERNO OTOÑO INVIERNO PRIMAVERA VERANO Variables Valores PRIMAVERA 1999 “P99” n =12 2000 “V00” n =11 2000 “O00” n = 13 2000 “I00” n=9 2001 “O01” n =13 2001 “I01” n =9 2001 “P01” n =12 2002 “V02” n =11 Test de Kruskal Wallis T (ºC) AF mínimo máximo Promedio Desv. estand. 8,25 11,43 9,20 0,83 8,41 15,37 11,48 2,41 8,94 11,86 10,31 1,18 5,66 8,00 7,22 0,80 6,16 7,64 6,97 0,58 7,23 11,41 8,75 1,19 7,96 15,21 10,91 2,61 O00-O01 ns I00-I01 ns P99-P01 ns V00-V02 ns S (ups) AF mínimo máximo Promedio Desv. estand. 33,255 33,644 33,559 0,10 33,301 33,637 33,503 0,11 33,176 33,652 33,479 0,14 33,074 33,773 33,466 0,21 33,344 33,826 33,554 0,13 33,226 33,597 33,430 0,14 33,220 33,562 33,455 0,11 33,390 33,567 33,486 0,06 O00-O01 ns I00-I01 ns P99-P01 ns V00-V02 ns D (kg/m3) AF mínimo máximo Promedio Desv. estand. 25,469 26,127 25,955 0,20 24,681 26,128 25,498 0,53 25,297 26,083 25,710 0,28 26,054 26,343 26,176 0,08 25,394 26,185 25,914 0,30 26,103 26,253 26,185 0,04 25,323 26,238 25,941 0,27 24,708 26,155 25,587 0,51 O00-O01 ns I00-I01 ns P99-P01 ns V00-V02 ns O (mlO2/l) AF mínimo máximo Promedio Desv. estand. 5,02 6,42 5,75 0,48 2,57 6,43 5,00 1,00 2,49 5,99 4,44 1,47 6,40 6,82 6,58 0,15 2,84 6,03 3,97 1,36 6,54 7,33 6,82 0,28 5,37 6,66 5,70 0,30 3,67 5,89 4,54 0,70 O00-O01 ns I00-I01 ns P99-P01 ns V00-V02 ns Cl a (mg/m3) AS mínimo máximo Promedio Desv. estand. 0,10 2,21 0,66 0,54 0,18 2,37 0,86 0,63 0,52 3,38 1,14 0,81 0,43 0,94 0,57 0,14 0,31 2,25 1,04 0,57 0,46 2,33 1,09 0,67 0,31 8,72 2,07 2,24 0,13 2,57 0,84 0,63 O00-O01 ns I00-I01 ns P99-P01 ** V00-V02 ns Cl a (mg/m3) CM mínimo máximo Promedio Desv. estand. 0,28 1,08 0,65 0,32 0,39 1,35 0,76 0,33 3,05 0,96 1,10 0,36 1,06 0,17 0,78 0,62 2,33 0,64 1,03 0,06 7,65 2,44 2,81 0,98 11,66 3,46 3,61 0,53 0,61 0,18 0,30 0,12 O00-O01 ns I00-I01 ** P99-P01 ** V00-V02 ns Cl a (mg/m3) AF mínimo máximo Promedio Desv. estand. 0,06 1,01 0,31 0,27 0,23 2,16 0,70 0,63 0,07 2,11 0,54 0,55 0,39 1,22 0,67 0,26 0,03 0,93 0,23 0,29 0,74 4,40 1,76 1,25 0,03 2,64 0,68 0,88 0,03 2,92 0,43 0,85 O00-O01 ns I00-I01 ** P99-P01 ns V00-V02 ns 8,07 11,69 9,38 1,46 *0,01< P < 0,05 - ** P < 0,01 – ns P > 0,05 187 Tabla 37. Estadística descriptiva de las variables químicas de los sedimentos comparadas entre el primer y segundo período de estudio. PRIMAVERA Variables MOT (%) COT (%) NT (%) C:N FT (%) Cl a (S) (μg/g) Feop (S) (μg/g) VERANO OTOÑO INVIERNO OTOÑO INVIERNO PRIMAVERA VERANO 1999 “P99” n =12 2000 “V00” n =11 2000 “O00” n = 13 2000 “I00” n=9 2001 “O01” n =13 2001 “I01” n =9 2001 “P01” n =12 2002 “V02” n =11 mínimo máximo Promedio Desv. estand. 0,73 9,48 5,75 2,88 1,04 9,60 4,87 3,16 1,75 9,29 5,45 2,30 2,01 12,85 7,04 4,21 2,94 9,24 5,79 2,20 1,66 9,03 5,66 2,90 1,91 9,59 5,53 2,04 1,96 10,24 5,68 2,65 O00-O01 ns I00-I01 ns P99-P01 ns V00-V02 ns mínimo máximo Promedio Desv. estand. 0,33 2,74 1,33 0,63 0,42 3,17 1,44 0,93 0,30 2,16 1,25 0,64 0,42 2,23 1,36 0,85 0,80 2,35 1,42 0,57 0,30 2,07 1,30 0,69 0,28 2,16 1,18 0,60 0,29 2,36 1,27 0,75 O00-O01 ns I00-I01 ns P99-P01 ns V00-V02 ns mínimo máximo Promedio Desv. estand. 0,03 0,24 0,13 0,07 0,01 0,16 0,08 0,06 0,04 0,40 0,17 0,11 0,10 0,31 0,19 0,07 0,10 0,32 0,19 0,09 0,07 0,36 0,19 0,11 0,05 0,51 0,22 0,13 0,11 0,26 0,19 0,06 O00-O01 ns I00-I01 ** P99-P01 ** V00-V02 ** mínimo máximo Promedio Desv. estand. 3,43 20,29 11,19 3,56 11,45 69,48 28,11 18,66 4,97 17,13 8,10 3,43 2,89 10,86 6,61 3,02 3,95 20,13 8,61 4,26 3,89 11,10 6,79 2,44 2,06 11,98 6,36 2,82 1,20 11,88 6,94 3,69 O00-O01 ** I00-I01 ns P99-P01 ns V00-V02 ** - - - - 0,058 0,072 0,064 0,005 0,004 0,068 0,050 0,030 0,036 0,058 0,047 0,007 0,016 0,071 0,040 0,014 P00-P01 ns V01-V02 ns mínimo máximo Promedio Desv. estand. 0,01 0,81 0,24 0,25 0,05 1,35 0,35 0,36 0,02 1,62 0,41 0,44 0,22 1,87 1,04 0,55 0,39 1,79 1,02 0,40 0,92 8,65 2,29 2,40 0,50 8,27 2,75 2,03 0,49 3,09 1,72 0,81 O00-O01 ns I00-I01 ** P99-P01 ** V00-V02 ** mínimo máximo Promedio Desv. estand. 0,24 34,06 11,69 10,48 1,15 21,62 9,58 6,10 3,70 24,51 11,08 6,45 5,46 33,57 16,69 10,02 10,90 40,99 24,20 10,42 13,56 33,39 23,26 8,17 11,92 60,53 29,90 14,96 5,07 34,57 17,92 10,03 O00-O01 ** I00-I01 ** P00-P01 ** V01-V02 ns Valores mínimo máximo Promedio Desv. estand. Test de Kruskal Wallis *0,01< P < 0,05 - ** P < 0,01 – ns P > 0,05 188 FIGURAS 189 A B Figura 1. A. Imagen satelital del Golfo San Jorge y resto del litoral patagónico. B. Batimetría del Golfo San Jorge (De La Garza, 2003). 190 Limitaciones Concepción de la Investigación (Objetivos) Elección Datos inutilizados Nuevas hipótesis Análisis de los datos Tratamiento numérico planificación del muestreo Muestreo Determinaciones en el Laboratorio Imaginación – Intuición Conclusiones Interpretación de resultados Figura 2. Esquema de la interrelación entre las diferentes fases de investigación en ecología e importancia de la planificación del muestreo (Legendre & Legendre, 1979). 191 Primavera de 1999 - invierno de 2000 Golfo San Jorge en su totalidad 26 a 39 estaciones SEDIMENTOS Variables físico- químicas AGUA DE FONDO Temperatura, salinidad, densidad, concentración de oxígeno disuelto y concentración de clorofila a BENTOS Parámetros estructurales de las comunidades bentónicas Otoño de 2001 – verano de 2002 Principales áreas de concentración del recurso langostino en el Golfo San Jorge 17 a 20 estaciones SEDIMENTOS Variables químicas AGUA DE FONDO Temperatura, salinidad, densidad, concentración de oxígeno disuelto y concentración de clorofila a Invierno de 2003 Área del GSJ donde se localizan las mayores concentraciones de langostino 46 estaciones SEDIMENTOS Variables físico-químicas AGUA DE FONDO Temperatura, salinidad, densidad, concentración de oxígeno disuelto y concentración de clorofila a. LANGOSTINO Parámetros poblacionales . Figura 3. Esquemas de los procedimientos de muestreo utilizados en el presente estudio. 192 C° Dos Bahías 45 13 12 1 2 LATITUD (ºS) 28 26 23 33 90 m 25 34 35 24 39 36 38 37 SANTA CRUZ 32 27 21 22 47 29 20 6 30 19 7 31 18 8 80 m 17 9 5 16 10 4 46 15 11 3 CHUBUT 14 C° Tres Puntas 50 m 68 67 66 65 LONGITUD (ºW) Figura 4. Primer período de estudio. Ubicación de las estaciones generales de muestreo codificadas y localización de la transección seleccionada para la representación de los perfiles verticales de temperatura, salinidad y densidad. 193 A B C Figura 5. Operación de muestreo con extractor de gravedad Phleger. A: extractor de gravedad Phleger, B: izado del instrumental y C: tratamiento a bordo de la muestra obtenida. 194 Figura 6. Rastra tipo Picard. 195 Figura 7. CTD “SBE” (Sea-Bird Electronic) Modelo XIX, utilizado para la obtención de los datos de temperatura, salinidad y densidad, con fluorómetro (Sea point Chlorophyll Fluorometer) adosado, para la determinación “in situ “ de los perfiles verticales de fluorescencia del fitoplancton “in vivo”. Figura 8. Botellas tipo Niskin, para la obtención de muestras de agua a diferentes profundidades. 196 45 352 CHUBUT 16 17 353 20 19 18 LATITUD (ºS) 350 15 14 342 13 339 46 12 334 11 331 297 5 278 4 261 6 7 282 259 3 256 8 47 SANTA CRUZ 2 329 10 295 300 9 292 288 1 Estaciones generales de la campaña de otoño de 2001 Código de las estaciones generales de las campañas de invierno y primavera de 2001 y verano de 2002 68 67 66 65 LONGITUD (ºW) Figura 9. Segundo período de estudio. Ubicación de las estaciones generales de muestreo y localización de la transección seleccionada para la representación de los perfiles verticales de temperatura, salinidad y densidad. 197 C° Dos Bahías 45 LATITUD (ºS) CHUBUT 144 46 142 140 138 137 129 47 169 170 131 114 115 148 134 147 151 149 130 132 117 135 133 152 150 116 127 120 126 123 122 98 153 119118 12512499 109 110 100 107 155102 101 111 106 112 103 104 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 10. Tercer período de estudio. Ubicación de las estaciones generales de muestreo y localización de la transección seleccionada para la representación de los perfiles verticales de temperatura, salinidad y densidad. 198 Figura 11. Red tangonera convencional. 199 A B Figura 12. Muestreo de langostino. A: separación por sexo y B: medición del largo de caparazón. 200 Primavera de 1999 - invierno de 2000 Golfo San Jorge en su totalidad Datos Brutos _____ Datos estandarizados ______ Matriz similitud _______ CLASIFICACIÓN factores físico - químicos 39 estaciones en primavera de 1999 26 estaciones en verano de 2000 37 estaciones en otoño de 2000 29 estaciones en invierno de 2000 Datos Brutos ORDENACIÓN (ACP) _____ Datos transformados ______Matriz similitud _______ CLASIFICACIÓN factores biológicos (comunidad bentónica) 36 estaciones en otoño de 2000 ORDENACIÓN (AC) Otoño de 2001 – verano de 2002 Principales áreas de concentración del recurso langostino en el Golfo San Jorge Datos Brutos _____ Datos estandarizados ______ Matriz similitud _______ CLASIFICACIÓN factores físico - químicos 17 estaciones en otoño de 2001 19 estaciones en invierno de 2001 20 estaciones en primavera de 2001 20 estaciones en verano de 2002 ORDENACIÓN (ACP) Invierno de 2003 Área del GSJ donde se localizan las mayores concentraciones de langostino Datos Brutos _____ Datos estandarizados ______ Matriz similitud _______ CLASIFICACIÓN factores físico-químicos 46 estaciones en invierno de 2003 Datos Brutos ORDENACIÓN (ACP) _____ Datos transformados ______Matriz similitud ________ CLASIFICACIÓN factores biológicos (Recurso langostino) 46 estaciones en invierno de 2003 ORDENACIÓN (AC) (ACC) Figura 13. Esquematización de los pasos seguidos en el análisis multivariante. ACP (Análisis de Componentes Principales), AC (Análisis de Correspondencia) y ACC (Análisis de Correlación Canónica). 201 FIGURAS PRIMER PERÍODO DE ESTUDIO PRIMAVERA DE 1999 – INVIERNO DE 2000 202 0 510 509 Estaciones 507 506 508 505 504 501 0 65 Prof. (m) Prof. (m) 40 60 Estaciones 78 86 88 40 60 45 80 80 100 100 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) 71 20 20 45 66 47 PRIMAVERA 1999 Temperatura (ºC) VERANO 2000 Temperatura (ºC) 68 67 0 245 246 Estaciones 259 258 255 66 256 68 67 0 525 257 566 Estaciones 567 568 66 569 570 571 20 Prof. (m) 20 Prof. (m) 526 40 60 45 45 40 60 80 80 100 100 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 INVIERNO 2000 Temperatura (ºC) OTOÑO 2000 Temperatura (ºC) 68 67 68 66 67 66 LONGITUD (ºW) 6 7 8 9 10 11 12 13 14 15 16 (ºC) Figura 14. Distribución horizontal de la temperatura (ºC) del agua de fondo y perfil vertical de la columna de agua en el Golfo San Jorge. 203 TEMPERATURA DEL AGUA DE FONDO SALINIDAD DEL AGUA DE FONDO 16 33.800 15 33.750 14 33.700 13 33.650 12 ups (ºC) 33.600 11 33.550 10 33.500 9 33.450 8 33.400 7 6 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media 33.350 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 DENSIDAD DEL AGUA DE FONDO ± D. E. ± E. S. Media CONCENTRACION DE OXIGENO EN EL AGUA DE FONDO 26.60 7 26.40 6 26.20 5 26.00 4 ml/l kg/m3 25.80 25.60 3 25.40 2 25.20 1 25.00 24.80 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media 0 PRIMAVERA 1999 VERANO 2000 OTOÑO 2000 INVIERNO 2000 ± D.E. ± E.E. Media Figura 15. Valores medios e intervalos de confianza (95 %) de las variables físico – químicas del agua de fondo, en el Golfo San Jorge. 204 0 510 509 508 Estaciones 507 506 505 504 0 65 501 Prof. (m) Prof. (m) 40 60 Estaciones 78 86 88 40 60 45 80 80 100 100 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 LATITUD (ºS) 71 20 20 45 66 PRIMAVERA 1999 Salinidad (ups) 68 VERANO 2000 Salinidad (ups) 67 0 245 246 Estaciones 259 258 255 66 256 68 67 0 525 257 Prof. (m) Prof. (m) 566 Estaciones 567 568 66 569 570 571 20 20 45 526 40 60 45 40 60 80 80 100 100 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 INVIERNO 2000 Salinidad (ups) OTOÑO 2000 Salinidad (ups) 68 67 66 68 67 66 LONGITUD (ºW) 33.05 33.15 33.25 33.35 33.45 33.55 33.65 33.75 (ups) Figura 16. Distribución horizontal de la salinidad (ups) del agua de fondo y perfil vertical de la columna de agua, en el Golfo San Jorge. 205 Estaciones Estaciones 0 510 509 508 507 506 505 504 0 501 20 Prof. (m) Prof. (m) 20 40 60 45 45 65 65 65 65 65 65 65 65 65 65 65 65 65 65 65 65 65 65 66 71 78 88 86 40 60 80 80 100 100 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) 47 VERANO 2000 Densidad PRIMAVERA 1999 Densidad 68 67 68 66 67 0 246 259 258 255 256 0 257 525 526 566 567 568 569 570 571 20 Prof. (m) 20 Prof. (m) 66 Estaciones Estaciones 245 40 60 45 45 40 60 80 80 100 100 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 INVIERNO 2000 Densidad OTOÑO 2000 Densidad 68 67 66 68 67 66 LONGITUD (ºW) 24.5 24.8 25.0 25.3 25.5 25.8 26.0 26.3 26.5 (kg/m3) Figura 17. Distribución horizontal de la densidad (kg/m3) del agua de fondo y perfil vertical de la columna de agua, en el Golfo San Jorge. 206 PRIMAVERA 1999 Contenido de oxígeno (ml/l) VERANO 2000 Contenido de ox;igeno (ml/l) 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ LATITUD (ºS) 47 47 68 67 66 68 OTOÑO 2000 Contenido de oxígeno (ml/l) 67 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 68 66 INVIERNO 2000 Contenido de oxígeno (ml/l) 67 68 66 67 66 LONGITUD (ºW) 2.0 3.0 4.0 5.0 6.0 7.0 (ml O2/l) Figura 18. Distribución horizontal de la concentración de oxígeno en ml O2/l del agua de fondo en el Golfo San Jorge. 207 PRIMAVERA 1999 Agua de fondo Clorofila a (mg/m3) Clorofila a (mg/m3) VERANO 2000 Agua de fondo Clorofila a (mg/m3) Clorofila a (mg/m3) 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) 47 68 67 68 66 OTOÑO 2000 Agua deafondo Clorofila (mg/m3) Clorofila a (mg/m3) 67 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 68 66 INVIERNO 2000 Agua deafondo Clorofila (mg/m3) Clorofila a (mg/m3) 67 68 66 67 66 LONGITUD (ºW) 0.2 0.5 0.8 1.1 1.4 1.7 3 (mg/m ) Figura 19. Distribución horizontal de la concentración de clorofila a (mg/m3) del agua de fondo en el Golfo San Jorge. 208 CLOROFILA a EN AGUA SUPERFICIAL 2.0 mg.m-3 1.5 1.0 0.5 0.0 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media CLOROFILA a EN CAPA DE MEZCLA 2.0 mg.m-3 1.5 1.0 0.5 0.0 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media CLOROFILA a EN AGUA DE FONDO 2.0 mg.m-3 1.5 1.0 0.5 0.0 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media Figura 20. Valores medios e intervalos de confianza (95 %) de las variables clorofila a en agua de superficie, capa de mezcla y agua de fondo, en el Golfo San Jorge. 209 Cº Dos Bahías Cº Tres Puntas 100 80 60 40 20 GRAVA Y ARENA 0 20 40 60 80 100 120 LIMO Y ARCILLA Figura 21. Porcentaje en peso de las fracciones granulométricas de los sedimentos superficiales del Golfo San Jorge. 210 ARGENTINA - GOLFO SAN JORGE C° Dos Bahías -45.00 CHUBUT 529 531 C° Aristizabal 528 526 525 -45.50 LATITUD (ºS) -46.00 C. Rivadavia 517 503 518 522 505 506 512 499 498 508 511 511 500 507 513 -46.50 504 515 514 521 501 516 519 520 509 497 510 -47.00 502 527 524 523 530 76 496 74 75 SANTA CRUZ C° Tres Puntas Grava CAMPAÑA OB-06/99 - NOVIEMBRE DE 1999 Arena Limo- ENERO DE 2000 CAMPAÑA OB-01/00 -68.00 -67.50 -67.00 -66.50 LONGITUD (ºW) -66.00 -65.50 Figura 22. Porcentaje en peso de los componentes granulométricos grava, arena, limo y arcilla de los sedimentos superficiales del Golfo San Jorge. 211 LATITUD (ºS) 45 C° Dos Bahías CHUBUT 46 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) grava grava arenosa arena gravosa limo arenoso limo arcilloso arena limosa limo arcilla limosa Figura 23. Distribución de los distintos tipos sedimentarios del Golfo San Jorge. 212 MEDIA GRANULOMÉTRICA C° Dos Bahías 45 CHUBUT 4 0.5 1.5 1.0 2 2.5 3.9 3.5 3 5 6 6 -LIMO FINO 5 -LIMO MEDIO LATITUD (ºS) 3.5 4 - LIMO GRUESO 46 3.9 6 4 3,5 - ARENA M. FINA 5 4 5 3 - ARENA FINA 2,5 - ARENA FINA 3.5 3.9 3 2 - ARENA MEDIANA 6 2.5 47 3,9 - ARENA MUY FINA 1,5 - ARENA MEDIANA 2 1 - ARENA GRUESA 1.5 0,5 - ARENA GRUESA SANTA CRUZ 1 0 - ARENA M. GRUESA C° Tres Puntas 68 67 66 LONGITUD (ºW) Figura 24. Distribución de la media granulométrica de los sedimentos superficiales del Golfo San Jorge (en unidades Φ). 213 SELECCIÓN C° Dos Bahías 45 CHUBUT 2.6 MUY POBREMENTE SELECCIONADO LATITUD (ºS) 2.0 POBREMENTE SELECCIONADO 46 1.4 MODERADAMENTE SELECCIONADO 0.8 47 SANTA CRUZ C° Tres Puntas 68 67 66 LONGITUD (ºW) Figura 25. Distribución del grado de selección de los sedimentos superficiales del Golfo San Jorge (en unidades Φ). 214 ASIMETRIA C° Dos Bahías 45 CHUBUT 1.0 MUY POSITIVA LATITUD (ºS) 0.3 POSITIVA 46 0.1 CERCANAMENTE SIMETRICA -0.1 0.1 NEGATIVA - 0.1 -0.3 47 SANTA CRUZ C° Tres Puntas 68 67 66 LONGITUD (ºW) Figura 26. Distribución de la asimetría de los sedimentos superficiales del Golfo San Jorge (en unidades Φ). 215 PRIMAVERA 1999 Materia orgánica total (%) VERANO 2000 Materia orgánica total (%) 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ LATITUD (ºS) 47 47 68 67 66 68 66 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 68 67 INVIERNO 2000 Materia orgánica total (%) OTOÑO 2000 Materia orgánica total (%) 47 67 66 68 67 66 LONGITUD (ºW) 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 (%) Figura 27. Distribución horizontal de la materia orgánica total (%) de los sedimentos superficiales en el Golfo San Jorge. 216 MATERIA ORGANICA TOTAL EN SEDIMENTOS CARBONO ORGANICO TOTAL EN SEDIMENTOS 14 3.5 12 3.0 10 2.5 8 2.0 (%) 4.0 (%) 16 6 1.5 4 1.0 2 0.5 0 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media ± D.E. ± E.E. Media 0.0 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 NITROGENO TOTAL EN SEDIMENTOS RELACIÓN CARBONO / NITRÓGENO 0.6 40 35 0.5 30 0.4 0.3 C:N (%) 25 20 15 0.2 10 0.1 5 0.0 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 CLOROFILA a EN SEDIMENTOS FEOPIGMENTOS EN SEDIMENTOS 3.2 55 2.6 45 2.0 35 1.4 25 ug/g ug/g ± D.E. ± E.E. Media 0 15 0.8 0.2 5 -0.4 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 ± D.E. ± E.E. Media ± D.E. ± E.E. Media -5 PRIMAVERA 1999 OTOÑO 2000 VERANO 2000 INVIERNO 2000 Figura 28 . Valores medios e intervalos de confianza (95 %) de las variables químicas de los sedimentos superficiales en el Golfo San Jorge. 217 VERANO 2000 Carbono orgánico total (%) PRIMAVERA 1999 Carbono orgánico total (%) 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) 47 68 67 68 66 67 INVIERNO 2000 Carbono orgánico total (%) OTOÑO 2000 Carbono orgánico total (%) 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 68 66 67 68 66 0.2 67 66 LONGITUD (ºW) 0.6 1.0 1.4 1.8 2.2 2.6 3.0 3.4 (%) Figura 29. Distribución horizontal de carbono orgánico total (%) de los sedimentos superficiales en el Golfo San Jorge. 218 PRIMAVERA 1999 Nitrógeno total (%) VERANO 2000 Nitrógeno total (%) 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) 47 68 67 68 66 67 INVIERNO 2000 Nitrógeno total (%) OTOÑO 2000 Nitrógeno total (%) 45 45 CHUBUT CHUBUT 46 46 47 68 66 SANTA CRUZ SANTA CRUZ 47 67 68 66 67 66 LONGITUD (ºW) 0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 (%) Figura 30. Distribución horizontal de nitrógeno total (%) de los sedimentos superficiales en el Golfo San Jorge. 219 VERANO 2000 Relación Carbono:Nitrógeno PRIMAVERA 1999 Relación Carbono:Nitrógeno 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) 47 68 67 68 66 67 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 68 66 INVIERNO 2000 Relación Carbono:Nitrógeno OTOÑO 2000 Relación Carbono:Nitrógeno 67 68 66 67 66 LONGITUD (ºW) 2 8 14 20 26 32 38 44 50 56 (C:N) Figura 31. Distribución horizontal de la relación carbono-nitrógeno de los sedimentos superficiales en el Golfo San Jorge. 220 PRIMAVERA 1999 Clorofila a VERANO 2000 Clorofila a 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) 47 68 67 68 66 66 67 66 INVIERNO 2000 Clorofila a OTOÑO 2000 Clorofila a 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 68 67 67 68 66 LONGITUD (ºW) 0.1 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 (μg/g) Figura 32. Distribución horizontal de la concentración de clorofila a (μg/g) de los sedimentos superficiales en el Golfo San Jorge. 221 PRIMAVERA 1999 Feopigmentos VERANO 2000 Feopigmentos -45 45 CHUBUT CHUBUT -46 46 SANTA CRUZ SANTA CRUZ 47 LATITUD (ºS) -47 68 67 68 66 OTOÑO 2000 Feopigmentos 67 45 45 CHUBUT CHUBUT 46 46 SANTA CRUZ SANTA CRUZ 47 47 68 66 INVIERNO 2000 Feopigmentos 67 68 66 67 66 LONGITUD (ºW) 0 10 20 30 40 50 60 70 80 90 (μg/g) Figura 33. Distribución horizontal de la concentración de feopigmentos (μg/g) de los sedimentos superficiales en el Golfo San Jorge. 222 PRIMAVERA 1999 G phi -2 C Cl a (AF) AF phi 3 O T AMG phi 0 AG phi 1 AG phi 0.5 AF phi 2.5 G phi -1.5 AMG phi -1 AMG phi -0.5 AM phi 1.5 AM phi 2 AMF phi 3.5 AMF phi 3.9 Cl a (S) LG phi 4 Feop (S) LM phi 5 P S D C:N LF phi 6 LMF phi 7 ArM phi 9 ArF MF phi 10 ArG phi 8 MOT COT NT 1 2 0 25 50 75 100 DISIMILITUD VERANO 2000 G phi -2 AMG phi -0.5 AMG phi 0 AG phi 0.5 AG phi 1 C:N Cl a (AF) AF phi 2.5 C G phi -1.5 AMG phi -1 AM phi 2 AM phi 1.5 AF phi 3 O T AMF phi 3.5 AMF phi 3.9 LG phi 4 LM phi 5 LF phi 6 P S D MOT COT NT LMF phi 7 ArM phi 9 ArF MF phi 10 ArG phi 8 Cl a (S) Feop (S) 1 2 0 25 50 75 100 75 100 DISIMILITUD OTOÑO 2000 G phi -2 C AMG phi 0 AG phi 1 AG phi 0.5 G phi -1.5 AMG phi -1 AM phi 2 AM phi 1.5 AMG phi -0.5 C:N AF phi 2.5 AF phi 3 O T Cl a (AF) AMF phi 3.5 AMF phi 3.9 LG phi 4 LM phi 5 S Cl a (S) Feop (S) LF phi 6 MOT NT COT P D LMF phi 7 ArM phi 9 ArF Mf phi 10 ArG phi 8 1 2 0 25 50 75 100 DISIMILITUD INVIERNO 2000 G phi -2 AG phi 1 AMG phi 0 AG phi 0.5 AMG phi -0.5 C G phi -1.5 AMG phi -1 AM phi 2 AM phi 1.5 AF phi 2.5 AF phi 3 C:N AMF phi 3.5 AMF phi 3.9 LG phi 4 LM phi 5 P S D O Cl a (AF) LF phi 6 T MOT COT NT Cl a (S) Feop (S) LMF phi 7 ArM phi 9 ArF MF phi 10 ArG phi 8 1 2 0 25 50 DISIMILITUD Figura 34. Análisis de agrupamiento entre las variables físico-químicas. Bray-Curtis, UPGMA. 223 PRIMAVERA 1999 2 3 1 493 523 495 531 494 496 497 498 499 500 522 524 526 529 511 501 528 506 504 527 516 530 502 509 510 512 503 520 521 505 517 508 513 519 514 515 518 525 507 0 20 40 60 80 100 DISIMILITUD VERANO 2000 3 1 2 64 72 87 77 73 91 74 65 66 90 88 67 68 70 69 79 89 71 85 80 84 86 78 92 75 76 0 20 40 60 80 100 80 100 DISIMILITUD OTOÑO 2000 1 3 2 243 245 246 256 267 277 278 255 257 265 258 260 263 275 264 259 261 262 268 269 271 266 270 244 247 251 252 253 254 272 274 276 249 248 273 249 250 0 20 40 60 80 100 DISIMILITUD INVIERNO 2000 1 3 2 522 565 566 570 553 563 564 561 554 569 558 568 571 556 562 528 529 559 567 555 557 560 523 526 525 524 527 530 531 0 20 40 60 DISIMILITUD Figura 35. Análisis de agrupamiento entre las estaciones de muestreo. Bray-Curtis, UPGMA. 224 PRIMAVERA 1999 1.0 0.8 NT 0.6 0.4 2 0.5 1 0 1.5 C - 0.5 - -2-11.5 98 10 MOT 7 COT 6 P 2.5 Cl a (AF) Factor 2 0.2 O Feop (S) T 0.0 D Cl a (S) S 5 C:N 3 -0.2 4 -0.4 -0.6 3.5 -0.8 -1.0 -1.0 -0.8 -0.6 -0.4 -0.2 3.9 0.0 0.2 0.4 0.6 0.8 1.0 Factor 1 VERANO 2000 1.0 3.5 3.9 0.8 0.6 OT 0.4 Factor 2 0.2 0.0 -0.2 -0.4 Cl a (S) Feop(S) 6 Cl a (AF) C:N -1.5 1.5 C2.5 -0.52 1 00.5 7 S P 10 D NT MOT COT -0.6 -0.8 -1.0 -1.0 -0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 Factor 1 OTOÑ0 2000 1.0 0.8 0.6 0.4 -0.5 2 1 00.5 -1.5 1.5 -2 C:N C Factor 2 0.2 8 COT 10 NT MOT 79 6 P D Cl a (S) Feop (S) 2.5 0.0 5 -0.2 4 Cl a (AF) O T 3 S -0.4 -0.6 3.5 3.9 -0.8 -1.0 -1.0 -0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 Factor 1 INVIERNO 2000 1.0 0.8 0.6 0.4 Cl a (S) 2.5 -0.52 1.5 1 -1.5 00.5 C O 0.2 Factor 2 Feop S) NT Cl a (AF) 10 6 9 7 PCOT MOT D S T 0.0 C:N -0.2 -0.4 -0.6 3.5 3.9 -0.8 -1.0 -1.0 -0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 Factor 1 Figura 36. Análisis de Componentes Principales entre las variables físico-químicas. 225 PRIMAVERA 1999 3 2 493 494 523 531 Factor 2 1 501 - 502 - 503 504 - 505 - 506 508 - 509 - 510 512 - 513 - 514 515 - 516 - 517 518 - 519 - 520 521 - 525 - 527 528 2 530 0 -1 496 - 497 498 - 499 500 - 507 511 - 522 524 - 526 529 495 -2 -3 -3.5 -2.5 -1.5 -0.5 1 3 0.5 1.5 2.5 3.5 Factor 1 VERANO 2000 3 64 2 74 72 - 73 77 - 87 91 Factor 2 1 3 65 - 66 - 67 68 - 69 - 70 71 - 78 - 79 80 - 84 - 85 86 - 88 - 89 90 0 92 -1 75 76 1 2 -2 -3 -3.5 -2.5 -1.5 -0.5 0.5 1.5 2.5 3.5 2.5 3.5 Factor 1 OTOÑO 2000 3 249 250 2 2 243 - 245 - 246 255 - 256 - 257 258 - 259 - 260 261 - 262 - 263 264 - 265 - 266 267 - 268 - 269 270 - 271 - 275 277 - 278 273 0 244 - 247 248 - 251 252 - 253 254 - 272 274 - 276 279 -1 -2 -3 -3.5 -2.5 -1.5 -0.5 1 3 0.5 1.5 2.5 3.5 Factor 1 INVIERNO 2000 3 2 530 531 2 522 - 523 - 524 525 - 526 - 553 554 - 555 - 556 557 - 558 - 560 561 - 562 - 563 564 - 565 - 566 567 - 568 - 569 570 - 571 1 Factor 2 Factor 2 1 0 525 527 528 529 559 -1 1 3 -2 -3 -3.5 -2.5 -1.5 -0.5 0.5 1.5 Factor 1 Figura 37. Análisis de Componentes Principales entre las estaciones de muestreo. 226 45 CHUBUT C° Dos Bahías LATITUD (ºS) C° Aristizabal 46 47 SANTA CRUZ C° Tres Puntas SECTOR 1 SECTOR 2 SECTOR 3 68 67 66 LONGITUD (ºW) Figura 38. Sectores definidos de acuerdo al Análisis Multivariante, en el Golfo San Jorge. 227 C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 36000 SANTA CRUZ 47 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 39. Distribución de la densidad faunística (individuos/0,00025 mn2) de los grupos taxonómicos considerados en conjunto: Poliquetos, Moluscos, Crustáceos y Equidonerdos en el Golfo San Jorge. 25000.0 Densidad 20000.0 15000.0 10000.0 5000.0 0.0 Estaciones Poliquetos Moluscos Crustáceos Equinodermos Figura 40. Densidad faunística (individuos/0,00025 mn2) de los grupos taxonómicos considerados por estación de muestreo, en el Golfo San Jorge. 228 LATITUD (ºS) 45 C° Dos Bahías CHUBUT 46 SANTA CRUZ 47 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 41. Distribución de la riqueza específica de los grupos taxonómicos considerados en conjunto: Poliquetos, Moluscos, Crustáceos y Equidonerdos, en el Golfo San Jorge. 8 Riqueza específica 7 6 5 4 3 2 1 0 Estaciones Equinodermos Poliquetos Moluscos Crustáceos Figura 42. Riqueza específica de los grupos taxonómicos considerados por estación de muestreo, en el Golfo San Jorge. 229 LATITUD (ºS) 45 C° Dos Bahías CHUBUT 46 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 43. Distribución de la diversidad de los grupos taxonómicos considerados en conjunto: Poliquetos, Moluscos, Crustáceos y Equidonerdos, en el Golfo San Jorge. 230 35.00 30.00 25.00 20.00 IR 15.00 arcilla limosa limo arcilloso limo limo arenoso arena limosa arena gravosa grava arenosa grava 10.00 5.00 0.00 S S OS MO OS R CO CE E S A ET D U T U L O N US LIQ MO UI CR PO EQ Figura 44. Importancia Relativa de los grupos faunísticos considerados, según los tipos sedimentarios en el Golfo San Jorge. 70.00 60.00 50.00 40.00 IR 30.00 20.00 10.00 arcilla limo sa limo arcillo s limo areno so limo areno so arena limo sa arena gravo sa grava areno sa grava Leanira quatref agesi Cistenides ehlersi Asy chis amphy gly pta Nucula puelcha Semirossia tenera Nuculana sulculata Ptery gosquilla armata Kennerley a patagonica Austropandalus gray i Peisos petrunkev itchi Munida subrugosa Callianassa brachy ophthalma Peltarion spinosulum Pseudechinus magellanicus 0.00 Figura 45. Importancia Relativa de las especies constantes, muy comunes y comunes según los tipos sedimentarios en el Golfo San Jorge. 231 100 3 2 2 CISTENIDES ASYCHIS PTERYGOSQUILLA LEANIRA CALLIANASSA PELTARION MUNIDA AUSTROPANDALUS PSEUDECHINUS NUCULANA NUCULA KENNERLEYA PEISOS OPHIURA TRYPILASTER PITAR MALLETIA LUMBRINEREIS GAMMARUS SEMIROSSIA DIPLASTERIAS SPHAEROMA EUNICE AUSTROCIDARIS MYTILUS ANTARCTURUS ALPHEUS SEROLIS CALLIOSTOMA PHOTINULA LIMATULA HEMIOEDEMA ARBACIA ZYGOCHLAMYS LITHODES CIROLANA PONTOCARIS OCTOPUS FALSILUNATIA LEUROCYCLUS ANISODORIS LOLIGO EURYPODIUS 100 271 243 266 272 252 279 247 244 248 249 250 251 260 261 276 257 259 270 262 269 253 254 265 258 255 264 267 273 275 278 263 268 246 277 245 256 Similitud Similitud 0 20 40 60 80 1 Figura 46. Análisis de agrupamiento de las especies de los grupos taxonómicos considerados, en el Golfo San Jorge. Bray-Curtis, UPGMA. 20 40 60 80 Estaciones 1 Figura 47. Análisis de agrupamiento de las estaciones de muestreo, en el Golfo San Jorge. Bray-Curtis, UPGMA. 232 Dimensión 2 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 -0.5 -1.0 -1.5 -2.0 -2.5 -3.0 -3.5 -4.0 -4.5 -1.5 E259 E263 E258 E268 E270 Callianassa Pseudechinus E265 E264 E254 E255 E267 E262 E258 Cistenides Gammarus E275 Leanira E273 E272Asychis Lumbrinereis Ophiura E252 E251 Kennerleya Nuculana E279 E249 Peisos Nucula E250 Falsilunatia Pterygosquilla E261 E247 E269 Pitar E278 Munida E257 E256 E245 E276 E244 Loligo Eurypodius Anisodoris Trypilaster Octopus Pontocaris Malletia Peltarion E277 E266 Cirolana Semirossia E246 Leurocyclus Calliostoma Austropandalus Photinula Lithodes Zygoclamys E271 E243 Serolis Diplasterias Arbacia Hemiodema Limatula Antarcturus Alpheus Austrocidaris Sphaeroma Mytilus Eunice -1.0 -0.5 0.0 0.5 1.0 1.5 Dimensión 1 Figura 48. Análisis de correspondencia entre las especies de los grupos taxonómicos considerados y las estaciones de muestreo, en el Golfo San Jorge. 233 Dimensión 2 5.0 4.5 4.0 3.5 Pseudechinus magellanicus, Gammarus sp, 3.0 Callianassa brachyophthalma, Munida subrugosa, Ophiura sp, Kennerleya patagonica, Nucula puelcha, Leanira quatrefagesi, Peisos petrunkevitchi, 2.5 Nuculana sulculata, Falsilunatia soluta, Pitar rostratus, Octopus tehuelchus, Anisodoris sp, 2.0 Lumbrinereis sp, Asychis amphiglypta. Eurypodius latreillei. 1.5 1.0 Callianassa Pseudechinus CistenidesLeanira Gammarus Asychis 0.5 Lumbrinereis Ophiura Kennerleya Nuculana Peisos Nucula Falsilunatia Pterygosquilla Pitar Munida 0.0 Eurypodius Anisodoris Loligo Trypilaster Octopus -0.5 Pontocaris Malletia Peltarion -1.0 Cirolana sp, Calliostoma modestulum, Austropandalus grayi, Photinula blackei, -1.5 Cirolana Lithodes santolla, Zygoclamys patagonicus,Serolis schytei, Diplasterias brandti, Semirossia -2.0 Austrocidaris canaliculata, Sphaeroma sp, Eunice magellanica, Cystenides ehlersi, Malletia cumingii, Mytilus platensis, Pterygosquilla armata armata, Antarcturus sp, Leurocyclus -2.5 Calliostoma Alphues puapeba, Pontocaris boschii, Limatula pigmaea,Hemiodema spectabilis, Austropandalus Photinula -3.0 Trypilaster phylippi, Arbacia dufresnii, Loligo gahi. Lithodes Zygoclamys -3.5 Serolis Diplasterias Arbacia Hemiodema Limatula Antarcturus Alpheus Austrocidaris Sphaeroma Mytilus Eunice -4.0 -4.5 -5.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 1.5 Dimensión 2 Dimensión 1 4.5 4.0 3.5 3.0 estaciones de la zona litoral 2.5 estaciones del (costa y extremo este correspondiente 2.0 interior del golfo al Cabo Tres Puntas) y del sector sudeste 1.5 del umbral del golfo. E259 1.0 E263 E258 E268 E270 E265 E264 E254 E255 E267 E262 E258 E275 E273 E272 0.5 E252 E279 E249 E251 E250 E261 E247 E269 E278 0.0 E257 E256 E245 E276 E244 -0.5 E277 -1.0 E266 -1.5 -2.0 E246 -2.5 estaciones aisladas ubicadas -3.0 en el sudoeste y norte del golfo E243E271 -3.5 -4.0 -4.5 -1.5 -1.0 -0.5 0.0 0.5 1.0 1.5 Dimensión 1 Figura 49 . Análisis de correspondencia entre las especies de los grupos taxonómicos considerados y las estaciones de muestreo, en el Golfo San Jorge, desglosado y ampliado para su mejor visualización. 234 LATITUD (ºS) 45 C° Dos Bahías CHUBUT Sector 1 46 Sector 3 Sector 2 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 50. Sectores definidos de acuerdo al Análisis Multivariante aplicado a los grupos taxonómicos considerados, en el Golfo San Jorge. 235 FIGURAS SEGUNDO PERÍODO DE ESTUDIO OTOÑO DE 2001 – VERANO DE 2002 236 0 Estaciones 250288 292 295 329 331 334 339 342350 0 50 Estaciones 696702703 704705 706707713 712 50 45 100 45 100 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 SANTA CRUZ 47 SANTA CRUZ INVIERNO 2001 Temperatura (ºC) OTOÑO 2001 Temperatura (ºC) 68 67 Estaciones 951947969 977980 981982983 984 0 66 65 68 67 Estaciones 0 67 69 70 77 43 78 79 80 985 50 45 711 81 66 65 66 65 82 50 45 100 100 CHUBUT CHUBUT 46 46 47 47 SANTA CRUZ VERANO 2002 Temperatura (ºC) PRIMAVERA 2001 Temperatura (ºC) 68 67 SANTA CRUZ 66 65 68 67 LONGITUD (ºW) Figura 51. Distribución horizontal de la temperatura (ºC) del agua de fondo y perfil vertical de la columna de agua, en el Golfo San Jorge. 237 TEMPERATURA EN AGUA DE FONDO SALINIDAD DEL AGUA DE FONDO 14 33.70 13 33.65 33.60 12 33.55 11 ups ºC 33.50 10 33.45 9 33.40 8 33.35 7 33.30 ± D.E. ± E.E. Media 6 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 33.25 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 ± D.E. ± E.E. Media CONCENTRACIÓN DE OXÍGENO EN EL AGUA DE FONDO DENSIDAD DEL AGUA DE FONDO 7.5 26.40 26.20 6.5 26.00 5.5 ml/l kg/m3 25.80 25.60 4.5 25.40 3.5 25.20 ± D.E. ± E.E. Media 25.00 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 2.5 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 ± D.E. ± E.E. Media CLOROFILA a EN AGUA 7 ± D.E. ± E.E. Media 6 5 mg/m3 4 3 2 1 0 OTOÑO 2001 INVIERNO 2001 PRIMAVERA 2001 VERANO 2002 -1 AS CM AF AS CM AF AS CM AF AS CM AF Figura 52. Valores medios e intervalos de confianza (95 %) de las variables temperatura, salinidad, densidad, concentración de oxígeno en agua de fondo y concentración de clorofila a en agua de superficie (AS), capa de mezcla (CM) y agua de fondo (AF), en el Golfo San Jorge. 238 Estaciones 0 250 288 292295 329 331 334 339 Estaciones 342350 0 50 45 696 702 703 704705 711 100 CHUBUT 46 46 47 LATITUD (ºS) 712 50 45 100 CHUBUT 47 SANTA CRUZ SANTA CRUZ INVIERNO 2001 Salinidad (ups) OTOÑO 2001 Salinidad (ups) 68 67 Estaciones 0 951 947 969 977980 981 982 983 984 0 33.4 66 68 65 65 -66 -65 Estaciones 3350 67 69 70 77 43 50 45 78 79 80 81 82 33.40 100 CHUBUT CHUBUT 46 46 47 SANTA CRUZ 67 SANTA CRUZ VERANO 2002 Salinidad (ups) PRIMAVERA 2001 Salinidad (ups) 68 66 33.60 100 47 67 0 985 50 45 706 707 713 66 65 -68 -67 LONGITUD (ºW) Figura 53. Distribución horizontal de la salinidad (ups) del agua de fondo y perfil vertical de la columna de agua, en el Golfo San Jorge. 239 INVIERNO 2001 Densidad OTOÑO 2001 Densidad 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 47 SANTA CRUZ 68 67 66 65 68 PRIMAVERA 2001 Densidad 66 65 66 65 45 CHUBUT CHUBUT 46 68 67 VERANO 2002 Densidad 45 47 SANTA CRUZ 46 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 LONGITUD (ºW) Figura 54. Distribución horizontal de la densidad (kg/m3) del agua de fondo en el Golfo San Jorge. 240 INVIERNO 2001 Contenido de oxígeno (ml/l) OTOÑO 2001 Contenido de oxígeno (ml/l) 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 68 67 SANTA CRUZ 47 SANTA CRUZ 66 65 68 67 45 45 CHUBUT CHUBUT 46 46 68 65 VERANO 2002 Contenido de oxígeno (ml/l) PRIMAVERA 2001 Contenido de oxígeno (ml/l) 47 66 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 66 65 LONGITUD (ºW) Figura 55. Distribución horizontal de la concentración de oxígeno en ml O2/l del agua de fondo, en el Golfo San Jorge. 241 OTOÑO 2001 Agua de fondo Clorofila a INVIERNO 2001 Agua de fondo Clorofila a 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 47 SANTA CRUZ 68 67 66 68 65 66 65 45 45 CHUBUT CHUBUT 46 46 68 67 4.00 VERANO 2002 Agua de fondo Clorofila a PRIMAVERA 2001 Agua de fondo Clorofila a 47 SANTA CRUZ 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 66 65 LONGITUD (ºW) Figura 56 Distribución horizontal de la concentración de clorofila a (mg/m3) del agua de fondo, en el Golfo San Jorge. 242 INVIERNO 2001 Materia orgánica total (%) OTOÑO 2001 Materia orgánica total (%) 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 47 SANTA CRUZ 68 67 66 65 68 PRIMAVERA 2001 Materia orgánica total (%) 66 65 66 65 45 CHUBUT CHUBUT 46 46 68 67 VERANO 2001 Materia orgánica total (%) 45 47 SANTA CRUZ 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 LONGITUD (ºW) Figura 57. Distribución horizontal de materia orgánica total (%) de los sedimentos superficiales en el Golfo San Jorge. 243 MATERIA ORGANICA TOTAL EN SEDIMENTOS CARBONO ORGÁNICO TOTAL EN SEDIMENTOS 2.8 7.5 2.4 6.5 2.0 5.5 1.6 4.5 1.2 3.5 0.8 % 8.5 OTOÑO 2001 ± D.E. ± D.E. ± E.E. Media 2.5 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 0.4 OTOÑO 2001 INVIERNO 2001 NITRÓGENO TOTAL EN SEDIMENTOS ± E.E. PRIMAVERA 2001 VERANO 2002 Media RELACIÓN CARBONO / NITRÓGENO EN SEDIMENTOS 13 0.36 0.32 11 0.28 0.24 9 % C:N 0.20 7 0.16 0.12 5 0.08 ± D.E. ± E.E. Media 0.04 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 3 OTOÑO 2001 FÓSFORO TOTAL EN SEDIMENTOS ± D.E. ± E.E. Media CLOROFILA a EN SEDIMENTOS 5 0.075 4 0.065 3 0.055 2 % ug/g 0.085 0.045 1 0.035 0 ± D.E. ± E.E. Media 0.025 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 -1 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 ± D.E. ± E.E. Media FEOPIGMENTOS EN SEDIMENTOS 45 40 35 ug/g 30 25 20 15 10 5 OTOÑO 2001 PRIMAVERA 2001 INVIERNO 2001 VERANO 2002 ± D.E. ± E.E. Media Figura 58. Valores medios e intervalos de confianza (95 %) de las variables químicas de los sedimentos superficiales en el Golfo San Jorge. 244 OTOÑO 2001 Carbono orgánico total (%) INVIERNO 2001 Carbono orgánico total (%) 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 47 SANTA CRUZ 68 67 66 65 SANTA CRUZ 68 PRIMAVERA 2001 Carbono orgánico total (%) 65 45 CHUBUT CHUBUT 46 46 68 66 VERANO 2002 Carbono orgánico total (%) 45 47 67 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 66 65 LONGITUD (ºW) Figura 59. Distribución horizontal de carbono orgánico total (%) de los sedimentos superficiales en el Golfo San Jorge. 245 INVIERNO 2001 Nitrógeno total (%) OTOÑO 2001 Nitrógeno total (%) 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 SANTA CRUZ 47 68 67 66 68 65 66 65 66 65 45 45 CHUBUT CHUBUT 46 46 68 67 VERANO 2002 Nitrógeno total (%) PRIMAVERA 2001 Nitrógeno total (%) 47 SANTA CRUZ 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 LONGITUD (ºW) Figura 60. Distribución horizontal de nitrógeno total (%) de los sedimentos superficiales en el Golfo San Jorge. 246 INVIERNO 2001 Relación Carbono:Nitrógeno OTOÑO 2001 Relación Carbono:Nitrógeno 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 47 SANTA CRUZ 68 67 66 65 68 66 65 45 45 CHUBUT CHUBUT 46 46 68 67 VERANO 2002 Relación Carbono:Nitrógeno PRIMAVERA 2001 Relación Carbono:Nitrógeno 47 SANTA CRUZ 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 66 65 LONGITUD (ºW) Figura 61. Distribución horizontal de la relación carbono-nitrógeno de los sedimentos superficiales, en el Golfo San Jorge. 247 INVIERNO 2001 Fósforo total (%) OTOÑO 2001 Fósforo total (%) 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 47 SANTA CRUZ 68 67 66 65 68 PRIMAVERA 2001 Fósforo total (%) 66 65 66 65 45 CHUBUT CHUBUT 46 46 68 67 VERANO 2002 Fósforo total (%) 45 47 SANTA CRUZ 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 LONGITUD (ºW) Figura 62. Distribución horizontal de fósforo total (%) de los sedimentos superficiales en el Golfo San Jorge. 248 INVIERNO 2001 Clorofila a OTOÑO 2001 Clorofila a 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 47 SANTA CRUZ 68 67 66 65 68 66 65 66 65 45 45 CHUBUT CHUBUT 46 46 68 67 8.00 VERANO 2002 Clorofila a PRIMAVERA 2001 Clorofila a 47 SANTA CRUZ SANTA CRUZ 67 47 8.00 66 65 SANTA CRUZ 68 67 LONGITUD (ºW) Figura 63. Distribución horizontal de la concentración de clorofila a (μg/g) de los sedimentos superficiales, en el Golfo San Jorge. 249 INVIERNO 2001 Feopigmentos OTOÑO 2001 Feopigmentos 45 45 CHUBUT CHUBUT 46 46 LATITUD (ºS) 47 SANTA CRUZ 68 67 10.00 66 47 65 68 66 65 45 45 CHUBUT CHUBUT 46 46 68 67 VERANO 2002 Feopigmentos PRIMAVERA 2001 Feopigmentos 47 SANTA CRUZ 47 SANTA CRUZ 67 66 65 SANTA CRUZ 68 67 66 65 LONGITUD (ºW) Figura 64. Distribución horizontal de la concentración de feopigmentos (μg/g) de los sedimentos superficiales, en el Golfo San Jorge. . 250 OTOÑO 2001 P S D 1 MOT COT NT PT Cl a (S) Feop (S) T O 2 Cl a (AF) C:N 0 20 40 60 80 100 120 DISIMILITUD INVIERNO 2001 P T S C:N 1 D MOT COT NT Feop (S) O 2 Cl a (S) Cl a (AF) PT 0 20 40 60 80 100 120 100 120 DISIMILITUD PRIMAVERA 2001 P S D 1 MOT COT Feop (S) NT PT T Cl a (AF) 2 Cl a (S) O C:N 0 20 40 60 80 100 120 DISIMILITUD VERANO 2002 P D MOT Feop (S) NT PT 1 Cl a (S) S COT C:N T 2 Cl a (AF) O 0 20 40 60 80 DISIMILITUD Figura 65. Análisis de agrupamiento entre las variables físico-químicas. Bray-Curtis, UPGMA. 251 OTOÑO 2001 3 2 1 E256 E288 E292 E331 E295 E329 E352 E259 E261 E278 E300 E350 E282 E339 E342 E297 E334 0 20 40 60 80 100 120 DISIMILITUD INVIERNO 2001 2 1 3 E695 E698 E696 E697 E708 E699 E701 E709 E700 E705 E702 E703 E707 E712 E713 E706 E710 E704 E711 0 20 40 60 80 100 120 80 100 120 DISIMILITUD PRIMAVERA 2001 3 1 2 E947 E969 E990 E984 E989 E980 E986 E981 E983 E985 E974 E977 E982 E988 E970 E973 E972 E951 E952 E971 0 20 40 60 80 100 120 DISIMILITUD VERANO 2001 2 3 1 E34 E45 E89 E67 E43 E82 E83 E77 E79 E71 E81 E69 E84 E48 E57 E80 E78 E56 E85 E53 0 20 40 60 DISIMILITUD Figura 66. Análisis de agrupamiento entre las estaciones de muestreo. Bray-Curtis, UPGMA. 252 OTOÑO 2001 1.2 COT 0.8 NT MOT Cl a (S) Feop (S) PT FACTOR 2 0.4 Cl a (AF) C:N T O P 0.0 D S -0.4 -0.8 -1.2 -1.2 -0.8 -0.4 0.0 0.4 0.8 1.2 FACTOR 1 INVIERNO 2001 1.2 D 0.8 Cl a (S) Feop NT (S) MOT COT O 0.4 FACTOR 2 Cl a (AF) S 0.0 PT C:N P -0.4 T -0.8 -1.2 -1.2 -0.8 -0.4 0.0 0.4 0.8 1.2 FACTOR 1 PRIMAVERA 2001 1.2 0.8 O D FACTOR 2 0.4 P C:N S 0.0 Cl T a (AF) MOT NT COT PT -0.4 Cl a (S) Feop (S) -0.8 -1.2 -1.2 -0.8 -0.4 0.0 0.4 0.8 1.2 FACTOR 1 VERANO 2002 1.2 NT 0.8 Feop (S) O 0.4 FACTOR 2 MOT Cl a (S) T PT 0.0 Cl a (AF) S COT P D -0.4 C:N -0.8 -1.2 -1.2 -0.8 -0.4 0.0 0.4 0.8 1.2 FACTOR 1 Figura 67. Análisis de Componentes Principales entre las variables físico-químicas. 253 OTOÑO 2001 3 256 2 342 2 FACTOR2 1 350 297 278 300 282 261 339 259 0 1 334 329 352 292 288 -1 331 3 295 -2 -3 -3 -2 -1 0 1 2 3 FACTOR1 INVIERNO 2001 3 2 696 699 697 1 708 2 700 FACTOR2 709 710 702 0 1 701 698 695 705 703 706 704 707 -1 3 712 713 711 -2 -3 -3 -2 -1 0 1 2 3 2 3 FACTOR1 PRIMAVERA 2001 3 2 989 969 984 FACTOR2 1 2 980 971 0 951 947 990 3 985 983 977 981986 982 988 974 972 -1 970 952 1 973 -2 -3 -3 -2 -1 0 1 2 3 FACTOR1 VERANO 2002 3 85 2 2 3 34 53 79 FACTOR2 1 45 0 89 67 1 80 77 78 69 57 56 48 84 71 8143 82 83 -1 -2 -3 -3 -2 -1 0 1 FACTOR1 Figura 68. Análisis de Componentes Principales entre las estaciones de muestreo. 254 OTOÑO 2001 INVIERNO 2001 45 45 3 CHUBUT CHUBUT 1 1 46 46 1 1 3 3 2 LATITUD (ºS) 47 2 47 SANTA CRUZ 68 67 66 65 SANTA CRUZ 68 PRIMAVERA 2001 67 66 VERANO 2002 45 45 CHUBUT CHUBUT 1 3 46 1 3 2 68 3 46 1 47 65 2 47 SANTA CRUZ 67 3 66 65 68 SANTA CRUZ 67 66 65 LONGITUD (ºW) Figura 69. Sectores definidos de acuerdo al Análisis Multivariante, en el Golfo San Jorge. 255 . FIGURAS TERCER PERÍODO DE ESTUDIO INVIERNO DE 2003 256 TEMPERATURA (ºC) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 9.6 46 9.6 8.8 SANTA CRUZ 47 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) 104 106 107 110 Estaciones 119 117 114 170 Profundidad (m) 10 30 50 70 Temperatura (ºC) TEMPERATURA (ºC) 90 Figura 70. Distribución horizontal de la temperatura (ºC) del agua de fondo y perfil vertical de la columna de agua en el sector sur del Golfo San Jorge. 257 SALINIDAD (ups) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 33.36 46 33.44 33.36 33.24 33.16 SANTA CRUZ 47 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) 104 106 107 110 Estaciones 119 117 114 170 Profundidad (m) 10 30 50 70 Salinidad (ups) SALINIDAD (ups) 90 Figura 71. Distribución horizontal de la salinidad (ups) del agua de fondo y perfil vertical de la columna de agua en el sector sur del Golfo San Jorge 258 DENSIDAD C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 25.96 26.04 25.72 25.80 SANTA CRUZ 47 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) 104 106 107 110 Estaciones 119 117 114 170 Profundidad (m) 10 30 50 70 90 3 DENSIDAD (kg/m3) Densidad (kg/m ) Figura 72. Distribución horizontal de la densidad (kg/m3) del agua de fondo y perfil vertical de la columna de agua en el sector sur del Golfo San Jorge 259 CONCENTRACIÓN DE OXÍGENO (ml O2/l) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 1.5 6.0 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 73. Distribución horizontal de la concentración de oxígeno en ml O2/l del agua de fondo en el sector sur del Golfo San Jorge 260 CLOROFILA a - AGUA DE FONDO C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 0.05 0.7 0.05 0.6 0.9 47 0.7 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 74. Distribución horizontal de la concentración de clorofila a (mg/m3) del agua de fondo en el sector sur del Golfo San Jorge 261 CLOROFILA a - AGUA DE SUPERFICIE C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 0.80 0.75 0.60 0.60 47 SANTA CRUZ 0.80 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 75. Distribución horizontal de la concentración de clorofila a (mg/m3) en agua de superficie en el sector sur del Golfo San Jorge 262 CLOROFILA a - CAPA DE MEZCLA C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 1.50 5.00 4.00 0.75 0.75 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 76. Distribución horizontal de la concentración de clorofila a (mg/m3) en capa de mezcla en el sector sur del Golfo San Jorge 263 ARENA MEDIANA (%) ARENA GRUESA A MUY GRUESA (%) CHUBUT LATITUD (ºS) CHUBUT LATITUD (ºS) C° Dos Bahías 45 C° Dos Bahías 45 46 2.94 46 13.36 50.38 47 SANTA CRUZ 47 SANTA CRUZ C° Tres Puntas C° Tres Puntas 68 67 66 68 65 67 65 ARENA MUY FINA (%) ARENA FINA (%) C° Dos Bahías 45 C° Dos Bahías 45 CHUBUT LATITUD (ºS) CHUBUT LATITUD (ºS) 66 LONGITUD (ºW) LONGITUD (ºW) 25 46 46 50 47 47 SANTA CRUZ SANTA CRUZ C° Tres Puntas C° Tres Puntas 68 67 66 68 65 67 LIMO (%) 65 ARCILLA (%) C° Dos Bahías 45 C° Dos Bahías 45 CHUBUT CHUBUT LATITUD (ºS) LATITUD (ºS) 66 LONGITUD (ºW) LONGITUD (ºW) 46 25 46 15 47 SANTA CRUZ 47 SANTA CRUZ C° Tres Puntas 68 67 66 LONGITUD (ºW) C° Tres Puntas 65 68 67 66 65 LONGITUD (ºW) Figura 77. Distribución de las fracciones granulométricas de los sedimentos superficiales en el sector sur del Golfo San Jorge. 264 30 25 porcentaje 20 1999 15 2003 10 5 ArF MF 10 ArM 9 ArG 8 LMF 7 LF 6 LM 5 LG 4 AMF (3.5 a 3.9) AF (2.5 a 3) AM (1.5 a 2) AG (0.5 a 1) AMG (-1 a 0) Gr (-2 a -1.5) 0 clases texturales Figura 78. Comparación de la estructura porcentual de las clases texturales de los sedimentos superficiales en el sector sur del Golfo San Jorge entre el primer y tercer período de estudio. 265 TIPOS SEDIMENTARIOS C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) arena limosa limo arenoso arcilla limosa arena arcillosa limo arcilloso arcilla arenosa Figura 79. Distribución de los distintos tipos sedimentarios en el sector sur del Golfo San Jorge. 266 MEDIA GRANULOMÉTRICA C° Dos Bahías 45 CHUBUT LATITUD (ºS) 10 ARCILLA FINA A MUY FINA 46 9 ARCILLA MEDIANA 8 ARCILLA GRUESA 7 LIMO MUY FINO 6 LIMO FINO 5 LIMO MEDIO 4 LIMO GRUESO 3.9 ARENA MUY FINA 3.5 ARENA MUY FINA 3 ARENA FINA 2.5 ARENA FINA 2 ARENA MEDIANA 1.5 ARENA MEDIANA 1 ARENA GRUESA 0.5 ARENA GRUESA 0 47 ARENA MUY GRUESA SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 80. Distribución de la media granulométrica de los sedimentos superficiales en el sector sur del Golfo San Jorge (en unidades Φ). 267 SELECCIÓN C° Dos Bahías 45 CHUBUT LATITUD (ºS) MUY POBREMENTE SELECCIONADO POBREMENTE SELECCIONADO 46 MODERADAMENTE SELECCIONADO 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 81. Distribución de la selección de los sedimentos superficiales en el sector sur del Golfo San Jorge (en unidades Φ). 268 ASIMETRÍA C° Dos Bahías 45 CHUBUT MUY POSITIVA 0.3 LATITUD (ºS) POSITIVA 0.1 46 CERCANAMENTE SIMETRICA -0.1 NEGATIVA -0.3 MUY NEGATIVA -1 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 82. Distribución de la asimetría de los sedimentos superficiales en el sector sur del Golfo San Jorge (en unidades Φ). 269 MATERIA ORGÁNICA TOTAL (%) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 6.0 47 SANTA CRUZ 2.0 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 83. Distribución horizontal de la materia orgánica total (%) de los sedimentos superficiales en el sector sur del Golfo San Jorge 270 CARBONO ORGÁNICO TOTAL (%) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 47 SANTA CRUZ 0.4 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 84. Distribución horizontal de carbono orgánico total (%) de los sedimentos superficiales en el sector sur del Golfo San Jorge. 271 NITRÓGENO TOTAL (%) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 0.16 0.26 0.10 47 SANTA CRUZ 0.06 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 85. Distribución horizontal de nitrógeno total (%) de los sedimentos superficiales en el sector sur del Golfo San Jorge. 272 RELACION CARBONO:NITRÓGENO C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 86. Distribución horizontal de la relación carbono-nitrógeno de los sedimentos superficiales en el sector sur del Golfo San Jorge. 273 FÓSFORO TOTAL (%) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 0.08 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 87. Distribución horizontal de fósforo total (%) de los sedimentos superficiales en el sector sur del Golfo San Jorge. 274 CLOROFILA a C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 9.0 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 88. Distribución horizontal de la concentración de clorofila a (μg/g) de los sedimentos superficiales en el sector sur del Golfo San Jorge. 275 FEOPIGMENTOS C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 40.0 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 89. Distribución horizontal de la concentración de feopigmentos (μg/g) de los sedimentos superficiales en el sector sur del Golfo San Jorge. 276 INVIERNO 2003 AMG phi 0 AG phi 0.5 AM phi 1.5 AG phi 1 AM phi 2 1 AF phi 2.5 AF phi 3 C:N T O Cl a (AF) AMF phi 3.5 LG phi 4 LM phi 5 LF phi 6 LMF phi 7 COT NT 2 ArM phi 9 MOT ArF MF phi 10 Cl a (S) Feop (S) ArG phi 8 S PT P 0 20 40 60 80 100 DISIMILITUD Figura 90. Análisis de agrupamiento entre las variables físico-químicas. Bray-Curtis, UPGMA. INVIERNO 2003 E98 E152 E127 E129 E142 E138 E147 E153 E140 E99 E101 E103 E125 E126 E130 E122 E100 E155 E107 E102 E123 E124 E133 E135 E131 E134 E132 E104 E106 E111 E144 E116 E112 E109 E151 E110 E120 E149 E150 E148 E114 E118 E119 E117 E169 E170 1 2 0 20 40 60 80 100 120 DISIMILITUD Figura 91. Análisis de agrupamiento entre las estaciones de muestreo. Bray-Curtis, UPGMA 277 INVIERNO 2003 1.0 0.8 3.5 4 0.6 3 0.4 S 5 T Factor 2 0.2 P Cl a (AF) 0.0 PT -0.2 -0.4 10 6 8 C:N O Cl a (S) (S) MOTFeop 7 9 NT COT 2.5 -0.6 2 0.5 1.5 0 1 -0.8 -1.0 -1.0 -0.6 -0.2 0.2 0.6 1.0 Factor 1 Figura 92. Análisis de Componentes Principales entre las variables físico-químicas INVIERNO 2003 2 2 169 114 1 148 151 150 109 Factor 2 1 147 127 0 100 117 110 118 120 170 149 107 104 106 119 116 111 144 155 153 130 102 126 98 135 10199 103 131 129 122 152 132 133 123 124 125 138 134 142 140 -1 -2 -2 -1 0 1 2 Factor 1 Figura 93. Análisis de Componentes Principales entre las estaciones de muestreo. 278 C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 SECTOR 2 SECTOR 1 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 94. Sectores definidos de acuerdo al Análisis Multivariante, en el sur del Golfo San Jorge. 279 18000 miles de individuos/mn2 16000 14000 12000 10000 8000 6000 4000 2000 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 0 Lcap (mm) TOTALES MACHOS HEMBRAS Figura 95. Estructura de talla del total de individuos y por sexo de langostino en el sector sur del Golfo San Jorge. 280 TALLA MEDIA (Lcap mm) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 29 47 SANTA CRUZ 25 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 96. Distribución de la talla media de langostino en el sector sur del Golfo San Jorge. 281 TALLA MEDIA DE MACHOS (Lcap mm) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 38 46 47 SANTA CRUZ 24 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 97. Distribución de la talla media de machos en el sector sur del Golfo San Jorge. TALLA MEDIA DE HEMBRAS (Lcap mm) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 47 SANTA CRUZ 27 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 98. Distribución de la talla media de hembras en el sector sur del Golfo San Jorge. 282 60 50 porcentaje 40 30 20 10 0 juv en iles < 24 m m adult s uba os 31 dulto - 40 m s 2530 m m m adult os > 41 m m categorias Número en miles de indiv/mn2 Peso en ton/mn2 Figura 99. Composición en número y peso de la concentración de langostino por categorías en el sector sur del Golfo San Jorge. 283 DENSIDAD DE LANGOSTINO C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 10000 1000 27000 47 SANTA CRUZ 4000 10 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 100. Distribución de la densidad de langostino (miles de individuos/mn2) en el sector sur del Golfo San Jorge. 284 INDIVIDUOS JUVENILES (4 - 24 mm Lcap) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 1000 4000 47 SANTA CRUZ 800 10 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 101. Distribución de la densidad de juveniles de langostino (miles de individuos/mn2) en el sector sur del Golfo San Jorge. 285 INDIVIDUOS SUBADULTOS (25 - 30 mm Lcap) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 6000 3000 3000 16000 1000 47 SANTA CRUZ 50 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 102. Distribución de la densidad de subadultos de langostino (miles de individuos/mn2) en el sector sur del Golfo San Jorge. 286 INDIVIDUOS ADULTOS (31 - 40 mm Lcap) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 6000 47 SANTA CRUZ 50 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 103. Distribución de la densidad de adultos de langostino (miles de individuos/mn2) en el sector sur del Golfo San Jorge. 287 INDIVIDUOS ADULTOS (> 41 mm Lcap) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 300 47 SANTA CRUZ 3 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 104. Distribución de la densidad de adultos de langostino (> 41 mm Lcap) (miles de individuos/mn2) en el sector sur del Golfo San Jorge. 288 CONCENTRACIÓN DE MACHOS (%) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 105. Distribución de la concentración de machos de langostino en el sector sur del Golfo San Jorge. CONCENTRACIÓN DE HEMBRAS (%) C° Dos Bahías 45 LATITUD (ºS) CHUBUT 100 46 47 SANTA CRUZ 100 C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 106. Distribución de la concentración de hembras de langostino en el sector sur del Golfo San Jorge. 289 ADULTOS SUBADULTOS JUVENILES ADULTOS(>41MM) 50 60 70 80 90 100 Similitud Figura 107. Análisis de agrupamiento de las categorías de langostino en el sector sur del Golfo San Jorge. Bray-Curtis, UPGMA. 0 40 60 80 100 144 104 106 99 148 147 169 120 131 122 134 109 110 123 153 151 170 130 125 132 124 107 98 152 116 149 126 118 150 119 127 155 103 140 142 129 138 133 135 111 117 100 102 112 101 114 Similitud 20 1 2 Figura 108. Análisis de agrupamiento de las estaciones de muestreo, en el sector sur del Golfo San Jorge. Bray-Curtis, UPGMA 290 C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Agrupación 1 Agrupación 2 Figura 109. Agrupaciones de estaciones de muestreo definidas de acuerdo al Análisis de Similitud, en el sector sur del Golfo San Jorge. 291 0.5 129 juveniles (4 - 24 mm Lcap) 151 98 130 Dimensión 2 127 adultos (31 - 40 mm Lcap) 147 99 152 0.0 142 138 120 103 100123 140 132 169 adultos (> 41 mm Lcap) 148 124 119131 122 150 109 111118 102 149 126 110 170101 155 107 133 153 114 135 subadultos 134 125 (25 - 30 mm Lcap) 116 112 106 117 -0.5 -1.0 -0.5 0.0 0.5 1.0 Dimensión 1 Figura 110. Análisis de correspondencia entre las categorías de langostino y las estaciones de muestreo, en el sector sur del Golfo San Jorge. 292 C° Dos Bahías 45 LATITUD (ºS) CHUBUT 46 Sector Sector noreste central y sudeste Sector oeste 47 SANTA CRUZ C° Tres Puntas 68 67 66 65 LONGITUD (ºW) Figura 111. Sectores definidos según el Análisis de Correspondencia en el sector sur del Golfo San Jorge. 293 169 170 151 119 116 118120 147 150 148 114 149 144 111 110 109 112 153 126 140 152 104 117 135 123 138 10698 155 107 131101 133 125 122 102 130127 103 100 124 129132134 142 99 Figura 112. Distribución canónica tridimensional de cada estación de muestreo. 294 FIGURAS ANÁLISIS COMPARATIVO ENTRE EL PRIMER Y SEGUNDO PERÍODO DE ESTUDIO DEL SECTOR SUR DEL GOLFO SAN JORGE. PRIMAVERA DE 1999 – INVIERNO DE 2000 Y OTOÑO DE 2001 – VERANO DE 2002 295 TEMPERATURA DEL AGUA DE FONDO 15 13 ºC 11 9 7 5 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 113. Valores medios e intervalos de confianza (95 %) de la temperatura del agua de fondo del primer y segundo período de estudio. SALINIDAD DEL AGUA DE FONDO 33.80 33.70 ups 33.60 33.50 33.40 33.30 33.20 P 1999 O 2000 P 2000 O 2001 P 2001 V 2000 I 2000 V 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 114. Valores medios e intervalos de confianza (95 %) de la salinidad del agua de fondo del primer y segundo período de estudio 296 DENSIDAD DEL AGUA DE FONDO 26.400 26.200 26.000 kg/m3 25.800 25.600 25.400 25.200 25.000 24.800 P 1999 O 2000 P 2000 O 2001 P 2001 V 2000 I 2000 V 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 115. Valores medios e intervalos de confianza (95 %) de la densidad del agua de fondo del primer y segundo período de estudio CONCENTRACION DE OXÍGENO EN EL AGUA DE FONDO 8.0 7.0 6.0 ml/l 5.0 4.0 3.0 2.0 1.0 0.0 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 116. Valores medios e intervalos de confianza (95 %) de la concentración de oxígeno en el agua de fondo del primer y segundo período de estudio 297 CLOROFILA a EN AGUA SUPERFICIAL 5.5 4.5 mg/m3 3.5 2.5 1.5 0.5 -0.5 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 117. Valores medios e intervalos de confianza (95 %) de la concentración de clorofila a en agua de superficie del primer y segundo período de estudio CLOROFILA a EN CAPA DE MEZCLA 8.0 7.0 6.0 5.0 mg/m3 4.0 3.0 2.0 1.0 0.0 -1.0 P 1999 O 2000 P 2000 O 2001 P 2001 V 2000 I 2000 V 2001 I 2001 V 2002 ±Std. Dev. ±Std. Err. Mean Figura 118. Valores medios e intervalos de confianza (95 %) de la concentración de clorofila a en capa de mezcla del primer y segundo período de estudio 298 CLOROFILA a EN AGUA DE FONDO 3.5 3.0 2.5 2.0 mg/m3 1.5 1.0 0.5 0.0 -0.5 -1.0 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 119. Valores medios e intervalos de confianza (95 %) de la concentración de clorofila a en agua de fondo del primer y segundo período de estudio MATERIA ORGÁNICA TOTAL EN SEDIMENTOS 14 12 10 % 8 6 4 2 0 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 120. Valores medios e intervalos de confianza (95 %) de la materia orgánica total en sedimentos superficiales del primer y segundo período de estudio. 299 CARBONO ORGÁNICO TOTAL EN SEDIMENTOS 3.0 2.6 2.2 % 1.8 1.4 1.0 0.6 0.2 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 121. Valores medios e intervalos de confianza (95 %) del carbono orgánico total en sedimentos superficiales del primer y segundo período de estudio. NITRÓGENO TOTAL EN SEDIMENTOS 0.5 0.4 % 0.3 0.2 0.1 0.0 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 122. Valores medios e intervalos de confianza (95 %) del nitrógeno total en sedimentos superficiales del primer y segundo período de estudio. 300 RELACIÓN CARBONO / NITRÓGENO EN SEDIMENTOS 50 40 C:N 30 20 10 0 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 123. Valores medios e intervalos de confianza (95 %) de la relación carbono-nitrógeno en sedimentos superficiales del primer y segundo período de estudio. CLOROFILA a EN SEDIMENTOS 5.5 4.5 ug/g 3.5 2.5 1.5 0.5 -0.5 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 124. Valores medios e intervalos de confianza (95 %) de la concentración de clorofila a en sedimentos superficiales del primer y segundo período de estudio. 301 FEOPIGMENTOS EN SEDIMENTOS 50 40 ug/g 30 20 10 0 P 1999 O 2000 V 2000 P 2000 I 2000 O 2001 V 2001 P 2001 I 2001 V 2002 ± D.E. ± E.E. Media Figura 125. Valores medios e intervalos de confianza (95 %) de la concentración de feopigmentos en sedimentos superficiales del primer y segundo período de estudio. 302 LÁMINAS 303 Asychis amphiglypta Eunice magallanica Lámina I. Invertebrados más representativos de las comunidades bentónicas del Golfo San Jorge: Poliquetos. Cistenides ehlersi 304 Semirossia tenera Loligo gahi 1mm Octopus tehuelchus Nuculana sulculata 1mm Nucula puelcha Mytilus platensis Malletia cumingii Pitar rostratus Lámina II. Invertebrados más representativos de las comunidades bentónicas del Golfo San Jorge: Moluscos. Zygoclamys patagonicus 305 Pterygosquilla armata armata Peisos petrunkevitchi Austropandalus grayi Callianassa brachyophthalma Lithodes santolla Munida subrugosa Eurypodius latreillei Leurocyclus tuberculosus Lámina III. Invertebrados más representativos de las comunidades bentónicas del Golfo San Jorge: Crustáceos. Peltarion spinosulum 306 Diplasterias brandti Austrocidaris canaliculata Arbacia dufresnii Pseudechinus magallanicus Trypilaster phylippii Hemiodema spectabilis Lámina IV. Invertebrados mas representativos de las comunidades bentónicas del Golfo San Jorge: Equinodermos. 307