1 Generalidades
Anuncio

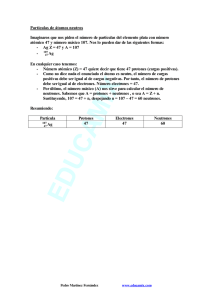
Curso de Ingreso de Química 2016 Ingeniería Ambiental Generalidades de Mediciones y Magnitudes Para la química, en su calidad de ciencia experimental, la medida constituye una operación fundamental ya que sus descripciones del mundo físico se refieren a magnitudes o propiedades medibles. Se denominan magnitudes a ciertas propiedades o aspectos observables de un sistema físico que pueden ser expresados en forma numérica. La longitud, la masa, el volumen, la fuerza, la velocidad, la cantidad de sustancia, son ejemplos de magnitudes. La cantidad se refiere al valor que toma una magnitud dada en un cuerpo o sistema concreto. Por ejemplo, la longitud y masa de una mesa, el volumen de un libro, etc. Una cantidad de referencia se denomina unidad, y el sistema físico que encarna la cantidad considerada como una unidad se denomina patrón. La medida de una magnitud física supone la comparación del objeto con otro de la misma naturaleza, que se toma como referencia y que constituye el patrón. Con el fin de facilitar la cooperación y comunicación en el terreno científico y técnico se ha adoptado un mismo sistema de unidades, el Sistema Internacional (SI) que distingue y establece, las magnitudes básicas y derivadas. El SI toma como magnitudes fundamentales: la longitud, la masa, el tiempo, la intensidad de corriente eléctrica, la temperatura absoluta, la intensidad luminosa y la cantidad de sustancia, y fija las correspondientes unidades para cada una de ellas. Las siguientes son las siete unidades fundamentales Unidad de Longitud: el metro (m). Unidad de Masa: el kilogramo (kg), Unidad de Tiempo: el segundo (s). Unidad de Cantidad de Sustancia, El mol. Unidad de Corriente Eléctrica, el ampere (A). Unidad de Temperatura Termodinámica, el Kelvin (K). Unidad de Intensidad Luminosa, La candela (cd). Las unidades derivadas han recibido nombres y símbolos especiales. Las mismas pueden ser utilizadas en combinación con otras unidades fundamentales o derivadas para expresar unidades de otras cantidades. La notación científica. Es muy frecuente en esta área trabajar con números muy grandes o muy pequeños. Por ejemplo, en 16 g de oxígeno (1 mol de átomos) hay 602200000000000000000000 átomos de oxígeno, y cada átomo tiene una masa de 0,0000000000000000000000267 g. El manejo de estos números es engorroso, por lo cual, para manejar dichos números, se utiliza la llamada Notación Científica. Curso de Ingreso de Química 2016 Ingeniería Ambiental Sin importar su magnitud, todos los números en formato decimal se pueden expresar de la siguiente forma: N x10n donde N es un número comprendido entre 1 y 9, y n es un exponente, que debe ser un número entero positivo o negativo. En los dos ejemplos antes mencionados, dichos números expresados en notación científica son 6,022 x1023 átomos de oxígeno y 2,67 x10-24 g. La expresión “x10”, no significa que debes multiplicar el número x10 y luego elevarlo al exponente escrito, ya que de esa manera estarías agregando un cero más al número. Esto, en la calculadora, se trabaja con la tecla que dice EXP, la cual se encuentra generalmente al lado del signo igual. Ejemplo Si es positivo, la coma se corre a la derecha, 1,3 x105 = 130000 Si es negativo, la coma se corre a la izquierda, 1,3 x10-5 = 0,000013 Estructura de la materia El átomo se compone mayoritariamente de tres partículas subatómicas: el protón, el electrón y el neutrón. Protones y neutrones se disponen en la región central dando lugar al núcleo del átomo, mientras que los electrones giran alrededor de este centro en regiones bien definidas. Muchas de las propiedades físicas de los átomos, como masa, densidad o capacidad radiactiva se relacionan con el núcleo. Por el contrario, del arreglo de los electrones en la periferia del átomo dependen propiedades químicas, como la capacidad para formar compuestos con átomos de otros elementos. Asimismo, algunas propiedades físicas de los elementos y compuestos, como el punto de fusión y de ebullición, el color o la dureza, están determinadas en gran parte por la cubierta externa de electrones. Al describir un elemento químico se mencionan siempre algunas de sus principales propiedades, entre las que se encuentra el número atómico, el número de masa y la masa atómica. El Número atómico indica el número de protones presentes en el núcleo y se representan con la letra Z. Es el número que determina la “identidad” del elemento. Número de masa o número másico se representa con la letra A y hace referencia al número de protones y neutrones presentes en el núcleo. La masa del átomo está concentrada en el núcleo y corresponde a la suma de la masa de los protones y los neutrones presentes, dado que la masa de los electrones es despreciable en relación con la masa nuclear, el número másico también es un indicador indirecto de la masa atómica. Consideremos el elemento sodio contiene 11 protones y 12 neutrones en su núcleo. Esto significa que Z es igual a 11 y A es igual a 23, es decir, la suma de 11 protones y 12 neutrones. El número de neutrones presente suele representarse con la letra N. Z = 11; N = 12 A = N + Z, es decir, A = 12 + 11 = 23 Curso de Ingreso de Química 2016 Ingeniería Ambiental Ejercicios 1- Comparar y ordenar en forma creciente las siguientes cantidades a) 10-3 L b) 70 dm3 c) 120 cm3 d) 1570 mL 2- Expresar em Litros. a) 5350 ml b) 0,345 m3 c) 14,3 dm3 d) 350 cc 3- Expresar las siguientes cantidades en notación científica o en forma decimal, según corresponda. a) 0,0000000027 b) 3560 c) 47700 d) 0,096 e) 1,56 x10-3 f) 7,78 x 10-5 g) 2,59 x 102 h) 9,00 x 105 i) 0,00000709 4- Se determinaron las siguientes propiedades de un trozo de hierro: masa = 40 g, volumen = 5,08 cm3, densidad = 7,87 g/cm3, temperatura de fusión = 1535°C. Indicar cuáles son propiedades extensivas y cuáles propiedades intensivas. 5- La densidad del mercurio (Hg) a 273,15 K es 13,60 g/cm3. ¿Cuál es el volumen que ocuparán 35 g de mercurio? Expresar el volumen en cm³, mL y L. 6- El oro es un metal precioso químicamente inerte. Un lingote de oro con una masa de 301 g tiene un volumen de 15,6 cm3. Calcular la densidad del oro. Expresar la densidad en kg/dm³. 7- ¿Cuál es el volumen ocupado por 5,0 g de plata sólida a 20°C si la densidad es 10,5 g/cm3? 8- La masa de un cristal de sacarosa es 6,080 mg. Las dimensiones de cristal son 2,2 mm x 1,36 mm x 1,23 mm. Calcule la densidad de la sacarosa en g/cm3. Rta: 1,65 g/cm3. 9- La densidad del vinagre es 1,05 g/cm3. ¿Cuál es la masa (en g y en kg) de tres litros de vinagre? Suponga que 1 L = 1 dm3. Rta: m = 3150 g = 3,150 kg. 10- La densidad de la plata es de 10,5 g/cm3. ¿Cuál es el volumen de un lingote con masa de 0,643 kg de plata? Si esta muestra de plata es un cubo, ¿qué longitud (en cm) tendría de lado? Curso de Ingreso de Química 2016 Ingeniería Ambiental Rta: Si V = 61,24 cm3. a= 3,94 cm 11- El número atómico, Z, se define como el número de protones que posee un átomo en su núcleo, y el número másico, A, como el número de protones más el número de neutrones. Completa la siguiente tabla utilizando la información que se encuentra en ella: Elemento 57 A P+ Z Fe 26 35 17 27 19 13 F 9 12- Indique cuál de las opciones es la correcta. Una partícula de 56Fe2+ contiene: a) 54 protones, 56 neutrones y 52 electrones b) 26 protones, 30 neutrones y 24 electrones c) 26 protones, 26 neutrones y 26 electrones d) 28 protones, 28 neutrones y 26 electrones e) 58 protones, 58 neutrones y 56 electrones 13- Complete el siguiente cuadro: Símbolo Z 21 A N 25 13 N° de electrones Ne 56 14- Completa el siguiente cuadro Z A Au 197 Fe 56 Na Zn P 42 N e79 26 11 12 30 15- Indicar cuáles de las siguientes afirmaciones son Verdaderas o Falsas. En las F cambiar los conceptos equivocados para que la afirmación se convierta en V. a)- El átomo está formado por un núcleo formado por carga negativa. b)- El número atómico es el número de protones. c)- La masa del electrón es mayor que la del protón. d)- El número másico es el número de neutrones. e)- El número de neutrones se obtiene sumando Z + A. Curso de Ingreso de Química 2016 Ingeniería Ambiental 16- Según la siguiente tabla: P N e A 8 8 10 B 3 4 2 10 9 C 9 a)- ¿Cuál o cuáles de estas partículas tienen carga? b)- Calcular Z y A. c)- ¿Cuál puede ser catión y cuál anión? 17- Complete la siguiente tabla Elemento Masa atómica (UTM) Masa de un mol de átomos (g) Sn 79,9 Mg 51,99 18- Completa la siguiente tabla. Elemento Masa (g) S Número de moles Número de átomos 1,5 5 x 1024 2,32 x 10-23 5,143 x 10-23 250 4719 x 1023 100 2 C Masa de un átomo (g) 2,657 x 10-23 3,8 19- ¿Cuántas moléculas hay en 15 g de cada una de las siguientes sustancias? a) CO2 b) N2 20- ¿Cuántos átomos y moles de átomos hay en 245 g Mg? Calcule la masa (en g) de un átomo de Mg. Curso de Ingreso de Química 2016 Ingeniería Ambiental 21- Complete la siguiente tabla. Molécula Masa (g) Cl2O3 Número de moles Moles de oxígeno Moles de halógeno 5,4 HBrO3 HIO 7,1 3,22 22- Calcule el número de átomos de nitrógeno que hay en 40 g de sulfato de amonio. (NH4)2SO4. 23- Determinar la masa molecular del ácido sulfúrico H2SO4 24- Calcule la masa molar de las siguientes sustancias: a) carbonato de litio (Li2CO3), b) nitrato de potasio (KNO3), c) sulfato de sodio (Na2SO4). 25- ¿Cuantas moléculas hay en 15 g de cada una de las siguientes sustancias? a) CO2 b) N2. 26- La urea se utiliza como fertilizante (NH2)2CO, calcule el número de átomos de N, C, O e H contenidos en 2300 g de urea. 27- Calcule el peso del hierro (Fe) en una muestra de 10 gramos de óxido de hierro III (Fe2O3).