Repaso 1. Sistema inmune
Anuncio

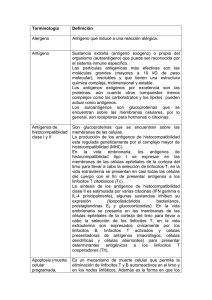
Repaso 1. Sistema inmune Dra. León Funciones del sistema inmune (SI) ¿Para qué existe el sistema inmune? Su principal función es de DEFENSA para preservar la integridad del individuo en todas sus formas y esto lo logra a partir de tres escenarios diferentes: Protección contra antígenos externos: biológicos, inertes, microorganismos, patógenos. Este es el escenario más común y cuando disfunciona produce un síndrome infeccioso. Tal como pasa en inmunodeficientes que tienen infecciones recurrentes y por gérmenes que no son los clásicos. Eliminación de antígenos endógenos anormales: células de desecho, detritos celulares, células tumorales. En inmunodeficientes se encuentra un riesgo aumentado de síndromes tumorales, especialmente los relacionados con el sistema inmune. Esta función se encuentra dentro del concepto de INMUNOVIGILANCIA, por la formación de neoantígenos por procesos tumorales. Evitando la autodestrucción: mediante mecanismos efectores y constrictores de la respuesta inmune ya que ésta tiene la capacidad de generar un daño en el organismo. Cuando hay inmunodeficiencias (defectos en la respuesta inmune) se encuentra mayor incidencia de enfermedades autoinmunes, en las que el cuerpo ataca lo propio. Antígenos: - La mayoría son proteicos, pero también se pueden montar respuestas inmunes contra antígenos que son azúcares. - Se definen como una parte, secuencia o sección de algo que puede ser reconocido y es capaz de generar una respuesta inmune efectiva, aunque esta respuesta podría ser de tolerancia, entonces lo más importante es que puede ser reconocido. - Un antígeno para un sistema celular es diferente q ue para un sistema humoral. Historia: Edward Jenner se conoce como el padre de la inmunología, iniciando con la vacunología. Era un inglés, científico, investigador, que descubrió la vacuna para la viruela. Él vio que las personas que ordeñaban las vacas, que tenían vaccinia (viruela de las vacas), no les daba viruela y no se morían. Entonces empezó a sacar sustancias de las pústulas de las vacas y se las inyectó a una persona, la cual no se enfermó. Componentes del Sistema Inmune Órganos y tejidos Ganglios linfáticos Timo y Bazo Médula ósea Tejido linfoide asociado a mucosas Moléculas Inmunoglobulinas Citocinas Histocompatibilidad Receptores Complemento Adhesión Células PMNs Linfocitos B y T Monocitos Macrófagos Cel. Dendríticas Cel. NK Para cumplir con estos escenarios el SI está ampliamente organizado y en constante movimiento, para lograr estar íntimamente relacionadas en todo momento. Asimismo, tenemos leucocitos en sangre y otros se encuentran en el estroma, tejidos (células dendríticas, células NK, células endoteliales). Estas últimas forman parte del sistema inmune aunque no se encuentren en el tejido hematopoyético propiamente. Las moléculas solubles que forman parte del SI, son las inmunoglobulinas que son 5 clases (G-A-D-E-M), citocinas, moléculas de histocompatibilidad en humanos (HLA o MHC), sirven para comunicación, opsonización y muchas otras funciones. Las inmunoglobulinas son tridimensionales, no ocupan que los antígenos sean identificados y procesados. Todas las células del organismo pueden responder a citocinas, son sustancias por excelencia comunicadoras, transmiten señales, funcionan en forma autocrina (la misma célula), paracrina (células circundantes) y endocrina (células alejadas). Estas también tienen la capacidad de producir apoptosis, lisis celular, etc. Es decir, son uno de los principales mecanismos efectores de las células T. Hay una inmensa cantidad de receptores que están en la superficie de las células que interactúan con las inmunoglobulinas, citoquinas, HLA. Unos de estos receptores son inducibles ante el contacto célula-célula, otros están activos constitucionalmente. Algunos de estos receptores permiten diferenciar entre las células del SI, estos se llaman CD (cluster diferenciation) hay cerca de 350 patrones de diferenciación altamente reconocidos, son proteínas con funciones biológicas. Estas moléculas son importantes porque interactúan con HLA específicos, las CD8 con HLA1 y las CD4 con HLA2. Esto es llamado “restricción de HLA”. Con respecto a las células, se dice que hay una célula madre hematopoyética, un progenitor linfoide común y uno mieloide común. Los órganos o tejidos del SI se clasifican en: -Primarios: se da la ontogenia (el origen) y maduración de los componentes del SI. Estos son la médula ósea, el timo y el bazo. Todas las células del sistema inmune se producen en la médula ósea, algunas maduran en la misma médula, otras en el timo y otras en el bazo. El timo es el órgano de la maduración exclusivamente de las células T. -Secundarios: en estos órganos se da la respuesta inmune, un contacto entre el sistema inmune innato y adaptativo. Acá también empieza a darse el cambio hacia una respuesta más específica. Estos son: ganglios linfáticos y tejido linfoide asociado a mucosas (MALT). Este último constituye un 50%, es el más extenso, difuso en tejido respiratorio (BALT) y gastrointestinal (GALT), es un tejido no encapsulado pero está muy bien organizado, es el que tiene mayor relevancia y mayor representación del sistema inmune. El mejor caracterizado se encuentra en las placas de Peyer en el intestino, el cual es de los órganos más dinámicos, porque por ahí entran todos los patógenos. Los ganglios están distribuidos anatómicamente en lugares específicos como cervical, retroauricular, axilar, epitroclear, intratorácico, intraabdominal, paraaórticos, inguinales y poplíteo. No toda pelota es un ganglio. Además hay un sistema de drenaje específico, cada ganglio recibe la linfa de las partes del cuerpo relacionadas a este. -Terciarios: es un concepto reciente, es el lugar anatómico donde se esté ejecutando una respuesta inmune, porque se sabe que cualquier tejido del cuerpo puede convertirse a linfoide en algún momento, según las circunstancias. Mecanismos de defensa Las respuestas inmunes deben ser reguladas en lugar y tiempo, se tienen que dar en el lugar específico donde se necesitan, por el tiempo necesario para eliminar lo que esté causando el daño. Uno de los problemas principales es cuando el sistema inmune da respuestas generalizadas y no controladas, entonces se perpetúan. Innatos: tiene componentes asociados con inflamación y fagocitosis. Son células suicidas que carecen de especificidad pero que poseen moléculas que las activa y las orienta hacia donde debe dirigirse. También se encuentran las barreras naturales: piel, mucosas, PH gástrico. Su disrupción puede ser causa de inmunodeficiencia, que se manifiestan con más riesgo de infecciones recurrentes. Trata de evitar el establecimiento de una infección. Las células activadas y las moléculas secretadas determinarán el tipo de respuesta inmune adaptativa. La mayoría de los patógenos que logran irrumpir en el organismo son eliminados en horas por medio de mecanismos preformados y rápidamente inducibles. Son la primera línea de defensa (fundamental). Las principales células responsables de inmunidad innata son: Macrófago: función de fagocitosis y activación de linfocitos T Célula NK: citotóxica, tienen un reconocimiento por patrones, como bacterias gram + o -, no es tan específico, su ataque generalmente es por degranulación de vacuolas que producen lisis celular Neutrófilo: Célula fagocítica por excelencia del SI innato. Realiza fagocitosis y eliminación de microorganismos Este sistema tiene como función liberación de lo que ya está formado, en el sitio específico de la lesión, como la liberación de Histamina ya sea por macrófagos o mastocitos en otros tejidos, vasodilatador, que permite la salida de sustancias para que se dé la respuesta inflamatoria en el sitio, proteínas o complementos. Pacientes que presentan urticaria presentan una reacción generalizada de esta liberación de histamina ya sea por medicamentos u otras causas. Adaptativos: Se requieren 7 días para generar una respuesta inmune de este tipo. Es una reacción que demanda: 1. Identificación 2. Selección 3. Proliferación Pruebas serológicas para detectar infección, en los primeros 7 días será negativa, por ejemplo con el dengue, ya que no hay producción de anticuerpos. Los linfocitos que son células con capacidad de memoria, efector una vez que se han encontrado con su antígeno, alta especificidad sin haber conocido nunca al antígeno es decir no se desarrolla con la exposición repetida. Al encontrarse con el antígeno hace que se generen dos clonas: efectora y de memoria, logrando que la respuesta sea más eficiente, rápida y autolimitada. Las principales células del sistema inmunitario son los linfocitos, las células presentadoras de antígenos y las células efectoras. Los linfocitos son las células que reconocen los antígenos extraños de manera específica y responden contra ellos, por lo que constituyen los mediadores de la inmunidad humoral y celular. Existen distintas subpoblaciones que difieren en la forma de reconocer los antígenos y en sus funciones. Los linfocitos B se producen en la médula ósea, maduran (generan su receptor que la hace funcional por medio de un proceso genético de recambio) también en la médula ósea, luego salen a circulación y después van visitando órganos linfoides para encontrar el antígeno específico que la hace proliferar. Son las únicas células capaces de producir anticuerpos. Reconocen los antígenos extracelulares (incluso sobre su propia superficie) y se diferencian en células plasmáticas secretoras de anticuerpos, por lo que actúan como mediadores de la inmunidad humoral. Los linfocitos T, las células de la inmunidad celular, se producen en la médula ósea, maduran en el timo y salen a circulación. Pero en la circulación no pueden interactuar con muchas células, tienen que ir a órganos específicos como ganglios o MALT. Reconocen los antígenos de los microorganismos intracelulares y sirven para destruir estos microbios o las células infectadas. Estos NO producen moléculas de anticuerpo. Sus receptores del antígeno son moléculas de membrana distintas de ellos, pero dotadas de una estructura afín. Presentan una especificidad restringida hacia los antígenos; reconocen péptidos derivados de proteínas extrañas que están unidas a proteínas propias llamadas moléculas del complejo principal de histocompatibilidad (MHC). El inicio de las respuestas inmunitarias adaptativas y su desarrollo requiere la captación de los antígenos y su exposición ante unos linfocitos específicos. Las células que cumplen esta misión se denominan células presentadoras de antígenos (APC). Las células de la inmunidad innata interaccionan entre sí y con otras células del anfitrión durante las fases de iniciación y efectora de las respuestas inmunitarias innata y adaptativa. Muchas de estas interacciones están mediadas por citocinas. Por otra parte, entre los fagocitos se encuentran el neutrófilo, macrófagos, eosinófilo (es un mal fagocito ya que su función biológica consiste en degranularse). La mayoría de los fagocitos cuentan con granulos intracitoplasmáticos, que se estimulan ante determinados antígenos. El otro grupo de células son las células auxiliares, éstas colaboran con la función del sistema inmune aunque no tengan una función efectora. Ejemplo: Basófilos, células mastocíticas, plaquetas. Éstas últimas pueden secretar citoquinas para localizar la respuesta inmune. Las células endoteliales (estromales) tienen la capacidad de producir citoquinas, interferones, moléculas de adhesión leucocitaria que organizan la respuesta inmune. Todos los ¨actores¨ anteriores se originan de una célula madre hematopoyética a nivel de la médula ósea. La mayoría sale al torrente sanguíneo en una forma madura, con una sola excepción que es: la célula T. A ésta célula le toca migrar hacia el timo para sufrir fenómenos de selección y maduración previos. Las otras células sufren dos procesos de maduración dentro de la médula ósea. La célula T tiene que sufrir un tratamiento especial, ya que tiene que ser educada con el objetivo de evitar células auto-reactivas en el torrente sanguíneo. De lo contrario vamos a tener en el torrente sanguíneo clonas con la capacidad de reconocer nuestros antígenos y generar enfermedades auto-inmunes. Por eso una vez que los precursores linfoides han sido generados en la médula, deben viajar al timo. Estas células tímicas exponen a los linfocitos inmaduros a dos procesos: - Selección Positiva: consiste en seleccionar solo a aquellos linfocitos que cuentan con la capacidad de reconocer al HLA. Un Linfocito que no tenga capacidad de reconocer el HLA no será de mucha utilidad entonces recibe una señal de apoptosis. - Selección Negativa: consiste en presentarle a esos linfocitos que reconocieron el HLA, antígenos propios de nuestro cuerpo. Los que reconocen los antígenos propios que les presentaron serán llamados a la apoptosis. Es decir, se busca que tengan una baja afinidad por antígenos propios. De todos los linfocitos que entran al timo apenas el 5% estará en sangre periférica, el resto no cumple con los criterios de selección y enviado a la apoptosis. Los fenómenos de selección tímica son muy intensos en la fase fetal y los primeros años de vida, hasta las primeras dos décadas. Es en este momento que se recluta el repertorio de células que nos protegerán por el resto de la vida. Como sabemos, con el paso del tiempo va a tender a involucionar y se infiltra con grasa. Este fenómeno se llama senescencia inmunológica. Por otro lado, las células T que salen del timo ya son funcionales, es decir no requieren del contacto con el antígeno para sensibilizarse. Cuando salen del timo son células Naive con toda la capacidad de respuesta al antígeno que tiene su receptor. Mientras tanto, los procesos de selección de la célula B son a nivel de la médula ósea. Su maduración está relacionada con la capacidad de expresar el receptor de célula B (BCR). Este receptor es la inmunoglobulina que va a producir la célula B al diferenciarse hacia una célula plasmática en el momento de encontrar el estímulo adecuado. Todo dependerá de la avidez de este receptor para interactuar con los antígenos para los que fue hecho. Normalmente las células B que van a proliferar son aquellas que pueden interaccionar con su ligando de manera débil o moderada. Aquellas que reconocen fuertemente el antígeno para el cual tienen un BCR deben ser enviadas a la apoptosis, esto tiene que ver con un proceso de regulación y homeostasis ya que la respuesta inmune que se genera sería demasiado intensa, difícil de modular y el proceso inflamatorio demasiado, incluyendo daño tisular. Entonces, las células B que circulan en nuestro cuerpo tienen una pobre avidez para reconocer el antígeno. No obstante, tienen una elevada especificidad. Conteo normal de leucocitos: 5000-10000/mm3. Este valor se estableció por una curva de Moss. 2,5% de la población tienen menos y 2,5% tienen más y es normal. Conteo normal de linfocitos: 20-50%. 800-4500/mm3. Neutrófilos: 40-75%. 1800-6500/mm3. <1500: neutropenia. Eosinófilos: 5-7%. <700/mm3. Indican parásitos o alergias. Las cantidades de células del sistema inmune van a ser variables para cada edad, lo importante es contar con el mínimo de materia prima que se requiere para trabajar. Por ejemplo, en los neutrófilos el número sería 1500 por debajo de ese número: neutropenia. Dependiendo del libro, en el caso de los adultos se requiere al menos 2000. Por encima de esta cifra ¨todo¨ es normal, es decir la neutrofilia es lo que se espera de un huésped inmunocompetente. La patología está en el factor que esté produciendo la proliferación de estas células. Como se dijo los neutrófilos tienen amplia capacidad de fagocitosis, si éstos proliferan quiere decir que hay gran cantidad microorganismos extracelulares candidatos a ser fagocitados. Por ejem, bacterias gran negativas. Siempre que se evalúa el conteo de células se debe hacer en números absolutos, hay que evitar guiarse por porcentajes ya que como se dijo, son variables según la etapa de la vida. Luego, se debe pensar si este número es el mínimo requerido para trabajar. En resumen, como sabemos el SI debe reconocer el antígeno esto lo hace mediante el sistema innato o adaptativo. Los primeros en llegar son los miembros del SI innato: polimorfonucleares neutrófilos que tienen la capacidad de fagocitar que con sus gránulos que contienen radicales del oxígeno y otros derivados del óxido nítrico. La función de los neutrófilos es suicidarse en el sitio. Posteriormente llegarán las células¨ barredoras¨, presentadoras de antígenos van a fagocitar los antígenos que quedaron libres para presentárselos a los miembros del sistema inmune adaptativo: células T que cuentan con la capacidad de estimular clonas de células B o de hacer una función efectora con expansión clonal, diferenciación y eliminación directa de antígenos. La célula B con su receptor puede hacer un reconocimiento directo de los antígenos, endocitarlos y presentárselos a la célula T. Todo este proceso es el Reconocimiento del Antígeno que se hará por una de dos vías: T dependiente o T independiente. Si es T dependiente habrá una expansión clonal y diferenciación (término adecuado para referirse a nivel periférico, maduración es en los órganos primarios) hacia clonas de células efectoras que en el caso de la célula B se diferencia a una célula plasmática o de T citotóxicos en la célula T. Posteriormente en el proceso ocurre la fase de contención en que todos los componentes que participaron en la respuesta inmune son enviados a apoptosis. Las más importantes para esto son las células T reguladoras que expresan en su membrana moléculas como el CD25. De toda la experiencia debe sobrevivir una clona de células de memoria con el objeto de crear luego una respuesta más rápida y efectiva. Recapitulando, los órganos linfoides se pueden agrupar en encapsulados (ganglios linfáticos y bazo) y no encapsulados (tejido linfoide asociado a mucosas). El bazo es un ganglio especializado responsable de poner en contacto los antígenos del torrente sanguíneo con los miembros del sistema inmune adaptativo. Mientras que los nódulos linfáticos son los encargados de poner en contacto los antígenos que están en el resto de los tejidos con las células del SIA que migraron por vía linfática. Anatómicamente el ganglio linfático es encapsulado, trabeculado. Con una zona cortical y medular. Si es una zona más externa más células T y en las zonas más internas se espera encontrar más células B. El estímulo viaja gracias a las células presentadoras de antígeno, como las células dendríticas y aquí se sigue la secuencia de activación de las células. Toda la circulación linfática va orientada a llevar los antígenos desde la periferia. Mientras que los antígenos que vienen por el torrente sanguíneo van a drenar al bazo. (*Insiste en este concepto) El sistema mucoso Es el primer sitio de encuentro de las células de la respuesta inmune con los antígenos que entran por esas superficies. La mayoría de los antígenos entran por mucosas o por piel. Lo que pasa es que la piel tiene demasiadas barreras mecánicas que dificultan el ingreso de antígenos. Las mucosas tienen barreras químicas y físicas pero son menos eficientes. Como se dijo, el 50% del tejido linfoide está asociado a mucosas. Los bebés están muy expuestos a hacer alergias, porque tienen un sistema intestinal inmaduro. Algunas células del epitelio intestinal en las placas de Peyer han tenido una diferenciación especial y se les ha llamado la célula E que son células epiteliales diferenciadas a nivel de la mucosa. Son células ¨huecas¨ en las que se pueden acumular gran cantidad de células del sistema inmune. Mientras que la célula M se encarga de transportar los antígenos que lleguen a la superficie para generar una respuesta efectora local. Tienen gran capacidad de secreción de citoquinas para estimular células del SI tanto Innato como adaptativo y no son infectables por los antígenos entonces sobreviven a los insultos Para cada una de las mucosas existe un sistema parecido, el que más ha sido estudiado es el sistema linfoide asociado a mucosas en las placas de Peyer pero es básicamente una célula epitelial diferenciada que guarda cantidades de células inflamatorias en su interior. ¿Cómo las células del sistema inmune innato son capaces de actuar contra un insulto? Las células del sistema inmune adaptativo tienen especificidad y capacidad de proliferar ante un estímulo especifico. Las células del sistema inmune innato tratan de evitar el establecimiento de una infección por mecanismos de rastreo y sensores que no son específicos, se ha propuesto recientemente que estos mecanismos son los efectores o cómplices de muchas de las enfermedades autoinmunes. Las células del SII tienen sensores de peligro a los cuales se les llama PRR´s los cuales son receptores de patrones moleculares, existen tanto anclados a la membrana del SII como en el interior del citoplasma y algunos se encuentran circulando en el torrente sanguíneo. Estos PRR´s son utilizados en la clínica diaria como mediadores inflamatorios. Por ejemplo el fibrinógeno o la proteína C reactiva son PRR´s, otro ejemplo son los receptores tipo Toll, los cuales están anclados a la membrana y tienen como objetivo detectar patrones moleculares asociados a patógenos (PAMP´s), algunos autores recientemente los han llamado MAMP´s (Patrones moleculares asociados a microorganismos), el cual es un término un poco más correcto ya que no todos los patrones que se encuentran son patógenos, algunos son producto de la flora normal. Los MAMP´s son estructuras en la membrana, en el núcleo o en los productos de secreción de un microorganismo que son capaces de estimular o activar los PRR´s en cualquiera de sus formas, con el objetivo de dar una señal de alerta a esta célula para que produzca ciertas citoquinas que atraen las células del SII sin que haya reconocimiento especifico. Por ejemplo, los gérmenes Gram negativos tienen un patrón molecular clásico que no se presenta en ningún otro grupo de bacterias y que es responsable de mucha de la patogenia asociada a la infección por estos gérmenes: los lipopolisacáridos. Este mecanismo es considerado no específico porque la célula del SII no es capaz de reconocer si es una E.coli o Klebsiella, reconoce que es un gran negativo y que el lipopolisacarido es peligroso. La parte más importante del Sistema inmune es el SII, cerca del 90% de las infecciones que tratan de entrar al cuerpo, son eliminadas en horas por medio de los mecanismos inducibles del SII. Solo es 10% tienen contacto con las células efectoras del SIA, lo cual no quiere decir que no se esté generando memoria, ya que las muestras igual se transportan al ganglio linfático para que el SIA esté alerta en caso de que haya re-exposición a futuro. Algo muy importante es que algunos de los PRR´s emiten señales de tolerancia, entonces a nivel de la flora intestinal, por ejemplo, algunas células del SII como las dendríticas emiten señales al SIA para que no se genere una respuesta hacia la flora normal. Cuando alguno de estos mecanismos de tolerancia falla, se puede generar algunas patologías como la Enfermedad inflamatoria intestinal. Recordando: El SII tiene como objetivo evitar el establecimiento de la infección, para lo cual es muy eficiente y contribuye a erradicar infecciones ya establecidas, todo mediante mecanismos inespecíficos. El SIA también protege contra infecciones solo que de forma muy lenta ya que requiere toda una reacción en el órgano linfoide secundario y lo hace por medio de mecanismo efectores específicos. Recordar que proliferación clonal es cuando una sola célula se multiplica, es decir, todo lo que deriva del mismo progenitor, de la misma célula madre, que va a tener la misma afinidad. En las células B, esa afinidad va a mejorar con la exposición a antígenos. Toda la respuesta inmune se basa en proliferación. Normalmente no es una sola clona, los microorganismos tienen muchos antígenos, por ejemplo un virus que tiene muchos antígenos, entonces van a causar una respuesta inmune policlonal, varias clonas se activan y proliferan. En esta, la célula a la que es específico ese antígeno, es la que se multiplica. Receptores de células T y B El receptor para el antígeno de los linfocitos T CD4+ cooperadores y de CD8+ citotóxicos restringidos por el MHC es un heterodímero que consta de dos cadenas polipeptídicas transmembranarias, designado TCR alfa y beta unidas entre sí de forma covalente por un enlace disulfuro. Las proteínas CD3 se asocian de forma no covalente al heterodímero alfa-beta del TCR, y cuando el TCR reconoce al antígeno, estas proteínas asociadas transducen las señales que llevan a la activación del linfocito T. El CD4 y el CD8 son correceptores del linfocito T que se unen a regiones no polimórficas de las moléculas del MHC y facilitan la producción de señales por el complejo TCR durante la activación del linfocito T. Los linfocitos T maduros expresan CD4 o CD8, pero no ambos. El CD8 y el CD4 interactúan con moléculas de las clases I y II del MHC, respectivamente, y son responsables de la restricción por las clases I o II del MHC de estos subgrupos de linfocitos T. El TCR no reconoce un antígeno solo, reconoce un antígeno capturado, procesado y presentado por un HLA. El conjunto de péptido-HLA interactúa con el TCR. Esta interacción es lo que se conoce como señal primaria. Es la que da especificidad, es fundamental pero no es suficiente. Muchas veces, las células que solo reciben esta señal, se “tolerabilizan”, en lugar de dar respuesta inmune, reconocen eso como si fuera propio. Para que se dé la respuesta, tiene que tener otras señales, señales secundarias, como el CD80, CD28, etc. Lo que hacen es que al mismo tiempo que se da la señal específica, dan la señal a la célula T CD4 de que prolifere, lo que estimula la producción de IL2, que hace que se amplifique la respuesta de las células B y se generen células de memoria. La célula T CD8 funciona igual, solo aquí es la CD8 la que entra en contacto con la CPA que es cualquier célula nucleada del cuerpo. Además la CD8 se caracteriza por producir lisis. El receptor del linfocito B para el antígeno es una forma transmembranaria de una molécula de anticuerpo (IgM e IgD) asociada a dos cadenas transmisoras de señales que sí tiene capacidad de reconocer diferentes tipos de antígenos. La Ig que más tiene capacidad de anclarse a mucosas es la IgD. La célula plasmática produce los Ac. Después de que se activa, tiene la capacidad de cambiar la cadena pesada (rearreglo genético), ya no va a producir IgDs, sino que va a producir Ig solubles. La primera respuesta siempre va a ser IgM. Antígeno leucocitario humano (HLA) o Complejo mayor de histocompatibilidad (MHC) Los HLA son moléculas que se encuentran codificadas en el cromosoma número 6. Hay de tres tipos, los de clase 1 y 2 son los importantes en el sistema inmune, los de clase 3 tienen más relevancia en el fenómeno de la coagulación, tiene que ver con la proteína C y S de la coagulación y algunas moléculas reguladoras del complemento. HLA-1: son antígenos expresados en la membrana de todas las células nucleadas del cuerpo (somáticas, no germinales). Pueden ser de tipo A, B o C. HLA–2: son expresadas en todas las células que tengan la capacidad de expresar antígenos. Pueden ser DP, DQ, DR o DM. HLA-3: no son moléculas de presentación, hay proteínas de golpe de calor, de complemento y otras citoquinas. Entonces todas las células que presentan antígenos expresan HLA-1 porque son nucleadas y HLA-2 porque presentan antígenos y las demás nucleadas que no presentan antígenos solo HLA-1. Los HLA son proteínas de gran complejidad, dos cadenas que recuperan péptidos en su hendidura para presentarlos al sistema inmune. Los de clase 1 lo que hacen es presentar péptidos propios para identificarlos como tal y que no sean atacados por el sistema inmune, concretamente por los linfocitos. Los de clase 2, muestran a las células del sistema inmune péptidos de moléculas que no son propias del cuerpo y tienen como objetivo estimular a las células efectoras SIA para que las reconozcan como ajenas y generen la respuesta inflamatoria. Los HLA tienen una alta variabilidad en la población, son moléculas muy polimórficas. Se heredan del padre y de la madre, por eso se usan para pruebas de paternidad. La probabilidad de que dos personas tengan HLA con exactamente las mismas características es muy baja, solo los gemelos homocigotos. Esta variabilidad determina las diferentes respuestas inmunes que se presentan clínicamente. Los HLA tienen la capacidad de enseñarle al sistema inmune como deben responder, son muy variables y por ende así es la respuesta inmune de la población general y son muy importantes en trasplantes tanto de órganos sólidos como de medula ósea porque la compatibilidad de estos antígenos determina el grado de rechazo hacia el trasplante, entonces cuando se va a realizar un trasplante se busca la mayor compatibilidad posible tanto de clase 1 como de clase 2 para maximizar las probabilidades de éxito. Señales Normalmente se dividen el grupo de señales necesarias para proliferar que recibe la célula B en 3 tipos: Señal 1: de reconocimiento específico, la que selecciona la célula T, se da entre la molécula del HLA + antígeno y el receptor de la célula T. esta es necesaria pero no suficiente, como se había mencionado. Con esta, no se da la respuesta inmune, si se da sola, hace que el sistema inmune se vuelva tolerante, anérgico. De hecho es una de las formas que se usan para evitar que haya rechazo de trasplantes. Señal 2: esta es la señal coestimuladora por excelencia, dada por correceptores que aumentan la estimulación de la célula T para que comience a proliferar, por medio de la expresión y secreción de IL2. Hay muchos tipos de correceptores, pero los más importantes son el CD80 y el CD28. Señal 3: es la señal soluble, a través de citoquinas. Sale de la CPA a la célula T. Se dan entre 100-150 interacciones simultáneamente en una célula para que se active y prolifere. Todas estas interacciones son con el mismo antígeno. Las moléculas migran a través de la membrana lipídica para interactuar con los HLA.