Diapositiva 1 - IES Las Viñas
Anuncio

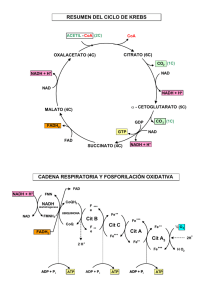
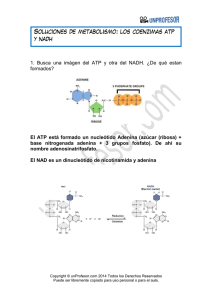
INTRODUCCIÓN AL METABOLISMO CELULAR SUSANA SERRADILLA IES LAS VIÑAS. MANILVA. Conceptos clave Los seres vivos y las células que los forman son sistemas abiertos, en equilibrio y que realizan un trabajo. Sistema abierto Intercambio de materia y energía Equilibrio. Sus variables se mantienen dentro de unos niveles de tolerancia. Energía Célula Materia Materia Energía Trabajo. Realiza trabajos dentro de su propia actividad de ser vivo (moverse, reproducirse, renovar tejidos…) Concepto de metabolismo • El metabolismo es el conjunto de reacciones químicas que se producen en el interior de las células y que conducen a la transformación de unas biomoléculas en otras. • Las distintas reacciones químicas del metabolismo se denominan vías metabólicas y las moléculas que intervienen se llaman metabolitos. • Todas las reacciones del metabolismo están reguladas por enzimas, que son específicas para cada metabolito inicial o sustrato y para cada tipo de transformación. • Las sustancias finales de una vía metabólica se denominan productos. • Las conexiones existentes entre diferentes vías metabólicas reciben el nombre de metabolismo intermediario. Se pueden considerar tres fases en el metabolismo: Catabolismo: Transformación de moléculas orgánicas complejas en otras más sencillas, con liberación de energía que se almacena en ATP. Anabolismo: Síntesis de moléculas orgánicas complejas a partir de otras más sencillas. Se necesita suministrar energía, en forma de ATP Anfibolismo: (una fase intermedia). Procesos en los que se almacena gran cantidad de energía (para los posteriores procesos anabólicos) Moléculas que intervienen en el metabolismo Metabolitos Nucleótidos Moléculas con enlaces ricos en energía Glucosa, ácidos grasos… NAD, FAD, NADP… ATP, coA Moléculas ambientales O2, H2O, CO2 Tipos de metabolismo Las células se encuentran siempre en un proceso constante de autodestrucción y autoregeneración. • El metabolismo forma una unidad, aunque se estudia fragmentado en rutas o vías metabólicas. • Las rutas metabólicas no son independientes entre si , poseen encrucijadas comunes. • Un mismo metabolito común a dos rutas podrá seguir por una o por otra en función de las condiciones celulares. Para crecer y desarrollarse, todos los seres vivos necesitan incorporar materia y energía y en función de estas clasificamos los distintos tipos de metabolismo de los seres vivos. MATERIA. 1. Si la fuente de carbono es el dióxido de carbono (CO2 atmosférico) o carbono inorgánico, se habla de metabolismo autótrofo 2. Si la fuente es la propia materia orgánica (formas más o menos reducidas del carbono como metano, glucosa, grasas, etc., es decir, el llamado carbono orgánico), se habla de metabolismo heterótrofo. ENERGIA 1. Fotosintéticos si energía es la luz. la 2. Quimiosíntéticos si desprendida en químicas. fuente de es energía reacciones TIPO DE ORGANISMO FUENTE DE ENERGÍA FUENTE DE C ORGANISMOS Fotolitótrofo Luz solar CO2 Vegetales. Bact. fotosintéticas Fotoorganótrofo Luz solar Comp. orgánicos Bacterias purpúreas Quimiolitótrofo Reacciones redox CO2 Bacterias desnitrificantes Quimioorganótrofo Reacciones redox Comp. orgánicos Animales y Hongos El ATP Puede actuar como molécula energética, al ser capaz de almacenar o ceder energía gracias a sus dos enlaces éster-fosfóricos que son capaces de almacenar cada uno de ellos, 7,3 kcal/mol. ATP + H2O ADP + Pi + energía (7,3 kcal/mol) ADP + H2O AMP + Pi + energía (7,3 kcal/mol) También se pueden dar las reacciones inversas (almacén de energía) Se dice que el ATP es la moneda energética de la célula, pues representa la manera de tener almacenado un tipo de energía de pronto uso. En ocasiones son utilizados para el mismo fin otros nucleótidos como el GTP el UTP o el CTP. La síntesis de ATP puede realizarse por dos vías: Fosforilación a nivel de sustrato. Síntesis de ATP gracias a la energía que se libera de una biomolécula al romperse uno de sus enlaces ricos en energía, (ocurre en algunas reacciones de la glucólisis y del ciclo de Krebs). Las enzimas que regulan estos procesos se denominan quinasas. Fosforilación en el transporte de electrones. Mediante enzimas del grupo de las ATP-sintetasas existentes en las crestas de las mitocondrias (fosforilación oxidativa) o en los tilacoides de los cloroplastos (fotofosforilación), cuando dichas enzimas son atravesadas por un flujo de protones (H+ ). • Muchas de las reacciones del catabolismo suponen la oxidación de un sustrato, lo cual libera electrones. • Por el contrario, el anabolismo frecuentemente consiste en reacciones de reducción que requieren electrones. • Los electrones son transportados desde las reacciones catabólicas de oxidación hasta las reacciones anabólicas de reducción. • Intervienen coenzimas transportadores de electrones, como el NAD o el FAD, que llevan electrones de un punto a otro de la célula de un modo similar a como el ATP transporta la energía. • Cuando uno de estos coenzimas se encuentra cargado de electrones, en estado oxidado, se dice que tiene poder reductor, puesto que al liberarse de los electrones podrá reducir a otro compuesto. Reacciones catabólicas (oxidación de moléculas) Liberación de e- que van a los coenzimas NAD FAD NADH FADH2 Liberación de e- desde los coenzimas que van a reducir otras moléculas Reacciones anabólicas (reducción) Balance del metabolismo En las reacciones metabólicas, la energía generada se transforma, parte en ATP que si puede ser utilizado por la célula, y otra parte, se transfiere al entorno en forma de calor: Por ejemplo: Un mol de glucosa por combustión genera 680 Kcal. Mediante reacciones metabólicas da 36 ATP (262,8 Kcal) y 417 Kcal se pierden en forma de calor Balance del metabolismo Número de moléculas con enlaces ricos en energía (ATP u otros), que se producen por cada metabolito oxidado. Balance energético En general: Relación: ATP/metabolito oxidado Balance positivo Se obtiene ATP Balance negativo Se gasta ATP Ruta catabólica Ruta anabólica Glucolisis Síntesis de proteínas • Rutas catabólicas: Balance positivo • Rutas anabólicas: Balance negativo Control del metabolismo 1.- El control bioquímico Las sustancias que intervienen en el metabolismo celular son muy estables a temperatura ambiente Sin “ayuda” no reaccionarían o lo harían tan lentamente que no sería posible la vida. Esta dependencia de ayuda es paradójicamente una gran ventaja, ya que permite al organismo regular qué reacciones se han de dar y en que momento, es decir, el control bioquímico del metabolismo 2.- Control hormonal o sistema endocrino. El elemento fundamental de este sistema de control son las hormonas, que actúan específicamente sobre determinadas células como mensajeros químicos, regulando el metabolismo interno Muchas sustancias químicas, desprenden energía calorífica, son las reacciones exergónicas. Este desprendimiento se debe a que la energía interna de los reactivos, (energía química de los enlaces), es mayor que la energía interna de las sustancias producidas (productos). Estas reacciones no se dan de forma espontánea porque para iniciar una reacción, primero es necesario suministrar la energía suficiente para debilitar los enlaces de los reactivos y posibilitar así su rotura. Reactivos Productos E. interna (reactivos) > E. interna (productos) Este paso intermedio, que requiere un aporte de energía, recibe el nombre de estado de transición, y en él hay tantas posibilidades de que las moléculas acaben formando el producto como de que retrocedan. Energía de activación Reactivos Estado de transición Productos Ejemplos: • • Tirar por la ventana un objeto que está sobre el suelo. El papel no arde espontáneamente pese a la presencia de oxígeno en el aire, y sí lo hace cuando se calienta hasta una determinada temperatura. Enzimas Para acelerar una reacción química también hay dos soluciones: 1. Calentar los reactivos. 2. Añadir un catalizador, En los seres vivos, un aumento de temperatura podría provocar la muerte, por lo que se sigue el segundo mecanismo, es decir, el concurso de catalizadores biológicos o biocatalizadores. Las moléculas que desempeñan esta función son las enzimas Enzimas • Las enzimas son los catalizadores de las reacciones biológicas. • Actúan rebajando la energía de activación, y por tanto acelerando la velocidad de la reacción, la cual se puede medir por la cantidad de producto que se forma por unidad de tiempo. • Exceptuando las ribozimas, son proteínas globulares, solubles en agua, que se difunden bien en los líquidos orgánicos, y que pueden actuar a nivel intracelular, es decir, en el interior de la célula donde se han formado, o a nivel extracelular, en la zona donde se segregan, como sucede con las enzimas digestivas. • Las ribozimas son unos ARN capaces de catalizar a otros ARN, quitándoles o añadiéndoles nucleótidos, sin consumirse ellos mismos. • Se considera que en la primera materia viva la función catalítica la realizaba el ARN, luego aparecieron las proteínas, en las que se delegó la función enzimática, y los ADN, en los que se delegó, por su mayor estabilidad, la función de almacenar la información. Las enzimas cumplen las dos características de todos los catalizadores: • • Incluso en cantidades muy pequeñas, aceleran la reacción. No se obtiene más producto, sino la misma cantidad en menos tiempo. No se consumen durante la reacción biológica. Además, a diferencia de los catalizadores no biológicos, las enzimas presentan estas características: • Son muy específicas. Pueden actuar en una reacción determinada sin alterar otras. • Actúan siempre a temperatura ambiente, la temperatura del ser vivo. • Son muy activas. Algunas consiguen aumentar la velocidad de reacción mas de un millón de veces, muy superior a los catalizadores no biológicos. • Presentan un peso molecular muy elevado. • Dada su naturaleza proteica, su síntesis implica una codificación genética. Diferencias entre catalizadores biológicos y químicos BIOLÓGICOS QUÍMICOS Son específicos para una determinada reacción química o para un grupo de reacciones químicas a para un sustrato o grupo de sustratos. Aceleran cualquier reacción inespecíficamente. Son proteínas (aunque hay ARN – Ribozimas- con función enzimática). Son sustancias simples finamente divididas. Son saturables No son saturables. Son altamente eficaces (son eficaces en bajas concentraciones). Son medianamente eficaces. Puede ser regulada su actividad catalítica. No pueden ser regulados. Son termolábiles y su actividad puede variar también de acuerdo al pH del medio. No son termolábiles ni se alteran con cambios de pH. Factores que afectan la actividad enzimática Influencia de la temperatura. • • • Si a una reacción enzimática se le suministra energía calorífica, las moléculas aumentan su movilidad y el número de encuentros moleculares, por lo que aumenta la velocidad en que se forma el producto. Existe una temperatura óptima para la cual la actividad enzimática es máxima. Si la temperatura aumenta, se dificulta la unión enzima-sustrato y a partir de cierta temperatura la enzima se desnaturaliza, pierde su estructura terciaria y cuaternaria si la tiene y, por tanto, pierde su actividad enzimática. Factores que afectan la actividad enzimática Influencia del pH. • Las enzimas presentan dos valores límite de pH entre los cuales son eficaces; traspasados estos valores, las enzimas se desnaturalizan y dejan de actuar. • Entre los dos límites existe un pH óptimo en el que la enzima presenta su máxima eficacia. • El pH óptimo está condicionado por el tipo de enzima y de sustrato, debido a que el pH influye en el grado de ionización de los radicales del centro activo de la enzima y también de los radicales del sustrato. • Las variaciones de pH provocan cambios en las cargas eléctricas, alterando la estructura terciaria del enzima y por tanto, su actividad. Factores que afectan la actividad enzimática Inhibidores. • Los inhibidores son sustancias que disminuyen la actividad de una enzima o bien impiden completamente la actuación de la misma. • Pueden ser perjudiciales o beneficiosos como, por ejemplo, la penicilina, que es un inhibidor de las enzimas que regulan la síntesis de la pared bacteriana, por lo que es útil contra las infecciones bacterianas, y el AZT, que es un inhibidor de la transcriptasa inversa, por lo que retrasa el desarrollo del SIDA. Factores que afectan la actividad enzimática Concentración del sustrato A mayor concentración del sustrato, a una concentración fija de la enzima se obtiene la velocidad máxima. Después de que se alcanza esta velocidad, un aumento en la concentración del sustrato no tiene efecto en la velocidad de la reacción. Concentración de la enzima Siempre y cuando haya sustrato disponible, un aumento en la concentración de la enzima aumenta la velocidad enzimática hacia cierto límite. Velocidad de la reacción Después de que se alcanza esta velocidad, un aumento en la concentración del sustrato no tiene efecto en la velocidad de la reacción. (todos los enzimas están ocupados) A medida que aumenta la concentración de sustrato, aumenta la velocidad de reacción (mientras queden enzimas libres). Concentración de sustrato (concentración de enzima fija) Velocidad de la reacción Después de que se alcanza esta velocidad, un aumento en la concentración del enzima no tiene efecto en la velocidad de la reacción. (no hay más sustrato que procesar) A medida que aumenta la concentración de enzima, aumenta la velocidad de reacción (mientras queden sustrato sin reaccionar). Concentración de enzima (concentración de sustrato fija) Cofactores enzimáticos Sólo proteínas Cationes metálicos (Ca2+ Fe2+..) Enzimas Coenzimas NAD, FAD Cofactor Moléculas orgánicas Holoenzimas Apoenzima (parte proteica) Grupo prostético (Grupo hemo) Nomenclatura de los Enzimas 1. NOMENCLATURA ANTIGUA: SUFIJO -asa • Nombre de la fuente u origen del enzima: Pancreasa • Nombre del sustrato: Proteasa • Tipo de reacción catalizada: Hidrolasa 2. NOMENCLATURA ACTUAL: Enzyme Commission [E.C.] de la IUBMB • Clasificación de enzimas (6 clases) • Asignación de código E.C.: 1.1.1.1 • Nombre sistemático: Sustrato:Cosustrato Tipo de Reacción -asa Etanol:NAD+ Oxidorreductasa Clasificación de los Enzimas CLASE TIPO DE REACCION CATALIZADA 1. OXIDO-REDUCTASAS 20 subclases Transferencia de electrones Sred + S’ox Sox + S’red 2. TRANSFERASAS 9 subclases Transferencia de grupos S-grupo + S’ S’-grupo + S 3. HIDROLASAS 11 subclases Rotura hidrolítica de enlaces A-B + H2O A-H + B-OH 4. LIASAS 7 subclases Rotura de enlaces A-B A+B Salida de grupos CX-CY C=C + X-Y Adición a dobles enlaces C=C + XY CX-CY 5. ISOMERASAS 6 subclases Cambios internos Transferencias internas de grupos 6. LIGASAS 5 subclases Formación de enlaces mediante reacciones de condensación con gasto de energía (ATP) International Union of Biochemistry and Molecular Biology [IUBMB] La reacción enzimática 1. La enzima (E) actúa fijando al sustrato en su superficie (adsorción) mediante enlaces débiles 2. Se forma el complejo enzíma-sustrato (ES). Se generan tensiones que debilitan los enlaces del sustrato, por lo que para llegar al estado de transición del complejo enzima-sustrato, (complejo activado) se requiere mucha menos energía que para llegar al estado de transición del sustrato solo. 3. Se liberan la enzima intacta (E) y el producto (P) El centro activo de los enzimas • La actividad enzimática se inicia con la formación del complejo ES. • Esta unión se realiza gracias a los radicales de algunos pocos aminoácidos que establecen enlaces con el sustrato (y con el grupo prostético si lo hay), fijándolo y luego rompiendo alguno de sus enlaces. • La región de la enzima que se une al sustrato recibe el nombre de centro activo. Características del centro activo • Es una parte muy pequeña del volumen total de la enzima. • Tienen una estructura tridimensional en forma de hueco que facilita encajar al sustrato. • Están formados por aminoácidos lejanos en la secuencia polipeptídica, que debido a los repliegues de ésta, quedan próximos. • Los radicales de estos aminoácidos presentan afinidad por el sustrato, lo atraen y establecen enlaces débiles con él. • Esto facilita que, una vez roto alguno de sus enlaces, los productos resultantes se puedan separar con facilidad del centro activo. La especificidad de los enzimas Fischer (1890) Modelo «llave (sustrato) - cerradura (enzima)» La especificidad de los enzimas En la actualidad se ha visto que algunas enzimas, al establecer los enlaces con el sustrato, modifican la forma de sus centros activos para adaptarse mejor al sustrato, es decir, solamente son complementarias después de haberse unido a él, es el llamado acoplamiento inducido (como el guante (enzima) se adapta a la mano (sustrato)). La especificidad puede darse en varios grados. • Especificidad absoluta. Se da cuando la enzima sólo actúa sobre un sustrato, por ejemplo, la ureasa sólo actúa sobre la urea. • Especificidad de grupo. Se da cuando la enzima reconoce un determinado grupo de moléculas, por ejemplo, la β-glucosidasa que actúa sobre todos los β-glucósidos • Especificidad de clase. Es la menos específica, dado que la actuación de la enzima no depende del tipo de molécula, sino del tipo de enlace Por ejemplo, las fosfatasas separan los grupos fosfato de cualquier tipo de molécula. Eficacia de las vías metabólicas En las vías metabólicas el producto generado por una enzima es el sustrato de la siguiente enzima, por ello, para aumentar la eficiencia del sistema hay distintos mecanismos: 1. La compartimentación. Consiste en separar mediante membranas los lugares donde se realizan aquellas vías metabólicas que no se desea que se relacionen 2. Complejo multienzimático. Es la asociación de varias enzimas que actúan sucesivamente en una vía. El complejo supramolecular resultante es más eficaz que si las enzimas estuvieran dispersas en el medio. 3. Inclusión en membranas. Algunas enzimas y algunos complejos multienzimáticos se encuentran englobados de forma ordenada en las membranas, de forma que esto facilita la unión entre los sucesivos productos y las sucesivas enzimas. Vitaminas Son moléculas muy variadas que pueden pertenecer a distintos grupos de principios inmediatos. Algunas son indispensables en la dieta, ya que no pueden ser sintetizadas por el organismo (excepto la B5). Otras vitaminas son necesarias para la actuación de determinados enzimas, ya que funcionan como coenzimas que intervienen en distintas rutas metabólicas y , por ello, una deficiencia en una vitamina puede originar importantes defectos metabólicos. Las cantidades necesarias son mínimas (una dieta variada garantiza las necesidades del organismo) Las vitaminas se clasifican según su solubilidad en agua: 1. Vitaminas hidrosolubles. • Actúan como coenzimas o precursores de coenzimas. • Son las del complejo B o la vitamina C 2. Vitaminas liposolubles. • No son solubles en agua y si en disolventes no polares. • Son lípidos insaponificables. • No suelen ser cofactores o precursores. • Son las vitaminas A,D,E y K Avitaminosis Defecto Hipovitaminosis Vitaminas Exceso Hipervitaminosis VITAMINAS FUNCIONES Enfermedades carenciales C (ácido ascórbico) Coenzima de algunas peptidasas. Interviene en la síntesis de colágeno Escorbuto B1 (tiamina) Coenzima de las descarboxilasas y de las enzima que transfieren grupos aldehidos Beriberi B2 (riboflavina) Constituyente de los coenzimas FAD y FMN Dermatitis y lesiones en las mucosas B3 (ácido pantoténico) Constituyente de la CoA B5 (niacina) Constituyente de las coenzimas NAD y NADP B6 ( piridoxina) B12 (cobalamina) Biotina Interviene en las reacciones transferencia de grupos aminos. Fatiga y trastornos del sueño de Pelagra Depresión, anemia Coenzima en la transferencia de grupos metilo. Anemia perniciosa Coenzima de las enzimas transfieren grupos carboxilo, metabolismo de aminoácidos. Fatiga, dermatitis... que en A (retinol) Ciclo visual, crecimiento, protección y mantenimiento del tejido epitelial Ceguera nocturna, xeroftalmia, desecación epitelial D Metabolismo del Ca2+, esencial en el crecimiento y mantenimiento de los huesos Raquitismo, deformidades óseas CATABOLISMO CATABOLISMO Y OBTENCIÓN DE ENERGÍA. Concepto de catabolismo. • El catabolismo es la fase degradativa del metabolismo y su finalidad es la obtención de energía. • Las moléculas orgánicas son transformadas en otras más sencillas que intervendrán en otras reacciones metabólicas hasta transformarse en los productos finales del catabolismo, que son expulsados de la célula. Son los llamados productos de excreción (CO2, NH3, urea, ácido úrico, etc.). • La energía liberada en el catabolismo es almacenada en los enlaces ricos en energía del ATP y posteriormente podrá ser reutilizada. • El catabolismo es semejante en los organismos autótrofos y en los heterótrofos. Las reacciones del catabolismo Son reacciones de oxidación y pueden ser: 1. Mediante la pérdida de átomos de hidrógeno que se encuentran unidos al carbono (deshidrogenación). 2. Por ganancia de átomos de oxígeno (oxigenación). Deshidrogenación. Una molécula orgánica se oxida al perder átomos de hidrógeno (por ejemplo, estableciéndose un doble enlace entre dos carbonos). CH3-CH2-CH2- ... + B CH3-CH= CH - ... + BH2 Oxigenación. Una molécula orgánica se oxida al incorporar átomos de oxígeno. (por ejemplo, en la molécula anterior podría ser así): CH3-CH2-CH2- ... + BO CH3-CH2 - CHOH- ... + B Las reacciones catabólicas son reacciones redox. En ellas unos compuestos se oxidan y otros se reducen. En la materia orgánica, para que una molécula pueda deshidrogenarse, ha de haber otra que acepte esos hidrógenos (molécula aceptora de hidrógeno). Los átomos de hidrógeno desprendidos en las reacciones de oxidación son captados los transportadores de hidrógeno, (NAD+, NADP+ y FAD), hasta que finalmente son traspasados a la molécula aceptora final de hidrógeno, que se reduce. AH2 + FAD A + FADH2 B + FADH2 BH2 + FAD En las reacciones de oxidación y reducción, frecuentemente los protones (H+) y los electrones (e-) van separados: Los electrones antes de llegar a la molécula aceptora final de electrones, son captados por los llamados transportadores de electrones, que son los citocromos. El paso de los electrones de un citocromo a otro conlleva una disminución del nivel energético del electrón y la liberación de una energía que es utilizada para fosforilar el ADP y formar moléculas de ATP. Si se trata de una oxidación por oxigenación, ha de haber una sustancia donadora de átomos de oxígeno. electrones Nivel energético electrones citocromos Cuanto más negativo sea el potencial redox, más capacidad de reducción tiene el compuesto. Cuanta mayor sea la diferencia del potencial de reducción entre el estado final e inicial de la reacción, mayor será la energía desprendida. En la gráfica adjunta: – El NADH puede dar electrones al citocromo Q, pero no a la inversa. – Se trata de un proceso aerobio porque el último aceptor es el oxígeno. Tipos de catabolismo Según sea la naturaleza del aceptor final de electrones, se distinguen dos tipos de catabolismo: 1. Respiración aerobia 2. Respiración anaerobia En la respiración la molécula que se reduce es un compuesto inorgánico, por ejemplo O2, NO3-, SO42- , etc. Si es el oxígeno (O2) se denomina respiración aeróbica, y si es una sustancia distinta del oxígeno, por ejemplo, el NO3-, SO42-, etc , se denomina respiración anaeróbica Catabolismo Respiración Fermentación Oxidación parcial de la materia orgánica. Los productos de reacción contienen todavía energía. Se libera poca energía El aceptor final de electrones es una molécula orgánica. Oxidación total de la materia orgánica. Los productos de reacción no contienen energía. Se libera toda la energía. Aerobia Anaerobia Láctica Alcohólica Aceptor final el O2 Aceptor final molécula inorgánica distinta del O2 Procesos catabólicos aerobios Aminoácidos Glúcidos Grasas Desaminación Glucólisis Beta oxidación Acido pirúvico Acetil coA Ciclo de Krebs Cadena respiratoria Fermentaciones o El aceptor final de electrones es algún compuesto de naturaleza orgánica. o Los procesos fermentativos liberan una menor cantidad de energía que la respiración aerobia, debido a que la oxidación del sustrato no es completa. o No es necesaria la presencia de oxígeno, (no actúa como aceptor final de electrones). o Las fermentaciones las realizan varias bacterias y levaduras y tienen una gran importancia por sus aplicaciones industriales (fabricación de cerveza, vino, yogur, etc.). o Dentro de las fermentaciones se puede incluir el proceso de putrefacción, que es la fermentación de las proteínas. El catabolismo de los glúcidos • En animales, mediante los procesos digestivos, los polisacáridos ingeridos son hidrolizados y convertidos en monosacáridos (glucosa, fructosa o galactosa). • Las reservas de glucógeno del tejido muscular de los animales o las reservas de almidón de los vegetales también pueden ser hidrolizadas, cuando se requiere energía, en glucosa. • La glucosa es el más abundante de los monosacáridos, y su proceso degradativo sirve de ejemplo del catabolismo respiratorio de los glúcidos. • En su degradación total, hasta el aprovechamiento completo de toda la energía liberada, se distinguen dos fases: la glucólisis y la respiración. • En la respiración se distinguen dos procesos, el ciclo de Krebs y el transporte de electrones en la cadena respiratoria. GLUCOLISIS • La glucólisis ("rotura de glucosa") es la secuencia de reacciones que convierten una molécula de glucosa (seis carbonos) en dos moléculas de piruvato (tres carbonos) produciendo ATP. • Cada reacción es regulada por una enzima específica y en el proceso total hay una ganancia neta de dos moléculas de ATP. • Las reacciones de la glucólisis se llevan a cabo en el citoplasma. • Los ingredientes necesarios, como ADP, NAD+ y fosfato, se encuentran libremente en el citoplasma y se utilizan conforme se hace necesario. • La glucólisis no requiere de oxígeno y puede realizarse en condiciones aerobias o anaerobias. La glucólisis se realiza en dos etapas. Fase preparatoria: • • • Hay una inversión inicial de energía para facilitar la degradación. Es una etapa en la que se invierten dos moléculas de ATP por cada molécula de glucosa que comienza a ser degradada Se obtienen dos moléculas de tres átomos de carbono conteniendo grupos fosfato. Fase de beneficio: • • • • Las moléculas producidas en la fase anterior se convierten en dos moléculas de ácido pirúvico (disociado como piruvato). En este proceso se produce una oxidación que genera dos moléculas de NADH. La energía producida por la oxidación es aprovechada para fabricar ATP a partir de ADP y fosfato inorgánico (“fosforilación a nivel de sustrato”). En esta segunda etapa se forman 4 ATP, con lo que el balance global es energéticamente positivo (+ 2 ATP). Fase preparatoria Fase de beneficio Balance energético de la glucólisis Glucosa + 2 ADP + 2 Pi + 2 NAD+ 2 piruvato + 2 ATP + 2 NADH + 2 H+ + 2 H2O Etapas clave de la glucólisis La etapa 5 del proceso es un punto crucial de esta ruta metabólica. Es necesario que se oxide el NADH producido. Esta oxidación puede hacerse de dos formas: 1. En presencia de oxígeno (respiración celular en las mitocondrias) • El NADH extramitocondrial entra en la mitocondria gracias a un intermediario y se convierte en FAD reducido que va a la cadena respiratoria 2. En ausencia de oxígeno (fermentaciones, en el citosol). • El NADH extramitocondrial se oxida a NAD+ mediante la reducción del piruvato El balance energético de una u otra vía van a ser muy diferentes. Matriz mitocondrial NAD+ Glicerol 3 P NADH DHAP Citosol FAD Glicerol 3 P DHAP FADH2 Espacio intermembrana Membrana mitocondrial externa A la cadena respiratoria Membrana mitocondrial interna La respiración: el ciclo de Krebs 1. Este ciclo es la ruta final de la oxidación del piruvato, ácidos grasos y cadenas de carbono de los aminoácidos. 2. Se lleva a cabo en la mitocondria. 3. Cada reacción es catalizada por una enzima específica. 4. En la mayoría de los procariotas las enzimas del ciclo se localizan en el citosol, en tanto que en los eucariotas están dentro de las mitocondrias. 5. Es necesaria una transformación del piruvato para que se inicie el proceso. Oxidación del ácido pirúvico a Acetil-S-CoA El ácido pirúvico producido en la glucólisis, para poder ser oxidado por respiración debe entrar en el interior de las mitocondrias atravesando la doble membrana de éstas. Para ello sufre un proceso de oxidación y descarboxilación (pérdida de un átomo de carbono) en el que intervienen varias enzimas y coenzimas (el sistema piruvato-deshidrogenasa), transformándose en acetil-S-CoA. Esta molécula se puede ya incorporar al ciclo de Krebs, cuyos pasos son los siguientes: 1. Unión del acetil-S-CoA (2C) con el ácido oxalacético (4C) para formar el ácido cítrico (6C). 2. El ácido cítrico se isomeriza a ácido isocítrico. 3. El ácido isocítrico se descarboxila y se oxida perdiendo hidrógenos, con lo que se forma el ácido α-cetoglutárico (5 C). 4. El ácido α-cetoglutárico se descarboxila y deshidrogena, formándose succinil-CoA (4 C) y necesitándose para la reacción la ayuda del CoA. 5. El succinil-CoA pierde el CoA y se transforma en ácido succínico, liberándose una energía que es suficiente para fosforilar una molécula de GDP y formar una de GTP. 6. El ácido succínico se oxida a ácido fumárico. 7. El ácido fumárico se hidrata y se transforma en ácido málico. 8. El ácido málico se oxida y se transforma en ácido oxalacético, con lo que se cierra el ciclo. 66 La reacción global del sistema piruvato-deshidrogenasa y del ciclo de Krebs es (sin poner el CoA): CH3-CO-COOH + 2H2O + 4NAD+ + FAD + GDP + Pi 3 CO2 + 4NADH + 4H+ + FADH2 + GTP Como en el ciclo de Krebs penetra un compuesto de dos C (el acetil-S-CoA) y se producen dos descarboxilaciones (pasos 3 y 4), la molécula queda totalmente degradada. Además, como en la glucólisis se forman dos moléculas de ácido pirúvico, para la degradación total de una molécula de glucosa son necesarias dos vueltas del ciclo de Krebs. Los GTP se transforman posteriormente en ATP. Balance energético del ciclo de Krebs Acido Pirúvico Acetil CoA 4 NADH 1 FADH2 1 GTP Como se obtienen 2 piruvatos por cada molécula de glucosa: 2 Acidos Pirúvicos 2 Acetil CoA 8 NADH 2 FADH2 2 GTP La respiración: el transporte de electrones en la cadena respiratoria Durante el catabolismo de la glucosa se obtienen varios coenzimas reducidos: NADH + H+ y FADH2 (moléculas con un alto poder reductor). Estas moléculas se van a oxidar en la última etapa de la respiración, la cadena respiratoria. Pasan por una cadena en la que se reducen y se oxidan diferentes moléculas, a medida que se van traspasando unas a otras los protones y los electrones procedentes del NADH y del FADH2. En esta cadena, los transportadores de electrones pueden estar agrupados en grandes complejos de enzimas respiratorios, que se ocupan de transportar simultáneamente electrones y protones (H+) • complejo NADH deshidrogenasa • el complejo coenzima-Q reductasa o ubiquinona, • los citocromos: • complejo de citocromos b-C1, • complejo citocromo-oxidasa La energía que se libera cuando pasan los electrones se utiliza para bombear protones desde la matriz mitocondrial al espacio intermembrana. En las células eucariotas, las moléculas que integran la cadena respiratoria se encuentran en las crestas mitocondriales. En las bacterias, están situadas en los mesosomas Cada transportador tiene un potencial de reducción (tendencia a dar electrones) inferior al anterior (y por tanto se oxida al ceder los e-) y superior al siguiente (se reduce al aceptar los e-). Como la energía liberada durante la oxidación es mayor que la consumida para la reducción, en cada paso hay un sobrante de energía que se invierte en la síntesis de ATP. Si las oxidaciones que se producen en la fosforilación oxidativa se hicieran en un solo paso, se liberaría una gran cantidad de calor, que además de suponer una pérdida de energía, sería incompatible con las condiciones celulares. . Cada transportador de electrones de la cadena se oxida al ceder electrones y el siguiente se reduce al aceptarlos. Como la energía liberada durante la oxidación es mayor que la consumida para la reducción, en cada paso hay un sobrante de energía que se invierte en la síntesis de ATP. Si las oxidaciones que se producen en la fosforilación oxidativa se hicieran en un solo paso, se liberaría una gran cantidad de calor, que además de suponer una pérdida de energía, sería incompatible con las condiciones celulares. Fosforilación oxidativa. Hipótesis quimiosmótica de Mitchell. • Según esta teoría, la energía liberada se invierte en provocar un bombeo de protones (H+) desde la matriz mitocondrial al espacio intermembranal. • Se crea un gradiente electroquímico. • Cuando los protones (H+) en exceso en el espacio intermembranoso vuelven a la matriz mitocondrial, lo hacen atravesando las partículas F o complejos enzimáticos ATP-sintetasa, suministrándoles la energía necesaria para la síntesis de ATP. • Se ha calculado que los H+ bombeados en cada uno de los complejos NAD deshidrogenasa, citocromos b-c1 y citocromo-oxidasa, son suficientes para sintetizar un ATP. • A partir de un NADH+H+ que ingresa en la cadena respiratoria se obtienen 3ATP. • A partir de un FADH2 sólo se obtienen 2ATP, ya que el FADH2 se incorpora a la cadena respiratoria en el complejo coenzima Q reductasa. • Al final de la cadena respiratoria aeróbica los hidrógenos se unen al oxígeno y forman agua. Partículas F • • Forman canales por donde pasan los protones Están formados por: 1. Complejo enzimático F1 2. Zona de anclaje Fo • Por cada 3 protones que pasan se forma una molécula de ATP Rendimiento energético del catabolismo por respiración de la glucosa: • • • • En la glucólisis por cada molécula de glucosa que es degradada se forman dos moléculas de ácido pirúvico, 2 NADH y 2 ATP. En el sistema piruvato-deshidrogenasa y en el ciclo de Krebs se producen 1 GTP (equivalente a 1 ATP), 4 NADH y 1 FADH2. Si las dos moléculas de ácido pirúvico obtenidas en la glucólisis inician el ciclo de Krebs, todos los productos de éste hay que multiplicarlos por dos: 2 GTP (equivalente a 2 ATP), 8 NADH y 2 FADH2. Las coenzimas reducidas ingresan en la cadena respiratoria y se forma ATP. En las bacterias, como el NADH que se obtiene en la glucólisis no tiene que entrar en la mitocondria (no hay), pasa directamente a la cadena respiratoria y se obtienen 3 ATP en lugar de 2. El balance global es de 38 ATP en lugar de 36 ATP (eucariotas). Rendimiento energético del catabolismo por respiración de la glucosa: Proceso Glucolisis Respiración Citoplasma Matriz mitocondrial 2 ATP 2 NADH Ac. Piruvico a Ac. CoA 2 X (1NADH) Ciclo de Krebs 2 X (1 GTP) 2 X(3 NADH) 2 X(1 FADH2) Balance energético global (por molécula de glucosa) Transporte electrónico Total 2 FADH2 2 x (2ATP) 2 ATP 4 ATP 2 x (3ATP) 6 ATP 6 x (3ATP) 2 x (2ATP) 2 ATP 18 ATP 4 ATP 36 ATP CATABOLISMO DE OTROS NUTRIENTES • Muchos organismos dependen de otros nutrientes, además de la glucosa. • Los seres humanos y otros animales obtienen más energía mediante la oxidación de los ácidos grasos provenientes de los triglicéridos (aceites o grasas) que de la oxidación de la glucosa. • En algunos casos también los aminoácidos de las proteínas pueden ser utilizados como combustible. • Estos nutrientes se transforman en alguno de los intermediarios que intervienen en la glucólisis o en el ciclo del ácido cítrico. Catabolismo de los lípidos • • • • • Tiene lugar en la matriz mitocondrial y los peroxisomas. Cada gramo de triglicérido contiene más del doble de kilocalorías que 1 g de glucosa o de aminoácidos. Las grasas son ricas en calorías porque contienen un gran número de átomos de hidrógeno. Tanto el glicerol como los ácidos grasos de las grasas neutras pueden utilizarse como combustible. El glicerol es fosforilado y luego oxidado a PGAL (gliceraldehído-3fosfato) y entonces sigue la ruta de la glucólisis, pero el 95% de la energía de las grasas reside en los ácidos grasos. Glicerol Glucólisis Ácidos grasos -oxidación Grasas -oxidación de los ácidos grasos • • • • Tiene lugar en la matriz mitocondrial. Antes de entrar en la matriz mitocondrial, los ácidos grasos se activan uniéndose a la coenzima A, y forman un acil-CoA (espacio intermembrana El Acil-CoA entra en la matriz previa unión a la carnitina, que actúa como lanzadera. El Acil CoA empieza el proceso de -oxidación Activación de un ácido graso y traslocación de acil-CoA resultante por la carnitina Rojo: acil-CoA, verde: carnitina, Rojo+verde: acilcarnitina, CoASH: coenzima A, CPTI: carnitina palmitoiltransferasa I, CPTII: carnitina palmitoiltransferasa II, 1: acil-CoA sintetasa, 2: translocasa, A: membrana mitocondrial extena, B: espacio intermembrana, C: membrana mitocondrial intena, D: matriz mitocondrial Los ácidos grasos son convertidos en unidades de acetilco A en un proceso que se denomina -oxidación porque el carbono destinado a ser oxidado es el carbono (el carbono siguiente al , que es el vecino al grupo ácido). CH3-CH2-(CH2)n-CH2-CH2-COOH El proceso, en cuatro pasos da como resultado un acil CoA con 2 carbonos menos, un acetil CoA que se incorpora al ciclo de Krebs, una molécula de FADH2 y otra de NADH (estas dos últimas pasan a la cadena de transporte electrónico). El Acil CoA comienza un nuevo ciclo y así continúa hasta la total degradación del ácido graso. En general los ácidos grasos de los triglicéridos tienen número par de átomos de carbono, por lo que el número de moléculas de coenzima A producidas es igual a la mitad del número de átomos de carbono del ácido graso sometido a -oxidación. CoA-SH CH3-(CH2)n- CH2-CH2-COOH β CITOPLASMA CH3-(CH2)n- CH2-CH2-COSCoA (ACIL CoA) α SE INTRODUCE EN LA MITOCO ATP ADP FAD D. H SIGUE DEGRADÁNDOSE DE 2 2N 2 C FADH2 CH3-(CH2)n-COSCoA +CH3-CO-SCoA Acetil CoA LIASA CoA-SH MATRIZ CH3-(CH2)n- CH=CH-COSCoA PRODUCTOS FINALES (POR 2 CARBONOS) H CADA 0 HIDROLASA 2 CH3-(CH2)n- CO-CH2-COSCoA NADH+H+ NAD+ D.H. AL CICLO CH3-(CH2)n- CHOH-CH2-COSCoA DE KREBS Rendimiento de la oxidación de ácido palmítico (16C) Activación del acido graso Ciclo de Krebs Cadena respiratoria - 2 ATP 8 Acetil Co A -2 ATP 8* ( 3 NADH + 1 FADH2 + 1 GTP) = (12 ATP) * 8 96 ATP 7 NADH 3 ATP * 7 21 ATP 7 FADH2 2 ATP * 7 14 ATP TOTAL 129 ATP Catabolismo de los aminoácidos • Las proteínas y los péptidos extracelulares tienen que hidrolizarse primero a aminoácidos para poder usarse como fuente energética. • En las proteínas hay 20 aminoácidos con diversos esqueletos carbonados, por lo que hay 20 rutas catabólicas distintas para la degradación de los aminoácidos. • Estas veinte rutas catabólicas de los aminoácidos convergen en 5 puntos de entrada al ciclo de Krebs: acetil coenzima A, -cetoglutarato, succinilCoA, fumarato u oxaloacetato. • En el hombre los aminoácidos sólo aportan del 10% al 15% de la producción energética corporal, por lo que sus rutas degradativas son mucho menos activas que la glucólisis y la oxidación de los ácidos grasos. En cambio, los animales carnívoros pueden obtener hasta el 90% de sus necesidades energéticas a partir de la oxidación de los aminoácidos ingeridos En los animales, la degradación de aminoácidos puede deberse a tres causas: • Que durante el recambio proteico normal algunos de los aminoácidos no se necesiten para la síntesis de nuevas proteínas. • Que la dieta sea muy rica en proteínas (los aminoácidos no se pueden almacenar; las semillas de algunas plantas almacenan proteínas de reserva para las necesidades del embrión tras la germinación) • Que el organismo se encuentre en estado de inanición, recurriendo entonces a todas sus reservas. Los esqueletos hidrocarbonados de los aminoácidos generalmente van a parar el ciclo de Krebs y de allí se oxidan para producir energía química o se canalizan hacia la gluconeogénesis (se vuelven a transformar en azúcares y se almacenan como glucógeno). El grupo amino se elimina por transaminación. Esta etapa de separación del grupo amino resulta ser el comienzo de todas las rutas catabólicas de los aminoácidos. En general, los grupos amino se utilizan en forma muy conservadora en los sistemas biológicos, debido a que sólo unos pocos microorganismos (algunas bacterias y cianobacterias) pueden convertir el nitrógeno atmosférico en nitrógeno utilizable. El hombre y otros animales (mamíferos terrestres y anfibios) excretan el nitrógeno en forma de urea, pero hay animales que eliminan nitrógeno en forma de ácido úrico (aves y reptiles terrestres) y otros animales y microorganismos lo hacen directamente en forma de amoníaco (la mayoría de los peces). AMINOÁCIDOS No se excretan No se almacenan Producción de energía α-amino Esqueleto carbonado Urea Intermediarios del ciclo de Krebs Excreción AA Cetogénicos AA Glucogénicos AA Mixtos Catabolismo de los ácidos nucleicos Los ácidos nucleicos se degradan a mononucleótidos por acción de las nucleasas. Los mononucleótidos son degradados posteriormente para utilizar los componentes: Nucleótidos Hidrólisis ácido fosfórico síntesis de ATP pentosas metabolismo de los glúcidos bases nitrogenadas síntesis de ácidos nucleicos o degradación Las bases púricas se degradan según la siguiente secuencia: purina ácido úrico alantoína ácido alantoico urea amoniaco. El producto excretado depende de la especie. En la especie humana, las purinas son degradadas a ácido úrico. El exceso de producción de dicho ácido y su depósito en los cartílagos constituye la enfermedad denominada gota. Las bases pirimidínicas, en la mayoría de las especies, son degradadas a urea y amoniaco. El catabolismo por fermentación • La fermentación es un proceso catabólico donde no interviene la cadena respiratoria. • El aceptor final de protones y de electrones es un compuesto orgánico. • Entre sus productos finales siempre hay algún compuesto orgánico. • Es siempre un proceso anaeróbico. • Sólo hay síntesis de ATP a nivel de sustrato. • Tienen una baja rentabilidad energética (sólo 2 ATP) • Las coenzimas reducidas (NADH) que se forman al oxidarse el sustrato en las fermentaciones, deben reoxidarse para evitar el bloqueo del proceso por falta de coenzimas oxidadas (NAD+). • Las fermentaciones son propias de los microorganismos (ciertas levaduras y bacterias), aunque alguna, como la fermentación láctica, puede realizarse en los músculos de animales cuando no llega suficiente oxígeno a las células. Fermentaciones Etílica Láctica Es erróneo llamarla fermentación Acética Butírica Levaduras, bacterias Bacterias Bacterias Bacterias, hongos Alcohol Lactato Ac. Acético Butírico Oxidación parcial de la materia orgánica. Los productos de reacción contienen todavía energía. Se libera poca energía ( 2 ATP) El aceptor final de electrones es una molécula orgánica. En ocasiones se denomina erróneamente fermentación a procesos en los que interviene el oxígeno, por ejemplo, la mal llamada fermentación acética, mediante la que se obtiene ácido acético (vinagre) a partir del vino y del aire cuando en realidad es una respiración aeróbica de oxidación incompleta. CH3-CH2OH + 02 CH3COOH + H2O Ello se debe a la costumbre en la industria de denominar fermentación a todo proceso que se realiza en un aparato denominado fermentador, y que da como producto final un compuesto orgánico, tanto si se realiza en ausencia de oxígeno (fermentación o respiración anaeróbica) como si hay que insuflar aire para que se produzca (respiración aeróbica). • El metabolismo anaerobio es muy ineficiente porque el combustible sólo se oxida en parte. • El alcohol, producto final de la fermentación, contiene una gran cantidad de energía (puede utilizarse como combustible para automóviles). • El lactato, compuesto de tres carbonos, contiene aún más energía que el alcohol de dos carbonos. • La ineficiencia del metabolismo anaerobio requiere de un gran suministro de glucosa. Las células que funcionan en anaerobiosis degradan rápidamente muchas moléculas de combustible para compensar la poca energía que obtienen de cada una de ellas ("efecto Pasteur": las moléculas de glucosa son consumidas por la levadura mucho más rápidamente en anaerobiosis que en presencia de oxígeno). • Para realizar la misma cantidad de trabajo que una célula aerobia, una célula anaerobia necesita veinte veces mas glucosa, lo que resulta beneficioso desde el punto de vista biotecnológico, porque la cantidad de producto (ácido láctico o etanol, según el caso) es mucho mayor. La fermentación alcohólica Es la transformación de ácido pirúvico en etanol y CO2. En una primera etapa se realiza la glucólisis y se transforma la glucosa en ácido pirúvico, y en la etapa siguiente se realiza la fermentación alcohólica, transformándose el ácido pirúvico en etanol y CO2, reoxidando el NADH a NAD+. La fermentación alcohólica se realiza gracias a enzimas contenidas en levaduras del género Saccharomyces, que son anaerobias facultativas. Dependiendo de la especie de levadura se puede llegar a obtener cerveza, ron (S. cerevisiae), vino (S. ellypsoideus), sidra (S. apiculatus) y pan (variedad purificada de S. cerevisiae) glucólisis C6H12O6 2 ATP inversión 2 ADP 2 NAD+ 2 4 NADH ATP 2 piruvato cosecha 2 ATP netos forma etanol 2 H2O 2 CO2 2 acetaldehídos electrones, hidrógeno forma NAD+ 2 etanol Dependiendo de la especie de levadura se puede llegar a obtener cerveza, ron (S. cerevisiae), vino (S. ellypsoideus), sidra (S. apiculatus) y pan (variedad purificada de S. cerevisiae) La fermentación láctica En esta fermentación se forma ácido láctico a partir de la degradación de la glucosa. Esta fermentación se da cuando determinados microorganismos inician la fermentación de la lactosa de la leche, lo que produce el agriamiento de ésta y la coagulación de la proteína caseína. También se produce en las células musculares de los animales cuando no hay suficiente oxigeno para efectuar un sobreesfuerzo físico y el ácido pirúvico procedente de la glucólisis no puede oxidarse de manera aerobia y se transforma en ácido láctico. Si el sustrato es la lactosa, primero se hidroliza en una molécula de glucosa y otra de galactosa, la cual posteriormente se transforma en glucosa. Luego, las dos glucosas continúan el proceso antes descrito para las células musculares. Si el sustrato es la lactosa, primero se hidroliza en glucosa y galactosa, la cual posteriormente se transforma en glucosa. Luego, las dos glucosas continúan el proceso antes descrito para las células musculares. GLUCOLISIS ISOMERIZACIÓN glucólisis 2 C6H12O6 Fermentación Láctica ATP inversión 2 NAD+ 2 ADP 2 4 NADH ATP cosecha 2 piruvato 2 ATP netos lactate fermentation electrones, hidrógeno froma NADH 2 lactato Fig. 8-11, p.133 Los microorganismos que realizan esta fermentación son las bacterias de las especies Lactobacillus casei, L. bulgaricus, Streptococcus luctis y Leuconostoc citrovorum, obteniéndose de ello productos derivados de la leche como el queso, el yogur y el kéfir. Solo producen acido láctico Homoláctica Lactobacillus lactis L. bulgaricus Leche fermentada Yogur Queso Fermentación láctica Acido láctico + otras sustancias Heteroláctica Lactobacillus brevis Leuconostoc La fermentación butírica • Consiste en la descomposición de sustancias glucídicas de origen vegetal, como el almidón y la celulosa, en determinados productos como el ácido butírico, el hidrógeno, el dióxido de carbono y otras sustancias malolientes. Se producen entre otros sitios en el rumen de los herbívoros. • La realizan bacterias anaerobias como Bacillus amilobacter y Clostridium butiricum. • La fermentación butírica tiene gran importancia, ya que contribuye a la descomposición de los restos vegetales en el suelo. COMPARACIÓN DE LOS DIFERENTES TIPOS DE CATABOLISMO Conceptos considerados Respiración Aerobia Fermentación Anaerobia ¿Necesitan oxígeno? Si. No. No. Sustrato que pueden oxidar. Cualquier principio inmediato. Cualquier principio inmediato. Preferentemente glúcidos y prótidos. Primer aceptor de los H+ y de los electrones. NAD+ NAD+ NAD+ Aceptor final de los hidrógenos (H+ y e-). O2 Se trata de moléculas inorgánicas como el SO42- NO3- CO2, CO32- El aceptor final de hidrógenos es una molécula orgánica que generalmente procede del propio sustrato. Éste se divide en una parte que cede hidrógenos (se oxida) a la otra parte, que al aceptarlos se reduce. Productos en los que se transforman los aceptores finales de H+ y e-. H^O. SH2 , N02- N2 CH4. Algún compuesto orgánico, como, por ejemplo, el etanol, el ácido láctico, etc. Productos en los que se transforma el carbono del sustrato. Generalmente da CO2. En ocasiones, la oxidación puede ser incompleta. Por ejemplo, de etanol a ácido acético. Generalmente da CO2. En ocasiones, la oxidación del carbono puede ser incompleta. Siempre produce algún compuesto orgánico, como el etanol, el ácido láctico, etc. Además puede aparecer C02. ¿Son capaces de obtener ATP al oxidar eINADH + H+? Sí. Sí. No. Carecen de cadena respiratoria. Sólo hay fosforilación a nivel de sustrato. El NADH + H' cede sus hidrógenos al aceptor final sin producirse la síntesis de ATP. Energía que se obtiene de una glucosa. Hasta 38 ATP. Hasta 38 ATP. Variable. Suele ser de unos 2 ATP.