Descargar
Anuncio
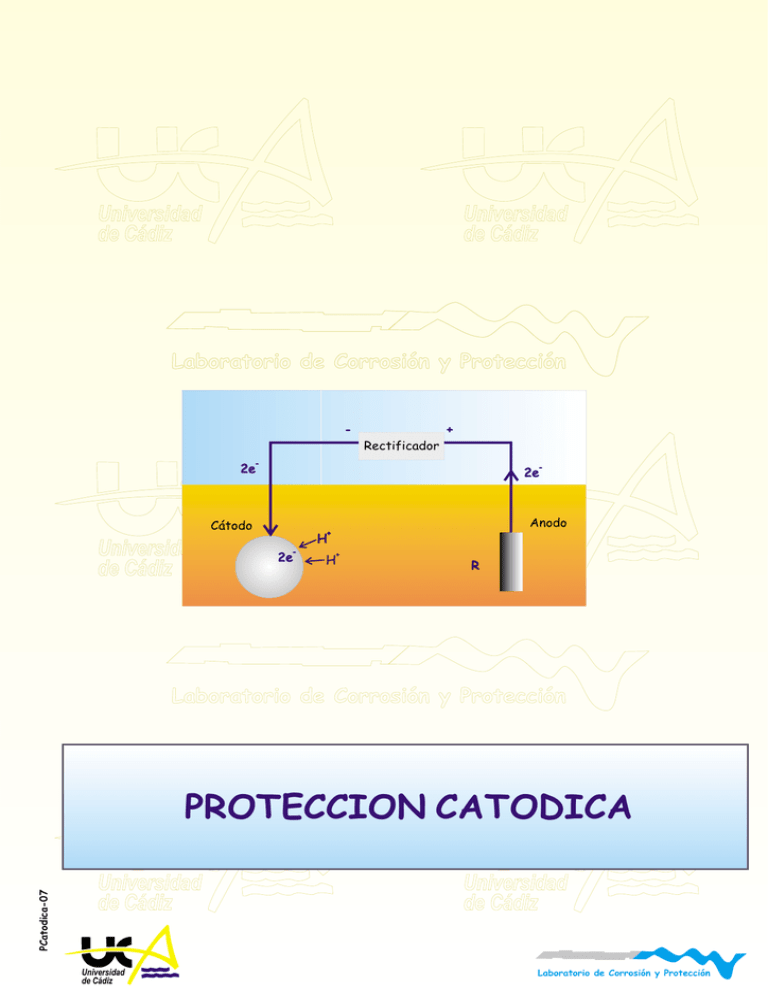
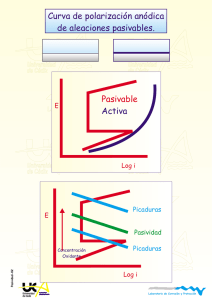
Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección - + Rectificador 2e - 2e Cátodo Universidad de Cádiz H 2e - Anodo + H - + Universidad R de Cádiz Laboratorio de Corrosión y Protección PCatodica-07 PROTECCION CATODICA Universidad de Cádiz Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica El metal a proteger es convertido en el cátodo de una celda electroquímica. Universidad Universidad ánodo es un metal más activo odeunCádiz electrodo inerte deElCádiz conectado a una fuente de corriente continua. Hierro Laboratorio de Corrosión y Protección 2 Pasividad Pasividad 1 Corrosión 0 EA Universidad EB de Cádiz Inmunidad 0 7 pH -1 Universidad de Cádiz 14 -2 Laboratorio de Corrosión y Protección Modificación del potencial de corrosión mediante polarización catódica. Disminuir la velocidad de corrosión. Pcatodica-01 Hacer que el proceso de corrosión deje estar favorecido termodinámicamente. Universidad de Cádiz Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Densidad de corriente de corrosión Fe en medio ácido: 10-4 A/cm2 Universidad -0,0 de Cádiz - 2H + +2 +2 Fe e- +2 e Fe H Universidad de Cádiz V = 1.2 mmpa 2 -0,2 -0,4 -0,6 Laboratorio de Corrosión y1 Protección A cm 10 10 10 -6 -4 -2 -2 Pasividad CONDICION DE PROTECCION E< -0.6 V Ecorr = - 0.20 V UniversidadE= - 0.65 V de Cádiz Polarización de -0.45 V 2 iapp = 1Universidad A/cm de Cádiz Polarización de -0.20 V -2 2 E= - 0.40 V iaplicada = 10 A/cm Laboratorio de Corrosión y Protección -6 2 ianódica = 10 A/cm Vcorr = 12 m m/año Pcatodica-02 SIN 2.5 años Tubería de 3 mm Universidad Universidad CON 250 de Cádiz deaños Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Medios ácidos Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Pasividad Corrientes altas Disminuir superficie expuesta Recubrimientos no resistentes a la acción del medio Medios Universidad de Cádiz neutros y básicos Universidad de Cádiz Laboratorio de Corrosión y Protección Pcatodica-03 Corrientes altas Disminuir superficie expuesta Recubrimientos resistentes a la acción del medio Universidad de Cádiz Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Anodos de sacrificio Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Pasividad Corriente impresa Universidad de Cádiz Universidad de Cádiz Pcatodica-04 Laboratorio de Corrosión y Protección Universidad de Cádiz Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Propiedades de ánodos de sacrificio. Potenciales de corrosión negativos. Su valor determina la cantidad de corriente que puedan proporcionar al formar el par galvánico. Universidad Universidad Cádiz de Cádizen la corriente para Baja de polarización. Se busca una alta variación pequeñas variaciones de potencial. Equivalente electroquímico alto. Determina el valor de la carga teóricamente disponible por unidad de masa. Laboratorio de Corrosión y Protección Eficiencia alta. Porcentaje de carga liberada en la práctica. Pasividad Propiedad Magnesio Ecorr (SCE) -1.68 -1.10 -1.05 Salida (A-h/Kg) Universidad Eficencia de Cádiz Densidad Coste U$ (Apa) 2200 50-60 1.7 27 810 Universidad >90 de Cádiz 7.1 18 2000 >90 2.7 8 a Cinc Aluminio b Mg: Ecorr muy negativo y baja polarización. Suelos y aguas puras. No Laboratorio de Corrosión y Protección recomendable para agua de mar, causa sobreproteccion, ineficiencia, rápido consumo. Pcatodica-05 Zn: Ecorr intermedio, baja polarización, alta eficiencia. Ideal para agua de mar. Al: Aleaciones convencionales se pasivan, presentando una alta polarización. Aleado con Zn, In, Hg, Sn permanece en el estado activo. Universidad Universidad Utilizado en agua de mar. Alta valencia baja densidad y coste. Se pasiva en de Cádiz de Cádiz aguas naturales y en suelos. Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Etapas del diseño de un sistema de protección catódica. 1.- Area a proteger. Difícil de estimar. Se suele expresar como un porcentaje del la superficie pintada incluyendo un factor que considere el aumento del área como consecuencia del deterioro Universidad Universidad del recubrimiento. de Cádiz de Cádiz 2.- Potencial de protección. Determina la cantidad de corriente necesaria para alcanzar dicho potencial. Laboratorio de Corrosión y Protección 3.- Demanda de corriente. Es calculada como el producto de la Pasividad densidad de corriente a aplicar por el área expuesta. Existen valores tabulados para aceros en algunos medios. 4.- Consumo de ánodos. Se determina a partir del valor de la demanda de corriente y la velocidad de consumo del ánodo a Universidad Universidad utilizar. de Cádiz de Cádiz 5.- Número y distribución de los ánodos. El peso total de ánodos debe dividirse de forma que la distribución de corriente resulte lo más uniforme posible. Laboratorio de Corrosión y Protección Pcatodica-06 6.- Resistencia de los ánodos. Se determina a partir del número de ánodos y de su distribución. 7.- Salida de corriente. Se determina a partir del voltaje de protección y de la resistencia de los ánodos, aplicando la ley de Universidad Ohm.Universidad Debe ser igual o superior a la demanda de corriente (etapa de Cádiz 3)l de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Universidad de Cádiz Cátodo Universidad de Cádiz Anodo Al aplicar la corriente Ig(sc) , la corr Laboratorio de Corrosión y IProtección disminuye hasta Icorr(sc) Pasividad La caída óhmica provoca: Aumento de la corriente de protección hasta Icorr(R) Para alcanzar el nivel de protección deseado es necesario aumentar la corriente aplicada. Causas de la caída óhmica Universidad de Cádiz Universidad de Cádiz Pcatodica-07 Laboratorio de Corrosión y Protección Sobretensión en el cátodo Caída óhmica alrededor del cátodo Caída óhmica a través del electrolito Caída óhmica alrededor del ánodoUniversidad Universidad de Cádiz Sobretensión en el ánodo de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Potenciales de protección recomendados Material E vs Cu/CuSO4 (V) Hierro y Aceros Universidad medios aeróbios de Cádiz medios anaeróbios Universidad 0,85 de-Cádiz - 0,95 Plomo - 0.60 Aleaciones de cobre - 0.5 a - 0,65 Laboratorio de Corrosión y Protección Aluminio -0,95 a -1,20 Zona SobreSobreSobrede Corrosión Corrosión Protección protección protección protección Escasa Protección Libre Intensa ligera Acusada Severa Catódica -0,6 -0,5 -0,7 -0,8 -0,9 -1,0 -1,1 Universidad Universidad de Cádiz de Cádiz Corrientes requeridas para proteger acero Medio -1,1 -2 Densidad de corriente (A m ) Laboratorio de Corrosión y Protección Pcatodica-08 H2SO4 caliente Suelos Agua de mar A.V. Agua caliente sat O2 Agua en movimiento Universidad de Cádiz Universidad de Cádiz 300 - 500 0,01 - 0,5 0,3 - 0,15 0.1 - 0,15 0,05 - 0,1 Universidad de Cádiz Laboratorio de Corrosión y Protección Corriente impresa - + Rectificador 2e Universidad de Cádiz - 2e Cátodo H 2e - Universidad de CádizAnodo + H - + R H2 Las reacciones R que pueden verificarse en el ánodo son: Laboratorio de Corrosión y Protección 2+ - 1) M M + 2e Pasividad 2) 2H2O O2 + 4 H + 4e 3) 2Cl - + Cl2 + 2e - - La reacción 1 debe evitarse ya que provoca Universidad el consumo del ánodo. Universidad de Cádiz de Cádiz Las reacciones 2 y 3 son las que suelen darse sobre ánodos inertes que son los utilizados normalmente en corriente impresa. Los potenciales de las reacciones 2 y 3 a pH 7 son 0,82 y 1,36 V. Así, durante la polarización anódica se producirá primero la evolución Laboratorio de Corrosión y Protección de O2 y posteriormente la de Cl2. Pcatodica-09 La evolución de O2 es muy lenta sobre la mayoría de los metales: io (Pt) 10-12 Acm-2. La evolución de Cl2 es mucho más rápida io(Pt) 10-3 Acm-2. Cuando se alcanza el valor 1,36 se produce un aumento brusco de la corriente. Universidad de Cádiz Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Anodos para corriente impresa HIERROS FUNDIDOS Y ACEROS.- Fueron utilizados en los inicios de la protección catódica. Se disolvían rápidamente al darse fundamentalmente la reacción 1. MATERIALES de Cl- la reacción 2 Universidad PASIVABLES.- En suelos libres Universidad Cádiz de Cádiz es de la que se da sobre este tipo de materiales. El de más bajo coste Hierro fundido de alto silicio (Fe-0.95C, 0.75Mn, 14.5Si, 4.5Cr). 2 Se suele utilizar en suelos y aguas. i= 10.8-40 A/ m ; Consumo 0.23-0.45 Kg/A a) No son utilizables aceros inoxidables ya que su capa pasiva se Laboratorio de Corrosión y Protección desestabiliza al potencial de evolución del O2 o se pican a potenciales más bajos en presencia de cloruros. Pasividad Pcatodica-10 GRAFITO COMPACTADO.- Es un material inerte y de bajo coste. Se suele utilizar en suelos y agua salada ya que el Cl2 evoluciona alta velocidad con bajas polarizaciones. Es un material frágil. i= 10.82 40 A/ m ; Consumo 0.23-0.45 Kg/A a) Universidad Universidad Se suele utilizar grafito como relleno de otros ánodos: incrementa de Cádiz de Cádiz el área anódica, disminuye la resistencia entre el ánodo y el electrolito, facilita el desprendimiento de O2 y aumenta la vida de los ánodos . PLATINO.-Laboratorio Es el material para ser utilizado como ánodo de de ideal Corrosión y Protección corriente impresa. No se consumen por la reacción 1 y se consiguen velocidades de evolución apreciables en las reacciones 2 y 3 con polarizaciones bajas. Presenta un elevado coste. Se solventa este problema utilizando ánodos platinizados, Ti/ Pt ( 1-5 micras). Proporcionan más corriente por unidad de peso y volumen que cualquier otro tipo de ánodos. Es el ánodo más utilizado en aguaUniversidad y agua de mar. i= 540Universidad 2 de A/ Cádiz de Cádiz 1080 m ; Consumo 6 mg/A a) Universidad de Cádiz Laboratorio de Corrosión y Protección Anodos de Sacrificio vs Corriente Impresa Anodos de Sacrificio: VENTAJAS No se necesita una fuente de corriente externa. Fácil de instalar Universidad Universidad de CádizDeben estar correctamente unidos de Cádiz a la estructura No necesita control durante el funcionamiento No suelen existir problemas de sobreprotección Fácil obtener una distribución homogénea de corriente sobre toda la estructura. Laboratorio de Corrosión y Protección INCONVENIENTES Pasividad No permite vencer fuertes caídas óhmicas. Uso restringido a medios conductores y a estructuras recubiertas. Corriente Impresa: Universidad de CádizVENTAJAS Universidad de Cádiz Pcatodica-11 Permite vencer caídas óhmicas altas. Se puede utilizar para proteger estructuras grandes, no recubiertas en medios poco conductores. Se necesitan pocos ánodos Laboratorio de Corrosión y Protección El nivel de protección del sistema puede ser seguido en tiempo real. INCONVENIENTES Necesidad de una fuente de corriente externa. Peligro de sobreprotección si se producen fallos. Dificultad para conseguir niveles de protección Universidad Universidad homogéneos en estructuras complejas. de Cádiz de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica Comparación entre Protección Anódica y Protección Catódica Universidad de Cádiz Anódica Universidad de Cádiz Catódica Pcatodica-12 Tipo de metales Sólo pasivables Cualquier aleación Laboratorio de Corrosión y Protección Tipo de medios Corrosividad media/alta Pasividad Corrosividad media/baja Costes Instalación Alto Bajo Mantenimiento Alto Bajo Operación Muy Bajo Alto Universidad Universidad Corriente Alta Baja de Cádiz de Cádiz Equipamiento Potenciostatos Potenciostatos/Galvanostatos Corriente aplicada Muy baja Mas alta Corrosión y Protección Es una Laboratorio medida de ladeVcorr No mide la Vcorr Condiciones de operación Pueden ser determinadas Experiencia a través de medidas electroquímicas Universidad de Cádiz Universidad de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección Protección Catódica vs Protección Anódica Protección Anódica Metales Pasivables Universidad de Cádiz Medios Protección. Catódica Cualquier tipo Corrosividad Media/alta Universidad de Cádiz Corrosividad Media/baja Pcatodica-13 Suprime la No reacción anódica Laboratorio de Corrosión y Protección Pasividad Si Condiciones de trabajo Determinables en laboratorio Ajuste fino en funcionamiento Demanda de corriente Universidad de Cádiz Corriente aplicada Baja/mantenimiento Alta Alta/establecimiento Universidad de Cádiz Mide Vcorr No mide Vcorr Distribución Homogénea No homogénea Laboratorio de Corrosión y Protección Protección sobre la línea de agua No No Aire No No Universidad No conductores de Cádiz No Universidad No de Cádiz Universidad de Cádiz Laboratorio de Corrosión y Protección