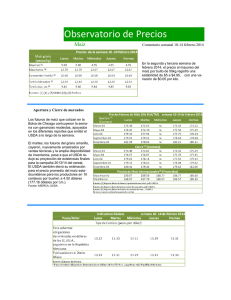
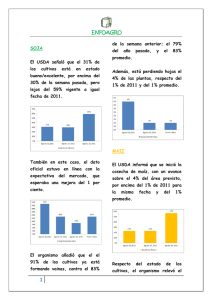
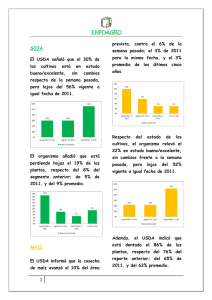
Revisión de la seguridad ambiental de la proteína Cry1Ab
Anuncio

Revisión de la seguridad ambiental de la proteína Cry1Ab Center for Environmental Risk Assessment, ILSI Research Foundation 1156 Fifteenth Street N.W., Washington D.C. 20005-1743 EE. UU. 22 de Diciembre de 2011 INTRODUCCIÓN ORIGEN Y FUNCIÓN DE CRY1AB Este documento presenta una revisión completa de la información y los datos relevantes para la evaluación de riesgo ambiental del Cry1Ab y también presenta una declaración resumida acerca de la seguridad ambiental de esta proteína. Todas las fuentes de información aquí revisadas están disponibles públicamente e incluyen: expedientes presentados a las autoridades regulatorias; resúmenes de decisiones preparados por las autoridades regulatorias; bibliografía revisada por pares y resúmenes de productos preparados por los desarrolladores de productos. Bacillus thuringiensis y las δ-endotoxinas Cry Las evaluaciones de riesgo ambiental relacionadas con la introducción de plantas genéticamente modificadas (GM) se realizan caso por caso y consideran la biología de la planta, la naturaleza del transgen y la proteína que produce, el fenotipo que concede el transgen y también el uso previsto de la planta y el medioambiente en el que se la introducirá (es decir, el ambiente receptor). Dichas evaluaciones son comparativas por necesidad y por lo general implican comparaciones con una línea progenitora sin transformar o con una isolínea muy relacionada (CBD 2000a, 2000b, NRC 1989, OECD 1992, EFSA 2006, Codex 2003a, 2003b). El propósito de estas comparaciones es identificar los posibles riesgos que la planta GM podría presentar al ambiente, más allá de los ya aceptados de plantas similares. Cualquier riesgo identificado se puede evaluar en busca de posibles consecuencias. En nueve países y en la Unión Europea, se han emitido las aprobaciones regulatorias para la liberación ambiental de plantas GM que expresan Cry1Ab. Esta incluye seis eventos de transformación, aprobados en 17 líneas1, muchos de estos contienen otros rasgos GM. 1 Al 12/19/2011. Incluye las aprobaciones para cruces convencionales de dos plantas GM en países que exigen la obtención de dichas aprobaciones. Bacillus thuringiensis es una bacteria en forma de bastón, gram positiva, capaz de formar endosporas de larga vida. Por lo general, se la menciona como una bacteria del suelo aunque se encuentra en todo el medioambiente (Hofte and Whiteley 1989, Schnepf et al. 1998, OECD 2007). Existe una enorme variación entre las especies con respecto al tipo o clase de proteínas pesticidas que difieren en su modo de acción, la especificidad diana y el mecanismo de expresión (Hofte and Whiteley 1989, Schnepf et al. 1998, OECD 2007). Las proteínas pesticidas expresadas por las cepas de B. thuringiensis incluyen compuestos antihongos, β exotoxinas2, proteínas insecticidas vegetativas (Vip) y las δ endotoxinas que incluyen las proteínas Cry (cristalina) y las proteínas Cyt (citolítica), estructuralmente no relacionadas (Hofte and Whiteley 1989, Schnepf et al. 1998, OECD 2007). Se ha demostrado que la mayoría de ellas contribuye con la toxicidad frente a los insectos y algunas (se destacan las β exotoxinas y las proteínas Cyt) tienen un amplio espectro de actividad (Hofte and Whiteley 1989, Schnepf et al. 1998, OECD 2007). Las preparaciones de aislados naturales de B. thuringiensis se usaron por primera vez como insecticida comercial en Francia en 1938 y se han registrado B. thuringiensis subespecie kurstaki (que, entre otras proteínas Cry, produce Cry1Ab) en US EPA desde 1961 (Kumar et al. 1996, Schnepf et al. 1998, USEPA 2001). Las preparaciones microbianas de B. thuringiensis actualmente están aprobadas para su uso en todo el mundo, incluido en Australia, Canadá, la Unión Europea y los Estados Unidos (AVPMA 2010, EU DG SANCO 2010, PMRA 2008, USEPA 2001). Dichas preparaciones contienen una mezcla de pesticidas microbianos, que incluyen proteínas Cry, que interactúan ampliamente entre sí para influir en la toxicidad y la especificidad de los insectos (Schnepf et al. 1998, OECD 2007). Si bien se podría extrapolar cierta información sobre la seguridad ambiental de las proteínas Cry a partir 2 también llamada thuringiensin. Palabras clave Cry1Ab, Bacillus thuringiensis, resistencia a los insectos, genéticamente modificado, evaluación de riesgo ambiental Copyright © ILSI Foundation 2012 Research El presente trabajo está autorizado en virtud de la licencia Creative Commons Attribution-NoncommercialNo Derivative Works 3.0 de Estados Unidos. Para ver una copia de esa licencia, visite http://creativecommons. org/licenses/by-nc-nd/3.0/us/ o envíe una carta a Creative Commons, 171 Second Street, Suite 300, San Francisco, California, 94105, EE. UU. Tabla 1. Aprobaciones regulatorias para la liberación al ambiente de plantas GM que contienen Cry1Ab. Uruguay Sudáfrica Filipinas Colombia Brasil Japón Unión Europea Argentina Canadá Identificador único de la OCDE Estados Unidos Evento X X X X X Bt176, 1786 SYN-EV176-96 X X X X X X X X X BT11; X4334CBr, X4734CBR SYN-BT011-1 X MON80100 X X X MON802 X X X MON809 X X X X X X X X X MON810 MON-00810-6 X BT11 x MIR162 SYN-BT011-1, SYN-IR162-4 X BT11 x MIR162 x MIR604 SYN-BT011-1, SYN-IR162-4, SYN-IR604-5 * X BT11 x MIR604 SYN-BT011-1, SYN-IR604-5 * X BT11 x MIR604 x GA21 SYN-BT011-1, SYN-IR604-5, MON-00021-9 * X MON810 x LY038 MON-00810-8, REN-00038-3 * X X MON810 x MON88017 MON-00810-8, MON-88017-3 * X MON810 x MON863 MON-00810-8, MON-00863-5 * X X MON810 x MON863 x NK603 MON-00810-8, MON-00863-5, MON-00603-6 * X X X X X X MON810 x NK603 MON-00810-8, MON-00603-6 X indica una aprobación regulatoria *Acumulación de eventos que pueden considerarse aprobados para su liberación al medioambiente según las aprobaciones existentes de las líneas progenitoras GM de las cuales se derivan. Las aprobaciones dependen de los registros de los pesticidas, los cuales requieren una renovación periódica. El estado actual de estos registros se puede consultar en el siguiente enlace: http://www.epa.gov/oppbppd1/biopesticides/pips/pip_list.htm. de la experiencia con estas preparaciones bacterianas, se debe tener presente que la actividad del rociado foliar bacteriano se debe a una combinación de varias δ endotoxinas como también de otras toxinas y calidades de la espora misma, que pueden tener un impacto sobre la selectividad y el rango de huésped (Schnepf et al. 1998, Tabashnik et al. 1992). Asimismo, el perfil de exposición para el rociado foliar de preparaciones bacterianas difiere de la expresión de proteínas Cry en una planta GM (OECD 2007). Las δ endotoxinas de la proteína Cry reciben ese nombre porque son el componente principal de los cristales parasporales de la proteína, que son característicos en la formación de esporas en B. thuringiensis (Hofte and Whiteley 1989, Kumar et al. 1996, Schnepf et al. 1998, OECD 2007). Se propuso una nomenclatura sistemática para identificar y diferenciar las proteínas Cry en 1989 y fue ampliamente adoptada (Hofte and Whiteley 1989, OECD 2007). Conforme a esta nomenclatura, las proteínas Cry se agruparon en cuatro clases iniciales I, II, III y IV en función de su toxicidad a órdenes específicos de insectos. Las proteínas CryI son aquellas tóxicas para lepidópteros solamente, las proteínas CryII son tóxicas para lepidópteros y dípteros, las proteínas CryIII son tóxicas para coleópteros y las proteínas CryIV son tóxicas para dípteros. Este sistema se ha actualizado posteriormente para dar cuenta de las proteínas Cry adicionales y ampliar el conocimiento de la estructura y función molecular y la familiaridad, lo cual conduce a algunas discrepancias menores en los nombres en comparación con la bibliografía anterior (Crickmore et al. 1998, Crickmore et al. 2005, OECD 2007). Este documento utiliza la nomenclatura más reciente (Cry1Ab para la proteína, cry1Ab para el gen) pero la proteína en cuestión es análoga con la nomenclatura anterior CryIA(b). Las proteínas Cry1 se clasifican en función de la secuencia de aminoácidos y las proteínas designadas como Cry1A (incluidas Cry1Aa, Cry1Ab y Cry1Ac) son más del 85% idénticas en su secuencia 2 de aminoácidos (Hofte and Whitely 1989, Crickmore et al. 1998). Se ha determinado la estructura cristalina de Cry1Aa y presenta un alto nivel de similitud con otras estructuras conocidas de la proteína Cry (Cry3A, Cry2A, Cry4A y Cry4B) a pesar de las identidades de la secuencia, que pueden ser menores al 30% (Crickmore et al. 1998, Aronson and Shai 2001, Kumar et al. 1996, OECD 2007, Bravo et al. 2007). Mecanismo de la actividad insecticida de Cry1Ab Aunque existe una significativa variabilidad en la secuencia de aminoácidos y en el rango objetivo, se cree que el mecanismo general por el que las proteínas Cry (incluidas las Cry1Ab) logran la actividad insecticida es común en todo el grupo (Hofte and Whiteley 1989, Crickmore et al. 1998, 2005, OECD 2007, Aronson and Shai 2001, Kumar et al. 1996, Bravo et al. 2007). Las proteínas Cry1 se producen en forma de protoxinas de 130-140 kDa en tamaño, con 1100-1200 residuos de aminoácidos (Aronson and Shai 2001, Kumar et al. 1996, Bravo et al. 2007, OECD 2007). En el caso de la Cry1A, las protoxinas se dividen para generar toxinas activas que están compuestas por fragmentos de 60-70 kDa de la porción terminal N de la proteína (Knowles 1994, Kumar et al. 1996, OECD 2007, Soberon 2009). Existen diversas teorías de cómo estas toxinas activas pueden causar la muerte celular, sin embargo se reconoce que el primer paso es mediante la adhesión de receptores específicos a la membrana plasmática de las células epiteliales del intestino medio de los insectos susceptibles (Aronson and Shai 2001, Kumar et al. 1996, Bravo et al. 2007, Bravo et al. 2011, Ibrahim et al. 2010, OECD 2007, Soberon et al. 2009, Zhang et al. 2006, Zhang et al 2008). La teoría más común sostiene que, una vez unida a los receptores, la toxina puede insertarse en la membrana plasmática mediante la formación de poros oligoméricos transmembrana (Aronson and Shai 2001, Bravo et al. 2007, Bravo et al. 2010, Kumar et al. 1996, OECD 2007). Se cree que dichos poros forman canales iónicos que afectan el potencial trasmembrana, lo cual causa lisis osmótica (Aronson and Shai 2001, Bravo et al. 2007, Bravo et al. 2011, Hofte and Whiteley 1989, Kumar et al. 1996, OECD 2007, Soberon et al. 2009). No se comprende totalmente el proceso bioquímico de la inserción en la membrana, pero se cree que incluye la adhesión de otros receptores de la superficie celular que facilitan la oligomerización (Bravo et al. 2007, Bravo et al. 2011, Soberon et al. 2009). Otro estudio, basado en el trabajo de cultivo celular, sugiere que luego de la adhesión a ciertos receptores de la superficie celular, se produce la exocitosis y la inducción de una cascada de señales mediada por una proteína G que produce la muerte celular oncótica sin oligomeración de las proteínas Cry o la formación de poros. (Bravo et al. 2011, Ibrahim et al. 2010, Zhang et al. 2006, Zhang et al 2008). Existen evidencias de que algunas proteínas Cry cuentan con receptores múltiples, o bien que pueden estar unidas a múltiples sitios en un único receptor y se ha demostrado que la unión de receptores es necesaria pero no es suficiente para la toxicidad (Aronson and Shai 2001, Jenkins et al. 1999, OECD 2007). Existe cierta evidencia, basada parcialmente en experimentos que utilizan concentraciones inferiores a las mortales, de que podrían existir otras interacciones relevantes entre las proteínas Cry y los insectos diana (Aronson and Shai 2001). medias con la desviación típica o el error típico de las medias. (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995a, 1995b, 1995c, 1995d, 1996a, 1996b, 1996c, 1996d, 1997, USEPA 2001). Las variaciones en la metodología empleada para recolectar las muestras hacen que sean inadecuadas las comparaciones cruzadas y estadísticas directas de los datos, pero el peso de la evidencia indica que las plantas GM expresaron la Cry1Ab a niveles muy bajos, en comparación con la proteína total disponible en la planta (consultar el anexo I y las referencias que allí se incluyen). La Tabla 2 incluye los valores más altos informados de la expresión de Cry1Ab en las plantas GM que presentan expresión, donde los datos estaban disponibles. El Anexo I contiene información adicional acerca de la expresión de la proteína Cry1Ab. Tabla 2. Información de concentraciones más altas de proteína Cry1Ab en el tejido vegetal GM.1 Transformación EXPRESIÓN DE CRY1AB EN PLANTAS GM QUE RESISTEN A LOS INSECTOS El nivel de expresión de Cry1Ab en las plantas GM se determina mediante varios factores relacionados con los tipos de promotores y secuencias finales y los sitios de inserción de los genes. Por lo tanto, cada evento de transformación tiene como resultado un perfil de expresión distinto. Los datos del nivel de expresión de Cry1Ab en las plantas GM que han obtenido aprobaciones regulatorias están disponibles en los documentos de presentaciones y decisiones que son accesibles para el público (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995a, 1995b, 1995c, 1995d, 1996a, 1996b, 1996c, 1996d, 1997, USEPA 2001). Los tipos de tejido y los métodos de recolección variaron en los estudios, pero todos utilizaron el método de ensayo por inmunoabsorción ligado a enzimas (ELISA) o el ensayo de inmunotransferencia de Western blot para cuantificar la cantidad de proteína Cry1Ab presente en una muestra dada. Por lo general, se tomaron una o más muestras de tejido de la planta en un centro de ensayo en el campo y se agruparon para su análisis. Por lo general, la cantidad de Cry1Ab se determinó en peso seco y luego se calculó para arrojar valores relevantes a nivel ambiental relacionados con el peso fresco total de la muestra y se representó en una proporción (p. ej., microgramos de la proteína Cry1Ab por gramo de peso fresco) (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995a, 1995b, 1995c, 1995d, 1996a, 1996b, 1996c, 1996d, 1997, USEPA 2001). Las muestras se recolectaron de varios tipos de tejido y en distintas etapas de crecimiento, y se obtuvieron datos de plantas a través del tiempo y de distintas ubicaciones. En la mayoría de los casos, los datos se presentaron como un valor medio (por lo general, se promedió una media de medias como valores dentro de un estudio de campo y también entre distintos estudios) y un rango (por lo general, también un rango de medias que representaban la expresión promedio en un centro de estudio, aunque esto también varió, según cada caso en particular). En otros conjuntos de datos, se presentan las BT 176 MON80100 Tejido Cry1Ab (ng/g de peso fresco) Hoja 3029 Planta entera 1770 Bt-11 Hoja 5300 MON 809 Hoja 1630 MON 810 Hoja 103402 MON 802 Hoja 9550 1 Los valores se informan como media a menos que se indique lo contrario. 2 El valor representa el valor más alto observado de una muestra de 6 en la que la media fue 9350 ng/g de peso fresco. Modificaciones al gen cry1Ab y a la proteína Cry1Ab en plantas GM Existen dos tipos de modificaciones al gen cry1Ab de Bacillus thuringiensis que son relevantes para el uso en plantas GM. El primer tipo incluye modificaciones a la secuencia nucleotídica que no altera la secuencia de aminoácidos de la proteína (USDA APHIS 1994, 1995a, 1995b, 1995c, 1995d, 1996a, 1996b, 1996c, 1996d). Estas modificaciones tienen como fin principal aumentar la traducción del gen ya sea al modificar el uso de codones con el fin de dotarla de codones preferidos por las plantas, o bien al insertar intrones vegetales a fin de mejorar la eficiencia de la traducción (Perlak et al. 1991, USDA APHIS 1994, 1995a, 1995b, 1995c, 1995d, 1996a, 1996b, 1996c, 1996d). El segundo tipo de modificación incluye cambios en la secuencia nucleotídica que afecta en última instancia la secuencia de aminoácidos de la proteína resultante. En el caso de plantas GM que expresan la proteína Cry1Ab, solo se han presentado las truncaciones de la proteína para aprobaciones regulatorias (ANZFA 2000b, ANZFA 2000c, CFIA 1996a, CFIA 1996b, EC 1997, Japan BCH 2007a, 2007b, 2007d, USDA 1994, 1995, 1995d, 1996a). Esto significa que la proteína expresada en plantas contiene un subgrupo de aminoácidos en la proteína nativa de longitud completa de B. thuringiensis. Sin embargo, no se informó ningún otro cambio en la secuencia de aminoácidos. Estas proteínas truncadas imitan la forma “activada” de la proteína Cry1Ab, después de la digestión de la proteasa en el intestino medio del insecto. Aún así, es necesario que estas proteínas se unan a uno o 3 Tabla 3. Resumen de las modificaciones al gen cry1Ab de B. thuringiensis en plantas GM. Transformación Modificaciones a la secuencia nucleotídica Modificaciones a la secuencia de aminoácidos Datos de equivalencia proteica presentados para revisión regulatoria1 Referencia BT 176 Modificado para uso de codones Truncado2 (648 aminoácidos del extremo N-terminal) Peso molecular Inmunoreactividad Secuencia de proteínas Modificación postraduccional Bioactividad Resistencia a la tripsina USDA APHIS 1994 MON80100 Modificación para uso de codones Ninguno: secuencia nativa completa Peso molecular Inmunoreactividad Resistencia a la tripsina USDA APHIS 1995b Bt-11 Modificación para uso de codones, inserción de intrones Truncado2 Peso molecular Inmunoreactividad Resistencia a la tripsina Secuencia de aminoácidos Glicosilación Bioactividad USDA APHIS 1995d MON 8093 Modificación para uso de codones, inserción de intrones Ninguno: secuencia nativa completa Ninguno informado USDA APHIS 1996b MON 810 Modificación para uso de codones, inserción de intrones Ninguno: secuencia nativa completa Ninguno informado USDA APHIS 1996b MON 802 Modificación para uso de codones, inserción de intrones Ninguno: secuencia nativa completa Ninguno informado USDA APHIS 1996d Todos los estudios de equivalencia informados se presentan para realizar comparaciones con la proteína Cry1Ab completa originada en B. thuringiensis subespecies kurstaki y expresadas en E. coli. Para obtener información detallada sobre los estudios específicos, consulte las fuentes citadas. 2 Truncado indica que la proteína expresada en plantas contiene un subgrupo de aminoácidos en la proteína nativa de longitud completa de B. thuringiensis. Sin embargo, no se informó ningún otro cambio en la secuencia de aminoácidos. 3 Este evento de transformación también incluye la inserción de un fragmento del gen cry1Ab que no produce ninguna proteína detectable. varios receptores específicos del intestino medio del insecto y retienen la especificidad de la especie encontrada en la proteína completa (ANZFA 2000b, ANZFA 2000c, CFIA 1996a, CFIA 1996b, EC 1997, Japan BCH 2007a, 2007b, 2007d, USDA 1994, 1995, 1995d, 1996a) PRUEBAS EN ORGANISMO NO DIANA E IMPACTOS DE LA EXPOSICIÓN A LA PROTEÍNA CRY1AB La proteína Cry1Ab pertenece al grupo de proteínas Cry1 que inicialmente se clasificaron en función de sus propiedades insecticidas específicas contra ciertos insectos lepidópteros (Hofte and Whiteley 1989, Crickmore et al. 1998, 2005, OECD 2007). El propósito de insertar el gen cry1Ab en un cultivo es el de ofrecer protección frente al daño causado por la alimentación de plagas lepidópteras. Otros organismos del sistema agrícola que no son plagas también pueden quedar expuestos a la proteína Cry1Ab y se los considera “organismos no diana”. Dicha exposición puede ser directa, a partir de la alimentación intencional o incidental con tejidos del cultivo como las hojas, las mazorcas, los estigmas o el polen u hojas en descomposición, o también puede ser indirecta, a partir de la alimentación con otros herbívoros que a su vez se alimentan del cultivo. Aunque se ha considerado el posible daño a los organismos no diana como parte de las evaluaciones de riesgo regulatorias de las plantas GM que expresan Cry1Ab, con especial consideración en los organismos no diana beneficiados que llevan a cabo funciones valiosas así como en las especies amenazadas, en peligro de extinción o atractivas, la larga data de uso de preparaciones microbianas de Bacillus thruinginesis, junto con la inicial caracterización de las proteínas Cry1A como inofensivas para las especies de vertebrados y con actividad específica contra solo un subgrupo de lepidópteros han servido de guía para la especificación de requisitos regulatorios en este respecto (ANZFA 2000a, 2000b, 4 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998, Hofte and Whitely 1989, Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, OECD 2007, Rose et al. 2007, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). Generalmente, se consideran las posibles exposiciones y se las utiliza para determinar qué organismos pueden verse afectados por el pesticida y luego se puede analizar a dichos organismos o especies sustitutas que los representen, en busca de efectos adversos. El impacto de los pesticidas sobre los organismos no diana generalmente se determina mediante una serie secuencial de pruebas llamadas Nivel I, Nivel II, Nivel III y Nivel IV (USEPA 2007). La naturaleza exacta de cada nivel de pruebas depende de cada caso, pero habitualmente el nivel de realismo y complejidad de las pruebas excede los niveles (EFSA 2006, Romeis et al. 2008, Rose 2007, USEPA 2007, USEPA 2010). Los primeros estudios por niveles incluyen ambientes de laboratorio muy controlados, donde los organismos no diana o la especie sustituta se exponen a altas concentraciones del pesticida en estudio con el propósito de determinar si existe algún efecto (Romeis et al. 2008, Rose 2007,USEPA 2010, USEPA 2007). Si no se observan efectos, por lo general, no es necesario realizar más pruebas en los niveles superiores (Romeis et al. 2008, Rose 2007, USEPA 2010, USEPA 2007). Si se observan efectos adversos en las pruebas de los primeros niveles o si existe una duda inaceptable, las pruebas adicionales continuarán, según sea necesario, hasta los últimos niveles para reducir la duda a un nivel aceptable para la toma de decisiones (EFSA 2006, Romeis et al. 2008, USEPA 2010, USEPA 2007). Vías de exposición ambiental Las decisiones regulatorias, por lo general, toman en cuenta tres vías principales de exposición además del contacto directo con la planta GM que expresa la proteína Cry1Ab, a saber: exposición al polen que contiene Cry1Ab y exposición a la Cry1Ab depositada en el suelo por la planta en descomposición y exposición tritrófica a través de la Tabla 4. Resumen de pruebas ecotoxicológicas de Cry1Ab sobre organismos no diana, no lepidópteros analizados en decisiones regulatorias. Especie Método de exposición Duración de la exposición Apis mellifera larvas de abejas Exposición a una sola dosis de proteína a 20 ppm unidosis NOEL> 20 ppm Apis mellifera abeja adulta Exposición a una sola dosis a 20 ppm unidosis No se observó ninguna diferencia estadísticamente significativa entre las poblaciones de prueba y de control. En el grupo de prueba, la mortalidad media fue de 16,2% Chrysoperla carnea larvas de crisopa de alas verdes Exposición a 16,7 ppm Hippodamia convergens (escarabajos “mariquitas” o “vaquitas”) Exposición a una sola dosis a 20 ppm unidosis NOEL> 20 ppm Brachymeria intermedia (himenópteros parasíticos ) Exposición a una sola dosis a 20 ppm unidosis NOEL > 20 ppm Folsomia candida (Colémbolos) Tejidos liofilizados de hojas (estimado de 50,6 µg Cry1Ab/g) 28 días NOEL > 50% de la dieta Daphnia magna Exposición a la proteína Cry1Ab en el polen del maíz en múltiples concentraciones 48 horas NOEC > 150 mg/L Lombriz de tierra Exposición a la proteína Cry1Ab bacteriana en un sustrato de suelo artificial. 14 días NOEL > 200 ppm Mus musculus (ratón) Sonda aguda por vía oral a 3280 mg/kg unidosis Efecto no observado 7 días Resultados NOEL > 16,7 ppm Informado en USEPA 2001. alimentación con herbívoros que consumen la planta GM (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). La exposición a través del polen puede ocurrir en el maíz o en las hojas que lo rodean, pero está limitada por los niveles de expresión generalmente bajos de Cry1Ab en el polen de las variedades que recibieron aprobaciones regulatorias (consultar el Anexo I para conocer los datos del nivel de expresión en polen de las variedades aprobadas) como también por la densidad de sedimentación del polen que disminuye rápidamente al estar la planta original a una distancia mayor (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). Aunque se puede presentar cierta exposición biológicamente significativa a poca distancia de los campos de cultivo, por lo general, las agencias regulatorias únicamente solicitan datos del impacto de Cry1Ab sobre las especies polinizadoras más representativas (p. ej., la abeja). Asimismo, la especificidad de la toxicidad de Cry1Ab sobre los lepidópteros y la evidencia que sugiere una exposición baja a través del suelo condujo a quienes emiten las regulaciones a solicitar pruebas únicamente de las especies de artrópodos que habitan el suelo (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d, USEPA 2001). En varios informes, se ha indicado que las proteínas Cry de las plantas GM pueden unirse a los sustratos de arcilla presentes en el suelo y que dichas proteínas unidas están protegidas de la digestión de los microbios pero conservan su actividad insecticida (Koskella and Stotzky 1997, Crecchio and Stotsky 1998, OECD 2007). Estos estudios utilizaron concentraciones muy altas de proteínas Cry en relación con la cantidad de sustrato unido, lo cual representa una exposición mucho más alta de la que posiblemente ocurra en un ambiente agrícola. Los estudios posteriores, bajo condiciones más relevantes para los campos agrícolas, han respaldado las conclusiones anteriores acerca de la degradación de la proteína Cry con una vida media de aproximadamente 9-40 días (Accinelli et al. 2008, Marchetti et al. 2007). Las aprobaciones regulatorias de los eventos de Cry1Ab han considerado información sobre las tasas de degradación de la proteína Cry en un rango de tipos de suelos, pero no han solicitado pruebas adicionales de la toxicidad que implica la proteína Cry1Ab para los organismos del suelo (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). Las posibles exposiciones bitróficas y tritróficas se tratan con pruebas ecotoxicológicas. Pruebas ecotoxicológicas de Cry1Ab sobre organismos no diana, no lepidópteros Se tiene conocimiento que la proteína Cry1Ab es tóxica para ciertos lepidópteros, y se llevaron a cabo pruebas en organismos no diana de la Cry1Ab purificada en una gran variedad de especies de no lepidópteros para las presentaciones regulatorias relacionadas con las plantas GM que producen Cry1Ab (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d, USEPA 2001). Debido a que se conoce desde hace tiempo el espectro de actividad de las proteínas Cry1, y en particular de la proteína Cry1Ab, los análisis regulatorios se han centrado en confirmar este espectro utilizando organismos de prueba bien caracterizados que con frecuencia están sujetos a pruebas de pesticidas químicos (Rose 2007, ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). Los organismos de prueba incluyeron Apis mellifera (abeja) adultas y larvas, coleópteros depredadores Hippodamia convergens (escarabajos “mariquitas” o “vaquitas”) y neurópteros Chrysoperla carnea (crisopa de alas verdes), himenópteros parásitos Brachymeria intermedia, especies 5 que viven en el suelo, como los colémbolos (pulgas de nieve) Folsomia candida, Daphnia magna acuática y lombrices de tierra (Rose 2007, USEPA 2001). Ninguno de estos organismos presentó una respuesta significativa frente a la Cry1Ab con las concentraciones utilizadas en la prueba, lo cual condujo a observaciones de nivel de efectos no observado (NOEL) con concentraciones que oscilan entre 20 y 200 ppm. Esto se puede comparar con las estimaciones de exposición en el peor de los casos basadas en las concentraciones más altas de Cry1Ab observadas en tejidos de plantas GM entre 3 y 10 ppm (consultar la Tabla 2). Además, se realizaron pruebas toxicológicas agudas en mamíferos como ratones (Mus musculus) (USEPA 2001). La Tabla 4 incluye un resumen de los resultados de estos estudios. Se llevaron a cabo muchos otros estudios con la proteína Cry1Ab así como una variedad de ensayos para determinar los efectos potenciales sobre diversos organismos de prueba; no obstante el subgrupo revisado en este documento ha sido ampliamente considerado en los análisis regulatorios (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). Pruebas ecotoxicológicas de Cry1Ab sobre los lepidópteros no diana Danaus plexippus L. (mariposa monarca) y evaluaciones de riesgo posteriores Se sabe que las proteínas Cry1 tienen un efecto tóxico sobre ciertos insectos del orden de los lepidópteros (Crickmore et al. 1998, 2005, Hofte and Whiteley 1989, OECD 2007). Puesto que los lepidópteros que se alimentan de las plantas modificadas para que expresen proteínas Cry1 son considerados una plaga, los estudios de los organismos no diana han considerado el impacto sobre los lepidópteros no plagas que incidentalmente puedan encontrarse expuestos a las proteínas Cry. Se ha prestado especial atención a las investigaciones enfocadas en la mariposa monarca (Danaus plexippus), una especie reconocida, apreciada y valorada de Norteamérica. Un estudio de laboratorio informó que el polen del maíz Bt que expresa la proteína Cry1Ab podría inhibir el crecimiento de la larva monarca y causar su muerte, por ello podría también afectar la población en el campo (Losey et al 1999). Sin embargo, este estudio carece de métodos adecuados de experimentación y de interpretación y fue fuertemente criticado por la comunidad científica (Shelton and Sears 2001). Un estudio de campo preliminar sugiere que la sedimentación del polen sobre plantas asclepias (de las que se alimentan las mariposas monarcas) en campos de maíz podría alcanzar niveles suficientemente elevados para causar la muerte de las mariposas monarcas (Jesse and Obrycki 2000). Si bien se sabe desde hace mucho tiempo que las larvas monarcas son sensibles a la proteína Cry1Ab, las preguntas importantes fueron la concentración de Cry1Ab en el polen de diferentes eventos de transformación y el nivel de exposición al polen en el campo. Los estudios (Stanley-Horn et al 2001, Hellmich et al. 2001) indicaron que el polen del maíz Bt176 (que tiene un promotor específico que promueve la expresión) causó la mortalidad a concentraciones bajas pero el polen del maíz Bt 11 y del maíz MON 810 mostraron efectos poco significativos a concentraciones de hasta1000 granos de polen/cm2 y en concentraciones más altas. Un estudio sobre la sedimentación del polen sobre las asclepias ubicadas en los campos de maíz y sus alrededores estableció que se espera que menos del 1% de las hojas de asclepia que se encuentran dentro del campo de maíz durante las dos semanas de antesis presenten concentraciones de polen superiores a 900 granos/cm2 (OECD 2007, Pleasants et al. 2001, Hellmich et al. 2001). Un análisis de riesgo de la exposición que tienen las mariposas monarcas a la proteína Cry1Ab en el maíz estima que los niveles realistas de exposición podrían ocasionar una mortalidad del 0,05% y las estimaciones “en el peor de los casos” en las que se 6 supone que todo el maíz Bt cultivado es Bt176, el que expresa niveles altos de la Cry1Ab en el polen, podrían ocasionar una mortalidad del 6,1%.3 Este resultado confirma las evaluaciones de riesgo anteriores, en las cuales se predecían impactos insignificantes debido a la baja exposición de lepidópteros no diana al polen o a otros tejidos vegetales que contengan Cry1Ab (CFIA 1996a, 1996b, 1997a, 1997b, 1998, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997). Estudios de campo de Cry1Ab en organismos no diana Se han publicado numerosos documentos sobre los estudios del maíz con expresión de la proteína Cry1Ab en organismos no diana y diversas revisiones y metaanálisis han analizado los resultados netos de gran parte de la literatura disponible sobre los organismos no diana en el campo y los estudios de laboratorio (Romeis et al. 2006, Marvier et al 2007, Naranjo 2009, Wolfenbarger et al. 2008, Duan et al. 2008, 2010). Se ha creado una base de datos 4 que reúne dicha información para facilitar el estudio continuo (Marvier et al 2007, Naranjo 2009, Wolfenbarger et al. 2008, Duan et al. 2008, 2010). Cuando se compararon las plantas GM que expresan la proteína Cry1Ab con las plantas de control que no habían sido tratadas con insecticidas químicos hubo una disminución menor en la abundancia de artrópodos, pero cuando las plantas de control sí habían sido tratadas con insecticida, la abundancia de artrópodos fue significativamente mayor en el maíz que expresa la proteína Cry1Ab (Marvier et al. 2007, Naranjo 2009, Wolfenbarger et al. 2008). Los metaanálisis de grupos funcionales del maíz que expresa la proteína Cry1Ab muestran que la reducción general se debe a una reducción en parásitos en comparación con las plantas de control que no fueron tratadas con insecticidas y esta reducción se debe a la disminución de la abundancia de un depredador himenóptero específico del artrópodo diana. Esta reducción se explica por la ausencia de presas y no por los efectos de la proteína Cry1Ab (Wolfenbarger et al. 2008, Naranjo, 2009). Los estudios de laboratorio que no muestran ningún efecto directo o indirecto sobre los himenópteros respaldan esta idea (Romeis et al. 2006, Wolfenbarger et al. 2008, Naranjo, 2009). La exclusión de los efectos del depredador específico revela que no existe una diferencia significativa en números de artrópodos entre el maíz Bt y de control (Wolfenbarger et al. 2008, Naranjo, 2009). En estudios tritróficos sobre organismos no diana, los informes acerca del daño a depredadores no lepidópteros y parasitoides se ha atribuido a los escasos efectos de calidad del huésped (Naranjo 2009). Se han utilizado presas resistentes a Cry1A a fin de evitar estos efectos espurios (Chen et al. 2008, Li et al. 2009). Un reciente metaanálisis de estudios de campo que diferencian entre distintos taxones de arácnidos también no halló ninguna diferencia entre el maíz que expresa Cry1Ab y de control tanto para el total de especies de arácnidos como para la abundancia relativa de los taxones (Peterson et al. 2011). 3 Esta evaluación no está dirigida a todo Norteamérica sino al estado de Iowa, el que podría considerarse como un estado representativo de “los peores casos” debido al alto porcentaje de tierra con cultivos de maíz, el elevado uso de maíz Bt y la elevada superposición entre los campos de maíz y el hábitat de las mariposas monarcas (Sears et al. 2001). 4 La base de datos de los efectos no diana de los cultivos Bt la conserva el Centro Nacional de Análisis y Síntesis Ecológicos (National Center for Ecological Analysis and Synthesis, NCEAS) http://delphi.nceas.ucsb.edu/ btcrops/. Los documentos deben cumplir con los siguientes criterios para ser incluidos en la base de datos: (i) incluir una especie de cultivo que haya sido transformada genéticamente para que exprese uno o más genes cry derivados de Bacillus thuringiensis; (ii) medir los efectos del cultivo transformado para uno o más grupos de invertebrados no diana; (iii) incluir una comparación con un control no transgénico o un rango de niveles de exposición a la planta transgénica o a sus productos (p. ej., polen); y (iv) estar escrito en inglés. ESTABLECIMIENTO Y PERSISTENCIA EN EL MEDIOAMBIENTE DE LAS PLANTAS QUE EXPRESAN CRY1AB Biología de la especie de planta Por lo general, el punto de comienzo de las evaluaciones de riesgo ambiental de las plantas GM es la familiaridad con la biología de la especie de planta sin transformar o planta huésped dentro del ambiente que la recibe (OECD 2006). La información acerca de la biología de la planta huésped se puede utilizar para identificar las características específicas de la especie que pueden verse afectadas por los rasgos nuevos, de manera de permitir que la planta transgénica se transforme en “maleza”, que invada hábitats naturales o que sea perjudicial para el ambiente, de cualquier manera. También puede brindar detalles acerca de las interacciones importantes entre la planta y los demás organismos, y esos detalles pueden ser importantes para considerar los posibles perjuicios. Al considerar la biología de la planta huésped, el evaluador de riesgo puede identificar los peligros posibles que pueden estar asociados con la expresión de la nueva proteína (por ejemplo, Cry1Ab) y luego puede evaluar la probabilidad de que dichos peligros se hagan realidad. Por ejemplo, si la especie de la planta está muy aclimatada y necesita de gran intervención humana para crecer o reproducirse, el evaluador puede tener en cuenta lo anterior al considerar la probabilidad de que la planta GM se establezca fuera del cultivo. Datos del fenotipo La información acerca del fenotipo de las plantas GM que expresan Cry1Ab se recaba del laboratorio, el invernadero y los estudios de campo, y se presenta en las presentaciones regulatorias para: (1) identificar todo cambio intencional al fenotipo que pueda afectar la seguridad ambiental de la planta; y (2) para identificar todo cambio no intencional hecho sobre la biología de la planta que pueda afectar la seguridad ambiental. En las presentaciones regulatorias y en las publicaciones de pares, los datos del fenotipo se han concentrado en las características de la planta que podrían contribuir a su supervivencia o persistencia (p. ej., el potencial para convertirse en maleza) o que podrían afectar negativamente el rendimiento agrícola (p. ej.,, la susceptibilidad frente a enfermedades y los datos de rendimiento) (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). Puesto que la proteína Cry1Ab tiene el propósito de ofrecer resistencia a las plagas de insectos diana, este dato se considera al momento de realizar las observaciones de fenotipo. Algunos de los datos recolectados son cuantitativos (p. ej., altura de la planta o porcentaje de germinación de la semilla), mientras que otros datos son cualitativos y de observación (p. ej., no hay diferencia en la susceptibilidad frente a enfermedades) (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). En muchos casos, se observaron diferencias estadísticamente significativas entre las plantas GM que expresan Cry1Ab y los controles, pero fueron pequeñas y entraban dentro del rango informado sobre el maíz cultivado (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d, USEPA 2001). Conjuntamente, los datos de fenotipo no presentaron ningún patrón de cambio que respaldara la hipótesis de que la introducción de la proteína Cry1Ab tuviera un efecto no intencional sobre la morfología general o las características del fenotipo de las plantas, además de conceder resistencia a los insectos en las plagas de lepidópteros. Potencial para convertirse en maleza en ambientes agrícolas El maíz tienen cierto potencial para ser “voluntaria” a convertirse en maleza en las temporadas posteriores de cultivo (OECD 2003, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997). Las características que influyen en la capacidad de una planta para ser voluntaria son, en gran medida, las mismas que generalmente están presentes para convertirse en maleza, por ejemplo, el reposo vegetativo de la semilla, la dehiscencia y la competitividad; el maíz posee muy pocas de estas características (Baker 1974, OECD 2003, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997). No existen datos que indiquen una vinculación entre la expresión de la proteína Cry1Ab y el aumento de la capacidad de supervivencia o de pasar el invierno que pudiera alterar la prevalencia de maíz voluntario en las temporadas posteriores de cultivo ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). No se espera que los voluntarios de la temporada siguiente que expresen Cry1Ab presenten ninguna dificultad de control y se los puede tratar del mismo modo que a los voluntarios convencionales de maíz. Potencial para convertirse en maleza en ambientes no agrícolas Los principales mecanismos mediante los cuales se puede introducir Cry1Ab en un medioambiente no agrícola son el movimiento y el establecimiento de la planta GM fuera de las áreas cultivadas y del flujo de genes de la planta GM a una población naturalizada o a un grupo de familiares compatibles sexualmente (Mallory-Smith and Zapiola 2008). Las evaluaciones de riesgo de las plantas GM que expresan Cry1Ab han considerado los posibles impactos asociados con ambos tipos de movimiento (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997, USEPA 2001). Si bien en ciertos contextos todas las plantas pueden considerarse malezas, no se considera que el maíz sea una maleza invasiva o agresiva fuera de los sistemas agrícolas. El maíz tiene una capacidad muy restringida para establecerse sin la intervención humana (OECD 2003, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997). Los datos agronómicos indican que la Cry1Ab no tiene un impacto significativo sobre los rasgos asociados con el potencial para convertirse en maleza (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d, USEPA 2001). Aunque el no estar sometidas a los factores naturales de control (incluidos los insectos herbívoros) se ha presentado como explicación parcial del éxito de las especies invasivas (Blumenthal 2005, Keane and Crawley 2002, Mason et al. 2003, Mack 1996) la mayoría de las decisiones regulatorias han acordado que es poco probable que el agregado de resistencia a las plagas de lepidópteros haya conducido a que el maíz 7 que expresa Cry1Ab se haya transformado en invasivo en los ambientes que no son agrícolas (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d, USEPA 2001). Considerando los datos de los eventos aprobados, no hay patrones de cambios sistemáticos o confiables en la composición proximal de plantas que expresan Cry1Ab. Esto indica que la expresión de Cry1Ab no tiene ningún efecto biológicamente significativo sobre el metabolismo general de las plantas transformadas. Movimiento del transgen a familiares sexualmente compatibles CONCLUSIÓN El movimiento de transgenes de una planta GM a sus familiares silvestres se realiza mediante el polen, y la producción de híbridos reproductivamente viables depende de la proximidad física y temporal de las plantas GM con las especies compatibles sexualmente. El maíz no tiene familiares a los que se considere invasivos en los ecosistemas ni malezas de importancia agrícola de amplia distribución para los que la hibridación sea una preocupación (OECD 2003). El maíz se hibrida libremente con teosintes silvestres, pero se cree que la introgresión de genes es limitada (OECD 2003, Serratos et al. 1995, Baltazar et al. 2005). Las poblaciones de teosintes silvestres se limitan a la zona de México, Guatemala y una única población en Nicaragua; y si bien algunos agricultores mexicanos la consideran una maleza grave, otros la tratan como beneficiosa (Serratos et al. 1995). ANÁLISIS DE COMPOSICIÓN DE LAS PLANTAS CRY1AB El análisis detallado de la composición es un componente estrictamente científico de la caracterización de las plantas GM y es un requisito de las autoridades regulatorias para obtener las aprobaciones de seguridad de alimentos y pienso GM (OECD, 1992; WHO, 1995; FAO/WHO, 1996, EFSA 2006, Codex 2003a, 2003b). La selección de análisis que se realizan depende de la naturaleza del producto y su intención de uso. Los cultivos GM que expresan Cry1Ab y que presentan resistencia a los insectos, por lo general, se someten a un análisis proximal (proteína cruda, grasa cruda, fibra, humedad y cenizas) (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d). También se han realizado los análisis detallados de la composición de ácidos grasos y aminoácidos, así como el análisis de metabolitos secundarios importantes que tiene propiedades tóxicas o antinutricionales (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d). Los datos recabados pueden ser útiles como indicadores de cambios no intencionales en la planta transformada (Nickson and McKee 2002, Codex 2003a, 2003b). En el Anexo II, se sintetizan los datos de los análisis de composición disponibles al público. Si bien se observaron algunas diferencias estadísticamente significativas en la composición, las plantas GM que expresan Cry1Ab estuvieron dentro del rango normal que se observa en la especie de cultivo (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 USDA APHIS 1994, 1995b, 1995d, 1996b, 1996d). Los análisis regulatorios subsiguientes no consideraron que dichas diferencias fueran importantes en el contexto de seguridad ambiental (ANZFA 2000a, 2000b, 2000c, CFIA 1996a, 1996b, 1997a, 1997b, 1998, EC 1997, 1998 Japan BCH 2004a, 2004b, 2004c, 2004d, 2005a, 2005b, 2006, 2007a, 2007b, 2007c, 2007d, USDA APHIS 1995a, 1995c, 1996a, 1996c, 1997). 8 La proteína Cry1Ab expresada en plantas GM con resistencia a los insectos se deriva de las bacterias comunes del suelo Bacillus thuringiensis y es específicamente tóxica para los lepidópteros. Las pruebas de toxicidad con un rango representativo de organismos no diana arrojó valores de NOEL en concentraciones que representan diez veces o más las concentraciones ambientales esperadas de Cry1Ab. Los metaanálisis de los estudios de campo sugieren que el cultivo de plantas de maíz GM que expresan Cry1Ab no afectan la abundancia de artrópodos no diana, a excepción de los depredadores específicos de la plaga diana. La Cry1Ab en plantas puede ser tóxica para los lepidópteros no diana, pero las evaluaciones regulatorias de riesgo para los productos aprobados han concluido que la baja probabilidad de exposición tiene como resultado un riesgo adicional insignificante en comparación con otras prácticas agrícolas. El peso de las pruebas de los análisis de fenotipo y de composición demuestra que la expresión de Cry1Ab en los eventos aprobados de maíz no alteró la fisiología general de la planta y dichas plantas no tienen más probabilidades de convertirse en malezas ni en invasoras que sus equivalentes convencionales. REFERENCES Journal Articles and Books Accinelli C., Koskinen W. C., Becker J. M. and Sadowsky M. J. (2008). Mineralization of the Bacillus thuringiensis Cry1Ac endotoxins in soil. Journal of Agricultural and Food Chemistry. 56:1025-1028. Aronson A. I and Shai Y. (2001). Why Bacillus thuringiensis insecticidal toxins are so effective: unique features of their mode of action. FEMS Microbiology Letters 195: 1-8. Baker H.G. (1974). The evolution of weeds. Annual Review of Ecology and Systematics 5:1-24. Baltazar B. M., Sanchez-Gonzales J. J., Cruz-Larios, L., and Schoper, J. B. (2005). Pollination between maize and teosinte: an important determinant of gene flow in Mexico. Theoretical Applied Genetics 110:519-526. Blumenthal D. (2005). Interrelated causes of plant invasion. Science 310:243244. Bravo A., Gill S. S. and Soberon M. (2007). Mode of action of Bacillus thuringiensis Cry and Cyt toxins and their potential for insect control. Toxicon. 49(4):423435. http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1857359. Chen M., Zhao J.-Z., Collins H. L., Earle E. D., Cao J. and Shelton A. M. 2008. A critical assessment of the effects of Bt transgenic plants on parasitoids. PLoS ONE 3(5): e2284. doi:10.1371/journal.pone.0002284. Crecchio C. and Stotsky G. (1998). Insecticidal activity and biodegradation of the toxin from Bacillus thuringiensis subsp. Kurstaki bound to humic acids from soil. Soil Biology and Biochemistry 30(4):463-470. Crickmore N., Zeigler D. R., Feitelson J., Schnepf E., Van Rie J., Lereclus D., Baum J. and Dean D. H. (1998). Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins. Microbiology and Molecular Biology Reviews 62(3):807-813. Crickmore N., Zeigler D.R., Schnepf E., Van Rie J., Lereclus D., Baum J., Bravo A., and Dean D.H. (2005). Bacillus thuringiensis Toxin Nomenclature (Homepage). [cited January 2010]. http://www.lifesci.sussex.ac.uk/Home/Neil_ Crickmore/Bt/. Duan J. J., Marvier M., Huesing J., Dively G., Huang Z. Y. (2008) A meta-analysis of effects of Bt crops on honey bees (Hymenoptera: Apidae). PLoS ONE 3(1):e1415. Duan J. J, Lundgren J. G., Naranjo S., Marvier M. (2010) Extrapolating nontarget risk of Bt crops from laboratory to field. Biology Letters 6:74–77. Hellmich R. L., Siegfried B. D., Sears M. K., Stanley-Horn D. E., Daniels M. J., Mattila H. R., Spencer T., Bidne K. G. and Lewis L. C. (2001). Monarch larvae sensitivity to Bacillus thuringiensis-purified proteins and pollen. Proceedings of the National Academies of Science (U.S.A.) 98(21):11925-11930. Hofte H. and Whiteley H. R. (1989). Insecticidal crystal proteins of Bacillus thuringiensis. Microbiological Reviews 53(2):242-255. Jenkins J. L., Lee M. K., Sangadala S., Adang M. J. and Dean D. H. (1999). Binding of Bacillus thuringiensis Cry1Ac toxin to Manduca sexta aminopeptidase-N receptor is not directly related to toxicity. FEBS Letters 462:373-376. Jesse L. C. H. and Obrycki J. J. (2000). Field deposition of Bt transgenic corn pollen: lethal effects on the monarch butterfly. Oecologia 125:241-248. Keane R. M. and Crawley M. J. (2002). Exotic plant invasions and the enemy release hypothesis. Trends in Ecology and Evolution 17(4):164-170. Koskella J. and Stotzky G. (1997). Microbial utilization of free and clay-bound insecticidal toxins from Bacillus thuringiensis and their retention of insecticidal activity after incubation with microbes. Applied and Environmental Microbiology 63(9):3561-3568. Kumar P. A., Sharma R. P. and Malik V.S. (1996). The insecticidal proteins of Bacillus thuringiensis. Advances in Applied Microbiology 42:1-43. Li, Y., Romeis J., Wang P., Peng Y., and Shelton A. M. 2011. A comprehensive assessment of the potential effects of Bt cotton on Coleomegilla maculata demonstrates no detrimental effects by Cry1Ac and Cry2Ab. PLoS PLoS ONE 6(7): e22185. doi:10.1371/journal.pone.0022185. Losey J. E., Rayor L. S., Carter M. E. (1999). Transgenic pollen harms monarch larvae. Nature 399(6733):214. Mack R.N. (1996) Predicting the identity and fate of plant invaders: emergent and emerging approaches. Biological Conservation 78:107-121. Mallory-Smith C. and Zapiola M. (2008). Gene flow from glyphosate-resistant crops. Pest Management Science 64:428-440. Marchetti E., Accinelli C., Talame V. and Epifani R. (2007). Persistence of Cry toxins and cry genes from genetically modified plants in two agricultural soils. Agronomy for Sustainable Development 27(3):231-236. Marvier M., McCreedy C., Regetz J., Kareiva P. (2007). A meta-analysis of effects of Bt cotton and maize on nontarget invertebrates. Science 316:1475–1477. Mason P., Braun L., Warwick S. I., Zhu B., Stewart Jr. C. N. (2003) Transgenic Bt-producing Brassica napus: Plutella xylostella selection pressure and fitness of weedy relatives. Environmental Biosafety Research 2(4):263-276. Naranjo S. E. (2009). Impacts of Bt crops on non-target invertebrates and insecticide use patterns. CAB Reviews: Perspectives in Agriculture, Veterinary Science, Nutrition and Natural Resources 4(11): http://fbae.org/2009/FBAE/ website/images/pdf/imporatant-publication/impacts-of-bt-crops-on-non-targetinvertebrates-and-insecticide-use-patterns.pdf. Nickson T. E. and McKee M. J. (2002). Ecological assessment of crops derived through biotechnology. In Thomas J. A. and Fuchs R. L. (eds.) Biotechnology and safety assessment (third edition) (pp 233-252). Academic Press, San Diego, CA. NRC (1989). Field testing genetically modified organisms: framework for decisions. National Academy of Sciences, National Research Council (NRC) committee on Scientific Evaluation of the Introduction of Genetically Modified Microorganisms and Plants into the Environment. National Academy Press, Washington, D.C. Peterson J. A., Lundgren J. G, Harwood J. D. (2011). Interaction of transgenic Bacillus thuringiensis insecticidal crops with spiders (Araneae). The Journal of Arachnology 39:1-21 http://www.bioone.org/doi/full/10.1636/M10-98.1. Pleasants J. M., Hellmich R. L., Dively G. P., Sears M. K., Stanley-Horn D. E., Mattila H. R., Foster J. E., Clark P. and Jones G. D. (2001). Corn pollen deposition on milkweeds in and near cornfields. Proceedings of the National Academies of Sciences (USA) 98(21):11919-11924. http://www.pnas.org/content/98/21/11919.full. Rose R.I. (ed.) (2007) White paper on tier-based testing for the effects of proteinaceous insecticidal plant-incorporated protectants on nontarget invertebrates for regulatory risk assessment. USDA-APHIS and US Environmental Protection Agency, Washington, DC, USA. http://www.epa.gov/ pesticides/biopesticides/pips/non-target-arthropods.pdf Romeis J., Meissle M. and Bigler F. (2006). Transgenic crops expressing Bacillus thuringiensis toxins and biological control. Nature Biotechnology 24(1):63-71. Romeis J., Barsch D., Bigler F., Candolfi M. P., Gielkens M. M. C., Hartley S. E., Hellmich R. I., Huesing J. E., Jepson P. C., Layton R., Quemada H., Raybould A., Rose R. I., Schiemann J., Sears M. K., Shelton A. M., Sweet J., Vaituzis Z., and Wolt J. D. (2008). Assessment of risk of insect-resistant transgenic crops to nontarget arthropods. Nature Biotechology 26:203-208. http://www.nature.com/ nbt/journal/v26/n2/abs/nbt1381.html. Serratos J.A., Wilcox M.C., Castillo F. (Eds.) (1995). Proceedings of a Forum: Gene flow among maize landraces, improved maize varieties, and teosinte: implications for transgenic maize. The Mexican National Institute of Forestry Agriculture and Livestock Research (INIFAP), The International Maize and Wheat Improvement Center (CIMMYT), and The Mexican National Agricultural Biosafety Committee (CNBA). Schnepf E., Crickmore N., van Rie J., Lereclus D., Baum J., Fetelson J., Ziegler D. R. and Dean D. H. (1998). Bacillus thuringiensis and its pesticidal crystal proteins. Microbiology and Molecular Biology Reviews 62(3): 775-806. Shelton, A. M. and M. K. Sears. (2001). The monarch butterfly controversy: scientific interpretations of a phenomenon. The Plant Journal 27:483-488. Tabashnik B.E. (1992). Evaluation of synergism among Bacillus thuringiensis toxins. Applied and Environmental Microbiology 58(10):3343-3346. Wolfenbarger L. L., Naranjo S. E., Lundgren J. G., Bitzer R. J. and Watrud L. S. (2008). Bt crops effects on functional guilds of non-target arthropods: a meta-analysis. PloS One 3(5): e2118 http://www.ncbi.nlm.nih.gov/pmc/articles/ PMC2346550/pdf/pone.0002118.pdf. Zhang X., Candas M., Griko N. B., Taussig R., Bulla L. A. Jr. (2006). A mechanism of cell death involving an adenylyl cyclase/PKA signaling pathway is induced by the Cry1Ab toxin of Bacillus thuringiensis. Proceedings of the National Academies of Science (U.S.A.) 103(26):9897-9902. Regulatory Publications ANZFA (2000a). Final Risk Assessment Report Application A346 Food produced from insect protected corn line MON 810. Australia New Zealand Food Standards Agency, Canberra, Australia. http://www.foodstandards.gov. au/_srcfiles/Application%20A346%20Draft%20IR.pdf. ANZFA (2000b). Final Risk Assessment Report Application A385 Food produced from insect protected Bt-176 corn line. Australia New Zealand Food Standards Agency, Canberra, Australia. http://www.foodstandards.gov.au/_ srcfiles/A385IR.pdf. ANZFA (2000c). Draft Final Risk Assessment Report Application A386 Food produced from insect protected, herbicide tolerant Bt-11 corn line. http://www. foodstandards.gov.au/_srcfiles/A386_IR.pdf. CBD (2000a). Cartagena Protocol on Biosafety. Secretariat of the Convention on Biological Diversity (CBD), Montreal. http://www.cbd.int/biosafety/protocol.shtml. CBD (2000b). Cartagena Protocol on Biosafety Annex III: Risk Assessment. Secretariat of the Convention on Biological Diversity (CBD), Montreal. http:// www.cbd.int/biosafety/articles.shtml?a=cpb-43. 9 CFIA (1996a) Decision Document DD96-09: Determination of Environmental Safety of Event 176 Bt Corn (Zea mays L.) Developed by Ciba Seeds and Mycogen Corporation. Canadian Food Inspection Agency, Ottawa, Canada. http://www.inspection.gc.ca/english/plaveg/bio/dd/dd9609e.shtml. CFIA (1996b) Decision Document DD96-12: Determination of Environmental Safety of Northrup King Seeds’ European Corn Borer (ECB) Resistant Corn (Zea mays L.). Canadian Food Inspection Agency, Ottawa, Canada. http://www. inspection.gc.ca/english/plaveg/bio/dd/dd9612e.shtml. CFIA (1997) Decision Document 97-18: Determination of the Safety of Pioneer Hi-Bred International Inc.’s European Corn Borer (ECB) Resistant Corn (Zea mays L.) Line MON809. Canadian Food Inspection Agency, Ottawa, Canada. http://www.inspection.gc.ca/english/plaveg/bio/dd/dd9718e.shtml. CFIA (1997b) Decision Document 97-19: Determination of the Safety of Monsanto Canada Inc.’s Yieldgard™ Insect Resistant Corn (Zea mays L.) Line MON810. Canadian Food Inspection Agency, Ottawa, Canada. http://www. inspection.gc.ca/english/plaveg/bio/dd/dd9719e.shtml. CFIA (1998) Decision Document 98-26: Determination of the Safety of Monsanto Canada Inc.’s Yieldgard™ Insect Resistant Corn (Zea mays L.) Line MON802. Canadian Food Inspection Agency, Ottawa, Canada. http://www. inspection.gc.ca/english/plaveg/bio/dd/dd9826e.shtml. Codex (2003a). Principles for the risk analysis of foods derived through modern biotechnology. Codex Alimentarius Commission (Codex), Rome http://www. codexalimentarius.net/download/standards/10007/CXG_044e.pdf. Codex (2003b). Guideline for the conduct of food safety assessment of foods derived from recombinant DNA plants. Codex Alimentarius Commission (Codex), Rome http://www.codexalimentarius.net/download/standards/10021/ CXG_045e.pdf. Japan BCH (2004d) Outline of the Biological Diversity Risk Assessment Report: MON-00810-6 http://www.bch.biodic.go.jp/download/en_lmo/MON810enRi. pdf. Japan BCH (2005) Outline of the Biological Diversity Risk Assessment Report: MON-00021-9 X MON-00810-6 http://www.bch.biodic.go.jp/download/en_ lmo/GA21_MON810enRi.pdf. Japan BCH (2005b) Outline of the Biological Diversity Risk Assessment Report: ACS-ZM003-2 X MON-00810-6 http://www.bch.biodic.go.jp/download/en_ lmo/T25_MON810enRi.pdf. Japan BCH (2006) Outline of the Biological Diversity Risk Assessment Report: MON-88017-3 X MON 00810-6 http://www.bch.biodic.go.jp/download/en_ lmo/MON88017_MON810enRi.pdf. Japan BCH (2007) Outline of the Biological Diversity Risk Assessment Report: SYN-BTØ11-1 http://www.bch.biodic.go.jp/download/en_lmo/Bt11enRi.pdf. Japan BCH (2007b) Outline of the Biological Diversity Risk Assessment Report: SYN-EV176-9 http://www.bch.biodic.go.jp/download/en_lmo/Event176enRi. pdf. Japan BCH (2007c) Outline of the Biological Diversity Risk Assessment Report: REN-00038-3 X MON-00810-6 http://www.bch.biodic.go.jp/download/en_lmo/ LY038_MON810enRi.pdf. OECD (1992). Recombinant DNA safety considerations. Organization for Economic Cooperation and Development (OECD), Paris, France. OECD (2003). Consensus document on the biology of Zea mays subsp. Mays. . Organization for Economic Cooperation and Development (OECD), Paris, France. CTNBio (2005). Commercial release of genetically modified cotton, Bollgard Cotton (531). Brazilian National Biosafety Technical Commission (CTNBio), Sao Paulo http://www.ctnbio.gov.br/index.php/content/view/3663.html. OECD (2006). Points to consider for consensus documents on the biology of cultivated plants. Organization for Economic Cooperation and Development (OECD), Paris, France. CTNBio (2009). Commercial release of genetically modified cotton, Bollgard Cotton (MON 15985): Technical Opinion no. 1832/2009. Brazilian National Biosafety Technical Commission (CTNBio), Sao Paulo. OECD (2007) Consensus Document on Safety Information on Transgenic Plants Expressing Bacillus thuringiensis - Derived Insect Control Protein. Series on Harmonisation of Regulatory Oversight in Biotechnology, No. 42. Organisation for Economic Co-operation and Development, Paris. EC (1997) Commission Decision 97/98/EC of 23 January 1997 concerning the placing on the market of genetically modified maize (Zea mays L.) with the combined modification for insecticidal properties conferred by the Bt-endotoxin gene and increased tolerance to the herbicide glufosinate ammonium pursuant to Council Directive 90/220/EEC. http://www.biosafety.be/PDF/97_98.pdf. EC (1998) Commission Decision of 22 April 1998 concerning the placing on the market of genetically modified maize (Zea mays L. line MON 810) pursuant to Council Directive 90/220/EEC. http://www.biosafety.be/PDF/98_294.pdf. EFSA (2006). Guidance document of the scientific panel on genetically modified organisms for the risk assessment of genetically modified plants and derived food and feed. European Food Safety Authority (EFSA), Brussels, Belgium. http://www.efsa.europa.eu/en/scdocs/doc/gmo_guidance_derived_feed_food. pdf. EU DG SANCO (2010). EU Pesticides Database [Search for Bacillus thuringiensis]. European Union Directorate General, Health and Consumers (EU DG SANCO) Brussels, Belgium http://ec.europa.eu/sanco_pesticides/public/ index.cfm?event=activesubstance.selection. FAO/WHO (1996). Biotechnology and food safety. Report of a Joint FAO/ WHO Consultation. Food and Agriculture Organization (FAO)/World Health Organization (WHO), Food and Nutrition Paper 61, Rome, Italy. http://www. fao.org/ag/agn/food/pdf/biotechnology.pdf. Japan BCH (2004) Outline of the Biological Diversity Risk Assessment Report: MON-00863-5 X MON-00810-6 X MON-00603-6 http://www.bch.biodic.go.jp/ download/en_lmo/MON863_MON810_NK603enRi.pdf. Japan BCH (2004b) Outline of the Biological Diversity Risk Assessment Report: MON-00603-6 X MON- 00810-6 http://www.bch.biodic.go.jp/download/en_ lmo/NK603_MON810enRi.pdf. Japan BCH (2004c) Outline of the Biological Diversity Risk Assessment Report: MON-00810-6 X MON-00863-5 http://www.bch.biodic.go.jp/download/en_ lmo/MON810_863enRi.pdf. 10 PMRA (2008). Re-evaluation decision document: Bacillus thuringiensis. Health Canada, Pest Management Regulatory Agency (PMRA), Ottawa. [accessed Feb18, 2010] http://www.hc-sc.gc.ca/cps-spc/pubs/pest/_decisions/rvd2008-18/ index-eng.php. USDA APHIS (1994). Petition for Determination of Nonregulated Status of Ciba Seeds’ Corn Genetically Engineered to Express the Cry1A(b) Protein from Bacillus thuringiensis subspecies kurstaki. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis.usda.gov/brs/aphisdocs/94_31901p.pdf. USDA APHIS (1995). USDA/APHIS Petition 94-319-01 for Determination of Nonregulated Status for Event 176 Corn: Environmental Assessment and Finding of No Significant Impact. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis. usda.gov/brs/aphisdocs2/94_31901p_com.pdf. USDA APHIS (1995b). Petition for Determination of Nonregulated Status: Insect Protected Corn (Zea mays L.) with the cryIA(b) Gene from Bacillus thuringiensis subsp. Kurstaki. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis.usda. gov/brs/aphisdocs/95_09301p.pdf. USDA APHIS (1995c). USDA/APHIS Petition 95-093-01 for Determination of Nonregulated Status for Insect Protected Corn Line MON 80100: Environmental Assessment and Finding of No Significant Impact. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis.usda.gov/brs/aphisdocs2/95_09301p_com.pdf. USDA APHIS (1995d). Petition for determination of Nonregulated Status for: Insect Protected Corn (Zea mays L.) Expressing the Cry IA(b) Gene from Bacillus thuringiensis var. kurstaki. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis. usda.gov/brs/aphisdocs/95_19501p.pdf. USDA APHIS (1996). USDA/APHIS Petition 95-195-01 for Determination of Nonregulated Status for Bt11 Corn: Environmental Assessment and Finding of No Significant Impact. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis.usda.gov/ brs/aphisdocs2/95_19501p_com.pdf. USEPA (2007). White paper on tier-based testing for the effects of proteinaceous insecticidal plant-incorporated protectants on non-target arthropods for regulatory risk assessments. U.S. Environmental Protection Agency (USEPA), Washington D. C. http://www.epa.gov/pesticides/biopesticides/pips/non-targetarthropods.pdf. USDA APHIS (1996b). Petition for Determination of Nonregulated Status: Additional YieldGard Corn (Zea mays L.) Lines with the cry1A(b) Gene from Bacillus thuringiensis subsp. kurstaki. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis. usda.gov/brs/aphisdocs/96_01701p.pdf. USEPA (2010). The Office of Prevention, Pesticides and Toxic Substances (OPPTS), Harmonized Test Guidelines. U.S. Environmental Protection Agency (USEPA), Washington D. C. http://epa.gov/oppts/pubs/frs/home/guidelin.htm. USDA APHIS (1996c). Addition of Two Genetically Engineered Insect Resistant Corn Lines to Determination of Nonregulated Status. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis.usda.gov/brs/aphisdocs2/96_01701p_com.pdf. USDA APHIS (1996d). Petition for Determination of Nonregulated Status: Insect-Protected Roundup Ready Corn Line MON 802. APHIS Petition no. 96-317-01. United States Department of Agriculture, Animal and Plant Health Inspection Service, Washington D.C. http://www.aphis.usda.gov/brs/ aphisdocs/96_31701p.pdf. USEPA (2001). Bt Plant-Incorporated Protectants October 15, 2001 Biopesticides Registration Action Document. U.S. Environmental Protection Agency (USEPA), Washington D. C. http://www.epa.gov/pesticides/biopesticides/pips/ bt_brad.htm. WHO (1995). Application of the Principles of Substantial Equivalence to the Safety Evaluation of Foods or Food Components from Plants Derived by Modern Biotechnology. A Report of a WHO Workshop. World Health Organisation (WHO), Geneva. ANEXO I: RESUMEN DE DATOS DE EXPRESIÓN DE LA PROTEÍNA CRY1AB Las tablas que aparecen a continuación presentan un resumen de datos de publicaciones revisadas por pares y de presentaciones regulatorias. Los datos se presentan en el formato en el que están disponibles en el documento citado, con el propósito de facilitar las referencias cruzadas. En las fuentes citadas, se puede encontrar información adicional acerca de las metodologías de recolección y de toma de muestras. Tabla I.1. Niveles de la proteína Cry1Ab en líneas de maíz Bt176 y de híbridos durante el desarrollo (ELISA) (USDA 1994, CFIA 1996, ANZFA 200b). Etapa de desarrollo µg/g de peso seco (n) Plántula Antesis Madurez de la semilla Senescencia Bt1761 10,5 (3; 8,57-13,09) 176 x 5542 4,78 (5; 2,41-5,95) 3,04 (3; 2,84-3,43) 1,43(3; 0,46-2,70) 0,10 (2; 0,09-0,10) 2,70 (3; 2,22-3,36) 1,65 (3; 0,95-2,90) 176 x 5643 0,12 (3; 0,08-0,19) 7,56 (3; 2,56-11,28) 13,37 (2; 7,20-19,54) 1,52 (2; 1,25-1,78) 0,30 (3; 0,06-0,50) Bt1761 4,19 (3; 2,45-7,45) 1,44 (5; 0,93-1,94) 0,29 (4; 0,10-0,49) <0,02 (5) 176 x 5542 2,85 (6; 0,75-7,33) 0,20 (3; 0,05-0,44) 0,15 (4; 0,09-0,25) <0,02 (4) 176 x 5643 3,40 (2 3,27-3,52) 0,74 (3; 0,52-0,86) 0,26 (4; 0,17-0,33) <0,02 (3) Hojas Planta entera Granos Bt1761 <0,01 (4) <0,01 (5) 2 <0,01 (3) <0,01 (3) 176 x 5643 <0,01 (2) <0,01 (3) 176 x 554 Polen4 Bt1761 4,32 (4; 3,70-5,58) 176 x 5542 2,34 (3; 1,77-3,15) 176 x 5643 5,01 (3; 4,76-5,21) Raíces Bt1761 <0,1 (2) <0,04 (4) <0,04 (4) nd 176 x 5542 <0,1 (6) <0,04 (3) <0,04 (3) nd 176 x 5643 <0,1 (1) <0,04 (3) <0,04 (2) nd Médula Bt1761 nd <0,07 (4) <0,04 (4) nd 2 nd <0,07 (3) <0,04 (3) nd 176 x 5643 nd <0,07 (3) <0,04 (2) nd 176 x 554 1 El genotipo Bt176 se refiere a CG00526-176 que es homocigota del gen cry1Ab. 2 El genotipo 176 x 554 se refiere a la línea de híbridos de maíz derivada de la cruza entre CG00526-176 y la línea CG00554 y es hemicigoto de cry1Ab. 3 El genotipo 176 x 564 se refiere a la línea de híbridos de maíz derivada de la cruza de CG00526-176 y la línea CG00554 y es hemicigoto de cry1Ab. 4 Los valores de polen se determinaron en muestras de polen seco y extrapoladas a peso fresco. 11 Tabla I.2. Niveles de Cry1Ab en híbridos de maíz Bt-176 [µg/g total de proteína detectado por el método de ensayo por inmunoabsorción ligado a enzimas (ELISA)]1. Línea Granos en madurez fisiológica <0,093 Plantas enteras en madurez fisiológica 3,63 Plantas enteras en antesis Bt 176 x 554 <0,093 2,14 2,50 Bt176 x 564 <0,103 3,71 7,40 Bt 176 14,40 1 Valores derivados del cálculo de los valores en la Tabla 1. 2 Por debajo del límite de cuantificación. Tabla I.3. Niveles de proteína Cry1Ab en Bt-176 en peso fresco durante el desarrollo del maíz Bt, verano 1993 (ELISA) (USDA 1994). Tejido Genotipo, Línea de maíz Media de ng Cry1Ab/g de peso fresco (N; rango) Plántula Antesis Madurez de la semilla Senescencia 1159 (3; 892-1506) 735 (3; 657-793) 465 (3; 158-922) 66 (2; 55-77) 1 Hojas Raíces Médula Polen2 Granos +/+ CG00526-176 +/- CG00554 x CG00526-176 596 (5; 308-738) 530 (3; 449-614) 471 (3; 266-765) 88 (3; 57-141) +/- CG00564 x CG00526-176 839 (3; 285-1253) 3029 (2; 1631-4427) 442 (2; 365-520) 225 (3; 47-379) +/+ CG00526-176 <8 (2) <8 (4) <8 (4) nd +/- CG00554 x CG00526-176 <8 (6) <8 (3) <8 (3) nd +/- CG00564 x CG00526-176 <8 (1) <8 (3) <8 (2) nd +/+ CG00526-176 nd <8 (4) <8 (4) nd +/- CG00554 x CG00526-176 nd <8 (3) <8 (3) nd +/- CG00564 x CG00526-176 nd <8 (3) <8 (2) nd 2021 (4; 1732-2611) <5 (4) +/+ CG00526-176 +/- CG00554 x CG00526-176 1137 (3; 828-1474) <5 (3 +/- CG00564 x CG00526-176 2348 (3; 2226-2438) <5 (2) +/+ CG00526-176 <5 (5) +/- CG00554 x CG00526-176 <5 (3) +/- CG00564 x CG00526-176 Planta entera <5 (3) +/+ CG00526-176 315 (3; 191-532) 182 (5; 159-213) 73 (4; 50-107) <5 (5) +/- CG00554 x CG00526-176 230 (6; 81-556) 44 (3; 14-88) 41 (4; 21-68) <5 (4) +/- CG00564 x CG00526-176 316 (2; 305-328) 144 (3; 102-167) 71 (4; 48-92) <5 (3) Todas las muestras se determinaron mediante ELISA y no se corrigieron para evaluar la eficiencia de extracción o recuperación. Todas las plantas de control tenían valores ELISA correspondientes a 0 ng Cry1Ab/g en peso fresco. Cuando se detectaron cantidades traza no cuantificables, los valores se muestran como (<) por debajo del límite de cuantificación determinado para dicho tejido. Las plantas que eran homocigotas o hemicigotas para los transgenes se designaron “+/+” y “+/-” respectivamente. na=no analizado El espacio vacío significa que no hay tejido disponible en dicha etapa de desarrollo. 1 Las plántulas se cultivaron en invernaderos y se analizaron 3 semanas después de la siembra; todos los otros estados se cultivaron en campo. 2 Los valores se determinaron en muestras de polen seco y extrapolados a peso fresco al multiplicar µg Cry1Ab/g de polen en peso seco por 0,486 (g de polen en peso seco/g de polen en peso fresco). Tabla I.4. Resumen de los niveles de proteínas específicas medidos en tejidos de MON 80100 1 (USDA 1995b). Línea de maíz Hoja Grano Planta entera3 Polen3 MON 80100 1,3 0,57 1,77 N.D.2 1 Los valores son medias calculadas de cinco sitios a partir de medias calculadas del análisis de 3-4 muestras réplicas por sitio y se expresan como µg/g de peso fresco. 2 No Detectado. 3 Los valores son medias calculadas del análisis de cuatro muestras réplicas de un sitio. 4 Determinación a partir del análisis por duplicado de una muestra de polen de un sitio. 12 Tabla I.5. Concentración específica de la proteína Cry1Ab en tejidos de maíz transgénicos Bt11 durante el ciclo de vida 1 (USDA 1995d). Días después de la plantación Tejido 5 10 15 Cotiledón 20,5 (0,4) 36 (1,7) Raíces 22,1 (1,3) 11,7 (0,8) 2 hoja 106 (4,7) a 20 27,9 (3) 25 30 37 59 84 119 37 (7) 12 (3,4) 18,2 (4) 2,2 (1,2) 22,4 (0,9) 125 (5) 38 (1,3) 55,6 (4) 45,7 (2) 168 (5) 34 (1,3) 54 (3,3) 5a hoja 10 hoja 16,7 (1,2) 102 (6) a 30 (1,5) 9,4 (1) 37,9 (2,2) 10,2 (1,1) 36 (3,3) 10,4 (2,6) 12,6 (3,4) 9,0 (2,2) 27 (4) 19,2 (3,1) 18,0 (4,8) 8,8 (2,0) 8,0 (1,4) 8,8 (2,0) 6,8 (4,2) 15a hoja Epidermis del tallo Méd. del tallo Panícula Polen 1,25 (0,75) Estigmas (barbas o “sedas”) Caña 2,4 (0,6) 6,6 (1,8) 5,2 (3,8) 13,6 (2,3) 27,2 (8,8) 5,2 (1,4) Espata (chala) 24,8 (2,9) 15,4 (5,3) 2,6 (2,6) Olote (zuro) 13,0 (3,0) 26,6 (6,4) 16,2 (3,3) Cepellón 3,2 (1,2) 7,0 (2,1) 4,8 (2,1) 8,2 (2,5) 0,4 (0,4) Grano 1 Los valores se expresan en ng de Cry1Ab/mg de proteína vegetal y no están corregidos para evaluar la eficiencia de extracción real.(Error típico de las medias). Las plantas se cultivaron en invernadero y se extrajeron cinco réplicas para cada fecha de muestreo destructivo. Tabla I.6. Proteína Cry1Ab en tejidos de plantas de maíz Bt 11en etapa de R6 (USDA 1995d). Tejido Cry1Ab ug/g de peso fresco Hojas 3,26 Tallo2 0,14 Grano 1,40 1 1 La hoja incluye: la hoja, el tallo de la hoja y la espata (chala). 2 El tallo incluye: el tallo, la caña, la panícula, el olote, las raíces y los estigmas (conocidos como barbas o sedas). Tabla I.8. Niveles medios de la proteína Cry1Ab detectados mediante ELISA (ANZFA 2000c). Niveles medios en hojas y granos (µg/g de peso fresco)1 Hoja Grano X4334-CBR 4,3 ± 0,66 X4734-CBR X6534-CBR X7634-CBR Control NK7514 Tabla I.7. Concentración específica de la proteína Cry1Ab en tejidos de maíz Bt11 con deet durante el ciclo de vida de plantas cultivadas en invernadero (ELISA)1 (ANZFA 2000c). ng de Cry1Ab/mg de proteína vegetal ± SE Tejido 102 Raíces 11,7 ± 1,7 2a hoja 106 ± 4,7 252 592 842 1192 12 ± 3,4 18,2 ± 4 2,2 ± 1,2 37,9 ± 2,2 Polen 1,25 ± 0,8 Grano 8,2 ± 2,5 0,71 ± 0,11 5,05 ± 0,35 1,30 ± 0,28 0,84 ± 0,18 0,55 ± 0,06 5,30 ± 0,90 1,50 ± 0,04 0,79 ± 0,03 0,64 ± 0,04 5,24 ± 0,78 1,60 ± 0,13 1,04 ± 0,23 0,53 ± 0,06 0 0 0 0 Tabla I.9. Niveles de la proteína Cry1Ab en tejidos de híbridos de maíz dulce Bt-11 (ELISA)1 (ANZFA 2000c). Niveles de Cry1Ab en tejidos Bt-11 (µg/g de peso fresco) Hojas Media 10,2 ± 1,1 Control 2 0,4 ± 0,4 1 Los valores son medias de muestras tomadas de 5 plantas réplicas (n=5). Los datos que no están disponibles en ciertas etapas de desarrollo se dejaron en blanco. 2 Días después de la plantación. Tallo 1 n=4 125 ± 5 15a hoja 1,5 ± 0,21 Espata (chala) 1,1 ± 0,26 Grano Rango Media 0 Rango 0 Híbrido 0943 4,53 3,87-5,18 3,17 2,54-3,80 Híbrido 0937 3,10 2360-3,86 1,59 1,41-1,80 Híbrido 0941 3,31 2,66-3,92 0,78 0,51-1,08 1 Los valores se expresan en µg/g de peso fresco. n=3 excepto en el caso del híbrido 0943 en donde n=2. 2 Las variedades de las plantas de control son Jubilee, Bonus y Empire. Las plantas de control tenían valores ELISA correspondientes a 0 ng Cry1Ab/g en peso fresco. 13 Tabla I.10. Expresión del tejido de la proteína Cry en Bt111 (USEPA 2001). Ingrediente activo Cry1Ab – Bt11 (006444) Hoja Raíz 3,3 ng/mg 2,2-37,0 ng/mg de proteína Polen Tabla I.11. Resumen de los niveles de proteínas específicas en tejidos de la línea YieldGard de maíz MON 809 (µg/g de peso fresco) 1 (USDA 1996b, CFIA 1997a). Semilla < 90 ng 1,4 ng/mg Cry1Ab/g de (grano) polen en peso seco 1 Los valores se expresan en peso fresco de tejido a menos que se indique lo contrario. Línea de maíz Hoja Grano Planta entera2,3 Polen2 MON 809 1,63 0,55 1,23 N.D.4 1 Los valores son medias calculadas a partir de los análisis de seis muestras vegetales, una de cada uno de los seis campos, a menos que se indique lo contrario. 2 La media se calculó a partir de los análisis de muestras vegetales de un sitio. 3 Los valores son medias calculadas a partir de los análisis de dos muestras réplicas de un sitio. 4 No Detectado. Tabla I.12. Niveles de expresión de proteína en las líneas de maíz protegidas contra insectos determinados mediante ELISA (ANZFA 2000a, USDA 1996b, CFIA 1997b). Media de niveles de expresión y rangos (µg/g de peso fresco)1 Hoja Cry1Ab Grano Planta entera2 Polen3 Media Rango Media Rango Media Rango Media Rango 9,35 7,93-10,34 0,31 0,19-0,39 4,15 3,65-4,65 0,09 nd 1 Los valores son medias de muestras tomadas de 6 plantas (n=6). De cada sitio se toma una muestra vegetal, a menos que se indique lo contrario. 2 Los valores son medias de muestras tomadas de muestras vegetales réplicas. 3 Los valores son medias de muestras tomadas de un solo sitio (n=6). nd = sin ensayos disponibles. Tabla I.13. Expresión del tejido de la proteína Cry 1 (USEPA 2001). Ingrediente activo Planta entera Cry1Ab – 10,34 ng/ < 90 ng 0,19-0,39 ng/mg 4,65 ng/mg MON810 mg Cry1Ab/g de (grano) (006430)2 polen en peso seco 1 Los valores se expresan en peso fresco de tejido a menos que se indique lo contrario. 2 Datos de estudios de campo 1994. 14 Hoja Polen Semilla Tabla I.14. Resumen de los niveles de proteínas específicas medidos en tejidos de plantas de maíz MON 802 (USDA 1996d, CFIA 1998) Línea de maíz Hoja1 Grano1 Planta entera2 MON 802 9,55 3,20 1,35 1 Los valores son medias calculadas de los seis sitios. 2 Los valores son medias calculadas a partir del análisis de dos muestras vegetales réplicas de un sitio. ANEXO II: RESUMEN DE ANÁLISIS DE COMPOSICIÓN DE LAS PLANTAS GM QUE EXPRESAN CRY1AB. Las tablas que aparecen a continuación presentan un resumen de datos de publicaciones revisadas por pares y de presentaciones regulatorias. Los datos se presentan en el formato en el que están disponibles en el documento citado, con el propósito de facilitar las referencias cruzadas. En las fuentes citadas, se puede encontrar información adicional acerca de las metodologías de recolección y de toma de muestras. Tabla II.1. Análisis proximales de granos de maíz Bt y de control (Bt 176) (USDA 1994, ANZFA 2000b). Días después de la plantación Genotipo1 N2 Ceniza Fibra Grasa Humedad3 Proteína Almidón 526 5 526-176 5 554x526 5 554x526-176 5 637x526 5 637x526-176 5 684x526 5 684x526-176 5 615 2 615-176 2 635x615 2 635x615-176 2 1,44 ± 0,03 (1,38-1,46) 1,41 ± 0,04 (1,35-1,45) 1,30 ± 0,05 (1,26-1,36) 1,27 ± 0,03 (1,22-1,30) 1,63 ± 0,25 (1,26-1,90) 1,68 ± 0,23 (1,31-1,90) 1,73 ± 0,16 (1,45-1,84) 1,63 ± 0,16 (1,36-1,74) 1,73 ± 0,21 (1,58-1,87) 1,82 ± 0,01 (1,81-1,83) 1,93 ± 0,08 (1,87-1,99) 1,81 ± 0,01 (1,80-1,82 1,95 ± 0,08 (1,85-2,05) 1,86 ± 0,13 (1,69-2,03) 1,50 ± 0,13 (1,30-1,65) 1,41 ± 0,12 (1,20-1,50) 1,97 ± 0,10 (1,90-2,14) 1,77 ± 0,32 (1,20-2,00) 1,56 ± 0,38 (0,90-1,80) 1,61 ± 0,16 (1,45-1,80) 1,84 ± 0,08 (1,78-1,90) 1,70 ± 0,22 (1,54-1,85) 1,74 ± 0,06 (1,69 -1,78) 1,92 ± 0,23 (1,75 -2,08) 4,74 ± 0,8 (3,84-5,65) 4,07 ± 0,80 (3,30-5,38) 2,55 ± 1,14 (0,95-3,90) 4,21 ± 0,794 (3,35-5,28) 4,07 ± 1,12 (2,64-5,08) 3,49 ± 1,62 (1,01-5,54) 3,66 ± 0,96 (2,35 -5,04) 2,04 ± 0,60 (1,45-2,89) 4,67 ± 0,59 (4,25-5,08) 4,34 ± 0,13 (4,24-4,43) 4,14 ± 0,10 (4,07-4,21) 4,05 ± 0,21 (3,90-4,19) 11,94 ± 0,44 (11,28-12,49) 12,38 ± 0,34 (12,02-12,82) 9,64 ± 0,40 (9,29-10,27) 12,23 ± 0,304 (11,98-12,72) 12,17 ± 0,49 (11,55-12,72) 10,24 ± 1,88 (7,87-11,97) 12,14 ± 0,28 (11,93-12,46) 9,01 ± 1,274 (6,97-10,30) 10,82 ± 0,26 (10,63-11,00) 12,38 ± 0,04 (12,35-12,41) 13,22 ± 0,27 (13,03-13,41) 12,06 ± 0,10 (11,99-12,13) 12,21 ± 0,43 (11,60-12,74) 11,71 ± 0,35 (11,23-12,05) 11,96 ± 0,35 (11,43-12,33) 10,88 ± 0,174 (10,70-11,11) 12,13 ± 0,48 (11,53-12,72) 13,62 ± 0,4 (13,14-14,14) 12,85 ± 0,39 (12,51-13,48) 13,32 ± 0,37 (12,85-13,87) 10,07 ± 0,15 (9,96-10,17) 11,79 ± 0,074 (11,74-11,84) 11,17 ± 0,62 (10,73-11,60) 11,38 ± 0,33 (11,14-11,61) 65,85 ± 4,17 (60,86-72,08) 65,95 ± 0,88 (68,69-70,84) 68,29 ± 10,06 (57,28-79,51) 72,19 ± 2,56 (68,25-74,64) 66,84 ± 2,97 (63,88-71,09) 68,85 ± 2,29 (66,81-72,06) 58,23 ± 7,19 (50,37-67,51) 68,07 ± 3,014 (64,54-71,82) 63,16 ± 0,93 (62,50-63,82) 59,14 ± 0,98 (58,45-59,83) 61,51 ± 0,75 (60,96-62,04) 61,04 ± 1,82 (59,75-62,32) 1 Abreviaturas: 526 = CG00526 autógamo; 554 x 526 = CG00554 x CG00526 híbrido, etc.. Los números CG designan líneas de semillas patentadas. Los sufijos “-176” indican el híbrido/línea Bt transgénico. 2 Número de muestras réplicas analizadas a partir de una muestra compuesta de granos que representan distintas plantas. En donde N = 5, las muestras se analizaron una vez. En donde N = 2, cada muestra se analizó dos veces. 3 La humedad se expresa como un porcentaje del peso de la muestra (antes del secado). 4 Marca una diferencia significativa respecto de la media de control correspondiente (p ≤ 0,05). Tabla II.2. Análisis de la composición de granos de maíz CG00526-176 autógamo1 (Bt 176) (ANZFA 2000b). Control CG00526 Componente % de proteína % de grasa total Desviación típica ± media 12,21 ± 0,43 4,74 ± 0,80 Bt CG00526-176 Rango 11,60-12,74 Desviación típica ± media 11,71 ± 0,35 Rango 11,23-12,05 Rango de bibliografía2(%) 6-12 3,84-5,65 4,07 ± 0,80 3,30-5,38 3,1-5,7 % de ceniza 1,44 ± 0,03 1,38-1,46 1,41 ± 0,04 1,35-1,45 1,1-3,9 % de almidón 65,85 ± 4,17 60,86-72,08 69,05 ± 0,88 568,69-70,84 65,3-83 % de fibra 1,95 ± 0,08 1,85-2,05 1,86 ± 0,13 1,69-2,03 2,53 Humedad 11,94 ± 0,44 12,38 ± 0,34 7-23 1 Los valores son medias de muestras tomadas de 6 plantas (n=6). De cada sitio se toma una muestra vegetal, a menos que se indique lo contrario. 2 Los valores son medias de muestras tomadas de muestras vegetales réplicas. 3 Los valores son medias de muestras tomadas de un solo sitio (n=6). nd = sin ensayos disponibles. 15 Tabla II.3. Análisis de la composición de granos de maíz CG00526-176 autógamo1 (Bt 176) (ANZFA 2000b). Componente Tabla II.4. Resumen del análisis de la composición de plantas de maíz de control y Bt-111 (ANZFA 2000c). 13,18 ± 0,07 1,6 Total de nitrógeno3 Humedad Control isogénico H8540 12,35 ± 0,06 12,3 12,6 2,2 Ceniza 1,47 ± 0,04 1,79 ± 0,007 1,70 ± 0,02 1,6 ± 0,02 1,1-3,9 68,02 ± 0,4 67,57 ± 0,4 70,83 ± 0,81 70,25 ± 0,48 61-78 3,3-4,3 1,93-2,54 19,2-33,14 MON 80100 MON 80080 13,12 12,0 Grasa 4,0 4,0 Ceniza 1,6 Fibra 2,3 Proteína Línea autógama H8540-Bt Híbrido Bt+/Bt- Híbrido de control Rango normal2 12,28 ± 0,03 12,30 ± 0,0 7,7-104 12,6 13,3 7-23 Carbohidratos 81,32 82,2 Almidón Humedad 14,8 14,6 Celulosa 2,99 ± 0,007 2,9 ± 0,05 2,67 ± 0,28 2,92 ± 0,05 Xantófilas 24,2 21,0 21,6 19,1 1 Análisis de los datos obtenidos de muestras de semillas de 5 sitios. 2 Los valores son significativamente diferentes con un nivel de confianza del 95% respecto de la línea de control MON 80080. 1 Las muestras son de 500 g de granos de: mazorcas Bt+/Bt+ H8540 n=54, H8540 de control n=56, híbrido de Bt+/Bt- n=50, mazorcas híbridas de control n= 45. Cada punto de datos representa la media de dos análisis de réplica realizados con muestras de 500 g. Datos obtenidos de AGPM. Todos los datos salvo la humedad (% de H2O) y las xantófilas (mg/kg en peso seco) se expresan en % de peso seco. 2 Wright, 1987 in Corn chemistry and technology, 1987, Watson SA and Ramstad PE (eds), American Association of Cereal Chemists, St. Paul, Minesota, USA. 3 Todos los valores de las líneas de control y modificadas genéticamente varían significativamente respecto del rango. 4 Datos obtenidos de AGPM. Tabla II.4. Resumen del análisis de la composición de plantas de maíz de control y Bt-111 (ANZFA 2000c). Total de nitrógeno3 Humedad Línea autógama H8540- Control isogénico H8540 Bt 13,18 ± 0,07 12,35 ± 0,06 Híbrido Bt+/Bt- Híbrido de control Rango normal2 12,28 ± 0,03 12,30 ± 0,0 7,7-104 12,3 12,6 12,6 13,3 7-23 1,47 ± 0,04 1,79 ± 0,007 1,70 ± 0,02 1,6 ± 0,02 1,1-3,9 Almidón 68,02 ± 0,4 67,57 ± 0,4 70,83 ± 0,81 70,25 ± 0,48 61-78 Celulosa 2,99 ± 0,007 2,9 ± 0,05 2,67 ± 0,28 2,92 ± 0,05 Xantófilas 24,2 21,0 21,6 19,1 3,3-4,3 1,93-2,54 19,2-33,14 Ceniza 1 Las muestras son de 500 g de granos de: mazorcas Bt+/Bt+ H8540 n=54, H8540 de control n=56, híbrido de Bt+/Bt- n=50, mazorcas híbridas de control n= 45. Cada punto de datos representa la media de dos análisis de réplica realizados con muestras de 500 g. Datos obtenidos de AGPM. Todos los datos salvo la humedad (% de H2O) y las xantófilas (mg/kg en peso seco) se expresan en % de peso seco. 2 Wright, 1987 in Corn chemistry and technology, 1987, Watson S. A and Ramstad P. E. (eds), American Association of Cereal Chemists, St. Paul, Minesota, USA. 3 Todos los valores de las líneas de control y modificadas genéticamente varían significativamente respecto del rango. 4 Datos obtenidos de AGPM. Tabla II.5. Resumen del análisis de la composición de plantas de maíz de control y Bt-111 (ANZFA 2000c). Proteína Aceite Almidón Fibra X6534CBR Control isogénico X6514 X7634CBR Control isogénico X7514 Rango normal 9,89 (9,40-10,60) 9,96 (9,10-11,40) 10,55 (10,24-11,00) 9,68 (8,90-10,94) 6-12 4,09 (4,00 4,16) 4,11 (4,10-4,13) 4,02 (4,00-4,02) 4,07 (3,80-4,31) 3,1-5,7 70,09 (68,80-71,07 70,19 (67,80-71,50) 69,32 (68,60-70,36) 70,36 (69,07-71,40) 61-78 2,95 (2,86-3,00) 2,97 ( 2,92-3,00) 2,93 (2,89-3,0) 2,91 (2,90-2,92) 2,54 1 Los valores se expresan en % de peso seco. Los valores son medias de 3 muestras tomadas de 3 lugares (es decir, 1 muestra/lugar), los rangos figuran entre paréntesis. Las líneas de maíz modificadas genéticamente se indican como CBR y son isogénicas respecto de sus muestras de control salvo por la presencia de los nuevos genes. 16 Tabla II.6. Resumen del análisis de la composición de plantas de maíz de control y Bt-111 (ANZFA 2000c). del Norte/anterior Proteína X4334CBR Control N4242 X4734CBR Control N4640 Rango normal2 8,65 (8,03-9,11) 9,25 (8,63-9,63) 8,19 (7,74-9,16) 8,96 (8,28-9,53) 6-12 3 4 Aceite 3,17 (2,81-3,73) 3,23 (3,04-3,50) 3,34 (3,36-3,48) 3,30 (3,12-3,68) 3,1-5,7 Almidón 72,93 (71,8-73,2) 72,57 (71,7-73,4) 72,73 (71,5-73,7) 72,62 (71,3-73,2) 61-78 Fibra 2,69 (2,66-2,83) 2,75 (2,67-2,93) 2,77 (2,68-2,83) 2,77 (2,69-2,83) 2,55 X6534CBR X6514 X7634CBR X7514 Proteína 9,52 (8,35-10,60) 9,93 (9,10-11,40) 9,85 (8,63-11,0) 9,87 (8,67-10,94) 6-12 Aceite 3,80 (3,63-4,16) 3,93 (3,27-4,13) 3,37 (2,59-4,00) 3,48 (2,70-4,31) 3,1-5,7 Almidón 70,77 (68,8-72,5) 71,07 (67,8-72,7) 71,33 (68,6-74,3) 71,12 (69,1-73,9) 61-78 Fibra 2,78 (2,55-3,00) 2,80 (2,61-3,0) 2,74 (2,53-3,00) 2,72 (2,46-2,92) 2,55 del Sur/posterior 1 Los valores se expresan en % de peso seco. Los valores son medias de 6 muestras tomadas de 2 sitios en 3 lugares (es decir, dos muestras distintas de cada uno de los 3 lugares), los rangos figuran entre paréntesis. 2 En Corn Chemistry and technology, 1987, Watson S. A. and Ranstad P. E (eds.), American Association of Cereal Chemists, St. Paul, Minnesota, USA. 3 Los valores varían significativamente respecto del valor de control con un nivel de probabilidad del 5%. 4 Los valores varían significativamente respecto del valor de control con un nivel de probabilidad del 1%. 5 Valor promedio. Tabla II.7. Resumen de análisis proximal de los granos del maíz MON 809, MON 810 y 818 (control)1 (USDA 1996b). Característica Proteína MON 818 MON 809 MON 810 Rangos informados3 12,8 13,1 13,1 1,5 1,5 1,6 6,0-12,0 9,7-16,1 6,8-13,4 10,0-14,1 3,1-5,7 2,9-6,1 2,0-5,9 1,0-5,7 1,1-3,9 Carbohidratos2 82,7 82,8 82,4 No informado Calorías/100 g 409 407 408 No informado Humedad 12,0 13,2 12,4 7-23 2 Grasa 2,9 2 Ceniza2 2 2,6 3,0 Tabla II.8. Valores medios y rangos de análisis proximales de ensayos de maíz (MON 810) (ANZFA 2000a). Control2 MON 8102 Media Rango Media Rango Proteína1 12,8 11,7-13,6 13,1 12,7-13,6 Grasa1 2,9 2,6-3,2 3,0 2,6-3,3 1 Ceniza 1,5 1,5-1,6 1,6 1,5-1,7 Carbohidratos1 82,7 81,7-83,8 82,4 81,8-82,9 Calorías Kcal/100 g1 Humedad 409 406-410 408 407-410 12 10,6-14,2 12,4 11,0-14,4 1 Los valores se expresan como % de peso seco. 2 El valor es la media de seis muestras (n=6), una muestra de cada uno de 6 campos. 1 Los valores informados son medias de seis muestras, una muestra de cada campo. 2 Peso seco porcentual de la muestra. 3 Rangos de diferentes fuentes bibliográficas. Para referencias, lea el documento original (USDA APHIS 1996b). Tabla II.9. Resumen de análisis proximal del contenido de calcio y fósforo del grano de maíz de la línea MON 8021 (USDA 1996d). Característica MON 818 Control2 MON 8022 12,8 (11,7-13,6) 12,9 (11,8-13,7) Grasa 2,9 (2,6-3,2) 3,1 (2,8-3,2) Ceniza 1,5 (1,5-1,6) 1,6 (1,5-1,8) Rango de bibliografía3 (6,0-12,0) (9,7-16,1) (3,1-5,7) (2,9-6,1) (1,1-3,9) Fibra cruda 2,4 (2,3-2,5) 2,4 (2,1-2,6) (2,0-5,5) Carbohidratos 82,7 (81,7-83,8) 82,4 (81,5-83,2) No informado Calorías/100 g 409 (406-410) 409 (409-410) No informado Proteína % de calcio 0,003 (0,003-0,004) 0,003 (0,003-0,003) (0,01-0,1) % de fósforo 0,348 (0,327-0,363) 0,336 (0,21-0,356) (0,26-0,75) 12,0 (10,6-14,2) 12,6 (11,2-14,8) (7-23) % de humedad 1 Peso seco porcentual de la muestra, excepto de humedad. 2 Rango de media en el que la media es la media de seis muestras, una para cada campo y el rango denota los valores más bajos y más altos de cada línea. 3 Rangos de diferentes fuentes bibliográficas. Para referencias, lea la cita original (USDA 1996d). 17