Guía N2 ciencias - Nivelación de Estudios CREA
Anuncio

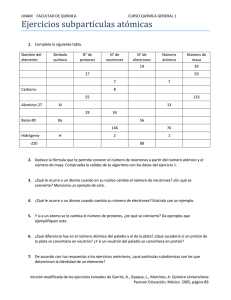
Ciencias Naturales 3º y 4º Medio Guía Nº2 Temas: Modelo atómico Iones Partículas subatómicas Modelo atómico El átomo es la unidad más pequeña de una sustancia, a partir de ella se forman las moléculas (mediante fuerzas que enlazan a los átomos) los compuestos y toda la materia que conocemos. La materia es todo lo que nos rodea, puede estar en estado líquido, sólido o gaseoso dependiendo de sus características químicas, sin embargo están formadas por la misma partícula, el átomo. Al ser una unidad, se define como un peldaño de una escala que va desde lo menos hasta lo más complejo, si observamos un elemento veremos que está formado por átomos, pero no tiene las mismas características que un átomo, sino que adquiere una complejidad mayor, y por ende nuevas características. “La materia no puede ser creada ni destruída” Dalton A su vez si estudiamos un átomo, veremos que en el interior de éste existen partículas aún más pequeñas, pero que no podrían existir de manera separada. Se ha establecido que un átomo está constituido por: neutrones, protones y electrones. Átomo: unidad básica de un elemento que puede entrar en combinación química Caracteristicas de las partículas subatómicas Partícula Neutrón Protón Electrón Símbolo n° p+ e- Carga 0 +1 -1 Masa 1.67495 X 10 -24 g 91.67252 X 10 -24 g 9.09 X 10 -28 g Ubicación núcleo núcleo orbitales Elemento químico: es el conjunto de todos los átomos con el mismo número atómico (Z) Normalmente un elemento de anota de la siguiente manera: En donde A: número másico Z: número atómico Algunos conceptos importantes -Número atómico (Z): Corresponde al número de protones que posee el núcleo de un átomo, es lo que identifica a éste. Cuando se dice que el número atómico del sodio (Na) es 11, quiere decir que en el núcleo existen 11 protones. En un átomo neutro el número de protones es igual al número de electrones. Ej. El número atómico del Nitrógeno es 7, esto significa que cada átomo neutro de nitrógeno tiene 7 protones y 7 electrones. -Número másico (A): Corresponde a la suma de protones y de neutrones que existen en un átomo. Número másico= número de protones + número de neutrones Número másico= número atómico + número de neutrones A= Z + número de neutrones Los electrones son tan pequeños en comparación con las otras partículas subatómicas que no se toman en cuenta cuando se determina el número másico. Ej. El elemento (Litio) Li de Z=3 posee 3 protones y 3 electrones, por lo tanto si el elemento Litio es neutro el número de electrones también será 3. Si ahora tenemos que Li- podemos notar que el mismo Litio tiene una carga negativa, por lo tanto posee 3 protones y 4 electrones. Estos átomos cargados se llaman iones, pueden ser positivos o negativos -Catión: ión positivo -Anión: ión negativo Ej. El número másico (A) del Flúor es 19 y su número atómico (Z) es 9, por tanto el número de neutrones corresponde a: N°neutrones = A – Z N°neutrones = 19-9 N°neutrones = 10 Ejercicios 1.Completar: Elemento A B Hg H Mn Mn2+ P K Al Al3+ Ca2+ O216 Z N° de electrones 5 N° de neutrones 25 16 18 2 .El Hierro (Fe) tiene un número másico igual a 56 y el número de electrones que posee es de 26. Con estos datos se puede afirmar que el número de neutrones y el número atómico del Fe es respectivamente: n° Z a) 26 30 b) 56 26 c) 30 26 d) 26 56 e) 82 26 3. ¿Dónde se encuentra cada partícula subatómica? a) El electrón se encuentra en el núcleo. b) El neutrón se encuentra en la corteza. c) El neutrón se encuentra en el núcleo. d) El protón se encuentra en la corteza 4. El plomo (Pb) tiene de número atómico (Z) 82 y de número másico (A) 207. Las partículas del átomo neutro son: a. Número de protones (4)_____. b. Número de electrones (5)_____. c. Número de neutrones (6)_____. 5. El Cs (cesio) tiene Z=55 y A=132. Las partículas del átomo neutro son: a. Número de protones 55. b. Número de electrones 55. c. Número de neutrones 77. 6. ¿Qué explica el modelo atómico de Thomson? a) La materia no está constituida por átomos. b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda la masa. c) Los fenómenos eléctricos. d) Ninguna de las otras respuestas. 7. Señala las afirmaciones correctas. a) Rutherford descubrió que el átomo era prácticamente hueco. b) Rutherford descubrió que casi toda la masa del átomo se encontraba alrdedor de un núcleo muy pequeño y hueco. c) Rutherford descubrió la existencia de neutrones. d) Rutherford descubrió la existencia de electrones. 8. Señala las afirmaciones correctas. a) En valor absoluto, la carga de un electrón y de un protón son iguales. b) La carga de un protón y de un neutrón son iguales en valor absoluto. c) El protón tiene carga negativa. d) La masa de un neutrón y de un protón son muy diferentes. e) La masa de un electrón es muy superior a la de un neutrón. 9. Completar con las siguientes palabras. Diferentes/ electrones/ elementos neutrones /neutrones/ Número atómico /Número másico /protones /protones/ protones/ protones (1)______________ es el número de (2)______________ que contiene el núcleo, coincide con el número de (3)______________ sólo si el átomo es neutro. Los (4)______________ se caracterizan por su número atómico; es decir, por el número de (5)______________ del núcleo. Átomos con diferente número de protones pertenecen a elementos (6)______________. (7)______________ es el número de nucleones del núcleo atómico; es decir, la suma total de (8)______________ y (9)______________ del núcleo. Átomos de un mismo elemento que tienen diferente número de (10)______________ se denominan isótopos de dicho elemento. Los isótopos de un elemento siempre tienen el mismo número de (11)______________.