Tema 6_IQ
Anuncio
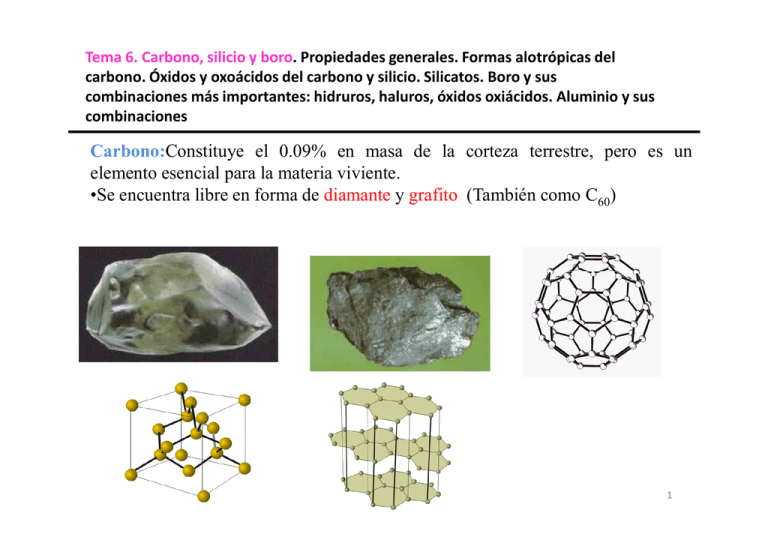
Tema 6. Carbono, silicio y boro. Propiedades generales. Formas alotrópicas del carbono. Óxidos y oxoácidos del carbono y silicio. Silicatos. Boro y sus combinaciones más importantes: hidruros, haluros, óxidos oxiácidos. Aluminio y sus combinaciones Carbono:Constituye el 0.09% en masa de la corteza terrestre, pero es un elemento esencial para la materia viviente. •Se encuentra libre en forma de diamante y grafito (También como C60) Tema 6. carbono y silicio 1 También se presenta en el gas natural, en el petróleo y en el carbón. Combinado con el oxígeno forma dióxido de carbono en la atmósfera y carbonatos como en la piedra caliza en la superficie terrestre. Los otros elementos del mismo grupo Tema 6. carbono y silicio 2 El diamante y el grafito son alótropos del carbono. •El grafito es la forma estable a 25°C y 1 atm, pero la velocidad del proceso espontáneo es extremadamente pequeña. Pueden pasar cientos de años antes de que un diamante se convierta en grafito C(diamante) C(grafito) ∆H = -2.87 kJ El diamante sintético se puede preparar a partir de grafito aplicando presiones y temperaturas muy altas. Son útiles como abrasivos y para cortar el concreto y muchas otras sustancias duras, inclusive los metales y sus aleaciones. Tema 6. carbono y silicio 3 •El carbono se combina con el hidrógeno para formar un gran número de compuestos denominados hidrocarburos. Carburos y cianuros. El carbono se combina con los metales para formar numerosos compuestos iónicos denominados carburos, en los cuales el carbono está en forma de iones C2-2 o C4- . El CaC2 y Be2C constituyen dos ejemplos. •Estos iones son bases fuertes de Brönsted y reaccionan con el agua. C2-2(ac) +4H2O(l) 2OH (ac) + C2H2(g) C4- (ac) + 4H2O(l) 4OH (ac) + CH4g) •El carbono también forma compuestos covalentes con el silicio. El carburo de silicio, SiC, se llama carborundum. SiO2(s) + 3C(s) SiC(s) + 2CO(g) Tema 6. carbono y silicio 4 •También se forma por calentamiento del silicio en presencia de carbono a 1500°C. El carborundum es casi tan duro como el diamante y tiene estructura de diamante. Se usa sobre todo para cortar, moler y pulir metales y vidrios. •Los cianuros constituyen otra importante clase de compuestos del carbono, que contienen el grupo aniónico: CN-. •Los iones cianuro son demasiado tóxicos porque se enlazan casi irreversiblemente al ion Fe(III) de la citocromooxidasa, una enzima clave en procesos metabólicos. •El cianuro de hidrógeno, que tiene el aroma de las almendras amargas, es aun más peligroso por su volatilidad (p. eb. 26°C). Unas cuantas ppm en volumen de HCN en aire pueden provocar la muerte en minutos. •El cianuro de hidrógeno se prepara tratando cianuro de sodio o de potasio con ácido: NaCN(s) + HCl(ac) NaCl(ac) + HCN(ac) Tema 6. carbono y silicio 5 •El HCN (llamado ácido cinahídrico, cuando está en disolución) es un ácido muy débil (Ka = 4.9 x 10-10), y se desprende de la disolución como cianuro de hidrógeno gaseoso. •Por esta razón, nunca se deben mezclar ácidos con cianuros metálicos en el laboratorio sin la ventilación pertinente. •Los iones cianuro se usan para extraer el oro y la plata de sus menas. •En un proceso común, la mena pulverizada se trata con una disolución acuosa de un cianuro en presencia de aire para disolver el oro por la formación del ion complejo soluble [Au(CN)2]-: 4Au(s) + 8CN-(ac) + O2(g) + 2H2O(l) 4[Au(CN)2]-(ac) + 4OH-(ac) •El ion complejo [Au(CN)2]- se separa por filtración y se trata con un metal electropositivo como el zinc para recuperar oro: [Zn(CN)4]2-(ac) + 2Au(s) Zn(s) + 2[Au(CN)2]-(ac) Tema 6. carbono y silicio 6 Óxidos de carbono. •Los más importantes son el monóxido, CO, y el dióxido de carbono, CO2. •El monóxido de carbono es un gas incoloro e inodoro que se forma por la combustión incompleta del carbón o de los compuestos Que contienen carbono: 2C(s) + O2(g) 2CO(g) •El monóxido de carbono arde con facilidad en oxígeno para formar el dióxido: 2CO(g) + O2(g) 2CO2(g) ∆H = -566 kJ •El monóxido de carbono no es un óxido ácido y es poco soluble en agua. •A pesar de que el CO es relativamente inerte, es un gas muy venenoso. La afinidad de la hemoglobina por el CO es unas 200 veces mayor que la del O2. Datos de enlace en CO y CO2 CO CO2 d(C-O) Å 1.123 1.163 EE(C-O) kJ mol-1 1070 531.4 Tema 6. carbono y silicio ángulo O-C-O 180 7 •El dióxido de carbono se produce cuando se quema en un exceso de oxígeno cualquier tipo de carbón o de compuestos que contengan carbono. •Muchos carbonatos desprenden CO2 cuando se calientan y todos desprenden CO2 cuando se tratan con ácido: CaCO3(s) CaO(s) + CO2(g) CaCO3(s) + 2HCl(ac) CaCl2(ac) + H2O(l) + CO2(g) •El dióxido de carbono también es un subproducto de la fermentación del azúcar y un producto final en el metabolismo animal: C6H12O6(ac) Glucosa 2C2H5OH(ac) Etanol + 2CO2(g) C6H12O6(ac) + 6O2(g) 6CO2(g) + 6H2O(l) •El dióxido de carbono es un gas incoloro e inodoro. A diferencia del monóxido de carbono, el CO2 es inocuo. • El dióxido de carbono se usa en las bebidas, en los extintores de fuego y en la manufactura de la “levadura” para cocinar, NaHCO3, y en la sosa solvay, Na2CO3. Tema 6. carbono y silicio 8 •El dióxido de carbono sólido, llamado hielo seco se usa como refrigerante. • El hielo seco también se usa en la "siembra" de nubes para inducir la lluvia. •El dióxido de carbono es soluble en agua y de carácter ácido Ácido carbónico y carbonatos pH< 8 CO2 + H2O CO2(ac) H2CO3 + OH- H2CO3 (lento) HCO3- + H2O (rápido) pH>10 CO2 + OH- HCO3- (lento) HCO3- + OH- CO32- + H2O (rápido) Procesos de ionización: H2CO3 + H2O H3O+ + HCO3- pKa1= 6.37 HCO3- + H2O H3O+ + CO3-2 pKa2= 10.33 Tema 6. carbono y silicio d(C-O)= 1.29 Å, entre un enlaces sencillo (1.34Å) y uno doble (1.20Å). Orden de enlace 1 1/3 9 El ciclo del carbono. •La transferencia de dióxido de carbono de y hacia la atmósfera es una parte esencial del ciclo de carbono, que empieza con el proceso de fotosíntesis conducido por las plantas y ciertos microorganismos: 6CO2 + 6H2O C6H12O6 ∆H = 2862 kJ Los animales consumen carbohidratos y otras moléculas complejas que contienen carbono, y al respirar emiten CO2. Tema 6. carbono y silicio 10 El silicio puro tiene la estructura del diamante. •No se conoce silicio análogo del grafito. •Se puede obtener por reducción de SiO2 con carbón SiO2(s)+2C(s) Si(s) + 2CO(g) •El silicio ultrapuro se prepara por la técnica de refinación por zonas; se usa en la electrónica de estado sólido. Tema 6. carbono y silicio 11 Silanos. El silicio forma una serie de hidruros covalentes denominados silanos, que tienen la fórmula general SinH2n+ 2(SiH4, Si2H6, Si3H8, Si4H10). •Son gases a temperatura ambiente. Químicamente, son mucho más reactivos que sus análogos de carbono: SiH4(g) + 2O2(g) SiO2(s) + 2H2O(l) •Los silanos se comportan más como hidruros metálicos que como hidrocarburos. En presencia de un catalizador alcalino, reducen el agua a hidrógeno: SiH4(ac) + 2H2O(l) SiO2(s) + 4H2(g) •Sólo se han preparado unos cuantos compuestos que contienen los enlaces Si=Si y Si=C. •El radio atómico de Si (132 pm) es mucho mayor que el del C (91 pm); en consecuencia, el orbital 3p de un átomo de Si no puede solaparse eficazmente con un orbital p de un átomo vecino (como el Si, C u O) para formar un enlace Π. Tema 6. carbono y silicio 12 •El mayor tamaño del Si también explica la diferencia entre el CO2 y SiO2. •El CO2, es una especie molecular cuya estructura de Lewis es: O=C=O. En vez de ello, la estructura de SiO2 es una red tridimensional gigante constituida por átomos de Si enlazados tetraédricamente a cuatro átomos de O. •La sílice se disuelve lentamente disoluciones alcalinas fuertes, SiO2(s) + 2OH-(ac) en SiO3-2(ac) + H2O(l) •Las disoluciones de NaOH o KOH deben guardarse en recipientes de polietileno y no en botellas de vidrio. Tema 6. carbono y silicio 13 Polimorfismo del SiO2 Tema 6. carbono y silicio 14 Silicatos •Casi el 90% de la corteza terrestre consta de silicatos, que son grupos de aniones constituidos por átomos de Si y O. •La unidad básica consta de un átomo Si enlazado tetraédricamente a cuatro átomos de O. En silicatos superiores, estas unidades se unen por compartimiento de un átomo de O entre dos átomos de Si. Tema 6. carbono y silicio 15 Estructuras básicas de los silicatos Tema 6. carbono y silicio 16 •En vista de que el silicio es unas 146 veces más abundante que el carbono y comparte con él propiedades, los científicos se preguntan por qué no juega un papel más significativo en la determinación de la química de las formas vivientes. •La poca estabilidad de muchos de los compuestos del silicio proviene de la debilidad del enlace Si-Si, unos 222 J/mol, en comparación con la fuerza del enlace C-C. que es de casi 346 J/mol. Tema 6. carbono y silicio 17 Boro •El boro elemental, una sustancia cristalina transparente, casi tan dura como el diamante, tiene propiedades semimetálicas, se le clasifica como metaloide. •Es un elemento raro que constituye menos del 0.0003% de la corteza terrestre en masa. •El boro puro no se encuentra en la naturaleza; existe en forma de compuestos oxigenados. Algunos de estos compuestos son el bórax, Na2B4O7 .10H2O; el ácido ortobórico, H3BO3; y la kernita, Na2B4O7 .4H2O. Tema 6. carbono y silicio 18 El Boro se puede preparar por reducción del óxido de boro con polvo de magnesio: 2B(s) + 3MgO(s) B2O3(s) + 3Mg(s) Compuestos de Boro •Los compuestos binarios formados por boro e hidrógeno se denominan boranos. •Existen numerosos boranos, el más simple e importante es el diborano, B2H4. •Como la configuración electrónica del boro es 1s22pl, hay un total de 12 electrones de valencia en el diborano (3 de cada átomo de boro y 6 de los átomos de hidrógeno). Esto significa que es imposible representar al diborano como: H H B H Tema 6. carbono y silicio H B H H 19 •Se supone que cada átomo de B está en hibridación sp3. •Cuatro átomos de hidrógeno están enlazados a los boros por enlaces sigma. B H •Los otros dos se mantienen unidos por orbitales moleculares tritentricos. •Los enlaces tricéntricos se extiende dos átomos de boro y otro de hidrógeno. H B B H B B H B Tema 6. carbono y silicio B 20 • El enlace tricéntrico no sólo se presenta en el diborano. También en otro boranos superiores, como el B5H9 y B6H10 donde se encuentran átomos de hidrógeno formando puentes. Los halogenuros de boro (BF3, BCl3, BBr3 y BI3) Constituyen otro interesante: grupo de compuestos. Como tienen estructura plana, se supone que la hibridación del boro es sp2 El orbital 2p, no hibridizado está vacío y puede aceptar un par de electrones de otra molécula para formar un compuesto de adición. Esta, es una reacción tipo ácido /base de Lewis. BF3 + NH3 Tema 6. carbono y silicio F3B NH3 21 Oxidos •El único óxido importante del boro es el trióxido, B2O3. •Se prepara por calentamiento del ácido bórico y se usa en la preparación del boro, material de vidrio térmicamente resistente y en componentes electrónicos. •Como la mayoría de los óxidos no metálicos, es un óxido ácido. B2O3(s) + 3H2O(l) 2B(OH)3(ac) El ácido bórico, al que suele escribírsele como H3BO3, es moderadamente soluble en agua. •Es un ácido monoprótico muy débil. B(OH)3(ac) + H2O(l) •Se comporta como ácido de Lewis al aceptar un par de electrones de un ion hidróxido: B(OH)4-1 (ac) + H+(ac) Tema 6. carbono y silicio Ka=7.3x 10-10 22 Su debilidad como ácido y sus propiedades antisépticas, hacen del ácido bórico una sustancia idónea para lavado de ojos. En forma industrial, el ácido bórico se usa para hacer vidrio térmicamente resistente, llamado vidrio borosilicato. El boro ejemplifica las relaciones diagonales que se dan entre los elementos de la tabla periódica. La química del boro se parece a la del silicio en varios aspectos: •Los óxidos B2O3 y SiO2 son ácidos; forman los oxoácidos H3BO3 y H2SiO3. •Forman una serie de hidruros complejos. •Forman boruros y siliciuros metálicos, que reaccionan con ácido clorhídrico para formar hidruros de boro y silicio respectivamente. •El boro y el silicio forman materiales vítreos similares. Tema 6. carbono y silicio 23 Tipos de vidrio Tipos de vidrio Tema 6. carbono y silicio 24 Aluminio •El aluminio es el metal más abundante, y por ello ocupa el tercer lugar como elemento de la corteza terrestre (7.5% en masa). • No se encuentra en forma elemental en la naturaleza; su mineral principal es la bauxita (A12O3.2H2O). La ortoclasa (KAlSi3O2), el berilio (Be3A12Si6O18), la criolita (Na3AlF6) y el corindón (A12O3) son otros minerales que contienen aluminio. • El aluminio se prepara a partir de bauxita, la cual suele estar contaminada con sílice (SiO2), óxidos de hierro y óxido de titanio(IV). Primero se convierte la sílice en silicatos solubles: SiO2(s) + 2OH-(ac) SiO3-2(ac) + H2O(l) Y el óxido de aluminio se convierte en ion aluminato (AlO2-): Al2O3(s) + 2OH-(ac) 2AlO2 -(ac) + H2O(l) Tema 6. carbono y silicio 25 Este tratamiento no afecta a los óxidos de hierro y titanio que se filtran. A continuación, la disolución se trata con ácido para precipitar el hidróxido de aluminio insoluble: AlO2 -(ac) + H3O+(ac) Al(OH)3(s) Después de la filtración, el hidróxido de aluminio se calienta para obtener el óxido: 2Al(OH)3(s) Al2O3 (s) + 3H2O(g) El óxido de aluminio anhidro(Al2O3), o corindón, se reduce a aluminio por el proceso Hal-Heroult. La clave del proceso Hall-Heroult estriba en el uso de la criolita, Na3AlF6 (p.f. 1000°C), como disolvente del óxido de aluminio (p.f. 2045°C). La mezcla se electroliza para producir aluminio y oxígeno gaseoso: Tema 6. carbono y silicio 26 El oxígeno gaseoso reacciona con los ánodos de carbón para formar CO. •El aluminio metálico líquido (p.f. 660.2°C) cae hacia el fondo del recipiente, el cual se puede drenar de cuando en cuando durante el proceso. •El aluminio tiene baja densidad (2.7 g/cm3) y alta resistencia a la tensión. •El aluminio es maleable, puede formar hojas muy delgadas, y es un excelente conductor eléctrico. Cátodo (reducción): 4x [Al3+ + 3e- 4Al(l) ] Ánodo (oxidación): •Su conductividad es más o menos del 65% respecto de la del cobre. Sin embargo, como es más barato y más ligero que el cobre, se usa en las líneas de transmisión de alto voltaje. Tema 6. carbono y silicio 3x [ 2O2- Global: 2Al2O3 O2(g) + 4e ] 4Al(l) + 3O2(g) 27 •Sus propiedades mecánicas se mejoran de manera considerable aleándolo con pequeñas cantidades de metales como el cobre, el magnesio y el manganeso, o bien con silicio. Reactividad •A pesar de que el aluminio se considera un metal activo, no reacciona con el agua como lo hacen el sodio y el magnesio. El aluminio reacciona con ácido clorhídrico y con bases fuertes: 2AlCl3(ac) + 3H2(g) 2Al(s) + 6HCl(ac) 2Al(s) + 2NaOH(ac) + 2H2O(l) 2NaAlO2(ac) + 3H2(g) •El aluminio forma rápidamente el óxido A12O3 cuando se expone al aire originando una película fuertemente adherida que protege al aluminio de la corrosión: 4Al(s) + 3O2(g) 2Al2O3(s) (∆Hf = -670 kJ/mol). •El óxido de aluminio tiene una entalpía de formación exotérmica muy grande •Esta propiedad confiere utilidad al aluminio como combustible Tema 6. carbono y silicio 28 •La gran afinidad del aluminio y el oxígeno se muestra en la reacción del polvo de aluminio con varios óxidos metálicos, en particular los óxidos de los metales de transición, para producir los correspondientes metales. Aluminotermias 2Al(s) + Fe2O3(s) Al2O3(l) +2Fe(l) ∆H = -852 kJ Halogenuros •Al contrario que los derivados del Boro el cloruro de aluminio existe como dímero •El cloruro de aluminio se hidroliza de la siguiente manera: AlCl3(s) + 3H2O(l) Al(OH)3(s) + 3HCl(ac) Tema 6. carbono y silicio 29 • El hidróxido de aluminio es un hidróxido anfótero: Al(OH)3(s) + OH- (ac) Al (OH)4- (ac) Al(OH)3(s) + 3H+(ac) Al3+(ac) + 3H2O(l) •El hidruro de aluminio. [AlH3]n es una sustancia polimérica en la que cada átomo de aluminio está rodeado octaédricamente por puentes de hidrógeno Cuando se evapora lentamente una mezcla de sulfato de aluminio y sulfato de potasio, se forman cristales de KAl(SO4)2 .12H2O. Que forma parte de una familia llamada alumbres de fórmula general: M+M3+(SO4)2 .12H2O M+: K+, Na+, NH4+; M3+: Al3+, Cr3+, Fe3+ Tema 6. carbono y silicio 30