1. Dibuje el croquis de la tabla periódica en el
Anuncio

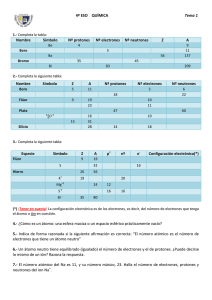
COLEGIO LOS PRÓCERES “Al rescate de los valores perdidos para vivir dignamente y convivir pacíficamente” Lic. Biología y química Diana Florez centeno PLAN DE MEJORAMIENTO 1º PERIODO GRADO: 9° ASIGNATURA: QUÍMICA DOCENTE DIANA FLOREZ CENTENO LOGROS: Realiza adecuadamente la distribución electrónica, comprendiendo su definición por lo que está en capacidad de hallar periodo, grupo, nube electrónica, partículas sub-atómicas, spin, estructura de Lewis, anión o catión y tipo de enlace NOMBRES AYALA SEBASTIAN prueba tipo icfes BRANDON PARRA BECERRA NATALIA PEÑALOZA BOHORQUEZ RANGEL CORREA INES RAMIREZ CARDENAS CAMILA VARGAS CORONA VERANO prueba tipo icfes DURAN ANDRES CASANOVA prueba tipo icfes MONICA ESPEJO BRAYAN PARRA prueba tipo icfes SARA LEON JESSICA JAIMEZ prueba tipo icfes MONTES EDGAR ROJAS JUAN DAVID prueba tipo icfes MORENO JONIER ANA MARIA VERA prueba tipo icfes MOGOLLON MERCADO NAVA DIEGO ORTEGA OLAVE ALEJANDRA NOTA: TODOS DEBEN TENER EN CUENTA LOS EJERCICIOS REALIZADOS EN EL AULA DE CLASE PARA DESARROLLAR LOS PUNTOS QUE AQUÍ SE PLANTEAN RECOMENDACIÓN 1. 2. 3. 4. PRESENTAR EN ADSOLUTO ORDEN, CON BUENA LETRA Y CON CARPETA LAS ACTIVIDADES ANTERIORES NO DEBEN COPIARSE LOS EJERCICIOS UNOS CON OTROS, TRABAJOS QUE SEAN IGUALES SERAN RECHAZADOS ESTUDIANTE QUE NO REALICE LAS ACTIVIDADES CON TIEMPO, NO PODRÁ PRESENTAR LA RESPECTIVA EVALUACIÓN TODO DEBE SER REALIZADO A MANO Y POR EL ESTUDIANTE, SE TENDRÁ PRESENTE PARA CALIFICAR: ORDEN, LA LETRA, ORTOGRAFÍA Y QUE ESTÉ COMPLETO ACTIVIDADES 1. Hallar todo a los siguientes átomos Z=25 A= 54,9 manganeso Mn Z=30 A=65,38 zinc Zn Z=52 A=127,6 telurio Te Z=37 A=85,46 rubidio Rb 2. CONTESTA ACERTADAMENTE CADA UNO DE LOS SIGUINETES ITENS 1. Dibuje el croquis de la tabla periódica en el cuaderno y señale los alcalinos, alcalinotérreos, familia del boro, familia del carbono, familia del nitrógeno, gases nobles, halógenos, actínidos, lantánidos, y elementos de transición (en su orden). 2. Realiza los siguientes ejercicios: a) El Bario tiene un número atómico de 56 y un número de masa de 137. Las partículas del átomo neutro son: Protones___, Neutrones ___ y Electrones___ b) El Hierro tiene un número atómico de 26 y un número de masa de 55. Las partículas del átomo neutro son: Protones___, Neutrones ___ y Electrones___ OBSERVA LA SIGUIENTE GRAFICA La tabla periódica es la organización de los elementos químicos en orden ascendente de los números atómicos. A partir del gráfico anterior podría decir que pertenecen al mismo periodo A. 1, 4 B. 4, 7 C. 3, 4 D. 1, 2 3. Los elementos que pertenecen al mismo grupo de acuerdo a la grafica serían: A. 8, 3 B. 3, 4 C. 4, 5 D. 1, 2 4. 5. El número atómico corresponde al número de protones. El número atómicos de 2 y 5 es: A. 18, 21 6. B. 18, 21 C. 20, 17 D. 20, 18 El Neón es un elemento de la tabla periódica que tiene un número atómico de 10 se encuentra ubicado en el grupo 8 y en el periodo 2. A partir de lo anterior se podría afirmar que: A: El Neón es un elemento que tiene en su núcleo 10 protones y 12 neutrones y en la corteza presenta 11 electrones. B. El Neón es un elemento que se utiliza para hacer rejas, puertas o bicicletas. C. El Neón es un elemento de transición que no presenta la misma cantidad de protones y electrones, pues presenta 8 protones y 11 electrones. D. El Neón pertenece a los gases Nobles, presenta un periodo de 2 y presenta un símbolo Ne SABER HACER: 7. 2 La configuración electrónica me indica cómo están organizados los electrones alrededor del núcleo. La configuración electrónica que corresponde a los elementos 1, 5 2 6 1 2 2 6 2 5 A. 1s , 2s , 2p , 3s Y 1s , 2s , 2p , 3s , 3p 2 2 6 1 2 2 6 B. 1s , 2s , 2p , 3s Y 1s , 2s , 2p 1 2 6 2 2 2 6 2 5 C. 1s , 2s , 2p , 3s Y 1s , 2s , 2p , 3s , 3p 2 2 6 2 2 5 D. 1s , 2s , 2p Y 1s , 2s , 2p El átomo está formado por un una corteza, en la que se ubica los electrones, los cuales se mueven alrededor de un núcleo, formado por neutrones y protones. A partir de lo anterior se podría decir que la cantidad de protones y electrones del Argón es: A. 8 electrones y 8 protones. B. 18 Electrones y 18 Protones C. 18 Electrones y 16 Protones. D.17 Electrones y 8 Protones. 8. 9. A. p Los subniveles s, p, d, y f son los encargados de ubicar los elementos en un sector especifico de la tabla periódica, dándole una lógica a la distribución electrónica que se hace con cada elemento, es por eso que la ubicación que corresponde al número 2 es: B. d C. s D. f 10. A partir de la distribución electrónica, sería correcto afirmar que el 8, que tiene un número atómico de 6, A. Presenta un periodo de 3 y un grupo de 3A B. se Ubica en el sector s, con un periodo de 3 y un grupo de IIIA C. se ubica en un periodo 3 y un grupo IIIB, siendo un elemento de transición D. Se ubica en los elementos de No metales y hace parte del grupo IVA y periodo 2 11. Cada nivel de energía tiene un número máximo de electrones y se encuentra dado por la siguiente 2 Formula 2(n) donde n corresponde al nivel de energía. Si en dado caso un elemento presenta 2 niveles de energía, lo más probable es que presente: A. 8 electrones C 4 electrones B. 20 electrones D. 32 electrones 12. En la imagen se muestra un átomo, el cual se puede ubicar en la tabla periódica en: El grupo 8 y en el periodo 3 A. El grupo 3 y el periodo 8 B. El grupo 18 y el periodo 2 El grupo 8 y periodo 4 13. Hojalata es la lámina delgada de acero con revestimiento de estaño. La distribución electrónica del estaño es 1 S 2 6 2 6 2 10 6 2 1ó 2 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p ; el grupo y el período en el que se encuentra en la tabla periódica son A. grupo 4A, período 5 B. grupo 5A, período 4 C. grupo 2A, período 5 2 D. grupo 5A, período 2 2 2 6 2 6 2 10 6 2 5 El elemento de configuración electrónica 1 S 2s 2p 3s 3p 4s 3d 4p 5s 4d está ubicado en el A. Periodo 5, grupo VB B. Periodo 5, grupo IIA C. Periodo 4, grupo VA D. Periodo 5, grupo VIIB 15. Un átomo tiene 4 protones, 4 electrones y 5 neutrones. La masa atómica para el átomo es A. 5 B. 7 C. 6 D. 9 16. Si el azufre pertenece al grupo VIA y tiene Z=16 y su periodo es el tercero, se puede afirmar que: A. Tiene tres electrones de valencia B. Su último nivel de energía es el 6 C. Tiene 6 electrones en su nivel 3 2 4 D. Su configuración electrónica final es 3s 2d 17. El núcleo de un átomo con Z=8 y masa atómica 16 contiene A. 16 neutrones B. 16 protones C. 9 protones D. 8 protones y 8 neutrones 18. El elemento que corresponde a la siguiente configuración electrónica y spin es 14. A. 5B B. 17Cl C. 9F D. 7N 19. Del Ca con Z=20 y del Se con Z=34 se puede afirmar A. Los dos 5 niveles de energía B. El Ca es más pequeño que el Se C. El Se es más electronegativo que el Ca D. El Ca necesita mayor energía de ionización que el Se 20. La configuración electrónico correspondiente al elemento rubidio (Rb) con número atómico 37 2 2 6 2 6 2 10 6 2 A. 1 S 2s 2p 3s 3p 4s 3d 4p 5s 2 2 6 2 10 2 3 B. 1 S 2s 2p 3s 2d 4s 4p 2 2 6 2 6 2 10 6 1 C. 1 S 2s 2p 3s 3p 4s 3d 4p 5s 2 2 6 2 6 2 7 6 D. 1 S 2s 2p 3s 3p 4s 3d 4p 21. Según la configuración electrónica anterior, la ubicación en la tabla periódica del elemento rubidio es A. periodo 4, grupo VIA B. periodo 4, grupo IIIA C. periodo 5, grupo IA D. periodo 3, grupo IVA 22. Si un elemento A tiene Z=4 y otro elemento B tiene Z= 9, ambos elementos se encuentran en el mismo periodo, se puede afirmar que: A. A y B están en el tercer periodo B. A y B pertenecen al grupo IIIA C. A es más electronegativo que B D. A pertenece al grupo IIA y B al grupo VIIA 23. Para un elemento los valores Z y A son respectivamente 92 y 238 por tanto, el número de neutrones es A. 92 B. 146 C. 330 D. 258 24. La notación orbital que presenta el nivel energético más externo del oxigeno en el estado normal es (Z=8) 25. El número total de electrones no apareados en un átomo de nitrógeno (Z=7)en estado normal es A. 5 B. 2 C. 3 D. 4 26. El número atómico del fosforo es 15, esto significa que A. El fosforo tiene 15 neutrones B. El fósforo tiene 15 electrones C. El fósforo tiene 15 partículas en su núcleo D. El fósforo tiene 8 protones y 7 electrones 27. Si tenemos la distribución electrónica de un elemento no podemos predecir A. Número de protones en el núcleo B. Peso atómico C. Periodo al que pertenece D. Grupo al que pertenece 2 2 6 2 6 2 28. Un átomo cuya configuración electrónica es 1 s 2s 2p 3s 3p 4s A. El subnivel 2s es incompleto B. Incompleto el tercer nivel energético principal C. Incompleto el primer nivel energético D. Incompleto el subnivel 3s 29. En el tercer nivel energético principal, el subnivel de máxima energía es A. S B. P C. D D. F 2 2 6 2 5 30. La configuración electrónica de un elemento es 1s 2s 2p 3s 3p . Con esta única información se puede(n) determinar I) el grupo al que pertenece el elemento en la tabla periódica II) el número atómico del elemento III) el período al que pertenece el elemento en la tabla periódica. A. sólo I B. sólo II C. sólo III D. sólo I y II E. I, II y III 2 2 2 31. La configuración electrónica de un elemento es 1s 2s 2p . Con esta información se puede afirmar que dicho elemento I) tiene cuatro electrones de valencia II) tiene incompleto su segundo nivel III) se ubica en el grupo cuarto de la tabla periódica A) sólo I B) sólo II C) sólo III D) sólo I y II E) I, II y II 2 2 4 20. La configuración electrónica de un elemento es 1s 2s 2p . Con esta información se puede afirmar que dicho elemento A) es un gas noble. B) tiene 4 electrones de valencia. C) tiene incompleto el segundo nivel. D) pertenece al cuarto período de la tabla periódica. E) se ubica en el grupo cuarto de la tabla periódica. 21. Cuántos electrones poseen los átomos de Argón (Ar), de número atómico 18, en su capa o nivel más externo A. 2 electrones B. 8 electrones C. 6 electrones D. 18 electrones 22. ¿Cuál de las siguientes configuraciones electrónicas corresponde al átomo de cobre (Cu), de número atómico 29? (En la notación se indican los niveles por números colocados como coeficientes y los índices de las letras indican el número de electrones en ese subnivel): A. 1s2 2s2 2p6 3s2 3p6 3d10 4p B. 1s2 2s2 2p6 3s2 3p6 4s2 3d9 C. 1s2 2s2 2p6 3s2 3p6 3d10 4s1 D. 1s2 2s2 2p6 3s2 3p6 4s10 4p2 23. ¿Qué tienen en común las configuraciones electrónicas de los átomos de Li, Na, K y Rb?: A. Que poseen un solo electrón en su capa o nivel más externo B. Que poseen el mismo número de capas o niveles ocupados por electrones C. Que tienen completo el subnivel s más externo D. Sus configuraciones electrónicas son muy diferentes y no tienen nada en común 24. ¿Qué tienen en común las configuraciones electrónicas de los átomos de Ca, Cr, Fe, Cu y Zn? Señala las afirmaciones correctas: A. Todos tienen el mismo número de capas o niveles ocupados por electrones B. Tienen el mismo número de orbitales ocupados por electrones C. Todos tienen el mismo número de electrones en su nivel más externo D. Tienen pocos electrones en su nivel más externo 25. Un átomo tiene 12 protones, 13 neutrones y 12 electrones. ¿Cuál es su número atómico? A. 12 B. 13 C. 24 D. 25 26. Un átomo de volframio (W) tiene 74 protones y 108 neutrones. ¿Cuál es su representación adecuada? 1. 2. 3. 4. Con base en la" siguiente información conteste las preguntas 27 y 29 La ubicación de un elemento en la tabla nos da mucha información sobre la clase de elementos: representativos si terminan en orbitales s o p, transición si terminan en orbitales d, transición interna si terminan en orbitales f. Si es representativo el número de e en el último nivel coincide con el número del grupo. En los grupos de transición la suma de los electrones del último nivel con los del último orbital d coincide con el número del grupo. 27. X, Y, Z se encuentra en el periodo y grupo A) 4, 2A, 8B, 6A B) 4, 2A, 8B, 7A C) 3, 2A, 8B, 7A D) 3, 3A, 8B, 7A 28. Entre X, Z, Y, W, T y U son elementos representativos A) X, Y B) X, W C) W, Z D) X, Z 29. X, Z termina en orbitales y el número de electrones en el último orbital es A. s, p 2, 7 B. s, p 2, 5 C. s, s 2, 5 D. s, d 2, 7 TEN EN CUENTA LA SIGUIENTE INFORMACIÓN Y CONTESTA DE LA 30 A LA 34 La tabla que se presenta a continuación muestra la configuración electrónica para los siguientes elementos 30. la configuración electrónica que corresponde al elemento con número atómico 15 es A. B. C. D. 2 2 6 2 3 1s 2s 2p 3s 3p 2 2 6 2 6 2 10 1s 2s 2p 3s 3p 4s 3d 2 2 2 1s 2s 2p 2 2 6 2 6 2 6 1s 2s 2p 3s 3p 4s 3d 31. el átomo que presenta mayor número de electrones de valencia es A. Zn B. Fe C. P D. Ca 32. teniendo en cuenta la configuración electrónica el Fe se encuentra en A. grupo 6B porque tiene 6 electrones en su último nivel B. grupo 8B porque la suma de sus electrones del último orbital s con los del subnivel da 8 C. grupo 8B porque tiene 8 electrones en su último nivel D. periodo 5 porque tiene 5 niveles de energía 33. pertenecen al cuarto periodo A. H, C, Fe B. Fe, Zn, P C. Fe, Zn, Ca D. Ca, Zn, C 34. Bohr en su modelo atómico explicó que la energía de los electrones está cuantizada dependiendo del nivel y subnivel. Si se traslada un electrón de un nivel inferior a uno superior debe absorber energía necesaria para poder realizar el cambio. Y si un electrón pasa de un nivel superior a uno inferior debe perder la energía necesaria para ocupar ese nivel. Se absorbe más energía en la transición de un electrón de A) 2s a 2p B) 3s a 2p C) 3s a 4p D) 3p a 4p 35. La regla de Hund o de máxima multiplicidad dice que sólo cuando todos los orbitales de un mismo subnivel tenga cada uno un electrón, podrá llenarse un orbital. El fundamento de este principio estriba en que los electrones en los orbitales separados se hallan en un estado energético más bajo que si ocuparan el mismo orbital. La distribución electrónica que hace uso de la regla del Hund es 2 2 6 2 5 A. 1s 2s 2p 3s 3p 2 2 6 2 6 2 B. 1s 2s 2p 3s 3p 4S 2 2 6 2 9 C. 1s 2s 2p 4s 3d 2 2 6 2 6 2 10 3 D. 1s 2s 2p 3s 3p 4s 3d 4p 36. La distribución electrónica permite ubicar los electrones de un átomo en sus correspondientes niveles y subniveles de energía. Por lo tanto, la distribución electrónica del elemento: 15 X es: 2 2 6 4 A. 1 s 2s 2p 3s1 3p 2 2 7 3 1 B. 1 s 2s 2p 3s 3p 1 2 6 2 4 C. 1 s 2s 2p 3s 3p 2 2 6 2 3 D. 1 s 2s 2p 3s 3p 37. Del anterior elemento.X podemos afirmar que se encuentra en el grupo 5 A Y el período 3 de la tabla periódica porque presenta: A. 5 electrones de valencia y el nivel de valencia es 3 B. 3 electrones de valencia y el nivel de valencia es 5 C. 5 electrones de valencia y el nivel de valencia es 5 D. 3 electrones de valencia y el nivel de valencia es 3 39. COMPLETE LA SIGUIENTE TABLA