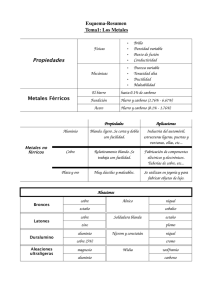
C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN 2ºESO TEMA 4. MATERIALES METÁLICOS. AMPLIACIÓN. 1. EL HIERRO Y SUS DERIVADOS El hierro, de símbolo químico Fe (del latín ferrum), es un elemento metálico, magnético, maleable y de color blanco plateado. El hierro puro tiene una dureza que oscila entre 4 y 5. Es blando y dúctil. Se magnetiza fácilmente a temperatura ordinaria; es difícil magnetizarlo en caliente, y a unos 790°C desaparecen las propiedades magnéticas. Tiene un punto de fusión de unos 1.535°C, un punto de ebullición de 2.750°C y una densidad relativa de 7,86 gr/cm3. Fue descubierto en la prehistoria y era utilizado como adorno y para fabricar armas; el objeto más antiguo, aún existente, es un grupo de cuentas oxidadas encontrado en Egipto, y data del 4000 a.C. El procesado moderno del hierro no comenzó en Europa central hasta la mitad del siglo XIV. El hierro es el metal más utilizado por las personas. Su producción y consumo son altamente significativos, y representan uno de los indicadores del grado de desarrollo industrial de un país. La industria del hierro se dedica a la obtención de productos férreos que se emplean en la fabricación de todo tipo de útiles, herramientas, máquinas, equipamientos industriales y estructuras. El hierro no se encuentra en estado puro en la naturaleza, sino mezclado con otros elementos químicos. Los principales minerales de hierro que resultan industrialmente rentables son el oligisto, la magnetita, la limonita y la siderita: - El oligisto se obtiene de una mena formada por óxido férrico (Fe 2 O 3 ). La variedad más importante es la hematites roja, de aspecto compacto, terroso, y con un color rojizo. La piedra imán, o magnetita, se obtiene de una mena formada por óxido ferroso férrico (Fe 3 O 4 ). Se presenta en masas compactas y brillantes, o en formas granuladas de color negruzco. La limonita es óxido de hierro hidratado (FeO·nH 2 O). Se encuentra en abundantes masas terrosas, es de fácil extracción y de color amarillento pardo. La mena de la siderita está formada por carbonato ferroso (FeCO 3 ). Aunque el contenido de hierro es bajo, la siderita es un mineral muy apreciado, ya que suele encontrarse acompañada de manganeso (Mn) y cobalto (Co), metales de gran valor tecnológico. En forma de compuestos químicos, está distribuido por todo el mundo, y ocupa el cuarto lugar en abundancia entre los elementos de la corteza terrestre; después del aluminio, es el más abundante de todos los metales. También existen pequeñas cantidades de hierro combinadas con aguas naturales y en las plantas; además, es un componente de la sangre. Los compuestos de hierro se usan en medicina para el tratamiento de la anemia, es decir, cuando desciende la cantidad de hemoglobina o el número de glóbulos rojos en la sangre. 1.1. La metalurgia del hierro Se denomina metalurgia el conjunto de procedimientos y técnicas empleados en la extracción, elaboración y tratamiento de los metales y de sus aleaciones. La metalurgia del hierro se llama siderurgia. Página 1 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN 2ºESO Una vez extraídos los minerales de hierro y concentradas sus menas, se procede a mezclar éstas con un combustible, el carbón de coque, de alto poder calorífico. A continuación se añaden sustancias fundentes y, en un horno especial (alto horno), se consigue fundir los materiales. El producto resultante del alto horno es el arrabio, un producto férreo constituido por una aleación de hierro que contiene entre un 2,5% y 4,5% de carbono, y cantidades similares de silicio (Si) y manganeso. Pero también contiene fósforo (P) y azufre (S), sustancias que son impurezas perjudiciales y es preciso eliminar. A partir del arrabio se obtienen otros productos cuya característica común es que su componente principal es el hierro. Los principales productos siderúrgicos son el hierro dulce, el acero y la fundición. El hierro dulce es la forma más pura de hierro empleado en la industria. Se obtiene a partir del arrabio después de haberse eliminado las impurezas. Contiene un 99,8% de hierro, funde a 1.535ºC y tiene una densidad de 7,9 g/cm3. Es un material resistente empleado en la fabricación de objetos que han de soportar esfuerzos bruscos, como anclas, cadenas, clavos, etc… 1.2. El acero El acero es el producto férreo más importante de todos. Más del 75% de todo el arrabio se destina a la obtención de acero. Es una aleación de hierro y carbono (presenta un contenido de carbono comprendido entre 0,2% y 1,7%) con cantidades variables de silicio y manganeso. Según sea su composición, se distinguen dos clases de aceros: los aceros comunes y los aceros aleados. o Los aceros comunes. También denominados aceros ordinarios. Contienen únicamente hierro y carbono como elementos base. En general son aceros dúctiles (se pueden fabricar hilos finos y alambres con ellos), maleables (pueden extenderse en láminas muy finas) y son fáciles de soldar. Al aumentar el contenido de carbono adquieren dureza y resistencia, resultando menos deformables y más quebradizos. Estos aceros se emplean en la fabricación de piezas y elementos mecánicos de resistencia media para maquinaria y vehículos de todo tipo. También se usan en la fabricación de herramientas corrientes, tornillería, herrajes, raíles y perfiles en barras de múltiples secciones. o Los aceros aleados En los aceros aleados intervienen, además del hierro y el carbono otros elementos que se añaden durante el proceso de fabricación. De esta manera se mejoran notablemente las cualidades del acero al carbono dando lugar a una gran variedad de aceros. • • • • El acero al silicio (Si) tiene gran elasticidad y resistencia y se emplea en muelles, ballestas y chapas para transformadores. El acero al manganeso (Mn) presenta mayor resistencia al desgaste y se suelda con facilidad. Se usa en raíles y en perfiles estructurales. El acero con cromo (Cr) y vanadio (V) tiene mayor resistencia a las deformaciones en frío. Se usa en herramientas, en ejes de máquinas o para piezas de gran responsabilidad en vehículos. El acero con volframio (W) y molibdeno (Mo) tiene gran dureza y resistencia a la deformación en caliente y se usa en herramientas de corte: brocas, limas, hojas de sierra, gubias, etc. Página 2 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN • 2ºESO El acero con níquel (Ni) y cromo (Cr) tiene gran dureza y resistencia a la dilatación y a la corrosión, y es inoxidable. Se utiliza en árboles de transmisión, engranajes, cables, instrumentos de medida, de precisión y quirúrgicos, y en cuberterías y ornamentación. Los diferentes tipos de aceros se presentan comercialmente en forma de perfiles, chapas, redondos y prismas con diferentes secciones. 1.3. La fundición La fundición es un producto férreo con un contenido de carbono comprendido entre el 1,7% y el 4,5%. Se obtiene por afino (descarburación, eliminación de carbono) del arrabio en hornos llamados cubilotes. Presenta un color que va desde el gris oscuro al blanquecino. Es dura, quebradiza, resistente al desgaste y fácil de moldear. Se emplea en la elaboración de piezas moldeadas de gran tamaño, como carcasas, elementos de soporte, guías, bancadas de maquinaria, etc. 2. EL ALUMINIO El aluminio (Al) es el metal más abundante en la naturaleza, pero como es un elemento muy reactivo, siempre se encuentra formando parte de otros compuestos químicos. En muchas ocasiones está mezclado de tal forma que no es rentable su producción. El aluminio se encuentra en el feldespato, en el caolín o arcilla, en la mica y en el corindón o esmeril. También forma parte de muchas variedades de piedras preciosas, como el zafiro, el rubí, la esmeralda, el aguamarina, el lapislázuli o la turquesa. 2.1. Propiedades. El aluminio es un metal de color blanco plateado que funde a 660ºC. Es un metal muy ligero, con una densidad de 2,7 g/cm3, bastante menor que la densidad de otros metales. Es muy dúctil y maleable, propiedades que pierde por encima de los 150ºC; es blando, buen conductor del calor y la electricidad, fácil de moldear y bastante resistente a la corrosión. El aluminio se oxida con rapidez, pero la capa de óxido que queda en la superficie es muy resistente e impide que el metal se siga oxidando. 2.2. Minerales de aluminio. Los minerales rentables, es decir, de los que se obtiene una mayor cantidad de aluminio son la bauxita y la criolita. - La bauxita es el mineral de aluminio, por excelencia. Su mena está formada por óxido de aluminio hidratado (Al 2 0 3 ·nH 2 O) La criolita es un mineral blanco o incoloro de composición compleja formado por fluoruro de aluminio y sodio (Na 3 AlF 6 ). Igual que sucede con otros metales que no se encuentran en estado puro en la naturaleza, el aluminio se extrae de sus menas mediante diversos métodos químicos y físicos. Página 3 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN 2ºESO 2.3. Metalurgia del aluminio Para la obtención de aluminio se procede, en primer lugar, a la calcinación de las menas de bauxita enriquecidas, con lo cual se obtiene alúmina (óxido de aluminio). El aluminio se extrae de la alúmina mediante electrólisis, un proceso que consiste en hacer pasar una corriente eléctrica a través de un compuesto químico en disolución, separando sus componentes. La electrólisis descompone el óxido de aluminio en oxígeno y aluminio. 2.4. Aplicaciones El aluminio tiene múltiples aplicaciones pero es un metal especialmente apropiado para elaborar objetos ligeros y resistentes: - Motores de automóviles, vagones de ferrocarril, etc. Cámaras fotográficas, utensilios de cocina y latas. Perfiles y molduras para carpintería en forma de planchas delgadas y láminas para envolver alimentos (papel de aluminio) y recubrir paneles para aislar térmicamente. Conexiones y tendidos conductores usados en la industria eléctrica. Motores y aeronaves empleados en la industria aeronáutica. Cementos, pinturas, arcillas para objetos cerámicos, loza, porcelana, obtención de piedras preciosas, etc. Los trenes de alta velocidad, como el AVE, están fabricados con aluminio, ya que es el metal que mejor combina la resistencia y el poco peso, cualidades indispensables en esta clase de transportes. 2.5. Aleaciones de aluminio. Las principales aleaciones de aluminio son las que forma con el cobre (Cu), con el magnesio (Mg) y con el silicio (Si). - - Las aleaciones de aluminio y cobre permiten obtener piezas moldeadas y forjadas de elevada resistencia mecánica a altas temperaturas (hasta 300ºC). De las aleaciones de aluminio y magnesio se obtienen piezas moldeadas y forjadas de fácil mecanización, gran resistencia a la corrosión y elevada resistencia mecánica. Las aleaciones de aluminio y silicio proporcionan piezas moldeadas de todo tipo, de formas complicadas y secciones delgadas, con buena resistencia mecánica en caliente, baja dilatación y resistentes al desgaste. El duraluminio es una aleación de aluminio con un 4% de cobre y algo de magnesio, manganeso y silicio. Esta aleación conserva la ligereza del aluminio, pero tiene una resistencia mucho mayor. 3. EL COBRE El cobre es un metal menos abundante en la superficie terrestre que el aluminio o el hierro. Aunque no es tan reactivo como el aluminio, a menudo está presente en la naturaleza formando unos minerales en los que se encuentra combinado con otros elementos químicos, como el oxígeno, el azufre y el carbono. 3.1. Minerales de cobre. Los minerales más rentables de cobre son la cuprita, la calcosina, la calcopirita, la malaquita y la azurita. Página 4 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN - 2ºESO La cuprita es un mineral de color rojo formado por óxido de cobre (Cu 2 O). La calcosina está formada por sulfuro de cobre (Cu 2 S). La calcopirita un sulfuro de hierro y cobre (CuFeS 2 ). La malaquita es un mineral verde brillante compuesto por un carbonato complejo de cobre (Cu 2 C0 3 [OH] 2 ). La azurita es un mineral de color azulado con una composición química muy parecida a la malaquita (Cu 2 [C0 3 ] 2 .Cu[OH] 2 ). Igual que ocurre con las menas de otros metales, éstas deben tratarse posteriormente para obtener el metal en estado puro. 3.2. Propiedades El cobre es un metal de color rojo brillante característico, funde a 1.083ºC y su densidad es de 8,96 g/cm3, algo mayor que la del hierro. - Puede reducirse con facilidad a hilos y a láminas finas, o sea, es muy dúctil y maleable. Es un metal no demasiado duro. Es muy buen conductor del calor y de la electricidad. Es fácilmente moldeable. Es resistente a la corrosión y a la oxidación. Tiene excelentes cualidades bacteriostáticas (afecta a las bacterias depositadas en su superficie y no permite que se reproduzcan). 3.3. Metalurgia del cobre Para obtener el cobre de las menas nativas, el mineral ha de ser sometido a la trituración, el lavado y la fusión final en el horno. En general, las menas de los minerales de cobre son pobres (contienen menos del 3% de cobre) y es necesario concentrarlas para obtener menas enriquecidas hasta el 40% aproximadamente. A continuación se tuestan en el horno para eliminar el azufre y otras impurezas, obteniéndose un concentrado denominado mata de cobre. El tratamiento posterior depende de la utilidad que se pretenda dar al material. En el caso de que se quieran fabricar con él hilos conductores, la mezcla anterior se purifica por electrólisis, ya que las pequeñas impurezas aumentan considerablemente la resistencia eléctrica. Tras la electrolisis las impurezas se quedan en la disolución empleada y se obtiene cobre con una pureza del 99,9%. 3.4. Aplicaciones La gran capacidad del cobre para conducir la electricidad y el calor determina la mayoría de sus aplicaciones. - Aproximadamente un 65% de su producción total se emplea en la industria eléctrica, en conexiones, hilos conductores, bobinados de transformadores, motores y generadores, tendidos de líneas eléctricas, telegráficas, telefónicas, etc. Página 5 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN - 2ºESO Con él también se construyen accesorios de fontanería, como tuberías, conducciones de agua y gas, calderas y alambiques. Su apariencia exterior lo hace útil en ornamentación: monedas, medallas, grabados, planchas para impresión, etc. Aunque en la industria eléctrica se emplea fundamentalmente cobre, en otras aplicaciones se usan diferentes aleaciones que modifican las propiedades del material. 3.5. Aleaciones de cobre Después de las aleaciones de hierro, las aleaciones de cobre son las más usadas en la industria. Las más importantes son el bronce y el latón. • El bronce está formado por un 90% de cobre y un 10% de --.. estaño (Sn). Se obtiene en forma de planchas, varillas y toda clase de objetos moldeados. Esta aleación se emplea en la fabricación de hélices de barcos, equipos de bombeo, casquillos, juntas, engranajes, recipientes a presión, campanas, estatuas, ornamentación, etc. En la actualidad hay muchos tipos de bronce que se obtienen enriqueciendo la aleación con algún otro elemento, como el plomo (Pb) o el fósforo (P), lo que le da unas propiedades específicas, como ocurre con los distintos tipos de aceros. • El latón está compuesto aproximadamente por un 70% de cobre y un 30% de cinc (Zn). Se obtiene en forma de barras de diferentes perfiles, planchas, tubos, varillas y alambres. Se emplea en canalizaciones, llaves y válvulas para agua y gas, utillaje eléctrico, resortes, pomos, bisagras, tornillería, etc. Además del bronce y el latón, hay muchas otras aleaciones en las que está presente el cobre junto con otros metales. Una de las aplicaciones más comunes es la elaboración de monedas. 4. LOS METALES NOBLES 4.1. La plata La plata, de símbolo Ag (del latín argentum) se conoce y se ha valorado desde la antigüedad como metal ornamental y de acuñación. Probablemente las minas de plata en Asia Menor empezaron a ser explotadas antes del 2500 a.C. Los alquimistas la llamaban el metal Luna o Diana, por la diosa de la Luna, y le atribuyeron el símbolo de la luna creciente. Al igual que los otros metales nobles, la plata es un exponente principal en todas las manifestaciones económicas, artísticas y culturales de las diferentes civilizaciones. La plata es el menos «noble» de los tres metales preciosos, ya que se altera con más facilidad que el oro o el platino. - Es un metal blanco brillante, y funde a 960ºC. Es un metal pesado, con una densidad de 10,5 g/cm3. Es muy blando, y bastante dúctil y maleable. Es el elemento mejor conductor del calor y de la electricidad que existe en la naturaleza. Es muy resistente a la oxidación y a la corrosión. Página 6 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN 2ºESO 4.1.1. Aplicaciones de la plata. La plata se utiliza en forma de compuestos químicos y aleaciones. • En reproducción fotográfica se empleaba para la elaboración de películas y clichés para cine, fotografía, radiografía, imprenta, etc. • En electricidad y electrónica se usa en la fabricación de regletas, contactos y pistas conductoras. • En orfebrería, para joyería, bisutería, fabricación de cadenas, numismática, etc. • En uniones capilares estancas en tuberías para conducciones de agua y gas por soldadura. • En galvanotecnia, para baños y recubrimiento de objetos. También se emplea en la artesanía textil, para elaborar catalizadores de procesos, suturas quirúrgicas, para fabricar espejos y lunas térmicas, en farmacología y cosmética o como amalgama odontológica. 4.2. El oro Oro, de símbolo Au (del latín aurum) se conoce y aprecia desde tiempos remotos, no solo por su belleza y resistencia a la corrosión, sino también por ser más fácil de trabajar que otros metales y menos costosa su extracción. Debido a su relativa rareza, comenzó a usarse como moneda de cambio y como referencia en las transacciones monetarias internacionales. La unidad para medir la masa del oro es la onza troy, que equivale a 31,1 gramos. La inalterabilidad del oro con el paso de los años hace que este metal haya sido muy cotizado desde la antigüedad. A diferencia de otros metales, el oro se encuentra en estado puro en la naturaleza, en forma de pepitas, sin mezclarse con otros elementos. - Es un metal de color amarillo brillante que funde a 1.064ºC. Es más pesado que la plata. Su densidad es de 19,3 g/cm3. Es más blando que a plata; es el más dúctil y maleable de todos los metales. Es un buen conductor del calor y de la electricidad. Es resistente a la oxidación, el ataque químico y la corrosión. Es antialérgico. Raramente se produce alguna reacción en la piel de personas que están en contacto con algún objeto de oro. Como el oro puro es bastante blando, muchas veces se elaboran aleaciones con otros metales, como el platino, la plata (oro blanco), el cobre (oro rojo) o el níquel. De esta forma mejora la dureza. En estas aleaciones, el número de quilates indica las partes de oro que hay en 24 partes de aleación. Por tanto, al oro puro le corresponden 24 quilates. 4.2.1. Aplicaciones del oro Las propiedades que diferencian el oro de otros metales lo hacen muy apropiado para innumerables aplicaciones. • En electrónica se usa en conexiones y contactos en chips, circuitos impresos e integrados y aparatos de investigación, equipos de televisión, telefonía, radares y telecomunicaciones, etc. • En galvanotecnia, para baños y recubrimiento de objetos. Página 7 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN • • 2ºESO En orfebrería: joyería, numismática (elaboración de monedas conmemorativas), hilos, fabricación de cadenas, monturas de piedras preciosas, sortijas, relojes y toda clase de objetos personares, objetos religiosos, etc. En medicina se utiliza en aleaciones y prótesis odontológicas, agujas de acupuntura, implantaciones epidérmicas, suturas craneales, cirugía, diagnosis y tratamiento radio-isotópico, recubrimiento de monturas de gafas y audífonos, etc. También se emplea en la artesanía textil, para elaborar lingotes y trajes de astronautas, en cristales y parabrisas anti-reflectantes, etc... 4.3. El platino El descubrimiento del platino ha sido posterior al de la plata o el oro. Tiene muchas propiedades comunes con el resto de metales nobles. - Es un metal blanco con un punto de fusión elevado: 1.772ºC. Es más pesado que el oro. Tiene una densidad de 21,45 g/cm3. Es dúctil y maleable, pero posee buena resistencia mecánica. Es un buen conductor del calor, pero conduce mal la electricidad. Es muy resistente al desgaste, a la oxidación, a los ataques químicos y a la corrosión, incluso a temperaturas altas. Posee excelentes cualidades catalíticas; su presencia acelera determinados procesos industriales. 4.3.1. Aplicaciones del platino. • • • • • • Hay muchas industrias que emplean el platino con frecuencia. En la industria química, interviene como catalizador en la obtención de abonos, pesticidas y herbicidas agrícolas, en productos petrolíferos, farmacéuticos (antibióticos y vitaminas) y automovilísticos (filtros anticontaminación). En medicina, para la elaboración de instrumentos quirúrgicos, prótesis e implantes odontológicos y quirúrgicos, tratamiento contra el cáncer y equipos de rayos X. Fabricación de utillaje de laboratorio, como crisoles, cazos y vasijas de hornos, pinzas y sopletes. En joyería, para la elaboración de pulseras, colgantes o anillos. Fabricación de vidrio: recubrimientos refractarios y anticorrosivos, para utillajes (agitadores, etc.). Equipos de control térmico: termopares y termosondas para la regulación de temperaturas en hornos industriales, cámaras criógenas y estaciones meteorológicas. En la actualidad, sin perder los valores estéticos el papel de los metales nobles es fundamentalmente industrial. No existe apenas industria clásica en la que no intervengan, y son materias primas imprescindibles para las tecnologías más avanzadas. 5. OTROS METALES DE USO INDUSTRIAL. 5.1. El estaño El estaño (del latín “stannum”, símbolo Sn) es un metal de aspecto blanco brillante, muy resistente al aire, fácil de fundir y de trabajar. Es muy maleable en frío, y en caliente se vuelve quebradizo. Se obtiene a partir de la casiterita. Página 8 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN 2ºESO Se emplea, aleado con plomo o con plata, en la soldadura blanda y en la elaboración de aleaciones como los bronces. También se utiliza como recubrimiento del hierro y del cobre; sobre el hierro, para obtener hojalata, y sobre el cobre, para evitar que se cubra de "cardenillo". Dado que no es tóxico, el estaño también se emplea en la industria de la alimentación. El estaño es un metal muy utilizado en centenares de procesos industriales en todo el mundo. El estaño es importante en las aleaciones comunes de bronce (estaño y cobre), en la soldadura (estaño y plomo) y en el metal de imprenta (estaño, plomo y antimonio). También se usa aleado con titanio en la industria aeroespacial, y como ingrediente de algunos insecticidas. El sulfuro de estaño, conocido también como oro musivo, se usa en forma de polvo para broncear artículos de madera. 5.2. El plomo El plomo (del latín “plumbum”, símbolo Pb) es un metal de color blanco-azulado, de elevada densidad, bajo punto de fusión, blando y muy fácil de trabajar. La cerusita y la anglesita son sus menas más importantes después de la galena. La extracción del plomo de la galena se lleva a cabo por calcinación de la mena, convirtiéndola en óxido y reduciendo el óxido con coque en altos hornos. Otro método consiste en calcinar la mena en un horno de reverbero hasta que parte del sulfuro de plomo se transforma en óxido de plomo y sulfato de plomo. Una fuente importante de obtención de plomo son los materiales de desecho industriales, que se recuperan y funden. Debido a que la galena contiene normalmente otros metales, el plomo en bruto obtenido por procesos de fundición suele tener impurezas como cobre, cinc, plata y oro. La recuperación de metales preciosos de las menas de plomo es a menudo tan importante como la extracción del plomo en sí. El oro y la plata se recuperan por el proceso de Parkes. Tiene múltiples aplicaciones. El plomo se emplea en grandes cantidades en la fabricación de baterías y en el revestimiento de cables eléctricos. También se utiliza industrialmente en las redes de tuberías, tanques y aparatos de rayos X. Debido a su elevada densidad y propiedades nucleares, se usa como blindaje protector de materiales radiactivos. Entre las numerosas aleaciones de plomo se encuentran las soldaduras, el metal tipográfico y diversos cojinetes metálicos. Por su bajo punto de fusión, se usa para hacer aleaciones para soldar. Debido a su gran densidad, se ha empleado tradicionalmente para fabricar pesas y lastres. El carbonato de plomo es un importante ingrediente en la fabricación de pigmentos para pinturas. Sin embargo, el plomo es un metal tóxico, por lo que ha dejado de emplearse en la fabricación de cañerías y se está dejando de utilizar como aditivo de las gasolinas. 5.3. El cinc. El cinc (del alemán “zink”, símbolo Zn) es un metal blando, de color blanco azulado, resistente a la intemperie. No existe libre en la naturaleza, sino que se encuentra como óxido en el mineral cincita (también llamada ancramita), como silicato en la hemimorfita, como carbonato en el mineral esmitsonita, como óxido mixto de hierro y cinc en la franklinita, y como sulfuro de cinc (ZnS) en la esfalerita, o blenda. Se obtiene a partir de la blenda. La mena de cinc se refina por un procedimiento de flotación: se inyecta aire a presión en la masa fundida y el cinc sube en forma de espuma, quedándose los compuestos de plata y plomo al fondo. Se usa en la fabricación de recipientes, canalones y planchas para cubiertas y tejados. También se utiliza para recubrir piezas y planchas de hierro. El recubrimiento se lleva a cabo por dos procedimientos: • Galvanizado. El objeto se conecta al polo positivo de un generador y se introduce en una disolución de sulfato de cinc. El polo negativo del generador se conecta a una placa de cinc que también se sumerge en la disolución. Mediante electrolisis, parte del cinc de la barra se va depositando sobre el objeto. • Cincado. Introduciendo las piezas en un baño de cinc fundido. Página 9 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN 2ºESO ACTIVIDADES 1. Contesta: a) ¿Qué es el arrabio? ¿Cómo se obtiene? b) ¿Cuáles son los principales productos siderúrgicos'? c) ¿Qué se entiende por metalurgia? 2. Indica el nombre de los minerales de los cuales se extraen los siguientes metales: a) Hierro. b) Cobre. c) Aluminio. 3. Responde a estas preguntas sobre el hierro y sus derivados: a) b) c) d) ¿En qué se diferencia el hierro dulce del acero ordinario? ¿En qué se diferencian los aceros ordinarios de los aceros aleados? ¿Qué aplicaciones tiene el hierro? ¿Qué es la fundición? 4. Recuerda las características y los usos del aluminio: a) ¿Cuáles son las propiedades más significativas del aluminio? b) ¿Cuáles son las principales aleaciones de aluminio? ¿Qué características presentan? c) ¿Qué aplicaciones tienen el aluminio y sus aleaciones? 5. Recuerda las características y los usos del cobre: a) ¿Qué características presenta el cobre? b) ¿Cuáles son las principales aleaciones de cobre? ¿Qué características tienen? c) ¿Qué aplicaciones tienen el cobre y sus aleaciones? 6. Indica las propiedades más significativas de cada uno de los metales nobles. a) Plata. b) Oro. c) Platino. • ¿Qué aplicaciones tiene cada uno de estos metales en la industria? 7. Explica los procesos realizados con el oro en las plantas siderúrgicas. a) b) c) d) ¿Qué tipo de operaciones se realiza estas instalaciones? ¿Cómo se obtiene el producto siderúrgico conocido como fundición? ¿Cómo se efectúa la metalurgia del hierro? ¿Qué repercusiones medioambiente presenta la siderurgia? 8. Indica cómo se obtiene el cobre de las menas nativas. Página 10 de 11 C.M. Miguel Castillejo FUNDACIÓN VERA CRUZ JAÉN 2ºESO 9. Investiga en tu entorno e identifica objetos ( al menos tres) fabricados con los siguientes metales y aleaciones: • • • • • • • • • • Hierro. Aluminio. Acero. Oro. Fundición. Plata. Bronce. Cobre. Latón. Acero inoxidable. 10. Investiga qué materiales son los que se emplean para los siguientes usos. • • • • • • • • • • • • • • • • • • • • Herramientas de corte. Carpintería metálica. Orfebrería. Galvanotecnia. Soldadura. Numismática. Elementos decorativos metálicos. Construcción de máquinas-herramienta Fontanería. Material eléctrico. Instrumentos de medida. Instrumentos quirúrgicos. Prótesis dentales. Construcción naval. Industria electrónica. Industria ferroviaria, Industria aeronáutica. Industria del automóvil. Estructuras metálicas resistentes. Máquinas eléctricas. 11. Busca información en internet acerca de la composición de los minerales a partir de los cuales se obtienen plomo, estaño y cinc. Presenta la información en forma de tabla. 12. A partir de la información del tema, y otras que puedas aportar, haz una relación de las aplicaciones más importantes de los tres metales anteriores. Página 11 de 11
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados