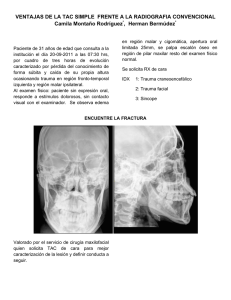
Tratamiento del Paciente Trasplantado Hepático
Anuncio

TRATAMIENTO DEL PACIENTE TRASPLANTADO HEPÁTICO Á Jornadas de Actualización en Atención Farmacéutica Farmacé tica al Paciente con Patologías Víricas Zoe Mariño Hospital Clinic. Barcelona I. Recidiva de la Hepatitis p C tras el Trasplante p Hepático p Peculiaridades de la infección VHC post TH Ef t y objetivos Efecto bj ti d l tratamiento. del t t i t II. Tratamiento de la Recidiva C post TH Pasado, p presente y futuro Nuevos fármacos, nuevo escenario: interacciones farmacológicas Recidiva de la Hepatitis C tras el Trasplante Hepático Anualmente se realizan más de 1 1.000 000 trasplantes hepáticos al año en territorio español. Tasa de donación ~ 24,1 trasplantes / millón de habitantes (máximo registro internacional) La cirrosis hepática por VHC +/- hepatocarcinoma constituyen la primera causa de TH en nuestro medio (~ 25- 30%) Recidiva de la Hepatitis C tras el Trasplante Hepático La infección del injerto por VHC es universal. ni ersal Escenario único: conocimiento del instante de la “primoinfección”. Estrategias de tratamiento antiviral en lista de espera. Prevención de la infección del órgano. Recidiva de la Hepatitis C tras el Trasplante Hepático Baja aplicabilidad del tratamiento antiviral en lista de espera. Pacientes VHC en lista de espera de TH • Previa no respuesta Tratamiento ( contraindicación)) (no • Mala función hepática • Insuficiencia renal • Trombocitopenia Respuesta virológica ((HCV-RNA negativo) g ) RVS (HCV-RNA negativo post TH) 10 20 30 40 50 60 70 80 90 100 % pacientes Forns et al, J Hepatol. 2003 Carrión et al, J Hepatol 2009 Recidiva de la Hepatitis C tras el Trasplante Hepático El daño hepático crónico (VHC) promueve la activación de mecanismos reparadores p tisulares: fibrosis. Tasa de fibrosis acelerada en el injerto: ~ 30% pacientes CH en 5 años. Prieto et al, Hepatology 1999 Recidiva de la Hepatitis C tras el Trasplante Hepático Impacto de la recurrencia VHC sobre la supervivencia ONT/ RETH (1991-2011) Años tras el TH Recidiva de la Hepatitis C tras el Trasplante Hepático 1,0 F<2 F 0–1 ,8 ,6 F≥2 ,4 4 ,2 Log-rank<0 Log rank<0.001 001 mpensació ón Pacientes sin descom Pacientes sin descom mpensació ón Monitorización de la evolución post TH: biopsia biopsia, GPP GPP, FS HVPG ≤ 5 mmHg HVPG < 6 mmHg 1,0 ,8 HVPG > 5 mmHg ,6 HVPG ≥ 6 mmHg ,4 4 P < 0.000 ,2 Log-rank<0 Log rank<0.0001 0001 ,0 ,0 0 10 20 30 Meses post BH 40 0 10 20 30 40 Meses post GPP Blasco et al, Hepatol 2006; Carrión et al, Liver Transpl 2006; Adebajo et al, Liver Transpl 2012; Crespo et al, Gastroenterol 2012 Recidiva de la Hepatitis C tras el Trasplante Hepático Efecto de la RVS sobre la progresión de la recidiva p = 0.003 20 Supervivencia: RVS (n = 33) vs NR (n = 56) p = 0.004 0 004 P= 0.032 16 12.0 p = 0.047 12 8 6.7 50 5.0 3.5 4 0 NO (n = 26) YES (n = 11) Seguimiento (días) desde el TH RVS Carrion JA, et al. Gastroenterol 2007 Berenguer M, et al. Am J Transpl. 2008 Tratamiento de la Hepatitis C tras el Trasplante Hepático OPCIONES: 1 Tratamiento estandar: PegIFN + RBV 1- 2 Uso 2U F Fuera de d IIndicación di ió d de IInhibidores hibid d de P Proteasa: t Experiencias con telaprevir y boceprevir 3- Uso Compasivo de nuevos fármacos. 4- Ensayos clínicos. Tratamiento post TH: estandar Eficacia del tratamiento (PegIFN + RBV) en pacientes G1 (ITT) ~ 30% 100 Discontinuación RVS 80 60 40 20 43 33 39 31 28 33 33 16 0 Mukherjee S et al, Transpl Proc. 2003; Picciotto FP et al. J Hepatol 2007; Angelico M et al. J Hepatol 2007; Carrión JA et al. Gastroenterol 2007 Tratamiento post TH: Nuevos Fármacos Proteinas virales: nuevas dianas, nuevos antivirales Nucleocápside RdRp: “mano derecha” Entrada y Fusión Proteasa catalizadora Esencial para replicación Replicación p Producción partículas Regula vias señalización Canal calcio: función poco conocida Koutsoudakis G et al, Gastroenterol Hepatol 2013 Tratamiento post TH: Nuevos Fármacos Proteinas virales: nuevas dianas TLV, BOC, SIM, FLD… INHIBIDORES DE PROTEASA NS3/4A / ‐ Alta potencia ‐ Varios genotipos ‐ Barrera a la R intermedia/ alta SOF INHIBIDORES NUCLEOSIDOS NS5B INHIBIDORES NUCLEOSIDOS NS5B ‐ Potencia intermedia ‐ Pangenotipicos ‐ Barrera a la R alta INHIBIDORES NO‐NUCLEOSIDOS NS5B ‐ Potencia intermedia ‐ Limitado cubrimiento genotípico g p ‐ Barrera a la R baja INHIBIDORES DE NS5A ‐ Alta potencia ‐ Múltiples genotipos ‐ Barrera a la R baja/intermedia B l R b j /i t di DLV Koutsoudakis G et al, Gastroenterol Hepatol 2013 Tratamiento post TH: Nuevos Fármacos Coste Efectos adversos Interacciones farmacológicas EFICACIA Tratamiento post TH: Off – label (TLV, BOC) Boceprevir n=41 - Serie Europea Telaprevir n=57 - Multicéntrico: Francia, Suiza, HCV-RNA in H ndetectable e (%) Bélgica (Mar 2011- Nov 2012) 100 83% - Pacientes TH G1, 30% G1a 82% 80 - Mediana 3,3 años post TH 61% 60 38% - ~ 30% previos NR post TH. - CyA/ C A/ TAC ~ 50 % 40 20 34/41 35/57 14/17 0 W 12 6/16 - Tasa discontinuación: 44% (no R virológica o SAEs) EOT Coilly y et al,, EASL 2013 - 3 muertes en cada grupo (5 infecc graves, graves 1 trauma) Tratamiento post TH: Off – label (TLV, BOC) - Serie Americana HCV-RNA in H ndetectable e (%) N=112 (90% Telaprevir) 100 - Pacientes TH G1, 55% G1a 84% 80 - Mar 2011 2011- actualidad 67 % 65 % - Mediana 3.7 años post TH - 96% fase de LI (86% <90 días) 60 - ~ 48% p previos NR p post TH. 40 - CyA 65%/ TAC 35% 20 78/93 58/86 0 W 12 EOT 28/436/16 RVS4 Verna et al, EASL 2013 - F2-4 84%, 10% CH, 11% HCF - Tasa SAEs: 38% - 2 muertes Tratamiento post TH: Off – label (TLV, BOC) Nuestra Experiencia. Hospital Clinic, n=13 n 13 Feb 2012- actualidad Pacientes TH G1, G1 naive BOC (n=3), TLV (n=10) y 2/ TAC 10/ EVL 1 IMS: CyA Eficacia: W4: 1/3 (BOC, w8), 6/10 (TLV) W12: 3/3 (BOC), 8/9 (TLV), 1 Discont EOT y SVR12: 1/1 (BOC), 2/2 (TLV) BT (n=2): W4 y W24 (TLV) D/C SAE (neutropenia): 1 (W8)* SVR12 Uso de GSF (n=4), EPO (n=6), Tx (n=2) Tratamiento post TH: compasivos HCF, 6 meses post TH, G1b, contraindicación para PegIFN. Daclatasvir (NS5A) 60 mg/d + Sofosbuvir (NS5B NI) 400 mg/d (24 semanas) RVS 24 Fontana et al , AASLD 2012 Tratamiento post TH: compasivos Daclatasvir (NS5A) + PR (24 semanas) G1b con recurrencia severa post- Re TH (previa NR post TH) IMS con CyA y Prednisona RVS 24 Fontana et al , Liver Transpl 2012 Tratamiento post TH: ensayos clinicos Inicio: Q4 2011 Finalización: Q2 2014 Telaprevir + Peg-IFN alfa 2a + RBV T12PR48 n=75 0 4 8 Peg-IFN alfa 2a + RBV 12 16 36 Seguimiento 48 60 RVS12 • REPLACE (Clinicaltrials.gov: NCT01571583): • Estudio fase IIIb multicéntrico abierto,, pacientes p VHC trasplantados naive, con dosis estable de TAC/ CyA 72 Tratamiento post TH: ensayos clinicos A Phase 2, multicenter, open-label study to investigate the safety and efficacy of sofosbuvir and ribavirin for 24 weeks in subjects with recurrent chronic HCV post liver transplant. Cli i lT i l ClinicalTrials.gov. NCT01687270 TH (cualquier G) Sofosbuvir (NS5B NI) + RBV Inicio Reciente de Inclusión de Pacientes TH G1 ABT450 (PI)/r+ ABT267(NS5A)+ ABT333 (NS5B NNI) + RBV A Phase 2,, open-label p study y to investigate g the safety y and efficacy of ABT-450/r/ABT-267 and ABT-333 with ribavirin in HCV-G1 subjects with recurrent chronic HCV post liver transplant. ClinicalTrials.gov. NCT01782495 RVS (%) 0 20 40 60 80 100 Tratamiento post TH: Interacciones Farmacológicas Tratamiento del TH: - Farmacos inmunosupresores - Profilaxis antibiótica - Antihipertensivos - Antidiabéticos - Antilipemiantes - etc Tratamiento antiviral y relacionados: - PegIFN g - Ribavirina - IP (TLV/ BOC) - Estimulantes de colonias (EPO GSF…) (EPO, GSF ) Tratamiento de los efectos adversos: - Antidepresivos - Antitérmicos - Antihistamínicos - Antieméticos - Antibióticos - etc Tratamiento post TH: Interacciones Farmacológicas Las isoenzimas CYP3A son las más abundantes en el hígado y las responsables bl mayoritarias it i d dell metabolismo t b li d de llos fá fármacos Tratamiento post TH: Interacciones Farmacológicas Absorción Glicoproteína-P TAC/ CyA Distribución IPs (1ª g, TLV/ BOC): sustratos e inhibidores +++ Metabolismo CYP3A4 Excreción TAC/ CyA Conccentración n del fárma aco (ACN)) Tratamiento post TH: Interacciones Farmacológicas Inhibición enzimática (introducción de IP) IP Días Aumento niveles de ACN: HTA IR, HTA, IR neurotoxicidad, t i id d sobreinmunosupresión…. “Normalizacion” enzimática (fin del tratamiento con IP) STOP IP Días Disminución niveles de ACN: Aumento del riesgo de rechazo Tratamiento post TH: Interacciones Farmacológicas 100000 Cyclosporine A Cyclosporine A + Telaprevir (day 1) C l Cyclosporine A + Telaprevir (day 8) i A T l i (d 8) TAC Mean Blood Concentratio on CsA Mean B Blood Concentratiion 10 1 0.1 0.01 0 4.6‐Fold 10 20 30 40 50 60 70 Nominal Time (h) 80 90 Tacrolimus Tacrolimus + Telaprevir (day 8) 10000 1000 100 70‐Fold 100 10 0 20 40 60 80 100 Nominal Time (h) 120 140 2.7‐ Fold Nominal Time (h) TA AC Mean Conccentration CssA Blood Concentration Garg et al, Hepatol 2011 17‐Fold Nominal Time (h) Hulskotte et al , Hepatol 2012 Tratamiento post TH: Interacciones Farmacológicas RECOMENDACIONES EN TRATAMIENTO TRIPLE CAMBIO DOSIS IMS DESDE EL PRIMER DIA DE IP TELAPREVIR: BOCEPREVIR: CYA CYA: reducir d i a ~ 1/ 4 (200 mg/d /d Æ 50 mg/d) /d) CYA CYA: reducir d i a ~ 1/ 2 (200 mg/d /d Æ 100 mg/d) /d) TAC: reducir a ~ 1/ 30 (2 mg/d Æ 0.2 mg c/ 2-3 d o bien 0.5 mg/ semana) TAC: reducir a ~ 1/ 8 (4 mg/d Æ 0.5 mg/d) • Control de niveles cada 24-48hs durante la primera semana o hasta equilibrio • Reinstaurar la dosis inicial desde el mismo día de suspensión del IP y control semanal al menos 1 mes. Coilly et al, Liver Int 2013 Tratamiento post TH: Interacciones Farmacológicas 18 Telaprevir 3 16 14 2,5 12 2 10 8 1,5 6 1 4 05 0,5 2 0 0 w0 D1 D3 D5 D7 w2 w4 w8 w12 D2 D4 D7 W2 W4 W8 W12 Tacrolim mus trough levels (ng/ml) Tacrolim mus dosis ((mg/day) 3,5 Tratamiento post TH: Interacciones Farmacológicas Simeprevir (IP) y Anticalcineurinicos (TAC, CyA) Blood concentra ation of CsA (ng/mL L) 900 800 700 Single dose of CsA 100 mg (n=14) 600 SMV 150 mg QD + single dose of CsA 100 mg (n=14) CsA SMV QD + CsA 619.7 720.6 2013 2399 TAC SMV QD + TAC Cmax, ng/mL 15.23 11.63 AUClast, ng.h/mL 124.3 102.9 500 Cmax, ng/mL 400 300 AUClast, ng h/mL ng.h/mL 200 100 0 Who ole blood con ncentration of tacrolimus ((ng/mL) o 0 4 8 12 16 20 24 25 Single dose of TAC 2 mg (n=14) 20 SMV 150 mg QD + single dose of TAC 2 mg (n=14) 15 10 5 0 0 4 8 12 Time (hours) 16 20 24 Ouwerkerk-Mahadevan AASLD 2012 Tratamiento post TH: Interacciones Farmacológicas [CyA] y [TAC] con/ sin Sofosbuvir ((NS5B NI)) [SOF] con/ sin CyA o TAC Mathias et al AASLD 2012 Tratamiento post TH: Ejemplo Además de los fármacos immunosupresores… hay muchos más…. Varón 64 años, TH CH VHC hace 3 años. G1b 1 G1b, 1.2 2 mill UI/L IMS con TAC 2mg/ día (niveles ~ 6 ng/ml) Biopsia: F3 Otras: - HTA: amlodipino 10 mg/ día + enalapril 5 mg/ día - DM: metformina 850 mg/ 12hs, Hb glicada 6% - Hipercolesterolemia: simvastatina 20 mg/ día - HBP: tamsulosina 0.4 mg/día - Sde depresivo: mirtazapina 15 mg/día - Omeprazol y paracetamol ocasional. - Infusiones naturales “hepatoprotectoras” (??) Inicia tratamiento triple con Telaprevir + PegIFN + RBV Tratamiento post TH: Ejemplo http://www.hep-druginteractions.org + FH Fármaco Simvastatina Amlodipino Enalapril p Omeprazol Metabolismo mayoritario Efecto del Telaprevir Acción CYP3A4 Cambio por pravastatina hasta fin IP/ suspensión CYP3A4 Reducción dosis a 5 mg/día y monitorización de TA CYP2D6/ CYP34A Sin cambios CYP2C19 Sin cambios CYP2E1, CYP1A2 y Paracetamol Metformina Mirtazapina Tamsulosina Sustancias naturales Tacrolimus CYP3A C 3 Sin cambios X Sin cambios CYP2D6, CYP1A2 y CYP3A4 Reduccion de dosis a 10 mg/día Monitorizar mg/día. CYP3A4/ CYP2D6 Reducción de dosis. Monitorización ??? Suspe s o hasta Suspension asta fin de tratamiento con IP CYP3A4 Ajuste de dosis Conclusiones: - La recurrencia de la Hepatitis C post TH es la primera causa de pérdida del injerto e impacta de forma notable sobre la supervivencia. Hasta la fecha, el tratamiento conseguía tasas de curación ~ 30%. - Los nuevos fármacos antivirales suponen un notable aumento en la eficacia e impactarán en el pronóstico de los pacientes trasplantados por VHC. Sin embargo, g , conllevan un nuevo escenario de efectos adversos y notables interacciones farmacológicas. - La planificación farmacológica previa es indispensable para evitar toxicidad y f favorecer la l adherencia, dh i lla tolerancia l i y llos resultados. l d