Dpto. de Física y Química 2º BCH Curso: 2015/16
Anuncio

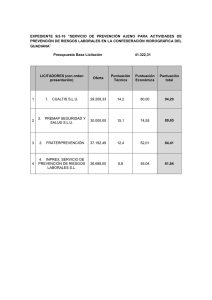
Dpto. de Física y Química 2º BCH Curso: 2015/16 IES SIERRA SUR -Valdepeñas de Jaén- QUÍMICA Nombre: NOTA Fecha: 27/11/2015 CALI/ORDEN/PRES Caligrafía Orden/Pres ORTOGRAFÍA Grafía PUNTUACIÓN EXPRESIÓN NOTA FINAL Tildes OBSERVACIONES: Respuestas del examen de estructura atómica y enlace químico. Instrucciones: a) Duración: 1 hora y 30 minutos. b) No es necesario copiar la pregunta, basta con poner su número. Se podrá responder a las preguntas en el orden que desee. c) Puntuación: Cuestiones (nº 1, 2, 3 y 4) hasta 1,5 puntos cada una. Problemas (nº 5 y 6) hasta 2 puntos cada uno. d) Exprese sólo las ideas que se piden. Se valorará positivamente la concreción en las respuestas y la capacidad de síntesis. e) Se permitirá el uso de calculadoras que no sean programables. f) Penalizaciones: En la pregunta nº 1 por cada fallo -0,5 puntos. En el resto de las preguntas por cada fallo -0,5 puntos; por poner mal las unidades -0,5 puntos y -0,25 puntos por no ponerlas si el resultado o los resultados las requieren ; también se penalizará con –0,25 puntos por error en los cálculos o por poner exceso o defecto de cifras decimales en ellos. Tanto en las preguntas de teoría como de problemas -0,25 puntos por no indicar el nombre de la ley, o del principio o de la ecuación que esté aplicando. 1.- Formule o nombre los compuestos siguientes: a) Nitrito potásico b) Peróxido de potasio c) [p]-diclorobenceno d) NH4HS e) K3N f) C H2=CH-CO-NH-CH3 Res. a) KNO2 ; b) K2O2 ; d) hidrogenosulfuro de amonio; e) nitruro de potasio o mononitruro de tripotasio; f) N-metilpropenamida. c) ClC6H4Cl => H | H-C —C // \\ Cl-C C -Cl \ / H-C = C-H 2.- a) Razone si para un electrón son posibles las siguientes series de números cuánticos: [1, 1, 0, -½]; [1, 0, -1, +½]; [4, 1, -1, +½]; [5, 0, 1, -½]; [3, 2, 0, +½ ]. b) Indique a qué tipo de orbital corresponden los estados anteriores que sean posibles. c) Indique en cuál de ellos (de los posibles) la energía es mayor. Justifica tu respuesta. Res. a) [1, 1, 0, -½] imposible, ya que l varía ente 0,...y (n-1); en este caso l es igual que n que vale 1. [1, 0, -1, +½] y [5, 0, -1, -½] son imposibles, puesto que m puede valer entre -l y +l pasando por cero; en ambos casos solo puede valer 0 ya que l vale 0. [4, 1, -1, +½] y [3, 2, -1, +½] son posibles. b) [4, 1, -1, +½] nivel de energía 4 porque n = 4 y subnivel de energía 1 por ser l = 1, por tanto el O.A. es de tipo p, en consecuencia: 4p. [3, 2, -1, +½] nivel de energía 3 porque n = 3 y subnivel de energía 2 por ser l = 2, por tanto el O.A. es de tipo d, en consecuencia: 3d. c) Teniendo en cuenta la segunda regla de Madelung, la suma (n+l) para el 4p da 5 (5 = 4+1) y es igual a la de 3d que da 5 (5=3+2) y en estos casos de empate el que tiene mayor el número cuántico principal, n, es al que le corresponde mayor energía, por tanto la solución es 4p por tener un n = 4 frente a 3p que tiene un n = 3. RECUERDA: La nota inicial podrá disminuir hasta un máximo de 2 puntos en ESO y 3 en Bachillerato. Por caligrafía, orden, presentación, puntuación y expresión se puede reducir un máximo de 0,5 en cada apartado. En ortografía, se penalizará con 0,25 cada falta y 0,25 cada dos tildes. Dpto. de Física y Química 2º BCH Curso: 2015/16 IES SIERRA SUR -Valdepeñas de Jaén- QUÍMICA Nombre: NOTA Fecha: 27/11/2015 CALI/ORDEN/PRES Caligrafía Orden/Pres ORTOGRAFÍA Grafía PUNTUACIÓN EXPRESIÓN NOTA FINAL Tildes OBSERVACIONES: Respuestas del examen de estructura atómica y enlace químico. Instrucciones: a) Duración: 1 hora y 30 minutos. b) No es necesario copiar la pregunta, basta con poner su número. Se podrá responder a las preguntas en el orden que desee. c) Puntuación: Cuestiones (nº 1, 2, 3 y 4) hasta 1,5 puntos cada una. Problemas (nº 5 y 6) hasta 2 puntos cada uno. d) Exprese sólo las ideas que se piden. Se valorará positivamente la concreción en las respuestas y la capacidad de síntesis. e) Se permitirá el uso de calculadoras que no sean programables. f) Penalizaciones: En la pregunta nº 1 por cada fallo -0,5 puntos. En el resto de las preguntas por cada fallo -0,5 puntos; por poner mal las unidades -0,5 puntos y -0,25 puntos por no ponerlas si el resultado o los resultados las requieren ; también se penalizará con –0,25 puntos por error en los cálculos o por poner exceso o defecto de cifras decimales en ellos. Tanto en las preguntas de teoría como de problemas -0,25 puntos por no indicar el nombre de la ley, o del principio o de la ecuación que esté aplicando. 3.- Los elementos Na, Al y Cl tienen de números atómicos 11, 13 y 17, respectivamente, a) Escriba la configuración electrónica de cada elemento. b) Escriba la configuración electrónica de los iones Na+, Al3+y Cl-. c) Ordene, de forma razonada, los radios de los iones anteriores. Res. a) Na: 1s22s22p63s1; Al: 1s22s22p63s23p1; Cl: 1s22s22p63s23p5. b) Na+: 1s22s22p6; Al3+: 1s22s22p63s2; Cl-: 1s22s22p63s23p6. b) Al3+ < Na+ < Cl-. El catión Al3+ es el más pequeño, pues aunque tiene la misma configuración electrónica que Na+, en aquel los electrones están atraídos por 13 protones, mientras que en el Na+ sólo están atraídos por 11 (su atracción electrostática es menor, según la ley de Coulomb de la electrostática en la que se dice que la fuerza de atracción entre cargas de distinto signo es directamente proporcional al producto de las mismas e inversamente proporcionar a la distancia entre ellas). El Cl - es el de mayor radio, pues ha ganado un electrón y tiene una capa más que los otros dos. 4.- Dada la molécula PH3 a) Represéntala mediante estructura de Lewis. b) ¿Qué tipo de hibridación presenta el átomo central de la citada molécula? c) Justifique la polaridad de los enlaces y la polaridad de la molécula. d) ¿Qué tipo de unión intermolecular presenta? Justifica tu respuesta. e) e-I) Indica si la molécula es un gas, o un sólido o un líquido a temperatura ambiente. e-II) Indica si la molécula es soluble en agua o en disolventes orgánicos. Justifica tus respuestas. Res. a) H / H ̶̶ P ̶ H53B ̶̶ P ̶ H53 ̶̶ P ̶ H53P ̶̶ P ̶ H53B H b) Hibridación sp3 no equivalente. Por lo tanto, su estructura es piramidal triangular. Su ángulo de enlace es de 106,5º debido a que la repulsión electrostática del par de electrones no compartidos cierra el ángulo de en lace de 109º 28´ procedente del nacimiento de los orbitales híbridos sp3, es decir, como consecuencia de la hibridación tetragonal que se produce en el átomo central: el fósforo. RECUERDA: La nota inicial podrá disminuir hasta un máximo de 2 puntos en ESO y 3 en Bachillerato. Por caligrafía, orden, presentación, puntuación y expresión se puede reducir un máximo de 0,5 en cada apartado. En ortografía, se penalizará con 0,25 cada falta y 0,25 cada dos tildes. Dpto. de Física y Química 2º BCH Curso: 2015/16 IES SIERRA SUR -Valdepeñas de Jaén- QUÍMICA Nombre: NOTA Fecha: 27/11/2015 CALI/ORDEN/PRES Caligrafía Orden/Pres ORTOGRAFÍA Grafía PUNTUACIÓN EXPRESIÓN NOTA FINAL Tildes OBSERVACIONES: Respuestas del examen de estructura atómica y enlace químico. Instrucciones: a) Duración: 1 hora y 30 minutos. b) No es necesario copiar la pregunta, basta con poner su número. Se podrá responder a las preguntas en el orden que desee. c) Puntuación: Cuestiones (nº 1, 2, 3 y 4) hasta 1,5 puntos cada una. Problemas (nº 5 y 6) hasta 2 puntos cada uno. d) Exprese sólo las ideas que se piden. Se valorará positivamente la concreción en las respuestas y la capacidad de síntesis. e) Se permitirá el uso de calculadoras que no sean programables. f) Penalizaciones: En la pregunta nº 1 por cada fallo -0,5 puntos. En el resto de las preguntas por cada fallo -0,5 puntos; por poner mal las unidades -0,5 puntos y -0,25 puntos por no ponerlas si el resultado o los resultados las requieren ; también se penalizará con –0,25 puntos por error en los cálculos o por poner exceso o defecto de cifras decimales en ellos. Tanto en las preguntas de teoría como de problemas -0,25 puntos por no indicar el nombre de la ley, o del principio o de la ecuación que esté aplicando. •• P / | \ H H H - Estructura piramidal triangular. - Ángulo de enlace 106,5º. - Molécula polar, soluble en disolvente polares. c) Los tres enlaces son polares porque cada uno se producen entre átomos de distinta electronegatividad (se considera que se produce para diferencias de electronegatividades, según Pauling, mayores de 0,4). La molécula es polar porque no se anulan entre sí los momentos dipolares existentes, pues, de acuerdo con la geometría de esta molécula, está formada por tres enlaces P ̶̶ P ̶ H53 B ̶̶ P ̶ H53 H ̶̶ P ̶ H53 que ̶̶ P ̶ H53 son ̶̶ P ̶ H53 polares ̶̶ P ̶ H53 y ̶̶ P ̶ H53 presentan ̶̶ P ̶ H53 ángulos ̶̶ P ̶ H53 en ̶̶ P ̶ H53 el ̶̶ P ̶ H53 espacio ̶̶ P ̶ H53 de ̶̶ P ̶ H53 unos ̶̶ P ̶ H53 106,5º; ̶̶ P ̶ H53 por ̶̶ P ̶ H53 tanto, el resultado global de la suma de los momentos dipolares o dipolos de los correspondientes enlaces es distinto de cero. d) Por ser una molécula polar –presenta dipolo permanente-, en consecuencia, las moléculas se unen entre sí en forma de dipolo permanente-dipolo permanente; por tanto, la unión intermolecular es de tipo: uniones de Van der Waals de orientación. e) e-1) A temperatura ambiente la molécula es un gas debido a la debilidad de su unión intermolecular, ya que su valor, expresado en forma de energía potencial, oscila entre 1 y 7 kJ/mol. e-2) La molécula es soluble en agua por ser polar, ya que el agua es un disolvente polar; y es sabido, en el mundo de la Química, que semejante disuelve a semejante. Por otra parte, al no ser una molécula apolar es insoluble en disolventes apolares como son los disolventes orgánicos, por ejemplo: CCl4, CS2, C6 H6 (benceno), etc. 5.- Calcule la energía reticular del KBr y represente su ciclo de Born-Haber, sabiendo que: ∆Hoformación del KBr (s) = - 391,80 kJ mol-1 ∆Hosublimación del K (s) = 81,26 kJ mol-1 ∆Hovaporización del Br2 (l) = 30,70 kJ mol-1 ∆Hodisociación del Br2 (g) = 193,50 kJ mol-1 E 1ª de ionización del K (v) = 418,40 kJ mol-1 E electroafinidad 1ª del Br (g) = - 321,90 kJ mol-1. Res. En primer lugar se escribe la reacción macroscópica de formación que tiene lugar: K (s) + ½ Br2 (l) → KBr (s) ΔH0f KBr (s). RECUERDA: La nota inicial podrá disminuir hasta un máximo de 2 puntos en ESO y 3 en Bachillerato. Por caligrafía, orden, presentación, puntuación y expresión se puede reducir un máximo de 0,5 en cada apartado. En ortografía, se penalizará con 0,25 cada falta y 0,25 cada dos tildes. Dpto. de Física y Química 2º BCH Curso: 2015/16 IES SIERRA SUR -Valdepeñas de Jaén- QUÍMICA Nombre: NOTA Fecha: 27/11/2015 CALI/ORDEN/PRES Caligrafía Orden/Pres ORTOGRAFÍA Grafía PUNTUACIÓN EXPRESIÓN NOTA FINAL Tildes OBSERVACIONES: Respuestas del examen de estructura atómica y enlace químico. Instrucciones: a) Duración: 1 hora y 30 minutos. b) No es necesario copiar la pregunta, basta con poner su número. Se podrá responder a las preguntas en el orden que desee. c) Puntuación: Cuestiones (nº 1, 2, 3 y 4) hasta 1,5 puntos cada una. Problemas (nº 5 y 6) hasta 2 puntos cada uno. d) Exprese sólo las ideas que se piden. Se valorará positivamente la concreción en las respuestas y la capacidad de síntesis. e) Se permitirá el uso de calculadoras que no sean programables. f) Penalizaciones: En la pregunta nº 1 por cada fallo -0,5 puntos. En el resto de las preguntas por cada fallo -0,5 puntos; por poner mal las unidades -0,5 puntos y -0,25 puntos por no ponerlas si el resultado o los resultados las requieren ; también se penalizará con –0,25 puntos por error en los cálculos o por poner exceso o defecto de cifras decimales en ellos. Tanto en las preguntas de teoría como de problemas -0,25 puntos por no indicar el nombre de la ley, o del principio o de la ecuación que esté aplicando. La primera etapa a considerar es la sublimación del potasio: K (s) → K (v) ΔH0sublimación K (s). El potasio cederá un electrón para quedar con estructura estable [Ne]3s 23p6 mediante una etapa de ionización: K (v) – 1e- → K+(v) E 1ª de ionización del K (v). Las siguientes etapas tendrían que ver con la vaporización del bromo, la disociación del mismo y posterior ionización: ½ Br2 (l) → ½ Br2 (g) ½ ΔH0vaporización del Br2 (l) ½ Br2 (g) → Br (g) ½ ΔH0disociacón del Br2 (l) Br (g) +1 e- → Br-(g) E electroafinidad 1ª del Br (g). Por último, la etapa de formación del cristal: K+(v) + Br-(g) — U → KBr (s). Sumando las ecuaciones termoquímicas anteriores se observa que se obtiene la reacción macroscópica de formación del bromuro de potasio; por tanto, y teniendo en cuenta la Ley de Hess, podemos escribir que: ΔH0f KBr (s) = ΔH 0sublimación K (s) + E 1ª ionización K (v) + ½ ΔH0 vaporización Br2 (l)+ ½ ΔH0 disociación Br2 (g) + E electroafinidad 1ª Br (g) + U; despejando queda: U = ΔH0 f KBr (s) - (ΔH 0sublimación K (s) + E 1ª ionización K (v) + ½ ΔH0 vaporización Br2 (l)+ ½ ΔH0 disociación Br2 (g) + E electroafinidad 1ª Br (g)) U = - 391,80 kJmol-1 - ( 81,26 kJmol-1+ 418,40 kJmol-1 + ½ ·30,70 kJmol-1 + ½ ·193,50 kJmol-1 - 321,90 kJmol-1) = - 681,66 kJmol-1. Solución: U = - 681,66 kJmol-1. RECUERDA: La nota inicial podrá disminuir hasta un máximo de 2 puntos en ESO y 3 en Bachillerato. Por caligrafía, orden, presentación, puntuación y expresión se puede reducir un máximo de 0,5 en cada apartado. En ortografía, se penalizará con 0,25 cada falta y 0,25 cada dos tildes. Dpto. de Física y Química 2º BCH Curso: 2015/16 IES SIERRA SUR -Valdepeñas de Jaén- QUÍMICA Nombre: Fecha: 27/11/2015 NOTA CALI/ORDEN/PRES Caligrafía ORTOGRAFÍA Orden/Pres Grafía PUNTUACIÓN EXPRESIÓN NOTA FINAL Tildes OBSERVACIONES: Respuestas del examen de estructura atómica y enlace químico. Instrucciones: a) Duración: 1 hora y 30 minutos. b) No es necesario copiar la pregunta, basta con poner su número. Se podrá responder a las preguntas en el orden que desee. c) Puntuación: Cuestiones (nº 1, 2, 3 y 4) hasta 1,5 puntos cada una. Problemas (nº 5 y 6) hasta 2 puntos cada uno. d) Exprese sólo las ideas que se piden. Se valorará positivamente la concreción en las respuestas y la capacidad de síntesis. e) Se permitirá el uso de calculadoras que no sean programables. f) Penalizaciones: En la pregunta nº 1 por cada fallo -0,5 puntos. En el resto de las preguntas por cada fallo -0,5 puntos; por poner mal las unidades -0,5 puntos y -0,25 puntos por no ponerlas si el resultado o los resultados las requieren ; también se penalizará con –0,25 puntos por error en los cálculos o por poner exceso o defecto de cifras decimales en ellos. Tanto en las preguntas de teoría como de problemas -0,25 puntos por no indicar el nombre de la ley, o del principio o de la ecuación que esté aplicando. La representación del ciclo de Born-Haber sería como sigue: K+(v) + Br-(g) ----U----→ KBr (s) ^ | 1 e- → E I1ª K (v) ^ | | | ^ ^ | A E1ª Br (g) / / / / ΔHf ^ | ES ½ED ½ Br2(g) / / ^ | | Nota: ½EV / K (s) + ½ Br2 (l) / E I1ª = energía de ionización 1ª A E1ª = afinidad electrónica 1ª E s = energía de sublimación E D = energía de disociación E V = energía de vaporización ΔHf = energía de formación U = energía reticular. 6.- a) Diseña el ciclo de Born-Haber para el óxido de berilio. b) Calcula la energía reticular del óxido de berilio sabiendo que se desprende 702,0 kJ/mol cuando se forma a partir de sus elementos. Datos: Energía de disociación del O2 = 498,2 kJ/mol. Calor de sublimación del Be = 130,5 kJ/mol. Electroafinidad 1ª del O = -141,2 kJ/mol. Energía 1ª de ionización del Be = 746,6 kJ/mol. Electroafinidad 2ª del O = -791,0 kJ/mol. Energía 2ª de ionización del Be = 1.467,6 kJ/mol. Res. a) La representación del ciclo de Born-Haber sería como sigue: Be++(v) + O=(g) ----U----→ BeO (s) ^ | 1 e- → E I2ª Be+(v) ^ | 1 e- → E I1ª Be(v) ^ | ^ ^ | A E2ª O (g) / - / / ^ | A E1ª O(g) ^ | ES ½E D / Be(s) + ½ O2(g) / / ΔHf / / Nota: E Iª = energía de ionización 1ª E I2ª = energía de ionización 2ª A E1ª = afinidad electrónica 1ª A E2ª = afinidad electrónica 2ª E s = energía de sublimación E D = energía de disociación ΔHf = energía de formación U = energía reticular. RECUERDA: La nota inicial podrá disminuir hasta un máximo de 2 puntos en ESO y 3 en Bachillerato. Por caligrafía, orden, presentación, puntuación y expresión se puede reducir un máximo de 0,5 en cada apartado. En ortografía, se penalizará con 0,25 cada falta y 0,25 cada dos tildes. Dpto. de Física y Química 2º BCH Curso: 2015/16 IES SIERRA SUR -Valdepeñas de Jaén- QUÍMICA Nombre: NOTA Fecha: 27/11/2015 CALI/ORDEN/PRES Caligrafía Orden/Pres ORTOGRAFÍA Grafía PUNTUACIÓN EXPRESIÓN NOTA FINAL Tildes OBSERVACIONES: Respuestas del examen de estructura atómica y enlace químico. Instrucciones: a) Duración: 1 hora y 30 minutos. b) No es necesario copiar la pregunta, basta con poner su número. Se podrá responder a las preguntas en el orden que desee. c) Puntuación: Cuestiones (nº 1, 2, 3 y 4) hasta 1,5 puntos cada una. Problemas (nº 5 y 6) hasta 2 puntos cada uno. d) Exprese sólo las ideas que se piden. Se valorará positivamente la concreción en las respuestas y la capacidad de síntesis. e) Se permitirá el uso de calculadoras que no sean programables. f) Penalizaciones: En la pregunta nº 1 por cada fallo -0,5 puntos. En el resto de las preguntas por cada fallo -0,5 puntos; por poner mal las unidades -0,5 puntos y -0,25 puntos por no ponerlas si el resultado o los resultados las requieren ; también se penalizará con –0,25 puntos por error en los cálculos o por poner exceso o defecto de cifras decimales en ellos. Tanto en las preguntas de teoría como de problemas -0,25 puntos por no indicar el nombre de la ley, o del principio o de la ecuación que esté aplicando. b) En primer lugar se escribe la reacción macroscópica de formación que tiene lugar: Be (s) + ½ O2(g) → BeO(s) ΔHf. La primera etapa a considerar es la sublimación del berilio: Be(s) → Be(v) Esublimación. El berilio cederá dos electrones para quedar con estructura estable 1s 2 mediante dos etapas de ionización sucesivas: Be(v) – 1e- → Be+(v)1.ª Eionización; Be+(v) – 1e- → Be++(v) 2.ª Eionización. Las siguientes etapas tendrían que ver con la disociación y posterior ionización del oxígeno: ½ O2(g) → O(g) ½ Edisociación O(g) +1 e- → O-(g) 1ª. Eelectroafinidad ; O-(g) +1 e- → O=(g) 2ª. Eelectroafinidad. Por último, la etapa de formación del cristal: Be++(v) + O=(g) — U → BeO(s). Sumando las ecuaciones termoquímicas anteriores se observa que se obtiene la reacción macroscópica de formación del óxido de berilio; por tanto, y teniendo en cuenta la Ley de Hess, podemos escribir que: ΔHf = Esublimación +1.ª Eionización +2.ª Eionización + ª. Eelectroafinidad + 2ª. Eelectroafinidad + ½ Edisociación + U despejando queda: U = ΔHf -(Esublimación +1.ª Eionización +2.ª Eionización + ª. Eelectroafinidad + 2ª. Eelectroafinidad + ½ Edisociación ) U = 702,0 kJmol-1 - ( 130,5 kJmol-1+ 746,6 kJmol-1 + 1.467,6 kJmol-1 -141,2 kJmol-1- 791,0 kJmol-1 + ½ · 498,2 kJmol-1) = - 2.363,6 kJmol-1. Solución: U = - 2.363,6 kJmol-1. RECUERDA: La nota inicial podrá disminuir hasta un máximo de 2 puntos en ESO y 3 en Bachillerato. Por caligrafía, orden, presentación, puntuación y expresión se puede reducir un máximo de 0,5 en cada apartado. En ortografía, se penalizará con 0,25 cada falta y 0,25 cada dos tildes.