sistema renina-angiotensina-aldosterona
Anuncio

INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
CAPITULO 4
FISIOPATOLOGÍA DE LA INSUFICIENCIA CARDIACA:
SISTEMA RENINA-ANGIOTENSINA-ALDOSTERONA
Prof.Dr. Fernando de la Serna1 , Prof. Dr. María Peral de Bruno2
Introducción. Aspectos fisiológicos.
La IC es definida como la incapacidad del corazón de aportar sangre con sus nutrientes en una tasa
acorde con los requerimientos metabólicos de los tejidos en reposo o durante ejercicio ligero. Esta
incapacidad motiva una respuesta neurohormonal compensatoria que se interrelaciona con las
alteraciones hemodinámicas vinculadas a las cargas ventriculares, más los problemas funcionales y
estructurales del miocardio que puedan existir. En la fisiopatología de la IC y de la Hipertensión
Arterial (HTA), asi como de las vasculopatías tiene participación clave el Sistema Renina
Angiotensina (SRA), cuyas acciones principales incluyen la de regular la presión arterial (PA), el tono
vascular, y la volemia, y facilitar la transmisión simpática. El SRA participa en la remodelación
ventricular del infartado y del hipertenso, asi como en la remodelación vascular.
La actividad del SRA es consecuencia de una sucesión de trasformaciones de distintas proteínas que
obtienen formación de efectores biológicos, las angiotensinas. Comienza por la acción de una
enzima, la renina, que actúa sobre un sustrato, el angiotensinógeno (A'geno), transformándolo en
Angiotensina (Ang) I. Esta, a su vez, es transformada por la llamada Enzima de Conversión ( ECA) en
Ang II. La Ang II tiene 2 receptores, AT1 y AT2, de acciones opuestas (ver más adelante)
Angiotensinógeno, renina y prorrenina
El primer paso es la transformación del sustrato Angiotensinógeno (A'geno), glucoproteína
de 452 aminoácidos (aa), de la familia de las alfa-2-globulinas, sintetizada en el hígado y en el
riñón, en el decapéptido denominado Angiotensina I (Ang I)[1] , por medio de la renina, proteasa
aspártica formada por 350 aa, que se expresa principalmente en la mácula densa y células
yuxtaglomerulares células yuxtaglomerulares renales (CYGR), aunque también en distintos
tejidos.
La renina tiene como antecesor una forma inactiva, la prorrenina (PRen). La secuencia comienza
por la producción de PRen en el Retículo Sarcoplásmico de las CYGR, para luego alojarse en las
cisternas de Golgi, después de haber sido sintetizada como un zimógeno inactivo. La PRen puede
ser excretada o convertida en renina (aproximadamente el 25% de la PRen se transforma en renina).
En condiciones normales la PRen no es catalíticamente activa, dada la presencia en su estructura de
un prosegmento de 43 aa ubicado en el extremo N-terminal, que recubre y obstruye la hendidura
1
Profesor Plenario, Facultad de Medicina, Universidad Nacional de Tucumán. 2 . Profesora Asociada
Fisiología. Dpto. BíoMedicina. Facultad de ´Medicina, Universidad Nacional de Tucumán. Investigadora
CONICET
2
50
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
donde está la zona a ser catalizada, impidiendo el contacto de esta con el A'geno. La PRen puede
activarse por dos mecanismos: proteolítico y no proteolítico; el proteolítico se produce solamente
en las CYGR, y es un proceso irreversible de escisión del prosegmento producido por agentes
endógenos (catepsina B y diversas serinproteasas); el mecanismo no proteolítico (puede ser bajo
pH [=3,3] o frío [4°C]), es un proceso reversible, tanto cuando la PRen esté libre o cuando esté unida
a su receptor (que no afecta su plena capacidad enzimática). La forma no proteolítica es la que
interviene en la síntesis de Ang, asociada a un aumento en la activación del SRA tisular.
La producción de renina está en su mayor parte limitada al riñón, siendo estimulada por : 1)
disminución de la señal de estiramiento de los barorreceptores de la arteriola aferente del
glomérulo renal, consecutiva al menor flujo; 2) la disminución de la concentración de ClNa
plasmático (sensada por la mácula densa, que es parte del aparato yuxtaglomerular renal); 3)
estímulos simpáticos (estimulación 1-adrenérgica de las CYGR); 4) factores locales como las
prostaglandinas, la dopamina, la adenosina, y el NO; 5) El AMPc es mediador de la estimulación
de la expresión de renina por las catecolaminas, de la actividad simpática, y de las
prostaglandinas; 6) El CREB (cAMP response element) actúa como mediador del señalamiento del
AMPc al gen de renina[2-4]; 7) disminución de la señal de retroalimentación negativa que envía
la Ang II.
Son inhibidores de la expresión de renina la Ang II y la endotelina (ET-1), por medio del incremento
de la concentración citosólica de Ca2+ , o por activación de la Protein Kinasa C (PKC). La vitamina D3
es inhibidora de la expresión de renina. Otros potentes inhibidores de la producción de renina son
las citoquinas proinflamatorias (TNFα, IL-1β), que así participan en la fisiopatología de la
hipotensión arterial y hasta del shock séptico de algunos procesos infecciosos graves[5]. El único
sitio conocido de producción de renina son las CYGR, mientras que la PRen es producida en el riñón,
las suprarrenales, los ovarios, los testículos, la placenta y la retina[6]. Hay evidencias actuales de
una fuerte asociación del SRA con los NHRs (Nuclear Hormone Receptors) [7], que integran una
familia de factores de transcripción involucrados en múltiples funciones celulares, incluyendo
hormonas, xenobióticos, prostaglandinas, ácidos grasos y derivados del colesterol, que intervienen
en el metabolismo glucídico y lipídico. Distintos NHRs regulan la producción de renina al interactuar
con elementos específicos del promotor de la misma, como por ejemplo el Receptor X Hepático-α
(Liver X Regulator-α = LXRα) – importante modulador del metabolismo de lípidos y glucosa, de
inflamación y de inmunidad - que se expresa en el hígado, intestino, corazón, riñón y suprarrenales
(en estas fundamentalmente de tipo LXRβ). El LRXα parece jugar un importante papel en la
producción de renina, a través de un promotor llamado CNRE (cAMP negative response element).
LXRα es una proteína ligante del CNRE que regula la expresión del mARN (mensajero del ARN) de la
renina, necesaria para la respuesta de las CYGR. El receptor de vitamina D es un LXR que actúa como
regulador negativo de la transcripción de renina. Los receptores de hormona tiroidea inducen la
transcripción y secreción de renina (dosis dependiente): en el hipotiroidismo hay disminución de los
niveles de A'geno. Los receptores de peroxisomas proliferadores activados (peroxisome proliferator
activated receptor=PPAR) tienen dos isoformas α y , Los PPAR-α estimulan la producción de renina
mientras que los PPAR-γ la inhibirían; el agonista de PPAR-γ pioglitazona, reduce los niveles
plasmáticos de renina en humanos. Otras hormonas como la progesterona, estradiol, testosterona
y aldosterona (ALDO) afectan los niveles de renina. La placenta libera PRen.
51
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Hay expresión de renina en un cierto número de tejidos extrarrenales, formando parte de los SRA
tisulares locales. Se piensa que sus efectos son autocrinos o paracrinos. En el corazón y grandes
arterias la renina proviene del plasma, y ejerce una acción paracrina[2,8,9]. Se ha dicho que la
renina se sintetiza en las CYGR, pero debe señalarse que el 25% de la renina sintetizada se ubica
en los gránulos secretorios, mientras que el 75% es secretada como PRen, o sea que la proforma
representa aproximadamente el 80-90 % de la renina total circulante.. La PRen, a través de
receptores tisulares de renina, lleva a activación proteolítica así como a generación local de Ang y
de segundos mensajeros[2], como AMPc y GMPc.
La PRen circula en el plasma en concentraciones hasta cien veces superiores a las de renina, y está
presente en anéfricos, por lo que se supone es de origen extrarrenal. Se encuentra particularmente
elevada en diabéticos con complicaciones microvasculares. Tiene una baja actividad intrínseca de
menos del 3% de la actividad de la renina completamente activada y es probable que sea la
responsable de la producción de Ang local[9]. En tejidos que no expresan el gen de renina, como el
corazón y la pared vascular, la generación de renina depende de la captación de la PRen/renina
circulante, por lo cual se hace necesaria la presencia de un mecanismo mediado por receptor. Hay
un receptor manosa-6-fosfato/IGF-1 (Insulin-like Growth
Factor-1), que probablemente sea usado como
Puede decirse entonces que la PRen
clearance, y otro receptor (pro)renina (PR-R) que sería el
y la renina son moléculas activas
captador tisular de la PRen/renina circulante. Se explica
que interactúan con un receptor
así como el supuesto inactivo precursor de renina (la
específico (PRORRENINA=PR-R),
PRen) gana actividad generadora de Ang I a través de
clonado y secuenciado en cultivos de
ligarse al PR-R, sin ir a escisión proteolítica.. Los animales
células mesangiales humanas)[9],
con sobreexpresión de PR-R humano presentan
células musculares lisas vasculares
aumento de la PA y de la concentración plasmática de
aldosterona,
y
desarrollan
proteinuria
y
del subendotelio glomerular y
glomerulosclerosis asociadas a un aumento en la
arterias renales y coronarias)[10].
expresión renal de MAPKs (Mitogen Activated Protein
Este PR-R no muestra homología con
Kinases) y TFG-β1 (Transforming Growth Factor β1).
otros receptores de la membrana
celular y hay mayores niveles de su
mensajero de ARN (mARN) en
cerebro, corazón y placenta y menos
en músculo esquelético, pulmón, y
retina [3,9]. El PR-R tiene un solo
segmento transmembrana (350 aa);
su extremo N-terminal extracelular
es largo, hidrofóbico y no
glucosilado y es el que se uniría a
PRen y renina y el extremo Cterminal intracitoplásmico (20 aa) y
se asociaría a acciones enzimáticas
intracelulares. El PR-R permitiría la
internalización, activación
proteolítica y posterior generación
intracelular de Ang I y de segundos
mensajeros como AMPc y GMPc.
Con respecto a la producción de renina por el riñón, ya
ha sido dicho que el AMPc es el principal estimulador de
su liberación. La activación de los receptores adrenérgicos renales, vía aumento de la actividad de la
adenilciclasa, estimula la secreción de renina; también
son estimuladores de la producción de renina la
prostaciclina (PGI2), la prostaglandina E, la
adrenomedulina y el CGRP (calcitonin gene-related
peptide).
La Ang II ejerce una retroalimentación negativa sobre la
liberación de renina y estimula al Sistema Nervioso
Simpático (SNS) a través de diferentes núcleos ubicados
en el hipotálamo y el bulbo, la médula espinal, los
ganglios simpáticos, y las terminaciones nerviosas;
además inhibe a función barorrefleja. Su actividad a
nivel central genera efectos sobre el volumen minuto
(VM) y la PA (PA)[10]. En los controles sobre el SRA del
52
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Sistema Nervioso Central (SNC) están involucrados núcleos nerviosos claves, tales como el Núcleo
Paraventricular (NPV) del hipotálamo (regulador de la producción de glucocorticoides y de
vasopresina), la RVLM - que es la región rostroventrolateral del bulbo (en inglés Medulla Oblongata
= bulbo raquídeo), que regula la PA y recibe señales que luego de ser integradas son trasmitidas al
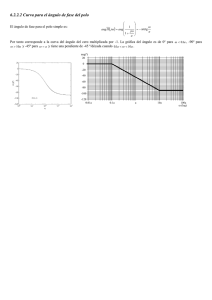
IFigura 1. Esquema de formación de distintos integrantes del SRA y sus receptores. APA= aminopeptidasa A; APN =
aminopeptidasa N; EPN = Endopeptidasa; PEP = Prolilendopeptidasa; TOP = Thimetoligopeptidasa
SNS preganglionar de la columna intermediolateral de la médula espinal (modulación del SNS, la PA
y los lechos vasculares) y el Núcleo del Tracto Solitario (NTS), que se ocupa entre otras funciones de
los barorreflejos. Estas regulaciones sugieren que la hipertensión arterial (HTA) neurogénica es el
resultado de impulsos provenientes del cerebro; además la Ang II modula la ingesta de H2O y Na+
por medio de receptores AT1 ubicados en los órganos circunventriculares como el subfornical y el
organum vasculosum de la lámina terminalis, aparte de que la expresión de los AT1 está
marcadamente aumentada en el bulbo y en el NTS. Aparentemente los altos niveles de Ang II
provocan regulación hacia arriba de sus receptores (ver más adelante); son efectos importantes su
vinculación con la generación de ROS (Reactive Oxygen Species) y la facilitación de la trasmisión
simpática. Se ha demostrado sobreproducción de ROS en la zona RVLM en conejos con insuficiencia
cardiaca (IC), asi como disminución en esa zona de presencia de barredores de radicales libres (RL)
como la superóxido dismutasa (SOD)[11].
Receptores de Ang II
53
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
La Ang II tiene dos tipos de receptores, el AT1 y el AT2 [12-20] , pertenecientes a la familia
rhodopsina de los GPCR (G Protein Coupled Receptors), que poseen diferencias en su distribución
y vías de señalamiento. Se ha descripto también a los tipo A3 y A4, todavía no aceptados en la
nomenclatura internacional de receptores. Los AT1 presentan en la especie murina dos subtipos,
AT1a y AT1b. Los receptores AT1 tienen 7 dominios transmembrana, e intervienen en múltiples
caminos de señalamiento intracelulares que involucran al calcio, fosfolípidos, kinasas y RL. Se
encuentran en las glándulas suprarrenales, en el cerebro, en el riñón, en el hígado, en el músculo
liso vascular y en el corazón, mientras que los receptores AT2 se ubican en grandes cantidades en
los tejidos fetales para luego disminuir grandemente después del nacimiento; están presentes en
gran número en las células musculares lisas vasculares (CMLV) y en baja cantidad en la adventicia
de la vasculatura (casi no se expresan en las células endoteliales [CE])[14]. Ambos receptores
difieren en cuál de las proteínas G ellos activan preferencialmente y en la variedad de señales que
inician. Zucker y col. [21] han presentado la hipótesis de que la Ang II regula al AT1 por medio de una
señal que incluye a la AP-1 (Activator Proteín-1) , quien contribuiría a la formación de ROS y
presencia de estrés oxidativo (EOx). La administración de H2O2 (peróxido de hidrógeno), que es una
forma de ROS, estimula a la MAPK (Mitogen Activated Protein Kinase) y a la JNK (cJun-terminal
amino kinase). Las ROS promovidas por la Ang II van a activar a la SAPK (stress activated protein
kinase).
El AT1 participa en el manejo
tubular renal de electrolítos, en
la liberación de ALDO, en la
facilitación de la actividad
adrenérgica, y es responsable del
remodelamiento hipertrófico de
las paredes vasculares vinculado
a las señales de promoción de
crecimiento de la Ang II, todo ello
relacionado con tirosino-kinasas.
La contracción del músculo liso
vascular se debe a la regulación
dual de la fosforilación de la cadena liviana de miosina (Myosin Light Chain = MLC) La estimulación
del receptor AT1 genera múltiples cascadas de señalamiento, principalmente a través de las MAPK,
inositol-trifosfato (IP3) y fosfolipasa C e inhibe la adenilciclasa, mediando vasoconstricción,
reabsorción de Na+, hipertrofia y proliferación celular, fibrosis tisular y reacción inflamatoria[21].
Los receptores AT1 se expresan en todos aquellos órganos
que participan en la regulación de la PA. En la vasculatura
su estimulación produce intensa vasoconstricción. En el
riñón la activación del receptor provoca vasoconstricción y
aumento de la reabsorción tubular de Na+ , mientras que
en la suprarrenal induce liberación de ALDO, quien
también promueve retención del ión. En el cerebro
intervienen en las respuestas vasopresoras, pero también
en la regulación de la sed, apetito para la sal y liberación
de arginina vasopresina (aVP)[19,20].
El efecto vasodilatador del AT2 es mediado por
la activación secuencial BK-NO-GMPc; y el de
formación de ácido araquidónico por medio de
las protein-fosfatasas que desfosforilan
proteínas y estimulan a la fosfolipasa A2.
Cuando hay disminución del Na+ plasmático o
estenosis de arteria renal, así como cuando hay
un bloqueo del receptor AT1 en diabéticos
hipertensos, se incrementa la expresión del AT2
generando vasodilatación.
En el estudio de las acciones de cada
receptor se han producido hallazgos
contrapuestos en distintas investigaciones:
Según Schneider y Lorell[22] la función del
AT2 depende del contexto, o sea de la
relación entre AT1 y AT2 (que no es estática)
en el momento dado. Por ejemplo en la
hipertrofia cardiaca (HC) aumenta la
relación AT1:AT2, explicándose así la razón
por la cual la inhibición de AT2 no amplifica
la respuesta de crecimiento en corazones
normales (ratas); en corazones en
insuficiencia los niveles de AT1 están
54
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
disminuidos mientras que los de AT2 no muestran cambios o están aumentados. Es probable que el
AT2 module el accionar del AT1 por interacción directa, con lo cual decir - con respecto al miocito que el AT2 tiene efecto anticrecimiento mientras que el AT1 favorece el mismo, es caer en una
simplificación que puede ser inexacta: se ha demostrado que la sobreexpresión de AT2 en los
ventrículos lleva a miocardiopatía dilatada con hipertrofia miocítica e IC[23].
La Ang II es un poderoso vasoconstrictor del músculo liso vascular, por medio de la activación del
receptor AT1 y de las proteínas contráctiles: luego de estímulos específicos se promueve entrada de
Ca2+ en la célula aumentando así su concentración intracelular; el catión se combina con calmodulín,
formando un complejo que activa a la kinasa de la cadena liviana de miosina (MLCK), la que fosforila
a la miosina, permitiendo así la formación del puente cruzado de actina-miosina. El Ca2+ intracelular
aumenta fundamentalmente por la liberación del mismo desde el Retículo Sarcoplásmico, reacción
gatillada por la entrada del catión a la célula a través de los canales de Ca2+. La activación del AT1
estimula la hidrólisis del fosfatidilinositol 4,5-difosfato (por la fosforilación de tirosina kinasa por la
fosfolipasa C-γ1), formándose inositol1,4,5-trifosfato (IP3) y diacilglicerol (DAG), mensajeros
intracelulares; el IP3 activa la liberación de Ca2+ de los almacenes intracelulares a través de los
receptores de IP3 (IP3R). , mientras que el DAG activa la protein-kinasa C (PKC), que actúa
potenciando a una proteína inhibitoria de la fosfatasa de proteína tipo 1 (CPI17), e inhibe
directamente la actividad de la fosfatasa de la miosina de cadena liviana (MLCP=miosin light chain
phosphatase), por la vía RhoA/Rho-kinasa[23]. La inhibición de la fosfatasa de la MLCP causa una
mayor amplitud de la fosforilación de miosina para una dada elevación de Ca2+, o sea sensibiliza el
miofilamento a la acción del Ca2+. La PKC unida al Ca2+ elevado promueven la expresión de factores
de transcripción tales como c-fos, c-myc y c-jun [22,23] , vinculados con la hipertrofia miocítica.
También se estimula la transcripción de PDGF-A (Platelet Derived Growth Factor-A) y de TGFβ
(Transforming Growth Factor beta). El AT1 también activa la entrada de Ca2+ por canales de la
membrana.
Asano y col.[24] han demostrado que la densidad de los
receptores AT1 (pero no la de AT2) está significativamente
disminuida en caso de miocardiopatía dilatada idiopática,
mas no en la isquémica. La densidad de receptores AT1 se
correlaciona con la de los 1-adrenérgicos. La regulación
hacia abajo de ambos receptores - aunque no específica se correlaciona con la gravedad de la IC. De estos los
primeros son los predominantemente expresados en los
tejidos. Es probable que la regulación del metabolismo del
Na+ sea regulada por los AT1a.. La regulación hacia abajo
del receptor AT1 puede atenuar el efecto inotrópico
negativo de la Ang II (probablemente vinculado a la alteración del manejo del Ca2+ como se ve en la
IC); pero si se produce con el AT1 y no con el AT2 , pueden aparecer efectos perniciosos sobre el
desempeño cardíaco por el incremento en los niveles de Ang II con potenciación de los efectos sobre
los AT2. La Ang II, en bajas dosis, induce la liberación de ET-1 quien activa al intercambiador Na+/H+
(NHE), produciéndose aumento del Na+ intracelular, que promueve la entrada de Ca2+ a la célula
por medio del intercambio reverso de Na+/Ca2+ (NCX), obteniéndose así un efecto inotrópico
positivo [25].
Los AT2 inhiben el crecimiento celular e inducirían apoptosis, y participan también en
antiproliferación de células endoteliales coronarias, inhibición de neoíntima y diferenciación
elular. Podrían estar vinculados al remodelado luego de IM. Henrion y col.[26] han comunicado
Se han señalado cuatro caminos
de señalamiento a partir del AT2, a
saber: 1) Activación de fosfatasas
protéinicas y desfosforilación
proteica; 2) regulación del sistema
BK-NO-GMPc; 3) activación de la
fosfolipasa A2 y liberación de ácido
araquidónico; y 4) formación de
ceramida.
55
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
que la estimulación del receptor AT2 (in vitro) induce la producción de NO, o sea efecto
vasodilatador; en esa condición la estimulación de AT2 inhibe el crecimiento y proliferación del
músculo liso vascular y cardiaco, estimula apoptosis, y promueve síntesis de la matriz extracelular.
In vivo la estimulación crónica del receptor AT2 lleva a HC y fibrosis. Según Ko[27] el receptor AT2 se
comporta como protector cardiaco, aparte del efecto vasodilatador, al inhibir el remodelamiento
dañoso y mejorar las funciones sistólica y diastólica luego de Infarto de miocardio, y prevenir fibrosis
perivascular coronaria. Los receptores AT2 son re-expresados por fibroblastos cardiacos ubicados
en las zonas fibrosadas de corazones insuficientes de animales de experimentación (ratas), que
ejercen acción anti-AT1 durante la progresión de la fibrosis, inhibiendo el metabolismo del colágeno
y el crecimiento de los fibroblastos, durante la remodelación cardiaca[28]. Tanto los receptores de
Ang II como los β-adrenérgicos comparten mecanismos de regulación hacia abajo. El receptor AT1
se desensibiliza e internaliza rápidamente después de ser estimulado por agonistas. El receptor AT2
actúa por medio de la proteína G y fosfatasas de tirosina para ejercer acciones inhibitorias de
aquellas mediadas por el AT1 [29]. Otros receptores que participan en el sistema, intermediarios
de Ang-(1-7) y Ang IV, y Alamandina, serán discutidos al describir esas angiotensinas.
Las evidencias apoyan a priori el concepto que una de las mayores funciones del receptor AT 2 es
la supresión del crecimiento, dado que alguna de las señales a partir del mismo provoca activación
de la fosfatasa Ser/Thr (PP2A), de la fosfatasa MAPK y apoptosis, de la fosfatasa protein tirosina
(SHP-1), y de la actividad de la ERK (Extracellular Regulated Kinase) Muchas investigaciones
actuales muestran que el AT2 tiene también funciones promotoras del crecimiento, y que en
algunos casos comparte con AT1 caminos comunes de señalamiento.
Más aspectos sobre el rol de los receptores AT1 y AT2 son estudiados más adelante, en Acciones de
las Angiotensinas.
Las Enzimas de Conversión de las Angiotensinas (ECA y ECA-2)
ECA
Desde hace muchos años se conoce que el decapéptido Ang I es convertido en el octapéptido Ang II
por la ECA, ectoenzima métalo-proteinasa de zinc dipeptidil carboxi-peptidasa (Quininasa II, EC
3.4.15.1) que escinde el dipéptido histidina-leucina de la terminal carboxilo (Asp-Arg-Val-Tir-IsoHisProl-Fen-His-Leu) formando el octapéptido Ang II, y que al mismo tiempo la ECA inactiva a la
bradiquinina (BK), por lo que es también llamada Kininasa II. La ECA también degrada la Sustancia P,
y al péptido hemorregulador N-acetil-seril-aspartil-lisil-prolina, que es un sustrato natural y específico
para el sitio catalítico terminal-amino en los seres humanos [30], ubicado en la membrana de las CE
parenquimatosas y también inflamatorias,
La ECA está ubicada en la membrana de las células endoteliales (CE) parenquimatosas y también
inflamatorias y presenta tres isoformas[31,32]: 1) ECA somática, que se encuentra en su mayor cantidad
en el endotelio de arterias pulmonares; pero también en otros tipos de CE, algunas CMLV, monocitos,
linfocitos T y adipocitos[31]. 2) ECA plasmática o soluble y 3) ECA germinal o testicular. La primera de
esas isoformas es la productora principal de Ang II y está presente en las válvulas cardiacas, arterias
coronarias, aorta, endotelio pulmonar, endocardio y epicardio[33] - en especial - pero también en el
56
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
cerebro, corteza suprarrenal, intestino y fibroblastos[34,35]. La expresión de ECA predomina en CE y
fibroblastos.
Es muy importante señalar que la activación de la ECA y por ende producción de Ang II, tiene fuerte
dependencia de la función endotelial, cuyas acciones principales se vinculan con la regulación de la
vasomoción, y con efectos antiinflamatorios, antitrombóticos, y antiproliferativos, etc., que
contribuyen grandemente al mantenimiento de la homeostasis circulatoria. Menos del 10% de la ECA
existente circula en el plasma, o sea que su acción es fundamentalmente tisular [36].
La Ang II y la ECA desempeñan un importante papel – usando la vía receptor AT1/ MCP-1 (Monocyte
Chemoattractan Protein-1)/NADPH (Nicotinamida Adenina Dinucleótido) oxidasa[36,37] - en el
remodelamiento vascular luego de injuria, en la restenosis, en la hipertensión arterial (HTA), en la
insuficiencia cardiaca (IC), en la aterosclerosis y en la formación de aneurisma de aorta abdominal
(AAA). Se ha comprobado que los niveles de ECA son mayores en los homocigotas para el alelo I e
intermedios en los con I/Des, aunque es importante la relación del genotipo ECA DD, con el desarrollo
de hipertrofia ventricular izquierda (HVI), en especial cuando existen sobrecargas[16].
Hay importantes niveles de ECA en el lecho capilar de los pulmones, y bajos en los miocitos, que
aumentan en caso de hipertrofia cardiaca (HC)… es probable que el estrés los aumente. Según
Dzau[37] los miocitos activados por el estiramiento pueden producir ECA : la enzima así formada es
trasportada a los macrófagos, que la trasladan al intersticio. El 80% de la Ang I local se forma a través
de la acción de la renina (Ren) sobre el angiotensinógeno (A’geno) tisular: los mismos fibroblastos
producen Ang II y generan fibrosis miocárdica. Aparentemente es necesario un SRA local para la
proliferación de fibroblastos y desarrollo de fibrosis.
La disfunción endotelial produce perturbación en la regulación vasomotora, en el crecimiento celular,
en el estado inflamatorio de la pared vascular, en la activación de la ECA tisular, y además aumento de
la producción local de Ang II y degradación de BK, todos ellos factores que perturban profundamente la
homeostasis circulatoria. Los inhibidores de la ECA tienen la capacidad de revertir en buena parte esas
alteraciones. La ECA soluble o plasmática se produce fundamentalmente en el endotelio, aunque en
algunas enfermedades puede encontrarse en distintos fluidos biológicos. Se ha señalado que los niveles
aumentados de ECA soluble representan un factor de riesgo de enfermedad coronaria e infarto de
miocardio[31]
Aparte de su importante función endotelial la ECA participa en la patogenia de la placa
aterosclerótica. Los niveles de ECA son mayores en los homocigotas para el alelo D, menores en los
homocigotas para el alelo I e intermedios para los I/D. Hay una importante relación del genotipo ECA
DD con el desarrollo de hipertrofia ventricular izquierda sobre todo en presencia de sobrecargas,
habiéndose observado que la remodelación ventricular se presenta predominantemente en
poseedores del genotipo mencionado[16] . Se ha comprobado que la Ang II y la ECA desempeñan
un importante papel en el engrosamiento neointimal, o sea el remodelamiento vascular que se
produce cuando hay injuria, reestenosis, HTA, aterosclerosis y formación de aneurisma. Ese rol está
mediado por el receptor AT1, usando como vías la MCP-1 (Monocyte Chemoattractant Protein-1) y
la NADPH oxidasa[37]. El remodelamiento vascular que lleva a la formación de aneurisma es
contrarrestado por la inhibición de la ECA, razón por la cual se estima que el metabolismo de las
métalo-proteinasas de la matriz extracelular (MMPs) está involucrado. Aún no se conoce bien cuál
es la participación de la ECA-2 en el remodelamiento vascular aunque si se ha visto asociación con
los cambios vasculares que acompañan a la HTA y a la aterosclerosis. Hay importantes niveles de la
enzima en el lecho capilar de los pulmones, mientras que el corazón tiene bajos niveles; hay escasa
cantidad en los miocitos, aunque se observa aumento en los mismos en corazones hipertróficos, y
57
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
en los seniles: es probable que el estrés incremente sus niveles. Según Dzau y col.[37] los miocitos
pueden producir ECA activados por el estiramiento. La enzima así formada es transportada por los
macrófagos que la trasladan al intersticio. El 80% de la Ang I local se forma a través de la acción de
la renina sobre el A'geno tisular local; los mismos fibroblastos generan Ang II contribuyendo a la
fibrosis miocárdica.
Pareciera ser que se necesita un SRA local intacto para la proliferación de fibroblastos y desarrollo
de fibrosis.
ECA-2
Tipnis y col.[38] y Donoghue y col.[39] han identificado a la ECA-2, que convierte a la Ang II en Ang(1-9 (nonapéptido), que no posee acciones vasculares, pero puede ser convertida en Ang-(1-7)
(heptapéptido), que es vasodilatadora[40]. El sustrato que prefiere la ECA-2 es la Ang II, sobre la
cual ejerce su actividad catalítica, 400 veces mayor que la que actúa sobre la Ang I, y lleva a la
formación de Ang-(1-7) en la mayoría de los tejidos[29].
La ECA-2 esta formada por 805 aa, y es una
monocarboxipeptidasa de la familia de la
métaloproteinasa-zinc M-2, y se expresa en el
corazón, riñón, cerebro y vasculatura (en
particular en las CMLV de la arterias intrarrenales
y las arterias coronarias). En un principio se creyó
que se localizaba exclusivamente en el
endotelio del corazón y en las células epiteliales
tubulares del riñón, pero después se vió que
está presente fundamentalmente en corazón,
riñón, pulmón, intestino delgado y testículos.
La actividad enzimática de ECA-2 es muy
baja, por la presencia de un inhibidor
endógeno. ECA-2 forma Ang-(1-7), por
hidrólisis de Ang II, y Ang(1-9) por hidrólisis
de Ang I (esta última reacción varios cientos
de veces más lenta que la hidrólisis de Ang
II). La Ang-(1-7) puede convertirse en Ang(15) por medio de la ECA, mientras que la ECA
puede convertir a la Ang(1-9) en Ang-(1-7).
En el corazón humano los principales
productos de la degradación de Ang I son la
Ang-(1-7) y la Ang II.
La ECA-2 no actúa sobre la BK y no es
inhabilitada por los Inhibidores de la
Aunque es una ectoenzima ligada a la membrana celular,
Enzima de Conversión (IECA). Se
también presenta una forma soluble en plasma y orina. El
supone que la ECA-2 contrabalancea
TNF- escinde a la ECA-2 de su dominio ectocelular. La
los efectos de la ECA al prevenir la
ECA-2 antagoniza los efectos presores, hipertróficos, y
acumulación de Ang II en tejidos
oxidativos de la Ang II, por medio de la formación de Angdonde
ambas
enzimas
son
(1-7), que produce muchos efectos beneficiosos sobre el
expresadas. Surge de allí que la
sistema cardiovascular [40,41].
producción de Ang-(1-7) protege al
miocardio de las consecuencias de la
isquemia, al disminuir los efectos dañosos de la Ang II[42-44]. La sobreexpresión de ACE-2 se asocia
con aumento de la presencia de componentes antihipertensivos tales como Ang-(1-7) y su receptor
Mas, y el receptor AT2 [43] que llevan a disminución de la PA y a menor respuesta a la infusión de
Ang II. Es probable que el efecto hipotensor se deba más a la disminución de Ang II que a la mayor
producción de Ang- (1-7)[45]. La ECA-2 se localiza en las CE y CMLV de vasos intramiocárdicos[40].
Crackower y col.[46] han demostrado que la ECA-2 tiene efectos directos sobre la función cardiaca:
encontraron que la ablación del gen de ECA-2 en el ratón produce en el corazón adelgazamiento de
la pared muscular y marcada reducción de la contractilidad, similar a la observable en el
atontamiento cardiaco.
58
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Se ha planteado la hipótesis de que la falta de ECA-2 facilitaría los procesos inflamatorios y el estrés
oxidativo (EOx), medidos por la Ang II, NADPH, anión superóxido y peroxinitrito. En aortas de ratas
carentes de ECA-2 se ha observado aumento de las citoquinas proinflamatorias MCP-1, IL-1IL-6,
pero no de TNF-. La Ang II estimula a la proteína ligada a la actina llamada profilina-1, que activa
directamente las vías de señalamiento Akt/ERK, importantes contribuyentes del desacoplamiento
de la eNOs (causante de producción de ROS y por ellos de peroxinitrito). El déficit de ECA-2 genera
aumento de profilina-1, de actividad de la NADPH, de producción de superóxido y de peroxinitrito,
todo ello vinculado con aumento de la fosforilación de Akt, eNOs y ERK-1[47].
Se ha encontrado que tanto la ECA como la ECA-2 están sobreexpresadas en los tejidos cardiacos y
renales de animales con IC, comparados con controles sin IC, lo que permite suponer que el aumento
de la benefactora ECA-2 en la IC sirve como un mecanismo compensatorio de la actividad dañosa
de la ECA [48]. Ha surgido la hipótesis de que la falta de ECA-2 facilitaría el proceso inflamatorio y el
EOx, mediados por la Ang II y el peroxinitrito.
Habría un disbalance entre ECA y ECA-2 en pacientes hipertensos. La Ang II regula hacia arriba a la
ECA y hacia abajo a la ECA-2, en especial en presencia de nefropatía. Cuando se inhibe la ECA-2
aparece regulación hacia arriba de la ECA y activación de ERK1/2 y p38 MAPK. Habría una alteración
del balance ECA/ECA-2 en la HTA, favorecedora del aumento de la generación de Ang II (regulación
hacia arriba de ECA), y de la disminución de la degradación de Ang II (regulación hacia abajo de ECA2)[49].
Se ha puesto énfasis últimamente en la acción combinada de la ECA-2 con la apelina {50], proteína
endógena cuyos efectos biológicos incluyen vasodilatación y aumento del inotropismo cardiaco. La
apelina es un ligando endógeno para el AT1 y muestra efectos beneficiosos en casos de
reperfusión/injuria. En caso de trasplante de células de médula ósea (TCMO) en pacientes con IC,
se observa aumento significativo del nivel de apelina y mejoramiento de la función cardiaca,
acompañado de aumento de la producción de VEGF (Vascular Endothelial Growth Factor) y
mejoramiento de la angiogénesis; probablemente la sobreexpresión de apelina en caso de TCMO
aumenta la reparación cardiaca y recuperación funcional por un mecanismo que comprende
regulación hacia arriba de Sirt y de angiogénesis. Sirt pertenece a una familia de histonas y su
actividad está fuertemente ligada a la longevidad humana. La histona Sirt-3 protegería a los miocitos
cardiacos del EOx[50]. Usando experimentalmente en ratas infusiones de ECA-2 recombinante, se
observa disminución de la HTA inducida por Ang II, resultado que apoya la idea de que la alteración
del nivel renal de ECA-2 contribuye a la HTA en el ser humano, y de la expresión de profilina-1 y del
señalamiento MAPK. La sobreexpresión vascular transgénica de ACE-2 reduce la PA y disminuye la
respuesta a la infusión de Ang II[41].
Vías alternativas de formación de Ang II, aparte de las ECAs
Son importantes las vías alternativas de transformación de la Ang I en Ang II - en las que no se
requiere presencia de la ECA o ECA-2 - constituidas por enzimas, como la quimasa, tonina, catepsina
G, CAGE (Chymostatin-sensitive Ang II Generating Enzyme) y Activador Tisular del Plasminógeno[51].
La distinta distribución celular y regional en el corazón y vasos sanguíneos de estas enzimas indica
que desempeñan funciones diferentes, como por ejemplo la formación de Ang II en ausencia de ECA
en corazones isquémicos o hipóxicos. La quimasa es una serina proteinasa presente en los gránulos
secretores de las células cebadas que ha sido detectada en el líquido intersticial de miocardio
ventricular, y en algunas células endoteliales [52]. Esa localización hace suponer que participa en la
formación de Ang II intersticial; a este respecto Chen y col.[53] han demostrado la existencia de una
expresión selectiva del gen de la quimasa humana en el corazón de ratones transgénicos, abonando
59
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
la hipótesis de una doble vía de formación de la Ang II (a través de ECA y de quimasa) en el tejido
cardiaco.
Según Katugampola y Davenport[54] la quimasa es la
enzima predominante entre las que median la
conversión de Ang I a Ang II en el corazón humano. La
quimasa adquiere la capacidad de actuar
enzimáticamente transformando la Ang I en Ang II luego
de que las células cebadas son activadas por un fuerte
estímulo como puede ser la injuria vascular producida
por catéter[52]. Se ha comprobado la acción enzimática
sobre la Ang I de la quimasa en las venas dorsales de la
mano[51]. La quimasa, para generar Ang II escinde a la Ang I, en el aa fenilalaninia, en forma quizás
más eficiente que la ECA; no es inactivada por los IECAs, haciéndose responsable en parte de la
generación de Ang II en pacientes tratados por su HTA con esas drogas. La quimasa se almacena en
los gránulos secretorios de las células cebadas, y una vez expulsada por exocitosis es rápidamente
inactivada, por lo cual plantea dudas sobre que tenga gran importancia en la formación de Ang II;
aunque puede serlo cuando existe disfunción vasomotora, proliferación vascular, remodelamiento
miocárdico, formación de aneurisma abdominal y regulación de la PA[56,57]. Ahmad y col.[56] han
encontrado en miocitos de tejido auricular humano que la quimasa provoca la transformación de la
Ang-(1-12) en Ang II. El mismo efecto, aunque de mucho menor cuantía, es producido por la ECA.
La identificación de diferentes enzimas eventualmente formadoras de Ang II, originadas en otros
tipos celulares, tal como la catepsina G de los neutrófilos, establece interrogantes sobre la
importancia de la formación de Ang II por las células cebadas. Según Wei y col.[58]., cuando se inhibe
la ECA hay una disminución marcada de los niveles plamáticos de Ang II, pero luego de un tiempo
esos niveles vuelven a casi lo normal pese a mantenerse la inhibición; además hay una marcada
elevación de BK, que va a activar la liberación de quimasa por las células cebadas, manteniéndose
asi los niveles de Ang II en los líquidos intersticiales. Se ha visto que los estrógenos inhiben la
liberación de quimasa por las células cebadas, y que son responsables de la protección contra el
remodelamiento cardiaco [59]- Las vías distintas de la ECA, alternativas de formación de Ang II,
cobran importancia en procesos tales como la HC y la IC[57].
La quimasa juega un relevante
papel en la remodelación cardiaca
al aumentar la formación de Ang II
y activar sus receptores AT1 y AT2,
y así también a la MMP-9, y
además regular la expresión del
gen del colágeno I.
SRA tisular
Actualmente se reconoce que el SRA es un sistema vasoactivo dual, que actúa tanto a nivel
endocrino como a nivel paracrino[60]. Se ha demostrado la presencia de SRAs tisulares en el
corazón, vasos sanguíneos, hígado, páncreas, ovario, útero, cerebro, retina ocular, tejido adiposo,
sistemas reproductivo y digestivo, etc., aparte de la consabida y clásica presencia en el tejido renal.
Además se han descubierto distintos receptores de Ang y de vías de señalización, así como nuevos
tipos de angiotensinas (ver más adelante). Como principal ejemplo, en el riñón se encuentran todos
los componentes del SRA, incluyendo el A'geno, la renina, la ECA, y los receptores de Ang II AT1 y
AT2, y los de Ang-(1-7) y Ang IV. La presencia de A'geno, renina y ECA es fundamental para la
formación local de Ang II, independientemente de la Ang II circulante. La tesis prevalente en la
actualidad es que esos sistemas locales poseen casi completa autonomía, y que desarrollan acciones
hemodinámicas y funciones como regulación del crecimiento, diferenciación y apoptosis celular,
generación de ROS, participación en inflamación, fibrosis y secreciones hormonales. Sus acciones
serán detalladas más adelante.
Formación por aminopeptidasas de Angiotensinas distintas de la Ang II.
60
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Si bien se considera que la Ang II es el principal efector final del SRA, existen otras angiotensinas,
formadas por cadenas más cortas de aa, que ejercen trascendentes acciones biológicas. En la
generación de esas angiotensinas intervienen aminopeptidasas que actúan como enzimas
convertidoras de las mismas : la glutamil aminopeptidasa A (APA:EC 3.4.11.7), transforma al
octapéptido Ang II (äcido aspártico-arginina-valina-tirosina-isoleucina-histidina-prolina-fenilalanina
= Asp-Arg-Val-Tir-Ile-His-Pro-Fe) en Ang III, por medio de la escisión del residuo de ácido aspártico
de la terminal amino; la alanil aminopeptidasa N (APN:EC 3.4.11.2) de la membrana, escinde la
arginina de la terminal amino de la Ang III para así formar Ang-(3-8), (que en adelante llamaremos
Ang IV[61]). La Ang IV puede ser convertida en Ang-(3-7) por la carboxipeptidasa P (Carb-P) y la prolil
oligopeptidasa (PO), a través de la escisión de la ligadura prolina-fenilalanina. Por otra parte la Ang
I puede ser convertida en el heptapéptido Ang-(1-7) (Asp-Arg-Val-Tyr-Ile-His-Pro) por
endopeptidasas tisulares (se describen más adelante), que como veremos se opone en alguna forma
a los efectos de la Ang II. Existen además el dodecapéptido Ang-(1-12)[56,62] , que como ha sido
dicho se transforma en Ang II por intermediación de la quimasa, y el nonapéptido Ang (1- 9). La Ang
I es inactiva mientras que la II y la III son agonistas de los receptores AT1 y AT2. La quimotripsina es
una endopeptidasa que juntamente con la dipeptidilcarboxipeptidasa escinde la ligadura histidinaprolina, transformando a la Ang IV y a la Ang(3-7) en fragmentos peptídicos inactivos. La Ang II puede
ser convertida en Ang-(1-7) por la CarbP, por la ECA-2, o por la escisión por la ECA del dipéptido
fenilalanina-histidina de la Ang (1-9).La Ang-(1-7) es posteriormente convertida en Ang-(2-7) por
acción de la APA. Estas aminopeptidasas, involucradas en el metabolismo de las angiotensinas, han
sido denominadas angiotensinasas. La APA y la APN desempeñan un papel relevante en el control
de la PA, a nivel cerebral.. En el año 2007 Jankowski y col.[63] comunicaron sobre la existencia del
octapéptido Ang A, (Ala-Arg-Val-Tir-Ile-His-Pro-Fe), que difiere de la Ang II por poseer alanina en vez
de ácido aspártico; es de acción vasoconstrictora potente, y se deriva de la Ang II, probablemente
por transformación automática por medio de una aspartato carboxilasa derivada de los leucocitos
mononucleares. La hidrólisis catalítica de la Ang A por la ECA-2 produce el heptapéptido
denominado Alamandina.
ANGIOTENSINAS DISTINTAS DE LA ANGIOTENSINA ii. Acciones
Angiotensina III
Dado que la administración de Ang II y Ang III en los ventrículos cerebrales provoca respuestas
presoras y dipsogénicas [64], se infiere que a nivel cerebral la Ang II se transforma en Ang III. El SRA
cerebral dispone de los componentes necesarios para producir Ang II, Ang III y IV, Ang-(1-7) y Ang(3-7), que actúan por medio de los receptores AT1, AT2, AT4 y Mas. Como ha sido dicho, la APA
convierte a la Ang II en Ang III, y que la APN transforma a la Ang III en Ang IV, que a su vez – por
medio de las peptidasas Carb P y PO – se transforma en Ang-(3-7). La quimiotripsina puede escindir
a la Ang IV y a la Ang-(3-7), convirtiéndolas en péptidos inactivos.
61
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Para evitar la transformación
de Ang II en Ang III se ha
usado experimentalmente
con aplicación intracerebral
un inhibidor de la APA,
observándose un bloqueo de
la elevación de la PA en SHR
(Spontaneous Hypertensive
Rats):
estos resultados
indican que la respuesta
presora depende de la conversión de Ang II en Ang III[64-66]. La Ang III usa como ligando al receptor
AT1. Como ha sido dicho más arriba la APN transforma a la Ang III en Ang IV: la inhibición de la
aminopeptidasa provoca acumulación de Ang III y aumento de la PA, y a la inversa su administración
la disminuye. La inhibición de APA reduce la PA a niveles normales en modelos experimentales de
ratas hipertensas[64]. Por esa razón tanto la Ang III como las aminopeptidasas A y N, son
actualmente eventuales blancos de la terapéutica de la HTA.
La Ang III produce efectos similares a los de la Ang II, aunque
menos potentes. Usa como ligando al AT1. Provoca aumento
de la PA en voluntarios sanos y en hipertensos, estimula la
secreción de aVP y aumenta la sed, cuando se la inyecta en
vasos cerebrales. Reduce la natriuresis. Estimula la expresión
de factores de crecimiento, de mediadores proinflamatorios y
de proteínas de la matriz extracelular (aumenta la síntesis de
colágeno).
En ratas tratadas previamente con Ang III y sometidas a isquemia miocárdica, seguida luego de
reperfusión, se observó aumento de la PFD y una disminución de la presión posisquémica
desarrollada, comparando con ratas no tratadas [65]. La Ang III disminuyó marcadamente el tamaño
del infarto de miocardio y los niveles de dehidrogenasa láctica, luego de reperfusión. El tratamiento
previo pre-isquemia con un antagonista del receptor AT2 atenúa las mejorías de PFD y dP/dt
inducidas por la Ang III. El tratamiento con Ang III aumenta los niveles de superóxido dismutasa
(SOD), catalasa y heme oxigenasa-1. Se supone que los efectos protectores cardiacos de la Ang III
están parcialmente relacionados con la activación de sustancias antioxidantes y antiapoptóticas.
Estos resultados experimentales son válidos cuando los inhibidores son suministrados
intracerebralmente, mientras que la administración endovenosa provoca solamente un bloqueo
limitado de la conversión de Ang II en Ang III.
Angiotensina IV
La Ang IV, también llamada Ang-(3-8), es otro fragmento de la Ang II, formado por la acción somática
de la APA y la APN, enzimas que también pueden transformar a la Ang I en Ang IV, antes de la
conversión a Ang II. La Ang IV posee un receptor, el AT4, que es una aminopeptidasa regulada por la
insulina (Insulin Regulated AminoPeptidase = IRAP), que se expresa fundamentalmente en el riñón,
porque allí las aminopeptidasas son particularmente abundantes, en especial en las membranas del
nefrón proximal, lugar de preferencia para la transformación de la Ang II en Ang IV (también puede
hacerse en el glomérulo).
Harding
y
col.[66]
El AT4-IRAP actúa como intermediario de una serie de acciones
descubrieron al AT4 en el año
de la Ang IV, que incluyen regulación de la PA, mejoramiento de
1992: se lo encuentra en
la memoria y de la capacidad de aprendizaje, incremento del
cerebro,
riñón,
corazón,
flujo sanguíneo cerebral[66], neuroprotección, mejoramiento de
pulmón y suprarrenalesTiene
la sinaptogénesis aumento de la reabsorción tubular de Na+ y
acciones sobre el crecimiento
natriuresis, expresión de PAI-1 (Plasminogen Activator Inhibitorde fibroblastos cariacos, CE y
CMLV. Cuando el endotelio
1), y proliferación celular. Esos efectos no son abolidos por
está intacto la Ang IV induce
antagonistas de los receptores AT1 o AT2 [67-69].
vasodilatación; en las CE
62
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
pulmonares incrementa la actividad de la eNOs y del GMPc, mientras que en el corazón acelera la
relajación ventricular..
.
Angiotensina-(1-7) [70-79]
La Ang II es hidrolizada por la ECA-2, y se convierte en el heptapéptido Ang-(1-7) (Asp-Arg-Val-Tyr-IleHis-Pro).. También se puede formar Ang-(1-7) por acción de la ECA sobre la Ang-(1-9), o por un
mecanismo enzimático independiente de la ECA-2, constituido por aminopeptidasas tisulares
específicas que escinden a la Ang I, como la neprilisina (NEP), la Prolilendopeptidasa (PEP); la Thimet
Oligopeptidasa (TOP) y la prolil carboxipeptidasa (PCP).
La NEP (EC 3.4.24.11), también llamada endopeptidasa neutra o neprilisina, hidroliza a la Ang I en la
circulación y la transforma en Ang-(1-7). La TOP (EC 3.4.24.15) lleva a la Ang I a Ang-(1-7) en las CMLV.
La PCP (EC 3.4.24.26) se encuentra en el cerebro canino, en células vasculares aórticas y en venas
umbilicales. La NEP está ligada a la membrana y por su condición de endoluminal se convierte en la
principal productora enzimática de Ang-(1-7) de la circulación,(es particularmente abundante en el
riñón). La NEP también posee capacidad de degradar al PNA, así como a la misma Ang-(1-7),
transformándola en Ang-(1-4)[76]. La Ang-(1-7) es hidrolizada y transformada en el producto inactivo
Ang-(1-5) por la ECA. La Ang-(1-7) y su receptor Mas (perteneciente a la familia de los GPCR), han
quedado establecidos como muy importantes componentes biológicamente activos en el SRA. Hay
una alta preferencia de la ECA-2 hacia la Ang II, por lo cual se explica la mayor importancia de la
enzima en la regulación del balance entre Ang II y Ang-(1-7). En un principio se pensó que la
inactivación de los genes que codifican a la NEP y a la ECA-2 podría provocar ascenso de la PA, pero
se comprobó - por lo contrario - que se causa caída de la PA. Ni la inactivación de Mas o de la ECA-2
produce efectos sobre la PA sistólica (la ECA-2 provoca descenso de la PA en ratones mayores de tres
meses de edad que al mismo tiempo presentan disminución de la contractilidad cardiaca). Es
probable que la ECA-2 actúe depurando Ang II. La afinidad de la Ang II para sus receptores es de cerca
de mil veces mayor que la que tiene para la proteasa que la convierte en Ang-(1-7), y explica porque
mucho tiempo antes de que se haya alcanzado la cantidad suficiente de Ang II - como para alimentar
la generación de vasodilatación vía Ang II/ECA-2/Ang-(1-7) – el receptor vasoconstrictor estará
saturado. Pero si se bloquea el AT1 la Ang II se acumulará y se convertirá en Ang-(1-7). Los niveles de
Ang-(1-7) aumentan casi 25 veces después de la inhibición de Ang II con IECA o con Bloqueador del
Receptor de Angiotensina (BRA). ECA-2 es particularmente abundante en la circulación coronaria,
donde desempeña un importante papel como productora de Ang-(1-7)[83]. Se ha demostrado la
expresión de ECA-2 y de NEP en los miocitos cardiacos [84], haciendo suponer que estas enzimas y
ciertos integrantes del SRA se sintetizan localmente. La Ang II regula hacia abajo a la ECA-2,
interfiriendo en algo en su transformación en Ang-(1-7), por lo cual los procesos que favorezcan la
producción de Ang II causarían mayor daño en el corazón [85].
La aldosterona (ALDO) modula los niveles del mARN de la ECA-2 [88]. La ET-1 reduce significativamente
el mARN de la ECA-2 vía MAPKK-1 (Mitogen Activated Protein Kinase Kinase-1). La Ang-(1-7), por medio
de su receptor Mas bloquea la regulación hacia abajo de la expresión de ECA-2 producida por la Ang II
y la ET-1[83]. La Ang-(1-7) potencia la acción vasodilatadora de la BK por medio de la liberación de
prostaglandinas, NO y EDHF (Endothelial Derived Hyperpolarizing Factor) e inhibe el crecimiento de
63
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
CMLV; es vasodilatadora en muchos lechos vasculares, incluyendo el coronario (perros y cerdos), el de
la aorta en la rata y de la arterias mesentéricas en los felinos.
La vasoconstricción de la arterias humanas inducida por Ang II es bloqueada por la Ang-(1-7).
Contrarresta los efectos profibróticos en el corazón y vasos sanguíneos de la Ang II, así como los
arritmogénicos. Además produce efectos aterogénicos y antitrombóticos; inhibe el EOx y la
producción de ROS, y modula la función hematopoyética. A estas acciones debe agregarse su
capacidad antioxidativa y antiinflamatoria [85]. La Ang-(1-7) activa la PI3-K (Phosphatidylinositol 3kinase), que sigue la vía Akt (Protein Kinase B), que por medio de la sintasa 3 del NO, activa a este
mismo[89]. Los efectos antihipertrofia de la Ang-(1-7) son mediados por el receptor Mas [85]. Estas
investigaciones abonan las evidencias de que la vía NO/GMPc es fundamental en la cascada Ang
II/ECA-2/Ang-(1-7)/NO/GMPc. De esta forma se estima que el NO es el mediador de los efectos
beneficiosos de la Ang-(1-7), y se señala la importancia del GMPc. Las ratas transgénicas con altos
niveles plasmáticos de Ang-(1-7) tienen a su vez mas altos niveles de la sintasa neuronal de NO en los
miocitos ventriculares[85]. Según Bosnyak y col.[88] la Ang-(1-7) ejerce acción vasodilatadora por
medio de Mas y el receptor AT2, efecto particularmente observable en la rata añosa.
La Ang-(1-7) modula la actividad del NFAT (Nuclear Factor of Activated T Cells), regulador de
genes prohipertrofia. También se ha detectado capacidad antiinflamatoria de la Ang-(1-7). Se
estudian actualmente los efectos de la Ang-(1-7) sobre el “transient” de Ca2+, es decir, su influencia
sobre como el tráfico de Ca2+ gobierna la contractilidad cardiaca. La Ang-(1-7) está presente en el
tejido cerebral participando en la regulación de la PA. En el NTS provoca bradicardia y respuesta
vasodepresora y aumento del control barorreflejo de la frecuencia cardiaca, efectos que se ven
aumentados en animales hipertensos. En la zona RVLM produce respuestas presoras mientras que
en la zona caudal (CVLM) provoca descenso de la PA al inhibir el efecto presor de la zona rostral. El
grupo de investigadores conducido por Ferrario [70] ha sido de los primeros en estudiar las acciones
de la Ang.(1-7), y han establecido que representa un factor contrarregulador intrínseco de los
efectos presores y tróficos de la Ang II; han demostrado que los efectos hipotensores de los IECA se
asocian con niveles urinarios y plasmáticos elevados de Ang-(1-7) [76]. Han observado además que
el antagonismo AT1 atenúa el remodelamiento y la disfunción cardiaca, interviniendo en ello
incrementos de la expresión de ECA-2, y que ejerce de esa forma efectos protectores contra la
injuria-reperfusión y las arritmias. En la HTA y en la IC la activación excesiva del SNS interviene
poderosamente en su fisiopatogenia: factores humorales como la BK, adenosina y las ROS,
producidos en el miocardio en caso de isquemia, estimulan a los nervios simpáticos cardiacos
aferentes, y dan lugar a los reflejos simpáticos aferentes cardiacos (CSAR= Cardiac Sympathetic
Afferent Reflex) que tienen características de retroalimentación positiva, que aumenta la actividad
simpática y la PA. El CSAR es modulado e integrado por el NTS y en la zona RVLM. La Ang-(1-7), el
NO, la ET-1, y el H2O2 y otras moléculas de señalamiento están involucradas en la regulación de CSAR
[89].
Angiotensina-(1-9)
La ECA-2 escinde la terminal carboxilo de los aa de la Ang I, transformándola en el nonapéptido
Ang-(1-9)[39], que potencia la vasoconstricción producida por la Ang II (ratas). En el ser humano los
niveles plasmáticos de Ang-(1-9) duplican a los de Ang II[34]. La Ang-(1-9) incrementa la acción de
la BK sobre sus receptores B2 interactuando con la ECA. Estimula al ANP (Atrial Natriuretic Peptide)
con la mediación del receptor AT2 [89], siguiendo la vía AT2/PI3K/Akt/NO/GMPc, camino a través del
cual también lograría un efecto antirremodelamiento[90].
Angiotensina-(1-12)
64
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Es un propéptido proveniente del clivaje del A'geno, que se supone actúa como precursor de la
formación local de Ang[70] , cuando hay ausencia de renina circulante. La quimasa, actúa sobre la
Ang-(1-12) y la transforma en Ang II, y así establece una vía donde está excluída la renina. Se ha
encontrado Ang-(1-12) en tejido renal y cardiaco de ratas normotensas e hipertensas, aunque
fundamentalmente en los miocitos y en menor cantidad en el endotelio de las coronarias .
Microinyecciones de Ang-(1-12) en el Núcleo Arqueado del hipotálamo provocan aumento de la PA
media, y de la frecuencia cardiaca, y mayor actividad de los nervios esplácnicos [91] . Las reaciones
a la Ang-(1-12) se atenúan con antagonistas de los receptores AT1: cuando se inhiben ECA y quimasa
se suprimen los efectos de esta forma de angiotensina. La Ang-(1-12) estimula a las neuronas a
través de los receptores AT1, presentes en la zona RVLM raquídea, adonde inyecciones de Ang-(112) provocan descenso de la PA media, de la frecuencia cardiaca y de la actividad nerviosa simpática.
Esas reacciones son bloqueadas por un IECA, indicando la importancia de la presencia de la ECA para
esas acciones. Inyecciones de Ang-(1-12) en la zona CVLM modula las respuestas barorreflejas [92].
Angiotensina A
Ha sido mencionado más atrás el descubrimiento por Jankowski y col.[63] de la Ang A, un nuevo
octapéptido derivado de la Ang, constituido por los aa Ala-Arg-Val-Tyr-Ile-His-Pro-Phe, que se
encuentra en pequeñas cantidades en el plasma de individuos normales, aunque aumentadas en
caso de insuficiencia renal severa terminal[93]. Se produce al decarboxilarse el aa Asp de la Ang II
en presencia de leucocitos mononucleares y es un agonista parcial que tiene la misma afinidad que
la Ang II por el receptor AT1, pero más alta afinidad por el AT2. Las respuestas a la Ang II y a la Ang A
son similares. Pareciera que la Ang A no interviene mayormente en la regulación de la PA y de la
hemodinámica renal.
Angioprotectina
En el año 2011 Jankowski y col.[94] comunicaron la existencia de un nuevo octapéptido (ProGluVal-Tyr-Ile-His-Pro-Phe), que posee los aa prolina y ácido glutámico en vez de los aa ácido aspártico
y arginina de la Ang II. Se origina probablemente por medio de una transformación enzimática de la
Ang II. Contrarresta los efectos vasoconstrictores de la Ang II, y usa al Mas como receptor (tiene
mayor afinidad que la Ang-(1-7) por este receptor). Los niveles de angioprotectina se encuentran
elevados en casos de insuficiencia renal crónica severa.
Alamandina
Es una nueva angiotensina , formada a partir de la hidrólisis catalítica de la Ang A (por la ECA-2) y
presenta alanina en la terminal amino; su receptor es el MrgD (Mas-related-G-coupled receptortype D) [95]. Tendría acciones similares a las de la Ang-(1-7). Alamandina se liga a MrgD e induce
vadolitación al estimular al NO endotelial. En vasos sanos alamandina aumenta la vasodilatación de
la aorta y de la arteria ilíaca producida por la acetilcolina.
Acciones de la Angiotensina II
La Ang II cumple distintas funciones fisiológicas, que entre otras incluyen vasoconstricción,
liberación de aldosterona, facilitación de la actividad simpática, estimulación de la producción
de Arginina Vasopresina, y crecimiento celular. Desempeña además un papel central en la
65
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
regulación hidroelectrolítica, control de la PA y remodelamiento cardiovascular. Sus acciones se
ejercen luego de ligarse a sus receptores, poniendo en marcha complejos sistemas de
señalamiento que trasmiten información a proteínas intracelulares participantes en la
contracción y relajación vascular y miocítica, crecimiento, migración, mitogénesis, apoptosis,
autofagia, diferenciación, y proliferación celular[17].
La mayoría de los efectos se produce vía Ang II/ECA/AT1, explicando el porqué del uso de
Inhibidores de la ECA (IECA) o de Bloqueadores del Receptor de Ang II (BRA) en el tratamiento de la
HTA, y en la IC (donde uno de los ejes donde gira su fisiopatología es la acción perjudicial de la Ang
II). La Ang II promueve el crecimiento de distintas células, incluyendo las mesangiales, las
endoteliales y las musculares lisas.
Acciones estructurales y funcionales sobre el corazón y vasos sanguíneos
La Ang II activa una cascada de señales (MAPKs, inositol-1,4,5-trifosfato [I3P] y a la fosfolipasa C), e
inhibe la adenilciclasa[20], provocando vasoconstricción, retención de Na+ por el riñón, hipertrofia
y proliferación celular, fibrosis tisular e inflamación[17]. Como contrapartida la estimulación de AT2
inhibe el crecimiento y proliferación del músculo liso vascular y cardiaco, estimula apoptosis, y
promueve síntesis de la matriz extracelular. La estimulación crónica del receptor AT1 lleva a HC y
fibrosis, mientras que las señales que inicia el AT2 llevan a la cascada BK-NO-GMPc, produciendo
vasodilatación, desfosforilación proteica, y estimulación de fosfolipasa A-2.
El tono vascular adecuado se mantiene por un balance entre la producción endotelial de
vasodilatadores como el NO y PGI2 y vasoconstrictores, como la Ang II y la ET-1. El endotelio libera
citoquinas y factores de crecimiento que modifican las condiciones celulares de los tejidos[16]; la
disfunción endotelial se asocia a vasculopatías, favorece la presencia de vasoconstricción, e
induce expresión de factores locales como citoquinas proinflamatorias, quimioquinas, moléculas
de adhesión, y PAI-1 (Plasminogen Activator Inhibitor-1) - con resultantes procesos inflamatorio y
trombosis - que afectan la capacidad inhibitoria del NO sobre la migración y el crecimiento de
CMLV. La disfunción endotelial favorece el espasmo vascular, la proliferación de CMLV, la trombosis
y el EOx[17]. Los efectos proinflamatorios de la Ang II en la pared vascular se suman a los de otros
factores de riesgo, como la dislipidemia, el tabaquismo, y la diabetes mellitus. En ratones se ha
logrado producir aneurismas de aorta abdominal (AAA) por medio de la infusión de angiotensina II,
que produce acumulación progresiva de leucocitos, degradación de la matrix extracelular,
expansión luminal y trombosis. La inhibición del AT1 o drogas como los IECAs o los BRAs reducen
sustancialmente la formación de AAA en ese modelo experimental, asi como lo logra la estimulación
de producción de ECA-2 [96]. El AAA es causa mportante de mortalidad, y tiene una
prevalencia de 5-7% en mayores de 64 años [97].
La Ang II ejerce poderosas influencias sobre la acumulación colágena en los tejidos y la migración
celular. Es muy importante el papel que desempeña en el mantenimiento de la integridad anátomofuncional de la pared arterial y en los procesos que regulan la PA. Como factor causal en el desarrollo
de fibrosis actúa directamente sobre los fibroblastos (probablemente a través de receptores AT1
que median una respuesta mitogénica e inducen expresión de genes de matriz extracelular) [98,99].
Esos receptores también influencian la contracción de las gelatinas colágenas por los fibroblastos y
66
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
la expresión de integrinas. La Ang II estimula la síntesis de colágeno y el crecimiento de las CMLV en
cultivo y promueve la proliferación de células simil-fibroblasto ; parece ser responsable – directo, o
en combinación con factores de crecimiento - de la acumulación de colágeno fibrilar en el intersticio
cardíaco en la enfermedad hipertensiva. En la producción de colágeno intervienen factores
generados por los miocitos que interactúan con los fibroblastos: como el TGF-β, la osteopontina
(OPN) y la ET-1[100]. La OPN, que procede de los miocitos cardiacos, parece ser una importante
mediadora del remodelamiento inducido por Ang II. La ET-1 estimula la producción de colágeno I y
III en las CMLV coronarias. La Ang II atenúa la producción de MMPs y aumenta la de TIMP-1 (TissueInhibitor MetalloProteinase-1) por las CE, y además regula el sistema funcional miocítico de
aldosterona, de muy importante papel en la fibrosis cardiaca. Hay evidencias que vinculan a la OPN
como mediadora crítica de los efectos cardiacos proinflamatorios y profibróticos de la Ang II. La OPN
interactúa con receptores de adhesión, y su función es alterada por enzimas como la trombina y
kinasas. Se ha encontrado elevada expresión del mRNA de la OPN en el ventrículo izquierdo
hipertrofiado y fibrótico de ratas con altas concentraciones miocárdicas de Ang II. En el ser humano
la hipertrofia y fibrosis miocíticas muestran una importante inmuno-reactividad para la OPN. En
cultivos de células cardiacas y endoteliales se ha demostrado que la Ang II estimula la expresión de
OPN, probablemente por acción de las ROS y las MAPKs, actuando como mediadora la
aldosterona[100]. La Ang II afecta la función cardíaca y el crecimiento miocítico, como es notorio
cuando en el tratamiento de la HTA con IECAs se logra reversión de la HC, efecto no observable con
otras drogas hipotensoras, por lo que se colige que tal reversión no depende exclusivamente del
descenso de la PA. Promueve crecimiento miocítico a través de receptores AT1 que inducen
fosforilación de MAPK y de caminos de señalamiento, con contribución del receptor de EGF
(Epidermal Growth Factor) [101]. Durante el desarrollo de HC en la HTA, la alteración del colágeno
y de sus fenotipos se produce especialmente durante la fase crónica de la misma, tanto en humanos
como en ratas, y el captopril provoca, juntamente con normalización de la PA, regresión de la HC y
reversión de la alteración de los fenotipos de colágeno. La Ang II contribuye importantemente a la
producción de HC, en parte a través del TGF-β1, factor este que influencia importantemente la
producción de matriz extracelular por los fibroblastos – en especial de colágeno y fibronectína característica del proceso de reparación. La fibronectina es un indicador sensible de cambios en el
fenotipo de los fibroblastos cardíacos, y su presencia precede la apariencia morfológica de
fibrosis[102]. El TGF-β requiere para la acción citada factores de apoyo, tales como proteínas
receptoras o activadoras. Ha sido dicho más atrás que la activación del AT2 se opone al efecto
causante de HC del AT1 [24] y que la inhibición del AT2 amplifica el aumento del crecimiento
propuesto por el AT1. Según Leri y col.[103] la Ang II puede inducir apoptosis de miocitos aunque
no de fibroblastos. En la HC la Ang II deprime la función diastólica, y los IECAs la mejoran[104,105].
En la sobrecarga de presión hay aumento de expresión del mARN del A'geno y del receptor AT1 en
el ventrículo. El A'geno se muestra aumentado en el subendocardio y presenta una distribución
similar a la del ANP [106]. El ANP regula los niveles de mARN de renina y A'geno en los fibroblastos
cardíacos recién formados[107]. Se ha postulado que la Ang II es la responsable directa de la HC;
de allí la importancia que se le asigna a su receptor, el AT1, ubicado en la superficie de los miocitos
cardíacos. Los IECA, los bloqueantes -adrenérgicos y los antagonistas cálcicos reducen la HC,
siendo los efectos más pronunciados con los primeros [108]. La Ang II puede actuar directamente
sobre el miocito para influenciar el crecimiento celular[109,110] . La activación a largo plazo del
SRA cardíaco lleva a HC, que es independiente de los niveles sistémicos de Ang II. Puede suceder
67
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
que el sistema local autacoide de SRA esté activado selectivamente en el corazón sobrecargado, y
que la Ang II circulante permanezca en niveles normales. El aumento del estrés de pared activa al
SRA, con consiguiente incremento de la Ang II, quien sería la responsable de la mayor rigidez
cardíaca y del remodelado (y de la fibrosis). Se observa además, en la IC, activación del gen de la
ECA. El efecto de la Ang II sobre la masa ventricular no se correlaciona con la presión sistólica[109],
aunque se ha señalado que el estiramiento mecánico induce HC y aumento del inotropismo.
Cingolani y col.[111] han demostrado que la Ang II activa al receptor ETA de la ET-1, generando
aumento de la producción de ROS, estimulación del intercambiador Na+/H+ (NHE), y activación del
intercambiador Na+/Ca2+ (NCX) (modo reverso), que provoca incremento de la concentración
intracelular de Ca2+ y de allí mayor contractilidad. La Ang II está fuertemente involucrada como
causante de la existencia de HC, remodelamiento y apoptosis. Estos efectos se deben al accionar del
SRA sistémico y del o de los SRAs tisulares locales. El estiramiento de los miocitos vinculado a la
presencia de sobrecarga, estimula la liberación de Ang II, que actúa como mediador inicial de la
respuesta hipertrófica. La interrelación de efectos producidos por la Ang II y los vinculados al
estiramiento de los miocitos (como pasa en la HTA) puede estar involucrada en el efecto Anrep
(lenta respuesta de fuerza al estiramiento)[112], a través de la vía Ang II/ET1/NADPH/ROS/NHE/NCX[25,113,114]. 3
En la HTA esencial hay correlación entre tasas correspondientes de excreción de Na+ y exagerada
respuesta de HC. De esta forma puede inferirse que una inadecuada supresión de Ang II favorecerá
cambios estructurales del VI en respuesta a un aumento de carga. En este caso también se
encuentra una elevada (inapropiada) concentración de aldosterona, causante del aumento del
contenido miocárdico de colágeno[113]. En la HTA - durante la fase crónica de desarrollo de la
HC[114-116] – se observa alteración del colágeno y de sus fenotipos. La Ang II, aisladamente o
particularmente en combinación con otros factores de crecimiento, tiene un significativo efecto en
la producción de colágeno; allí intervienen importantes factores generados por los miocitos
cardiacos que interactúan con los fibroblastos. Takizawa y col.[117] sugieren que el NO modula la
proliferación de fibroblastos inducida por la Ang II durante la fibrosis cardíaca. Los efectos sobre
fibroblastos de la administración de Ang II se exacerban cuando se agrega un inhibidor de la sintasa
del NO; luego de la activación de AT1 se produce una cascada de señales intracelulares que inician
la transcripción de genes específicos cardíacos. Están involucrados las familias MAPK y la JAK/STAT
tirosina-kinasa (Janus-activated kinase/Signal Transduction and Activators Transcription), que
inducen la expresión del proto-oncógeno c-fos[12,118,119] . En los vasos el estiramiento de las
CMLV activa la MAPK siendo intermediarios la Ang II y la ET-1[120]. La Ang II aumenta la producción
de ET-1 en la pared de los vasos sanguíneos: ha sido probada la acción mitogénica e inductora de
síntesis proteica de la ET-1 en CMLV en cultivo. Es un poderoso mitógeno para muchos tipos
celulares: induce hipertrofia e hiperplasia de las CMLV, por efecto directo a través de la vía ERK, o
indirectamente al aumentar la producción de TGF-β (Transforming Growth Factor beta), PDGF
(Platelet Derived Growth Factor), FGF (Fibroblast Growth Factor), PAF (Platelet Activated Factor),
IGF-1 , ET-1 , y OPN, destacándose entre ellos el PDGF y el TGF-β[12]..
3
.- En la HC patológica es crítica la participación del NHE, mientras que en la HC fisiológica el NHE parecería no estar activado
(probablemente por inhibición por Akt). Yeves AM, Villa-Abrile MC, Pérez NG, Medina AJ, Escudero EM, Ennis I. Phisiological cardiac
hypertrophy: critical role of AKT in the prevention of NHE-1 hyperactivity. J Mol Cell Cardiol 2014;76:186-95
68
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Se ha visto que la fosfatasa-1 MAPK (activada por el AT2) está involucrada en la apoptosis [121,122],
y que se inhibe cuando se fosforila (activa) el Bcl-2, que es antiapoptótico. La activación del AT2
inhibe la activación de la MAPK, provocando inactivación de Bcl-2 e inducción de apoptosis[123].
Ha sido dicho que dentro de los efectos vasculares de la Ang II están las trombosis[16]. El endotelio
produce t-PA, de acción crucial en la fibrinolisis endógena. La Ang II inhibe la fibrinolisis al aumentar
la expresión de PAI-1 (Plasminogen Activator Inhibitor-1). Los IECA aumentan la expresión de tPA
inducida por BK, y el bloqueo del receptor AT1 también mejora el comportamiento fibrinolítico[124].
Se concluye que el SRA sistémico y el local están involucrados en el remodelado estructural de los
compartimientos miocítico y no-miocítico, y así se explica el efecto “cardioprotector” de los IECAs y
BRAs. El propranolol bloquea la necrosis miocítica y el daño de la vasculatura coronaria causada por
Ang II . Este daño sería iniciado por la liberación local de catecolaminas facilitado por la Ang II, aunque
la injuria sería leve y corta por la regulación hacia abajo de receptores que se ve al tercer día. También
tienen influencia los receptores α1-adrenérgicos. La producción de matriz extracelular por los
fibroblastos cardiacos es una muy bien caracterizada característica del proceso de
reparación[99,125,126]. Además la Ang II aumenta la producción endotelial de ET-1[25], efecto que
se revierte con un antagonista de la ET-1[126].
Puede afirmarse que el aumento crónico de los niveles de Ang II es un determinante mayor en la
fisiopatología de la HC y la IC congestiva. Krüger y col.[127] han demostrado que la Ang II puede
promover un cambio en la expresión de las isoformas de titina, con subsecuente modulación de la
rigidez miocárdica, más aumento de la sensibilidad al
El receptor AT2 inhibe el crecimiento
Ca2+, y de eventos de señalamiento mecanoeléctricos,
independientemente
de
otros
miocítico. En el corazón insuficiente
mecanismos productores de hipertrofia.
hay disminución de la expresión de AT1
y aumento de la de AT2.
Experimentalmente, los ratones carentes de AT2
tienen regulación hacia debajo de la sintasa del NO y
reducción de los niveles de GMPc[126]. Oishi y col.[129] demostraron que los ratones carentes de
AT2 presentan después de infarto de miocardio, mayor cuantía de HC y remodelamiento,
acompañados de disfunción sistólica y diastólica, y mayor mortalidad, en comparación con ratones
sin carencia del receptor. Los receptores AT2 activan la cascada BK/NO/GMPc y estimulan las
enzimas proteína tirosina fosfatasa y serina/treonina fosfatasa: la primera inactiva a la MAPK
activada por el receptor AT1, y la segunda revierte las respuestas mitogénicas y pro-hipertrofia
inducidas por el AT1[56,130].
Efectos renales
En la IC, como consecuencia de la disminución del volumen minuto y de la hiperactividad simpática
se activa en el riñón el SRA, pero también puede ocurrir que el sistema local cardiaco autacoide de
SRA esté activado selectivamente en el corazón sobrecargado, y que la Ang II circulante permanezca
en niveles normales[131]. El eje renina/ECA/Ang II/AT1 provoca aumento de la PA, vasoconstricción
renal, disminución de flujo renal y de la tasa de filtración glomerular (FGL), estimulación del
transporte de Na+ en el túbulo proximal y aumento de la concentración de la orina, mientras que el
eje ACE-2/Ang-(1-7)/Mas, que actúa mediante la inhibición de las vías dependientes de la MAPK o
de la COX-2, o por medio de estimulación de la vía BK/NO/GMPc, se opone al accionar del primero,
reduce la PA, y provoca vasodilatación de vasos intrarrenales, con aumento del flujo renal y del FGL,
inhibiendo el transporte de Na+ del túbulo proximal e induciendo diuresis[131,132]. Es fundamental
la existencia de un balance entre los dos ejes mencionados: por ejemplo el accionar en exceso del
69
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
primero está fuertemente involucrado en la fisiopatogenia de enfermedades renales agudas o
crónicas, El mal comportamiento del eje ACE-2/Ang-(1-7)/Mas se asocia con aumentos de la PA o
de isquemia renal aguda e injuria de reperfusión[34,132] .
Cuando se administra por vía endovenosa una baja dosis de Ang II se observa aumento de la
resistencia vascular renal y disminución del flujo renal, sin que se afecte el filtrado glomerular
(FGL), con lo cual aumenta la fracción de filtración (FrF), o sea la relación entre FGL y flujo
plasmático renal. Con dosis mayores - aparte de la reducción del flujo renal - aparece caída del
FGL, aunque la FrF permanece elevada, dado que la disminución de FGL es proporcionalmente
menor que la del flujo sanguíneo
Quiere decir que la limitada activación del SRA produce principalmente aumento de los niveles de
Na+ tubulares, mientras que cuando la activación es intensa (p.ej. cuando hay una caída importante
del volumen sanguíneo circulante), la Ang II reduce el flujo renal que ayudará a sostener a la PA
mientras estimula la reabsorción de Na+. El Na+ se reabsorbe principalmente en el túbulo proximal,
lugar de localización preferente del receptor AT1. Si los niveles de Ang II son altos, se inhiben los
transportadores Na+-H+, Na+CO3 y Na+-K+-ATPasa. La estimulación del receptor AT1 provoca
vasoconstricción y retención de Na+, mientras que la de AT2 genera vasodilatación y natriuresis
(estos últimos efectos mediados por NO, BK y GMPc). El SRA cumple funciones endocrinas,
paracrinas e intracrinas en el riñón. En el riñón está presente la mayoría de los componentes del
SRA, incluyendo el A'geno; ECA y ECA-2; receptores AT1,AT2, AT4 y Mas; Ang-(1-7); y Ang III y IV. Hay
un mecanismo barorreceptor que sensa la caída de presión sanguínea en la arteriola aferente e
inicia la estimulación de la secreción de renina. La PA debe descender a menos de 90 mms de Hg,
para que se estimule la secreción de renina y se active el SRA, como forma de reestablecer el
equilibrio hemodinámico. No se conocen - en toda su extensión - cuales son los mecanismos
involucrados en la transducción de las señales dadas por la caída de presión y la liberación de renina,
aunque se sabe que participan los canales de Ca2+ activados por estiramiento, la ET-1 y las
prostaglandinas. Aparte del estímulo por caída de presión, la producción de renina es estimulada
por la activación simpática. Otra forma de estimulación de producción de renina es la disminución
crónica del aporte de ClNa a la mácula densa (intervienen mediadores como la adenosina, el NO y
prostaglandinas). Se ha visto, además, que existe un control metabólico de la secreción de renina:
intervienen el α-glutarato y el succinato (provenientes del ciclo de Kerbs) como ligantes de GPCR,
que por esa vía activan a las ERK172 y las MAPK[133].
Los receptores AT1 se encuentran en abundancia en las arteriolas aferentes y eferentes, en células
mesangiales y endoteliales y en podocitos. También están presentes en las células medulares
intersticiales, entre los túbulos renales y los vasa recta. La Ang II induce reducción de la FGL y del
flujo plasmático glomerular e incrementos de la resistencia vascular tanto de las arteriolas
glomerulares aferentes como de las glomerulares eferentes. La disminución del FGL sería una
consecuencia de la reducción del coeficiente de ultrafiltración glomerular (Kf), efecto
probablemente debido a cambios en la contractilidad de células mesangiales. Cuando por disfunción
endotelial disminuye la producción del NO, aumentan marcadamente las respuestas a la Ang II de
las arteriolas aferentes.
La Ang II modula (aumenta) la sensibilidad del mecanismo de retroalimentación túbulo-glomerular
(aunque no es mediadora directa): trasmite señales a las arteriolas aferentes y células mesangiales
a nivel de la mácula densa, para que se dilaten o contraigan – para así mantener la estabilidad de la
carga filtrada - cuando varía la concentración de los solutos en el fluido tubular. Otro efecto
importante de la Ang II es el de retención de Na+. Cuando hay altos niveles de la hormona se
producen retenciones de Na+ y H2O a través de acciones directas sobre el transporte tubular renal.
70
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
El A'geno se expresa en las células del túbulo proximal renal [36,131] y asi estimula la tasa de
reabsorción proximal de Na+, y continua su camino hacia los segmentos distales del nefrón, dando
lugar a mayor formación de Ang I y Ang II. Se han demostrado niveles urinarios aumentados de
A'geno en hipertensos no tratados con bloqueantes beta-adrenérgicos o IECAs, y que esos mayores
niveles del sustrato se correlacionan con la PA en humanos. El receptor de prorrenina se localiza en
el pulmón. cerebro, placenta y riñones. La renina y la PRen se localizan primariamente en las CYGR,
arteriolas aferentes e interlobulares, donde se activa la renina por disminución de la concentración
de Na+. La activación por la Ang II estimula la producción de aldosterona, que produce retención de
Na+ y excreción de K+ través de los receptores mineralocorticoides en los segmentos cortical y de
conexión del túbulo colector. La Ang II aumenta las concentraciones urinarias en el túbulo colector
y en los conductos conectores. Tiene importancia fundamental en esos aspectos la formación
intrarrenal de Ang II.
El efecto antinatriurético de la Ang II se produce más por aumento de la reabsorción tubular que
por la reducción de FGL. En concentraciones fisiológicas la Ang II estimula la reabsorción tubular
proximal, mientras que si son más altas la disminuyen. La reabsorción del Na+ se acopla con la de
bicarbonato (mediada por inhibición de la adenilciclasa).
La Ang II sería responsable de proliferación y apoptosis de células epiteliales tubulares proximales
en determinadas circunstancias. También se estima que es muy probable que la Ang II sea inductora
de EOx en los túbulos proximal y distal. Hay mayor expresión de componentes de la NADPH oxidasa
y disminución de la expresión de superóxido dismutasa (SOD) en la corteza renal. En el túbulo distal
la Ang II aumenta la reabsorción de bicarbonato. También estimula al trasportador Na+/H+ (NHE).
Estos efectos, junto con la ya comentada reabsorción proximal, contribuyen a una eficacia mucho
mayor de la conservación de Na+ . En los túbulos colectores la Ang II aumenta la secreción de H+ y la
absorción de Na+ (sin producir alcalosis). Aumenta asimismo los mecanismos de concentración
urinaria, provocando mayor reabsorción de agua.
Una amplia y excelente revisión sobre los efectos intrarrenales de la Ang II y su contribución a la
génesis de HTA crónica ha sido presentada por Navar y col. [133], cuya lectura aconsejamos-
Efectos metabólicos. Estrés oxidativo (EOx). Envejecimiento
La Ang II atenúa los efectos metabólicos cardiovasculares y musculares de la insulina, por medio
de la generación de las ROS y activación de moléculas pequeñas de bajo peso molecular RhoA y
Rac-1. Hay fuertes evidencias de que la Ang II contribuye a la resistencia a la insulina y a otros
integrantes del síndrome metabólico tales como HTA, dislipidemia, obesidad central, esteatosis
hepática, enfermedad renal crónica, y proteinuria[136]. Posee efectos proinflamatorios y
promueve remodelación, apoptosis, fibrosis y también produce oxidación de lípidos y proteínas,
causa además injuria celular y vasoconstricción. La generación de ROS es responsable de esos
efectos.
Por su parte las ROS activan factores de transcripción como el TNF-α (Tumor Necrosis Factor-alfa),
MCP-1, IL-6 y Proteína C reactiva. El TNF, por su lado, impide la activación de la sintasa endotelial
de óxido nítrico (eNOs) mediada por la insulina y el IGF-1 asi como los efectos antiapoptóticos de la
insulina y del IGF-1. La Ang II tiene efecto anorexígeno central y causa pérdida de peso
corporal[135,136] . Tanto la Ang II como la N-A tienen efectos catabólicos; tambien contribuye al
EOx e induce apoptosis[137] . Ver Tabla 4-II.
71
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
El envejecimiento se asocia con cambios estructurales y funcionales vasculares, tales como aumento
del espesor íntima-media, rigidez vascular y estado proinflamatorio, todo ello relacionado al
aumento de Ang II[138]. Las paredes vasculares o las CLMV (en ratas) tienen sobreabundancia de
componentes del SRA, y de efectores importantes como el TGF-β, la métalo-proteinasa de la matriz
extracelular 2 (MMP-2), la ET-1, el MCP-1 y las ROS. La MMP-2 tiene como mediador a la calpaína1, molécula ligada al estado de carga de Ca2+ celular, de importancia en la regulación de proteolisis
de enzimas claves y proteínas estructurales asi como en respuestas proinflamatorias. El aumento de
MMP-2 es característico del envejecimiento arterial y juega un rol importante en la migración de
CMLV y degradación de elastina. La calpaína parece ser eje en la cascada de señalamiento Ang
II/MMP2, o sea que interviene importantemente en la progresión de la inflamación y del
envejecimiento arterial. Produce además proteolisis de vimentína y espectrina (intervienen en
ligadura y expansión de fibroblastos). Su presencia es necesaria para la producción de hipertrofia
miocítica inducida por Ang II y para la secreción de MCP-1 de CMLV. La calpaína-1 activa al TGF-β1.
La HTA causada por Ang II es causada por el EOx [139-144]. La NADPH oxidasa (Nox) es la fuente del
anión superóxido (O2*), y es activada por la Ang II in vitro. In vivo, en ratones con p47phox deficiente
(elemento constitutivo esencial de la Nox), la infusión de Ang II tiene un efecto hipertensor
sumamente atenuado, sin que se observe aumento del O2*. En experimentos en ratones pudo
constatarse que la Ang II no produce aumento de la producción del O2* por las CE, cuando se les
despoja de p47phox. Se ha mencionado más atrás que Cingolani y col. [111] han demostrado que el
estiraminto miocítico genera producción de Ang II, y que esta hormona, vía AT1/ET-1/NADPH lleva
a la producción de ROS, en especial de Ox*. Hay una fuerte relación de la Ang II con el receptor
mineralocorticoide (RMC), necesaria para la producción de ROS . Ha sido dicho que el
envejecimiento es causado por el EOx, y que la mitocondria es la iniciadora de los cambios. El
disbalance oxdación-reducción mitocondrial y la formación tisular de ROS está íntimamente ligada
a la disregulación del SRA. La señal Ang II-AT1-NADPH-ROS provoca la apertura de canales K+ATP y
producción mitocondrial de ROS. El SRA está involucrado en la disminución de “barredores”
antioxidantes. El AT2 tendría funciones antioxidativas y protectoras mitocondriales [143].
Hay entonces un papel fundamental de la oxidasa de la NADPH y su constituyente p47phox en el
EOx y en la respuesta hipertensiva. La HTA que se induce en ratas por medio de la Ang II está
vinculada con una gran producción del O2*, que impide la acción vasodilatadora vascular del NO, y
participa en la oxidación de LDL, en la activación de proto-oncogenes tales como el c-fos y c-jun, y
en promover crecimiento celular y en la activación de moléculas proinflamatorias.
Según Luther y col.[144] la Ang II promueve EOx, activa al NF-KB, e induce la expresión de citoquinas
inflamatorias tales como IL-6 y Proteína C reactiva altamente sensible (PCRas). Los isoprostanos F2
séricos, que son el producto de la peroxidación por radicales libres del ácido araquidónico y
marcadores de EOx, aumentan en individuos hipertensos, luego de la infusión aguda de Ang II. Los
isoprostanos F2 urinarios están aumentados en pacientes con HTA renovascular. Hay además
evidencias que la aldosterona exógena aumenta las concentraciones de IL-6 circulante y que los
antagonistas de los RMCs atenúan el aumento de la IL-6 inducida por Ang II, sugiriendo estos
hallazgos que la aldosterona endógena contribuye a los efectos proinflamatorios de la Ang II. La
Ang II induce hipertrofia miocítica en la rata vía producción celular autocrina de ET-1, que a su vez
gatilla la producción de ROS [25,111,112] , y pone en marcha al intercambiador Na+/H+, y éste a su
vez al Na+/Ca++ (acción reversa), con consiguiente aumento del inotropismo. Rajagopalan y col.[145]
han detectado que ciertas formas de HTA asociadas con altos niveles de Ang II circulante muestran
singulares efectos vasculares por el aumento de MLV, debido a un incremento de la producción del
O2* vascular (por un mecanismo dependiente de la activación de la oxidasa NADPH).
72
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Las infusiones de Ang II aumentan los niveles de O2* en segmentos aórticos de la rata, mientras que
infusiones de N-A , que producen el mismo efecto presor, carecen de efecto sobre la producción de
las ROS [146]. Este efecto estresante puede ser suprimido con un bloqueador del receptor de Ang
II, o con liposomas que contengan superóxido dismutasa (SOD). La Ang II impide la vasodilatación
vascular en ratas, al aumentar el O2* por medio de la NADPH oxidasa ligada a la membrana (el anión
aumenta sobre todo en el endotelio y en la adventicia). Esto se revierte con la administración de
eNOs (sintasa endotelial de Óxido Nítrico), pero no con SOD. La generación de O2*, producido por
el endotelio a través de la eNOs, está aumentada en la SHR-SP (Spontaneous Hypertensive RatStroke Prone).
Estimulación de producción de Aldosterona
La corteza suprarrenal produce hormonas míneralo-corticoideas y gluco-corticoideas. De las
primeras la principal es la aldosterona, que actúa principalmente en el epitelio de los riñones, de las
glándulas salivales y del colon. Tiene receptores de gran afinidad que se encuentran en el hígado,
en el cerebro, en la hipófisis y en los monocitos[147]. Su característica acción hormonal es de
producir retención de Na+ y excreción de K+. El sustrato para la síntesis de aldosterona es el
colesterol, que luego de ser captado por la mitocondria es convertido en pregnenolona en el
llamado “camino precoz” (con intervención de la enzima P450). La pregnenolona, por acción de la
isoenzima II de la 3β-hidroxiesteroide deshidrogenasa (3β-HSD) es convertida en progesterona. La
progesterona es hidroxilada a 17α-OH-pregnenolona por medio de la actividad de la CYP
17α−hidroxilasa. La hidroxilación de progesterona en la zona glomerulosa, o de la 17α-OH en la
zona fasciculada es mediada por la 21-hidroxilasa con producción de desoxicorticosterona (DOCA)
u 11-desoxicortisol. El paso final en la biosíntesis del cortisol ocurre en la mitocondria, a través de
la conversión del 11-desoxicortisol en cortisol por medio de la enzima Citocromo P11B1 (CY P11B1)
o 11β-hidroxilasa. En la zona glomerulosa la progesterona por acción de la 21-hidroxilasa se
convierte en DOCA, luego en corticosterona por medio de la 11β- hidroxilasa o la CYP11B2 (sintasa
de aldosterona); esta última puede ser requerida para la conversión de corticosterona en
aldosterona a través de la 18-OHcorticosterona (“camino tardío”). El CYP11B2 puede producir 11βhidroxilación, 18-hidroxilación y 18-metiloxidación. La mayor proporción de córticosterona y DOCA
se produce en la zona fasciculada , mientras que la mayoría de la 18-hidroxicórticosterona se
produce en la zona glomerulosa. Para su secreción tiene dependencia del ACTH.
La presencia de exceso de aldosterona es un factor fisiopatológico importante en la HVI y en la IC,
más allá de las alteraciones de la PA que puedan existir[148-50]. Se encuentran receptores
mineralocorticoides (RMC) en el corazón, cerebro y riñón de la rata, que han sido clonados y que
tienen alta afinidad tanto para aldosterona como para cortisol. Hay un RMC específico en los
miocitos cardiacos[151]. Además, se ha demostrado que el miocardio mismo es capaz de producir
aldosterona[147]. Los mayores reguladores de la secreción de aldosterona son la Ang II, el ión K+,
y el ACTH[152]. El ACTH, cuando realiza estimulación en forma continua, tal como puede ocurrir en
el estrés crónico, produce disminución de la secreción de aldosterona. Ejercen una acción
estimulante menor la Ang III, la ET-1, vasopresina y serotonina, siendo inhibidores la somatostatina,
el ANP, la endorfina β, dopamina, y la digoxina.
73
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
La hormona regula el transporte de Na+ en las células cardiacas[153]. Directamente estimula la
síntesis del mARN de la Na+,K+-ATPasa y la acumulación de proteínas en las células cardiacas[154] .
También activa al cotransportador Na+-K+-2Cl- para aumentar la entrada de Na+ y estimular la
bomba Na+-K+[154,155]. Otra acción es la de regular la entrada de Ca2+ en los miocitos[156,157]. En
anillos vasculares con conservación de endotelio, la aldosterona atenúa rápidamente la
vasoconstricción inducida por fenilefrina. El efecto de la aldosterona es potente, altamente
específico y depende de la eNOs . La activación de la eNOs mediada por la aldosterona es
dependiente de la fosfatidil-3-inositol kinasa. La presencia de aldosterona provoca activación de la
ERK y p70 S6 kinasa de las CE y de las CMLV, que también dependen de la fosfatidil-3-inositol kinasa.
O sea que la aldosterona modula la reactividad vascular. En las suprarrenales el SRA local regula la
producción de aldosterona[158,159]. En la IC se observa regulación hacia arriba de la producción de
aldosterona por la ET-1 en pacientes previamente tratados con IECA y diuréticos. La droga bosentán,
antagonista de ET-1, reduce significativamente los niveles plasmáticos de aldosterona en pacientes
con IC[160].
En el tratamiento de la IC con IECA se observa que los efectos beneficiosos disminuyen
progresivamente a través del tiempo. Esto ha sido interpretado vinculado a “escape de producción
de Ang II” o a “escape de producción de aldosterona”. El primero se explica por la presencia de vías
alternativas de producción de la hormona como la de la quimasa. En el caso de la aldosterona se
debería al aumento de la potasemia inducido por los IECA. La aldosterona formada por este
“escape” atenuaría los efectos de los IECA, dando lugar a la llamada “resistencia a los IECA”[161].
Dentro de los efectos perjudiciales de la aldosterona tenemos [162-166]: 1) Pérdida de Mg2+ y K+
por aumento de su excreción urinaria, más retención de Na+; 2) potenciación de las catecolaminas;
3) Inducción de arritmias ventriculares; 4) Inducción de hipertrofia y fibrosis miocárdica; 5)
vasculopatía por disfunción endotelial, con aumento de retención de Na + por las CMLV, mayor
generación de ROS, hipertrofia de CMLV, estimulación de la síntesis de TGFβ-1 y regulación hacia
arriba de receptores de Ang II; 6) aumento de la síntesis de PAI-1, inhibiendo así la fibrinolisis; 7)
atenuación de los barorreflejos; y 8) desarrollo de nefroesclerosis maligna. Además eleva la PA.
La aldosterona eleva especificamente los niveles de AMPc en las CMLV y fosforila la CREB(cAMPresponse elements binding protein)[146].
La aldosterona[157]: 1) aumenta el contenido de NADPH, favoreciendo la formación de O2*
aumentando así el EO; 2) Induce inflamación vascular; 3) induce isquemia y necrosis miocárdica; 4)
aumenta la síntesis de colágeno en los fibroblastos; 5) regula el PAI-1; 6) disminuye la actividad de
los barorreceptores y la función refleja autonómica; 7) bloquea la captación miocárdica de N-A, 8)
estimula apoptosis, 9) inhibe la síntesis de NO, 10) promueve disfunción endotelial.
Puede concluirse entonces que la hormona tiene efectos específicos sobre el corazón. Es probable
que su acción a nivel celular se centre en el intercambio iónico. La aldosterona tiene además la
capacidad de inducir o inhibir la síntesis de numerosas proteínas y de colágeno por los
fibroblastos[158-162].
En la IC se produce “fibrosis intersticial reactiva” con acumulación de colágeno en el miocardio,
observándose regulación hacia arriba de las MMPs; todo ello se acompaña con niveles elevados de
aldosterona. Se ha visto disminución marcada de la fibrosis reactiva (perros) merced al tratamiento
con eplerenona, antagonista de la aldosterona[162].
Estos efectos perjudiciales de la aldosterona explican porque los antagonistas de la hormona son
beneficiosos en el tratamiento de la IC[162-167]..
74
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
Se han descrito efectos “no genómicos” de la aldosterona en células epiteliales, CMLV, células
musculares esqueléticas y colónicas renales[167-173]. Son asi denominados por su velocidad,
independencia de la síntesis proteica, y no ser inhibidos por la espironolactona. Se producirían a
través de cambios en distintos tejidos del pH intracelular, del Ca2+ intracelular y del Na+ intracelular.
Asi se ha visto que la aldosterona tiene efectos rápidos en el intercambio Na+/H+. No está aclarado
aún el mecanismo del efecto rápido inotrópico de la aldosterona. La espironolactona también
produce efectos inotrópicos positivos, que además son aditivos a los de la aldosterona.
Oberleithner[174] ha demostrado que la aldosterona, actuando a través de los RMCs, estimula la
entrada de Na+ y agua en las células. Estas células así edematizadas, disminuyen de tamaño cuando
se suministran concentraciones micromolares de amiloride (concentraciones que no inhiben el
intercambio de protones), probablemente por inhibición de un canal de Na+ (similar al de células
del túbulo contorneado distal del nefrón). Los efectos estimuladores de los canales de Na+ serían
inducidos por un efecto genómico de la aldosterona, que produce entrada de Na+ y despolarización,
creándose un gradiente electroquímico que provoca la acumulación de agua. La hinchazón celular
activa la bomba Na+/K+ATPasa (mayor entrada de K+). El mismo investigador ha demostrado que la
aldosterona induce crecimiento del 15 al 28% del núcleo de las CE, el cual desaparece a los 30
minutos. La hinchazón de las CE provocada por la aldosterona podría afectar la resistencia al flujo
de las pequeñas arterias.. Schiffrin[175], comentando el trabajo de Oberleithner, señala que la
aldosterona ha sido implicada en la inducción de fibrosis en el corazón ,vasos y el riñón, sobre todo
cuando hay una dieta rica en Na+. Ciertos efectos atribuidos a la Ang II, tales como remodelación
vascular, disfunción endotelial por EO e inflamación pueden – al menos en parte- ser ocasionados
por la aldosterona. Los efectos inflamatorios vasculares y cardiacos inducen incrementos de
mediadores tales como NFkB , AP-1, VCAM-1, y ET-1. Sin embargo hay algunas investigaciones que
señalan que la aldosterona puede ejercer efectos beneficiosos a través de la activación final de la
NOs. Además estimula la producción de ET-1 en el riñón, los vasos sanguíneos y el corazón. No se
sabe bien porque los antagonistas de la aldosterona disminuyen la mortalidad cardiovascular y la
isquemia. La aldosterona provoca disfunción endotelial y en experimentación animal aumenta la
infiltración de macrófagos y aterosclerosis. Las células endoteliales (CE) coronarias y aórticas
expresan mARN de RMC y proteínas y los RMC de las CE median en la transcripción de genes
dependientes de la aldosterona. La aldosterona estimula el gen de ICAM-1 y expresión de proteínas
en las CE de las arterias coronarias, procesos estos que son inhibidos por la espironolactona. La
aldosterona propicia la adhesión de leucocitos a las CE y la espironolactona inhibe ese efecto[176].
Otro aspecto que debe destacarse es el hallazgo de receptores míneralo-corticoides en el cerebro
que producen estimulación del SNS, y pueden causar aumento de la PA así como respuestas
inflamatorias.
Estimulación de producción de Vasopresina
La arginina vasopresina (AVP) es un nonapéptido de peso molecular 1.099 sintetizado en el
hipotálamo, En años anteriores se tuvo en cuenta su potente efecto vasoconstrictor, pero luego se
vió que también aumentaba la permabilidad al agua en los tubos colectores del riñón,
incrementando la reabsorción de la misma, razón por la cual también se la conoce como Hormona
Antidiurética. Cuando en el nonapéptido se sustituye la isoleucina ubicada en posición 3 por
fenilalanina se constituye la oxitocina (Ox), que tiene acción constrictora uterina potente[131,177].
Juntamente con neurofisina que posee 95 aa y un glucopéptido de 39 aa, forman la prohormona
denominada preproneurofisina II, que se sintetiza en las células parvo y magnocelulares de los
75
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
núcleos supraóptico y paraventricular, desde donde es transportada al lugar donde se almacena (en
forma de gránulos) y secreta, el lóbulo posterior de la hipófisis[178].
La secreción de vasopresina se produce en respuesta a la hiperosmolaridad o a la acción
estimulante de la Ang II, que actúan en conglomerados magnocelulares del hipotálamo, tales como
el órgano subfornical y células del órgano vascular de la lámina terminalis o del núcleo mediano
preóptico, que producen la hormona que luego almacenan en el lóbulo posterior de la hipófisis
(constituido por los axones de las células magnocelulares y parvocelulares ubicadas en los núcleos
mencionados). Se encuentran además en el cerebro, varios conglomerados parvocelulares,
localizados en el núcleo paraventricular cerebro, en la stria terminalis, la amígdala media y el núcleo
supraquiasmático[179]. Sería importante su intervención en funciones cerebrales, tales como la
regulación de la agresión y la memoria, y se investiga su rol en el estrés, la ansiedad y la depresión,
o sea la integración del comportamiento humano Los estímulos para la secreción de AVP aumentan
el mARN (mensajero del Acido Ribonucleico) y su trascripción en las neuronas magnocelulares. En
ratas la deshidratación acelera la transcripción y aumenta los niveles de los mARN de AVP y de
oxitocina, mientras que la hipoosmolarididad produce una disminución de esos mensajeros. La
cantidad de AVP almacenada en la hipófisis posterior es aproximadamente equivalente a la cantidad
de hormona suficiente como para mantener una liberación - en condiciones basales - durante 30 a
60 días o en la caso de necesidad de liberación máxima, durante 5 a 10 días[180].
La deshidratación o la sobrecarga de sal estimulan la liberación de AVP, y si el estímulo es
prolongado e intenso puede llevar al agotamiento del almacenamiento. Experimentalmente se
observa retorno al estado fisiológico basal en 7 a 14 días, cuando en la experimentación se permite
al animal ingerir la cantidad normal de agua. Cuando existe una hipovolemia lo suficientemente
intensa como para causar un descenso de la presión arterial se produce un abrupto y exponencial
aumento en sangre del nivel de AVP. La AVP participa entonces principalmente en el sistema de
regulación de la osmolaridad pero también en el sistema de regulación de la presión y del volumen,
aunque en este último es francamente predominante la acción del SRAA. La estimulación de la
liberación de AVP se produce por disminución súbita del estiramiento cardiaco por caída del
volumen de carga ventricular – sensado por el mecanorreceptor ventricular – y por el cese de la
acción inhibitoria simpática de los barorreceptores carotídeo y aórtico y directamente por activación
de receptores hipotalámicos que sensan cambios ósmóticos menores del 1%. El estímulo de la
hipovolemia puede sobrepasar al efecto de la disminución osmótica en forma tal que se puede
estimular la liberación de AVP pese a la existencia de hiponatremia significativa[180].
También son importantes estimulantes de la secreción de AVP la N-A y la Ang II. La concentración
plasmática normal de AVP es de 3 pgm/ml. Un leve aumento de esa cantidad a 9 pg/ml reduce el
flujo medular renal y ejerce potente efecto antidiurético al aumentar la permeabilidad al agua del
tubo colector. O sea que la AVP es la determinante mayor de la tasa de excreción renal de agua.
Cuando hay depleción de volumen e hipotensión arterial pueden observarse altos niveles
plasmáticos de AVP (20-400 pg/ml).
La AVP tiene 3 receptores: V1a, V1b (también llamado receptor V3) y V2 . El gen del receptor V1a –
mediador de vasoconstricción e hipertrofia miocárdica - se expresa en los vasos sanguíneos de una
amplia variedad de órganos y tejidos (células musculares lisas vasculares, plaquetas, linfocitos y
monocitos, corteza supararrenal y miocardio). Los receptores V2 se encuentran principalmente en
las células de los tubos colectores renales, donde estimulan a la acuaporina-2 (proteína de los
canales de agua celulares, que aumenta la permeabilidad de la membrana celular al agua). El
receptor V1b (o V3) modula la liberación de ACTH y de β- endorfina. Cabe señala que la ACTH
estimula la liberación de aldosterona (que puede provocar retención de sodio y reabsorción de
76
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
agua)[180]. En normales la estimulación de V1a no provoca hipertensión, porque hay simultánea
estimulación de V2 , que tiende a bajar la frecuencia cardiaca y el volumen minuto. Niveles que
superan los límites fisiológicos reducen la contractilidad y el flujo coronario por mediación de V1a ,
mientras que en niveles fisiológicos tienen efectos opuestos provocando ligero aumento de la
contractilidad. En pacientes con IC los niveles plasmáticos de AVP se encuentran elevados, sobre
todo en los descompensados que presentan hiponatremia. El aumento de AVP lleva a un incremento
en el número de canales de acuaporina-2 en los tubos colectores renales, con aumento de la
reabsorción de agua, aun en presencia de hiponatremia. El aumento del retorno venoso por la
reabsorción de agua consecutiva a la presencia en exceso de AVP causa mayor precarga, aumento
de la presión capilar pulmonar y de llenado ventricular izquierdo. La vasoconstricción causa
aumento de la poscarga.
Por todo lo señalado se ha considerado en el tratamiento de la IC que la inhibición de la secreción
de AVP puede tener efectos beneficiosos. El conivaptan antagoniza ambos receptores de AVP e
induce excreción de agua libre (disminución de peso corporal), disminución de presión arterial y de
péptido natriurético plasmático y de masa ventricular[181].
.
. Bibliografía
1. Schroten NF, Gaillard AJM, van Veldhuisen DJ, Szymanski MK, Hillege HI, de Boer RA. New
roles for renin and prorenin in heart failure and cardiorenal crosstalk. Heart Fail Rev
2012;17:191-201
2. Castrop H, Höcherl K, Kurtz A, Schweda F, Todorov V, Wagner C. Physiology of kidney
renin. Physiol Rev 2010;90:607-67
3. Klar J, Sigl M, Obermayer B, et al.: Calcium inhibits renin gene expression by transcriptional
and posttranscriptional mechanisms. Hypertension 2005;46:1340-44
4. Pan L, Black TA, Shi Q, Jones CA, Petrovic N, Loudon J, KaneC, Sigmund CD, Gross KW.
Critical roles of a cAMP responsive element and an E-box in regulation of mouse renin
gene expression. J Biol Chem 2001, 276: 45530–45538..
5. Petrovic N, Kane CM, Sigmund CD, Gross KW. Downregulation of renin gene expression by
interleukin-1.Hypertension 1997; 30: 230–35.
6. Campbell DJ Critical view of prorenin and (pro)renin receptor research. Hypertension
2008;51:1259-64 Insuficiencia Cardiaca Crónica. Prof.Dr. Fernando de la Serna 78
7. Kuipers I, van der Harst P, Navis G, et al.: Nuclear hormones receptors as regulators of the
ReninaAngiotensin-Aldosterone System. Hypertension 2008;51:1442-48
8. Peters J, Farrenkopf R, Clausmeyer S, Zimmer J, Kantachuvesiri S, Sharp MG, Mullins JJ.
Functional significance of prorenin internalization in the rat heart. Circ Res 2002;90:1135–
1141, 2002
9. Danser AHJ, Batenburg WW, van Esch JHM, Krop M. Prorenin anno 2008. J Mol Med
2008;86:655-58
10. Cuadra AE, Shan Z, Sumners C, Raizada MK. A current view of brain renin angiotensin
system: Is the (Pro) renin receptor the missing link? Pharmacol Ther 2010,125:27
77
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
11. Liu D, Gao L, Roy SK, Cornish KG, Zucker IH.: The Role of Oxidant Stress on AT1 Receptor
Expression in Neurons of Rabbits With Heart Failure and in Cultured Neurons. Circ Res
2008;103-10
12. Touyz RM, Schiffrin EL : Signal transduction mechanisms mediating the physiological and
pathophysiological actions of angiotensin II in vascular smooth muscle cells. Pharmacolog
Rev 2000;52:639-72
13. Oliveira I, Costa-Nieto CM, Nakale CR, Scheier S, Shimuta SI, Paiva ACM. The angiotensin II
AT1 receptor structure-activity. Correlation in the light of rhodopsine structure. Physiol
Rev 2007;87:565-592
14. Dostal DE, Baker KM : The cardiac rennin-angiotensin system. Conceptual, or a regulator of
cardiac function?. Circ Res 1999;85:643-50
15. Kawaguchi H, Kitabatake A : Altered signal transduction system in hypertrophied
myocardium: angiotensin II modulates collagen synthesis in hypertrophied hearts. J Card
Fail 1996;2:S13-S19
16. Heeneman S, Sluimer IJ, Daemen MJ. Angiotensin converting enzyme and vascular
remodeling. Circ Res 2007;101:441-54
17. Dzau VJ : .Tissue Angiotensin and pathobiology of vascular disease. A unifying hypothesis.
Hypertensión 2001;37:1047-52
18. Crowley SD, Coffman TM: In hypertension: the kidney rules. Curr Hypert Reports
2007;9:148-153
19. Siragy HM. The potential role of the angiotensin subtype 2 receptor in cardiovascular
protection. Curr Hypertens Rep 2009;11:260-62
20. de Gasparo M; Whitebread S; Mele M; Motani AS; Whitcombe PJ; Ramjoue HP; Kamber B:
Biochemical characterization of two angiotensin II receptor subtypes in the rat. J
Cardiovasc Pharmacol 1990;16(Suppl 4):S31-5
21. Zucker IH. Novel mechanisms of sympathetic regulation in chronic heart failure.
Hypertension 2006;48:1005-11
22. Schneider MD, Lorell BH. AT2, judgment day: Which angiotensin receptor I is the output in
cardiac hypertrophy?. Circulation 2001;104:247-48
23. Booz GW.: Cardiac angiotensin AT2 receptor. What exactly does it do?. Hypertension
2004;43:1162-63
24. Asano K, Dutcher DL, Port D, Minobe WA, Tremmel KD, Roden RL, Bohlmeyer TJ, Bush EW,
Jenkin MJ, Abraham WT, Perryman B, Raynolds MV, Bristow MR.: Selective
downregulation of angiotension II AT1 receptor subtype in failing human ventricular
myocardium. Circulation 1997;95:1193-200
25. Pérez NG, Villa-Abrille MC, Aiello EA, Dulce RA, Cingolani HE, Camillón de Hurtado MC.: A
low dose of angiotensin II increases inotropism through activation of reverse Na(+)/Ca(2+)
exchange by endothelin release. Cardiovasc Res 2003;60:589-97
26. Henrion D, Kubis N, Lévy BI: Physiological and pathophysiological functions of the AT.2
subtype receptor of angiotensin II. From large arteries to the microcirculation.
Hypertension 2001;38:1150-57
27. Ko S-H, Cao W, Liu Z. Hypertension management and microvascular insulin resistance in
diabetes Hypertension 2010. ePub 29:6
78
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
28. Ohkubo N, Matsubara H, Nozawa Y et al. : Angiotensin type 2 receptors are reexpressed by
cardiac fibroblasts from failing myopathic hamster hearts and inhibit cell growth and
fibrillar collagen metabolism. Circulation 1997;96:3954-62
29. Ribeiro-Oliveira A, Impelizieri Nogueira R, Pereira RM, Vilas Boas WW, Souza dos Santos
RA, Simoes de Silva AC. The renin-angiotensin system and diabetes. Vasc Health Risk
Manag 2008;4:787-803,
30. Bernstein KE, Xiao HD, Frenzel K, Li P, Shen XZ, Adams JW, Fuchs S. Six truisms concernig
ACE and the renin--angiotensin system deducef from the genetic analysis of mice. Circ Res
2005;96:1135-44
31. Fabiani ME, Dinh DT, Nassis L, Johnston CI. Enzima convertidora de angiotensina:
propiedades básicas, distribución y papel funcional. . Cap 19, en Hipertension: el Riñón de
Brnner y Rector., editado por Oparil S,Weber MA. McGraw-Hill Interamericana. México,
2002
32. Fleming I. Signaling by the Angiotensin-Converting Enzyme. Circ Res 2006;98:887-96
33. Carey RM, Siragy HM. Newly recognized components of the renin angiotensin system:
potential role in cardiovascular and renal regulation. Endocr Rev 2005;24:261-71
34. Danilczyk U, Penninger JM. Angiotensin-Converting enzyme II in the heart and the kidney.
Circ Res 2006;98:463-71
35. Pagliano P, Penn C. Rethinking the renin-angiotensin system and its role in cardiovascular
regulation.Cardiovasc Drugs Ther 2005;19:77-87
36. Luchner A, Stevens TL, Borgeson DD, Redfield MM, Bailey JE, Sandberg SM, Heublein DM,
Burnett JC.: Angiotensin II in the evolution of experimental heart failure. Hypertension
1996;28:472-77
37. Dzau VJ, Bernstein K, Celermajer D, Cohen J, Dahlof B, Deanfield J, Diez J, Drexler H, Ferrari
R, van GilstW, Hansson L, Hornig B, Husain A, Johnston C, Lazar H, Lonn E, Luscher T,
Mancini J, Mimran A, Pepine C,Rabelink T, Remme W, Ruilope L, Ruzicka M, Schunkert H,
Swedberg K, Unger T, Vaughan D, Weber M: The relevance of tissue angiotensinconverting enzyme: manifestations in mechanistic and endpoint data. Am J Cardiol
2001;88(Suppl 1):1-20
38. Tipnis SR, Hooper NM, Hyde R, Karran E et al: A human homolog of angiotensin-converting
enzyme: cloning and functional expression as a captopril-insensitive carboxypeptidase. J
Biol Chem 2000;275:33238-43
39. Donoghue M, Hsieh F, Baronas E. et al: A novel angiotensin-converting enzyme-related
carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9. Circ Res 2000;87:E1-E9
40. Boehm M, Nabel EG : Angiotensin-converting enzyme 2 – A new cardiac regulator. New
Engl J Med 2002;347:1795-97
41. Wang W, Bodiga S, Das SK, Lo J, Patel V, Oudit GY. Role of ACE2 in diastolic and systolic
heart failure. Heart Fail Rev 2012;17:683-91
42. Kazemi-Bajestani SM, Patel VB, Wang W, Oudit GY. Targeting the ACE2 at apelin pathways
are novel therapies for heart failure: :Opportunities and challenges. Cardiol Res 2012, ID
823193.
43. Oudit GY, Penninger JM. Recombinant human angiotensin-converting enzyme 2 as a new
renin-angiotensinsystem peptidase for heart failure therapy. Curr Heart Fail Rep
2011;8:176-83
79
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
44. Burrell LM, Risvanis J, Dean RG, MacDonald PS, Lu S, Tikellis CH, Grant SL, Lew RA, Smith
AI, Cooper ME,Johnston CI. Myocardial infarction increases ACE2 expression in rats and
humans. Eur Heart J 2005;26:369-75
45. Wysocki J, Ye M, Rodríquez E, Gonzalez-Pacheco FR, Barrios C, Evora K, Schuster M,
Loibner H, Bridget Brosnihan K, Ferrario CM, Penninger JM, Batlle D. Targeting the
degradation of angiotensin II with recombinant angiotensin-converting enzyme 2:
prevention of angiotensin II dependent hypertension. Hypertension 2010;55;90-98
46. Crackower MA, Sarao R, Oudit GY, Yagil C, Kozieradzki I, Scanga SE, et al: Angiotensinconverting enzyme 2 is an essential regulator of heart function. Nature 2002
20;417(6891):822-8.
47. Jin H-Y, Song B, Oudit CY, et al.: ACE2 deficiency enhances angiotensin II mediated aortic
profilin-1 expression, inflammation and peroxynitrite production. PLoS ONE 2012;7 ePub
June.
48. Cohen-Segev R, Francis B, Abu-Saleh N, et al. Cardiac and renal distribution of ACE and
ACE-2 in rats with heart failure. Acta Histochem 2014;116:1342-49 (abstract)
49. Koka V, Ru Huang X, Chung ACK, Wang W, Truong LD, Lan HY. Angiotensin II up-regulates
angiotensin Iconverting enzyme (ACE), but down-regulate ACE-2 via the AT1-ERK/p38 MAP
Kinase pathway. Am J Pathol 2008;172:1174-1183
50. Li L, Zang H, Hou X, He X, Chen J-X. Myocardial injection of apelin-overexpressing bone
marrow cells aimproves cardiac rapair viia up regulation Sirt after myocardial infarction.
PLOS ONE 2013;8(9):e71041
51. Clapp C, Thebault S, Jeziorski MC, Martinez de la Escalera G. Peptide hormone regulation
of angiogenesis.Physiol Rev 2009;89:1177-1215
52. Lindpaitner K, Ganten D: Tissue renin-angiotensin systems and their modulation: the heart
as a paradigm for new aspects of converting enzyme inhibition. Cardiology 1991;79(Suppl
1)32-44
53. Chen LY, Li P, He Q, Jiang LQ, Cui CJ, Xu L, Liu LS. Transgenic study of the function of
chymase in heart remodeling. J Hypertens 2002 Oct;20(10):2047-55
54. Katugampola SD, Davenport AP. Radioligand binding reveals chymase as the predominant
enzyme for mediating tissue conversion of angiotensin I in the normal heart.. Clin Sci
2002;102:15-21
55. De Mello WC, Danser AHJ : Angiotensin II and the heart. On the intracrine reninangiotensin system.Hypertension 2000;35:1183-88
56. Ahmad S, Simmons T, Varagic J, Moniwa N, Chappell MC, Ferrario CM. Chymasedependent generation of angiotensin II from angiotensi-(1-12) in human atrial tissue. PLoS
ONE 2011;6:e28501
57. Chitravanshi VC, Sapru HN Cardiovascular responses elicited by a new endogenous
angiotensin in thenucleus tractus solitarius of the rat. Am J Physiol Heart Circ Physiol.
2011;300: H230–H240.
58. Wei C-C, Hase N, Inoue Y, et al. Mast cell chymase limits the cardiac efficacy of Ang Iconverting enzyme inhiitor therapy in rodents. J Clin Ivest 2010;120:1229-39
59. Li J, Jubair S, Janicky JS- Estrogen inhibits mast cells chymase reléase to prevent pressure
overload-induced adverse cardiac remodeling. Hypertension 2015;65:328-34
80
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
60. Zhuo JL, Li XC. New insights and perspectives on intrarenal renin-angiotensin System: focus
on intracrine/intracellular angiotensin II. Peptides 2011;32:1551-65
61. Wright JW, Mizutani S, Harding JW. Focus on brain angiotensin III and aminopeptidase A in
the control of hypertension.. Int J Hypertension 2012, Art.ID 124758.
62. Jessup J, Trask AJ, Chappell MC, Nagata A, Kato J, Kitamura K, Ferrario CM.: Localization of
the novel angiotensin peptide angiotensin-(1-12), in heart and kidney of hypertensive and
normotensive rats. Am J Physiol Heart Circ Physiol 2008;294:H2614-H2618
63. Jankowski V, Vanholder R, van der Giet M, et al.: Mass-spectrometric identification of a
novel angiotensin peptide in human plasma. Arterioscler Thromb Vasc Biol 2007;27:297302
64. Wright JW, Tamura-Myers E, Wilson WL et al., Conversion of brain angiotensin II to
angiotensin III is critical for pressor response in rats. American Journal of Physiology,
2003;284:R725-R733.<
65. Byung Mun Park, Shan Gao, Seung Ah Cha, Byung Hyun Park, Suhn Hee Kim. Cardio
protective effects of Ang III against ischemic injury via the AT2 receptor and KATP channels.phisiolg Rev 2013. Nov 1(6) e00. On line Nov 13-151
66. Harding JW, Jensen LL, Hanesworth JM, Roberts KA, Page TA, Wright JW. Release of
angiotensins in paraventricular nucleus in response to physiological and chemical stimuli.
Am J Physiol 1992;262:F17-23
67. Wright JW, Yamamoto BJ, Harding JW. Angiotensin receptor subtype mediated
physiologies and behaviors: New discoveries and clinical targets. Progr Neurobiol
2008;84:157-181
68. Wright JW, Kawas LH, Harding JW. The development of small molecule angiotensin IV
analogs to treat Alzheimer’s and Parkinson’s diseases. Progr Neurobiol 2014; 125C:26-46
69. Benoist CC, Kawas LH, Zhu M, Tyson KA, Stillmaker L, Appleyard SM, Wright JW, Wayman
GA, Harding JW. The procognitive and synaptogenic effects of angiotensin IV-derived
peptides are dependent on the activation of the hepatocyte growth factor/c-met system. J
Pharmacol Exp Ther 2014;351:390-402
70. Ferrario CM, Chappell MC, Tallant EA, Brosnihan KB, Diz DL. Counterregulatory actions of
angiotensin-(1-7). Hypertension 1997;30:535-41
71. Ferrario CM : Does angiotensin-(1-7) contribute to cardiac adaptation and preservation of
endothelial functionin heart failure. Circulation 2000;105:1523-24
72. Roks AJ, van Geel PP, Pinto YM, Buikema H, Henning RH, de Zeeuw D; van Gilst WH:
Angiotensin-(1-7) is a modulator of the human renin-angiotensin system. Hypertension
1999;34:296-301
73. Loot A, Roks AJM, Henning RH, et al. Angiotensin-(1–7) attenuates the development of
heart failure after myocardial infarction in rats. Circulation. 2002; 105: 1548–1550
74. Ferrario CM. Angiotensin-converting enzyme 2 and angiotensin-(1-7): An evolving story in
cardiovascular regulation. Hypertension 2006;47[part 2]:515-521
75. Paul M, Mehr AP, Kreutz R. Physiology of local renina-angiotensin systems. Physiol Rev
2006;86:747-803
76. Varagic J, Trask AJ, Jessup JA, Chappell MC, Ferrario CM. New angiotensins. J Mol Med
2008;86:663-71
81
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
77. Ferrario CM. New physiological concepts of the renin-angiotensin system from the
investigation of precursors and products of angiotensin I metabolism. Hypertension
2010;55:445-52
78. Santos RAS, Simoes e Silva AC, Maric C, et al.: Angiotensin (1-7) is an endogenous ligand
for the G protein-coupled-receptor Mas.. Proc Natl Acad Sci USA 2003;100:8258-63
79. Sampaio WO, Henrique de Castro C, Santos RAS, Schiffrin EL Touyz RM. Angiotensin(1-7)
counterregulates angiotensin II signaling in human endothelial cells. Hypertension
2007;50:109380. Kostenis E, Milligan G, Christopoulos A, et al: G-Protein coup’led receptor Mas is a
physiological antagonist of the angiotensin II type 1 receptor. Circulation 2005;111:180613
81. Heitsch H, Brovkovych S, Malinski T, Wiemer G : Angiotensin-(1-7)-stimulated nitric oxide
and superoxide release from endotelial cells. Hypertension 2001;37:72-76
82. Reudelhuber TL.: A place in our hearts for the lowly angiotensin-(1-7) peptide?.
Hypertension 2006;47:1-5
83. Gallagher PE, Ferrario CM, Tallant LA. Regulation of ACE2 in cardiac myocytes and
fibroblasts. Am J Physiol 2008;295:H2373-H2379
84. Schindler C, Bramlage P, Kirch W, Ferrario CM. Role of the vasodilator peptide angiotensin(1-7) in cardiovascular drug therapy. Vasc Health Risl Nanag 2007;3:125-137
85. Gomes ERM, Santos RAS, Guatimosim S. Angiotensin-(1-7)-mediated signaling in
cardiomyocytes. Intl. J Hypertension 2012; ID:493129.
86. Yamamuro M, Yoshimura M, Nakayama M, et al. Aldosterone, but not angiotensin II,
reduces angiotensin converting enzyme-2 gene expression levels in cultures neonatal rat
cardiomyocytes.. Circ J 2008;72:1346-50
87. Dias-Peixoto MF, Santos RAS, Gomes ERM, et al. Molecular mechanisms involved in the
angiotensin-(1-7)/Mas signaling pathways in cardiomyicytes. Hypertension 2008;52:54248
88. Bosnyak S, Widdop RE, Denton KM, Jones EJS. Differential mechanisms of Ang-(1-7)mediated vasodepressor effect in aduklt and aged candesartan-treated rats. Int J
Hypertension 2012; ID 19258789. Chen WW, Kiong XO, Chen Q, Li YH, Kang YM, Zhu GO. Cardiac sympathetic afferent réflex
and its implications for sympathetic activation in chronic heart failure and hypertension.
Acta Physiol 2015, Jan 2 doc:10.1111/alpha.12447 (Epub ahead of print)- Abstract
90. Ocaranza MP, Michea L, Chiong M, Lagos CF, Lavandero S, Jalil JE. Recient insights and
therapeutic perspectives of angiotensin-(1-9) in the cardiovasculas system- Clin Sci 2014,
127:549-57.
91. Arakawa H, Chitravanshi VC, Sapru HN. The hypothalamic arcuate nucleus: a new site of
cardiovascular action of angiotensin-(1-12) and angiotensin II. Am J Physiol Heart Circ
Physiol 2011;300:H951-H980
92. Kawabe T, Kawabe K, Sapru HN. Cardiovascular effects of angiotensin-(1-12) in the caudal
ventrolateral medullary de pressor área of the rat- Am J Physiol Heart Circ Physiol
2014;306:H438-49
82
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
93. Yan R, Smolders I, Vanderheyden P, Demaegdt H, Van Eeckham A, et al. Pressor and renal
hemodynamic effects of the novel angiotensin A peptide are angiotensin II type 1A
receptor dependent. Hypertension 2011;57:956-64
94. Jankowski V, Tölle M, Santos RAS, Günthner T, Krause E, Beyermann M, Welker P, Bader
M, Barnt Pinheiro SV, Samapio WO, Lautner R, Kretschmer A, van der Giet M, Zidek W,
Jankowski J. Angiprotectin: an angiotensin II-like peptide causing vasodilatory effects.
FASEB J 2011;25:2987-95
95. Habiyakare B, Alsaadon H, Mathai ML, Hayes A, Zulli A. Reduction of angiotensin A and
alamandine vasoactivity in the rabbit model of atherogenesis: differential effects of
alamandine and Ang-(1-7). Int J Exp Pathol 2014;95:290-5 (abstract)
96. Thatcher SE, Zhang X, Howatt DA, et al. ACE-2 decreases form and and severity of
angiotensin II-induced aortic abdominla aneurism. Arterioscl Thromb Vasc Biol
2014;34:2617-23
97. Diehm N, Baumgartner I. D-dimer measurement: a useful prognostic marker in
surveillance of patients with abdominal aortic aneurysm?. (EDITORIAL) Eur Heart J
2011;32:258-260
98. Siragy HM. The potential role of the angiotensin subtype 2 receptor in cardiovascular
protection, Curr Hyperten Rep 2009;11:260-62
99. Brilla GC, Zhou G, Rupp H, Maisch B, Weber KT. Role of angiotensin II and prostaglandin E2
in regulating cardiac fibroblast collagen turnover. Am J Cardiol 1995;76:D8-13
100.
Dostal DE. Regulation of cardiac collagen. Angiotensin and cross-talk with local
growth factors. Hypertension 2001;37:841-44
101.
Diez J. Profibrotic effects of angiotensin II in the heart. A matter of mediators.
Hypertension 2004;43:11gu-65
102.
Magnusson MK, Mosher DF. Fibronectin, structure, assembling, and cardiovascular
implications. ArterioThromb Vasc Biol 1998;18:1363-70
103.
Leri A, Claudio PP, Li Q, Wang X, Reiss K, Wang S, Malhotra A, Kajstura J; Anversa P
Stretch-BP mediated release of angiotensin II induces myocyte apoptosis by activating p53
that enhances the local reninangiotensin system and decreases the Bcl-2-to-Bax protein
ratio in the cell. J Clin Invest 1998;101:1326-42
104.
Friedrich SP, Lorell BH, Rousseau MF, Hayashida W, Hess OM, Douglas PS, Gordon
S, Keighley CS, Benedict C, Krayenbuehl HP, et al: Intracardiac angiotensin-converting
enzyme inhibition improves diastolic function in patients with left ventricular hypertrophy
due to aortic stenosis. Circulation 1994;90:2761-71
105.
Weinberg EO; Schoen FJ; George D; Kagaya Y; Douglas PS; Litwin SE; Schunkert H;
Benedict CR; Lorell BH: Angiotensin-converting enzyme inhibition prolongs survival and
modifies the transition to heart failure in rats with pressure overload hypertrophy due to
ascending aortic stenosis. Circulation 1994;90:1410-22
106.
Barlucchi L, Leri A, Dostal DE et al: Canine ventricular myocytes possess a reninangiotensin system that is up-regulated with heart failure. Circ Res 2001;88:298-304
107.
Pieruzzi F, Abassi ZA, Keiser HR. Expression of renin-angiotensin system
components in the heart, kidney and lungs of rats with experimental heart failure.
Circulation 1995;92:3195-12
83
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
108.
Dahlof B; Pennert K; Hansson L : Reversal of left ventricular hypertrophy in
hypertensive patients. A metaanalysis of 109 treatment studies. Am J Hypertens
1992;5:95-110
109.
Harrap SB, Dominiczak AF, Fraser R.: Plasma angiotensin II, predisposition to
hypertension, and left ventricular size in healthy young adults. Circulation 1996;93:114854
110.
Inagami T, Senbonmatsu T : Dual effects of angiotensin II type 2 receptor on
cardiovascular hypertrophy.Trends Cardiovasc Med 2001;11:324-28
111.
Cingolani HE, Villa-Abrille MC, Cornelli M, Nolly A, Ennis IL, Garciarena C, Suburu
AM, Torbidoni V, Correa MV, Camillon de Hurtado MC, Aiello EA. The positive inotropic
effect of angiotensin II. Role of endothelin-1 and reactive oxygen species. Hypertension
2006;47:1-8
112.
Villa-Abrille MC, Caldiz CI, Ennis IL, Nolly MB, Casarini MJ, Chiappe de Cingolani GE,
Cingolani HE, Pérez NG.l: The Anrep effect requires transactivation of the epidermal
growth factor receptor. J Physiol 2010;588:1579-90
113.
Schlaich MP, Schmieder RE : Left ventricular hypertrophy and its regression:
pathophysiology and therapeutic approach. Focus on treatment with antihypertensive
agents. Am J Hypertens 1998;11:1394-404
114.
Moreau P, d'Uscio LV, Shaw S, Takase H, Barton M, Lüscher TF.: Angiotensin II
increases tissue endothelin and induces vascular hypertrophy. Reversal by ETA -Receptor
Antagonist. Circulation 1997;96:1593-97
115.
Schlaich MP, Schobel HP, Hilgers K, Schmieder RE : Impact of aldosterone on left
ventricular structure and function in young normotensive and mildly hypertensive
subjects. Am J Cardiol 2000;85:1199-206
116.
Brecher P.: Angiotensin II and cardiac fibrosis. Trends Cardiovasc Med 1996;6:1939
117.
Takizawa T, Gu M, Chobanian AV, Brecher P.: Effect of nitric oxide on DNA
replication induced by angiotensin II in rat cardiac fibroblasts. Hypertension 1997;30:103540.
118.
Booz GW, Day JN, Baker KM. Interplay between the cardiac renin angiotensin
system and JAK-STAT signaling: role in cardiac hypertrophy, ischemia/reperfusion
dysfunction, and heart failure. J Mol Cell Cardiol 2002 34:1443-53
119.
El-Adawi H, Deng L, Tramontano A, Smith S, Mascareno E, Ganguly K, Castillo R, ElSherif N. The functional role of the JAK-STAT pathway in post-infarction remodeling.
Cardiovasc Res 2003 57:129-38
120.
Hosokawa H, Aiuchi S, Kambe T, Hagiwara Y, Kubo T. Mechanical stretch-induced
mitogen-activated protein kinase activation is mediated via angiotensin and endothelin
systems in vascular smooth muscle cells. Biol Pharm Bull 2002 25:1588-92
121.
Yamada T; Horiuchi M; Dzau VJ : Angiotensin II type 2 receptor mediates
programmed cell death. Proc Natl Acad Sci USA 1996;93:156-60
122.
Horiuchi M; Hayashida W; Kambe T; Yamada T; Dzau VJ : Angiotensin type 2
receptor dephosphorylates Bcl-2 by activating mitogen-activated protein kinase
phosphatase-1 and induces apoptosis. J Biol Chem 1997;272:19022-26
84
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
123.
Iwai-Kanai E, Hasegawa K, Araki M, Kakita T, Morimoto T, Sasayama S : Alpha and
beta-adrenergic pathways differentially regulate cell type-specific apoptosis in rat cardiac
myocites. Circulation 1999;100:305-1
124.
Newby DE : The renin angiotensin system and endothelial dysfunction in chronic
heart failure: role of endogenous fibrinolysis. Congest Heart Fail 1999;5:254-59
125.
Landmesser U, Cai H, Dikalov S, McCann L, Hwang J, Jo H, Holland SM, Harrison
DG. Role of p47phox in vascular oxidative stress and hypertension caused by angiotensin II.
Hypertension. 2002;40:511-5.
126.
Brilla CG, Zhou G, Rupp H, Maisch B, Weber KT.: Role of angiotensin II and
protaglandin E2 in regulating cardiac fibroblast collagen turnover. Am J Cardiol
1995;76:D8-13
127.
Krüger M, Sachse C, Zimmermann WH, et al. Thyroid hormone regulates
developmental titin isoform transitions via the phosphatidylinositol-3-kinase/AKT
pathway. Circ Res 2008;102:439-47
128.
Brede M, Roell W, Weisman F,Jahns R, Haase A, Fleischmann BK, Heia I, Cardiac
hypertrophy is associated with decreased eNOS expression in angiotensin AT2 receptordeficient mice. Hypertension 2003;42:1177-82
129.
Oishi Y, Orono R, Yano Y, Teranisho Y, Akishita M, Horiuchi M, Oshima T, Kambe M,
Cardioprotective role of AT2 receptor in postinfarction left ventricular remodeling.
Hypertension 2003;41:814-18
130.
Dzau VJ; Gibbons GH; Pratt RE : Molecular mechanisms of vascular reninangiotensin system in myointimal hyperplasia. Hypertension 1991;18(Suppl) II100-05
131.
Brenner & Rector's The Kidney. Edited by Taal MW, Chertow GM, Warsden PA,
Storecky K, Yu ASL, Brenner BM. 7th. Ed., 2011. www.mdconsult.com. (online)
132.
de Silveira KD, Pompermayer Bosco KS, Diniz LR, Carmona AK, Cassali GD, BrunaRomero O, de Sousa LP, Teixeira MM, Santos RA, Sampaio e Silva AC, Ribeiro Vieira MA.
ACE2-angiotensin-(1-7)-Mas axis in renal ischemia/reperfusion injury in rats. Clin Sci
2010;119:385-94.
133.
Navar IG, Prieto MC, Satou R, Kobori H. Intrarenal angiotensin II and its
contribution to the génesis of chronic hypetension. Curr Opin Pharmacol 2011;11:180-86
134.
Cooper SA, Whalley –Connell A, Habibi J, et al.: Renin-angiotensin-aldosterone
system and oxidative stress in cardiovascular insulin resistance. Am J Physiol Heart Circ
Physiol 293:H2009-23
135.
Brink M; Wellen J; Delafontaine P Angiotensin II causes weight loss and decreases
circulating insulin-like growth factor I in rats through a pressor-independent mechanism. J
Clin Invest 1996;97:2509-16
136.
Berry C, Clark ALÑ : Catabolism in chronic heart failure. Eur Heart J 2000;21:521-32
137.
Gavras I, Gavras H : Angiotensin as a cardiovascular risk factor. J Hum Hypertens
2002;16(suppl 2):S2-6
138.
Jiang L, Wang M, Zhang J, Monticone RE, Telijohann R, Spínetti G, Pintus G, Lakatta
EG.: Increased aortic calpain-1 activity mediates age-associated Ang II signaling in vascular
smooth muscle cells. PLoS ONE 2008;3:e2231
85
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
139.
Laursen JB; Rajagopalan S; Galis Z; Tarpey M; Freeman BA; Harrison DG : Role of
superoxide in angiotensin II-induced but not catecholamine-induced hypertension.
Circulation 1997;95:588-93
140.
Oskarsson HJ, Heistad DD. : Oxidative stress produced by angiotensin too.
Implications for hypertension and vascular injury. Circulation 1997;95:557-59
141.
Nakane H, Miller FJ, Faraci FM, Toyoda K, Heistad DD : Gene transfer of endotelial
nitric oxide synthase reduces angiotensin II-induced endotelial dysfunction. Hypertension
2000;35:595-601
142.
Kerr S, Brosnan J, McIntyre M, Reid JL, Dominiczak AF, Hamilton CA. Superoxide
anion production is increased in a model of genetic hypertension. Role of the
endothelium. Hypertension 1999;33:1353-58.
143.
Vajapey R, Rini D, Walston J, Abadir P. The impact of age-related dysregulation of
the angiotensin system on mitocondrial redox balance. Front Phusiol 2014;5 (Art.439)
144.
Luther JM, Gainer JV, Murphey LJ, Yu C, Vaughan DE, Morrow JD, Brown
NJ.:Angiotensin II Induces Interleukin-6 in Humans Through a Mineralocorticoid Receptor–
Dependent Mechanism. Hipertensión 2006;48:1050-57
145.
Rajagopalan S; Kurz S; Munzel T; Tarpey M; Freeman BA; Griendling KK; Harrison
DG. Angiotensin IImediated hypertension in the rat increases vascular superoxide
production via membrane NADH/NADPH oxidase activation. Contribution to alterations of
vasomotor tone. J Clin Invest 1996;97:1916-23
146.
Reckelhoff JF : Gender differences in the regulation of blood pressure.
Hypertension 2001;37:1199-208
147.
Wilson JD, Foster DW, Kronenberg HM, Larsen PR. Adrenal Cortex. In Williams
Textbook of Endocrinology.9th Edition. WB Saunders Co., Philadelphia, USA,1998
148.
Ikeda U, Hyman R, Smith TW, Medford RM. Aldosterone-mediated regulation of
Na+, K+-ATPase gene expression in adult and neonatal rat cardiocytes. J Biol Chem.
1991;266:12058–12066.
149.
Duprez DA, Bauwens FR, De Buyzere ML, De Backer TL et al: Influence of arterial
blood pressure and aldosterone on left ventricular hypertrophy in moderate essential
hypertensison. Am J Cardiol 1993;71:17A-20A
150.
Brilla CG, Maisch B, Weber KT. Myocardial collagen matrix remodelling in arterial
hypertension. Eur Heart J.1992;13(suppl D):24–32.
151.
Lombes M, Alfaidy N, Eugene E, Lessana A, Farman N, Bonvalet JP. Prerequisite for
cardiac aldosteroneaction. Mineralocorticoid receptor and 11 ß-hydroxysteroid
dehydrogenase in the human heart. Circulation.1995;92:175–182
152.
Silvestre JS, Robert V, Heymes C, Aupetit-Faisant B, Mouas C, Moalic JM,
Swynghedauw B, Delcayre C. Myocardial production of aldosterone and corticosterone in
the rat. Physiological regulation. J Biol Chem.1998;273:4883–4891
153.
Williams GH : Aldosterone biosynthesis, regulation, and classical mechanism of
action. Heart Fail Rev 2005;10:7-13
154.
Mihailidou AS, Buhagiar KA, Rasmussen HH. Na+ influx and Na+-K+ pump activation
during short-term exposure of cardiac myocytes to aldosterone. Am J Physiol.
1998;274:C175–C181.
86
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
155.
Korichneva I, Puceat M, Millanvoye-Van Brussel E, Geraud G, Vassort G.
Aldosterone modulates both the Na+/H antiport and Cl/HCO3 exchanger in cultured
neonatal rat cardiac cells. J Mol Cell Cardiol. 1995;27:2521–2528.
156.
Wehling M, Neylon CB, Fullerton M, Bobik A, Funder JW. Nongenomic effects of
aldosterone on intracelular Ca2+ in vascular smooth muscle cells. Circ Res. 1995;76:973–
997
157.
Bénitah J-P, Vassort G : Aldosterone upregulates Ca2+ current in adult rat
cardiomyocytes. Circ Res 1999;85:1139-45
158.
Mulrow PJ, Franco-Saenz R : The adrenal renin-agiotensin system: a local hormonal
regulator of aldosterone production. J Hypertension 1996;14:173-76
159.
Liu SL, Schmuck S, Chorazcyzewski JZ, et al: Aldosterone regulates vascular
reactivity. Circulation 2003;108:*** (Internet)
160.
Sütsch G, Bertel O, Riskenbacher P, Clozel M, Yandle TG, Nicholls MG, Kiowski W :
Regulation of aldosterone secretion in patients with chronic congestive heart failure by
endothelins. Am J Cardiol 2000;85:973-76
161.
Struthers AD : Aldosterone: Cardiovascular assault. Am Heart J 2002;144:S2-7
162.
McMahon EG. Recent studies with eplerenone, a novel selective aldosterone
receptor antagonist. Curr Opin Pharmacol 2001 Apr;1(2):190-6
163.
Christ M, Günther A, Heck M et al: Aldosterone, not estradiol, its the physiological
agonist for increases in cAMP in vascular smooth muscle cells. Circulation 1999;99:148591
164.
Bonvalet JP, Alfaidy N, Farman N, Lombès M.: Aldosterone: intracellular receptors
in human heart. Eur Heart J 1995;16(suppl N):92-97
165.
Struthers AD.: Aldosterone in chronic heart failure: have we forgotten it ?. In Heart
Failure in Clinical Practice, Edited by John JV McMurray and John GF Cleland, Martin
Dunitz Ltd., London, 1996
166.
Brilla CG, Matsubara LS, Weber KT. Anti-aldosterone treatment and the prevention
of myocardial fibrosis in primary and secondary hyperaldosteronism. J Mol Cell Cardiol.
1993;25:563–575
167.
Cohn JN, Colucci W.: Cardiovascular effects of aldosterone and post-acute
myocardial infarction pathophysiology. Am J Cardiol 2006;97 [Suppl]:4F-12F
168.
Brilla CG, Zhou G, Matsubara LS, Weber KT. Collagen metabolism in cultured adult
rat cardiac fibroblasts: response to angiotensin II and aldosterone. J Mol Cell Cardiol.
1995;28:809–820.
169.
Robert V, Thiem NV, Cheav SL, Mouas C, Swynghedauw B, Delcayre C. Increased
cardiac types I and III collagen mRNAs in aldosterone-salt hypertension. Hypertension.
1994;24:30–36.
170.
Young M, Fullerton M, Dilley R, Funder JW. Mineralocorticoids, hypertension and
cardiac fibrosis. J Clin Invest. 1994;93:2578–2583.
171.
Delcayre C, Silvestre J-S : Aldosterone and the heart: towards a physiological
function? Cardiovasc Res 1999;43:7-12
172.
Tanhehco EJ, Rudolph AE, Susuki G et al:The aldosterone receptor antagonist,
eplerenone, decreases gelatinase activity in dogs with chronic heart failure. Circulation
2002;106:II-510(2521-abstract)
87
INSUFICIENCIA CARDIACA CRÓNICA- DR. FERNANDO DE LA SERNA
173.
Barbato JC, Rashid S, Mulrow PJ, Shapiro JI, Franco-Saenz R. Mechanisms for
aldosterone andspironolactone-induced positive inotropic actions in the rat heart.
Hypertension. 2004;44:751-7.
174.
Oberleithner H, Ludwig T, Riethmüller C, Hillebrand U, Altermann L, Schafer C,
Shahin V ; Human endothelium, target for aldosterone. Hypertension 2004;43:952-56
175.
Schiffrin EL. The many targets of aldosterone. Hypertension. 2004;43:938-40
176.
Caprio M, Newfell BG, la Sala A, et al.: Functional mineralocorticoid receptor in
human vascular endotelial cells regulates ICAM-1 expression and promotes leukocyte
adhesion. Circ Res 2008;102:1359-67
177.
Larsen: Williams Textbook of Endocrinology, 10th ed., Copyright © 2003 Saunders.
In MDconsult.http://www.mdconsult.com
178.
Costello-Boerritger LC; Smith WB, Boerritger G, Ouyang J, Zimmer CA, Orlandi C,
Burnett JC. Vasopressin-2-receptor antagonism augments water excretion without chages
in renal hemodynamics or sodium and potassium excretion in human heart failure. Am J
Physiol Renal Physiol 2006;290:F273-F278
179.
Caldwell HK, Lee H-J, MacBeth AH, Scott Young III W.: Vasopressin;behavioral roles
of an“original”neuropeptide. Prog Neurobiol 2008;84:1-24
180.
Chatterjee K: Neurohormonal activation in congestive heart failure and the role of
vasopressin. Am J Cardiol 2005;95[suppl]:8B-13B
181.
Lee CR, Watkins MI, Patterson JH, Gattis W, O’Connor CM, Gheorghiade M, Adams
KF: vasopressin: a newtarget for the treatment of heart failure. Am Heart J 2003;146:9- -------------------------------------
88