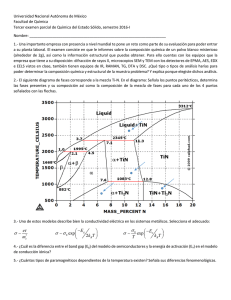
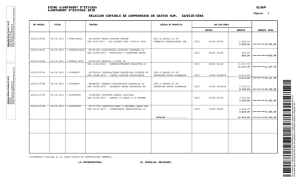
Compara las intensidades de las dos primeras líneas de emisión de
Anuncio

Compara las intensidades de las dos primeras líneas de emisión de la serie de Lyman del átomo de hidrógeno, Ly Ly . y Solución: Tenemos que las líneas son Ly : 2p ! 1s y Ly : 3p ! 1s La probabilidad de emisión, integrada sobre todas las direcciones y sumada sobre los dos estados de polarización es P = 4 e2 ! 3 2 jhf j ~r jiij 3 }c3 La intensidad de una línea espectral (energía por segundo) es porporcional a !P , de tal manera que para las dos líneas en consideración tenemos la siguiente razón entre las intensidades I = I 4 E E h1sj ~r j2pi h1sj ~r j3pi 2 Tenemos que E = 1 2 1 3 = 8 8 1 2 1 4 = 18 9 y E = Ahora 1 j1si = p exp ( r) 1 j2p; m = 0i = p r exp ( r=2) cos 4 2 j3p; m = 0i = 4 p 27 2 r r2 6 exp ( r=3) cos No importa el valor de m. Para más fácil usamos, = x + iy = r sin exp (i ) =x iy = r sin exp ( i ) z = r cos h1sj j2pi ! R2 0 exp (i ) d = 0 h1sj j2pi = 0 h1sj j2pi = 0 h1sj j3pi = 0 h1sj j3pi = 0 1 R R2 1 R1 drr4 exp ( 3r=2) 0 d sin cos2 0 d h1sj z j2pi = p 0 4 2 R 1 R1 = p 0 drr4 exp ( 3r=2) 0 d sin cos2 2 2 R 0 sin cos2 d = 2 3 1 R1 h1sj z j2pi = p 0 drr4 exp ( 3r=2) 3 2 R1 0 r4 exp ( 3r=2) dr = 256 81 1 256 128 p h1sj z j2pi = p = 2 243 3 2 81 h1sj z j3pi = = R 0 27 2 sin cos2 d = R1 r3 r h1sj z j3pi = I = I E E R1 0 8 R1 p drr3 r 27 2 0 h1sj z j3pi = 0 4 p r2 6 exp ( 4r=3) exp ( 4r=3) 2 3 16 R 1 p drr3 r 81 2 0 r2 6 r2 6 drr3 r r2 6 exp ( 4r=3) dr = R 0 R 0 d sin cos2 d sin cos2 exp ( 4r=3) 2187 1024 27 p 16 2187 p = 2 128 81 2 1024 4 h1sj ~r j2pi h1sj ~r j3pi 2 = 3=8 4=9 4 1 128 p 2 2 C B 243 @ 27 p A = 3: 16 2 128 0 2 R2 0 d