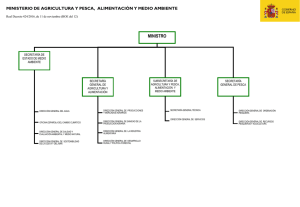
La diversidad genetica de los recursos pesqueros
Anuncio

FAO DOCUMENTO TECHNICO DE PESCA 344 La diversidad genética de los recursos pesqueros marinos Posibles repercusiones en la pesca TABLE OF CONTENTS por P.J.Smith Fisheries Research Centre Ministry of Agriculture and Fisheries P.O.Box 297 Wellington, Nueva Zelandia Las denominaciones empleadas en esta publicación y la forma en que aparecen presentados los datos que contiene no implican, de parte de la Organización de las Naciones Unidas para la Agricultura y la Alimentación, juicio alguno sobre la condición juridica de paises, territorios, ciudades o zonas, o de sus autoridades, ni respecto de la delimitación de sus fronteras o limites. M-42 ISBN 92-5-303631-1 Reservados todos los derechos. No se podrá reproducir ninguna parte de esta publicación, ni almacenarla en un sistema de recuperación de datos o transmitirla en cualquier forma o por cualquier procedimiento (electrónico, mecánico, fotocopia, etc.), sin autorización previa del titular de los derechos de autor. Las peticiones para obtener tal autorización, especificando la extensión de lo que se desea reproducir y el propósito que con ello se persigue, deberán enviarse al Director de Publicaciones. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Viale delle Terme di Caracalla, 00100 Roma, Italia. Organización de las Naciones Unidas Para la Agricultura y la Alimentación Roma, 1996 © FAO http://www.fao.org/DOCREP/003/V4865S/V4865S00.htm#TOC PREPARACION DEL PRESENTE DOCUMENTO La conservación de la biodiversidad en los océanos se ha descuidado más que la conservación terrestre, pese a que los océanos nos ofrecen una diversidad muy rica en genética, especies y ecosistemas. Los recursos pesqueros son un subgrupo muy importante de la biodiversidad del mundo. Dichos recursos se ven afectados por las actividades humanas, entre las que figuran la pesca, la acuicultura y otros sectores económicos. El presente documento ofrece una panorámica de la diversidad genética de los recursos pesqueros marinos y destaca especialmente las repercusiones de la pesca sobre ellos. La comprensión de estas repercusiones constituye un importante requisito previo de nuestro esfuerzo para formular una estrategia que impida una posible pérdida de la biodiversidad. Este documento es obra del Dr. Peter J. Smith de Nueva Zelandia, que ha venido trabajando en asuntos de pesca y se interesa especialmente por la biodiversidad. El autor agradece al Dr. Devin Bartley, del Departamento de Pesca de la FAO, sus valiosas observaciones sobre el manuscrito de este documento y también al Dr. Purwito Martosubroto su colaboración. Las opiniones expresadas en este documento son únicamente las de su autor y no representan necesariamente las opiniones de la FAO. Distribución : Departamento de Pesca de la FAO Oficiales Regionales de Pesca de la FAO Directores de Pesca Organizaciones Regionales e Internacionales de Pesca Smith. P. J. La diversidad genética de los recursos pesqueros marinos: posibles repercusiones de la pesca. FAO Documento Técnico de Pesca. No. 344. Roma, FAO. 1996. 59p. RESUMEN En este informe se examinan los datos recogidos sobre los efectos genéticos de la pesca en la variación genética de los recursos pesqueros marinos. El método más difundido para medir la diversidad genética de las poblaciones naturales es el de la electroforesis de las proteínas : los teleósteos marinos tienen unos niveles de diversidad genética que oscilan del 0.0 al 18 por ciento y los invertebrados marinos del 0.4 al 32 por ciento. Los estudios genéticos realizados han puesto de manifiesto que las poblaciones de especies marinas están menos diferenciadas que las especies de agua dulce, experimentan variaciones genéticas temporales, pueden verse afectados localmente por la contaminación y contienen especies crípticas. Las variaciones genéticas de las poblaciones se producen por selección o deriva. En las poblaciones naturales la pesca constituye una importante fuente de mortalidad, que no es aleatoria con respecto a la edad ni a la talla de los individuos. En las pesquerías de teleósteos muy explotadas se ha observado frecuentemente una disminución de la edad o la talla al llegar a la madurez sexual. La pesca selectiva por tallas favorecería la madurez precoz. Sin embargo, las tasas de crecimiento de algunos peces depende de la densidad y aumenta con la reducción de la población. Unos índices de crecimiento más rápidos redundan en la reducción de la edad o la talla al principio de la madurez sexual. Por ello, no es posible determinar si los cambios observados tienen carácter genético o compensatorio, como reacción a la disminución de la densidad de la población. No es probable que la deriva genética sea un factor que influya considerablemente en la diversidad genética de muchas pesquerías marinas, excepto para determinadas poblaciones, v.g. las almejas gigantes, que se han visto reducidas a niveles próximos a la extinción. Algunos peces de agua dulce raros o en peligro de extinción, muestran bajos niveles de diversidad genética. No hay pruebas de que se haya producido una pérdida de la diversidad genética en poblaciones casi agotadas de las especies pelágicas. Si bien las poblaciones pueden considerarse agotadas desde el punto de vista comercial, la mayoría de ellas presentan grandes tamaños aun en su nivel más bajo. La utilización de criaderos para obtener reproductores destinados a la acuicultura y al mejoramiento podría conducir a la pérdida de la diversidad genética en las poblaciones naturales por la salida de individuos de las poblaciones cultivadas o una elección inapropiada de los reproductores. Es preciso realizar estudios experimentales para determinar los efectos hereditarios y la respuesta a la selección de los caracteres del ciclo biológico de las especies explotadas y determinar si al aliviar la presión de pesca se favorecen los genes de “rápido crecimiento“ y la ”madurez tardía” o complejos de genes de las poblaciones. También sería interesante seguir la diversidad genética de las especies muy explotadas o recientemente explotadas. La combinación de los estudios experimentales con los de campo permitiría una comprobación más rigurosa de las variaciones genéticas en las poblaciones explotadas. Caso de demostrarse la aparición de variaciones genéticas en las especies explotadas sería preciso entonces modificar las actividades de ordenación para conservar los niveles de diversidad naturales. Los hiperenlances que remiten a sitios Internet distintos de los de la FAO no implican, de parte de la Organización, ratificación oficial o responsabilidad respecto a opiniones, ideas, datos o productos presentados en dichos sitios, o una garantía de validez acerca de las informaciones que contienen. El único propósito de los enlaces a sitios distintos de los de la FAO es proporcionar otras informaciones disponibles sobre asuntos conexos. INDICE INTRODUCCION VARIACIONES DE LAS POBLACIONES DE PECES LA DIVERSIDAD GENETICA DE LAS ESPECIES MARINAS Determinación de la diversidad genética Niveles de diversidad genética Diferenciación genética de las poblaciones marinas Variaciones genéticas temporales Especies crípticas Variaciones genéticas inducidas por la contaminación Caracteres del ciclo biológico FUERZAS QUE MODELAN LA ESTRUCTURA GENETICA DE LAS POBLACIONES EFECTOS SELECTIVOS DE LA PESCA Pruebas de las variaciones genéticas debidas a los efectos selectivos de la pesca preferencial a. Selección de tallas pequeñas y madurez precoz en el bacalao, Gadus morhua b. Selección de la madurez precoz en el eglefino, Melanogrammus aeglefinus c. Selección de la madurez precoz en los peces planos d. Selección de una talla menor a la madurez en la langosta e. Reducción de la edad del cambio de sexo en el camarón, Pandalus borealis f. Selección del desove tardío en el arenque, Clupea harengus g. Selección de una talla menor y una edad reducida en el salmón del Pacífico h. Selección de la madurez precoz en el salmón del Atlántico, Salmo salar i. Selección disruptiva en el salmón del Pacífíco j. Selección de la madurez precoz en los peces de lago k. Selección del tipo mórfico y de la talla reducida en el coregono, Coregonus lavaretus l. Pérdida de diversidad genética en el reloj anaranjado, Hoplostethus atlanticus m. Aumento de la diversidad genética del salmón rojo, Oncorhynchus nerka Estudios experimentales sobre la selección de los organismos acuáticos a. Selección de una tasa de crecimiento más lenta en el Oreochromis mossambicus b. Selección de la edad y talla a la madurez en los “guppies” Poecilia reticulata c. Selección de la talla en el Daphia magna Modelos para estudiar los efectos selectivos de la pesca VARIACIONES GENETICAS DEBIDAS A LA DERIVA Características genéticas de las poblaciones casi agotadas RESUMEN Y RECOMENDACIONES Variaciones genéticas debidas a la selección Variaciones genéticas debidas a la deriva Recomendaciones REFERENCIAS INTRODUCCION La pérdida de biodiversidad preocupa cada vez más en todo el mundo. La atención se ha centrado especialmente en los entornos terrestres y particularmente en los bosques tropicales, en los que tanto la destrucción del hábitat como el número de especies son elevados. En el medio acuático la conservación se ha dirigido especialmente a las aguas dulces, algunas de las cuales han sufrido cambios espectaculares e irreversibles (Micklin, 1988; White, 1988). En Norteamérica 27 especies de peces de agua dulce pertenecientes a tres géneros han quedado extinguidas en el pasado siglo (Miller et al., 1989). En cuanto al medio marino, la lista de las especies extinguidas se reduce a los mamíferos y a las aves mientras que la lista de especies amenazadas o en peligro está dominada por los mamíferos y las aves, así como algunos peces anádromos (Meffe, 1987; Upton, 1992). Los peces marinos de lento crecimiento y baja fecundidad son vulnerables a la pesca excesiva : de no reducirse los actuales niveles de explotación varias especies de tiburones pueden verse pronto en peligro de extinción (Manire y Gruber, 1990), mientras que la raya común se encuentra al borde de la extinción debido a la pesca comercial (Brander, 1981). La biodiversidad ha sido definida a grandes rasgos como “el grado de variedad de la naturaleza” (McNeeley, 1988) y como “la variedad de la vida y sus procesos” (Hughes y Noss, 1992) y abarca todas las especies de plantas, animales y microorganismos, junto con sus ecosistemas (Kapoor-Vijay, 1992). La biodiversidad se manifiesta en cuatro niveles: a. diversidad genética : la suma total de información contenida en los genes de los distintos organismos de una especie; b. diversidad de especies: el número y frecuencia de los organismos en una determinada zona; c. diversidad de ecosistemas: la variedad de los procesos ecológicos, comunidades y hábitats dentro de una región, y d. diversidad del paisaje: la heterogeneidad espacial de los distintos ordenamientos territoriales y ecosistemas dentro de una región comprendida en un cuadrado de 100 a 10 000 000 km de lado de lado (Noss, 1983; Norse et al., 1986; OTA, 1987). En el medio marino la diversidad de las especies y de los ecosistemas es muy grande y posee más filas y clases que el medio terrestre ya que sus organismos oscilan desde las plantas y animales unicelulares hasta las ballenas. El número de especies de teleósteos asciende a 20 000 y representa casi la mitad de las especies de vertebrados. Se explotan unas 9 000 especies de teleósteos y la captura correspondiente a 22 de ellas supera las 100 000 toneladas anuales. Alrededor del 58 por ciento de los peces son marinos, y aunque los océanos cubren los dos tercios del planeta la mayor parte de los peces marinos se encuentran an aguas costeras, que representan al menos el 10 por ciento de la superficie mundial. Se ha dicho que la zona costera está siendo alterada con tanta rapidez como los bosques tropicales, y saber qué ecosistema tiene más o menos especies puede inducir a error (Ray, 1988). La relativa falta de conocimiento sobre la pérdida de la diversidad marina se debe en parte al alejamiento y a la dificultad de vigilar los hábitats marinos. La pérdida de la diversidad forestal se produce por simplificación, fragmentación y destrucción selectiva (Norse, 1990), especialmente cuando la ordenación se centra en unas pocas especies (Cairns y Lackey, 1992). La transformación de zonas marinas en terrestres, la contaminación y la pesca excesiva producen efectos parecidos en las zonas costeras. La productividad de la agricultura terrestre alcanza sus valores más altos cuando los sistemas se han simplificado y están surgiendo tendencias parecidas en los medios costeros con el desarrollo de la acuicultura y del mejoramiento de las poblaciones (Ray, 1988). La conservación genética de los recursos acuáticos se ha centrado en los recursos de agua dulce y anádromos, en los que los problemas de la modificación del hábitat, las introducciones, y la sobrepesca son más agudos y urgentes (Ryman, 1981, 1991 ; Meffe, 1987; Skaala et al., 1990; Hindar et al., 1991; Mickley y Deacon, 1991; Nyman, 1991; Moyle y Leidy, 1992, Cloud y Thorgaard, 1993). Cada vez se presta más atención a la pérdida de la diversidad genética en el medio marino y se han presentado estudios al respecto por parte de la FAO, 1981, 1993; Polunin, 1983; Nelson y Soule, 1987; Ray, 1988; Carlton, 1989; PDT, 1990; Upton, 1992; Munro, 1993; Policansky, 1993. El tema principal del presente documento es la diversidad genética en el medio marino y las posibles repercusiones de la pesca. Las variaciones genéticas debidas a la explotación se han observado en una serie de pesquerías, desde el Océano Artico hasta los lagos tropicales de Africa. Los primeros informes sobre las respuestas genéticas a la explotación se presentaron por primera vez en los años setenta, antes de que se hubieran obtenido los métodos directos para medir la diversidad genética, tales como la electroforesis de las alozimas. Gran parte de las pruebas de las variaciones genéticas en las poblaciones de peces se basan en los caracteres del ciclo biológico, tales como las tasas de crecimiento, la talla por edades, y la talla o edad al llegar a la madurez. Dichos caracteres se ven influidos tanto por factores genéticos como por el medio ambiente. Las complejas, y mal comprendidas, relaciones entre los componentes genéticos de los caracteres del ciclo biológico y las respuestas no genéticas de dichas características a las variaciones de la densidad de la población y de los parámetros ambientales, hacen que sea difícil separar las repercusiones genéticas y no genéticas de la pesca sobre las poblaciones naturales. Por ello es necesario describir los principales factores que ocasionan cambios en las poblaciones de peces, antes de examinar la diversidad genética y las pruebas de las repercusiones que tiene la pesca. VARIACIONES DE LAS POBLACIONES DE PECES Las poblaciones de peces marinos fluctúan mucho debido tanto a circunstancias climáticas como a los efectos de la pesca. Se ha visto que algunas poblaciones han fluctuado mucho a lo largo de los siglos (Cushing 1982; Soutar e Isaacs, 1969), mientras otras muestran variaciones en el reclutamiento, apreciables en tan solo unos pocos años (Cushing 1965, 1982 ; Kawasaki et al., 1991). Las circunstancias climáticas pueden producir cambios en las poblaciones de peces tanto a corto como a largo plazo. Cushing (1975) estima que la relación entre el clima y la producción depende de la proporción entre las larvas de peces y el alimento de que disponen, especialmente en aguas templadas donde los peces tienden a desovar en períodos fijos, mientras que el ciclo de producción de alimentos es variable. En las pesquerías se ha observado la sustitución temporal de una especie por otra. En la parte occidental del Canal de la Mancha, durante los últimos años veinte y los treinta, la población de arenques disminuyó y vino a ser sustituida por la sardina (Cushing, 1975). No hay indicios de que estos cambios fueran debidos a la pesca, sino que más bien se asocian con el alza de la temperatura marina, que condujo a la sustitución de unas especies propias de aguas más frías por unas especies de teleósteos e invertebrados propios de aguas más templadas (Southward, 1963). En los años cincuenta, las poblaciones de sardinas disminuyeron frente a las costas de California y fueron sustituidas por las anchoas (Ahlstrom, 1966). Tal disminución se atribuye al cambio de temperatura, pero vino reforzada por las actividades pesqueras (Beverton, 1990; Cushing ,1982). Las escamas de pescado conservadas en sedimentos anaeróbicos frente a California ofrecen una huella cronológica de la abundancia de peces pelágicos, que muestran la fluctuación de la abundancia de las sardinas y anchoas a lo largo de centenares de años (Soutar e Isaacs, 1969). Existen cada vez más indicios de que se producen cambios sincrónicos de las poblaciones de peces a nivel mundial. Se han producido cambios en poblaciones separadas por grandes distancias pese a los diferentes métodos de ordenamiento de las regiones (Maan, 1993). Por ejemplo, en los últimos ochenta años, las capturas de sardinas en las pesquerías del Perú y California han variado al mismo ritmo que las capturas de sardinas en Asia sudoriental (Maan, 1993). La evolución de la corriente El Niño en el Pacífico ocasiona bajas capturas de sardinas frente a las costas del Perú y grandes capturas de jureles frente a las costas de Tasmania (Maan, 1993). Dichas observaciones ofrecen abundantes pruebas de que los acontecimientos climáticos en gran escala tienen gran influencia en la abundancia de las poblaciones de peces, por lo que la vigilancia de la evolución climátologica ofrece un instrumento de previsión para fijar las cuotas (Maan, 1993). Muchas pesquerías presentan un régimen de explotaciones sucesivas: el agotamiento de una especie viene seguido por la explotación de otras especies. La flota pelágica noruega pasó de capturar arenques para pasar al capelán y después a los jureles en los años sesenta (Garrod, 1973). En las pesquerías del mar del Norte los desembarques se mantuvieron relativamente constantes entre 1–1,5 millones de toneladas anuales durante cincuenta años, pero aumentaron rápidamente en los años sesenta con el desarrollo de las pesquerías industriales, primeramente con arenques y jureles juveniles y posteriormente con faneca noruega, anguilas y espadines (Hempel, 1978). A medida que las poblaciones de lenguado se iban agotando, los pescadores se trasladaron a otras zonas (Garrod, 1973). Esta tónica de sustitución no se ha debido a un aumento de la abundancia de las especies secundarias, sino al cambio de los objetivos de pesca tras la sobreexplotación de las especies primarias (Daann, 1980). En las pesquerías de salmón del Pacífico algunas poblaciones pequeñas han desaparecido debido a la pesca excesiva (Loftus, 1976). En el mar de Irlanda, la raya común, Raia batis, fue corriente en un tiempo, pero en la actualidad es muy rara. Esta especie tiene un crecimiento lento, llega a la madurez a una edad avanzada y su fecundidad es baja, en comparación con los teleósteos demersales que son objeto de la pesca de arrastre en el mar de Irlanda (Brander, 1981). Los peces pelágicos parecen ser menos resistentes a los cambios climáticos a largo plazo que las especies demersales, debido a su más baja fecundidad (Cushing, 1975) y ciclos biológicos más cortos (Maan, 1993). Además, la forma en que se comportan sus bancos los hace más vulnerables a los métodos de pesca industrial (Rothschild, 1986) y en los últimos cincuenta años la abundancia de varias especies ha sufrido una brusca reducción. La pesca ha sido la principal causa de esta casi desparición de las poblaciones del arenque del Atlántico, el arenque del Pacífico, la sardina del Pacífico, la sardina japonesa, la sardina del Atlántico Sur, la anchoa peruana, el capelán del mar de Barents, y el jurel del Pacífico (Beverton, 1990). De cada 10 casos de poblaciones bruscamente reducidas, nueve se han recuperado cuando se ha suspendido o reducido la pesca, siendo las poblaciones que han sufrido una reducción más drástica las que han arrojado una tendencia a la recuperación más lenta. Unicamente los arenques islandeses que desovan en primavera, que se redujeron bruscamente a fines de los años sesenta y principios de los setenta, no han mostrado signos de recuperación hasta la fecha (Beverton, 1990). La “explosión de los gádidos” (Cusing, 1984) y el correspondiente aumento de la pesca industrial en el mar del Norte puede atribuirse en parte a la disminución de la población de arenques (Beverton, 1990) que liberó alimentos para los reclutas de gádidos, pero el aumento de estas poblaciones se debió en realidad a cambios naturales del ecosistema. La producción en primavera del zooplancton Calanus, la alimentación principal de las larvas del bacalao, se vio retrasada cosa de un mes como reacción a unas temperaturas marinas más bajas en los años sesenta y setenta, lo que redundó en un mejor equilibrio entre la densidad de los alimentos y las larvas del bacalao, que se producen en una estación de desove fija (Cushing, 1984). En los últimos treinta años se han producido cambios importantes en la biomasa y en la composición de las especies demersales del Atlántico nordoccidental (Fogarty, 1992). La pesquería en Georges Bank pasó de estar dominada por gádidos en 1963 a estarlo por la de mielgas en 1986, cambio ocasionado por la elevada mortalidad por pesca del bacalao y el eglefino y un aumento de la abundancia de las mielgas (Sissenwine y Cohen, 1993). Como respuesta típica a la pesca, una población mostrará una disminución de la edad media a medida que desaparecen los peces mayores y más viejos, dejando una mayor proporción de peces jóvenes de más rápido crecimiento; este efecto de “renovación pesquera” fue descrito en primer lugar por Baranov (1918). El crecimiento de los peces depende en parte de la densidad de la población, por lo que cuando se reduce la biomasa mediante la pesca la tasa de crecimiento puede aumentar y, en condiciones de pesca moderada, puede conducir incluso a un aumento de la talla media por edades. Por ejemplo, en las poblaciones de platija, Platichthys flesus, del Báltico meridional, la edad media de los peces y las tasas de captura disminuyeron a medida que aumentó la pesca entre 1905–25, pero la longitud y pesos medios de los peces aumentaron (Kandler, 1932). Sin embargo, para 1931 la longitud media había empezado a decrecer, ya que el aumento de la tasa de crecimiento fue insuficiente para contrarrestar el ritmo de retirada de los peces de la población (Kandler, 1932). Este efecto se consideró positivo, ya que mejoraba el valor económico de la población (Kandler, 1932). En las pesquerías de platija americana, Hippoglossoides platessoides, en los Grand Banks la talla media por edades aumentó entre los años cincuenta a setenta, aun cuando las tasas de captura disminuyeron durante el mismo período como reacción a un aumento de la explotación (Pitt, 1975). Durante este período no hubo tendencias importantes de la temperatura que puedan haber afectado a las tasas de crecimiento, pero la reducción de la densidad de la platija americana y de la competencia pesquera dejó más alimentos disponibles para la platija (Pitt, 1975). La formulación de una teoría de la pesca se atribuye a Baranov en la Federación de Rusia y a Thompson en los Estados Unidos de América. Este campo de la dinámica de las poblaciones fue ampliado y desarrollado por muchos otros estudiosos, para convertirse en el núcleo central de la ciencia de la pesca. Los modelos de ordenación se basan en el concepto de la producción excedentaria y el máximo rendimiento sostenible. Se supone que las poblaciones están en equilibrio y alcanzan sus dimensiones óptimas de conformidad con la capacidad del medio ambiente. Cuando la población se reduce por la pesca, el reclutamiento y el crecimiento aumentan para devolver a la población su equilibrio. El aumento compensatorio del crecimiento y reclutamiento como reacción a la explotación es corriente y ha sido tratado con frecuencia en los trabajos sobre la pesca. Estos cambios compensatorios han ocultado las variaciones genéticas en los caracteres del ciclo biológico debidos a la explotación, lo que ha dificultado la detección de los efectos genéticos. LA DIVERSIDAD GENETICA DE LAS ESPECIES MARINAS Determinación de la diversidad genética La electroforesis de la gelatina, combinada con la separación química de proteínas específicas, empezó a utilizarse en los años sesenta y se convirtió en el método más difundido para medir la variación genética de las poblaciones naturales. Esta técnica es relativamente barata y ofrece una medición de muchos genes variables y no variables de los individuos y las poblaciones. Los fenotipos de la gelatina son fáciles de interpretar y existen programas informáticos para el análisis de los datos. La mayor parte de los estudios de la diversidad genética de las especies marinas se han basado en la proteínas y la diversidad se mide como la heterocigosis media de muchos loci proteínicos (la heterocigosis es la proporción de individuos que son heterocigóticos en un solo locus génico). Los genes de las proteínas representan tan sólo cerca del 10 por ciento del genoma, por lo que las variaciones medidas mediante la electroforesis de las proteínas pueden no ser representativas de la totalidad del genoma. La relación entre la heterocigosis de las proteínas y la aptitud física no está clara, si bien hay indicios de que existe una relación positiva entre la heterocigosis y los caracteres del ciclo biológico, tales como la tasa de crecimiento, la resistencia a las enfermedades, y la estabilidad del crecimiento (Mitton y Grant, 1984; Allendorf y Leary, 1986; Danzmann et al., 1989). Los grandes adelantos de la biología molecular ofrecen una serie de técnicas para el examen directo de las variaciones del ADN. Hasta la fecha, la mayor parte de los estudios de las poblaciones se han basado en los polimorfismos de la longitud del fragmento de restricción del genoma mitocondrial. El ADN mitocondrial (mt) es pequeño y relativamente fácil de purificar y los fragmentos generados por las digestiones de enzimas de restricción son fáciles de interpretar. Las variaciones del número de fragmentos están ocasionadas por adiciones y supresiones de los lugares de restricción, y las de las longitudes de los fragmentos por las inserciones o supresiones de los bloques de bases. Pueden aplicarse técnicas parecidas al ADN nuclear (n), pero el tamaño considerablemente mayor de este ADN significa que los fragmentos minúsculos del genoma deben analizarse con ensayos específicos. Varias regiones del genoma nuclear contienen repeticiones múltiples de breves secuencias de minisatélites que aparecen como la “huella genética” del ADN. La naturaleza hipervariable de estas repeticiones aparejadas de número variable ha llevado a la utilización generalizada de la “huella genética ” del ADN en los estudios forenses, pero esta técnica tiene una aplicación limitada en los estudios de las poblaciones marinas (Baker et al., 1992). La formulación del método de la reacción en cadena de las polimerasas ha ofrecido el medio para amplificar lo pequeños fragmentos del genoma. Con primarios de tamaño apropiado el método puede utilizarse para detectar la variación genética de individuos y poblaciones o, también, permite determinar la secuencia de los fragmentos ampliados. La aplicación de estos nuevos métodos genéticos puede aumentar nuestros conocimientos de la estructura genética de las poblaciones naturales, como ocurrió con la electroforesis de las proteínas en los años setenta y ochenta, si bien estos métodos no se han utilizado hasta la fecha con gran profusión para las especies marinas. Para medir la variación genética pueden utilizarse también los métodos cariológicos, ya sea la variación del número de cromosomas o los polimorfismos de banda. Estas técnicas resultan laboriosas en comparación con las técnicas electroforéticas, ya que exigen el uso de peces vivos para las preparaciones de cromosomas, lo que reduce sus posibles aplicaciones para muchas especies marinas. Los caracteres morfológicos, que han sido la base de la taxonomía tradicional, se han utilizado para describir las variaciones entre individuos y poblaciones. Los caracteres utilizados son merísticos (pueden contarse), tales como el número de rayos o vértebras de las aletas, y morfométricos (mesurables) expresados como cocientes de la longitud estándar o longitud de la horquilla. Los caracteres morfológicos presentan limitaciones para describir la diversidad genética intraespecífica por ser poligénicos y su expresión puede verse modificada por el medio ambiente. Su empleo en los estudios para la identificación de poblaciones ha sido sustituido en su mayor parte por la obtención de métodos genéticos directos. Las estrategias y características del ciclo biológico de una especie han quedado determinados por procesos evolutivos y ecológicos. Dichas estrategias y caracteres determinarán, a su vez, cómo una población responde a la explotación y cómo puede ser modificada por ésta (Garrod y Knights, 1979; Garrod y Horwood, 1984). Los caracteres del ciclo biológico que deciden la aptitud física de las poblaciones de peces son la tasa de crecimiento, la edad y la talla a la madurez, la duración de la vida y la fecundidad. Todos estos rasgos manifiestan la plasticidad del fenotipo y se adaptan a los cambios del medio; además, estos rasgos son hereditarios y los valores medios de la población pueden modificarse por la mortalidad diferencial. La importancia relativa de la plasticidad del fenotipo y de la variación genética se desconoce para la mayor parte de las especies (Wootton, 1990) y debido a las dificultades para distinguir entre los componentes genéticos y ambientales, los caracteres del ciclo biológico no se han estudiado tan a fondo como los marcadores de proteínas en las especies marinas. Es probable que los caracteres del ciclo biológico se vean influidos por un elevado número de loci segregantes (Bentsen, 1994). Se dispone de algunas estimaciones sobre el carácter hereditario de algunos rasgos para las especies utilizadas en acuicultura (véanse referencias en Wilkins y Gosling, 1983; Gall y Busack, 1986; Crandell y Gall, 1993a, 1993b), que junto con resultados de los programas de selección (v.g. Gjedrem, 1983) demuestran la base genética de estos caracteres. Sin embargo, los experimentos realizados con trasplantes en la trucha marina, Salmo clarkii, y el salvelino, Salvelinus malma, handemostrado que los peces pueden ajustar su edad a la madurez ante los cambios de la tasa de crecimiento por causas no genéticas (Jonsson et al., 1984). Niveles de diversidad genética Los invertebrados por lo general tienen unos niveles de diversidad genética superior a la de los vertebrados según confirma la electroforesis de las proteínas (Nevo, 1978). Dentro de los vertebrados, la mayor diversidad genética corresponde a los anfibios y la inferior a los teleósteos (Ward et al., 1991). El significado ecológico de estas conclusiones para las especies marinas ha sido objeto de estudio (Nevo, 1978, 1983; Nelson y Hedgecock, 1980, Smith y Fujio, 1982, Mitton y Lewis, 1989; Waples, 1991). Los invertebrados marinos muestran una gran variedad de niveles de diversidad genética. En 26 especies de moluscos la heterocis oscila del 2 al 32 por ciento (Johannesson et al., 1989). Los crustáceos son los que tienen los niveles más bajos de diversidad genética, que oscila del 0,4 al 10,9 por ciento en 44 especies de los decápodos (Nelson y Hedgecock, 1980), del 0,8 al 6,4 por ciento en seis especies de decápodos tropicales y dos especies del golfo de Carpentaria (Redfield et al., 1980), y del 0,6 al 3,33 por ciento en 13 especies del camarón australiano (Mulley y Latter, 1980). En los teleósteos marinos la hetorocigosis oscila del 0,0 en el eglefino, Lophius litulor, (Fujio y Kato, 1979), el L. piscatorius, (Leslie y Grant, 1991), el Liparis tanakai (Fujio y Kato, 1979) y tres especies de cotídeos (Johnson y Utter, 1976), a más del 17 por ciento en el pelágico, Cololabris saira, (Fujio y Kato, 1979) y en el costero Fundulus heteroclitus, (Mitton y Koehn, 1975). La heterocigosis para 106 especies marinas fue del 5,5 por ciento arrojando altos niveles para los clupeiformes, atheriformes, y pleuronectiformes y bajos niveles los gadiformes y los escorpeniformes (Smith y Fujio, 1982). Los elasmobranquios tienen una baja heterocigosis (MacDonald, 1988; Smith, 1986). Han habido pocos estudios relativamente sobre la diversidad del ADNmt en las especies marinas y la mayor parte de las especies ensayadas tienen baja diversidad de secuencia intraespecífica (Ovenden, 1990), si bien la vieira japonesa, Pactinopectin yessoensis, presenta una alta diversidad (Boulding et al ., 1993). Diferenciación genética de las poblaciones marinas Se han emprendido muchos estudios electroforéticos de las alozimas con objeto de identificar o describir las poblaciones, y en los estudios más recientes se han utilizado los marcadores directos del ADN. Como cabía esperar, en el medio marino existe una diferenciación genética inferior entre las poblaciones de teleósteos que entre los anádromos y las especies de agua fresca. En el reino sin solución de continuidad de los océanos hay menos barreras que se opongan al libre movimiento de los genes, lo que se produce por la deriva de las larvas o el movimiento de los adultos. La proporción de la diversidad genética debida a la subdivisión de las poblaciones se eleva al 1,6 por ciento en las especies marinas hasta 3,7 por ciento en los anádromos y al 29,4 por ciento en las especies de agua dulce (Gyllensten, 1985). Igualmente, el nivel de diferenciación genética medido con el ADN mitocondrial es infrerior en el ámbito marino que entre los peces de agua dulce (Avise, et al., 1987). Sin embargo, hay poblaciones genéticas discretas de peces marinos que se reconocen con las proteíns (véase el estudio de Smith et al., 1990). La diferenciación genética está correlacionada negativamente con la posibilidad de dispersión de algunas especies de aguas continentales (Waples, 1987), estrellas (Williams y Benzie, 1993) y crustáceos (Mulley y Latter 1981 a, 1981b). El empleo de técnicas ADN, más sensibles, ha puesto de manifiesto una estructura más compleja de las poblaciones, y así, por ejemplo, se detectó una importante disrupción genética en las poblaciones del cangrejo cacerola, Limulus polyphemus, frente a las costas de Florida tratado con el ADN mitocondrial (Saunders et al., 1986), pero no con las alozimas (Selander et al., 1970) y se obtuvieron resultados parecidos en las mismas zonas para el ostión virgínico, Crassostrea virginica, (Buroker, 1983; Reeb y Avise, 1990). Los estudios alozimáticos de las poblaciones australianas y neozelandesas del reloj anaranjado, Hoplostethus atlanticus, que es un teleósteo de aguas profundas, han puesto de manifiesto pocas subdivisiones genéticas (Smith, 1986; Elliot y Ward, 1992) mientras que los estudios del ADN mitocondrial han revelado subdivisiones genéticas (Smolenski et al., 1993; Smith y McVeagh, sin publicar). Se descubrió una gran divergencia de secuencias del ADNmt entre el bacalao ártico y el costero, Gadus morhua (1,8–5,6 por ciento) pero una baja divergencia ente las localidades costeras (< 1 por ciento) en el NE del Océano Atlántico (Dahle, 1991). Algunas especies de invertebrados marinos cuyos individuos adultos son sedentarios pero pelágicos en el estado larval, han mostrado importantes diferenciaciones genéticas a lo largo de cortas distancias geográficas (<5 km), mientras que otros muestran una uniformidad genética en gran escala de las frecuencias alélicas a distancias comprendidas entre cientos y millares de kilómetros (Benzie y Williams, 1992 ; Burton, 1983; Hedgecock, 1986; Kordos y Burton, 1993; Williams y Benzie, 1993). Las diferenciaciones localizadas, bautizadas con el nombre de “retazos” genéticos (Johnson y Black, 1982), parecen proceder de los procesos de prerreclutamiento en el erizo de mar, Echinometra mathaei, (Watts et al., 1990), la lamprea, Siphonaria jeanae (Johnson y Black, 1982, 1984), el gastrópodo Drupella cornus (Johnson et al., 1993) y en el cobo reina, Strombus gigas, (Campton et al., 1992; Mitton, et al., 1989). Sin embargo, se cree que las variaciones genéticas microgeográficas en otros invertebrados se deben a la selección posterior al asentamiento (v.g. la oreja de mar de labios negros, Haliotis rubra, Brown, 1991), si bien algunas observaciones de la variación genética espacial en el género Mytilus se deben a la mezcla de especies (Koehn, 1991). El ejemplo más convincente de selección posterior al asentamiento procede de los estudios de Kent y sus colaboradores sobre el polimorfismo de la leucine aminopeptidase (LAP) en el mejillón, Mytilus edulis. Las acusadas diferencias de forma de las frecuencias alélicas de la LAP en el M. edulis combinadas con los gradientes de salinidad en el estrecho de Long Island (Koehn et al., 1980) y en Cape Cod (Koehn et al., 1976) y en el Mytilus trossulus en la costa occidental de Norteamérica (McDonald y Siebenaller, 1989) se deben a las selecciones posteriores al reclutamiento entre los reproductores del océano (Hilbish, 1985; Hilbish y Koehn, 1985). Pese al flujo de genes establecido entre las poblaciones, la diferenciación genética se produce como respuesta a una fuerte selección. Variaciones genéticas temporales Se han observado cambios temporales en las frecuencias de los alelos de varias especies de teleósteos marinos mediante un muestreo repetido de la misma localidad en momentos sucesivos o el muestreo de clases anuales discretas. Dado que la mayor parte de estudios genéticos de las poblaciones marinas se basan en la electroforesis de las proteínas, las estimaciones de las variaciones genéticas temporales están limitadas a períodos comprendidos en los últimos veinticinco años. Uno de los marcadores estudiados por más tiempo es el polimorfismo de la hemoglobina en el bacalao del Atlántico, Gadus morhua, para el cual las frecuencia alélicas en las poblaciones noruegas han permanecido estables durante veinticinco años (Gjosaeter et al., 1992; Jostad y Naevdal, 1989). Las poblaciones del corvinón ocelado, Scianenops ocellatus , en el golfo de México muestran la estabilidad de los genotipos alozimáticos y del ADNmt entre las clases anuales (Gold et al., 1993). Por el contrario, se han observado variaciones genéticas en cortos períodos de tiempo entre las clases anuales de la dorada, Chrysophrys auratus, (Smith, 1979), el tarakihi, Cheilodactylus macropterus, (Gauldie y Johnston, 1980), el killifish, Fundulus heteroclitus, (Mitton y Koehn, 1975), y el róbalo, Anoplarchus purpurescens, (Johnson 1977). También se han observado importantes desplazamientos de las frecuencias del alelo en un lugar enzimático de un pez de arrecife, el “damselfish”, Stegastes partitus, de Florida durante dos generaciones, (Lacson y Morizot, 1991). Una población de “damselfish” con frecuencias alélicas atípicas se vio que había adquirido frecuencias típicas al tomar una muestra tres años más tarde. Se cree que las frecuencias típicas del alelo quedaron restablecidas por los elevados niveles de flujo génico que penetraron en la población perturbada (Lacson y Morizot, 1991). Las variaciones genéticas observadas en poblaciones del salmón real, Oncorynchus tshawytscha, de la costa del Pacífico del Estado de Oregón parecen ser el resultado de diferencias genéticas entre lotes de peces liberados de un criadero, (Bartley et al., 1992b; Waples y Teel, 1990). En la anguila americana, Anguilla rostrata, que desova en un solo lugar, se observaron importantes diferencias genéticas entre los adultos y los alevines, y entre localidades a lo largo de la costa este de los Estados Unidos (Williams et al., 1973). Estas diferencias genéticas se desarrollan durante la fase de alevín cuando salen del lugar de desove común del mar de los Sargazos (Williams et al., 1973). Los estudios alozímicos de los organismos marinos han permitido observar excesos homocigóticos, especialmente en los moluscos marinos, en los que el exceso es más notable en las fases juvenil y larval (Singh y Green, 1984; Zouros y Foltz, 1984). Dichos excesos ocurren en las grandes poblaciones y no es probable que se deban a la deriva genética o a errores genéticos de contagio y la causa de este difundido fenómeno sigue siendo una incógnita (Zouros y Romero-Dorey, 1988). Especies crípticas Varios estudios alozímicos han revelado la existencia de especies crípticas en las pesquerías costeras y han puesto de manifiesto que los recursos que se consideraban integrados por taxones únicos constan en realidad de dos o más especies. Se han encontrado ejemplos de especies crípticas, en los calamares (Brierley et al., 1993) ; Carvalho et al., 1992 ; Smith et al., 1981), los pulpos, (Levy et al., 1988), los bivalvos (Grant et al., 1984; Richardson et al., 1982; Sarver et al., 1992), los tamboriles, (Masuda et al., 1987), el pejerrey, (Prodohl y Levy, 1989), el lagarto escamoso (Shaklee et al., 1982; Waples, 1981; Yamaoka et al., 1989), los macabíes (Shaklee y Tamaru, 1981; Shaklee et al., 1982) y pequeñas especies pelágicas (Daly y Richardson, 1980; Smith y Robertson, 1981). Al contrario, la falta de diferencias genéticas entre los distintos colores que presentan los pequeños peces serránidos del género Hypoplectrus parece indicar que están compuestos de una sola especie (Graves y Rosenblatt, 1980). Igualmente, la falta de diferencias genéticas entre individuos de los “armourheads”, Pseudopentaceros wheeleri y P.pectoralis, pelágicos, del norte del Océano Pacífico llevan a la conclusión de que el armourhead está integrado por una sola especie metamórfica que reviste distintas morfologías entre las fases de su ciclo biológico (Humphreys et al., 1989). La falta de diferencias genéticas en 33 lugares examinados entre dos especies de langostas la Jasus edwardsii, de Nueva Zelandia y la J. novaehollandiae, de Tasmania, indican que se trata de poblaciones coespecíficas (Smith et al., 1980). Variaciones genéticas inducidas por la contaminación Los efectos de la contaminación sobre los recursos costeros son muchas veces espectaculares, traduciéndose en muertes masivas de las poblaciones locales, reducción de la diversidad de las especies, y en cambios de su composición. La contaminación puede ocasionar el cierre de zonas locales a la pesca. Entre las fuentes de contaminación figuran los metales pesados, pesticidas, aceites y detergentes, y vertidos térmicos y radioactivos. Los informes sobre las variaciones genéticas debidas a la contaminación marina son escasos, debido en parte a la dificultad de medirlos en poblaciones de peces cuyo reclutamiento puede quedar fuera de las zonas contaminadas. El mayor número de ejemplos conocidos de variaciones genéticas producidas por la contaminación corresponde a especies con capacidad limitada de dispersión; los moluscos pueden ser reclutados desde zonas exteriores a la zona de contaminación pero las fases juvenil y adulta son estacionarias. Los amplios estudios realizados por Nervo y sus colaboradores en el Mediterráneo sobre la influencia de la contaminación en la genética muestran que las variaciones genéticas se producen en las poblaciones naturales de los organismos marinos expuestas a los casos de contaminación local (Nevo et al., 1984, 1987). Por ello, sehan propuesto marcadores genéticos para seguir la contaminación marina (Ben-Shlomo y Nevo, 1988 ; Nevo et al., 1984). Los estudios de laboratorio realizados sobre moluscos y crustáceos han demostrado las distintas tasas de supervivencia de los genotipos alozímicos expuestos a los metales pesados (Hvilsom, 1983; Lavie y Nevo, 1982, 1986; Nevo et al., 1981). Se han advertido cambios parecidos en las frecuencias génicas de los organismos marinos expuestos al petróleo bruto (Battaglia et al., 1980; Nevo y Lavie, 1989; Nevo et al., 1978) si bien Fevolden y Garner (1986) no encontraron indicio alguno de selección genotípica en el Mytilus edulis, expuesto a bajas concentraciones de petróleo en los fiordos noruegos. En las pruebas de laboratorio efectuadas con parejas de especies expuestas a los contaminantes marinos, las especies con un nivel superior de diversidad genética mostraron una mayor supervivencia (Nevo et al., 1986). Se han observado menos casos de variaciones genéticas en los teleósteos debidos a la contaminación. Los desplazamientos temporales de las frecuencias fueron superiores en las aguas contaminadas del Báltico, que en las no contaminadas, para las poblaciones de charrascos, Myoxocephalus quadricornis (Gyllensten y Ryman, 1988). Sin embargo, no está claro si estas variaciones genéticas se deben a una mortalidad selectiva directa o a la invasión de los lugares contaminados por nuevas poblaciones (Gyllensten y Ryman, 1988). Caracteres del ciclo biológico La mayor parte de los peces e invertebrados marinos son iteróparos, es decir, se reproducen a lo largo de varios años, mientras que el salmón del Pacífico, del género Oncorhynchus, es semelparo, reproduciéndose una sola vez en su vida. Muchas especies son muy fecundas y el ciclo biológico comprende una fase dispersiva (Fogarty et al., 1991). Sin embargo, existen considerables variaciones interespecificas entre el ciclo biológico y la fecundidad, y muchas de las especies ampliamente difundidas presentan largas temporadas de desove y el momento de éste varía con la latitud. En el salmón rosado, Onorhynchus keta, el momento del regreso para desovar tiene un componente genético (Gharret y Smoker, 1993). Los experimentos de trasplante realizados con la vieira europea, Pecten maximus, han demostrado la existencia de un componente genético relacionado con el período de desove y este carácter presenta diferencias entre las poblaciones (Cochard y Devauchelle, 1993); Mackie y Ansell, 1993). La talla alcanzada en el momento de la madurez sexual varía entre las poblaciones intraespecíficas de la raya, Raja radiata (Templeman, 1987) y la platija americana, Hippoglossoides platessoides (Roff, 1982). El arenque, Clupea harengus, y la solla europea, Pleuronectes platessa, arrojan variaciones geográficas en su fecundidad (Mann y Mills, 1979) y el bacalao, Gadus morhua, presenta diferencias intraespecíficas en cuanto a la edad a la madurez (Garrod y Horwood, 1984). Existe una correlación importante entre la edad de la primera reproducción, la mortalidad y la tasa de crecimiento de los teleósteos y se cree que estas correlaciones son el resultado de una nivelación evolucionista entre el crecimiento, la reproducción y la supervivencia (Roff, 1984). La teoría de la pesca prevé que en aumento de la mortalidad por pesca redundará en un aumento del crecimiento y el reclutamiento. Tanto si el principio de la madurez sexual viene determinado por la edad como por la talla, aquél se verá modificado cuando aumente la mortalidad por pesca: los peces que crecen más rápidamente alcanzarán una talla mínima también más deprisa y madurarán a una edad más temprana, mientras que si el principio de la madurez viene determinado por la edad, entonces el pez madurará cuando alcance una talla mayor. Las complejas y mal comprendidas relaciones entre los componentes genéticos de la tasa de crecimiento, la talla y la edad en que se alcanza la madurez, así como las respuestas no genéticas de estos caracteres ante los cambios en la densidad de población y otros parámetros ambientales, especialmente la temperatura del agua, hace difícil distinguir entre las repercusiones genéticas y no genéticas de la pesca sobre las poblaciones naturales. FUERZAS QUE MODELAN LA ESTRUCTURA GENETICA DE LAS POBLACIONES Las fuerzas principales que modelan la estructura genética de las poblaciones son la deriva genética, la selección y las migraciones. Las mutaciones y combinaciones crean nuevas variaciones genéticas, pero no son fuerzas importantes en la determinación de los niveles de diferenciación dentro de las especies. Las mayor parte de los trabajos sobre la genética de las poblaciones ofrecen explicaciones y argumentos acerca de la deriva, la selección y la migración; pueden consultarse estudios detallados sobre la selección artificial de los peces en los trabajos de Gall y Chen, 1993; Gjedrem, 1990 y Kirpichnikov, 1981, mientras que los efectos de la deriva y el tamaño de la población sobre la diversidad genética son examinados por Soule, 1986, 1987; Soule y Wilcox, 1980 y en algunos números de la publicación Conservation Biology and Bioscience, que se comentan brevemente más adelante. La selección es la supervivencia no aleatoria de los genotipos, ocasionada por diferencias entre los individuos como producto de la reproducción y de la superviviencia de los hijos. En la selección natural los individuos más fuertes tienen más descendencia que los individuos menos aptos. El grado de aptitud se mide por s, que es el llamado coeficiente de selección, mientras que al genotipo más fuerte se le atribuye el valor de 1 y a los menos fuertes 1-s. Una diferencia de selección de tan solo unos pocos puntos porcentuales puede tener importantes repercusiones sobre una población a lo largo de varias generaciones. Se admiten tres tipos básicos de selección en las poblaciones : la selección direccional, que favorece un genotipo o carácter, la selección disruptiva, que favorece dos o más tipos diferentes, y la selección estabilizadora, que actúa contra la producción de individuos extremos. La aptitud dentro de estos tres tipos de selección puede expresarse según el modelo simplificado de gen único siguiente : selección direccional selección disruptiva selección estabilizadora AA 1 1 1–s Genotipos Aa 1 1–s 1 aa 1–s 1 1–s En la selección direccional variarían las frecuencias alélicas, pero los alelos no se perderían a no ser que la deriva repercutiera sobre una población pequeña, porque el alelo a está “protegido” en la condición heterocigótica. En la selección disruptiva la población podría escindirse en dos subpoblaciones fijadas para A y a, manteniéndose alta la diversidad. En la selección estabilizadora el heterocigoto está en desventaja y su proporción en la población llega a un valor de equilibrio. En las poblaciones naturales no es probable que la aptitud de un genotipo sea constante a lo largo del tiempo y cambiará con las condiciones ambientales, incluida la densidad de la población. Se estima que la selección que depende de la frecuencia es importante para mantener la variación genética cuando los alelos raros tienen una cierta ventaja selectiva. Los caracteres del ciclo biológico serán probablemente poligénicos, determinados por un número elevado de genes, en cuyo caso la respuesta ante la selección alterará la frecuencia media del alelo de los genes que codifican el carácter (Bentsen, 1994). La deriva genética se produce con el muestreo aleatorio de los gametos en cada generación. Ello produce fluctuaciones aleatorias en las frecuencias de los alelos de una generación a la siguiente y en las poblaciones pequeñas los cambios aleatorios pueden redundar en la pérdida de alelos. La deriva es probablemente la principal fuerza que determina las frecuencias de los genes en las poblaciones más pequeñas pero es menos importante en las poblaciones grandes. El cruzamiento consanguíneo, es decir, el aparejamiento entre individuos afines, se produce también en las poblaciones pequeñas. El cruzamiento consanguíneo ocurrirá con mayor probabilidad en las poblaciones pequeñas aisladas como son los criaderos o en las especies en peligro, donde existe una mayor probabilidad de que dos individuos afines se aparejen. En la acuicultura y en los programas de mejoramiento deben estudiarse mecanismos para evitar el cruzamiento consanguíneo (Gall, 1987). La tasa de pérdida de la variación selectivamente neutral debida a la deriva depende del tamaño de la población y del número de generaciones, y se expresa por Ht = Ho(1–1/2Ne)t (Wright,1969), fórmula en la que H es la heterocigosis, Ne el tamaño real de la población y t el tiempo en generaciones. Ne es normalmente mucho más pequeño que el tamaño real de la población, ya que solamente los adultos reproductores contribuyen a la población (Bartley et al., 1992a). Ne resulta difícil de medir y existen pocas estimaciones de este valor para las especies marinas. Sin embargo, este dato estadístico de la población es importante para la ordenación de los recursos genéticos y los especialistas empiezan a buscar medios de estimar Ne a partir de datos alélicos y genotípicos (v.g. Waples, 1990; Bartley et al., 1992a). El tamaño efectivo de la población viene disminuido por una proporción sexual desigual y por la variación del éxito reproductor que puede ser grande en las especies marinas de gran fecundidad, y por el traslado de las generaciones (Nelson y Soule, 1987). Para conseguir que el 99 por ciento de la diversidad genética se mantuviera en cada generación se necesitaría un Ne mínimo de 50, compuesto por el mismo número de machos y hembras. Si bien no existe un valor único de Ne apropiado para todas las especies, debido a las variaciones de sus ciclos biológicos (Kapuscinski y Lannan, 1986), se ha propuesto un Ne mínimo del orden de 500 para la conservación de la diversidad genética a largo plazo (Franklin, 1980; FAO, 1981). Las diferencias genéticas entre poblaciones evolucionan cuando el flujo génico entre ellas es muy pequeño o nulo y aumentan por selección; la migración contrarresta los efectos de la deriva y de la selección reintroduciendo alelos en las poblaciones. Aun una pequeña migración entre poblaciones es suficiente para eliminar la diferenciación debida a la deriva. Por ejemplo, en dos poblaciones teóricas de tamaño N que intercambien una proporción m por migración cada generación, no se producirán divergencias considerables entre las poblaciones si Nm > 1 (Lewontin, 1974; Slatkin, 1985). El tamaño de la población de muchas especies marinas importantes desde el punto de vista comercial será probablemente grande (> 1 000) pero unos cuantos emigrantes por generación, pequeños en valor absoluto, neutralizarán las divergencias debidas a la deriva. La deriva actuará sobre todos los loci de la misma forma mientras que la selección puede actuar de forma distinta en loci diferentes. La contribución relativa de la deriva y la selección a la variación de la frecuencia de los alelos observada en la población marina es incierta. Hay indicios de que existe una fuerte selección en determinados lugares enzimáticos, por ejemplo en el mejillón, Mytilus edulis (Koehn et al., 1983) y en el mummichog, Fundulus heteroclitus (Powers et al., 1983). Sin embargo, la deriva parecería ser la causa de las diferencias genéticas entre los años pares e impares en el salmón rosado, Oncorhynchus gorguscha, que vive en el mismo medio (Aspinwall, 1974). La pérdida de diversidad genética es ocasionada por la deriva, especialmente en las poblaciones pequeñas, también por la retirada selectiva de genotipos específicos. En teoría, toda actividad o proceso que exploten selectivamente tipos individuales o reduzca considerablemente el tamaño de la población, modificará la estructura genética de las poblaciones naturales. Además, también puede perderse la diversidad cuando pequeñas poblaciones se ven invadidas por un número elevado de individuos procedentes de una reserva genética diferente. Esta situación es rara en las poblaciones naturales, pero puede producirse en los programas de mejoramiento y se ha observado con el salmón oriundo de criaderos (Hindar et al., 1991). EFECTOS SELECTIVOS DE LA PESCA La pesca constituye un factor selectivo y tiene la posibilidad de modificar las poblaciones. Muchos pescadores se dedican a una especie o grupos de especies particulares y persiguen los ejemplares adultos de gran tamaño en lugar de los juveniles. Es bien sabido que con métodos distintos de pesca se capturan peces de distinta talla en la misma zona, v.g. las pesquerías de arrastre y con palangre del Atlántico Norte (ICNAF, 1963) y artes de cerco, redes de enmalle y con curricanes frente a las costas de la Columbia Británica para el salmón del Pacífico (Ricker et al., 1978). Pese a estas posibilidades de selección, las pruebas de que se hayan producido variaciones genéticas por la pesca, especialmente en las poblaciones marinas, son limitadas. Miller (1957) ya había llegado a la conclusión de que había pocos indicios de cambios hereditarios debidos a la explotación o a la introducción de peces de agua dulce. Desde entonces se han comunicado experiencias sobre variaciones genéticas en poblaciones de peces debidos a una pesca intensa. La mayor parte de los informes se basan en el cambio de los caracteres del ciclo biológico a lo largo del tiempo, pero estos caracteres pueden cambiar por factores extragenéticos en respuesta a los cambios ambientales. Pruebas de las variaciones genéticas debidas a los efectos selectivos de la pesca preferencial a. Selección de tallas pequeñas y madurez precoz en el bacalao, Gadus morhua El bacalao del Atlántico ha sido explotado en las aguas costeras del Atlántico Norte durante siglos, pero el muestreo biológico de las capturas se remonta únicamente a los últimos cincuenta años. El descubrimiento y recuperación de una goleta perdida en las costas de Nueva Escocia en los años 1750 ofreció un oportunidad única para realizar una comparación de las longitudes del bacalao entre los siglos XVIII y XX, basada en la medición de los huesos de la clavícula (Kenchington y Kenchington, 1993). Los bacalaos capturados con anzuelos modernos frente a las costas de Nueva Escocia son mucho más pequeños que los que se capturaba en los años 1750, si bien ocasionalmente se pescan bacalaos de una talla máxima parecida (Kenchington y Kenchington, 1993). En 1968 las capturas en la plataforma escocesa del Atlántico Norte llegaron a un máximo de 80 000 toneladas y vinieron acompañadas de un acusado declive de la biomasa y la reducción correspondiente de la talla y edades medias (Beacham, 1983a). Además, la longitud y las edades medianas al llegar a la madurez disminuyeron también : la edad mediana al llegar a la madurez sexual pasó de ser > 5 años en 1960 a < 3 años en 1978 (Fig.1) tanto para los machos como para las hembras (Becham, 1983a). El bacalao que maduró a los tamaños más pequeños más jóven tendría una pesca intensiva ya que el bacalao de mayor tamaño y de madurez más tardía habría sido capturado antes de llegar a la madurez sexual (Becham, 1983a). Se han observado casos parecidos para el bacalao del Atlántico en el oeste de Groenlandia, donde la edad media a la madurez pasó de 9,9 años en 1917 a 6,4 años en 1936 en la pesquería septentrional y de 9,3 años en 1922 a 7,6 años en 1936 en la pesquería meridional (Hansen, 1949). En las poblaciones ártico-noruegas del bacalao del Atlántico la mayoría de los ejemplares maduraron entre los 8 y los 10 años en los años treinta pero para los años setenta la mayoría del bacalao maduró a los 6 años (Borisov, 1979). Esta disminución se atribuyó a la retirada selectiva de la población del bacalao de maduración tardía (Borisov, 1979). Durante un período de cuarenta años no se observó tendencia alguna en cuanto a la longitud por edades, lo que parece indicar que el crecimiento no dependía de la densidad, si bien la reducción de la longitud por edades en la primera mitad de los años ochenta coincidió con una disminución de la abundancia relativa del capelán, que constituye la presa principal de los grandes bacalaos (Jorgensen. 1992). Law y Grey (1989) estiman que la pesca de los ejemplares de 4 años del mar de Barents y en la plataforma de Spitzbergen deberían restringirse y la pesca debería concentrarse en los peces de mayor tamaño que desovan, en la costa de Noruega. Esta modalidad de pesca seleccionaría individuos de madurez tardía y ofrecería un mayor rendimiento. b. Selección de la madurez precoz en el eglefino, Melanogrammus aeglefinus El eglefino ha sido explotado intensamente en las pesquerías demersales del Atlántico nordoccidental. Las capturas del eglefino en los bancos de la isla de San Pedro, frente a Terranova, aumentaron rápidamente para alcanzar un máximo de 58 000 toneladas en 1955, basadas principalmente en una clase anual excepcional en 1949. Esta gran captura vino seguida de una disminución de cerca de 6 000 toneladas en 1957 y otras reducciones de menos de 1 000 toneladas en los años setenta (Templeman y Bishop, 1979a). Los datos biológicos reunidos entre 1948–51 y 1969–75 arrojan una disminución de la edad media a una madurez del 50 por ciento (Fig. 2) que pasó de 4,6 a 3,3 años para los machos y de 5,9 a 4,3 años para las hembras (Templeman y Bishop, 1979b). Becham (1983b) ha señalado que esta disminuci ón se produjo en un período en que se dieron tasas de crecimiento tanto crecientes como decrecientes, por lo que el cambio de la edad a la madurez no está únicamente relacionado con la variaci ón de las tasa de crecimiento debida al efecto compensatorio de la reducción de la biomasa, sino que con gran probabilidad se trata de una variaci ón genética. Figura 1. Edad mediana a la madurez sexual para el bacalao del Atlánticok capturado en la División de Pesca 4W en la plataforma de Escotain, Canadá, entre 1959–79. Los triángulos unidos por una línea de trazo continuo representan los datos correspondientes a las hembras y los círculos unidos por una lx5inea de trazos a los machos, mientras que la línea de puntos indica que no se dispone de datos y las barras vetrticales representan los límites de confianza del 95 por ciento. (Datos presentados por Beacham, 1983a). Figura 2. Trendencias de la edad media a la madurez sexuel del 50 por ciento lpara el glefino macho y hembra en los bancos de la isla de San Pedro, Canadá, entre 1948–75. Las barras verticales representan los límites de confianza del 95 por ciento.(Datos facilitados por Templeman y Bishop, 1979b). En la plataforma continental de Escotian las capturas de eglefino ascendieron en 1965 a más de 50 000 toneladas y posteriormente disminuyeron a menos de 11 000 toneladas en 1967. Durante el mismo período de tiempo la longitud mediana a la madurez sexual se mostró relativamente constante, pero la edad mediana a la madurez disminuyó entre 1959–64 y 1975–79 para pasar de 3,9 a 2,7 para los machos y de 4,4 a 3,0 para las hembras (Beacham, 1983c). c. Selección de la madurez precoz en los peces planos En el Gran Banco, en el Atlántico nordoccidental, la captura de la platija americana, Hippoglossoides platessoides, fue aumentando durante los años cincuenta hasta alcanzar un máximo de unas 90 000 toneladas anuales en los años sesenta, para disminuir después y situarse en unas 45 000 toneladas (Pitt, 1975). Durante el período 1959–72 la talla media por edades aumentó gradualmente, al mismo tiempo que descendía la edad a la madurez sexual (Pitt, 1975). La longitud media estaba en correlación con la abundancia de la población, pero no la temperatura del agua, lo que indujo a Pitt (1975) a creer que los cambios del tamaño por edad se debían en gran medida a una reducción de la densidad. La causa del descenso de la edad de la madurez está menos clara al existir variaciones regionales de dicha edad; en algunas zonas los peces que crecen más rápidamente maduran a una edad más avanzada que los peces de crecimiento lento de otras zonas (Pitt, 1975). Es probable que la pesca retire una mayor proporción de peces de crecimiento más rápido, produciendo una disminución de la edad a la madurez pero no debido a un aumento de la tasa de crecimiento dependiente de la densidad. Beacham (1983b) ha presentado pruebas en apoyo de una disminución de la longitud y las edades medianas a la madurez sexual para la platija americana (Fig.3) y la limanda. Limanda ferruginea, en varias pesquerías del Atlántico nordoccidental. Esta disminución tanto de la talla como de la edad a la madurez no se explican fácilmente por un aumento de la tasa de crecimiento debida a los efectos compensatorios de una biomasa reducida (Beacham, 1983b), sino que probablemente reflejan una variación genética de la población. En la pesquería de limanda japonesa, Limanda espersa, en las costas de la Federación de Rusia, la talla y edad en la cual el 50 por ciento de las hembras que alcanzaban la madurez disminuyó de 29,9 cms y 8,5 años a 27,2 cm y 7,2 años durante el período 1961–69 (Tikhonov, 1977). Durante el mismo período se registró un aumento de la fecundidad de los peces de la misma talla. En cambio, en la pesquería del mar del Norte el aumento de la tasa de crecimiento del lenguado, Solea solea, estaba relacionado con la disponibilidad de alimentos procedentes de las actividades de arrastre más que de una reducción de la densidad de la población (de Veen, 1976). La talla a la madurez permaneció constante durante un largo período de tiempo y para aumentar después, mientras que la edad a la madurez no sufrió modificaciones durante el mismo período. Igualmente, Rijinsdrop et al., (1991) no encontraron pruebas de que el crecimiento dependiera de la densidad de los individuos adultos de lenguado y la solla europea, Pleuronectes platessa, adultos en un período de 30 años de gran explotación. En la solla la edad a la madurez, pero no la talla, varió a lo largo del período 1958–88 y estaba correlacionada positivamente con la tasa de crecimiento de los juveniles. En el lenguado no existía relación entre la tasa de crecimiento de los juveniles y la edad de la madurez, y tanto para la solla como para el lenguado no se advertía tendencia alguna de la tasa de crecimiento o la talla y la edad a la madurez (Rijinsdrop, 1991). d. Selección de una talla menor a la madurez en la langosta La observación de las poblaciones naturales de langostas indica que el principio la madurez sexual viene determinado por la edad y no por la talla. Cuando la población reproductora de la Panulirus longipes cygnus de la costa occidental de Australia alcanza una baja densidad, la talla de la primera cría y las tallas superiores de las hembras son más elevadas (Chittleborough, 1979). En condiciones de alta densidad (sin explotación) la tasa de crecimiento se retrasa y el principio de la madurez sexual se produce a una talla más pequeña (Chittleborough, 1979). En el Jasus lalandii, en el ecosistema de Benguela frente a Africa austral, las tasas de crecimiento y la talla a la madurez sexual son mayores cuando hay mucha abundancia de alimentos (Byers y Goosen, 1987). Se ha observado una reducción de la talla al principio de la producción de huevos y un aumento asintónico de la longitud de la langosta, Panulirus marginatus, de Hawai, tras un período intenso de pesca de una población virgen(Polovina, 1989). Esta disminución de la talla al principio de la producción de huevos en la P. marginatus, apunta en una dirección opuesta a la prevista en base a las relaciones de densidad y puede indicar un cambio genético de la población. Figura 3. Edad mediana a la madurez sexual para la platija americana capturada en la División de Pesca 4W en la plataforma de Escotain, Canadá, entre 1964–80. Los triángulos unidos por una línea de trazo continuo representan los datos correspondientes a las hembras y los círculos unidos por una línea de trazos a los machos, mientras que la línea de puntos indica que no se dispone de datos y las barras verticales representan los límites de confianza del 95 por ciento. (Datos presentados por Beacham, 1983c). e. Reducción de la edad del cambio de sexo en el camarón, Pandalus borealis Los camarones pandálidos son hermafroditas protándricos (reproduciéndose primeramente como machos) en los que la edad del primer cruzamiento y posterior inversión de sexo está relacionada con la talla individual (Charnov, 1979). En la pesquería de camarones, P. borealis, en el Skaggerak, se produjo una reducción de la talla de las hembras durante un período de intensa explotación (Jensen, 1965, 1967). Las capturas danesas y suecas de camarón combinadas ascendieron a más del doble entre 1956 y 1960, mientras que el porcentaje de camarones grandes, predominantemente hembras, disminuyó del 44 por ciento en 1944 al 14 por ciento en 1961. Más sorprendente todavía fue la aparición de una clase de hembras de pequeño (Cuadro 1), aproximadamente de la misma talla que los machos de un año de edad. Las hembras pequeñas (< 75 mm) no estaban presentes en 1953, pero para 1961–62 constituyeron el 21–30 por ciento de la captura (Jensen, 1965). Charnov (1981) sugiere que una mayor mortalidad por pesca de las hembras mayores ha dado lugar a la selección de unos individuos que maduran como hembras a la edad de la primera cría. f. Selección del desove tardío en el arenque, Clupea harengus Para las especies con un período de desove prolongado y las correspondientes pautas de conducta y movimiento estacionales, las actividades de pesca pueden infligir una mayor mortalidad en un componente del recurso. En las pesquerías de temporada o sin limitaciones, los explotadores comerciales se sienten tentados de conseguir las máximas capturas en cuanto se abre la temporada. Ello puede ejercer una mayor presión en los individuos que regresan pronto y favorecer a los que vuelven más tarde. Las primeras llegadas y desoves posteriores del arenque del Atlántico, C. harengus, en la costa noruega han cambiado a lo largo de un período de 60 años (Devold, 1963). Hacia fines del siglo pasado, los primeros arenques en regresar a los lugares de desove lo hacían en septiembre—octubre, pero esta fecha de regreso se ha ido retrasando progresivamente, por lo que para los años cincuenta los arenques no aparecían en dichos lugares hasta el mes de enero (Devold, 1963). Mathisen (1989) estimó que este cambio se debió a los efectos de la pesca, ya que se capturaban selectivamente los primeros subgrupos de arenque en regresar, de forma que con el tiempo éstos contribuían en menor medida a la pesquería y eran sustituidos sucesivamente por los subgrupos que regresaban más tarde. Cuadro 1. Disminución de la talla media y aumento de la frecuencia relativa de las hembras de pequeño tamaño en la pesquería de langostinos del Skagerak entre 1949–62. (Datos facilitados por Jensen, 1965). Período Sexo 1949–53 1954–57 1958–60 1961–62 longitud media (mm) Machos y transición 74 69 68 67 Hembras 96 87 83 82 porcentaje Machos y transición 65 81 85 83 Hembras >74mm 0 2 3 4 >75mm 35 17 12 14 Esta interpretación de las observaciones de Devold debe contrastarse con los cambios no genéticos que pueden haberse producido durante el período. Los cambios de los tiempos de desove de otros grupos de arenque del Atlántico han podido explicarse por los cambios de las condiciones ambientales. El arenque es una especie flexible fenotípicamente, que se ha subdividido en muchos grupos taxonómicos basados en los caracteres morfométricos y los períodos y lugares de desove (Parrish y Saville, 1965). El carácter hereditario de los momentos del desove en el arenque se desconoce pero hay indicios de que existe un fuerte componente ambiental. En el Báltico, los arenques desovan entre la primavera y el otoño (Aneer, 1985) produciéndose el desove menos fecundo en primavera y el más fecundo en otoño (Anokhina, 1971). La desaparición de los desoves de otoño se ha atribuido a unas mejores condiciones alimentarias, debidas a la eutrofización, por la que los adultos disponen de reservas suficientes de alimento para desovar en primavera (Aneer, 1985). En el noroeste del Océano Atlántico, los arenques nacidos en otoño y primavera, identificados por sus características otolíticas, se ha visto que desovaban en estaciones opuestas (Messieh, 1972). Por una extensión de esta hipótesis de desove selectivo, Mathisen (1989) cree que el declive de la anchoveta peruana, Engraulis ringens, se vio acelerado por la pesca selectiva disruptiva de las “mejores unidades reproductoras” con lo que quedaron solamente grupos marginales para reconstituir las poblaciones. g. Selección de una talla menor y una edad reducida en el salmón del Pacífico En las pesquerías de salmón del Pacífico de la Columbia Británica la mayor parte de los peces se capturan en la fase de adultos maduros cuando vuelven a los ríos para desovar. Por ello las pesquerías tienen menos probabilidades de demostrar el efecto de pesca que hemos visto en la pesca de arrastre para los teleósteos marinos. Un estudio realizado sobre cinco especies de salmón del Pacífico llego a la conclusión de que tres especies por lo menos presentaban una disminución de la talla media por años, tras varios años de pesca selectiva por tallas (Ricker, 1981). La pesca con redes de enmalle y con curricanes del salmón plateado. Oncorynchus kisutch, y el salmón rosado, O. gorbuscha, tiende a capturar los peces mayores y dichas especies presentan las mayores reducciones de las tallas medias (Ricker, 1981). El salmón real, O. tshawytscha, redujo tanto su talla media (Fig. 4) como su edad entre 1951 y 1975 (Ricker, 1980). Ricker (1981), estima que esta disminución de talla y edad se debe a la pesca con curricanes, que captura tanto los individuos maduros como los no maduros, lo cual milita en contra de los individuos que maduran tarde. Sin embargo, los datos son complejos y los métodos de pesca y los tamaños de las mallas han cambiado durante el período de muestreo y para el O. nerka se advirtió un aumento de la tasa de crecimiento a lo largo del período, que se atribuyó al enfriamiento de las aguas oceánicas (Ricker, 1981). En el caso del salmón plateado, O. kisutch, los machos maduran después de seis meses de permanencia en el océano como los jureles o tras dieciocho meses como los aguileños. Estas dos estrategias alternativas del ciclo biológico son mantenidas por la selección disruptiva (natural) que favorece los machos pequeños “sigilosos” y los machos grandes “luchadores” (Gross, 1985). La pesca captura selectivamente los peces mayores (Fig. 5) aumentando la frecuencia relativa de los jureles (Gross, 1991). Sin embargo, Gross (1991) ha demostrado que los cambios en otras fases del ciclo biológico pueden influir en la proporción entre jureles y aguileños. La limpieza de los arroyos puede reducir los refugios disponibles para los jureles por lo que favorece a los peces aguileños en los lugares de desove. Otros cambios ambientales, tales como la “eutrofización” pueden aumentar la tasa de crecimiento de los alevines, lo que conduce al aumento de la proporción de juveniles que maduran como jureles (Gross, 1991). h. Selección de la madurez precoz en el salmón del Atlántico, Salmo salar El salmón del Atlántico, S. salar, muestra grandes variaciones en su edad media entre distintas cuencas orográficas durante el primer desove. Se cree que estas variaciones son adaptativas y se mantienen por selección natural (Schaffer y Elson, 1975). La presión de pesca sobre los adultos que regresan para desovar ha eliminado a los peces mayores y más viejos de algunas carreras de desove, lo que ha redundado en una edad más baja de los peces primeros que regresan (Schaffer y Elson, 1975). i. Selección disruptiva en el salmón del Pacífico En las especies con una temporada de desove larga una presión de pesca desigual ejercida durante la temporada puede producir una mortalidad selectiva. En el río Columbia la carrera de desove del salmón real, Oncorhynchus tsawyscha, duraba de abril hasta agosto para alcanzar un máximo en junio-julio cuando se inició la primera pesca el siglo pasado (Thompson, 1951). La pesca tenía lugar principalmente durante el verano con el buen tiempo y cuando los peces eran más abundantes. La fuerte presión de pesca ejercida durante los momentos álgidos de la carrera de desove redujeron las capturas, de forma que en 1938 disminuyó el número total de ejemplares capturados y la carrera de desove alcanzó sus máximos en mayo y en agosto (Fig. 6) siendo muy pocos los peces capturados durante el período máximo anterior de junio-julio (Thomson, 1951). Mathisen (1989) ha interpretado estas observaciones como una selección disruptiva, que seleccionó tanto los peces que desovaban al principio como al final de la temporada, que no sustituyeron a los desovadores del período máximo medio. Ricker (1982) ha descrito una selección disruptiva de la talla en el salmón rojo, Onorhynchus nerka. La pesca con redes de enmalle permite capturar peces de talla media lo que ha favorecido la supervivencia de los pequeños peces oceánicos de tres años y los grandes de cuatro años. De resultas de ello los peces de tres años se han hecho más pequeños y los de cuatro más grandes, aumentando la diferencia entre ellos en unos 500g (Ricker, 1982). j. Selección de la madurez precoz en los peces de lago En muchas pesquerías de lago se utilizan las redes de enmalle, que capturan selectivamente los peces de gran peso, produciendo una mortalidad no aleatoria con respecto a la talla (Hamley, 1975). En el Canadá abundan los coregonos y el coregono de lago, Coregonus clupeaformis, constituye la base de la pesca en varios lagos. La comparación entre las poblaciones explotadas y no explotadas del coregono de lago puso de manifiesto los efectos compensatorios típicos de la pesca por los que la tasa de crecimiento aumenta con la explotación (Healey, 1975). La tasa de crecimiento de las poblaciones muy explotadas fue parecida a la tasa de crecimiento más rápido de las poblaciones no explotadas (Healey, 1975). Sin embargo, en las poblaciones muy explotadas los peces maduraron a una edad más temprana y su talla era más pequeña que la de los peces de las poblaciones no explotadas. En el lago Lesser Slave, provincia de Alberta, los recursos pesqueros se han explotado intensamente. La trucha de lago, Salvelinus namaycush, quedó agotada para los años veinte y disminuyó igualmente la abundancia de otras especies (Handford et al., 1977). Entre 1941 y 1975 se analizaron muestras del C. clupeaformis a partir de las capturas comerciales y de las destinadas a la investigación. Tras un aumento inicial del peso y de la longitud media se observó una disminución tanto de la longitud como del peso a una edad determinada. Para los años setenta los peces de una determinada edad pesaban menos de la mitad que los peces de la misma edad en los años cuarenta, si bien la longitud media por edades fue casi la misma tanto en los años setenta como en los cuarenta (Handford et al., 1977). Se han hecho observaciones parecidas en otros lagos (Handford et al., 1977). Además, las capturas del lago Lesser Slave arrojaron un aumento general de la edad media, resultado que era de esperar a niveles moderados de explotación en los que la selección favorece unas tasas de crecimiento más lentas que neutralizan los efectos de la compensación dependiente de la densidad (Hanford et al., 1977). La pesca de los pércidos de lago ha mostrado tendencias parecidas de un aumento de la tasa de crecimiento y la reducción de la edad al primer desove (Spangler et al., 1977). Figura 4. pesos medianos del salmón real capturado con curricanes frente a las costas de la Columbia Británica, Canadá. (Datos presentados por Ricker, 1981). Figura 5. Efectos de la pesca selectiva por tallas sobre la aptitud relativa de los jureles y los machos aguileños del salmoón plateado. la retirada selectiva de los machos aquileños aumenta el porcentaje de jureles en la pesquería; pl* ausencia de pesca, p2* y p3* niveles crecientes de pesca.(Datos de Gross, 1991). Figure 6. Cambios estacionales de las capturas del salmón plateado en el río Columbia. A. diarias con red de enmalle en 1876 y B. Captures en 1938. 9Datos ofrecidos por Mathieson, 1989). Las poblaciones de peces del lago George, Uganda, se estudiaron entre 1967 y 1972 cuando el cíclido Tilapia nilotica representaba cerca del 80 por ciento de las capturas. La pesca ha sido la fuente principal de la mortalidad entre los adultos para estas especies, cuya talla media disminuyó de unos 0,9 kg en 1950 a 0,4 en 1970. Durante el mismo período la talla a la madurez disminuyó de 20–29 cm a 18–24 cm (Gwahaba, 1973). k. Selección del tipo mórfico y de la talla reducida en el coregono, Coregonus lavaretus En el lago Femund de Noruega los coregonos, que son polimórficos, revisten tres formas. Una pesquería de pelágicos con redes de enmalle iniciada en los años ochenta procedió a una selección adversa al tipo pelágico, que disminuyó con respecto a las dos otras formas y ha redundado en una reducción de la proporción de peces grandes y de la talla por edades (Sandlund y Naesje, 1989). l. Pérdida de diversidad genética en el reloj anaranjado, Hoplostethus atlanticus En los años ochenta se creó una nueva pesquería dedicada al reloj anaranjado frente a las costas de Nueva Zelandia y tras diez años de explotación la biomasa se redujo en el 60–70 por ciento. La diversidad genética, medida por la electroforesis de la gelatina arrojó una disminución importante en tres caladeros aislados (Cuadro 2) entre 1982/83 y 1988 (Smith et al., 1991). El reciente descubrimiento de nuevos lugares de desove ofrece nuevas oportunidades para observar los efectos genéticos de la explotación de las poblaciones vírgenes. Los resultados preliminares de los estudios alozimáticos indican unos niveles de diversidad genética parecidos a los comunicados en 1982–83 anteriormente a la explotación (Smith, no publicados). En una situación parecida para la langosta, Panulirus marginatus, no se observaron variaciones genéticas a lo largo de nueve años de fuerte explotación de una población virgen (Seeb et al., 1990). m. Aumento de la diversidad genética del salmón rojo, Oncorhynchus nerka En las poblaciones de salmón rojo que desovan en lagos remotos en la península de Kamchatka, los ejemplares jóvenes pasan de uno a tres años en los lagos y luego emigran al mar para uno o cuatro años más antes de regresar como adultos sexualmente maduros. Los machos maduran según dos tallas distintas: como machos grandes, tras dos o más años en el mar, o como pequeños machos “kayiriki” después de un año en el mar (Altukhov, 1990). Además, algunos machos residuales del lago maduran como “enanos” (Altukhov, 1990). Este dimorfismo sexual es parecido al observado en el salmón plateado, O. kisutch (Gross, 1985). Los ejemplares machos grandes del salmón rojo tienen una ventaja sobre los machos pequeños en los lugares de desove, pero los machos pequeños consiguen su desquite en los años en que el nivel del agua es bajo, ya que los machos grandes no pueden penetrar en las zonas de desove superficiales (Altukhov, 1990). Cuadro 2. Niveles de heterocigosis del reloj anaranjado correspondientes a tres caladeros situados alrededor de Nueva Zelandia, observados en 1982/83 y 1988, antes y después de una pesca intensa. Se observa un fuerte descenso de la heterocigosis en cada caladero con una probabilidad de <0,02– <0,01 (Datos facilitados por Smith et al., 1991) Caladero Año del muestreo Heterocigosis media Probabilidad Chantham Rise 1982 0,20 <0,02 (Océano Pacífico) 1988 0,14 Costa este 1983 0,25 (Océano Pacífico) 1988 0,17 Challenger Plateau 1983 0,22 (Mar de Tasmania) 1988 0,15 <0,02 <0,01 Durante los treinta y cinco años comprendidos entre 1935–76 el número de salmones rojos que regresó al lago Dalneye, en la península de Kamchatka, disminuyó espectacularmente (Altukhov, 1990), mientras que aumentó la proporción de machos pequeños entre los que regresaban y, asimismo, la proporción de machos enanos residentes en la población aumentó considerablemente (Cuadro 3). Los estudios alozimáticos más recientes de las poblaciones de salmón rojo en tres lagos de Kamchatka (Cuadro 4) han revelado que la heterocigosis media entre dos loci enzimáticos es mayor en los machos pequeños que en los grandes (Altukhov, 1993). Las frecuencias alélicas son similares entre los dos grupos, pero los machos pequeños se caracterizan por un exceso importante de heterocigotos en el locus, phosphoglucomutase (PGM) y los machos grandes por un exceso importante de homocigotos en dos lagos. La hetorocigosis de las hembras se encuentra en un valor intermedio entre el de los machos grandes y pequeños (Altukhov, 1990). (Altukhov 1990) cree que estos cambios del heterocigotismo se deben a los efectos selectivos de la pesca. Mientras la pesca puede haber favorecido la supervivencia de los machos pequeños, como puede ocurrir con los cambios en un entorno de agua dulce, no hay datos históricos sobre las alozimas para las dos clases de talla de los machos. En tres lagos de Kamchatka el nivel de heterocigosis en la PGM aumenta con la proporción de machos pequeños existentes en el lago (Altukhov, 1990). Kirpichnikov et al. (1990) han demostrado que cuando los peces son pequeños los individuos de crecimiento más lento son menos heterocigóticos que los de crecimiento rápido. Si estos últimos maduran antes como enanos o machos pequeños, y en los salmónidos el crecimiento rápido está asociado con una madurez precoz, ello explicaría las observaciones de (Altukhov, 1990). La heterocigosis general de la población ha aumentado debido a los efectos indirectos de la pesca, que favorece la supervivencia de los machos pequeños. Estudios experimentales sobre la selección de los organismos acuáticos a. Selección de una tasa de crecimiento más lenta en el Oreochromis mossambicus El O. mossambicus se utiliza ampliamente en la acuicultura tropical de estanque. Se reproduce por la boca y se cría fácilmente en depósitos. Para medir los efectos de la pesca selectiva se establecieron dos poblaciones y después de 39 meses se cosecharon con dos meses de intervalo (Silliman, 1975). Mediante estas operaciones se extrajo aproximadamente el 10 por ciento de los peces: una población fue pescada selectivamente, retirando únicamente los peces que no podían pasar por una rejilla situada en el estanque. La segunda población, que actuaba de testigo, se pescó sin carácter selectivo, retirando un número parecido de peces pero de todas las clases de talla. Transcurridos 63 meses se aumentó la presión de pesca al 20 por ciento y se mantuvo durante otros 12 meses. Para observar los efectos genéticos de la pesca, se retiraron grupos de 46 individuos maduros, tanto de la población sometida a selección como de la no sometida, después de 77 meses, y se dejaron crecer durante otro período. El crecimiento se midió a los 55–56, 118–119, y 150–151 días después del comienzo del segundo experimento. Tanto en la población sometida a selección como en la no sometida los machos crecieron más rápidamente que las hembras, pero los machos de la población no sometida a selección crecieron más rápidamente que los machos de la población sometida a selección (Silliman, 1975). Así pues, la pesca selectiva dio lugar a la reducción de la tasa de crecimiento de los machos en tan solo tres generaciones. Es probable que las hembras se vieran menos afectadas. Cuadro 3. Número de ejemplares de salmón rojo en el lago Dalneye, península de Día, y número de machos pequeños y enanos durante el período 1935–76. (Datos facilitados por Krogius, 1979, y presentados por Altukhov, 1993) Salmón Períodos 1935–46 1947–56 1957–65 1966–76 Promedio de desovantes que entraron en el lago (10 000s) 63 10 6 1,6 Porcentaje de machos pequeños entre los machos migrantes 0,2 0,6 4,3 37,5 Porcentaje de enanos en la población de machos 26 49 47 89 Cuadro 4. Niveles de heterocigosis para los loci de la lactate dehydrogenase (LDH), y la phosphoglucomutase (PGM) del salmón rojo en tres lagos de Kamchatka. (Datos procedentes de Altukhov, 1993) Lago Peces Heterocigosis LDH PGM L. Nachikinskoye L. Blizhneye L. Dalineye machos pequeños .43 .55* machos grandes .39 .35* machos pequeños .19 .56* machos grandes .03 .36 machos anadrómicos .21 .31 machos enanos .16 .62* * desequilibrio genético significativo b. Selección de la edad y talla a la madurez en los “guppies”, Poecilia reticulata Las diferencia del ciclo biológico entre las poblaciones de “guppies” se deben a la depredación: algunos depredadores (cíclidos) hacen presión en los “guppies” sexualmente maduros de gran tamaño y otros depredadores (“killifish”) atacan a los “guppies” pequeños e inmaturos. Se trasplantó una población de “guppies” de un río, entre los que había un depredador cíclido, a un lugar tributario sin “guppies” pero con depredadores “killifish”. A lo largo de un período de once años la población trasplantada produjo hijos mayores y mayores hembras (Figura 7), que se reprodujeron por primera vez según una talla mayor que las hembras de la población testigo (Reznick et al., 1990). La cría de grupos de descendientes de las dos poblaciones en condiciones de laboratorio parecidas mostró que las diferencias del ciclo biológico tenían una base genética (Reznick et al., 1990). c. Selección de la talla en el Daphia magna Se llevó a cabo un experimento en el laboratorio con la pulga de agua, D. magna, para medir las repercusiones de dos regímenes de captura antagónicos, retirando los individuos pequeños y después los grandes (Edley y Law, 1988). En la primera extracción se retiró el 50 por ciento de la población y posteriormente el 40 por ciento cada ocho días. Los rendimientos disminuyeron en ambos regímenes, pero fueron mayores en la población de la que se extrajeron individuos grandes. En el régimen de retirada de individuos pequeños la talla media por edades aumentó, al igual que la talla a la primera reproducción, mientras que en el régimen de retirar los individuos grandes se produjo el efecto inverso, es decir, una disminución de la talla por edades y una disminución de la talla a la primera reproducción (Edley y Law, 1988). Figura 7. Talla de los hijos y talla media de las hembras sexualmente maduras en las muestras trasplantada y testigo de los “guppies” a lo largo del período de once años en el río Aripo de Trinidad. Los círculos unidos por una línea de trazo continuo corresponden al lugar introducido y los triángulos unidos por una línea de trazos son el lugar testigo. En este último lugar el principal depredador hizo presa predominantemente en los grandes “guppies” y en el lugar de trasplante el principal depredador atacó los “guppies” pequeños. (Datos facilitados por Reznick et al., 1990). Modelos para estudiar los efectos selectivos de la pesca Mentshutkin et al., (1989) formularon un modelo simulador para la pesquería del salmón rojo, Oncorhyncus nerka, en Kamchatka. Cuando el crecimiento estaba controlado por un gen único con dos alelos, la población modelo se hizo inestable al perder un alelo, lo cual apoya las observaciones de que la regulación del crecimiento es poligénica. Cuando el crecimiento era poligénico y multialélico, el porcentaje de alelos de “rápido crecimiento” (que equivale a la madurez precoz) aumentó en la población seleccionada y aumentó igualmente la proporción de peces no migratorios. Estos resultados corroboran las observaciones en la pesquería cuando ha habido un aumento de machos pequeños y de peces residentes en el lago (Altukhov, 1990). Favro et al., (1979, 1982) utilizaron un modelo de simulación para estimar la magnitud de los efectos genéticos en una pesquería de truchas sujeta a unos límites de talla mínima y en la que el crecimiento estaba regulado por un pequeño número de genes principales. Los resultados demostraron que la talla media y los números totales disminuyeron ante niveles moderados de presión de pesca y concordaban con las observaciones realizadas en la pesquería de la trucha marina, Salmo trutta, en Michigan. Ampliando el modelo para seleccionar los peces de una gama específica de tallas, para la que se fijó un límite máximo y mínimo, el modelo puso de manifiesto que un límite doble producía una disminución parecida en los peces grandes, al igual que ocurrió con los límites de talla mínima convencionales (Favro et al., 1980). Law y Edley (1989) han utilizado un modelo centrado en la edad para describir la explotación que actúa como una fuerza selectiva sobre la variación genética de los caracteres del ciclo biológico. La pesca selectiva inducirá cambios de los ciclos biológicos, que a su vez producirán cambios evolutivos del rendimiento. En principio, el director de la pesquería puede optar por la modalidad de pesca que seleccione el ciclo biológico óptimo y que producirá el mayor rendimiento, al que los autores se refieren como la “estrategia evolucionista para la pesca óptima estable” (Law y Edley, 1989). Aplicando este modelo al bacalao ártico-noruego, Gadus morhua, que ha mostrado una disminución de la edad a la madurez, puede obtenerse un aumento del rendimiento seleccionando los peces que maduran más tarde. En la práctica, aquello podría conseguirse restringiendo la pesca basada en los peces inmaturos en los lugares de alimentación septentrionales y centrando el esfuerzo en las pesquerías de desove (Law y Edley, 1989). McAllister y Peterman (1992) han propuesto un método de gestión experimental a gran escala para ensayar el carácter hereditario de la tasa de crecimiento y los efectos de la pesca selectiva por tallas en una población natural del salmón rosado, Oncorhynchus gorbuscha, con el objetivo de aumentar la biomasa de las capturas. Esta especie como ocurre con otros salmónidos de la costa oeste, ha mostrado una reducción de la talla media en los últimos veinte años (véase la sección g y Ricker et al., 1978) y no está claro si los cambios se deben a la captura selectiva de los peces mayores, al agotamiento selectivo de las poblaciones de gran tamaño corporal o a la modificación de las condiciones oceanográficas (McAllister y Peterman, 1992). La captura selectiva controlada de los peces pequeños permitiría comprobar el carácter hereditario de la tasa de crecimiento y, de ser ésta hereditaria, aumentar la talla media de los ejemplares de la pesquería. Las simulaciones realizadas en Monte Carlo pusieron de manifiesto que el diseño de bloque con pocas frepeticiones y breves tiempos de duración ofrecían una buena base estadística para determinar la importancia de la pesca con selección de tallas. Ampliando el diseño experimental, (McAllister y Peterman 1992) recurrieron al análisis decisorio para demostrar que el método experimental de ordenación de las poblaciones de salmón rosado produciría seguramente un valor de las capturas superior al obtenido con los métodos actuales. VARIACIONES GENETICAS DEBIDAS A LA DERIVA En las poblaciones pequeñas se producirá una pérdida de diversidad genética debido a la deriva. Hay pocos ejemplos de poblaciones marinas reducidas a un estado en el que pueda operar la deriva genética, pero algunas poblaciones de bivalvos, como la almeja gigante y el Trochus, han quedado muy reducidas en el Océano Indo-Pacífico como resultado de una explotación excesiva y tal vez no conseguirán sobrevivir sin una repoblación. La electroforesis de las proteínas de tres especies de almeja gigante ha puesto de manifiesto una elevada diversidad genética, pero el muestreo fue esporádico y no contenía muestras de las zonas en las que aquellas especies son raras (Benzie, 1993). En cambio, algunos teleósteos de agua dulce raros y en peligro de Norteamérica muestran una diversidad genética reducida y varias poblaciones desérticas se caracterizan por una variabilidad nula (Echelle, 1991). Se cree que los bajos niveles de heterocigosis observados en las poblaciones de salmón real, Oncorhynchus tshawytscha, que habita en la parte alta de los ríos de la cuenca del Columbia, Oregón y California, son el resultado de “estrangulamientos” naturales o causados por el hombre (Winans, 1989; Bartley et al., 1992b). La foca elefante septentrional, Mirounga angustirostrus, fue intensamente explotada en el pasado siglo y reducida a menos de 100 individuos. Esta especie muestra una variación genética reducida, medida por polimorfismos alozimáticos (Bonnel y Sealnder, 1974) y las secuencias del ADN mt (Hoelzel et al., 1993), en comparación con las poblaciones meridionales de la foca elefante, M. leonia, que, aunque explotada, su número de individuos no llegó a bajar de 1 000 (Gales et al., 1989; Hoelzel et al., 1993). Las pruebas experimentales demuestran que el cruzamiento consanguíneo reduce la productividad y la talla de los peces. Se crearon las poblaciones del pez mosquito, Gambusia holbrooki, en estanques artificiales a base de una hembra y un macho ambos vírgenes. En tres de los estanques los peces eran hermanos y en otros cuatro no tenían relación alguna. Las relaciones establecidas con hermanos tiene una variación genética prevista inferior al 25 por ciento de la correspondiente a los individuos no afines. Tras tres generaciones las poblaciones basadas en los individuos no afines produjeron 35 veces más juveniles que las poblaciones basadas en individuos afines y la talla de los machos a la madurez sexual fue superior en las poblaciones no afines que en las afines (Ledberg, 1990). La expansión de la industria de la acuicultura y la tendencia hacia la producción de reproductores en criaderos tanto para los programas de cría como para el mejoramiento, han llevado a la creación de muchos criaderos de organismos marinos y de agua dulce. La elevada fecundidad de estas especies permite obtener numerosos reproductores a partir de unos pocos padres, si bien con el riesgo de perder diversidad genética. Los estudios genéticos de las poblaciones de criadero indican que la pérdida de la diversidad genética es corriente y ha sido observada en los salmónidos de Norteamérica (Allendorf y Phelps, 1980; Cross y King, 1983; Leary et al., 1985; Verspoor, 1988) y Europa (Ryman y Stahl, 1980; Stahl, 1983; Vuorinen, 1984; Koljonen, 1989), en los sargos del Japón (Taniguichi, et al., 1983, Sugama et al., 1988), y en las ostras (Gosling, 1981, Gaffney et al., 1992); Hedgecock y Sly, 1990), las almejas (Dillon y Manzi, 1987; Benzie, 1993), en las caballas (Smith y Conroy, 1992), y en los camarones (Sbordoni et al., 1986). Además, los caracteres del ciclo biológico del salmón del Atlántico cultivado, Salmo salar, difieren a menudo de los de las poblaciones en libertad (Heggberget et al., 1993). Si bien la pérdida de la diversidad genética importa a los piscicultores, la suelta (intencionadas o no) de poblaciones de criaderos tiene consecuencias ecológicas y genéticas para las pesquerías naturales (Marnell, 1986; Thomas y Mathieson, 1993). El mantenimiento de algunas poblaciones del salmón del Pacífico depende de los reproductores de criadero (Winans, 1989) y en el Océano Pacífico septentrional se sueltan más de cuatro mil millones de crías al año (Hindar et al., 1991). El impacto genético de las sueltas en gran escala es incierto pero puede tener repercusiones negativas sobre las poblaciones naturales si las diferencias genéticas entre la población de criadero y la natural son grandes (Skaal et al., 1990; Hindar, et al., 1991). Ello es especialmente cierto para las poblaciones de salmónidos, que muchas veces están compuestas por subpoblaciones diferenciadas genéticamente. Hindar et al., (1991) han documentado muchos efectos genéticos de los salmónidos cultivados sobre las poblaciones nativas. Hay ciertos indicios de que las poblaciones introducidas de keta, Oncorhynchus keta, prosperan menos que la poblaciones nativas y no contribuyen posteriormente a las carreras de desove (Altukhov y Salmenkova, 1990) pero las pruebas electroforéticas con el salmón del Atlántico, Salmo salar, indican que el salmón de criadero escapado se cruza con el nativo (Crozier, 1993). En los ríos noruegos de desove se han descubierto muchos ejemplares de salmón salidos de un criadero (Skaala et al., 1990) y, en casos extremos, hasta el 80 por ciento de los individuos que desovan en los ríos pueden proceder de criadero (Hindar et al., 1991). En esta situación existe el peligro de que en las poblaciones naturales pequeñas los peces liberados inunden el acervo génico nativo. Las preocupaciones surgidas por las repercusiones genéticas de los salmónidos de criadero sobre las poblaciones naturales constituyen una advertencia sobre los peligros de los programas de mejoramiento. Los métodos genéticos para evitar el cruzamiento consanguíneo y la pérdida de diversidad debida a la deriva en los criaderos son bien conocidos (FAO, 1981; Soule, 1986; Gall, 1987; Munro, 1993), pero el mantenimiento y desove de un número elevado de reproductores puede presentar dificultades técnicas para las especies marinas (v.g. Gervis, 1993). Es aconsejable utilizar reproductores locales o genéticamente parecidos a las poblaciones locales, para reducir el riesgo de introducir alelos extraños en la población mejorada. Además, será necesario una buena ordenación de los criaderos, lo que supone aspirar el valor máximo del Ne (tamaño efectivo de la población), y reducir al mínimo los cruzamientos consanguíneos. La idea del marcado genético de los peces de criadero liberados resulta atractiva para los gestores de las pesquerías que desean medir las repercusiones a corto plazo de los peces liberados sobre la población natural, pero esta práctica podría tener consecuencias genéticas a largo plazo para la población. La mayor parte de propuestas para el marcado genético se centran en los alelos raros como marcador genético que debe introducirse selectivamente en los reproductores de criadero, por lo general cruzando algunos padres que sean portadores de este alelo raro. Aun el empleo de 50 padres nativos portadores del alelo raro no garantiza que algunos de ellos no sean afines y sin algún conocimiento de la composición genética de los portadores del alelo raro se corre el riesgo de crear reproductores que muestren alguna pérdida de diversidad. Características genéticas de las poblaciones casi agotadas Varias de las pesquerías pelágicas mayores del mundo se han agotado casi en los últimos cincuenta años, aunque en su mayor parte se han recuperado lentamente tras la suspensión de la pesca (Beverton, 1990). Se dispone de unos pocos datos genéticos sobre algunas poblaciones casi agotadas, pero deben interpretarse con cautela. Los bajos niveles de diversidad genética de algunas poblaciones de mamíferos se explican por el “estrangulamiento” de la población, ya sea natural (O'Brien et al., 1983) o debido a la explotación excesiva (Bonnell y Selander, 1974; Hoelzel et al., 1993; Pemberton y Smith, 1985). Sin embargo, otros mamíferos que no han pasado por un estrangulamiento recientemente también muestran bajos niveles de diversidad genética (v.g… Simonsen, 1982). Los datos genéticos para las poblaciones casi agotadas se recopilaron tras su brusca disminución, y las estimaciones de la variación genética se basan en la comparación con otras poblaciones o especies estrechamente relacionadas; no ha sido posible comprobar directamente la pérdida de alelos raros específicos o la reducción de la heterocigosis media dentro de las poblaciones. La pérdida de la diversidad alélica se producirá antes de que se advierta una disminución de la heterocigosidad (Waples et al., 1990) y los estrangulamientos de la población a corto plazo tendrán pocas repercusiones sobre ella, pero pueden reducir el número de alelos presentes (Allendorf, 1986). Además, las poblaciones pueden considerarse agotadas desde el punto de vista comercial y la pesca puede haberse suspendido por motivos económicos o de gestión, pero desde el punto de vista genético es posible que las especies hayan mantenido un elevado número de individuos. Ejemplos de poblaciones casi agotadas son las especies pelágicas pequeñas que en su momento de máxima abundancia constituían tamaños de poblaciones muy grandes con una biomasa madura de más de un millón de toneladas (Beverton, 1990). El arenque islandés, que puede haberse visto reducido a 1/3 000 de su biomasa máxima anterior, estará seguramente representado por un millón de peces aun en el punto más bajo alcanzado, mientras que otras poblaciones diezmadas ha mantenido unos tamaños todavía mayores (Beverton, 1990). La población de la sardina de California, Sardinops sagax caerulea, se redujo bruscamente a fines de los años cincuenta y permaneció 1/250 por debajo de su biomasa máxima anterior durante veinte años, para mostrar posteriormente signos de recuperación (Beverton, 1990). Esta especie de sardina tiene una diversidad genética baja con respecto a otros glupeoideos y una heterocigosis media de 1,0 por ciento (Hedgecock et al., 1989). En otras 15 especies de glupeoideos la heterocigosis media es del 7,1 por ciento y oscila del 4,0 al 10,1 por ciento (Hedgecock et al., 1989). Sin embargo, Hedgecock et al., (1989) estimaron que no era probable que esta baja diversidad genética se debiera a la reducción de la pesquería, ya que otras poblaciones de la sardina del Pacífico de Baja California y el Golfo de California, que no se vieron afectadas por la contracción, también arrojan una baja heterocigosis. Sin embargo, el bajo nivel de variación genética en la S. sagax caerula y el tamaño relativamente pequeño de la muestra no han permitido comprobar la distribución de los alelos raros, lo que podría ser una medida más sensible de la variación genética de las grandes poblaciones. Otras especies de sardinas que no parecen haber sufrido una brusca reducción recientemente también muestran una baja heterocigosis (Kinsey et al., 1994; Menzes, 1994). La pesquería de la sardina japonesa, Sardinops melanosticta, se vio bruscamente reducida en los años cuarenta, al pasar de unas capturas máximas de 2 700 000 toneladas en 1937 a menos de 10 000 toneladas en 1965. Esta especie desapareció de la parte norte de su zona, pero posteriormente se recuperó y a finales de 1970 las capturas ascendieron a más de 1 000 000 de toneladas al año (Kondo, 1980). Esta especie tiene una heterocigosis del 6,4 por ciento parecida a la de los dos otros clupeoideos estudiados en el mismo laboratorio (Fujio y Kato, 1979). Incluso con el bajo nivel alcanzado tras la brusca disminución de la población, las capturas se mantuvieron en millares de toneladas por año. Análogamente, en la pesquería de la sardina de Africa austral, Sardinops ocellata, que se desmoronó en los años setenta para pasar de un máximo de más de 1 000 000 de toneladas anuales a 11 000 toneladas en el año 1980, la heterocigosis media (5,2 por ciento) es parecida a la de otros clupeoideos (Grant, 1985). La pesquería de arenques, Clupea harengus, del Georges Bank se redujo radicalmente en los años setenta y la población pudo haber disminuido a 1/1 000 de la biomasa máxima (Beverton, 1990). En 1986 se observaron arenques que desovaban en el Georges Bank por primera vez y se recogieron muestras para su análisis genético. Se vio que estos arenques eran distintos de los de las poblaciones vecinas del golfo de Maine en un locus de la enzima, lo que combinado con una estructura de clases anuales distinta de las poblaciones vecinas, parece indicar que la población se recuperó por resurgimiento propio y no por colonización (Stephenson y Kornfield, 1990). Los niveles de heterocigosis en dos loci de la enzima y el nivel de diversidad del ADN mitocondrial eran parecidos al de otros grupos desovantes del Atlántico nordoccidental, indicando que no se había producido una pérdida de diversidad genética tras el agotamiento de la pesquería (Stephenson y Kornfield, 1990), si bien esta comparación se hizo con otras poblaciones de arenques muy explotadas. El atún del sur, Thunnus maccoyii, es muy explotado en los océanos meridionales; la pesquería no se ha agotado pero la biomasa padre es tan solo del 10–20 por ciento de la que había en 1965 (informe de 1993). Las muestras de tejidos tomadas en la pesquería de Nueva Zelandia en 1982–83 fueron sometidas a ensayos en 14 loci variables de enzima y en 1992 se repitieron las pruebas. No se observó cambio genético significativo alguno, medido por la heterocigosis media y el número medio de alelos, durante este período de 10 años de biomasa decreciente (Smith, no publicado). En cambio, las poblaciones de reloj anaranjado cuya biomasa virgen se había reducido en un 60–70 por ciento mostraron una pérdida importante de heterocigosis genética, pero ello se atribuye a la selección y no a la deriva, ya que estas poblaciones mantienen grandes grupos desovantes que justifican importantes pesquerías de varios millares de toneladas anuales (Smith et al., 1991). RESUMEN Y RECOMENDACIONES Variaciones genéticas debidas a la selección Los estudios experimentales realizados con organismos acuáticos han demostrado que la selección puede modificar los caracteres del ciclo biológico de una población en pocas generaciones. En las poblaciones naturales la pesca constituye una fuente importante de mortalidad y no es aleatoria con respecto a la edad y la talla de los individuos. A menudo, los cambios observados en los caracteres del ciclo biológico de las poblaciones explotadas, siguen la dirección prevista por la teoría y los exprimentos de selección. En los teleósteos una de las observaciones más corrientes ha sido la disminución de la edad o la talla a la madurez sexual (los ejemplos citados no son exhaustivos). Como el principio de la madurez sexual viene controlado tanto por factores genéticos como ambientales, las repercusiones genéticas de la pesca han sido difíciles de evaluar. En los primeros trabajos sobre las modificaciones de los caracteres del ciclo biológico no se tuvieron en cuenta los conceptos genéticos, y los modelos de equilibrio de la ordenación de las pesquerías, que tienen una base ecológica y están dominados por los efectos compensatorios, han pasado por alto la componente genética de la pesca. No fue sino hasta que Rickers (1980, 1981, 1982) y Beachams (1983a, 1983b, 1983c) presentaran informes detallados a principios de los años ochenta, que se tuvo en cuenta la selección genética como posible problema de una explotación excesiva. Todos los ejemplos de selección se refieren a poblaciones que han sido explotadas en exceso. Un control empresarial más riguroso de las poblaciones puede contribuir a reducir los efectos genéticos probables de la pesca en el futuro. Si existe la incertidumbre sobre la selección de una edad y talla reducidas a la madurez en algunas especies, existen en cambio mayores indicios de que la selección deriva de la selección de la talla en el salmón plateado (Gross, 1985, 1991) y de la variación de la talla a largo plazo en el salmón semelparo del Pacífico (Ricker, 1980, 1981). La reducción de la diversidad genética del reloj anaranjado se ha producido en poblaciones vírgenes que han sido explotadas más allá del rendimiento sostenible máximo. En ninguna de las pesquerías que han arrojado una respuesta genética a la explotación se ha producido una reducción total de la pesca para comprobar si los caracteres originales del ciclo biológico pueden devolverse a su estado primario. Unicamente en la anchoa, Engraulis capensis, se ha producido un aumento de la longitud a una madurez del 50 por ciento tras un aumento de la biomasa debido al reclutamiento, posiblemente como una reacción compensatoria (Shelton y Armstrong, 1983). Variaciones genéticas debidas a la deriva El cambio genético afecta a las poblaciones pequeñas y algunas especies de agua dulce raras y en peligro muestran unos bajos niveles de diversidad genética. No hay pruebas de que se haya producido la pérdida de la diversidad debido a la deriva en las poblaciones marinas, pero la mayor parte de las poblaciones no se ha reducido a niveles próximos a la extinción. Las poblaciones de bivalvos marinos, cuyo número de individuos se ha visto severamente reducido, no han sido examinadas para determinar su diversidad genética. No hay pruebas de que las poblaciones casi agotadas hayan sufrido una pérdida de la diversidad genética, pero las pruebas están limitadas a una comparación de los datos electroforéticos reunidos después de la reducción. Aunque las poblaciones estén agotadas desde el punto de vista comercial, la mayor parte de ellas ha mantenido tamaños grandes aun en su estado inferior, por lo que no cabe esperar que pierdan variedad genética debido a la deriva. El creciente uso de técnicas de mejoramiento para reconstruir las poblaciones diezmadas podría tener repercusiones genéticas en los recursos costeros. Una elección inapropiada de los reproductores y la pérdida de diversidad en los reproductores de criadero podrían cambiar la composición genética de la población natural. Recomendaciones Las recomendaciones que se desprenden del presente informe se refieren a tres aspectos: 1. Es necesario emprender estudios experimentales para determinar el carácter hereditario y la respuesta a la selección de los caracteres del ciclo biológico de las especies encontradas, y determinar si la suavización de la presión de pesca permite la recuperación de los genes correspondientes al “crecimiento rápido” y a la “maduración tardía” o a un complejo de genes en las poblaciones. Si bien no es probable que una pesquería marina abierta pueda volver al nivel de explotación anterior, sería conveniente utilizar una población experimental (lago o laboratorio) para ensayar las variaciones genéticas que se producen cuando se somete a grados de explotación intensa y amortiguada. Se han ideado experimentos para el salmón rosado, Oncorhynchus gorbuscha, a fin de ensayar el carácter hereditario de la tasa de crecimiento y los efectos de la pesca selectiva por tallas sobre una población natural, demostrándose que la realización de estos experimentos no comportaría perjuicios económicos (McAllister y Peterman, 1992). 2. Sería conveniente recopilar y registrar datos sobre los niveles de la diversidad genética en las especies explotadas, especialmente las explotadas recientemente o ligeramente. Hasta la fecha la mayor parte de los estudios genéticos se han centrado en la identificación de las poblaciones. Los conocimientos y recursos reunidos para estos estudios podrían adaptarse para los estudios internos de las poblaciones y utilizar tanto los caracteres del ciclo biológico como los marcadores moleculares para examinar la genética del reclutamiento y las variaciones genéticas de las poblaciones. Una combinación de estudios experimentales y de campo permitiría una comprobación más rigurosa de las variaciones genéticas en las poblaciones explotadas. 3. Debería estudiarse la modificación de las medidas de ordenación para aumentar la talla mínima en las poblaciones explotadas intensamente. El aumento del límite de la talla, a condición de que no se consiga mediante un índice de descartes superior de los peces que no den la talla, reduciría la presión de selección de la madurez precoz. Dichas medidas podrían revestir la forma de limitaciones impuestas a los aparejos o modificaciones para evitar la captura de juveniles, o disponer amplias zonas cerradas para protegerlos de la pesca. Hasta la fecha la mayor parte de las reservas marinas son de pequeñas dimensiones y se concentran en las inmediaciones de la zona sublitoral, con especial interés en los aspectos recreativos más que en los principios científicos de la conservación. Para los programas de mejoramiento se recomienda que los reproductores liberados se obtengan de las reservas locales y con un número eficaz mínimo de padres (Ne = 50). REFERENCIAS 1 Ahlstrom, E.H. 1966. Distribution and abundance of sardine and anchovy larvae in the California current region of California and Baja California, 1951–64: a summary. Special Scientific Report of the US Fish and Wildlife Service 534–571. Allendorf, F.W. 1986. Genetic drift and the loss of alleles versus heterozygosity. Zoo Biology 5: 181– 190. Allendorf, F.W., Phelps, S.R. 1980. Loss of genetic variation in hatchery stock of cutthroat trout. Transactions of the American Fisheries Society 109: 537–543. Allendorf, F.W., Leary, R.F. 1986. Heterozygosity and fitness in natural populations of animals, pp 57– 76. In Soule, M.E. (ed.) Conservation biology. Sinauer Associates, Massachusetts. Altukhov, Yu. P. 1990. Population genetics, diversity and stability. Translated from Russian by Appleby, J.H. Hardwood Academic, London. Altukhov, Yu. P. 1993. Effects of fishing on genetic resources of aquatic organisms. FAO unpublished document. 27p. Altukhov, Yu. P., Salmenkova E.A. 1990. Introductions of distinct stocks of chum salmon, Oncorhynchus keta (Walbum), into natural populations of the species. Journal of Fish Biology 37: 25– 33. Aneer, G. 1985. Some speculations about the Baltic herring (Clupea harengus membras) in connection with the eutrophication of the Baltic Sea. Canadian Journal of Fisheries and Aquatic Science 42 (Supp. 1): 83–90. Anokhina, L.E. 1971. Maturation of Baltic and White Sea herring with special reference to variations in fecundity and egg diameter. Rapports et Procès-verbaux des réunions 160: 12–17. Aspinwall, N. 1974. Genetic analysis of North American populations of the pink salmon (Oncorhynchus gorbuscha): possible evidence for the neutral mutation-random drift hypothesis. Evolution 28: 295–305. Avise, J.C., Reeb, C.A., Saunders, N.C. 1987. Geographic population structure and species differences in mitochondrial DNA of mouthbrooding catfishes (Aridae) and demersal spawing toadfishes (Batrachoidae). Evolution 41: 991–1002. Baker, C.S., MacCarthy, M., Smith, P.J., Perry, A.P., Chambers, G.K. 1992. DNA fingerprints of orange roughy, Hoplostethus atlanticus: a population comparison. Marine Biology 113: 561–567. Baranov, F.I. 1918. On the question of the biological básis of fisheries. Nauchnyi Issledovatelskii Ikhtiologicheskii Institut Isvestia 1: 81–128. Bartley, D., Bagley, M., Gall, G., Bentley, B. 1992a. Use of linkage disequilibrium data to estimate effective size of hatchery and natural fish populations. Conservation Biology 6: 365–375. Bartley, D., Bentley, B., Brodziak, J., Gomulkiewicz, R., Mangel, M., Gall, G.A.E. 1992b. Geographic variation in population genetic structure of chinok salmon from California to Oregon. Fishery Bulletin 90: 77–100. Battaglia, B., Bisol, P.M., Rodino, E. 1980. Experimental studies on some genetic effects of marine pollution. Helgolander Meeresunters 33: 587–595. Beacham, T.D. 1983a. Variability in median size and age at sexual maturity of Atlantic cod, Gadus morhua, on the Scotian shelf in the Northwest Atlantic Ocean. Fishery Bulletin 81: 303–321. Beacham, T.D. 1983b. Variability in size and age at sexual maturity of American plaice and yellowtail flounder in the Canadian Maritimes Region of the northwest Atlantic Ocean. Canadian Technical Report of Fisheries and Aquatic Sciences 1196. 75p. Beacham, T.D. 1983c. Variability in size and age at sexual maturity of haddock (Melanogrammus aeglefinis) on the Scotian Shelf in the northwest Atlantic. Canadian Technical Report of Fisheries and Aquatic Sciences 1168. 33p. Ben-Shlomo, R. Nevo, E. 1988. Isozyme polymorphism as monitoring of marine environments. Marine Pollution Bulletin 19: 314–317. Bensten, H.B. 1994. Genetic effects of selection on polygenic traits with examples from Atlantic salmon, Salmo salar L. Aquaculture and Fisheries Management 25:89–102. Benzie, J.A.H. 1993. Review of the population genetics of giant clams. In Munro, P.(ed.) Genetic aspects of conservation and cultivation of giant clams. ICLARM Conference Proceedings 39, pp 1–6. Benzie, J.A.H., Williams, S.T. 1992. No genetic differentiation of giant clam (Tridacna gigas) populations in the Great Barrier Reef, Australia. Marine Biology 113: 373–377. Beverton, R.J.H 1990. Small pelagic fish and the threat of fishing; are they endangered? Journal of Fish Biology 37 (Supplement A): 5–16. Bonnell, M.L., Selander, R.K. 1974. Elephant seals - genetic variation and near extinction. Science 184: 908–909. Borisov, V.M., 1979. The selective effect of fishing on the population structure of species with a long life cycle. Journal of Ichthyology 18:896–904. Boulding, E.G., Boom, J.D.G., Beckenbach, A.T. 1993. Genetic variation in one bottlenecked and two wild populations of the Japanese scallop (Patinopecten yessoensis): empirical parameter estimates from coding regions of mitochondrial DNA. Canadian Journal of Fisheries and Aquatic Sciences 50: 1147–1157. Brander, K. 1981. Disappearance of common skate Raia batis from Irish Sea. Nature 290: 48–49. Brierley, A.S., Rodhouse, P.G., Thorpe, J.P., Clarke, M.R. 1993. Genetic evidence of population heterogeneity and cryptic speciation in the ommastrephid squid Martialia hyadesi from the Patagonian Shelf and Antarctic Polar frontal zone. Marine Biology 116: 593–602. Brown, L.D. 1991. Genetic variation and population structure in the blacklip abalone, Haliotis rubra. Australian Journal of Marine and Freshwater Research 42: 77–90. Buroker, N.E. 1983. Population genetics of the American oyster Crassostrea virginica along the Atlantic coast and the Gulf of Mexico. Marine Biology 75: 99–112. Burton, R.S. 1983. Protein polymorhisms and genetic differentiation of marine invertebrate populations. Marine Biology letters 4: 193–206. Byers, C.J., Goosen, P.C. 1987. Variations in fecundity and size at sexual maturity of female rock lobster Jasus lalandii in the Beguela ecosystem. South African Journal of Marine Science 5: 513–521. Cairns, M.A., Lackey, R.T. 1992. Biodiversity and management of natural resources: the issues. Fisheries (Bethesda) 17: 6–10. Campton, D.E., Berg, C.J., Robinson, L.M., Glazer, R.A. 1992. Genetic patchiness among populations of queen conch Strombus gigas in the Florida Keys and Bimini. Fishery Bulletin 90: 250–259. Carlton, J.T. 1989. Man's role in changing the face of the ocean: biological invasions and implications for conservation of near-shore environments. Conservation Biology 3; 265–273. Carvalho, G.R., Thomson, A., Stoner, A.L. 1992. Genetic diversity and population differentiation of the shortfin squidIlex argentus in the south-west Atlantic. Journal of Experimental Marine Biology and Ecology 158: 105–121. Charnov, E.L. 1979. Natural selection and sex change in Pandalid shrimp: a test of a life history theory. American Naturalist 113: 715–734. Charnov, E.L. 1981. Sex seversal in Pandalus borealis: effect of a shrimp fishery? Marine Biology Letters 2: 53–57. Chittleborough, R.G. 1979. Natural regulation of the population of Panulirus longipes cygnus George and responses to fishing pressure. Rapports et Procès-verbaux des réunions Conseil international pour l'exploration de la mer. 175: 217–221. Cochard, J.C., Devauchelle, N. 1993. Spawning, fecundity and larval survival and growth in relation to controlled conditioning in native and transplanted populations of Pecten maximus (L): evidence for the existence of separate stocks. Journal of Experimental Marine Biology and Ecology 169: 41–56. Crandel, P.A., Gall, G.A.E. 1993a. The genetics of body weight and its effect on early maturity based on individually tagged rainbow trout (Onchorynchus mykiss). Aquaculture 117, No. 1/2: 77–93. Crandell, P.A., Gall, G.A.E. 1993b. The genetics of age and weight at sexual maturity based on individually tagged rainbow trout (Onchorynchus mykiss). Aquaculture 117, No. 1/2: 95–115. Cross, T.F. King, J. 1983. Genetic effects of hatchery rearing in Atlantic salmon. Aquaculture 33: 33– 40. Crozier, W.W. 1993. Evidence of genetic interaction between escaped farmed salmon and wild Atlantic salmon (Salmo salar L.) in a northern Irish river. Aquaculture 113: 19–29. Cushing, D.H. 1975. Marine ecology and fisheries. Cambridge University Press, Cambridge, 278 p. Cushing, D.H. 1982. Climate and Fisheries. Academic press, London, 373 pp. Cushing, D.H. 1984. The gadoid outburst in the North Sea. Journal of Cons. Int. Exploration de la Mer 41: 159–166. Daan, N. 1980. A review of replacement of depleted stocks by other species and the mechanisms underlying such replacement. Rapports et Procès-verbaux des réunions Conseil international pour l'exploration de la mer 177: 405–421. Dahle, G. 1991. Cod, Gadus morhua L., populations identified by mitochondrial DNA. Journal of Fish Biology 38: 295–303. Daly, J.C., Richardson, B.J. 1980. Allozyme variation between populations of baitfish species Stolephorus heterolobus and S. devisi (Pisces: Engraulidae) and Spratelloides gracilis (Pisces: Dussumieridae) from Papua New Guinea waters. Australian Journal of Marine and Freshwater Research 31: 701–711. Danzmann, R.G., Ferguson, M.M., Allendorf, F.W. 1989. Genetic variability and components of fitness in hatchery strains of rainbow trout. Journal of Fish Biology 35: 313–319. Devold, F. 1963. The life history of the Atlanto-Scandian herring. Rapports et Procèsverbaux des réunions 154: 98–108. Dillon, R.T., Manzi, J.J. 1987. Hard clam Mercenaria mercenaria, broodstock: genetic drift and loss of rare alleles without reduction in heterozygosity. Aquaculture 60: 99–105 Echelle, A.A. 1991. Conservation genetics and genic diversity in freshwater fishes of western North America. In Minckley W.L. and Deacon J.E. Battle against extinction. University of Arizona Press, Arizona, pp 141–153. Edley, M.T., Law, R. 1988. Evolution of life histories and yields in experimental populations of Daphnia magna. Biological Journal of the Linnean Society 34: 309–326. Elliot, N.G., Ward, R.D. 1992. Enzyme variation in orange roughy, Hoplostethus atlanticus (Teleostei: Trachichthyidae), from Southern Australian and New Zealand waters. Australian Journal of Marine and Freshwater Research 43: 1561–1571. FAO, 1981. Conservation of the genetic resources of fish: problems and recommendations. FAO Fisheries Technical Paper 217, Rome, Italy. 43p. FAO, 1993. Report of the expert consultation on utilization and conservation of aquatic genetic resources. FAO Fisheries Report 491, Rome, Italy. 58p. Favro, L.D., Kuo, P.K., McDonald, J.F. 1979. Population-genetic study of the effects of selective fishing on the growth rate of trout. Canadian Journal of Fisheries and Aquatic Sciences 36: 552–561. Favro, L.D., Kuo, P.K., McDonald, J.F. 1980. Effects of unconventional size limits on the growth rate of trout. Canadian Journal of Fisheries and Aquantic Sciences 37: 863–876. Favro, L.D., Kuo, P.K., McDonald, J.F., Favro, D.D., Kuo, A.D. 1982. A multilocus genetic model applied to the effects of selective fishing on the growth rate of trout. Canadian Journal of Fisheries and Aquatic Sciences 39: 1540–1543. Fevolden, S.E., Garner, S.P. 1986. Population genetics of Mytlius edulis (L) from Oslofjorden, Norway, in oil-polluted and non oil-polluted water. Sarsia 71: 247–257. Fogarty, M. 1992. Report of special session. Journal of Northwest Atlantic Fisheries Science 14: 9–11. Fogarty, M.J., Sissenwine, M.P., Cohen, E.B. 1991. Recruitment variability and the dynamics of exploited marine populations. Trends in Ecology and Evolution 6: 241–246. Franklin, I.R. 1980. Evolutionary change in small populations. In Soule, M.E. and Wilcox, B.A. (eds). Conservation Biology. Sinauer Associates, Sunderland, Mass. pp 135–150. Fujio, Y., Kato, Y. 1979. Genetic variation in fish populations. Bulletin of the Japanese Society of Scientific Fisheries 45: 1169–1178. Gaffney, P.M., Davis, C.V., Hawes, R.O. 1992. Assessment of drift and selection in hatchery populations of oysters (Crassostrea virginica). Aquaculture 105: 1–20. Gales, N.J., Adams, M., Burton, H.R. 1989. Genetic relatedness of two populations of southern elephant seal. Marine Mammal Science 5: 57–67. Gall, A.E. 1987. Inbreeding. In Ryman, N. and Utter, F. (eds). Population genetics and fishery management. Washington Sea Grant Program, Seattle, pp 47–87. Gall, A.E., Busack C.A. (eds). 1986. Genetics in aquaculture. Aquaculture 57: 1–386. Gall, A.E., Chen, H. (eds). 1993. Genetics in aquaculture IV. Aquaculture 111: 1–332. Garrod D.J. 1973. The variation of replacement and survival in some fish stocks. Rapports et Procèsverbaux des réunions Conseil international pour l'exploration de la mer 164: 43–56. Garrod, D.J., Horwood, J.W. 1984. Reproductive strategies and the response to exploitation. In Potts G.W.Wootton R.J. (eds). Fish reproduction: strategies and tactics. Academic Press, London, pp 367– 384. Garrod, D.J., Knights, B.J. 1979. Fish stocks: their life-history characteristics and response to exploitation. Symposium Zoological Society London 44: 361–382. Gauldie, R.W., Johnston, A.J. 1980. The geographical distribution of phosphoglucomutase and glucosephosphate isomerase alleles of some New Zealand fishes. Comparative Biochemistry and Physiology 66B: 171–183. Gervis, M. 1993. Giant clams, genetics and hatchery procedure. In Munro P. (ed.) Genetic aspects of conservation and cultivation of giant clams. ICLARM Conference Proceedings 39, pp 21–24. Gharrett, A.J., Smoker, W.W. 1993. Genetic components in life history traits contribute to population structure. In Cloud J.G. Thorogaard G.H. (eds). Genetic conservation of salmonid fishes. Plenum Press, London, pp 197–202. Gjerdrem, T. 1983. Genetic variation in quantitative traits and selective breeding in fish and shellfish. Aquaculture 33: 51–72. Gjedrem, T. (ed.) 1990. Genetics in aquaculture III. Aquaculture 85: 1–340. Gjosaeter, J., Jorstad, K., Naevdal, G., Thorkildsen, S. 1992. Genotype distributions of cod from the Norwegian Skagerrak coast. Sarsia 76: 255–259. Gold, J.R., Richardson , L.R., King , T.L., Matlock , G.C. 1993. Temporal stability of nuclear gene (allozyme) and mitochondrial DNA genotypes among red drums from the Gulf of Mexico. Transactions of the American Fisheries Society 122: 659–668. Gosling, E.M. 1982. Genetic variability in hatchery produced Pacific oysters (Crassostrea gigas Thunberg). Aquaculture 26: 273–287. Grant, W.S. 1985. Population genetics of the Southern African pilchard Sardinops ocellata, in the Benguela upwelling system. International Symposium on Upwelling of West Africa 1: 551–562. Grant, W.S., Cherry, M.I., Lombard, A.T. 1984. Acryptic species of Mytilus (Mollusca: Bivalvia) on the west coast of South Africa. South African Journal of Marine Science 2: 149–162. Graves, J.E., Rosenblatt, R.H 1980. Genetic relationships of the color morphs of the serranid fish Hypoplectrus unicolor. Evoluation 34: 240–245. Gross, M.R. 1985. Disruptive selection for alternative life histories in salmon. Nature 313: 47–48. Gross, M.T. 1991. Salmon breeding behaviour and life history evolution in changing environments. Ecology 72: 1180–1186. Gwahaba, J.J. 1973. Effects of fishing on the Tilapia nilotica (Linne" 1757) population in Lake George, Uganda over the past twenty years. East African Wildlife Journal 11: 317–328. Gyllensten, U., Ryman, N. 1988. Biochemical genetic variation and population structure of fourhorn sculpin (Myoxocephalus quadricornis; Cottidae) in Scandinavia. Hereditas 108: 179–185. Gyllensten, U. 1985. The genetic structure of fish: differences in the intraspecific distribution of biochemical genetic variation between marine, anadromous and freshwater species. Journal of Fish Biology 26: 691–699. Hamley, J.M. 1975. Review of gillnet selectivity. Journal of the Fisheries Research Board of Canada 32: 1943–1969. Handford, P., Bell, G., Reimchen, T. 1977. A gillnet fishery as an experiment in artificial selection. Journal of the Fisheries Research Board of Canada 34: 954–961. Hansen, P.M. 1949. Studies on the biology of the cod in Greenland waters. Rapports et Procèsverbaux des réunions 123: 1–77. Healey, M.C. 1975. Dynamics of exploited whitefish populations and their management, with special reference to the Northwest Territories. Journal of the Fisheries Research Board of Canada 32: 427– 448. Hedgecock, D. 1986. Is gene flow from pelagic larval dispersal important in the adaptation and evolution of marine invertebrates? Bulletin Marine Science 39: 432–443. Hedgecock, D. Sly, F. 1990. Genetic drift and effective population sizes of the Pacific oyster, Crassostrea gigas. Aquaculture 88: 21–38. Hedgecock, D., Hutchinson, E.S., Gang, L., Sly, F.L., Nelson,K. 1989. Genetic and morpometric variation in the Pacific sardine, Sardinops sagax caerulea: comparisons and contrasts with historical data and with variability in the northern anchovy, Engraulis mordax. Fishery Bulletin 87: 653–671. Heggbertget, T.G. and six co-authors 1993. Interactions between wild and cultured Atlantic salmon: a review of the Norwegian experience . Fisheries Research 18: 123–146. Hempel G. 1978. North Sea fish stocks - recent changes and their causes. Rapports et Procèsverbaux des réunions Conseil international pour l'exploration de la mer 172: 1–449. Hilbish , T.J. 1985. Demographic and temporal structure of an allele frequency cline in the mussel Mytilus edulis. Marine Biology 86: 163–171. Hilbish, T.J., Koehn, R.K. 1985. The physiological basis of natural selection at the LAP locus. Evolution 39: 1302–1317. Hindar, K., Ryman, N., Utter, F. 1991. Genetic effects of cultured fish on natural populations. Canadian Journal of Fisheries and Aquatic Sciences 48: 945–957. Hoelzel, A.R., Halley, J., O'Brien, S.J., Campagna, C., Arnbom, T., Le Boeuf, B., Ralls, K., Dover, G.A. 1993. Elephant seal genetic variation and the use of simulation models to investigate historical population bottlenecks. Journal of Heredity 84: 443–449. Hughes, R.M. Noss, R.F. 1992. Biological diversity and biological integrity: current concerns for lakes and streams. Fisheries (Bethesda) 17: 11–19. Humphreys, R.L., Winans, G.A., Tagami, D.T. 1989. Synonymy and life-history of the North Pacific pelagic armourhead, Pseudopentaceros wheeleri hardy (Pisces: Pentacerotidae). Copeia 1989: 142– 153. Hvilsom, M.M. 1983. Copper-induced differential mortality in the mussel Mytilus edulis. Marine Biology 76: 291–295. ICNAF 1963. The selectivity of fishing gear. International Commission for the Northwest Atlantic Fisheries. Special Publication No. 5, 225p. Jensen, A.J.C. 1965. Pandalus borealis in the Skagerak (length, growth, and changes in the stock and fishery yield. Rapports et Proces-Verbaux des Reunions 156: 109–111. Jensen, A.J.C. 1967. The Pandalus borealis in the North Sea and Skagerak. Marine Biology Association of India Proceedings of a Symposium on crustacea IV: 1317–1319. Johannesson, K., Rodstrom, E.M., Aase, H. 1989. Low genetic variability in Scandinavian populations of Ostrea edulis L.- possible causes and implications. Journal of Experimental Marine Biology and Ecology 128: 177–190. Johnson, A.G. Utter, F.M. 1976. Electrophoretic variation in intertidal and subtidal organisms in Puget Sound, Washington. Animal Blood Groups and Biochemical Genetics 7: 3–14. Johnson, M.S. 1977 Association of allozymes and temperature in the crested blenny Anoplarchus purpurescens Marine Biology 41: 147–152. Johnson , M.S., Black, R. 1982. Chaotic genetic patchiness in an intertidal limpet, Siphonaria spp. Marine Biology 70: 157–164. Johnson, M.S., Black, R. 1984. Pattern beneath the chaos: the effect of recruitment on genetic patchiness in an intertidal limpet. Evolution 38: 1371–1383. Johnson, M.S., Holborn, K., Black, R. 1993. Fine-scale patchiness and genetic heterogeneity of recruits of the corallivorous gastropod Drupella cornus Marine Biology 117: 91–96. Jonsson, B., Hindar, K., Northcote, T.G. 1984. Optimal age at sexual maturity of sympatric and experimentally allopatric cutthroat trout and Dolly Varden charr. Oecologia 61: 319–325. Jorgensen, T. 1992. Long-term changes in the growth of North-east Arctic cod (Gadus morhua) and some environmental influences. ICES Journal of Marine Science 49: 263–277. Jorstad, K.E., Naevdal, G. 1989. Genetic variation and population structure of cod, Gadus morhua L., in some fjords in northern Norway. Journal of Fish Biology 35(A): 245–252. Kandler, R. 1932. Veranderungen im flundernlie stand der Ostsee durch die fisherei. Rapports et Procès-verbaux des réunions Conseil international exploration de la mer 78: 1–45. Kapoor-Vijay, P. 1992. Biological diversity and genetic resources. Commonwealth Science Council, London. Kapuscinski, A.R.D., Lannan, J.E. 1986. A conceptual genetic fitness model for fisheries management. Canadian Journal of Fisheries and Aquatic Sciences 43: 1606–1616. Kawasaki T., Tanaka S., Toba Y., Taniguichi A. 1991. Long-term variability of pelagic fish populations and their environment. Pergamon Press, Oxford. Kenchington, T.J., Kenchington, E.L.R. 1993. An eighteenth century commercial length-frequency sample of Atlantic cod, Gadus morhua, based on archaeological data. Fisheries Research 18: 335– 347. Kinsey, S.T., Orsoy, T., Bert, T.M., Mahmoudi, B. 1994. Population structure of the Spanish sardine Sardinella aurita: natural morphological variation in a genetically homogeneous population. Marine Biology 118: 309–317. Kirpichnikov, V.S. 1981. Genetic bases of fish selection. Springer-Verlag, New York. Kirpichnikov, V.S., Muske, G.A., Scholl-Engberts, A.D., Chernov, V.M., Borchsenius, S.N. 1990. Genetic structure and allele frequency dynamics in the sockeye salmon population of Lake Dalneye, Kamchatka. Aquaculture 84: 13–25. Koehn, R.K. 1991. The genetics and taxonomy of species in the genus Mytilus. Aquaculture 94: 125– 145. Koehn, R.K., Newell, R.I.E., Immerman, F. 1980. Maintenance of an amino peptidase allele frequency cline by natural selection. Proceedings of the National Academy of Science 77: 5385–5389. Koehn, R.K., Milkman, R.D., Mitton, J.B., 1976. Population genetics of marine pelecypods IV. Selection migration and genetic differentiation in the blue mussel Mytilus edulis. Evolution 30: 2–32. Koehn, R.K., Zera, A.J., Hall, J.G. 1983. Enzyme polymorphism and natural selection. In Nei, M. and Koehn, R.K. (eds). Evoluation of genes and proteins. Sinauer Associates, Sunderland, Mass. pp 115– 136. Koljonen, M.L. 1989. Electrophoretically detectable genetic variation in natural and hatchery stocks of Atlantic salmon in Finland. Hereditas 110: 23–35. Kondo, K. 1980. The recovery of the Japanese sardine - the biological basis of stock-size fluctuations. Rapports et Procès-verbaux des réunions Conseil international exploration de la mer 177: 332–354. Kordos, L.M., Burton, R.S. 1993. Genetic differentiation of Texas Gulf Coast populations of the blue crab Callinectes sapidus. Marine Biology 117: 227–233. Lacson, J.M., Morizot, D.C. 1991. Temporal genetic variation in subpopulations of bicolor damselfish (Stegastes partitus) inhabiting coral reefs in the Florida Keys. Marine Biology 110: 353–357. Lavie, B., Nevo, E. 1982. Heavy metal selection of phosphoglucose isomerase allozymes in marine gastropods. Marine Biology 71: 17–22. Lavie, B., Nevo, E. 1986. The interactive effects of cadmium and mercury pollution on allozyme polymorphisms in the marine gastropods Cerithium scabridum. Marine Pollution Bulletin 17: 21–23. Law, R., Grey, D.R. 1989. Evoluation of yields from populations with age-specific cropping. Evolutionary Ecology 3: 343–359. Leary, R.F.F., Allendorf, F.W., Knudsen, K.L. 1985. Developmental instability as an indicator of reduced genetic variation in hatchery trout. Transactions of the American Fisheries Society 114: 230– 235. Ledberg, P.L. 1990. Influence of genetic variability on population growth: implications for conservation. Journal of Fish Biology 37 (Supplement A): 193–195. Leslie, R.W., Grant, W.S. 1991. Redescription of the Southern African anglerfish Lophius vomerinus Valenciennes, 1837 (Lophiiformes: Lophiidae). Copeia 1991(3): 787–800. Levy, J.A., Haimovici, M., Conceicao, M. 1988. Genetic evidence for two species to the genus Eledone (Cephalopoda: Octopidae) in South Brazil. Comparative Biochemistry and Physiology 90B: 275–277. Lewontin, R.C. 1974. The genetic basis of evolutionary change. Columbia University Press, New York. Loftus K.H. 1976. Science for Canada's fisheries rehabilitation needs. Journal Fisheries Research Board of Canada 33: 1822–1857. Maan, K.H. 1993. Physical oceanography, food chains, and fish stocks: a review. ICES Journal of Marine Science 50: 105–119. Maan, R.H.K., Mills, C.A. 1979. Demographic aspects of fish fecundity. Symposium Zoological Society of London 44: 161–177. McAllister, M.K., Peterman, R.A. 1992. Decision analysis of a large scale fishing experiment designed to test for a genetic effect of size-selective fishing on British Columbia pink salmon (Oncorhynchus gorbuscha). Canadian Journal of Fisheries and Aquatic Sciences 49: 1305–1314. McAllister, M.K., Peterman, R.A., Gillis, D.M. 1992. Statistical evaluation of a large scale fishing experiment designed to test for a genetic effect of size-selective fishing on British Columbia pink salmon (Oncorhynchus gorbuscha). Canadian Journal of Fisheries and Aquatic Sciences 49: 1294– 1304. MacDonald, C.M. 1988. Genetic variation, breeding structure and taxonomic status of the gummy shark Mustelus antarcticus in southern Australian waters. Australian Journal of Marine and Freshwater Research 39: 641–648. MacDonald, J.H., Sienballer, J.F. 1989. Similar geographic variation at the Lap locus in the mussels Mytilus trossulus and M. edulis. Evoluation 43: 228–231. Mackie, L.A., Ansell, A.D. 1993. Differences in reproductive ecology in natural and transplanted populations of Pecten maximus: evidence for the existence of separate stocks. Journal of Experimental Marine Biology and Ecology 169: 57–75. Manire, C.A., Gruber, S.H. 1990. Many sharks may be headed toward extinction. Conservation Biology 4: 10–11. Masuda, Y., Takeoka, S., Tabeta, O., Dotsu, Y. 1987. Genetic differences between two newly described shellfishes of the genus Lagocephalus from southern Kyushu, Japan. Nippon Suisan Gakkaishi 53: 767–772. Mathesion, O.A. 1989. Adaptation of the anchovetta (Engraulis ringens) to the Peruvian upwelling system. In Pauly, D., Muck, P., Mendo, J., Tsukayama, I. (eds). The Peruvian Upwelling ecosystem: dynamics and interactions. pp 220–234. ICLARM Conference Proceedings 18. 438 p. McNeeley, J.A. 1988. Economics and biological diversity. International Union for Conservation of Nature and Natural Resources, Gland, Switzerland, 236p. Marnell, L.F. 1986. Impacts of hatchery stocks on wild fish populations. In Stroud R.H. (ed.) Proceedings of the Symposium on the role of fish culture in fisheries management American Fisheries Society, Bethesdaf, pp 339–347. Meffe, G.K. 1987. Conserving fish genomes: philosophies and practices. Environmental Biology of Fishes 18: 3–9. Menezes, M.R. 1994. Little genetic variation in the oil sardine, Sardinella longiceps Val., from the western coast of India. Australian Journal of Marine and Freshwater Research 45: 257–264. Menshutkin, V.V., Kitain, V. Ya., Tseytlin, V.B. 1989. Eco-genetic simulation model of a commercially exploited Far East salmon population. Voprosy Ikhtiology 3: 399–405. Messieh, S.N. 1972. Use of otoliths in identifying herring stocks in the southern Gulf of St Lawrence and adjacent waters. Journal of Fisheries Research Board of Canada. 29: 1113–1118. Micklin, P.P. 1988. Desiccation of the Aral Sea: a water management disaster in the Soviet Union. Science 241: 1170–1175. Miller, R.B. 1957. Have the genetic patterns of fishes been altered by introductions or by selective fishing? Journal of the Fisheries Research Board of Canada 14: 797–806. Miller, R.R., Williams, J.D., Williams, J.E. 1989. Extinctions of North American fishes during the past century. Fisheries (Bethesda) 14: 22–38. Minckley, W.L., Deacon, J.E. 1991. Battle against extinction. University of Arizona Press, 517p. Mitton, J.B., Koehn, R.K. 1975. Genetic organisation and adaptive response of allozymes to ecological variables in Fundulus heteroclitus Genetics 79: 97–111. Mitton, J.B., Grant, M.C. 1984. Associations among protein heterozygosity, growth rate, and developmental homeostasis. Annual Review in Ecology and Systematics 15: 479–499. Mitton, J.B., Lewis, W.M. 1989. Relationships between genetic variability and life-history features of bony fishes. Evolution 43: 1712–1723. Mitton, J.B., Berg, C.J., Orr, K.S. 1989. Population structure, larval dispersal, and gene flow in the queen conch, Strombus gigas, of the Caribbean. Biological Bulletin 177: 356–362. Moyle, P.B., Leidy, R.A. 1992. Loss of biodiveristy in aquatic ecosystems: evidence from fish faunas. In Fielder, P.L., Jain, S.K. (eds). Conservation biology. Chapman and Hall, New York, pp 127–169. Mulley, J.C., Latter, B.D.H. 1980. Genetic variation and evolutionary relationships within a group of thirteen species of Penaeid prawns. Evolution 34: 904–916. Mulley, J.C., Latter, B.D.H. 1981a. Geographic differentiation of eastern Australian penaeid prawn populations. Australian Journal of Marine and Freshwater Research 32: 889–895. Mulley, J.C., Latter, B.D.H. 1981b. Geographic differentiation of tropical Australian penaeid prawn populations. Australian Journal of Marine and Freshwater Research 32: 897–906. Munro, P. 1993. Genetic aspects of conservation and cultivation of giant clams. ICLARM Conference proceedings 39: 47p. Nelson, K., Hedgecock, D. 1980. Enzyme polymorphism and adaptive strategy in the decapod Crustacea. American Naturalist 116: 238–280. Nelson, K., Soule, M. 1987. Genetical conservation of exploited fishes. In Ryman, N. and Utter, F. (eds). Population genetics and fishery management. Washington Sea Grant Program, Seattle, pp 345–368. Nevo, E. 1978. Genetic variation in natural populations: patterns and theory. Theoretical Population Biology 13: 121–177. Nevo, E. 1983. Adaptive significance of protein variation. In Protein polymorphism: adaptive and taxonomic significance (ed.) Oxford, G.S. and Rollinson, D. Academic Press London, pp 240–282. Nevo, E., Lavie, B., Noy, R. 1987. Mercury selection of allozymes in marine gastropods: prediction and verification in nature revisited. Environmental Monitoring and Assessment 9: 233–238. Nevo, E., Lavie, B. 1989 Differential viability of allelic isozymes in the marine gastropod Cerithium scabridium exposed to the environmental stress of nonionic detergent and crude oil-surfactant mixtures. Genetica 78: 205–213. Nevo, E., Ben-Shlomo, R., Lavie, B. 1984. Mercury selection of allozymes in marine organisms: prediction and verification in nature. Proceedings of the National Academy of Science USA 81: 1258– 1259. Nevo, E., Shimony, T., Libini, M. 1978. Pollution selection of allozyme polymorphisms in barnacles. Experientia 34: 1562–1564. Nevo, E., Perl, T., Beiles, A., Wool, D. 1981. Mercury selection of allozyme genotypes in shrimps. Experientia 37: 1152–1154. Nevo, E., Noy, R., Lavie, B., Beiles, A., Muchtar, S. 1986. Genetic diversity and resistance to marine pollution. Biological Journal of the Linean Society 29: 139–144. Norse, E.A. 1990. Ancient forests of the Pacific Northwest. Island Press, Washington, DC, 327p. Norse, E.A. and six co-authors 1986. Conserving biological diversity in our national forests. The Wilderness Society, Washington, DC, 116p. Noss, R.F. 1983. A regional landscape approach to maintain diversity. BioScience 33: 700–706. Nyman, L. 1991. Conservation of freshwater fish. Fisheries Development Series 56, 38p. O'Brien, S.J., Wildt, D.E., Goldman. D., Merril, C.R., Bush, M. 1983. The cheetah is depauperate in genetic variation. Science 221: 459–462. OTA (Office of Technology Assessment). 1987. Technologies to maintain biological diversity. US Printing Office, Washington, DC, 334p. Ovenden, J.R. 1990. Mitochondrial DNA and marine stock assessment: a review. Australian Journal of Marine and Freshwater Research 41: 835–853. Parrish, B.B., Saville, A. 1965. The biology of the north-east Atlantic herring populations. Oceanography & Marine Biology Annual Review 3: 323–373. PDT (Plan Development Team). 1990. The potential of marine fishery reserves for reef fish management in the US Southern Atlantic. NOAA Technical memorandum NMFS-SEFC-261 40p. Pemberton, J.M., Smith, R.H. 1985. Lack of biochemical; polymorphism in British fallow deer. Heredity 55: 199–207. Pitt, T.K. 1975. Changes in abundance and certain biological characteristics of Grand Bank American plaice, Hippolossoides platessoides. Journal of the Fisheries Research Board of Canada 32: 1383– 1398. Policansky, D. 1993. Fishing as a cause of evolution in fishes. In Law, R., Stokes, K. (eds). Evolution of exploited populations. Springer-verlag, London, pp 2–18. Polovina, J.J. 1989. Density dependence in spiny lobster, Panulirus marginatus, in the northwestern Hawaiian Islands. Canadian Journal of Aquatic and Fisheries Science 46: 660–665. Polunin, N.C.V. 1983. Marine genetic resources and the potential role of protected areas in conserving them. Environmental Conservation 10: 31–41. Powers, D.A., de Michele, L., Place, A.R. 1983. The use of kinetics to predict differences in cellular metabolism, development rate, and swimming performance between Ldh-B geneotypes of the fish Fundulus hetreoclitus In Whitt, G., Markert, C. (eds). Isozymes: current topics in biological and medical research. Academic Press, New York, pp 147–170. Prodohl, P.A., Levy, J.A. 1989. Genetic study of Atherinidae fishes of Mangueira lagoon (RS Brazil). Comparative Biochemistry and Physiology 94B: 423–426. Ray, G.C. 1988. Ecological diversity in coastal zones and oceans. In Wilson E.O., Peter F.M (eds). Biodiversity. National Academy Press, Washington, pp 36–50. Redfield, J.A., Hedgecock, D., Nelson, K., Salini, J.P. 1980. Low heterozygosity in tropical marine crustaceans of Australia and the trophic stability hypothesis. Marine Biology Letters 1: 303–313. Reeb, C.A., Avise, J.C. 1990. A genetic continuity in a continuously distributed species: mitochondrial DNA in the American oyster, Crassostrea virginica. Genetics 124: 397–406. Report 1993. Report of the twelfth meeting of Australian, Japanese and New Zealand scientists on southern bluefin tuna. Hobart, Australia, October 1993. Reznick, D.A., Bryga, H., Endler, J.A. 1990. Experimentally induced life history evolution in a natural population. Nature 346: 357–359. Richardson, J.R., Aldridge, A.E., Smith, P.J. 1982. Analyses of tuatua populations - Paphies subtriangulata and P. donacina. New Zealand Journal of Zoology 9: 231–238. Ricker, W.E. 1980. Causes of the decrease in age and size of chinook salmon (Oncorhyncus tshawytscha). Canadian Technical Report of Fisheries and Aquatic Sciences 944. 25 p. Ricker, W.E. 1981. Changes in the average size and age of pacific salmon. Canadian Journal of Fisheries and Aquatic Science 38: 1636–1656. Ricker, W.E. 1982. Size and age of British Columbia sockeye salmon (Oncorhynchus nerka) in relation to environmental factors and the fishery. Canadian technical report of Fisheries and Aquatic Sciences 1115: 1–117. Ricker W.E., Bilton H.T. Aro K.V. 1978. Causes of decrease in size of pink salmon (Oncorhynchus gorbuscha). Fisheries and Marine Service Technical Report 820: 1–93. Rijnsdorp, A.D., Daan, N., van Beek, F.A., Heesen, H.J.L. 1991. Reproductive variability in North Sea plaice, sole and cod. Journal Conseil international pour l'exploration de la mer 47: 352–375. Roff, D.A. 1982. Reproductive strategies in flatfish: a first synthesis. Canadian Journal of Fisheries and Aquatic Sciences 39: 1686–1698. Roff, D.A. 1984. The evolution of life history parameters in teleosts. Canadian Journal of Fisheries and Aquatic Science 41: 989–1000. Rothschild, B.J. 1986. Dynamics of marine fish populations. Harvard University Press, Cambridge, Massachusetts. 277 p. Ryman, N. (ed) 1981. Fish gene pools. Ecological Bulletins (Stockholm) 34, 111p. Ryman, L. 1991. Conservation genetics considerations in fishery management. Journal of Fish Biology 39A: 211–224. Ryman, N. Stahl, G. 1980. Genetic changes in hatchery stocks of brown trout (Salmo trutta). Canadian Journal of Fisheries and Aquatic Sciences 37: 82–87. Sandlund, O.T., Naesje, T.F. 1989. Impact of a pelagic gill-net fishery on the polymorphic whitefish (Coregonus lavaretus L.sl.) population in Lake Femund, Norway. Fisheries Research 7: 85–97. Sarver, S.K., Landrum, M.C., Foltz, D.W. 1992. Genetics and taxonomy of ribbed mussels (Geukensia spp.). Marine Biology 113: 385–390. Saunders, N.C., Kessler, L.G., Avise, J.C. 1986. Genetic variation and geographic differentiation in mitochondrial DNA of the horseshoe crab, Limulus polphemus. Genetics 112: 613–627. Sbordoni, V., de Matthaeis, E., Sbordoni, M.C., Rosa, G.La., Mattoccia, M. 1986. Bottleneck effects and the depression of genetic variability in hatchery stocks of Penaeus japonicus (Crustace, Decaopa). Aquaculture 57: 239–251. Schaffer, W.M., Elson, P.F. 1975. The adaptive significance of variations in life history among local populations of Atlantic salmon in North America. Ecology 56: 577–590. Seeb, L.W., Seeb, J.E., Polovina, J.J. 1990. Genetic variation in highly exploited spiny lobster Panulirus marginatus populations from the Hawaiian Archipelago. Fishery Bulletin 88: 713–718. Selander, R.K., Yang, S.Y., Lewontin, R.C., Johnson, W.E. 1970. Genetic variation in the horseshoe crab (Limulus polyphemus), a phylogenetic “relic”. Evolution 24: 402–414. Shaklee, J.B., Tamaru, C.S. 1981. Biochemical and morphological evolution of Hawaiian bonefishes (Albula). Systematic Zoology 30: 125–146. Shaklee, J.B., Tamaru, C.S., Waples, R.S. 1982. Speciation and evolution of marine fishes studied by the electrophoretic analysis of protiens. Pacific Science 36: 141–157. Shelton, P.A., Armstrong, M.J. 1983. Variations in parent stock and recruitment of pilchard and anchovy population in the southern Benguela system. FAO Fisheries Report 291: 1113–1126. Silliman, R.P. 1975. Selective and unselective exploitation of experimental populations of Tilapia mossambica. Fishery Bulletin 73: 495–507. Simonsen, V. 1982. Electrophoretic variation in large mammals II. The red fox, Vulpes vulpes, the stoat, Mustela erminea, the weasel, Mustela nivalis, the pole cat, Mustela putorinus, the pine marten, Martes martes, the beech martin, Martes foina, and the badger, Meles meles. Hereditas 96: 299–305. Singh, S.M., Green, R.H. 1984. Excess of allozyme homozygosity in marine molluscs and its possible biological significance. Malacologia 25: 569–581. Sissenwine, M.P., Cohen, E.B. 1993. Resource productivity and fisheries management of the northeast shelf ecosystem. In Sherman, K., Alexander, L.M., Gold, B.D. (eds.) Food chains, yields,, models, and management of large marine ecosystems. Westview Press, pp 105–121. Skaala, O., Dahle, G., Jorstad, K.E., Naevdal, G. 1990. Interactions between natural and farmed fish populations: information from genetic markers. Journal of Fish Biology 36: 449–460. Slatkin, M. 1985. Gene flow in natural populations. Annual Review of Ecology and Systematics 16: 393–430. Smith, P.J. 1986. Genetic similarity between samples of the orange roughy Hoplostethus atlanticus from the Tasman Sea, South-west Pacific Ocean and North-east Atlantic Ocean. Marine Biology 91: 173–180. Smith,P.J. 1986. Low genetic variation in sharks. Copeia 1986 (1): 202–207. Smith, P.J., Francis, R.I.C.C., McVeagh, M. 1991. Loss of genetic diversity due to fishing pressure. Fisheries Research 10: 309–310. Smith, P.J., Fujio, Y. 1982. Genetic variation in marine teleosts: high variability in habitat specialists and low variability in habitat generalists. Marine Biology 69: 7–20. Smith, P.J., Jamieson, A., Birley, A.J. 1990. Electrophoretic studies and the stock concept in marine teleosts. Journal Cons int. Exploration Mer. 47: 231–245. Smith, P.J., McKoy, J.L., Machin, P.J. 1980. Genetic variation in the rock lobsters jasus edwardsii and Jasus novaehollandiae. New Zealand Journal of Marine and Freshwater Research 13: 549–551. Smith, P.J., Roberts, P.E., Hurst, R.J. 1981. Evidence for two species of arrow squid in the New Zealand fishery. New Zealand Journal of Marine and Freshwater Research. 15: 247–253. Smith, P.J., and Robertson D.A. 1981. Genetic evidence for two species of sprat (Sprattus) in New Zealand waters. Marine Biology 62: 227–233. Smith, P.J. Conroy, A.M. 1992. Loss of genetic variation in hatchery produced abalone, Haliotis iris. New Zealand Journal of Marine and Freshwater Research 26: 81–85. Smolenski, A.J., Ovenden, J.R., White, R.W.G. 1993. Evidence of stock separation in southern hemisphere (Hoplostethus atlanticus, Trachichyidae) from restriction-enzyme analysis of mitochondrial DNA. Marine Biology 116: 219–230. Soule, M.E., Wilcox, B.A. 1980. Conservation biology: an evolutionary-ecological perspective. Sinauer Associates, Sunderland, Mass. Soule, M.E. 1986. Conservation biology: the science of scarcity and diversity. Sinauer Associates, Sunderland, Mass. Soule, M.E. 1987. Viable populations for conservation. Cambridge University Press, Cambridge. Soutar, A., Isaacs, J.D. 1969. History of fish populations inferred from fish scales in anaerobic sediments off California. California Cooperative Oceanic Fisheries Investigation Report. 15: 49–51. Southward, A.J. 1963. The distribution of some plankton animals in the English Channel and approaches. Journal of the Marine Biological Association of the UK, 43: 1–29. Spangler, G.R., Payne, N.R., Thorpe, J.E., Byrne, J.M., Reiger, H.A., Christie, W.J. 1977. Responses of percids to exploitation. Journal of Fisheries Research Board of Canada. 34: 1983–1988. Stahl, G. 1983. Difference in the amount and distribution of genetic variation between natural populations and hatchery stocks of Atlantic salmon. Aquaculture 33: 23–32. Stephenson, R.L., Kornfield I. 1990. Reappearance of spawning Atlantic herring (Clupea harengus harengus) on Georges Bank: population resurgence not recolonization. Canadian Journal of Fisheries and Aquatic Science 47: 1060–1064. Sugama, K., Taniguchi, N., Umeda, S. 1988. An experimental study on genetic drift in hatchery population of red sea bream. Nippon Suisan Gakkaishi 54: 739–744. Taniguchi, N., Sumantadinata, K., Iyama, S. 1983. Genetic changes in the first and second generations of hatchery stocks of black sea bream. Aquaculture 35: 309–320. Templeman, W. 1987. Differences in sexual maturity and related characteristics between populations of thorny skate (Raja radiata) in the northwest Atlantic. Journal of Northwest Atlantic Fisheries Society 7: 155–167. Templeman, W., Bishop, C.A. 1979a. Age, growth, year class, strength, and mortality of the haddock Melanogrammus aeglefinus of St Pierre Bank and their relation to the haddock fishery of this area. ICNAF Research Bulletin 14: 85–99. Templeman, W., Bishop, C.A. 1979b. Sexual maturity and spawning in haddock Melanogrammus aeglefinus of St Pierre Bank. ICNAF Research Bulletin 14: 77–83. Thomas, G.L. Mathisen O.A. 1993. Biological interactions of natural and enhanced stocks of salmon. Fisheries Research 18: 1–76. Thompson, W.F. 1951. An outline for salmon research in Alaska. Fisheries Research Institute, University of Washington, Circular 18, 49p. Tikhonov, V.I. 1977. Changes in fecundity and maturation of the yellowfin sole. Biol. Moriya3: 64–69. Upton, H.F. 1992. Biodiversity and conservation of the marine environment. Fisheries (Bethesda) 17: 20–25. de Veen, J.F. 1976. On changes in some biological parameters in the North Sea sole (Solea solea L.) Journal Conseil international pour l'exploration de la mer 37: 60–90. Verspoor, E. 1988. Reduced genetic variability in first generation hatchery populations of Atlantic salmon (Salmo salar). Canadian Journal of Fisheries and Aquatic Sciences 45: 1686–1690. Vuorinen, J. 1984. Reduction of genetic variability in a hatchery stock of brown trout, Salmo trutta. Journal of Fish Biology 24: 339–348. Waples, R.S. 1981. A biochemical and morphological review of the lizardfish genus Saurida in Hawaii, with a description of a new species. Pacific Science 35: 217–235. Waples, R.S. 1987. A multispecies approach to the analysis of gene flow in marine shore fishes. Evolution 41: 385–400. Waples, R.S. 1990. Conservation genetics of Pacific salmon III. Estimating effective population size. Journal of Heredity 81: 277–289. Waples, R.S. 1991. Heterozygosity and life-history variation in bony fishes: an alternative view. Evolution 45: 1275–1280. Waples, R.S., Teel, D.J. 1990. Conservation genetics of Pacific salmon. I. Temporal changes in allele frequency. Conservation Biology 4: 145–156. Waples, R.S., Winans, G.A., Utter, F.M., Mahnken, C. 1990. Genetic approaches to the management of Pacific salmon. Fisheries 15: 19–25. Ward, R.D., Skibinski, D.O.F., Woodwark, M. 1991. Protein heterozygosity, protein structure and taxonomic differentiation. In Hecht M.K., Wallace B., MacIntyre R.J. (eds). Evolutionary Biology. Plenum Press, London, pp 73–159. Watts, R.J., Johnson, M.S., Black, R. 1990. Effects of recruitment on genetic patchiness in the urchin Echinometra mathaei in Western Australia. Marine Biology 105: 145–151. White, G.F. 1988. The environmental effects of the high dam at Aswan. Environment 30: 5–40. Wilkins, N.P., Gosling, E.M. 1983. Genetics in aquaculture. Aquaculture 33: 1–426. Williams, S.T., Benzie, J.A.H. 1993. Genetic consequences of long larval life in the starfish Linckia laevigata (Echinodermata: Asteroidea) on the Great Barrier Reef. Marine Biology 117: 71–77. Williams, G.C., Koehn, R.K, Mitton, J.B. 1973. Genetic differentiation without isolation in the American eel, Anguilla rostrata. Evolution 27: 192–204. Winans, G.A. 1989. Genetic variability in chinook salmon stocks from the Columbia River basin. North American Journal of Fisheries Management 9: 47–52. Wootton, R.J. 1990. Ecology of teleost fishes. Chapman and Hall, London, 404 p. Wright, S. 1969. Evolution and the genetics of populations. Vol 2. The theory of gene frequencies. University of Chicago Press, Chicago. Yamaoka, K., Masaru, N., Tanaguchi, N., 1989. Genetic divergence in lizardfishes of the genus Saurida from Southern Japan. Japanese Journal of Ichthyology 36(2): 208–219. Zouros, E., Foltz, D.W. 1984. Possible explanations of heterozygote deficiency in bivalve molluscs. Malacologia 25: 583–591. Zouros, E., Romero-Dorey, M. 1988. Heterozygosity and growth in marine bivalves. Further data and possible explanations. Evolution 42: 1332–1341. 1 The references are presented as submitted by the author