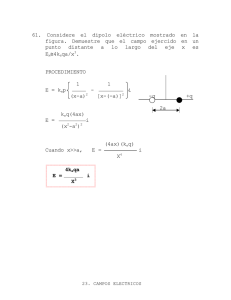
Serie de problemas Disoluciones Reales y Equilibrio Químico Profr
Anuncio

Serie de problemas Disoluciones Reales y Equilibrio Químico Profr. Eduardo Rodríguez de San Miguel Guerrero / Juan Manuel Vargas Alcaraz Semestre 2014-II 1. Calcular y comparar los valores de la actividad de los iones en las disoluciones siguientes al considerarlas con comportamiento ideal y real: a) FeSO4 0.05M b) FeSO4 0.001M c) Al(NO3)3 0.002M d) Co2(SO4)3 0.002M Asuma que la ley extendida de Debye-Hückel da cuenta por la variación de los coeficientes de actividad de los iones en el intervalo de fuerza iónica considerado según la ecuación: 2. Se tiene la siguiente reacción cuya constante de equilibrio vale 5x10 6: A(ac) + B(ac) 2C(ac) ¿Cuáles son las concentraciones al equilibrio de cada especie si en 1 L se mezclan 0.4mol de A y 0.7mol de B? 3. La reacción de producción de amoníaco se puede escribir: N2(g) + 3H2(g) 2NH3(g) 1/2 N2(g) + 3/2 H2(g) NH3(g) 1/3 N2(g) + H2(g) 2/3NH3(g) Escribir la constante de equilibrio para cada reacción y señalar la relación matemática entre cada una de ellas. 4. Escribe la expresión de la constante de equilibrio para cada una de las siguientes reacciones: 3Ag+(ac) + PO43-(ac) Ag3PO4(s) C6H6(l) + 15/2 O2(g) 3H2O(l) + 6CO2(g) 5. La energía libre de Gibbs estándar de la siguiente reacción es -32.9 KJmol-1 a 298K: N2(g) + 3H2(g) 2NH3(g) Escriba la expresión de Keq y determine su valor. ¿Cuáles son los valores de ΔG de la reacción cuando Q = 0.010 atm-2, Q = 0.1atm-2, Q = 10atm-2, Q = 1x105atm-2, Q = 1x106atm-2?. ¿Hacia qué dirección se encuentra desplazado el equilibrio para cada valor de Q? 6. Un análisis indica que en un recipiente de 12 L hay 2.5 mol de H2, 1.35x10-5 mol de S2 y 8.70 mol de H2S, para el siguiente proceso a 700°C en estado de equilibrio: 2H2(g) + S2(g) 2H2S(g) Escriba la expresión de la constante de equilibrio de la reacción y determine su valor, asumiendo idealidad de la mezcla de gases. 7. El equilibrio de disociación del ácido cianhídrico queda descrito por: HCN(ac) H+(ac) + CN-(ac) La constante de equilibrio asociada, denominada constante de disociación, es 7.2x10-10. Con base en este valor, ¿considera que la reacción de disociación es cuantitativa? Calcule el porcentaje de disociación de una disolución 1x10-3 M de dicho ácido. 8. A partir de las siguientes ecuaciones: HOCl HOCl + -OBr H+ + -OCl HOBr + -OCl Calcula el valor numérico para la reacción HOBr-(ac) (considerar que todas las especies están en disolución acuosa). Keq= 3.0 x 10-8 Keq=15 H+(ac) + OBr-(ac) 9. Comparar los valores calculados de las concentraciones de equilibrio de las especies resultantes de la disociación del ión dihidrogenofosfato en condiciones ideales y reales si la constante de acidez a I = 0 tiene un valor de Ka = 10-7 H2PO4- H+ + HPO42- La concentración analítica es de 0.1M. Asuma que la ley extendida de DebyeHückel da cuenta por la variación de los coeficientes de actividad de los iones en el valor de fuerza iónica considerado.