Tabla periódica: organización
Anuncio
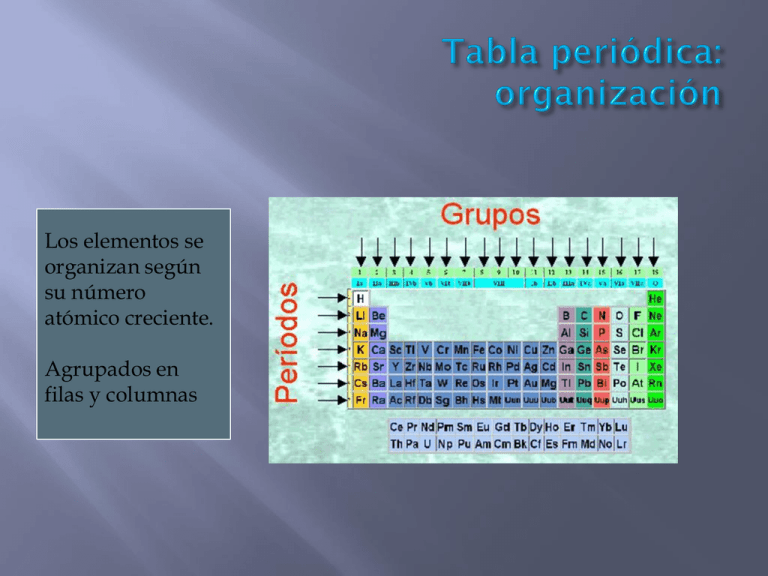
Los elementos se organizan según su número atómico creciente. Agrupados en filas y columnas Formada por siete periodos, filas horizontales las cuales se designan con números del 1 al 7 y cada periodo tiene un número determinado de elementos. Los elementos se agrupan en 18 columnas verticales que se llaman grupos, se designan con números romanos y se dividen en grupos A y B. Existen ocho grupos A y diez B. Los elementos de un mismo grupo tienen propiedades físicas y químicas similares y se llaman familias, por ejemplo: los metales alcalinos, los lantánidos, los halógenos y los gases nobles. GRUPOS 1 2 IA IIA 3 4 5 6 7 8 9 10 11 12 13 PERIODOS 2 4 5 6 7 16 17 18 IIIA IVA VA VIA VIIA VIIIA 1 3 14 15 IIIB IVB VB VIB VIIB VIIIB IB IIB Grupos de elementos que comparten algunas características GASES INERTES No METALES H METALES Elementos representativos y de transición IA 1 2 3 4 5 6 7 IIA (Grupos A) No metales representativos (Grupos A) Metales representativos IIIB IVB VB VIB VIIB VIIIB (Grupos B) Metales de transición IB IIB (Grupo A) Gases inertes IIIA IVA VA VIA VIIA VIIIA El número del período (fila horizontal) coincide con el número de niveles electrónicos. En los grupos representativos (A), el número de cada grupo coincide con el de electrones presentes en su último nivel, presentan incompleto este último nivel. En los grupos de transición (B), presentan los dos últimos niveles de energía incompletos. Casi todos los elementos tienen 2 electrones en su último nivel; mientras que en su penúltimo nivel tienen distintas cantidades de electrones. Los gases inertes, grupo VIII A, presentan último nivel completo (con 2 u 8 electrones). Elemento químico: es una sustancia que no se puede descomponer en otras, ni se puede elaborar a partir de otras más sencillas, por métodos químicos. Hay solo 110 tipos de elementos diferentes. Cada elemento químico se representa mediante un símbolo, que en muchos casos, es una letra mayúscula C H O K carbono hidrógeno oxígeno potasio En otros casos, cuando hay más de dos elementos con la misma inicial, se coloca a continuación de la primera letra, una segunda letra minúscula, C Cl Ca Co Carbono cloro calcio cobalto La combinación de átomos de los diferentes elementos da origen a una enorme variedad compuestos químicos (Ej: agua, dióxido de carbono, amoníaco, oxígeno). Los átomos que se unen pueden ser del mismo elemento (Ej: en la molécula del oxígeno) o de distintos elementos (Ej: en la molécula de agua). Los compuestos químicos se representan con una fórmula química. Para escribirla hay que tener en cuenta que elementos los constituyen y en que número se encuentran. En una fórmula química aparecen varios elementos: Las letras son los símbolos de los elementos que intervienen en el compuesto. Los subíndices junto a los símbolos de los elementos indican el número de átomos de cada elemento que intervienen en el compuesto. N2 CaCl2 O2 HNO 3 Cl2 H2O Cl2 O3 N H3 nitrógeno cloruro de calcio oxígeno ácido nitrico cloro agua trióxido de cloro amoníaco Sustancias simples: son aquellas están formadas por átomos iguales; cada átomo de una sustancia simple se llama elemento. Las sustancias simples no pueden descomponerse en otras. Ej: N2 nitrógeno , O2 oxígeno , Cl2 cloro Sustancias compuestas: son aquellas cuyas moléculas están formadas por átomos diferentes; también se les llama compuestos. Pueden descomponerse químicamente en otras sustancias. Ej: CO2 dióxido de carbono, SO2 dióxido de azufre, NH3 amoníaco








