Guía de Taller Nº 2
Anuncio

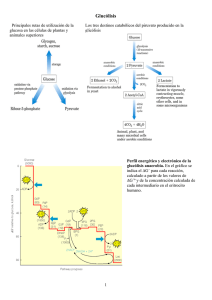
Universidad Nacional del Nordeste Facultad de Medicina Cátedra de Bioquímica PRIMER AÑO DE LA CARRERA DE MEDICINA ACTIVIDADES DE BIOQUIMICA Dra. Brandan N., Dra. Aguirre M.V. MODULO 3.- METABOLISMO GLUCIDICO: PRINCIPALES RUTAS METABÓLICAS Y SU CONTROL Temas 3 y 4 GUIA DE TALLER Nº 2 3.1. Glucólisis. Regulación. 3.2. Ruta pentosas fosfato. 3.3. Glucogenogénesis. 3.4. Glucogenolisis. 3.5. Gluconeogénesis. 3.6. Glicoproteínas. DIAGRAMA CONCEPTUAL DE CONTENIDOS GLUCOLISIS: • Introducción: importancia. Localización celular. Reacciones y productos en condiciones aeróbicas y anaeróbicas. • Metabolización diferencial de glucosa en los diferentes tejidos. Regulación. VIA DE LA HEXOSA MONOFOSFATO: • Introducción: importancia, condiciones en que se realiza, requerimientos. • Relación con la glucólisis. • Regulación. GLUCOGENOGENESIS y GLUCOGENOLISIS: • Importancia. Condiciones en que se realiza, requerimientos. • Principales órganos de almacenamiento de glucógeno • Regulación. GLUCONEOGENESIS: • Importancia. Condiciones en que se realiza. • Regulación. • Fuentes (sustratos, ciclo de Cori y ciclo de la alanina). GLUCOPROTEINAS: • Concepto. Importancia biomédica. • Distribución y funciones (con especial mención en las funciones de los oligosacaridos). Interrogantes y situaciones a plantearse durante la lectura del módulo 1.-Nombre los tejidos energéticamente dependientes de glucosa. 2.-¿Cómo es transportada la glucosa al interior de la célula? ¿Sufre este transporte algún tipo de regulación?. 3.-¿Cuál es la importancia de la fosforilación de la glucosa en el interior de la célula? Cátedra de Bioquímica 1 Guía de Taller Nº 2 4.-Señale la importancia biológica de la existencia de dos isoenzimas diferentes para fosforilar la glucosa en hígado y en músculo. (Hágalo teniendo en cuenta semejanzas y diferencias entre ellas así como su regulación). 5.-Esquematizar las etapas de la glucólisis, indicando: -Las enzimas participantes, sus coenzimas o cofactores cuando correspondiere. -Las reacciones irreversibles y los pasos susceptibles de regulación. 6.-¿Qué importancia tiene para esta vía la 6 Fosfofructo 1 quinasa?. 7.-Describa brevemente la cascada de regulación covalente mediante la que esta enzima puede modificarse según los niveles de AMPc intracelular. 8.-Completar el siguiente cuadro: ENZIMA Modulador Alostérico (+) Modulador Alostérico (-) Regulación Hormonal Hexoquinasa / Glucoquinasa 6 Fosfofructo 1 Quinasa Piruvato Quinasa 9.-Enumere los productos de la glucólisis indicando en cada caso su destino metabólico. 10.-¿En qué se diferencian la glucólisis aerobia y la glucólisis anaerobia?. 11.-Teniendo en cuenta los diversos tejidos, ¿en qué casos se produce la glucólisis anaerobia? 12.-Cite los tejidos en que se encuentra expresada y activa la vía de las pentosas fosfato (vía del fosfogluconato o de las hexosas monofosfato). Indique en cada caso las funciones que cumple esta ruta metabólica en esos tejidos. 13.- ¿Cuál es el paso clave de la vía de las pentosas? Describa brevemente cómo este paso es regulado. 14.- ¿Qué entiende por glucogenogénesis? ¿En qué tejidos se encuentra activa esta vía? 15.- Esquematizar las etapas de la glucogenogénesis, indicando: -Las enzimas participantes, sus coenzimas o cofactores si correspondiere. -Las reacciones irreversibles y los pasos susceptibles de regulación. 16.- ¿Cuál es el papel de la glucogenina en esta ruta anabólica? 17.- ¿Qué entiende por glucogenolisis? ¿En qué tejidos se encuentra activa esta vía? 18.- Esquematizar las etapas de la glucogenolisis, indicando: -Las enzimas participantes, sus coenzimas o cofactores si correspondiere. -Las reacciones irreversibles y los pasos susceptibles de regulación. 19.- Establecer semejanzas y diferencias entre la glucogenólisis hepática y muscular. Teniendo esta comparación en cuenta, ¿qué importancia tiene para el organismo la activación de la vía en uno y otro tejido? 20.- Describir el papel de ATP y AMP sobre el metabolismo del glucógeno. 21.- ¿Qué importancia tienen los niveles de glucosa intracelular sobre el metabolismo del glucógeno? 22.- Describir el papel del AMPc en la regulación covalente del metabolismo del glucógeno. 23.-Citar las hormonas que, a través de modificaciones en los niveles de AMPc modifican el metabolismo del glucógeno? ¿Qué importancia tiene cada una como activador de la glucogenolisis? 23.- ¿Tiene la insulina algún rol en la regulación del metabolismo del glucógeno? 24.- ¿Qué se entiende por gluconeogénesis y en qué tejidos se produce? 25.- Esquematizar las etapas de la gluconeogénesis, indicando: -Las enzimas participantes, sus coenzimas o cofactores si correspondiere. -Las reacciones irreversibles y los pasos susceptibles de regulación. 26.- Describa brevemente la importancia qué tienen para esta vía la actividad de la Piruvato Carboxilasa y la LDH. 27.- Explique por qué los lípidos no pueden ser fuente de esqueletos carbonados para la gluconeogénesis. Cátedra de Bioquímica 2 Guía de Taller Nº 2 28.- .Completar el siguiente cuadro: ENZIMA Modulador Alostérico (+) Modulador Alostérico (-) Regulación Hormonal Piruvato Carboxilasa Fosfoenolpiruvato carboxiquinasa Fructosa 1,6 bisfosfatasa Glucosa 6 fosfatasa 29.- ¿A qué se denomina “Compuesto de encrucijada metabólica”? ¿Puede incluir entre ellos a la Glu 6 Fosfato? Justifique su respuesta. 30.- ¿A qué se denomina Ciclo de la Alanina? 31.- ¿A qué se denomina Ciclo de Cori? 32.- Investigue cuáles son las funciones biológicas de los siguientes compuestos glucídicos: Glucolípidos, Dolicol Fosfato, Pentosas fosfato, Sorbitol, Condroitin y heparan sulfato, Glucuronato Hialuronato , Heparina. 33.- Enumere las funciones biológicas de las glucoproteínas. APLICACION CLINICA 1: Anemia hemolítica por déficit de piruvato quinasa Bioquímica. Thomas. M. Devlin. Editorial Reverté. 3º Edición. 2000. La producción de ATP en los eritrocitos maduros depende absolutamente de la actividad glucolítica. El ATP es necesario para las bombas iónicas, en especial la Na+, K+ - ATPasa, que mantienen la forma de disco bicóncavo de los eritrocitos, una característica que les ayuda a deslizarse a través de los capilares cuando llevan el oxigeno a los tejidos. Sin ATP, las células se hinchan y se rompen. El déficit de piruvato quinasa es raro, pero es con mucho el déficit genético más común de la vía glucolítica causante de anemia hemolítica. La mayor parte de los pacientes con déficit de piruvato quinasa tienen entre un 5% y un 25% de los niveles de piruvato quinasa de los eritrocitos normales, y el flujo a través de la vía glucolítica esta severamente restringido, lo que se traduce en niveles de ATP marcadamente inferiores. En los reticulocitos de pacientes con esta enfermedad se observan niveles normales de ATP. Aunque estos hematíes inmaduros son deficitarios en piruvato quinasa, contienen mitocondrias, y pueden generar ATP por fosforilación oxidativa. Como la glucólisis es defectuosa, las células maduras se pierden rápidamente de la circulación. La anemia aparece porque las células no pueden ser reemplazadas de forma suficientemente rápida por la eritropoyesis. Cuestionario de la aplicación clínica: 1)- ¿Por qué la deficiencia de la piruvato quinasa lleva a hinchazón celular y posterior lisis del hematíe? 2)- ¿Por qué los reticulocitos tienen niveles normales de ATP a diferencia de los hematíes maduros? APLICACION CLINICA 2: Glucosa – 6 fosfato deshidrogenasa: deficiencia genética Bioquímica. Thomas. M. Devlin. Editorial Reverté. 3º Edición. 2000. La susceptibilidad a la enfermedad hemolítica inducida por fármacos puede deberse a un déficit de la actividad G6P deshidrogenasa de los eritrocitos y fue uno de los primeros indicios de que existen deficiencias genéticas de esta enzima ligada al sexo. Esta enzima, que cataliza la oxidación de G6P a 6-fosfogluconato y la reducción de NADP+, es muy importante ya que la vía de las pentosas fosfato es la principal ruta para la producción de NADPH en el hematíe. Si se incrementa la tasa de oxidación del NADPH, las células deficitarias del enzima no son capaces de responder. Estas células carecen de suficiente NADPH para mantener el glutation en su estado reducido. El glutation reducido es necesario para la integridad de la membrana eritrocitaria. Los hematíes jóvenes pueden tener una actividad enzimática significativamente mayor que las células más viejas, debida a que poseen una variedad inestable del enzima. Después de un episodio de hemólisis, los hematíes jóvenes predominan y puede no ser posible diagnosticar esta deficiencia genética hasta que la población de hematíes envejece. Cátedra de Bioquímica 3 Guía de Taller Nº 2 Esta deficiencia enzimática no es normalmente detectada hasta 48 a 96hs después de la administración de ciertos fármacos (que actúan como oxidantes). Existen más de 300 variantes genéticas conocidas de este enzima, que contiene 516 aminoácidos, que explican una amplia gama de síntomas. Estas variantes pueden ser distinguidas mediante ciertas diferencias clínicas, bioquímicas y moleculares. Cuestionario de la aplicación clínica: 1)- ¿Cuál es la importancia de la G6P-deshidrogenasa en el hematíe? 2)- ¿Por qué hay diferencias entre el hematíe joven y el hematíe maduro con respecto a la susceptibilidad al daño hemolítico? 3)- Describa brevemente papel del Glutatión en la integridad del hematíe y su relación con la G6Pdeshidrogenasa. 4)- A su entender ¿Por qué la crisis hemolítica se manifiesta luego de la exposición a fármacos oxidantes? APLICACIÓN CLÍNICA 3: Diferencias en el control de la glucemia entre el neonato y el adulto El valor normal de glucemia en el adulto es de 70-110mg/dl, mientras que para un neonato a término oscila entre 40-60mg/dl, siendo más bajo aún en el prematuro. El neonato debe ser alimentado cada 3 horas y corre riesgo de sufrir severas hipoglucemias que podrían incluso dañar su SNC de forma irreversible. Este riesgo se incrementa más aún en el prematuro y en el de bajo peso al nacer. Cuestionario de la aplicación clínica: 1.- ¿Cuál es la ventaja de almacenar los glúcidos en forma de glucógeno? 2.- Investigue para esta situación qué diferencias posee el neonato con respecto al adulto en cuanto a reservas de glucógeno y control de la glucemia a través del metabolismo de glúcidos. APLICACION CLINICA 4: Enfermedades de almacenamiento de glucógeno Bioquímica. Thomas. M. Devlin. Editorial Reverté. 3º Edición. 2000. Existen una serie de enfermedades de almacenamiento del glucógeno todas ellas debidas a deficiencias heredadas de uno o más enzimas implicados en la síntesis y degradación del mismo. El hígado suele ser el tejido mas afectado, pero pueden ser defectuosos los metabolismos del corazón y del músculo. Enfermedad de Von Gierke: la enfermedad por almacenamiento más común, conocida como enfermedad tipo I o de Von Gierke, está producida por una deficiencia de la G-6-fosfatasa del hígado, la mucosa intestinal y el riñón. Los pacientes con esta enfermedad se pueden agrupar en aquellos que carecen del enzima G-6-fosfatasa per se (tipo Ia) y los que carecen de G-6-fosfatasa translocasa (tipo Ib). Esta anomalía genética se transmite con carácter autosómico recesivo. Las manifestaciones clínicas comprenden hipoglucemia en ayuno, acidemia láctica, hiperlipidemia, y hiperuricemia con artritis gotosa. Los síntomas de la enfermedad de Von Gierke pueden aliviarse si se administran glúcidos a lo largo del día, a fin de evitar una hipoglucemia. Enfermedad de Pompe: la enfermedad de almacenamiento de glucógeno tipo II o enfermedad de Pompe es producida por la ausencia de alfa-1,4-glucosidasa (o maltasa ácida) enzima que normalmente se encuentra en los lisosomas. La ausencia de este enzima conduce a la acumulación de glucógeno en virtualmente todos los tejidos. Los lisosomas captan gránulos de glucógeno y se vuelven defectuosos respecto a otras funciones cuando carecen de la capacidad necesaria para destruir los gránulos. Las otras rutas sintéticas y degradativas del metabolismo del glucógeno están intactas. No se conoce la razón de la acumulación de glucógeno extralisosomal. Se produce una cardiomegalia masiva que conduce en una edad temprana a la muerte por fallo cardiaco. Cuestionario de la aplicación clínica: 1)- En la enfermedad de Von Gierke, cuál es la deficiencia enzimática encontrada? La misma cursa con hipoglucemia en ayunas y acidemia láctica. Explicar los mecanismos bioquímicos que participan en la producción de estas manifestaciones. 2)- Los anteriores, son dos ejemplos de déficit enzimático en el metabolismo del glucógeno. Investigue otros ejemplos puntualizanndo brevemente en cada caso: cuál es el enzima deficitario, en qué tejidos, cómo se interfiere la vía y cuáles serían las consecuencias. Cátedra de Bioquímica 4 Guía de Taller Nº 2