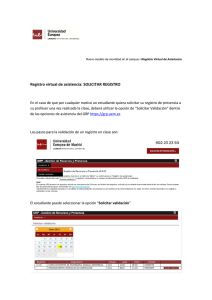
Presentación de PowerPoint
Anuncio

TALLER DE REVISION DE LA NOM-241-SSA1-2011 Comisión de Operación Sanitaria Comisión de Autorización Sanitaria 8 de abril de 2013 1 AGENDA • Proceso de certificación de Buenas Prácticas • Solicitud de Visita de Verificación • Estructura general y aspectos relevantes de la Norma • Receso • Hallazgos recurrentes en visitas de verificación • Contestación a oficios de seguimiento al acta OBJETIVO Conocer los lineamientos y tareas que permitirán la implementación de los requerimientos establecidos en la NOM-241. ¿POR QUE ES IMPORTANTE ESTA NORMA? ¿A QUIENES APLICA? ¿QUE GANAMOS? ¿QUE HAY QUE HACER PARA CUMPLIR? ¿COMO MANTENER EL CUMPLIMIENTO DE LA NORMA? 3 ¿POR QUÉ CUMPLIR? La salud es un factor de suma importancia para el bienestar y desarrollo social de la comunidad. Se han establecido requisitos que se deben cumplir durante el proceso de fabricación de los dispositivos médicos que garanticen su calidad y funcionalidad La Secretaria de Salud a través de la COFEPRIS ejerce el control Sanitario de los establecimientos empleando como marco de referencia la LGS, RIS, las Normas Oficiales 4 Mexicanas, la FEUM y sus suplementos NOM-241-SSA1-2011, Buenas prácticas de fabricación para establecimientos dedicados a la fabricación de dispositivos médicos Proyecto Respuesta Publicado en DOF el 15 de Noviembre de 2011 Respuesta a comentarios en DOF el 20 de Septiembre de 2012 Publicación DOF 11 de Octubre de 2012 Vigencia 9 de Abril de 2013 5 APLICA A TODOS: Los establecimientos dedicados a la fabricación de dispositivos médicos. Los almacenes de acondicionamiento y almacenes de deposito y distribución de dispositivos médicos. Todas aquellos establecimientos que efectúen algún proceso/etapa de producción; obtención, preparación, mezclado, ensamblado, manipulación, envasado, acondicionamiento, estabilidad, análisis, control, almacenamiento y distribución de los dispositivos médicos comercializados en el país. 6 RIS Capitulo IX ARTÍCULO 82. Los equipos médicos, prótesis, órtesis, ayudas funcionales, agentes de diagnóstico, Insumos de uso odontológico, material quirúrgico, de curación, productos higiénicos y otros dispositivos de uso médico, requieren para su producción, venta y distribución de registro sanitario. (Acuerdo publicado en DOF 31 de Diciembre de 2011) Los Establecimientos en los que se realice el proceso de los Insumos que se mencionan en el párrafo anterior deberán presentar aviso de funcionamiento, con excepción de los dedicados al proceso de fuentes de radiación de uso médico, que requieren de licencia expedida en forma coordinada con la Comisión Nacional de Seguridad Nuclear y Salvaguardias. 7 RIS ARTÍCULO 83. La Secretaría clasificará para efectos de registro a los Insumos señalados en el artículo anterior, de acuerdo con el riesgo que implica su uso, de la manera siguiente: CLASE I. Aquellos Insumos conocidos en la práctica médica y que su seguridad y eficacia están comprobadas y, generalmente, no se introducen al organismo; CLASE II. Aquellos Insumos conocidos en la práctica médica y que pueden tener variaciones en el material con el que están elaborados o en su concentración y, generalmente, se introducen al organismo permaneciendo menos de treinta días, y CLASE III. Aquellos Insumos nuevos o recientemente aceptados en la práctica médica, o bien que se introducen al organismo y permanecen en él, por más de treinta días. 8 Un requisito indispensable para registrar un dispositivo medico: OFICIO DE CERTIFICACIÓN DE BUENAS PRACTICAS DE FABRICACION 8 Proceso de Certificación de Buenas Practicas de Fabricación SOLICITUD DE VISITA DE VERIFICACION (ASPECTOS ADMINISTRATIVOS) 9 CBPF: Certificación de Buenas Prácticas de Fabricación LGS RIS NOM-241 Solicitud COFEPRIS-01-029 COS - DESyVS Visita de verificación Acta de visita de verificación COS CAS Dictamen del acta 11 X 12 Estructura General y Aspectos Relevantes de la Norma NORMA: NOM-241-SSA1-2012 PUBLICADA DOF: 11 /OCT/2012 12 Título INDICE 5. Clasificación de los dispositivos médicos 6. Organización de un establecimiento 7. Personal 8. Documentación 9. Diseño y construcción de un establecimiento dedicado a la producción, acondicionamiento, almacenamiento y distribución de dispositivos médicos 10. Control de la fabricación 11. Equipo de fabricación 12. Manejo de producto fuera de especificaciones (producto no conforme 13 13. Devoluciones y quejas 14. Retiro de producto del mercado 15. Validación 16. Estudios de estabilidad 17. Control de cambios 18. Desviaciones 19. Auditorías técnicas 20. Destrucción y destino final de residuos contaminantes y/o peligrosos 13 ALCANCE : Establece los requisitos que deben reunir los procesos, desde el diseño de la instalación, desarrollo, obtención, preparación, mezclado, producción, ensamblado, manipulación, envasado, acondicionamiento, estabilidad, análisis, control, almacenamiento y distribución de los dispositivos médicos comercializados en el país, por el tipo de insumo de que se trate; 14 y tiene por objeto asegurar que éstos cumplan consistentemente con los requerimientos de calidad y funcionalidad para ser utilizados por el consumidor final o paciente. Esta norma es de observancia obligatoria en el territorio nacional, para todos los establecimientos dedicados al proceso de dispositivos médicos comercializados en el país. 15 5. CLASIFICACION DE LOS DISPOSITIVOS MEDICOS : 16 ACTA: CLASIFICACION DEL ESTABLECIMIENTO AVISO DE FUNCIONAMIENTO AVISO DE RESPONSABLE ACTIVIDADES 17 Organización de un establecimiento: ORGANIGRAMA actualizado, identifique que el responsable de fabricación y el del área de calidad no dependan el uno del otro. 18 RESPONSABLE SANITARIO Ocupar el mayor nivel jerárquico del área de calidad y reportar directamente al puesto más alto del mismo. Mínimo estudios de licenciatura en el área farmacéutica, química, biológica, medicina, biomédica, bioquímica o afín al proceso. 19 Personal CAPACITACION: Personal calificado, incluyendo el temporal DOCUMENTO: Que indique obligaciones, responsabilidades y nivel de autoridad 20 EXPEDIENTE MEDICO Examen médico al ingreso y periódicos a todo el personal de las áreas de fabricación y calidad, incluyendo surtido de los insumos. Reportar cualquier condición de enfermedad que pueda tener efectos adversos sobre los procesos de fabricación. 21 INDUMENTARIA Y EQUIPO DE SEGURIDAD DE ACUERDO AL AREA DE TRABAJO Y NIVEL DE RIESGO DEL D.M. 22 8. Documentación MANUAL DE CALIDAD Descripción del sistema de gestión de calidad y de los procesos que llevan a cabo en el establecimiento 23 LISTAS ( PNO´s, equipos de fabricación, equipos e instrumentos analíticos. Relación de dispositivos que comercializan ) PLANOS Actualizados arquitectónicos, flujos y sistemas críticos 24 DOCUMENTOS MAESTROS ESPECIFICACIONES Actualizados, de acuerdo a Farmacopeas vigentes y correspondan a lo autorizado PROCEDIMIENTOS NORMALIZADOS DE OPERACIÓN 25 EXPEDIENTE LEGAL DEL DISPOSITIVO MEDICO (REGISTRO SANITARIO, ETIQUETA, INFORMACIÓN SOMETIDA PARA LA OBTENCIÓN DEL REGISTRO SANITARIO ) 26 Diseño y construcción REQUERIMIENTOS DE CONSTRUCCIÓN, AMBIENTALES, SEGURIDAD Y BUENAS PRÁCTICAS DE FABRICACIÓN. Las dimensiones de las diferentes áreas deben estar en función de la capacidad de producción, al nivel de seguridad y al tipo de operaciones al que se destine cada una. 27 ANALISIS DE RIESGO QUE DEFINA LOS REQUERIMIENTOS PARA LA CLASIFICACION (PROCESO /INSTALACION/ SISTEMAS CRITICOS) Clasificación de las áreas de producción de acuerdo a la naturaleza del proceso y producto, el análisis de riesgo y el control de la contaminación 28 Control de la fabricación (de acuerdo a PNO´s) GENERALIDADES Identificación de insumos Limpieza y sanitación Monitoreo ambiental Acceso controlado de personal e insumos 29 ADQUISICION Proveedores aprobados Especificaciones vigentes RECEPCION Certificado de análisis Envases que no interactúen 30 ALMACENAMIENTO Áreas identificadas, separadas, por medios físicos y sistema de control Primeras entradas/caducidades-primeras salidas 31 SURTIDO Insumos y productos aprobados, cuantificados y registrados Medidas para prevenir mezclas o contaminación cruzada Rastreabilidad 32 PRODUCCION ORDEN MAESTRA PROCEDIMIENTO DE PRODUCCION ORDEN DE PRODUCCION/REGISTROS CONTROLES DE PROCESO RENDIMIENTOS 33 ACONDICIONAMIENTO ORDEN MAESTRA PROCEDIMIENTO DE ACONDICIONAMIENTO ORDEN DE ACONDICIONAMIENTO/REGISTROS CONCILIACION DE MATERIALES RENDIMIENTOS 34 Área controlada para lotificación/codificación de materiales, registros y destrucción de remanentes 35 MAQUILAS Las responsabilidades entre el maquilador y el titular del registro estar claramente establecidas en un documento que debe contener las etapas técnicas requeridas. Transferencia de tecnología Etapas a maquilar validadas 36 LABORATORIO ANALITICO Métodos de análisis validado Registros de limpieza, análisis, calibración, mantenimiento y operación de instrumentos y equipos. Muestras de retención (área/conservación) 37 Manejo, identificación, preparación, valoración y revaloración (cuando aplique), almacenamiento y disposición final de sustancias o materiales de referencia, reactivos, soluciones, cepas y medios de cultivo empleados en el laboratorio. 38 LIBERACIÓN DE PRODUCTO TERMINADO Expediente de fabricación de cada lote fabricado Consideraciones y requisitos para la liberación de producto Conservación de expedientes 39 DISTRIBUCION Sistema y registros Condiciones de almacenamiento en la cadena de distribución 40 EQUIPO DE FABRICACIÓN (de acuerdo a PNO´s) Operación, Limpieza Mantenimiento Calibración Programas de los equipos computarizados validados 41 MANEJO DE PRODUCTO FUERA DE ESPECIFICACIONES (PRODUCTO NO CONFORME) Contar con PNO que describa las acciones a tomar para el tratamiento de producto no conforme y su dictamen. (Reacondicionado, retrabajado, reprocesado, rechazado, aprobado por concesión) 42 Los retrabajos o reprocesos no están permitidos en dispositivos médicos inyectables Todos los productos rechazados deben ser identificados y segregados hasta su destrucción o su disposición final, debe llevarse a cabo de acuerdo a un PNO. 43 DEVOLUCIONES Y QUEJAS Procedimientos Registros Acciones correctivas y preventivas para quejas Retención temporal de devoluciones 44 RETIRO DE PRODUCTO DEL MERCADO Contar con un sistema y procedimiento para retirar productos del mercado de manera oportuna y efectiva Reporte final, conciliación, acciones y destino final de producto 45 Validación 46 POLITICA: Requerimientos establecidos por una organización para realizar la calificación, validación y el mantenimiento de la validación de los equipos, áreas, procesos, limpieza, métodos analíticos y sistemas computacionales, que conllevan a demostrar que los procesos críticos de sus operaciones particulares se encuentran bajo control. 47 PLAN MAESTRO DE VALIDACION (PMV) Documento en que esquematiza las actividades a desarrollar para calificar los elementos del proceso y posteriormente validar. El PMV debe incluir todos los equipos, instalaciones, sistemas críticos, procesos de fabricación y acondicionamiento, limpieza, métodos analíticos, sistemas computacionales y todas las operaciones que impacten la calidad del producto. 48 CALIFICACION: CD: Evidencia documentada que demuestra que el diseño propuesto de las instalaciones, sistema y equipos es conveniente para el propósito proyectado CI: Evidencia documentada de que las instalaciones propuesto de las instalaciones, sistema y equipos se han instalado de acuerdo a las especificaciones de diseño previamente establecidas. CO: Evidencia documentada que demuestra que el equipo , instalaciones y sistemas operan consistentemente de acuerdo a las especificaciones de diseño establecidas CE: Evidencia documentada de que las instalaciones, sistema y equipos se desempeñan cumpliendo con los criterios de aceptación previamente establecidos. 49 VALIDACIÓN DE PROCESOS: Previo a la validación de los procesos se debe contar con la calificación de equipos, áreas, personal, calibración de instrumentos, protocolo de validación aprobado, etc. La validación de los procesos se puede realizar de tres formas: Retrospectiva Concurrente Recurrente 50 RETROSPECTIVA Se puede realizar tomando en cuenta las siguientes consideraciones: Número de lotes en base a análisis de riesgos. El proceso no haya sufrido cambios. Resultados satisfactorios de los lotes utilizados para la validación. Justificar y documentar el uso de validación retrospectiva. NO APLICA A SISTEMAS Y PROCESOS CRITICOS 51 CONCURRENTE Se puede realizar en casos excepcionales, tomando en cuenta las siguientes consideraciones: Quedar documentado y justificado. Se requiere de al menos 3 corridas o lotes consecutivos con resultados aprobatorios. Es de mencionar que se pueden liberar los lotes individualmente si se cumplen con las especificaciones. 52 RECURRENTE Se requiere al menos 3 corridas o lotes consecutivos con resultados aprobatorios, cuando aplique. En el caso de productos nuevos y procesos críticos. 53 VALIDACIÓN DE LIMPIEZA Se realiza para confirmar la eficiencia del proceso de limpieza de áreas, equipos que se encuentran en contacto directo con el producto En caso de equipos multiproductos en los que el procedimiento de limpieza es el mismo se puede realizar la validación de limpieza con el peor de los casos. 54 VALIDACIÓN DE LIMPIEZA Previo a realizar la validación de limpieza se debe considerar lo siguiente: El método analítico para determinar trazas debe estar validado y demostrar la sensibilidad, especificidad y precisión para la cuantificación del límite máximo permisible de trazas. El personal que realiza la validación del método, muestreo y cuantificación de trazas debe estar calificado. Contar con el protocolo de validación aprobado. 55 VALIDACIÓN DE LIMPIEZA Durante la validación de limpieza se debe tomar en consideración lo siguiente: Realizar mínimo tres corridas o lotes con resultados aprobatorios. Debe reflejar los patrones actuales de uso del equipo. Seguir el protocolo de validación para la ejecución de la validación. 56 VALIDACIÓN DE MÉTODOS ANALÍTICOS Se deben validar los siguientes métodos analíticos: Evaluación de materia prima, producto a granel, en proceso y terminado. Métodos para el análisis de estabilidad, los cuales deben ser indicativos de estabilidad. 57 Para los métodos analíticos farmacopeicos, normativos, validados internamente en casa matriz o corporativo, se debe demostrar la aplicabilidad del método antes de utilizar el método de rutina. Cualquier cambio en los métodos analíticos validados o métodos farmacopeicos, se debe someter a control de cambios y dependiendo del cambio puede aplicar una revalidación o validación completa. 58 SISTEMAS COMPUTACIONALES/FIRMAS ELECTRÓNICAS Deben validarse los sistemas computacionales que impacten la calidad del producto: Transferencia de materiales y producto Disposición de materiales y producto Control de procesos e instrumentos analíticos Control de sistemas críticos Sistema de documentación 59 En la validación de los sistemas computacionales y firmas electrónicas se debe evaluar: Diseño Instalación Operación Ejecución 60 Es importante asegurar durante la validación de sistemas computacionales y firmas electrónicas Seguridad del sistema mediante la creación de usuarios y clave de acceso. Contar con perfil de usuarios acorde con la descripción de actividades del usuario. 61 Sistema audit trail con el que se de rastreabilidad de los movimientos realizados por cada usuario. Comprobación de la adecuada secuencia de los proceso realizados con el sistema. Vinculación de firmas electrónicas con firmas autógrafas en registros electrónicos. Entre otros. 62 SISTEMAS Y PROCESOS CRITICOS Se deben validar los siguientes sistemas críticos Agua purificada y para fabricación de inyectables Aire (comprimido y HVAC) Vapor limpio Esterilización ( por medios físicos y químicos) Llenado simulado. 63 PROVEEDORES Se considera calificado a un proveedor si se cumple con lo siguiente: Existe evidencia del desempeño adecuado del proveedor en cuanto a la calidad de los insumos suministrados. Contar con auditoría en sitio. Haya sido aprobado acorde con el numeral 10.2 de la NOM 64 MANTENIMIENTO DEL ESTADO VALIDADO Se verifica mediante el cumplimiento de los siguientes sistemas y programas: Control de cambios Calibración Mantenimiento preventivo Calificación de personal Auditorías técnicas 65 MANTENIMIENTO DEL ESTADO VALIDADO Sistema de acciones preventivas y correctivas Cuando haya cambio en los sistemas y programas se debe realizar una revalidación o recalificación Al menos cada cinco años se debe realizar una verificación de los procesos, equipos, sistemas o instalaciones en las mismas condiciones que fueron validados o calificados para asegurar el estado de validación. 66 Estudios de estabilidad Protocolos, informe y programa de estabilidades avalados por el responsable sanitario 67 Control de cambios Contar con: Sistema y PNO para control de cambios Comité Técnico integrado Aprobación por el área de Calidad 68 DESVIACIONES Contar con: Sistema y PNO para Desviaciones Comité Técnico integrado Evaluación de la efectividad de las acciones resultantes de una desviación. 69 AUDITORIAS TECNICAS Procedimiento y programa Evidencia documental 70 DESTRUCCIÓN Y DESTINO FINAL DE RESIDUOS CONTAMINANTES Y/O PELIGROSOS Procedimiento y registros 71 HALLAZGOS RECURRENTES EN VISITAS DE VERIFICACION 72 • El responsable sanitario, es el propietario del establecimiento no afín al proceso • Programas de capacitación incompletos o no los cumplen, no hay evidencia • No hay rótulos de identificación de la empresa o con datos del responsable sanitario 73 • No hay identificación ni segregación de áreas. • No cuentan o no están actualizados los planos con flujos de materiales, personal, sistemas críticos 74 • Validación de procesos en base a protocolos pocas empresas los tienen • No cuentan con validación de sistemas críticos, métodos analíticos. 75 • Análisis de materias primas y producto terminado no se realizan completos de acuerdo a FEUM, suplemento actualizados o normas • No cuentan con infraestructura para los análisis requeridos • No analizan por cada lote de producción 76 No se cuenta con control de uso y vigencia de estándares, cepas, medios de cultivo y reactivos No se cuenta con control y evaluación de sanitizantes 77 • Identificación de materias primas y materiales de acondicionamiento, producto intermedio con datos incompletos, no indican condición (aprobado, cuarentena) de acuerdo a procedimiento 78 Aspectos Documentales Debilidades Procedimientos, instructivos Poco descriptivo, ausencia Documentos No se realiza de acuerdo al mismo Registros, bitácoras Poca información, parcial, malas practicas, ausencia 73 Programas incompletos de: • Mantenimiento • Calibración • Limpieza • Capacitación • Control de plagas 80 Ordenes de fabricación y acondicionamiento: • No tienen • Están incompletas • No se realiza los registros al momento. • No tienen el control de proceso • Son diferentes al documento maestro 81 Retención de muestras: • • • • • Sin identificación Insuficientes No esta documentada la cantidad requerida Envases inadecuados Control de condiciones del área no es adecuado 82 ALMACENAMIENTO ADECUADO 83 INDUMENTARIA 84 DELIMITACION AREA 85 LINEA ACONDICIONAMIENTO DELIMITACION AREA 86 AREA DE RECHAZOS 87 MUSEO DE MUESTRAS 88 LABORATORIO FISICOQUIMICOS 89 EQUIPO DE PRECISION 90 ALMACEN REACTIVOS ANALITICOS 91 CAMPANA DE FLUJO LAMINAR 92 Gracias 93 Contestación a Oficios de Seguimiento al Acta de Verificación 95 APLICA A TODOS: Los establecimientos dedicados a la fabricación de dispositivos médicos. Los almacenes de acondicionamiento y almacenes de deposito y distribución de dispositivos médicos. Todas aquellos establecimientos que efectúen algún proceso/etapa de producción; obtención, preparación, mezclado, ensamblado, manipulación, envasado, acondicionamiento, estabilidad, análisis, control, almacenamiento y distribución de los dispositivos médicos comercializados en el país. 97 CBPF: Certificación de Buenas Prácticas de Fabricación LGS RIS NOM-241 Solicitud COFEPRIS-01-029 COS - DESyVS Visita de verificación COS Requerimiento Desecho de trámite Dictamen del acta de visita Dictamen de evidencia CAS Respuesta a Requerimiento CBPF 98 Acta de Verificación Sanitaria A partir de la fecha de cierre del acta de verificación • Revisar si se subsanaron las anomalías. • CUMPLE, Emitir Oficio de Certificación. • NO CUMPLE, Se emite Oficio de 1er Requerimiento. Acta de Verificación Sanitaria A partir de la fecha de cierre del acta, Con fundamento en el Art. 68 de la LEFEPA, el Interesado tiene derecho a manifestar lo que a su derecho le conviene en un plazo de 5 días hábiles Evidencia documental en alcance al acta Documentación que subsane lo indicado en el acta de verificación. La remisión de programas o plan de acciones correctivas y preventivas, no proporcionan evidencia de Buenas practicas durante la fabricación Dictamen de acta • El dictamen del acta de verificación se efectuara en conjunto con la documentación enviada en alcance a esta, si hubiere Resultando…… Si, con la documentación enviada se subsanan las desviaciones asentadas en acta, existe evidencia de cumplimiento a las buenas prácticas de fabricación. Se emite OFICIO DE CERTIFICACION DE BUENAS PRACTICAS DE FABRICACION por planta de fabricación Oficio de 1er Requerimiento. Si, con la documentación enviada NO se subsanan las desviaciones asentadas en acta, se emitirá oficio de Requerimiento con plazo 180 días naturales; con base al art. 223 del RIS ¿Responsabilidad? Respuesta en tiempo y forma, No responde EN TIEMPO Y FORMA Se emite oficio de Desecho. Una vez que presentan evidencia documental, se efectúa su revisión a fin de dictaminar: Si, con la documentación enviada se subsanan las desviaciones asentadas en acta, existe evidencia de cumplimiento a las buenas prácticas de fabricación. Se emite OFICIO DE CERTIFICACION Si, no subsanan todas las desviaciones se emite un Oficio de 2º Requerimiento. Con plazo 90 días naturales con base al art. 223 del RIS ¿Cumple? SI: Se emite Oficio de Certificación. NO: Se emite Oficio de Desecho Aspectos importantes Visitas de verificación en condiciones dinámicas, es decir mientras están fabricando • NO ES POSIBLE EMITIR OFICIO DE CERTIFICACION DE BUENAS PRACTICAS DE FABRICACIÓN, si no están FABRICANDO Aspectos importantes • La implementación de las Buenas Prácticas de Fabricación (BPF) es parte fundamental de un sistema de gestión de la calidad: Auditorias Sistema CAPAS Manejo de desviaciones, quejas y devoluciones Control de cambios Evaluación de proveedores Aspectos importantes • Análisis a materias Numerales: primas; independientemente de 8.5.2.1, 8.5.2.2 que cuenten con certificado de proveedor Aspectos importantes Deben generar: • Orden de producción/acondicionamiento: que es la copia de la orden o fórmula maestra de producción/acondicionamiento a la cual se le asigna un número de lote, se utiliza como guía y registro de las operaciones efectuadas en la producción y/o acondicionamiento de un lote de dispositivo médico. Aspectos importantes • Procedimiento de producción, al documento que contiene las instrucciones detalladas para transformar las materias primas, materiales o componentes en dispositivos médicos a granel previo a su acondicionamiento en el empaque destinado para su comercialización. • El procedimiento de acondicionamiento Numerales: 8.3.1.2, 8.3.4.1 Aspectos importantes Es un requerimiento la emisión del Certificado analítico de producto terminado (numeral 8.5.1.2.). Entiéndase por Certificado de producto, en algunos casos como certificado de conformidad (pruebas de funcionalidad) Aspectos importantes “documento que avala que el producto ha sido probado antes de su liberación de la planta para garantizar su seguridad, eficacia, calidad y funcionalidad una vez que ha demostrado el cumplimiento con los parámetros de aceptación establecidos con base al tipo de producto y su nivel de riesgo. Debe incluir el número de lote o de serie, las especificaciones y resultado del producto terminado emitido por el fabricante, o copia de un certificado de análisis emitido por un laboratorio autorizado y firmado por el responsable de aseguramiento de la calidad o por el responsable sanitario” Aspectos importantes • Calificación de equipos y sistemas críticos de fabricación. Las diferentes etapas de calificación son secuenciales no es posible continuar a la siguiente si la etapa previa no se ha concluido de forma satisfactoria. • Clasificación y Calificación de áreas Aspectos importantes • Validación de proceso de esterilización; aun cuando este proceso se envíe a un maquilador debe realizarse y documentarse su validación considerando los requerimientos mínimos según el método que se efectúe, por ejemplo: Esterilización por Oxido de Etileno ISO 11135-1:2007; ISO 11135-2:2008 Aspectos importantes • Clasificación y Calificación de áreas GESTION DE RIESGO Análisis de riesgo • ICH Q9; QUALITY RISK MANAGEMENT. • ISO 14971:2009; Medical devices-Application of risk management to medical devices Enfoque con análisis de riesgo • 3.7 Análisis de riesgo, al método para evaluar con anticipación los factores que pueden afectar la funcionalidad de: sistemas, equipos, procesos o calidad de insumos y producto. • 7.4.1 Los requerimientos de indumentaria para cada área de fabricación dependerán de la clasificación del área con base al nivel de riesgo del dispositivo médico y deben estar definidos por escrito, incluyendo la disposición de indumentaria desechable. 117 Enfoque con análisis de riesgo • 8.5.7. Debe existir un PNO que permita llevar a cabo el análisis de riesgo del producto y la evidencia de su aplicación para su correcta administración, el cual debe contener como mínimo lo siguiente: • • • • • • 8.5.7.1 Metodología de Análisis de Riesgo empleado. 8.5.7.2 Determinación de puntos críticos de control. 8.5.7.3 Parámetros y límites críticos. 8.5.7.4 Monitoreo de los puntos críticos de control. 8.5.7.5 Acciones correctivas a realizar cuando indique que un punto crítico de control se encuentra fuera de control. 8.5.7.6 Plan de evaluación para garantizar que el análisis de riesgos y puntos críticos de control estén funcionando efectivamente. • 9.1.1 El establecimiento debe ser diseñado, construido y conservado de acuerdo con las operaciones que en él se efectúen tomando como base el nivel de riesgo del dispositivo médico. • Su diseño y construcción debe permitir su limpieza, orden, mantenimiento y prevención de la contaminación, así como los flujos unidireccionales del personal y materiales. 119 Enfoque con análisis de riesgo • 9.1.2 Debe existir un plan para definir los requerimientos del dispositivo médico con base a su clasificación de riesgo, que incluya los procesos empleados, los sistemas críticos y el alcance de la instalación. • 9.2.9 De acuerdo a la naturaleza del proceso y producto, el análisis de riesgo y el control de la contaminación; deben clasificarse las áreas de producción (véase Apéndice normativo A) 120 15. Validación: los fabricantes de dispositivos médicos deben determinar qué actividades deben validar considerando que: • Deben demostrar el control de los aspectos críticos de sus operaciones particulares. • Los procesos de fabricación MANUALES no se validan. • Debe utilizarse un enfoque de análisis de riesgos del dispositivo médico para evaluar el ámbito y grado de validación. • Todas las instalaciones, equipos, sistemas críticos que impacten en la calidad del dispositivo médico, deben estar calificados y los procesos de producción, métodos de limpieza y analíticos deben validarse. Imagen tomada de: http://ibscompany.blogspot.mx 122 Ejercicios Trabajar en equipos de 10 personas. Lea cuidadosamente las actividades que realiza el establecimiento, si existen dudas sobre el tipo de dispositivo medico asignado, no dude en preguntar. Respete la opinión de los demás y trabajen en equipo. Ejercicios 1. Plantee una metodología para la identificación y evaluación de los posibles riesgos. 2. Determine requerimientos de la NOM aplicables al tipo de establecimiento descrito. 3. Defina requisitos de instalación. 4. Determine cuales serán las actividades de calificación y validación que deberán realizar. ¡Muchas gracias! Iván V. Cruz Barrera :[email protected] Norah M. Silva Morlaes :[email protected] Ma. del Rosario Delgadillo Martínez :[email protected] Ma. De Lourdes López Torres : [email protected] Arminda López Alquicira : [email protected] Llanet Bolaños Valerio :[email protected] 125