Notice: Undefined index
Anuncio

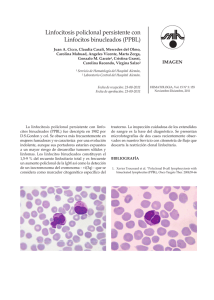
Documento descargado de http://www.elsevier.es el 24/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Med Clin (Barc). 2011;136(13):578–579 www.elsevier.es/medicinaclinica Editorial ? Linfocitosis B policlonal persistente. Una enfermedad benigna o un pre-linfoma? Persistent polyclonal B-cell lymphocytosis: Benign disease or prelymphoma? Estella Matutes Haemato-Oncology Department, Royal Marsden Hospital, London, England La mayorı́a de linfocitosis policlonales corresponden a expansiones de linfocitos T debidas a infecciones vı́ricas y son autolimitadas. Una minorı́a corresponde a la expansión policlonal de linfocitos B y se la designa como linfocitosis B policlonal persistente (LBPP). La LBPP fue descrita inicialmente en 1982 por Gordon et al en tres mujeres fumadoras con hipergammaglobulinemia policlonal IgM y la presencia de linfocitos circulantes con un núcleo bilobulado1. Posteriormente se han descrito numerosos casos aislados y series cortas de pacientes. La información en series largas de LBPP es escasa y derivada de los estudios franceses2,3. En este número de la revista, Florensa et al describen la experiencia del grupo catalán en una serie de 35 pacientes con LBPP, la única serie hasta la actualidad descrita en nuestra población4. La LBPP es una enfermedad que afecta casi exclusivamente a adultos y es muy infrecuente en niños5,6. La mayorı́a de pacientes son mujeres de mediana edad con antecedentes de tabaquismo y un haplotipo HLA-DR7. Estos pacientes se hallan asintomáticos o manifiestan sı́ntomas inespecı́ficos (fatiga), por lo que el diagnóstico suele establecerse en un análisis de rutina que pone de manifiesto una linfocitosis leve o valores de linfocitos normales pero con la presencia de formas atı́picas muy caracterı́sticas de este proceso y que corresponden a linfocitos con citoplasma abundante y un núcleo bilobulado. La organomegalia es infrecuente, aunque en una minorı́a de casos (15%) puede detectarse hepatoesplenomegalia y, más infrecuentemente, adenopatı́as de pequeño volumen. El estudio inmunofenotı́pico es esencial para demostrar la naturaleza policlonal de estos linfocitos B. Este permite identificar la presencia de linfocitos B maduros con positividad para diversos marcadores linfoides B y raramente con expresión débil de CD5 y CD23; una proporción de los linfocitos B expresa la cadena ligera de la inmunoglobulina (Ig) kappa y la población celular restante, la cadena lambda. En relación al nivel de diferenciación linfoide B, estudios inmunofenotı́picos e histológicos parecen indicar que estos linfocitos son células memoria de la zona marginal con expresión de las cadenas pesadas de la Ig IgM, IgD, CD27 y positividad intensa para el CD217–10. Aunque se dispone de pocos estudios histológicos, el patrón de infiltración de la médula ósea es predominantemente intrasinusoidal e intravascular11, y la histologı́a esplénica en tres casos descritos muestra Véase contenido relacionado en DOI: 10.1016/j.medcli.2010.09.048 Correo electrónico: [email protected] una expansión de la zona marginal de la pulpa blanca con un patrón bifásico, como se observa en los linfomas esplénicos marginales10. Es probable que este patrón de infiltración esplénica no sea universal, ya que en el único paciente del presente estudio al que se le realizó esplenectomı́a la infiltración linfoide fue predominantemente de la pulpa roja esplénica4. La patogénesis de la LBPP es incierta. Los hallazgos citogenéticos tanto en la serie francesa2,3 como en la presente serie catalana4, que demuestran la presencia de anomalı́as clonales, en particular un iso(3)(q10), inestabilidad cromosómica y condensación cromatı́nica prematura, son difı́ciles de interpretar e integrar con la falta de evidencia de la presencia de una clona B en base a estudios de Southern-blot o reacción en cadena de la polimerasa (PCR) encaminados a detectar el reordenamiento del gen que codifica para las cadena pesadas o ligeras de la Ig. Ello diferencia la LBPP de los linfomas B, en los que es casi universal la detección de un único reordenamiento de la Ig a excepción de algunos casos que pueden ser bi o triclonales. Una hipótesis o posible explicación podrı́a hallarse en que el daño o hit inicial en estos pacientes ocurriese en una célula linfoide precursora B en la que todavı́a no han acontecido reordenamientos de los genes que codifican para las cadenas de la Ig. Existe una evidencia clara de una predisposición genética de esta enfermedad sustentada por: 1) la alta incidencia (> 80% pacientes) de portadores de un haplotipo HLA-DR7 comparado a lo que se observa en la población general (que es del 26%) y 2) la descripción de familias con varios miembros afectos de LBPP12,13. Sin embargo, los factores responsables del inicio y desarrollo de esta condición en dichos individuos son inciertos. Algunos estudios han sugerido que la LBPP podrı́a ser el resultado de una expansión de linfocitos B que carecen de una respuesta a señales que fisiológicamente son responsables de la eliminación de linfocitos B memoria con baja afinidad para un antı́geno. Ello se basa en datos que demuestran que los linfocitos en la mayorı́a de pacientes poseen mutaciones del gen de la cadena pesada de la Ig, sin que se hallen diferencias en la utilización de la familia de la región variable de la cadena pesada de la Ig y sin que se evidencie un patrón que sugiera una selección positiva por uno o varios antı́genos9. Posiblemente la exposición constante al tabaco podrı́a ser un factor que mantiene la expansión de los linfocitos, pero no el evento inicial determinante de la misma. En nuestra experiencia personal, ası́ como en los datos descritos por el grupo francés, los valores de linfocitos en sangre periférica disminuyen o se normalizan en algunos pacientes que abandonan el hábito de 0025-7753/$ – see front matter ß 2010 Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.medcli.2010.11.022 Documento descargado de http://www.elsevier.es el 24/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. E. Matutes / Med Clin (Barc). 2011;136(13):578–579 fumar; sin embargo, la clona con un iso(3)(q10) persiste. Del mismo modo, la presencia de múltiples reordenamientos del gen BCL-2 con la cadena pesada de la Ig no es un factor causal, sino posiblemente contribuyente a la persistencia de la linfocitosis. La infección por el virus de Epstein-Barr habı́a sido sugerida como causante en base a casos anecdóticos descritos en los que el paciente manifestaba una infección crónica por este virus; sin embargo, ello no ha sido demostrado en la mayorı́a de LBPP y es probable que la reactivación del virus de Epstein-Barr sea un epifenómeno. Un estudio reciente que analiza el perfil génico mediante micromatrices ha demostrado que la LBPP posee un sello diferente al de la leucemia linfática crónica (LLC) y al de linfocitos B normales, y que se caracteriza por una expresión elevada de componentes de la familia del gen AP-1 (proteı́na activadora 1) y disminuida de una serie de genes involucrados en la apoptosis y en la vı́a del TGFB (transforming growth factor-B), que son reguladores del crecimiento y multiplicación celular14. La sobreexpresión de genes pertenecientes a la familia de AP-1 es caracterı́stica de los linfomas anaplásicos CD30+ y del linfoma de Hodgkin (CD30+), por lo que los autores han sugerido que la LBPP tal vez posea una vı́a patogénica similar a la de estos dos procesos linfomatosos. Es posible especular que además de la desregulación de AP-1, la adición de otros factores con mayor potencial oncogénico y que no se hallan involucrados en la LBPP sean los determinantes del desarrollo de linfoma en estos pacientes. Por otro lado, la expresión disminuida de genes reguladores de la apoptosis, en especial de componentes de la vı́a Fas/Fas-L14,15, podrı́an ser los determinantes de la persistencia de estos linfocitos y ausencia de su eliminación en estos individuos. Desde un punto de vista clı́nico, la información acerca de la posible evolución de una LBPP a un linfoma es un aspecto importante a considerar. En base a los datos publicados en la serie francesa3 y en este estudio4, esta eventualidad parece ser infrecuente. En la serie de 111 pacientes descrita por Cornett et al, con una media de seguimiento de 4,4 años, dos pacientes desarrollaron una gammapatı́a monoclonal de significado incierto (GMSI), en dos pacientes la LBPP se asoció con una GMSI al diagnóstico y tres pacientes desarrollaron un linfoma: difuso de células grandes en dos pacientes y un linfoma esplénico de la zona marginal en el tercero. Solamente en el último paciente pudo demostrarse que el linfoma resultaba de la evolución clonal de un linfocito presente en la fase de LBPP con iso(3)(q10). En el estudio de Florensa et al4 sólo un paciente desarrolló un linfoma folicular y no pudo establecerse que resultaba de la evolución clonal de un linfocito B de la LBPP. Aunque se han documentado casos aislados de desarrollo de linfoma, y esta es mi experiencia, la frecuencia de este evento es inferior al 4% de los casos. En conclusión, la LBPP es una enfermedad que acontece en individuos con una predisposición genética y que probablemente resulta de la expansión policlonal y persistente de un linfocito B memoria que ya ha interaccionado con un antı́geno y que el organismo es incapaz de eliminar, como ocurre en individuos normales con los linfocitos activados que poseen una afinidad baja para el antı́geno. Este «antı́geno» o estimulador de los linfocitos B desencadenante de la proliferación de estos no se ha establecido y 579 es probable que no sea uno especı́fico, sino una variedad de ellos. Si bien este serı́a el factor inicial, posiblemente se requiere una constelación de otros factores determinantes de la persistencia y/o proliferación de estos linfocitos. La LBPP es un proceso que posee caracterı́sticas benignas (policlonalidad) simultáneamente con rasgos que se observan en procesos neoplásicos (anomalı́as cromosómicas). Aunque la historia natural de este proceso es incierta y es recomendable un seguimiento de estos pacientes, la incidencia baja de su evolución a linfoma podrı́a indicar que no se trata de una forma prelinfomatosa. Por el contrario, es posible que pudiese ser un equivalente a lo que denominamos linfomas folicular y del manto in situ. En la actualidad se dispone de datos limitados que muestran un perfil anormal génico con un potencial oncogénico en la LBPP. Estudios funcionales y de expresión génica en células del microambiente tales como linfocitos T y células presentadoras de antı́geno podrı́an dar luces y contribuir a un mejor conocimiento de su patogénesis. Bibliografı́a 1. Gordon DS, Jones BM, Browning SW, Spira TJ, Lawrence DN. Persistent polyclonal lymphocytosis of B lymphocytes. N Engl J Med. 1982;307:232–6. 2. Mossafa H, Malaure H, Maynadie M, Valensi F, Schllinger F, Garand R, et al. Persistent polyclonal B lymphocytosis with binucleated lymphocytes: a study of 25 cases. Groupe Francais d’Hematologie Cellulaire. Br J Haematol. 1999;104: 486–93. 3. Cornett E, Lesesve JF, Mossafa H, Sebahoun G, Levy V, Davi F, et al. Long-term follow-up of 111 patients with persistent polyclonal lymphocytes with binucleated lymphocytes. Leukemia. 2009;23:419–22. 4. Florensa L, Navarro JT, Pérez Vila E, Domingo A, de la Banda E, Rozman M, et al. Linfocitosis B policlonal persistente: estudio de 35 casos. Med Clin (Barc). 2011;136:565–73. 5. Gomez P, Matutes E, Sanchez J, Garcia JM, Roman J, Gruszka-Westwood A, et al. An unusual form of persistent polyclonal B lymphocytosis in an infant. Br J Haematol. 2000;110:430–3. 6. Wong KF, Yuen HL, Leung JN, Chan JK. Polyclonal B-cell lymphocytosis mimicking malignant lymphoma in a newborn. Arch Pathol Lab Med. 2005;129:251–2. 7. Salcedo I, Campos-Caro A, Sampalo A, Reales E, Brieva JA. Persistent polyclonal B lymphocytosis: an expansion of cells showing IgVH mutations and phenotypic features of normal lymphocytes from the CD27+ marginal zone B-cell compartment. Br J Haematol. 2002;116:662–6. 8. Himmelmann A, Gautschi O, Nawrath M, Bollinger U, Fehr J, Stahel RA. Persistent polyclonal B-cell lymphocytosis is an expansion of functional IgD+ CD27+ memory B cells. Br J Haematol. 2001;114:400–5. 9. Loembe MM, Neron S, Delange R, Darveau A. Analysis of expressed V (H) genes in persistent polyclonal B cell lymphocytosis reveals absence of selection in CD27+ IgM+ IgD+ memory cells. Eur J Immunol. 2002;32:3678–88. 10. Del Giudice I, Pileri SA, Rossi M, Sabattini E, Campidelli C, Starza ID, et al. Histopathological and molecular features of persistent polyclonal lymphocytosis (PPBL) with progressive splenomegaly. Br J Haematol. 2009;144:726–31. 11. Feugier P, de March AK, Lesesve JF, Monhoven N, Dorvaux V, Braun F, et al. Intravascular bone marrow accumulation in persistent polyclonal lymphocytosis: a misleading feature for B-cell neoplasm. Mod Pathol. 2004;17:1087–96. 12. Carr R, Fishlock K, Matutes E. Persistent polyclonal B-cell lymphocytosis in identical twins. Br J Haematol. 1997;96:272–4. 13. Delage R, Jacques L, Massinga-Loembe M, Poulin J, Bilodeau D, Mignault C, et al. Persistent polyclonal B-cell lymphocytosis: further evidence for a genetic disorder associated with B-cell abnormalities. Br J Haematol. 2001;114: 666–70. 14. Lawrie CH, Shilling R, Troussard X, Cattan H, Mossafa H, Pezella F, et al. Expression profiling of persistent polyclonal B-cell lymphocytosis suggests constitutive expression of the AP-1 transcription complex and downregulation of Fas-apoptotic and TGF beta signalling pathways. Leukemia. 2009;23:581–3. 15. Roussel M, Roue G, Sola B, Mossafa H, Troussard X. Dysfunctin of the Fas apoptotic signalling pathway in persistent polyclonal B-cell lymphocytosis. Haematologica. 2003;88:239–40.