repaso QO II - Universidad de Navarra
Anuncio
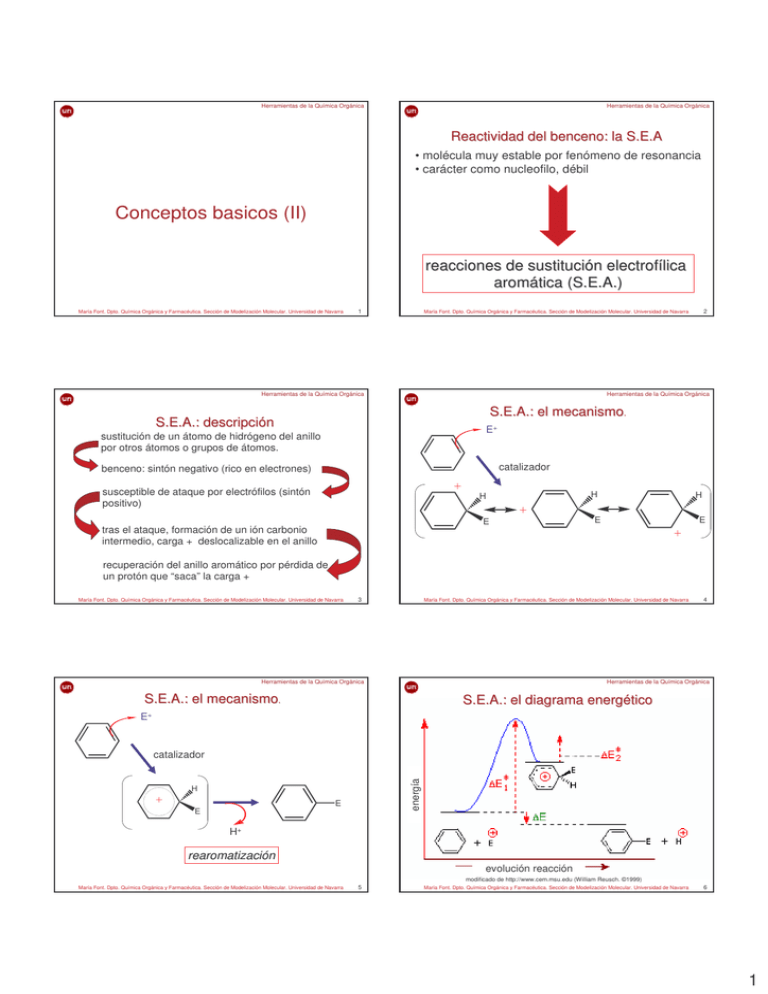
Herramientas de la Química Orgánica Herramientas de la Química Orgánica Reactividad del benceno: la S.E.A • molécula muy estable por fenómeno de resonancia • carácter como nucleofilo, débil Conceptos basicos (II) reacciones de sustitució sustitución electrofí electrofílica aromá á tica (S.E.A.) arom María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 1 2 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Herramientas de la Química Orgánica S.E.A.: el mecanismo. S.E.A.: descripció descripción E+ sustitución de un átomo de hidrógeno del anillo por otros átomos o grupos de átomos. catalizador benceno: sintón negativo (rico en electrones) susceptible de ataque por electrófilos (sintón positivo) H E tras el ataque, formación de un ión carbonio intermedio, carga + deslocalizable en el anillo H H E E recuperación del anillo aromático por pérdida de un protón que “saca” la carga + María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 3 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 4 Herramientas de la Química Orgánica S.E.A.: el mecanismo. S.E.A.: el diagrama energé energético E+ energía catalizador H E E H+ rearomatizació rearomatización evolución reacción modificado de http://www.cem.msu.edu (William Reusch. ©1999) María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 5 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 6 1 Herramientas de la Química Orgánica Herramientas de la Química Orgánica S.E.A.: tipos (I) S.E.A.: tipos (II) X2 RX X MeX3 HNO3 CH 2 CH3 alquilación H2SO4 nitración H2SO4 alquilación CH2=CH2 NO2 H2SO4 R MeX3 halogenación RCOCl SO3H 7 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra COR AlCl3 sulfonación acilación María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Herramientas de la Química Orgánica S.E.A.: las especies electrofí electrofílicas (I) Cl2 + AlCl3 ó Br2 + FeCl3 1. Halogenació Halogenación: Cl+ ó Br+ HNO3 + H2SO4 2. Nitració Nitración: NO2+ O H O N H+ + O H O N O H O O alquilación de Friedel-Crafts (1877) R+ XR + AlCl3 ó + FeCl3 N+ R+ CH2=CH2 + H2SO4 + H2O O O- S.E.A.: las especies electrofí electrofílicas (II) 4. Alquilació Alquilación: O 5. Acilació Acilación: RCO+ H2SO4 3. Sulfonació Sulfonación: SO3 O O 8 O O- S S+ S2+ O O O- María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra RCOCl + AlCl3 ó + FeCl3 acilación de Friedel-Crafts (1877) 9 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica S.A.E.: el catalizador, ejemplo (I) 10 Herramientas de la Química Orgánica S.E.A.: el catalizador, ejemplo (II) Electrófilo moderado c c Br+ Br+ c Br BrBr- no hay reacción c c c c c c c Br Br c c c c Br c c c c Fe Br Nucleófilo débil María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 11 Br María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 12 2 Herramientas de la Química Orgánica Herramientas de la Química Orgánica S.E.A.: el catalizador, ejemplo (III) S.E.A.: el ió ión carbonio (I) La formación de electrófilo Br Br- Br+ - Br Fe - Br Fe Br Br+ Br Br + Br sistema electrofílico fuerte 13 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 14 Herramientas de la Química Orgánica S.E.A.: el ió ión carbonio (II) Sustitución ≠ Adición (I) Br+ + H H + Br H Br Br ≡ + H + Br Adició Adición de E+ (H+) y del Nu- (Br-) María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 15 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Sustitución ≠ Adición (II) + H+ G NuNu Herramientas de la Química Orgánica Influencia de los sustituyentes sobre la reactividad de los aromáticos: (I) activantes SAE H E 16 Grupos que ceden e- al anillo H aumentan carácter negativo del anillo H E E Nu- Adición del pérdida de aromaticidad facilitan la siguiente reacción con electrófilos H+ Salida de recuperación de aromaticidad dificultan la siguiente reacción con nucleófilos Sustitució Sustitución de E+ (H+) por otro E+ (Br+) María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 17 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 18 3 Herramientas de la Química Orgánica Ejemplos de grupos activantes y desactivantes Influencia de los sustituyentes sobre la reactividad de los aromáticos: (II) desactivantes SAE G Herramientas de la Química Orgánica activantes Grupos que retiran e- del anillo disminuyen carácter negativo del anillo para reacció reacción tipo S.A.E. dificultan la siguiente reacción con electrófilos facilitan la siguiente reacción con nucleófilos desactivantes María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 19 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 20 Herramientas de la Química Orgánica Activación/desactivación y efecto director (II). Ejemplo: reacción de nitración sobre distintos derivados de Activación/desactivación y efecto director (I) El carácter activante o desactivante de cada tipo de grupo además de tener distinta eficacia, “se nota” de distinta manera en cada una de las posiciones del anillo sustituido por dicho grupo benceno, con grupos dadores de e-, referido a benceno CH3 H3C CH3 C CH3 1.0 Efecto director activante orto y para desactivante orto y para desactivante meta María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 21 8 1.0 3 4 1.0 55 75 6.0 1.0 147 24.5 99 16.5 22 Herramientas de la Química Orgánica El grupo hidroxilo, formas resonantes + : OH de benceno, con grupos que retiran e-, referido a benceno Cl 43 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Activación/desactivación y efecto director (II). Ejemplo: reacción de nitración sobre distintos derivados 1.0 + + OH OH OH COOCH3 - - 1.0 1.0 0.03 1.0 0.0 0.0025 OH 0.008 0.20 0.001 6.0 0.20 0.022 1.0 0.033 0.004 1.0 - + María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra activación - - activación 23 activación activació activación para siguiente SAE María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 24 4 Herramientas de la Química Orgánica Herramientas de la Química Orgánica El grupo amino, formas resonantes + : NH 2 NH2 NH2 - - - + NH2 activación El grupo metilo, formas resonantes + + NH2 activación - - activación sustitución en orto y para http://www.cem.msu.edu (William Reusch. ©1999) María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 25 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica El grupo nitro, formas resonantes (I) O N O + N O O O O + O + O N N + 27 Herramientas de la Química Orgánica N O Y= NO2, SO3H, CO2R, CONH2 CHO, CN, COR E+ + Y= O-, OH, OR, OCOCH3 NH2, NR2, R, C6H5 X= F, Cl, Br, I CH2X, CH=CH-NO2 Y Y E + Y desactivació desactivación para siguiente SAE E María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 28 Resumen de Y efectos directores + + O Herramientas de la Química Orgánica E O + N O María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra El grupo nitro, formas resonantes (II) O + ON O + N + http://www.cem.msu.edu (William Reusch. ©1999) María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra O + sustitución en orto y para desactivació desactivación para siguiente SAE 26 Herramientas de la Química Orgánica Los halógenos, formas resonantes - sustitución en orto y para activació activación dé débil para siguiente SAE activació activación para siguiente SAE 29 Y= O-, OH, OR, OCOCH3 NH2, NR2, R, C6H5 X = F, Cl, Br, I CH2X, CH=CH-NO2 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 30 5 Herramientas de la Química Orgánica Reducció Reducción del benceno • con metales Herramientas de la Química Orgánica La resonancia en compuestos aromáticos superiores (I) el naftaleno 1 8 α 2 7 3 6 4 5 http://www.cem.msu.edu (William Reusch. ©1999) María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 31 Herramientas de la Química Orgánica La resonancia en compuestos aromáticos superiores (III) el fenantreno La resonancia en compuestos aromáticos superiores (II) el antraceno 9 1 7 2 6 3 5 10 32 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 8 β 4 9 10 1 8 7 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 33 2 3 4 5 6 34 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Herramientas de la Química Orgánica Especies electrofílicas en S.E.A. (I) reacciones de los anillos aromáticos superiores • moléculas muy estables por fenómeno de resonancia • carácter como nucleofilo, débil HNO3 + H2SO4 2. Nitració Nitración: NO2+ O H O N H+ + O H O O reacciones de sustitució sustitución electrofí electrofílica aromá aromática (S.E.A.) 35 O O N O N+ O H + H2O O H2SO4 3. Sulfonació Sulfonación: SO3 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Cl2 + AlCl3 ó Br2 + FeCl3 1. Halogenació Halogenación: Cl+ ó Br+ O O- O O- S S+ S2+ O O O- María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 36 6 Herramientas de la Química Orgánica Especies electrofílicas en S.E.A. (II). Herramientas de la Química Orgánica puntos de reactividad en los anillos aromáticos superiores 4. Alquilació Alquilación: alquilación de Friedel-Crafts (1877) R+ XR + AlCl3 ó + FeCl3 R+ CH2=CH2 + H2SO4 5. Acilació Acilación: RCO+ 1 2 RCOCl + AlCl3 ó + FeCl3 acilación de Friedel-Crafts (1877) 9 9 10 10 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 37 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica mecanismo S.E.A. (I) 38 Herramientas de la Química Orgánica mecanismo S.E.A. (II): el intermedio H H E+ E E E H E catalizador + H H+ E H H rearomatizació rearomatización María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 39 E E María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Herramientas de la Química Orgánica La posición posición reactiva: alfa versus beta (I) Diagrama energético S.E.A. en naftaleno H H E 40 + E H E H E E + E+ + H+ María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra intermedios tras ataque en alfa 41 Dpto. Quí Química Orgá Orgánica y Farmacé Farmacéutica. Unidad de Modelizació Modelización Molecular. Universidad de Navarra María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 42 7 Herramientas de la Química Orgánica La posición posición reactiva: alfa versus beta (II) H E H E H Herramientas de la Química Orgánica Reacciones SEA en naftaleno (I) X X2 E MeX3 solo en alfa halogenación NO2 HNO3 H2SO4 solo en alfa nitración SO3H H2SO4 intermedios tras ataque en beta en alfa o en beta Dpto. Quí Química Orgá Orgánica y Farmacé Farmacéutica. Unidad de Modelizació Modelización Molecular. Universidad de Navarra María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 43 Herramientas de la Química Orgánica Reacciones SEA en naftaleno (II) sulfonación María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 44 Herramientas de la Química Orgánica La reacción de sulfonación en naftaleno (I) SO3 H R RX MeX3 alquilación en alfa o en beta H2 SO4 (c), 80 ºC COR H2 SO4 (c), 160 ºC RCOCl AlCl3 en alfa o en beta SO3 H acilación María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra H2 SO4 (c), 160 ºC 45 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica La reacción de sulfonación en naftaleno (II) 46 Herramientas de la Química Orgánica Acilación de Friedel-Crafts en naftaleno (I) SO3H COCH3 CH3 COCl/AlCl3 Cl4 C se forma rápidamente se desulfona rápidamente SO3H CH3 COCl/AlCl3 COCH3 C6 H5 NO2 se forma lentamente se desulfona lentamente María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 47 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 48 8 Herramientas de la Química Orgánica Acilación de Friedel-Crafts en naftaleno (II) Herramientas de la Química Orgánica Acilación de Friedel-Crafts en naftaleno (III) Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Al O Cl Cl Cl N Cl Cl Cl Cl Cl O CH3 Cl 49 Herramientas de la Química Orgánica Acilación de Friedel-Crafts en naftaleno (IV) H O O Cl Cl Al H O O O Cl O CH3 N María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 50 Herramientas de la Química Orgánica Acilación de Friedel-Crafts en naftaleno (V) H H N O Cl O Cl María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra N H H H H María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 51 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Activació Activación/desactivació n/desactivación y efecto director en S.E.A (I) 52 Herramientas de la Química Orgánica Activació Activación/desactivació n/desactivación y efecto director en S.E.A (II) El carácter activante o desactivante de cada tipo de grupo además de tener distinta eficacia, “se nota” de distinta manera en cada una de las posiciones del anillo sustituido por dicho grupo y sobre el otro anillo G Grupos que ceden e- al anillo aumentan carácter negativo del anillo que sustenta el grupo Efecto director en S.E.A. activante sobre el mismo anillo facilitan la siguiente reacción con desactivante que dirige al otro anillo María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 53 electrófilos sobre ese anillo María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 54 9 Herramientas de la Química Orgánica Activació Activación/desactivació n/desactivación y efecto director en S.E.A (III): posiciones de ataque preferentes Activació Activación/desactivació n/desactivación y efecto director en S.E.A (IV) G G Herramientas de la Química Orgánica H G E Grupos que retiran e- del anillo Disminuyen el carácter negativo del H E H E anillo que sustenta el grupo G menos estable G facilitan la siguiente reacción con electrófilos sobre el otro anillo H E María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 55 Herramientas de la Química Orgánica Reacciones S.A.E. en antraceno Herramientas de la Química Orgánica Reacciones S.A.E. en fenantreno Br H 56 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Br Br2 + HBr Br H FeBr3 9,10-dibromo-9,10-dihidroantraceno H H Br Br Br 9,10-dibromo-9,10-dihidrofenantreno 9-bromoantraceno María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 9-bromofenantreno Br2 Q/OH- 57 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 58 Herramientas de la Química Orgánica Reacciones de oxidación y reducción en antraceno Reacciones de reducción en naftaleno O Na NH3 (l)/ alcohol K2Cr2O7/H2SO4 1,4-dihidronaftaleno O H2/Ni ó H2/Pd-C 9,10-antraquinona presión y Q medio H H Na/C 2H5OH reflujo H2/Rh-C ó H2/Pt-C presión y Q H H 9,10-dihidroantraceno María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 59 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 60 10 Herramientas de la Química Orgánica Herramientas de la Química Orgánica Reacciones de oxidación y reducción en fenantreno O O Sustancias hidroaromáticas/sustancias aromáticas Pd/Q/corriente CO2 K2Cr2O7/H2SO4 H + H2 Pd 9,10-fenantrenoquinona H H H deshidrogenació deshidrogenación catalí catalítica hidrogenació hidrogenación catalí catalítica Na/C5H11OH reflujo 9,10-dihidrofenantreno 61 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica R R C R X C R C H H primario reacciones que implican el intercambio de un nucleófilo (el halógeno) por otro nucleófilo, ya sea neutro o cargado (anión) R X X Nu: + R:X R secundario Herramientas de la Química Orgánica Reacciones de los halogenuros de alquilo: (a) Reacciones de sustitución nucleofílica (S.N.), descripción Clasificación de los halogenuros de alquilo H nucleófilo neutro terciario R:Nu+ + :X- sustrato Nu:- + R:X nucleófilo (anión) 63 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra R:Nu + :X- sustrato María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), ejemplos + CN CH3CH2CH2Br - H3C C CH3 + CN H3C C CH3 + HCN + Br - Br CH3 CH3 H3C C CH3 + H2O H3C + CH3 + H + Br - CH2 CH3 C C Fórmula R-Nucleófilo Fórmula Nombre HO- hidróxido R-OH alcohol Nombre RO- alcóxido R-OR éter HOH agua R-O+H2 ión alquiloxonio ROH alcohol RO+HR ión dialquiloxonio RCOO- carboxilato ROCOR éster OH Br H3C Herramientas de la Química Orgánica Nucleófilo CH2 - 64 (a) Reacciones de sustitución nucleofílica (S.N.), tipos de nucleófilos (I) con oxígeno CH3CH2CH2CN CH3 62 CH3 + OH- H3C C CH3 + H2O + Br Br María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 65 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 66 11 Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), tipos de nucleófilos (II) con nitrógeno Nucleófilo Fórmula Nombre NH3 Fórmula amoniaco RNH2 amina 1aria R2NH amina 2 aria amina 3 aria R3N R-NH3+ Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), tipos de nucleófilos (III) con azufre R-Nucleófilo Nucleófilo Nombre ión alquilamonio R-NH2+R ión dialquilamonio Nombre HS- ión bisulfuro R-SH tiol RS- ión mercapturo R-SR tioéter R2S tioéter R-S+R2 ión trialquilsulfonio + R-NH R2 ión alquiloxonio + RN R3 Fórmula R-Nucleófilo Fórmula Nombre ión trialquiloxonio María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 67 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), tipos de nucleófilos (V) con carbono (a) Reacciones de sustitución nucleofílica (S.N.), tipos de nucleófilos (IV) con halógenos Nucleófilo Nucleófilo Fórmula Nombre I- yoduro Fórmula R-I R-Nucleófilo Nombre Nombre - acetiluro RC≡CR acetilenos - cianuro RCN cianuro de alquilo (nitrilos) C≡N 69 Fórmula R-Nucleófilo Fórmula C≡C yoduro de alquilo María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 68 Nombre María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 70 Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), intermedio de la reacción SN2 (a) Reacciones de sustitución nucleofílica (S.N.), la clasificación reacción en un único paso: formación de un intermedio, orden bimolecular 2 tipos de reacciones de sustitución nucleofílica - SN2: ciné cinética bimolecular Nu C X SN1: ciné cinética unimolecular María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 71 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 72 12 Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN2, mecanismo C X Nu C Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN2, consideraciones 1. La velocidad de la reacción depende de las concentraciones de sustrato y nucleófilo, orden bimolecular X V = k [Nu-] [RX] Nu- + Nu C + Nu X- María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 73 C X María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN2, consideraciones (II) C Br reacción en dos pasos: formación de un catión intermedio, por salida del halógeno, orden unimolecular CH3 HO- HO H C2H5 Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN1, el intermedio 2. Se produce una inversión de la configuración del centro que sustenta el halógeno H3C 74 C H C2H5 (R)-2-bromobutano C+ (S)-2-butanol 3. La reacción se acelera cuando el grupo alquilo del sustrato es metilo o primario, y se retarda cuando es terciario María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 75 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN1, el mecanismo C X lento C+ 76 Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN1, consideraciones (I) 1. La velocidad de la reacción depende de las concentraciones de sustrato únicamente; es independiente de la concentración de nucleófilo, orden unimolecular + X- V = k [RX] C+ + Nu rápido C Nu + Nu C Nu: Dos pasos María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra GS 77 Nu: :GS María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 78 13 Herramientas de la Química Orgánica Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN1, consideraciones (II) (a) Reacciones de sustitución nucleofílica (S.N.), la reacción SN1, consideraciones (III) 2. Si el carbono unido al grupo saliente es asimétrico se produce principalmente racemización (pérdida de actividad óptica) 3. La reacción se acelera cuando el grupo alquilo del sustrato es terciario y se retarda cuando es primario (orden de reactividad se corresponde con el orden de estabilidad de los carbocationes) R R R > C+ R terciario R CH+ >> secundario R CH2+ > primario CH3+ metilo Disminuye la estabilidad María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 79 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), SN1 versus SN2, análisis I. El tipos de sustrato/impedimentos estéricos 2ºIdentificar el tipo de nucleó nucleófilo (y localizació localización de e-) II. La fuerza del nucleófilo versus basicidad del nucleófilo 3ºIdentificar el tipo de grupo saliente en el sustrato C III. Estabilidad del grupo saliente Ta, P) IV. Condiciones de reacción OH Br + OH- disolvente * Polaridad del disolvente C Ta, P. Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), control de mecanismo 1ºIdentificar el tipo de carbono electrofí electrofílico en el sustrato 4ºValorar las condiciones de reacció reacción (disolvente, María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra * Acidez/neutralidad/basicidad 81 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), control de mecanismo (I), el sustrato Halogenuro primario S N2 Halogenuro secundario S N2 y S N1 Halogenuro terciario S N1 80 Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), control de mecanismo (II), los nucleófilos II.1. Los iones negativos son más nucleofílicos que las moléculas neutras correspondientes HO- > H2O; RS-> RSH; RO-> ROH; RCOO-> RCOOH II.2. En una columna de la tabla periódica, los elementos que están abajo tienden a ser más nucleofílicos que los de arriba HS- > HO-; I-> Br- > Cl-> F-; RSH> ROH * los carbocationes más sustituidos se encuentran estabilizados por los grupos alquilo II.3. Los elementos de una mísma línea de la tabla periódica, tienden a ser menos nucleofílicos cuanto mas electronegativo es el elemento. * el impedimento estérico afecta a la nucleofilia no a la basicidad (el ión etóxido C2H5O- es una base más fuerte que el ión t-butóxido (CH3)3CO-) María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 82 R3C- R2N- > RO- > F83 H3N > H2O > HF María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 84 14 Herramientas de la Química Orgánica (a) Reacciones de sustitución nucleofílica (S.N.), control de mecanismo (III), el grupo saliente (a) Reacciones de sustitución nucleofílica (S.N.), control de mecanismo (IV), las condiciones de reacción El sustrato debe tener un buen grupo saliente Grupo con carácter electroatrayente, relativamente estable, polarizable, bases débiles como I-, Br-, ClRSO3-; y moléculas neutras como agua, alcoholes, aminas IV.1. Los disolventes polares solvatan iones S N1 IV.2. La solvatación de los nucleófilos por disolvente polar prótico, impide que compartan sus e- (baja la eficacia del Nu) S N2 IV.3. Los disolventes polares apróticos (como DMSO (CH3)2S=O) solvatan cationes pero no aniones (aumenta la eficacia del Nu) S N2 las bases fuertes como HO-; RO-, H2Nno son buenos grupos salientes María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 85 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Herramientas de la Química Orgánica estado de transición C C σ energía Reacción en la que se elimina el halógeno y el hidrógeno del carbono adyacente (deshidrohalogenación), desaparecen dos enlaces σ y en su lugar se forma un enlace π H π X C 86 (b) Reacciones de eliminación (S.E.), diagrama energético Reacciones de los halogenuros de alquilo: (b) Reacciones de eliminación (S.E.), descripción (I) σ S N2 C productos reactivos reacción HX María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 87 Herramientas de la Química Orgánica (b) Reacciones de eliminación (S.E.), la clasificación María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 88 Herramientas de la Química Orgánica (b) Reacciones de eliminación (E): la reacción E2, el intermedio reacción en un único paso: el nucleófilo actúa como base y arranca un protón del carbono adyacente al halógeno (grupo saliente). Simultáneamente salta el grupo saliente y se forma el doble enlace, orden bimolecular 2 tipos de reacciones de eliminación E2: ciné cinética bimolecular H E1: ciné cinética unimolecular Nu- C C C C + NuH + X- X V = k [Nu-] [RX] María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 89 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 90 15 Herramientas de la Química Orgánica Herramientas de la Química Orgánica (b) Reacciones de eliminación (E): la reacción E1, el intermedio Reacción dos pasos: primero se suelta el nucleófilo del sustrato (el halogeno), formándose el catión y a continuación se produce la salida del protón y la formación del doble enlace, orden unimolecular (b) Reacciones de eliminación (E): la reacción H E1, el mecanismo H C C lento X H Nu V = k [RX] H C La velocidad de la reacción depende de las concentraciones de sustrato únicamente; es independiente de la concentración de nucleófilo. María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 91 C+ C C Nu 92 Herramientas de la Química Orgánica Reacciones de los halogenuros de alquilo: eliminación versus sustitución (I) eliminación ≠ sustitución 1-buteno 2-bromobutano C H+ Herramientas de la Química Orgánica hidrógenos β C María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra (b) Reacciones de eliminación (E): la reacción E1, ¿dónde se produce? (I) hidrógenos β C+ + X - C 2-buteno 2,3-dimetil-1-buteno 2-bromo-2,3-dimetilbutano ácido conjugado 2,3-dimetil-2-buteno María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 93 base conjugada electrófilo nucleófilo María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 94 Herramientas de la Química Orgánica Reacciones de los halogenuros de alquilo: eliminación versus sustitución (I) Reacciones de los halogenuros de alquilo: eliminación versus sustitución (II) Sustitución (S) eliminación ≠ sustitución C H C H C C Nu + X- X + NuC C + NuH + X- Eliminación (E) 1. Estructura del nucleófilo base Dependerá Dependerá de ácido 2. Estructura del sustrato (halogenuro) 3. Condiciones de la reacción María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 95 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 96 16 Herramientas de la Química Orgánica Reacciones de los halogenuros de alquilo: eliminación versus sustitución (III), ejemplos + CN CH 3CH 2CH 2Br - H3C C Compuestos organometálicos • Constituidos por C, H y al menos un átomo de metal (Li, Na, Zn, Cd, Mg) • Reactividad condicionada por la presencia de carbonos nucleofílicos CH 3CH 2CH 2CN CH2 CH3 CH3 + CN - H3C C CH3 - + HCN + Br Br CH3 CH3 H3C C H3C CH3 + H2O Me δ+ electroatrayentes + CH3 + H + Br C - C OH Br C δ− CH2 CH3 H3C Herramientas de la Química Orgánica CH3 - H3C + OH C CH3 + H2O + Br - electrodonantes Br María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 97 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Obtención de organometálicos halogenuro de alquilo Herramientas de la Química Orgánica Organomagnesianos: reactivos de Grignard • Constituidos por C, H, y al menos un halógeno y un átomo de Mg • Reactividad condicionada por la presencia del carbono nucleofílico, el carbono que sustenta el átomo de Mg++ organometálico Metal activo δ+ δ− éter seco R X + Mg María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 98 99 δ− δ++ δ− R MgX María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 100 Herramientas de la Química Orgánica Los carbaniones, características organomagnesianos: el disolvente R • misión del éter R C2H5 O Mg O C2H5 X C2H5 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra X • Reaccionan como sintones negativos sobre centros positivos • Bases fuertes (conjugadas de hidrocarburos, ácidos muy débiles) • Presencia del enlace carbono-metal • Reacción vigorosa con ácidos débiles como H2O ó cualquier compuesto que tenga enlaces O-H, S-H, N-H (por su carácter como base fuerte) funciona como base de Lewis C2H5 Mg 101 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 102 17 Herramientas de la Química Orgánica Herramientas de la Química Orgánica Los alcoholes: clasificación R H R C OH R C R OH H H primario Los alcoholes: propiedades secundario R C zona nucleófila OH R terciario zonas electrófilas Disminuye la reactividad María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 103 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Herramientas de la Química Orgánica Los alcoholes: clasificación Los alcoholes: propiedades y estructura R H • 1. Relacionadas con grupo OH R Puentes de hidrógeno C OH R Reactividad en SN primario • 2. Relacionadas con enlace O-H C R OH H H Basicidad secundario R C OH R terciario Disminuye la reactividad Acidez María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 104 105 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 106 Herramientas de la Química Orgánica Los alcoholes: propiedades y estructura Los alcoholes: propiedades • 1. Relacionadas con grupo OH zona nucleófila Puentes de hidrógeno Basicidad Reactividad en SN • 2. Relacionadas con enlace O-H zonas electrófilas María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Acidez 107 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 108 18 Herramientas de la Química Orgánica Propiedades de los alcoholes ligadas al enlace O-H: la basicidad. presencia de pares de e- libres del oxígeno H H O¨ R + H+ Propiedades de los alcoholes ligadas al enlace O-H: la acidez relacionada con la ruptura del enlace O-H H dadores de protones ión oxonio + O H ¨ H + O H ¨ O¨ H + H H+ Herramientas de la Química Orgánica R-OH R ión alquiloxonio ácidos dé débiles •Actúan como bases de Lewis (donan par electrónico) •Se protonan por acción de ácidos fuertes María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra R-O- + H+ Base conjugada: anió anión alcó alcóxido 109 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Propiedades de los alcoholes ligadas al enlace O-H: la acidez y la estructura (I) la acidez se relaciona con la capacidad que tenga la estructura del alcóxido para “aguantar” la carga negativa generada cuando ha salido el protón R-OH Herramientas de la Química Orgánica Propiedades de los alcoholes ligadas al enlace O-H: la acidez y la estructura (II) Compuesto Estructura Fenol R-O- + H+ Compuesto Estructura pKa Metanol Etanol t-butanol 2,2,2-trifluoroetanol CH3OH 15.5 15.9 18 12.4 CH3CH2OH (CH3)3COH CF3CH2OH 110 pKa 10.0 OH p-nitrofenol O 2N 7.2 OH NO2 Ácido pícrico O2 N OH 0.25 NO2 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 111 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Propiedades de los alcoholes ligadas al enlace O-H: la acidez y la estructura (III) H OH O Influencia de los sustituyentes: mayor contribución a la acidez, cuando retiran hacia si los electrones H H O G - O - F - María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 113 G G O O - H O Ion 2,2,2trifluoroetóxido O aumenta acidez O O O G F F H O H O H O Ion etóxido F F H F OH H H H O Ion etóxido Ion 2,2,2trifluoroetóxido Herramientas de la Química Orgánica Propiedades de los alcoholes ligadas al enlace O-H: la acidez y la estructura (III) Influencia de los sustituyentes: mayor contribución a la acidez, cuando retiran hacia si los electrones H H H 112 G - G María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 114 19 Herramientas de la Química Orgánica Propiedades de los alcoholes ligadas al enlace O-H: la acidez y la estructura (III) Reacciones de los alcoholes Influencia de los sustituyentes: mayor contribución a la acidez, cuando retiran hacia si los electrones OH H H H H O 1. Reacciones como ácidos: obtención de alcóxidos O 2. Reacciones de eliminación: la H O G Ion etóxido G G deshidratación de alcoholes disminuye acidez F F H O F Herramientas de la Química Orgánica - H O Ion 2,2,2trifluoroetóxido G 3. Reacciones de SN: como sustrato y como O O nucleófilo - G 4. Reacciones de oxidación G María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 115 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 1. Los alcoholes como ácidos: los alcóxidos, descripción 116 Herramientas de la Química Orgánica 1. Los alcoholes como ácidos: los alcóxidos, obtención (I) • Bases conjugadas de ácido débil: bases fuertes. • Analogía con Ion hidróxido. • Utilizados como bases. A veces se aíslan como sólidos blancos. • Reacción con K y Na metálicos o con hidruro metálico. • Fenoles sales con NaOH pero alcoholes no. ROH + NaOH RO-Na+ + H2O ácido muy dé débil ONa + H2O OH + NaOH ácido dé débil fenoles > acidez por > estabilidad anió anión fenó fenóxido reacción con bases fuertes tipo hidróxido María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 117 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 1. Los alcoholes como ácidos: los alcóxidos, obtención (II) ROH + NaOH Herramientas de la Química Orgánica 1. Los alcoholes como ácidos: los alcóxidos, obtención (III) RO-Na+ + H2O ROH + NaOH ácido muy dé débil 2 ROH + 2 K 2 ROH + 2 Na 118 RO-Na+ + H2O ácido muy dé débil RO- 2 ROH + 2 K 2 ROH + 2 Na 2 H2 2 RO- Na++ H2 Na Na+ + e- H2 2H+ + 2e- K++ Na 2H+ + 2e- 2 ROH + NaH María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 119 2 RO- K++ H2 2 RO- Na++ H2 Na+ + eH2 RO-Na+ + H2 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 120 20 Herramientas de la Química Orgánica 2. Los alcoholes en reacciones de eliminación: mecanismo de la deshidratación (I) Herramientas de la Química Orgánica 2. Los alcoholes en reacciones de eliminación: mecanismo de la deshidratación (I) hidratació hidratación María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 121 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 122 Herramientas de la Química Orgánica 2. Los alcoholes en reacciones de eliminación: mecanismo de la deshidratación (II) 2. Los alcoholes en reacciones de eliminación: mecanismo de la deshidratación (III) E1 (terciarios) y E2 (primarios) E1 (terciarios) y E2 (primarios) + + H (CH3)3C O H + H (CH3)3C OH CH3CH2 H + (CH3)3C+ + (CH3)3C O H HOH OH + + H + C C O H H2 H2 H H H CH3 + C C H2 CH3 CH3 H2C + H+ CH3 + H2C CH2 + H + HOH María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 123 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica 2. Los alcoholes en reacciones de eliminación: la deshidratación en alcoholes asimétricos (I) Herramientas de la Química Orgánica 2. Los alcoholes en reacciones de eliminación: la deshidratación en alcoholes asimétricos (II) Diagrama energético CH2 H+/calor CH2CH3 H2C OH HOH CH3 + H H H3C energía Cuando se puede deshidratar hacia ambos lados predomina el alqueno más sustituido (más estable). H3C H3C H C 124 CHCH3 CH3 Proporción lig. mayor Alqueno evolución de la reacción María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 125 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 126 21 Herramientas de la Química Orgánica 2. Los alcoholes en reacciones de eliminación: la deshidratación en fenoles Herramientas de la Química Orgánica 3. Los alcoholes en reacciones de sustitución (I) * Sustitució Sustitución por un electró electrófilo fuerte No hay reacción, por imposibilidad de alcanzar el catión fenilo intermedio (catión fenilo lineal: geometría imposible para anillo bencénico) O H electró electrófilo fuerte + H+ + O H H Catión fenilo 127 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra ión oxonio producto sustitució sustitución extraible por base * Sustitució Sustitución por un electró electrófilo débil alcó alcóxido base conjugada electró electrófilo débil producto sustitució sustitución María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 128 Herramientas de la Química Orgánica Herramientas de la Química Orgánica 3. Los alcoholes en reacciones de sustitución (II) 3. Los alcoholes en reacciones de sustitución (III) Mecanismo SN1 (terciarios) y SN2 (primarios) En fenoles no hay reacció reacción, con halogenuros de hidrógeno: Obtención de halogenuros de alquilo (CH 3 ) 3 C + OH H + (CH 3 ) 3 C O + H •En el caso del mecanismo SN1, por imposibilidad de alcanzar el catión fenilo intermedio (catión fenilo lineal: geometría imposible para anillo bencénico). H + (CH3)3C O H (CH3)3C+ + HOH H (CH3)3C+ + Cl- •En el caso de SN2 porque no se puede dar inversión en un anillo aromático. (CH3)3CCl María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 129 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 130 22