quimica compuestos inorganicos
Anuncio

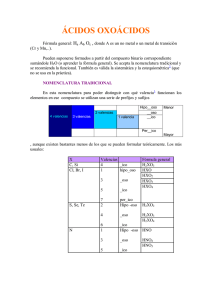
QUIMICA COMPUESTOS INORGANICOS Se dice que existen miles de sustancias químicas inorgánicas, las que están clasificadas en 5 grupos básicos: óxidos, hidróxidos, ácidos, hidruros y sales, y cada sustancias tiene un nombre común y otro sistemático. La nomenclatura química es la parte de la Química que estudia y asigna los nombres a los elementos y compuestos que van apareciendo con los trabajos científicos; básicamente, los nombres de las sustancias químicas juegan un papel muy importante en el lenguaje de la Química, por lo que la nomenclatura es su pie derecho. Tal nomenclatura se basa en leyes al momento de asignar el nombre a una sustancia, las que fueron elaboradas por una Comisión de Nomenclatura de Química Inorgánica de la International Union of Pure and Applied Chemestry (IUPAC), misma que presento, en 1921, un sistema de nomenclatura inorgánica conocido hoy como Sistema de Nomenclatura Tradicional, que ya no es recomendado por este organismo mundial para nombrar varias sustancias. Años después la IUPAC recomendó utilizar el Sistema Stock, en honor a su autor el químico alemán Alfred Stock, muerto en 1946; más tarde aparece el Sistema de Proporciones, recomendado también por la IUPAC, pero como una alternativa u opción al Sistema Stock. Así pues, existen tres sistemas de nomenclatura para utilizarlos sobre las sustancias inorgánicas, todos aprobados por la IUPAC, pero solo dos de ellos son los recomendados: - Sistema Tradicional. Fue el primer sistema de la IUPAC; es obsoleto, pero aun utilizado. - Sistema Stock. Es un sistema moderno; es el sistema oficial de la IUPAC - Sistema de Proporciones o estequiométrico. Es una opción contemporánea de la IUPAC. Se recalca que el nombre de una sustancia proviene de su fórmula y de las recomendaciones enmarcadas en las leyes del sistema de nomenclatura utilizado. Nomenclatura de Óxidos Para nombrar a los Óxidos Básicos solo se utiliza el Sistema Stock; para los Óxidos Ácidos se utiliza el Sistema de Proporciones, pues la IUPAC ya no recomienda utilizar el Sistema Tradicional. ÓXIDOS BÁSICOS. Recuérdese que estas sustancias están formadas por oxígeno y un elemento metal. Al momento de nombrarlos se presentan dos situaciones: - El metal posee una sola valencia (grupos IA, IIA y IIIA de la tabla periódica); entonces, al pronunciar el nombre del Óxido van de primero las palabras Óxido de ...seguidas del nombre del metal. Solo en este caso se emplea el Sistema Tradicional de nomenclatura. Ejemplos: -El metal posee dos o más valencias (grupos IB, y del IV al VIIIB de la tabla periódica); entonces, el nombre se pronuncia igual que la primera situación (Óxido de ..., seguido del nombre del metal), agregándole al final la valencia con que actúa el metal, escrita en números romanos y entre paréntesis; en esta situación se emplea el Sistema de Stock. Ejemplos de metales con dos valencias: ÓXIDOS ÁCIDOS. estas sustancias están formadas por oxígeno y un elemento no-metal, y al momento de nombrarlos se emplea el Sistema de Proporciones o estequiométrico, el cual toma en cuenta el sub-índice (cantidad de átomos) de cada elemento del compuesto químico; este Sistema se auxilia de un conjunto de prefijos, además de la formula, los que denotan o indican la cantidad o proporción de átomos que presentan el oxígeno y el nometal del Óxido ácido. Estos prefijos, que han sido tomados de la lengua griega clásica, se colocan antes de las palabras Óxido de …y antes del nombre del no-metal, los cuales son: Ejemplo: N2O3 esta fórmula está compuesta por tres átomos de oxígeno y dos de nitrógeno; si empleamos prefijos en sustitución de los números o cantidades de átomos, entonces el nombre de este Óxido ácido es trióxido de dinitrógeno. Como se observa, antes de la palabra óxido se colocó el prefijo tri, formándose la palabra Trióxido (tres átomos de Oxígeno), y antes de la palabra nitrógeno se colocó el prefijo di, formándose la palabra dinitrógeno, (dos átomos de nitrógeno). Más ejemplos a continuación: Nomenclatura de Hidróxidos Para nombrar estas sustancias se emplea el Sistema de Stock. Cuando el metal presenta 1 valencia entonces la sustancia se nombra como Hidróxido de…, seguido del nombre del metal. Recuerde que el ion hidroxilo (OH) usa valencia -1. Hidróxidos en los que el metal presenta una valencia NOMENCLATURA DE ÁCIDOS Anteriormente se indicó que los ácidos se clasifican en dos grupos: Oxácidos e Hidrácidos. Oxácidos. Están formados por hidrógeno (ácido), un elemento no-metal y oxígeno; en la actualidad aún se emplea el Sistema Tradicional para nombrar a estos compuestos, mediante el empleo de ciertos prefijos* y sufijos**, así: - Cuando el elemento no-metal posee una valencia entonces puede formar un solo tipo de ácido; tal valencia se toma como la más alta, por lo que se usa el sufijo ico para nombrar este ácido. *prefijo= partícula que va antepuesta (va de primero) a una palabra. **sufijo= partícula que va pospuesta (va de último) a una palabra, a manera de terminación. Ejemplo: se utilizara el Boro: H3BO3 - en este ácido el boro es el no-metal - el Boro actúa con su única valencia +3 - por lo anterior se utiliza el sufijo ico - al nombrar la sustancia se coloca de primero la palabra ácido, seguida del nombre del no-metal con terminación ico, así: Ácido bórico. Ejemplo : el carbono presenta dos valencias, de tal manera que, teóricamente, puede formar 2 tipos de Oxácidos, pero en la naturaleza solo forma uno: el Ácidos carbónico H2CO3 - en este ácido el carbono es el no-metal, - el carbono actúa con su única valencia (+4) para ácidos - por lo anterior se utiliza el sufijo ico - al nombrar la sustancia se coloca de primero la palabra ácido, seguida del nombre del no-metal con terminación ico, así: Ácido carbónico. H2CO2 - en este ácido el carbono actúa con su menor valencia +2 - por lo anterior se utiliza el sufijo oso - al nombrar la sustancia se coloca de primero la palabra ácido, seguida del nombre del no-metal con terminación oso, así: Ácido carbonoso. - Cuando el elemento no-metal tiene dos valencias se usan entonces dos sufijos: ico, para la valencia mayor, y oso, para la valencia menor. Esto significa que el nometal puede originar dos ácidos diferentes. Ejemplo 1: se utilizara el bromo (Br). HBrO3 - en este ácido el bromo (Br) es el no-metal, - el Bromo actúa con su valencia mayor +5 (hay mayor cantidad de átomos de oxígeno). - por lo anterior se utiliza el sufijo ico - al nombrar la sustancia se coloca de primero la palabra ácido, seguida del nombre del no-metal con terminación ico, así: Ácido brómico. HBrO - aquí el bromo actúa con su menor valencia +1, - por lo anterior se utiliza el sufijo oso - al nombrar la sustancia se coloca de primero la palabra ácido, seguida del nombre del no-metal con terminación oso, así: Ácido bromoso. - El elemento no-metal tiene tres valencias. Se emplean los dos sufijos anteriores y un prefijo, así: ico, para la valencia mayor; oso, para la valencia media e hipo...oso, para su menor valencia. Se deduce que el no-metal puede formar tres ácidos diferentes. Ejemplo: se utilizara el Yodo (I). H I O4 - el iodo actúa como no-metal y con su mayor valencia + 7; en este ácido se presenta la mayor cantidad de oxígenos - por lo anterior se utiliza el sufijo ico - al nombrar la sustancia se coloca de primero la palabra ácido, seguida del nombre del no-metal con terminación ico, así: Ácido yódico H I O3 - el iodo actúa con su valencia media +5, por lo que se usa la terminación oso; disminuyen los oxígenos - al nombrar la sustancia se coloca de primero la palabra ácido, seguida del nombre del no-metal con terminación (sufijo) oso, así: Ácido yodoso. H I O - el iodo actúa con su menor valencia +1, por lo que se emplea el prefijo hipo y la terminación (sufijo) oso. Este ácido tiene la menor cantidad de átomos de oxigeno - al nombrar la sustancia se coloca de primero la palabra ácido, luego el prefijo hipo y, a continuación, el nombre del no metal con terminación oso, así: Ácido hipoyodoso. - El no-metal tiene 4 valencias. Se emplean los dos sufijos anteriores y dos prefijos: per…ico para la cuarta valencia (la más alta); ico, para la tercera valencia; oso, para la segunda valencia e hipo...oso, para la primera valencia (la más baja). Ejemplo: el cloro tiene 4 valencias, es decir, puede formar 4 ácidos diferentes. HCLO4 - el cloro es el no-metal y actúa con su valencia más alta +7, pues este ácido tiene la mayor cantidad de oxígenos - para nombrarlo se usa de primero la palabra ácido, luego el prefijo per, seguido del nombre del no-metal con la terminación ico, así: Ácido perclórico. HCLO3 - aquí el cloro actúa con su tercera valencia +5, pues este ácido tiene menos cantidad de oxígenos que el anterior - para nombrarlo se usa de primero la palabra ácido, luego el nombre del no-metal con la terminación ico, así: Ácido clórico. HCLO2 - aquí el cloro usa su segunda valencia +3; se observa que ha disminuido, aun mas, la cantidad de átomos de oxígeno - al nombrarlo se usa primero la palabra ácido, luego el nombre del no-metal con terminación oso, así: Ácido cloroso. HCLO - aquí el cloro emplea su valencia más baja +1; obsérvese que el Oxígeno ha disminuido al máximo - para nombrarlo se usa de primero la palabra ácido, luego el prefijo hipo, seguido del nombre del no-metal con la terminación oso, así: Ácido hipocloroso. En resumen, dependiendo de la cantidad de valencias que presente el elemento no-metal del ácido, entonces así se usaran los prefijos y sufijos siguientes: HIDRÁCIDOS. Resultan de disolver en agua los Hidruros no-metálicos. Algunos autores afirman que se emplea el Sistema Stock para nombrar a estas sustancias, lo cual ya fue presentado en un cuadro de la unidad anterior (unidad 6); sin embargo, de nuevo se hace con el propósito de hacer una observación sobre la nomenclatura de estos ácidos. Obsérvese que en el nombre del Hidrácido (última columna) va colocado de primero la palabra ácido, seguida del nombre del no-metal con terminación hídrico.