Función alcoholes, fenoles y éteres
Anuncio

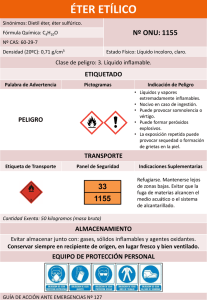
Sesión 18 Tema: ALCOHOLES, FENOLES Y ÉTERES I. Objetivos de la sesión Después de finalizar el estudio de este capítulo Ud. debería ser capaz de: 1) Escribir la fórmula estructural y el nombre de alcoholes, fenoles y éteres simples. 2) Distinguir entre alcoholes, fenoles y éteres. 3) Conocer las principales formas de obtención de los alcoholes, fenoles y éteres 4) Conocer las principales reacciones en que pueden intervenir los alcoholes, fenoles y éteres. II. Contenidos Si agregamos un átomo de oxígeno a una cadena de hidrocarburo tenemos dos posibilidades de hacerlo. O sustituimos un hidrógeno por el grupo –OH, generando un alcohol (R-OH), o colocamos el oxígeno entre dos átomos de carbono y obtenemos el grupo funcional éter (R-O-R). ALCOHOLES. Son compuestos que resultan de la sustitución de átomos de hidrógeno de los hidrocarburos por grupos hidroxilos (-OH). R-H R-O-H Clasificación 1.- Según la ubicación del grupo funcional: a) Alcoholes primarios son aquellos en que el -OH va unido a un carbono primario: H | R-C-O-H | H alcohol primario b ) Alcoholes secundarios son aquellos en que el -OH va unido a un carbono secundario: I. H | R-C-O-H | R’ alcohol secundario e) Alcoholes terciarios son los que llevan el -OH unido a un carbono terciario: R’ | R’’-C-O-H | 2.- Según el número de hidroxilos: R’’’ El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Monoles. Son los alcoholes que poseen un solo grupo funcional. A continuación se da una lista de los primeros términos. CH 3OH metanol alcohol metílico CH 3-CH 2OH etanol alcohol etílico CH 3-CH 2-CH 2OH 1-propanol alcohol propílico normal CH 3-CHOH-CH3 2-propanol alcohol isopropílico CH 3-CH 2-CH 2-CH2OH 1-butanol alcohol butílico normal CH 3-CHOH-CH2-CH3 2-butanol alcohol butílico secundario CH 3-CH-CH2OH | CH3 2-metil-1-propanol alcohol isobutílico CH3 | CH 3-C-OH | CH3 2-metil-2-propanol alcohol butílico terciario CH 3-CH 2-CH 2-CH2-CH2OH 1-pentanol alcohol amílico Dioles. Son los alcoholes que poseen dos grupos funcionales. Se nombran con el nombre del hidrocarburo respectivo terminado en diol. También se les llama glicoles. CH 2OH | CH 2OH etanodiol Glicol ordinario CH 2OH | CHOH | CH 3 1,2 propanodiol propilenglicol CH 2OH | CH 2 | CH 2OH 1,3 propanodiol trimetilenglicol Trioles. Son los alcoholes que llevan tres grupos hidroxilos. Su nombre se compone del nombre del hidrocarburo y la terminación triol. El más importante es la glicerina. CH 2OH | CHOH propanotriol, glicerina, glicerol | CH 20H Polioles. Son los alcoholes que poseen varios grupos OH: CH 2OH - CHOH - CHOH - CH 2OH eritrita, eritrol, butanotetrol CH 2OH - CHOH - CHOH - CHOH - CH2OH arabita, xilita, pentanopentol CH 2OH - CHOH - CHOH - CHOH - CHOH - CH 2OH sorbita, dulcita, manita, hexanohexol El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. FENOLES. Son compuestos hidroxilados en que el grupo funcional va unido a un carbono que forma parte de un anillo aromático. El representante más típico es el fenol ordinario o ácido fénico, derivado del benceno. OH Fenoles derivados del tolueno. Un monol aromático es el alcohol bencílico. C 6H 5-CH 2OH derivado del tolueno. CH2OH También tenemos los metilfenoles o cresoles, de los cuales hay tres isómeros CH 3 CH 3 CH 3 OH OH orto-cresol (o-cresol) meta-cresol (m-cresol) OH para-cresol (p-cresol) Fenoles derivados del naftaleno. Son dos isómeros y reciben el nombre de naftoles: OH OH alfa-naftol ( -naftol) beta-naftol ( -naftol) Fenoles derivados del antraceno. Se les llama antranoles y son tres isómeros, , y , según la posición del grupo OH. OH -antranol Fenodioles. Son los fenoles que poseen dos grupos funcionales OH. Son tres isómeros, orto, meta y para fenodiol, conocidos también como pirocatequina, resorcina e hidroquinona, respectivamente: OH OH OH OH OH pirocatequina resorcina OH hidroquinona Fenotrioles. Son los fenoles con tres grupos funcionales OH. Los dos más importantes son: El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. OH HO OH OH HO pirogalol OH floroglucina Nomenclatura: Para nombrar los alcoholes tenemos dos alternativas: 1. Añadir el sufijo -ol al nombre del hidrocarburo de referencia (p.ej.: propanol) 2. Citar primero la función (alcohol) y luego el radical (p.ej.: alcohol propílico) En compuestos ramificados el nombre del alcohol deriva de la cadena m ás larga que contenga el grupo -OH. Al numerar la cadena se asigna al C unido al -OH el localizador más bajo posible. Cuando el grupo -OH interviene como sustituyente se utiliza el prefijo -hidroxi. En alcoholes cí clicos el carbono unido al -OH ocupa siempre la posición 1. Preparación de al coholes. 1.- Por acción de los hidróxidos alcalinos en solución acuosa sobre compuestos halogenados R-CH2-Cl + NaOH R-CH 2OH + NaCl 2.- Por reducción de aldehidos, cetonas se producen alcoholes primarios y secundarios CH 3-CHO + H2 CH3-CH2OH CH 3-CO-CH 3 + H2 CH 3-CHOH-CH3 Los ácidos también pueden reducirse por acción del hidrógeno a elevadas presiones y en presencia de catalizadores. C12H25OH + H2O C11H23-COOH + 2 H2 El metanol se produce como producto secundario en la destilación de la madera y por esta razón también se le llama alcohol de madera. Sintéticamente se obtiene hidrogenando el monóxido de carbono CH 3OH CO + 2 H2 El etanol se puede obtener por fermentación del almidón de cereales y papas o del azúcar de las melazas con levaduras. Se produce etanol con desprendimiento de dióxido de carbono. C 6H 12O6 (C 6H 10O5)n + H 2O almidón glucosa fermentación 3.- Preparación de fenol. C 6H 12O6 2 C 2H 5OH + 2 CO2 El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Propiedades físicas de los alcoholes. Desde el metanol hasta los butanoles son líquidos de olor agradable y de sabor ardiente. Desde C6 hasta C11 son líquidos oleosos de olor desagradable. Los superiores son sólidos, sin olor ni sabor. Los primeros son muy solubles en agua, propiedad que disminuye al aumentar la cadena. La densidad es inferior a 1. La razón primaria del relativamente alto punto de ebullición del etanol y de sus propiedades como solvente similares a las del agua es la presencia de grupos –OH, que permite la formación de puentes de hidrógeno entre moléculas de etanol. Estos puentes de hidrógeno entre moléculas explican por qué el punto de ebullición del etanol es mucho más alto que el del dimetil éter y por qué el etanol se disuelve en agua. A diferencia del agua, en que cada molécula puede formar dos puentes de hidrógeno, el etanol sólo puede formar uno, por lo que su punto de ebullición es 78ºC, mientras que el del agua es 100ºC. Puentes de hidrógeno: (a) entre moléculas de etanol y (b) entre moléculas de etanol y agua. Propiedades químicas de los alcoholes. 1.- Formación de alcóxidos. El hidrógeno del grupo funcional es reemplazable por metales como Na, K, Ca, formándose alcoholatos o alcóxidos. En esta propiedad los alcoholes se parecen a los ácidos. 2 CH 3ONa + H 2 2 CH 3OH + 2 Na metilato sódico o metóxido de sodio Ar-OH + NaOH Ar-ONa + H2O Fenóxido de sodio 2.- Formación de ésteres. Se combinan con los ácidos produciendo ésteres. H 2O + CH3-COO-CH 2-CH 3 CH 3-CH 2OH + CH3-COOH 3.- Deshidratación. En presencia de agentes deshidratantes, como el ácido sulfúrico concentrado, producen alquenos o éteres, según la temperatura. A 140ºC se produce un éter CH3-CH2-O-CH 2-CH 3 + H 2O 2 CH 3-CH2OH a 180ºC se obtiene un alqueno CH 3−CH2OH CH 2 CH2 + H 2O 4.- Oxidación. Los primeros términos de la serie se oxidan con facilidad. El producto formado depende de la clase de alcohol a) los alcoholes primarios por oxidación débil producen un aldehído y si la acción oxidante es más enérgica producen un ácido MnO 4-1 + H + El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. H-CH2OH H 2O + H-CHO MnO4-1 + H + H-COOH H-CHO Metanal metanoico b) los alcoholes secundarios por oxidación suave producen una cetona CH3-CHOH-CH3 MnO4- + H + H2O + CH3-CO-CH3 En una segunda fase la cetona se oxida a ácido y dióxido de carbono. MnO 4-1 + H+ CH 3-COOH + H2O + CO2 CH 3-CO-CH 3 Si la cetona es mixta la cadena se rompe y se forman dos ácidos CH 3-CH 2-CO-CH2-CH2-CH3 MnO4- + H + CH 3-COOH + CH3-CH2-CH 2-COOH c) los alcoholes terciarios sólo responden a oxidación muy fuerte, descomponiéndose totalmente en CO 2 y H 2O CH3 | CH 3-C-OH + 12 O | CH3 4 CO2 + 5 H2O 5. Formación de haluros de alquilo. R-X + H 2O R-OH + HX 6. Reacción del haloformo. OH | R-CH-CH 3 + I2/NaOH CHI + R-COONa + H 2O + NaI iodoformo En lugar del halógeno e hidróxido se puede usar hipoiodito de Na. 7. Test de Lucas. Se trata de la reacción de un alcohol con HCl en presencia de ZnCl2 como catalizador, para formar el cloruro de acilo respectivo. Sirve para distinguir entre alcoholes primarios, secundarios y terciarios: los primarios reaccionan muy lentamente o no reaccionan (más de 5 min), los secundarios reaccionan en forma lenta (cerca de 5 min), mientras que los terciarios reaccionan en forma muy rápida R-CH2OH + HCl ZnCl2 R-CH 2Cl + H 2O (muy lenta o no se realiza) R-CHOH-R’ + HCl R’’ | R-C-R’ + HCl | ZnCl2 ZnCl2 R-CHCl-R’ + H2O (lenta) R’’ | R-C-R’ + H 2O (muy rápida) | El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. OH Cl 8. Nitración de fenol es OH OH OH NO 2 2 + 2 HNO3 + NO2 Las reacciones de los fenoles son de sustitución el ectrofílica aromáti ca teniendo en cuenta que ya existe el sustituyente –OH. ÉTERES. Se forman por condensación de dos alcoholes, con pérdida de una molécula de agua. R-O-H + R’-O-H R-O-R’ + H 2O Si los dos radicales unidos al oxígeno son iguales el éter es un éter simple (R-O-R). Si los radicales son diferentes, el éter se llama mixto (R-O-R’). Nomenclatura. Se nombran con la palabra éter seguida del o antepuesta al nombre de los radicales unidos al oxígeno, o usando el término oxi entre los nombre de los dos radicales. CH 3-O-CH 3 éter dimetílico o dimetil éter o metoximetano CH3-CH2-O-CH2-CH3 éter dietílico o dietil éter o etoxietano CH3-O-CH2-CH3 éter etilmetílico o etilmetil éter o metoxietano O-CH 2-CH 3 éter etilfenílico o etilfenil éter o etoxibenceno O éter difenílico o difenil éter o fenoxibenceno Los éteres son isómeros estructurales de los alcoholes, aunque poseen propiedades muy diferentes. Por ejemplo, el alcohol etílico tiene un punto de ebullición normal de 78ºC, mientras que el dimetil éter hierve a –24ºC. Una diferencia de 102º. Las propiedades de solvente de ambas moléculas también difieren. El etanol es extremadamente soluble en agua y lo mismo que el agua, disuelve muchas sustancias polares y iónicas. El etanol es un solvente polar. El éter dimetílico, en cambio, es un mal solvente para estas sustancias. Los éteres no pueden formar puentes de hidrógeno porque no tienen grupos –OH disponibles. Un caso particular de éteres son los epóxidos, cuyo esquema es el siguiente: Para nombrarlos se utiliza el prefijo epoxi- seguido del nombre del hidrocarburo correspondiente, e indicando los carbonos a los que está unido el O, con dos localizadores lo más bajos posibles, en caso de que sea necesario. El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Preparación. 1.- Método de Williamson: muy útil para obtener éteres mixtos. Se hace reaccionar un alcoholato con un yoduro de alquilo CH3-O-CH2-CH3 CH 3-CH 2 + Na-O-CH 3 2.- Deshidratación de alcoholes. Se aplica preferentemente a la obtención de éter etílico, a partir de etanol y ácido sulfúrico concentrado como deshidratante a 140º-145ºC. A temperaturas superiores la reacción procede en la dirección de la obtención de eteno. CH 3-CH 2-SO4H + H 2O CH 3-CH 2OH + H2SO4 El sulfato ácido de alquilo que se forma en esta primera etapa reacciona con otra molécula de etanol para formar el éter y liberar el ácido sulfúrico para otra deshidratación CH3-CH2-O-CH2-CH 3 + H2SO4 CH 3-CH 2-SO4H + HO-CH 2-CH3 3.- Epoxidación de alquenos: la acción de un perácido (ácido oxigenado), produce los epóxidos Reacciones. R-O-R’ + HI R’-OH + R-I R-O-R’ + 2 HI R’-I + R-I Los éteres son muy poco reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo. Apertura catalizada por ácido: El nucleófilo ataca al carbono más sustituido. El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Apertura directa por nucleófilo: El nucleófilo ataca al carbono menos sustituido. Alcoholes y éteres de mayor aplicación industrial: - Metanol: Es un líquido incoloro de olor agradable, muy tóxico, al ser ingerido ataca el nervio óptico, produciendo graves trastornos que pueden llevar a la muerte. Se utiliza como materia prima para la obtención de metanal, como disolvente de materias grasas, barnices y lacas, y en la fabricación de resinas sintéticas. También es utilizado como anticongelante en radiadores. - Alcohol Etílico: Es un líquido incoloro, de olor agradable, hierve a 78,3ºC y sus vapores son inflamables. Es uno de los productos de mayor utilización industrial. Se obtiene en gran cantidad por la fermentación de granos, frutas y azúcar de caña. También se prepara a partir del etileno tratado con ácido sulfúrico. El etanol puro se utiliza en la preparación de bebidas alcohólicas y en la fabricación de gran cantidad de productos químicos, perfumes, colorantes y explosivos, también se utiliza como combustible y antiséptico. - Glicerina o propanotriol: Es un líquido más denso que el agua, hierve a 290ºC y se encuentra principalmente formando parte de las grasas animales y vegetales. Cuando se combina con el ácido nítrico, forma varios compuestos, siendo el más importante la nitroglicerina (trinitroglicerina) que por su gran poder explosivo se utiliza en la fabricación de dinamita. Otras utilizaciones son: como humectante, materia prima para la fabricación de acroleína, alcohol alílico y ácido fórmico. - Etilenglicol o etanodiol: Líquido incoloro, viscoso, de sabor dulce, hierve a 197ºC, muy soluble en agua y alcohol. Su utilización es como anticongelante, edulcorante, preparación de resinas y fibras sintéticas (poliéster). El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. - Eter etílico o simplemente éter: Es el compuesto más conocido. Es un líquido incoloro, muy volátil, olor característico, poco soluble en agua. Es un excelente disolvente de sustancias orgánicas. Se usó como anestésico general. Por ser muy volátil e inflamable, su uso es muy limitado. Cuestionario: 1. Distinga entre alcoholes y fenoles dando ejemplos de cada uno. 2. Escriba la fórmula molecular y la fórmula estructural para a. n-propanol b. 2-butanol c. 3-clorociclopentanol d. m-bromofenol e. alcohol bencílico f. o-cresol g. -naftol h. -antranol i. pirocatequina j. resorcina k. hidroquinona l. pirogalol m. floroglicina 3. Escriba ecuaciones para las siguientes reacciones: a. Etanol y Na b. Fenol y NaOH c. Etanol y ácido acético d. Etanol y ácido sulfúrico concentrado a 140ºC e. Etanol y ácido sulfúrico concentrado a 180ºC f. n-propanol y permanganato de potasio en ambiente ácido g. 2-butanol y permanganato de potasio en ambiente ácido h. 2-metil-2-propanol y permanganato de potasio en ambiente ácido i. n-pentanol y HCl j. 2-pentanol y yodo en presencia de NaOH k. fenol y ácido nítrico 4. ¿Cómo distinguiría entre un alcohol primario, uno secundario y uno terciario? El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. 5. Escriba la fórmula molecular y la fórmula estructural para a. dimetil éter b. éter etílico c. metoxietano d. éter feniletílico e. difenil éter f. epoxipropano g. 3,4-epoxihexano 6. Escriba ecuaciones para las siguientes reacciones: a. iodoetano y alcoholato de metilo b. Etanol y ácido sulfúrico c. 2,3-dimetil-2-buteno y perácido acético d. etilmetiléter y ácido iodhídrico e. dietiléter y ácido iodhídrico en exceso en caliente III. Actividad previa. Syllabus sesión 16 IV. Metodología de la sesión. Clase expositiva, de debate y con ejercicios prácticos V. Lectura post-sesión. Por definir El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento.