DEBILIDAD PROXIMAL DE MIEMBROS SUPERIORES Paciente
Anuncio
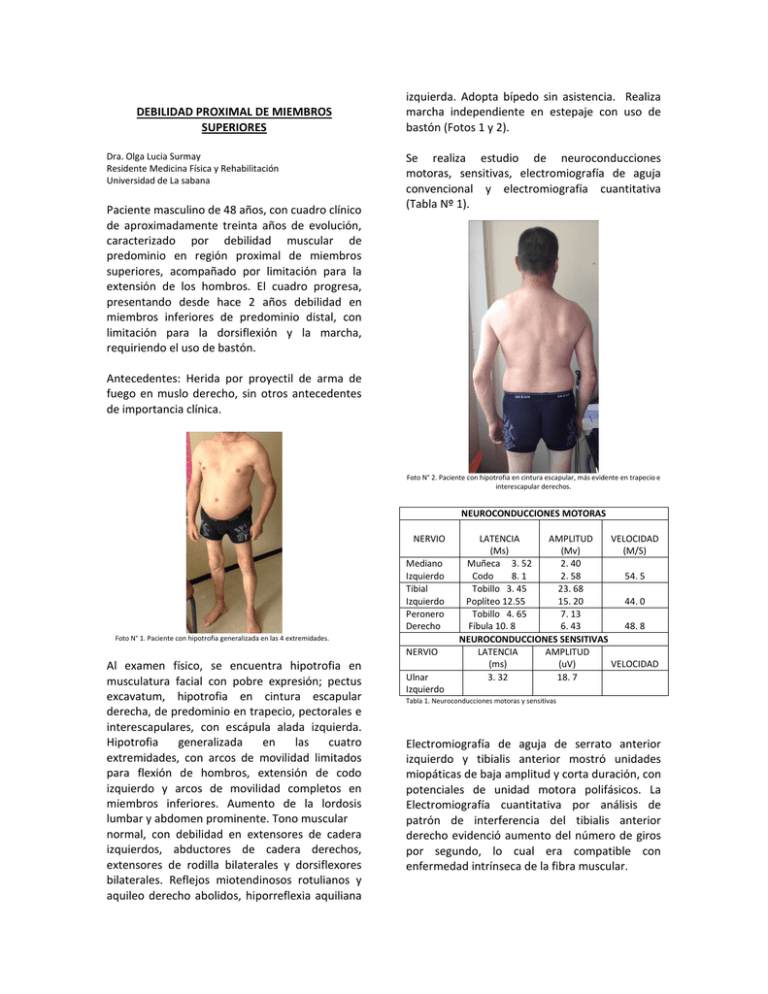
DEBILIDAD PROXIMAL DE MIEMBROS SUPERIORES Dra. Olga Lucia Surmay Residente Medicina Física y Rehabilitación Universidad de La sabana Paciente masculino de 48 años, con cuadro clínico de aproximadamente treinta años de evolución, caracterizado por debilidad muscular de predominio en región proximal de miembros superiores, acompañado por limitación para la extensión de los hombros. El cuadro progresa, presentando desde hace 2 años debilidad en miembros inferiores de predominio distal, con limitación para la dorsiflexión y la marcha, requiriendo el uso de bastón. izquierda. Adopta bípedo sin asistencia. Realiza marcha independiente en estepaje con uso de bastón (Fotos 1 y 2). Se realiza estudio de neuroconducciones motoras, sensitivas, electromiografía de aguja convencional y electromiografía cuantitativa (Tabla Nº 1). Antecedentes: Herida por proyectil de arma de fuego en muslo derecho, sin otros antecedentes de importancia clínica. Foto N° 2. Paciente con hipotrofia en cintura escapular, más evidente en trapecio e interescapular derechos. NEUROCONDUCCIONES MOTORAS NERVIO Mediano Izquierdo Tibial Izquierdo Peronero Derecho Foto N° 1. Paciente con hipotrofia generalizada en las 4 extremidades. NERVIO Al examen físico, se encuentra hipotrofia en musculatura facial con pobre expresión; pectus excavatum, hipotrofia en cintura escapular derecha, de predominio en trapecio, pectorales e interescapulares, con escápula alada izquierda. Hipotrofia generalizada en las cuatro extremidades, con arcos de movilidad limitados para flexión de hombros, extensión de codo izquierdo y arcos de movilidad completos en miembros inferiores. Aumento de la lordosis lumbar y abdomen prominente. Tono muscular normal, con debilidad en extensores de cadera izquierdos, abductores de cadera derechos, extensores de rodilla bilaterales y dorsiflexores bilaterales. Reflejos miotendinosos rotulianos y aquileo derecho abolidos, hiporreflexia aquiliana Ulnar Izquierdo LATENCIA AMPLITUD VELOCIDAD (Ms) (Mv) (M/S) Muñeca 3. 52 2. 40 Codo 8. 1 2. 58 54. 5 Tobillo 3. 45 23. 68 Poplíteo 12.55 15. 20 44. 0 Tobillo 4. 65 7. 13 Fíbula 10. 8 6. 43 48. 8 NEUROCONDUCCIONES SENSITIVAS LATENCIA AMPLITUD (ms) (uV) VELOCIDAD 3. 32 18. 7 Tabla 1. Neuroconducciones motoras y sensitivas Electromiografía de aguja de serrato anterior izquierdo y tibialis anterior mostró unidades miopáticas de baja amplitud y corta duración, con potenciales de unidad motora polifásicos. La Electromiografía cuantitativa por análisis de patrón de interferencia del tibialis anterior derecho evidenció aumento del número de giros por segundo, lo cual era compatible con enfermedad intrínseca de la fibra muscular. ANÁLISIS En este caso, las características clínicas del paciente dadas por debilidad muscular de predominio proximal, hipotrofia muscular de distribución característica, hiporreflexia, alteraciones posturales y de la marcha, asociado a la evidencia de unidades motoras de baja amplitud y corta duración, con potenciales de unidad motora polifásicos y aumento del número de giros por segundo sugieren enfermedad intrínseca de la fibra muscular, que por su distribución se considera que se trata de una distrofia muscular fascioescápulohumeral. La distrofia muscular facioescapulohumeral (FSHD) es una miopatía caracterizada por la atrofia progresiva y debilidad de un conjunto altamente selectivo de músculos, que fue descrita por primera vez por Landouzy y Dejerine en 1884. Es la tercera distrofia más común, después de los distrofinopatías y la distrofia miotónica y su prevalencia es de 1:15.000 a 1:20.000 (1,2). Es un trastorno autosómico dominante, pero hasta el 20% de los casos parecen ser de novo. Aproximadamente el 95% de los pacientes presenta una mutación por deleción del locus D4Z4 en el cromosoma 4q35 con restricción EcoRI o BINI. Durante la deleción de D4Z4, el gen adyacente DUX4 se activa, lo que conduce a una ganancia de función tóxica, que inhibe la miogénesis, sensibiliza a las células a estrés oxidativo e induce la atrofia muscular. Con la confirmación genética se evidencian fenotipos que difieren de las descripciones clásicas de la enfermedad; estos incluyen preservación facial con distrofia escapulohumeral, miopatía distal, debilidad braquial asimétrica, atrofia de miembros inferiores, hemiatrofia, diplejía, atrofia focal unilateral y debilidad axial (2,3). El espectro clínico de FSHD es amplio, desde los individuos asintomáticos y los que tienen mínimos signos clínicos hasta los pacientes que están en silla de ruedas. La edad de aparición es variable, típicamente inicia entre la segunda y tercera década de la vida; más del 90% muestran síntomas a los 20 años de edad. La presentación clínica se caracteriza inicialmente por debilidad facial, por lo general más grave en la musculatura inferior; seguido secuencialmente por debilidad de distribución en cintura escapular, tronco y extremidades inferiores de predominio en músculos del compartimiento anterior de la pierna manifestándose con pie caído. El síntoma inicial más común es la dificultad para llevar los brazos por encima de los hombros, con hombros protruidos, clavículas rectificadas, escápula alada que se evidencia con la flexión de los hombros, debido a la preservación relativa de la porción superior del trapecio y a la debilidad de los músculos romboides. Los músculos bíceps y tríceps suelen estar comprometidos, con preservación del trofismo y fuerza del deltoides y de los músculos del antebrazo, lo que se manifiesta con la aparición del brazo de "Popeye". Dada la debilidad de la musculatura abdominal se presenta un abdomen prominente que contribuye a la hiperlordosis lumbar; los músculos abdominales inferiores son más débiles que los superiores, causando un signo positivo de Beevor, un hallazgo físico bastante específico para FSHD. Los pacientes a menudo se pueden quejar de dolor secundario a compromiso muscular, articular y/o nervioso. Entre las manifestaciones extramusculares, las más comunes son la pérdida auditiva y las telangiectasias retinianas, que se producen en el 75% y el 60% de los individuos afectados respectivamente. Estas manifestaciones suelen ser asintomáticas, aunque pocos pacientes con alteraciones vasculares de la retina pueden desarrollar exudado, dando lugar al desprendimiento de ésta (Síndrome de Coat). La afección cardíaca, dada por arritmias auriculares, se observa en aproximadamente 5% de los pacientes. La enfermedad respiratoria restrictiva que requiere intervención ocurre en aproximadamente el 1% de los pacientes con debilidad muscular severa. Se ha evidenciado compromiso del sistema nervioso central en cuadros de inicio infantil, dado por retraso metal (1-4). Los estudios de laboratorio son útiles para excluir otros diagnósticos. La creatincinasa sérica se puede encontrar leve a moderadamente elevada (1.500 UI/L) (1,2,6). El electrodiagnóstico es menos sensible para la detección de miopatías en comparación con otras enfermedades neuromusculares, rara vez es útil para diferenciar entre los trastornos miopáticos. Las neuroconducciones son normales a no ser que el músculo examinado presente atrofia. La electromiografía de aguja muestra cambios miopáticos crónicos inespecíficos; se pueden encontrar varios tipos de actividad espontánea, incluyendo potenciales agudos positivos, fibrilaciones y descargas miotónicas. La actividad de inserción puede ser normal, aumentada o disminuida dependiendo del tipo de miopatía, la distribución y la etapa de la enfermedad. El patrón de reclutamiento es temprano, con la adición de MUAPs con un bajo nivel de esfuerzo. Las unidades motoras tienen características variables en función de la evolución, pueden tener amplitud baja, polifasia y menor duración. La disminución de la duración de los MUAPs es el indicador más sensible de un proceso miopático y la electromiografía cuantitativa puede ayudar en su detección. La ELECTROMIOGRAFÍA se realiza para la justificación del diagnóstico antes de proceder con la biopsia muscular o las pruebas genéticas (5,6). Los pacientes se diagnostican de acuerdo a los criterios clínicos y de laboratorio del International Consortium on FSHD, los cuales son: 1. Aparición de la enfermedad en musculatura facial y de la cintura escapular; escaso compromiso de músculos extraoculares, faríngeos, linguales y el miocardio; 2. Debilidad facial en más del 50% de los miembros de la familia afectados; 3. Patrón de herencia autosómico dominante en los casos familiares y 4. ELECTROMIOGRAFÍA y biopsia muscular con evidencia de una miopatía sin rasgos característicos de otro diagnóstico (1,2,4,6). variables de discapacidad, pueden presentar limitación para caminar, subir escaleras, agarrar objetos y hasta un 20% de los pacientes llega a requerir uso de silla de ruedas para desplazarse. Una subpoblación de los pacientes con inicio infantil de la FSHD evoluciona con discapacidad severa a una edad temprana. Algunos factores parecen influir en el pronóstico: las mujeres presentan cuadros menos severos y la gravedad aumenta con cada generación subsiguiente. Existe una correlación aproximada entre la severidad de la enfermedad y el tamaño de la deleción (4,7). En relación con los diagnósticos diferenciales, ante un déficit muscular de topografía facioescapulohumeral, se puede considerar una distrofia miotónica de Steinert al encontrarse evidencia clínica y electrofisiológica de miotonía; ante la presencia de retracción de los flexores de los 4 últimos dedos se debería considerar un diagnóstico de miopatía de Bethlem; en el caso de las miopatías congénitas la afectación muscular sería más difusa y de inicio temprano. Un patrón neuropático en la electromiografía puede ser indicativo de amiotrofia espinal de topografía facioescapulohumeral, que no siempre es fácil de diferenciar de la distrofia facioescapulohumeral. Por último, ante un déficit muscular de topografía facioescapulohumeral sin transmisión dominante, se debería considerar la polimiositis, la miastenia y con menor frecuencia la distrofia muscular relacionada con el cromosoma X o el síndrome de Moebius. (8,9). REFERENCIAS 1. Hasta el momento no se cuenta con estrategias terapéuticas eficaces para detener la progresión, la debilidad y/o la atrofia muscular en la FSHD (4). En cuanto al pronóstico, la tasa de progresión es generalmente lenta y constante. Muchos pacientes refieren episodios de recaída, con largos períodos de inactividad interrumpidos por periodos de deterioro rápido que compromete un grupo muscular determinado, a menudo precedida por dolor en la extremidad afectada. La evolución generalmente tiene una relación inversa con la edad de inicio de los síntomas (1). Los individuos afectados desarrollan grados 2. 3. 4. 5. 6. 7. 8. 9. Rabi Tawil, Silve`Re M. Van Der Maarel. Facioscapulohumeral Muscular Dystrophy. Muscle Nerve 34: 1–15, 2006 Johnson Nicholas, Quinn Christine, Eastwood Eileen. Patientidentified disease burden in facioscapulohumeral muscular dystrophy. Muscle Nerve 46: 951–953, 2012 Anhar Hassan, Lyell K Jones, Margherita Milone, Neeraj Kumar. Focal and other unusual presentations of facioscapulohumeral muscular dystrophy. Muscle & nerve September 2012 Lamperti Costanza, Fabbri Greta, Vercelli Liliana. A standardized clinical evaluation of patients affected By facioscapulohumeral muscular dystrophy: The FSHD clinical score. Muscle Nerve 42:213– 217, 2010 Lipa Bethany, Han Jay. Electrodiagnosis in Neuromuscular Disease. Phys Med Rehabil Clin N Am 23 (2012) 565–587 Podnar Simon, Zidar Janez. Sensitivity Of Motor Unit Potential Analysis In Facioscapulohumeral Muscular Dystrophy. Muscle Nerve 34: 451–456, 2006 Stübgen Joerg-Patrick, Stipp Annette. Facioscapulohumeral muscular dystrophy: a prospective study of weakness and functional impairment J Neurol (2010) 257:1457–1464. EMERY A. E. H. : «Emery-Dreifuss muscular dystrophy and other related disorders». Br. Med. Bull., 1989, 45, 3 : 772-787. Milanov I, Ishpekova B. Differential diagnosis of scapuloperoneal syndrome. Electromyogr Clin Neurophysiol. 1997 Mar;37(2):73-8.