Estados de oxidacion de los elementos
Anuncio
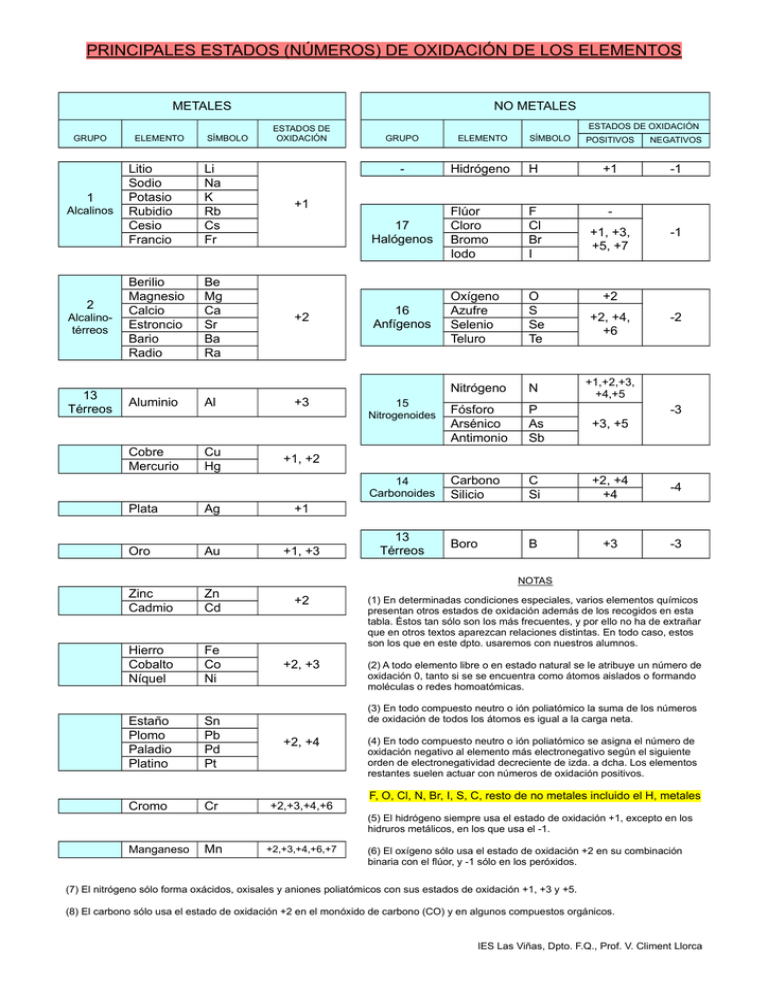
PRINCIPALES ESTADOS (NÚMEROS) DE OXIDACIÓN DE LOS ELEMENTOS METALES GRUPO 1 Alcalinos 2 Alcalinotérreos 13 Térreos ELEMENTO SÍMBOLO Litio Sodio Potasio Rubidio Cesio Francio Li Na K Rb Cs Fr Berilio Magnesio Calcio Estroncio Bario Radio Be Mg Ca Sr Ba Ra Aluminio Al NO METALES ESTADOS DE OXIDACIÓN ESTADOS DE OXIDACIÓN GRUPO ELEMENTO - Hidrógeno 17 Halógenos 16 Anfígenos +1 +2 +3 15 Nitrogenoides Cobre Mercurio Cu Hg SÍMBOLO POSITIVOS NEGATIVOS H +1 -1 Flúor Cloro Bromo Iodo F Cl Br I - Oxígeno Azufre Selenio Teluro O S Se Te Nitrógeno N +1,+2,+3, +4,+5 Fósforo Arsénico Antimonio P As Sb +3, +5 Carbono Silicio C Si +2, +4 +4 -4 Boro B +3 -3 +1, +3, +5, +7 -1 +2 +2, +4, +6 -2 -3 +1, +2 14 Carbonoides Plata Ag +1 Oro Au +1, +3 Zinc Cadmio Zn Cd +2 Hierro Cobalto Níquel Fe Co Ni (1) En determinadas condiciones especiales, varios elementos químicos presentan otros estados de oxidación además de los recogidos en esta tabla. Éstos tan sólo son los más frecuentes, y por ello no ha de extrañar que en otros textos aparezcan relaciones distintas. En todo caso, estos son los que en este dpto. usaremos con nuestros alumnos. +2, +3 (2) A todo elemento libre o en estado natural se le atribuye un número de oxidación 0, tanto si se se encuentra como átomos aislados o formando moléculas o redes homoatómicas. Estaño Plomo Paladio Platino Sn Pb Pd Pt +2, +4 Cromo Cr +2,+3,+4,+6 13 Térreos NOTAS (3) En todo compuesto neutro o ión poliatómico la suma de los números de oxidación de todos los átomos es igual a la carga neta. (4) En todo compuesto neutro o ión poliatómico se asigna el número de oxidación negativo al elemento más electronegativo según el siguiente orden de electronegatividad decreciente de izda. a dcha. Los elementos restantes suelen actuar con números de oxidación positivos. F, O, Cl, N, Br, I, S, C, resto de no metales incluido el H, metales (5) El hidrógeno siempre usa el estado de oxidación +1, excepto en los hidruros metálicos, en los que usa el -1. Manganeso Mn +2,+3,+4,+6,+7 (6) El oxígeno sólo usa el estado de oxidación +2 en su combinación binaria con el flúor, y -1 sólo en los peróxidos. (7) El nitrógeno sólo forma oxácidos, oxisales y aniones poliatómicos con sus estados de oxidación +1, +3 y +5. (8) El carbono sólo usa el estado de oxidación +2 en el monóxido de carbono (CO) y en algunos compuestos orgánicos. IES Las Viñas, Dpto. F.Q., Prof. V. Climent Llorca

