El receptor T (TCR)
Anuncio

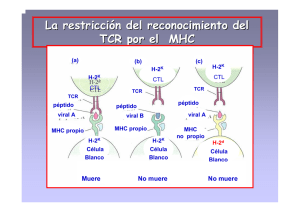
TEMA 10 (II) El receptor T (TCR) El receptor T es un hetero-dímero con una estructura de dominios (V y C) muy similar a la del receptor B y también estabilizado mediante un puente disulfuro. Las regiones transmembrana de ambas cadenas son poco corrientes, pues contienen residuos de aminoácidos (aa.) con carga positiva, lo que les permite interaccionar con las cadenas del complejo receptor que se encargan de la transducción de las señales. La mayor parte de las células T humanas expresan receptores codificados por los genes alfa y beta, que reconocen antígenos peptídicos previamente procesados y presentados en condiciones especiales por células especializadas, llamadas Células Presentadoras de Antígenos (CPAs). Siempre hay excepciones Pero datos iniciales indicaban que ciertas células T reaccionaban con antígenos no peptídicos, lo que no empezó a aclarase hasta que se comprobó que las moléculas CD1 (distintas de las CMH) podían presentar antígenos hidrocarbonados y lipídicos a la subpoblación T gamma-delta. Dicho de otro modo: el dogma “las células T solo reconocen a los antígenos cuando se les presentan procesados y unidos a moléculas del complejo principal e histocompatibilidad (CMH)” es válido para las células T αβ pero no parece serlo para otros tipos de células T. Trabajos estructurales más recientes indican que el receptor γδ puede fijar directamente moléculas proteicas (sin restricción CMH), lo que sugiere que este receptor se parece mucho, desde el punto de vista funcional, a los PRRs de la inmunidad innata. El reconocimiento de antígenos comunes a grupos de microorganismos y su capacidad para unirse a moléculas CMH no clásicas sugiere una respuesta rápida, que es más característica de la inmunidad innata que de la adaptativa. El número de células T γδ circulantes es pequeño, comparado con el de células T αβ, y sus segmentos génicos V tienen una diversidad limitada. Muchas de estas células carecen de CD4 y CD8 y la mayoría expresan la misma pareja de cadenas γδ en su receptor. En los humanos, el receptor predominante que se expresa en las células γδ circulantes reconoce un antígeno, que es un fosfolípido microbiano (3-formil-1-butil pirofosfato), propio de mycobacterium tuberculosis y otras bacterias y parásitos. Esta especificidad para antígenos de patógenos frecuentes apoya la hipótesis de que las γδ actúan como una rama de la inmunidad innata, presentando una respuesta rápida a ciertos antígenos sin necesidad de una fase de procesamiento. Es interesante notar que la especificidad de las células γδ circulantes de ratones, y otras especies estudiadas, no es paralela a la humana, lo que indica que esta respuesta debe dirigirse hacia los patógenos comunes a cada una de las distintas especies animales. EL COMPLEJO RECEPTOR T (TCR) El receptor T, de forma similar al B, se asocia con un grupo de proteínas (denominado aquí CD3). El receptor se encarga del reconocimiento del antígeno, mientras que CD3 se encarga de la transducción de las señales que se producen como consecuencia del reconocimiento. CD3 es un complejo de cinco polipéptidos invariantes que se asocian para formar tres dímeros: γε (gamma-epsilon), δε (delta-epsilon) y ζζ (zeta-zeta) o ζη (zeta-teta). Zeta y teta están codificados en el mismo gene, pero difieren en sus extremos C-terminales debido a diferencias en la maduración del trascrito primario de RNA. Aproximadamente el 90% de los CD3 incorporan el homodímero ζζ y el resto el ζη. Se puede concebir un TCR formado por cuatro dímeros: El heterodímero αβ (o el γδ) del receptor, que determina la especificidad para el ligando, y los dímeros que componen CD3 (γε, δε y ζζ o ζη), que son necesarios para que se exprese el receptor en la membrana durante la maduración de la célula T y para la transducción de señales. Las cadenas γ, δ y ε pertenecen a la SPF de las Ig, con un dominio extracelular seguido por una región transmembrana y un dominio citoplásmico de unos 40 aminoácidos. La cadena ζ tiene una estructura diferente, con una región extracelular muy pequeña (solo 9 aa.), una transmembrana y un tallo citoplásmico largo (113 aa.). Las regiones transmembrana de todas las cadenas de CD3 tienen aa. con carga negativa (aspártico o glutámico) que interaccionan con 1-2 aa. con carga positiva del dominio transmembrana del TCR. Los tallos citoplásmicos de CD3 tienen un motivo ITAM (Immunoreceptor tyrosinebased activation motif) , que también se encuentra en otros receptores (p.e. las cadenas asociadas Igα/Igβ en el BCR). Los ITAM interaccionan con tirosin-kinasas y juegan un papel importante en la transducción de señales. En CD3, las cadenas γ, δ y ε tienen un ITAM, mientras que ζ y η contienen tres copias. Las moléculas accesorias de las células T Son moléculas de superficie Algunas de ellas refuerzan la interacción entre las células T y las células presentadoras (CPAs) o las células blanco, mientras que otras actúan en la transducción de señales y otras, finalmente, en ambos sentidos. Los co-receptores CD4 y CD8 se unen a regiones conservadas de las moléculas de histocompatibilidad (CMH) de Clase II y Clase I, respectivamente. Las células T se pueden dividir en dos subpoblaciones en función de que expresen CD4 o CD8. CD4 y CD8 se clasifican como co-receptores porque reconocen a las moléculas CMH que forman parte del complejo de presentación antigénico y por su papel transductor de señales. Sus dominios extracelulares se unen a regiones conservadas de las moléculas CMH sobre las CPAs o sobe las células blanco. CD4 es un glicopéptido de membrana con 4 dominios extracelulares tipo Ig (D1-D4), una región transmembrana hidrofóbica y un largo tallo citoplásmico que contiene tres residuos de serina (que pueden fosforilarse). CD4 interacciona con las moléculas CMH de Clase II a través del dominio distal que se une a una depresión hidrofílica formada a expensas de residuos de los dominios α2 y β2 de la moléculas Clase II. CD4 facilita la transducción de señales y la activación de las células T que reconocen complejos Péptido-Clase II. CD8 se presenta como hetero-dímero (αβ) o como homo-dímero (αα), estabilizados mediante un puente disulfuro. Las cadenas son pequeñas y cada una tiene un dominio tipo Ig extracelular, una región transmembrana hidrofóbica y un tallo citoplásmico de 27-29 residuos, entre los que hay varios capaces de fosforilarse. CD8 contacta con los dominios α2 y α3 de la molécula Clase I (también tiene algún contacto con β2microglobulina) La afinidad del TCR por los complejos péptido-CMH aumenta gracias a los coreceptores La afinidad entre TCR y el complejo péptido-CMH es de afinidad baja a media (Kd 10-4 a 10-7 M) si se compara con la de la unión antígeno-anticuerpo (Kd 10-6 a 10-10 M). Sin embargo, las interacciones no dependen solo del TCR, pues las moléculas de adhesión aumentan la fuerza de la unión. Las células T tienen varias moléculas de adhesión (CD2, LFA-1, CD28 y CD45R) que se fijan, con independencia de otros ligandos, sobre las moléculas complementarias de las CPAs o de las células blanco. Una vez establecido el contacto célula-célula, a través de las moléculas de adhesión, el receptor T puede explorar la membrana de la otra célula en busca de complejos péptido-CMH. Durante la activación de la célula T, por la detección de un complejo particular péptido-CMH, hay un aumento transitorio de su expresión de moléculas de adhesión que permite un contacto más estrecho entre las células y la transferencia efectiva de citocinas o sustancias tóxicas. Al poco tiempo de la activación, disminuye el nivel de moléculas de adhesión y la célula T se desprende de la CPA o de la célula blanco correspondiente. Como ocurre con CD4 y CD8, algunas moléculas de adhesión también actúan como co-estimuladoras y transductoras de señales.