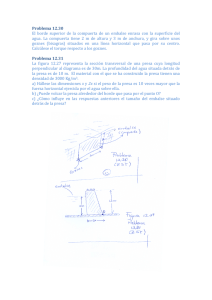
CALIDAD DEL AGUA DEL EMBALSE DE LA PRESA LA VEGA Y SU
Anuncio

CALIDAD DEL AGUA DEL EMBALSE DE LA PRESA LA VEGA Y SU IMPACTO EN LAS TIERRAS AGRÍCOLAS BAJO RIEGO CELIA DE LA MORA OROZCO, HUGO ERNESTO FLORES LOPEZ, ALVARO AGUSTIN CHAVEZ DURAN Centro de Investigación Regional Pacífico Centro Campo Experimental Centro Altos de Jalisco Tepatitlán de Morelos, Jalisco Noviembre de 2013 Libro Técnico Núm. 6 ISBN: 978-607-37-0186-0 Directorio Institucional SECRETARÍA DE AGRICULTURA, GANADERÍA, DESARROLLO RURAL, PESCA Y ALIMENTACIÓN LIC. ENRIQUE MARTÍNEZ Y MARTÍNEZ Secretario LIC. JESÚS AGUILAR PADILLA Subsecretario de Agricultura PROF. ARTURO OSORNIO SÁNCHEZ Subsecretario de Desarrollo Rural LIC. RICARDO AGUILAR CASTILLO Subsecretario de Alimentación y Competitividad ING. JAVIER GUÍZAR MACÍAS Delegado de la SAGARPA en Jalisco INSTITUTO NACIONAL DE INVESTIGACIONES FORESTALES, AGRÍCOLAS Y PECUARIAS DR. PEDRO BRAJCICH GALLEGOS Director General DR. SALVADOR FERNÁNDEZ RIVERA Coordinador de Investigación, Innovación y Vinculación MSC. ARTURO CRUZ VÁZQUEZ Coordinador de Planeación y Desarrollo LIC. LUIS CARLOS GUTIÉRREZ JAIME Coordinador de Administración y Sistemas LIC. MARÍA DEL CARMEN SANTILLANA ANDRACA Director General Adjunto de la Unidad Jurídica CENTRO DE INVESTIGACIÓN REGIONAL PACÍFICO CENTRO DR. JOSE ANTONIO RENTERIA FLORES Director Regional del CIRPAC DR. GERARDO SALAZAR GUTIERREZ Director de Investigación MC. PRIMITIVO DÍAZ MEDEROS Director de Planeación y Desarrollo LIC. MIGUEL MÉNDEZ GONZÁLEZ Director de Administración MC.RAMÓN HERNANDEZ VIRGEN Jefe del Campo Experimental Centro Altos de Jalisco CALIDAD DEL AGUA DEL EMBALSE DE LA PRESA LA VEGA Y SU IMPACTO EN LAS TIERRAS AGRICOLAS BAJO RIEGO Dra. Celia DE LA MORA OROZCO Investigador C.E. Centro Altos Jalisco CIRPAC-INIFAP Dr. Hugo Ernesto FLORES LOPEZ Investigador C.E. Centro Altos Jalisco CIRPAC-INIFAP M.C. Álvaro Agustín CHÁVEZ DURÁN Investigador C.E. Centro Altos Jalisco CIRPAC-INIFAP Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias Centro de Investigación Regional Pacífico Centro Campo Experimental Centro Altos de Jalisco Tepatitlán de Morelos Jalisco, México Libro Técnico Núm. 6 ISBN: 978-607-37-0186-0 Noviembre de 2013 CALIDAD DEL AGUA DEL EMBALSE DE LA PRESA LA VEGA Y SU IMPACTO EN LAS TIERRAS AGRICOLAS BAJO RIEGO No está permitida la reproducción total o parcial de esta publicación, ni la transmisión de ninguna forma o por cualquier medio, ya sea electrónico, mecánico, fotocopia, por registro u otros métodos, sin el permiso previo y por escrito a la Institución. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias Progreso Núm. 5. Colonia Barrio de Santa Catarina Delegación Coyoacán, C.P. 04010, México, D.F. Tel. (55) 38718700 www.inifap.gob.mx Primera Edición: 2013 Impreso en México ISBN: 978-607-37-0186-0 Libro Técnico Núm. 6 Noviembre de 2013 CAMPO EXPERIMENTAL CENTRO ALTOS DE JALISCO CIRPAC- INIFAP Kilómetro 8.0 Carretera Tepatitlán Lagos de Moreno Apartado Postal 56 Tepatitlán de Morelos, Jalisco., México. C.P. 47600 Teléfono (378) 7820355 Fax (378) 7824638 La presente publicación se terminó de imprimir el mes de Noviembre de 2013 en los talleres Gráficos de Prometeo Editores, S.A. de C.V. Libertad 1457, Colonia Americana, Guadalajara Jalisco CP.44160 Tel.01(33) 38262726. Su tiraje consta de 1000 ejemplares La cita correcta de esta obra es: De La Mora, O.C., H.E. Flores L. y Durán Ch., A.A. 2013. Calidad del agua del embalse de la presa La Vega y su impacto en las tierras agrícolas bajo riego. Libro Técnico Núm. 6 Campo experimental Centro-Altos de Jalisco, México. 168 p. CONTENIDO Página 1. INTRODUCCIÓN ............................................................................... 1 2. ANTECEDENTES .............................................................................. 2 2.1. Importancia de la calidad del agua .................................................. 2 2.2. Estudios previos en la presa La Vega ............................................. 4 2.3. Parámetros de calidad del agua, importancia para la vida acuática, riego agrícola y el medio ambiente. ........................................................ 9 2.3.1. Temperatura ............................................................................. 9 2.3.2. pH ............................................................................................ 9 2.3.3. Conductividad eléctrica .......................................................... 11 2.3.4. Oxígeno Disuelto .................................................................... 12 2.3.5. Turbiedad ............................................................................... 12 2.3.6. Durezas .................................................................................. 13 2.3.7. Solidos disueltos totales ......................................................... 15 2.3.8. Cloruros.................................................................................. 15 2.3.9. Sulfatos .................................................................................. 17 2.3.10. Alcalinidad (carbonatos y bicarbonatos) ............................... 17 2.3.11. Nitrógeno.............................................................................. 20 2.3.12. Compuestos de fósforo ........................................................ 27 2.3.13. Riesgo por sodio (la proporción relativa de los iones de sodio, calcio y magnesio). .......................................................................... 28 2.3.14. Carbonato Sódico Residual (CSR) ....................................... 30 2.3.15. Elementos Químicos ............................................................ 30 2.3.16. Coliformes fecales y totales .................................................. 32 2.3.17. Análisis Taxonómico y Cuantitativo del Plancton .................. 33 2.4. Efecto de la calidad del agua sobre la productividad agrícola ....... 33 2.4.1. Salinidad del suelo y su efecto en los cultivos ........................ 35 2.4.2. Manejo de agua salina para riego........................................... 39 2.4.3. La salinidad en la producción de caña de azúcar ................... 39 2.4.4. Unidades de salinidad en el agua ........................................... 40 2.4.5. Efecto del Boro en los cultivos ................................................ 41 2.4.6. Deficiencia de boro en las plantas .......................................... 42 2.4.7. Toxicidad por boro en las plantas ........................................... 43 3. JUSTIFICACIÓN .............................................................................. 45 4. PROBLEMÁTICA ............................................................................. 47 5. OBJETIVO ....................................................................................... 47 6. METODOLOGÍA .............................................................................. 48 6.1. Descripción del área de estudio .................................................... 48 i 6.2. Metodología para el análisis de agua ............................................ 50 6.3. Análisis de resultados de agua...................................................... 54 6.3.1. Determinación del Índice de Calidad del Agua (ICA) .............. 54 6.3.2. Metodología para la determinación del riesgo por salinidad (SAR) y carbonato sódico residual (CSR) en agua para uso en riego agrícola ............................................................................................ 58 6.3.3. Análisis comparativo con criterios establecidos para aguas de irrigación. ......................................................................................... 60 6.3.4. Utilización de estadística básica descriptiva y otras herramientas para la representación gráfica de la información en los resultados de muestras de agua ...................................................... 61 6.4. Muestreo de suelos ....................................................................... 61 6.4.1. Análisis de la condición de salinidad y contenido de boro en el suelo. 62 6.4.2. Muestreo de plantas ............................................................... 63 6.4.3. Análisis de información ........................................................... 64 7. RESULTADOS ............................................................................. 65 7.1. Índice de Calidad del Agua (ICA) .................................................. 65 7.2. Riesgo por salinidad (contenido total de sal soluble) ..................... 67 7.2.1. Conductividad........................................................................ 67 7.3. Riesgo por sodio (la proporción relativa de los iones de sodio, calcio y magnesio). ........................................................................................ 69 7.3.1. Proporción de Sodio Absorbido (SAR, Sodium Absorption Ratio por sus siglas en inglés) ................................................................... 69 7.3.2. Carbonato Sódico Residual (CSR) ......................................... 72 7.3.3. pH .......................................................................................... 75 7.3.4. Alcalinidad (carbonatos y bicarbonatos) ................................. 76 7.4. Iones específicos; (Cloruros, sulfatos, boro y nitratos) .................. 77 7.4.1. Cloruros.................................................................................. 77 7.4.2. Sulfatos .................................................................................. 80 7.4.3. Boro ....................................................................................... 82 7.4.4. Nitritos y Nitratos .................................................................... 85 8. OTROS PARÁMETROS DE IMPORTANCIA DE LA CALIDAD DE AGUA................................................................................................... 88 8.1. Temperatura ................................................................................. 88 8.2. Oxígeno Disuelto........................................................................... 90 8.3. Turbiedad ...................................................................................... 91 8.4. Dureza expresada en Grados hidrométricos franceses ................. 93 8.4.1. Nitrógeno Total ....................................................................... 94 8.4.2. Nitrógeno Amoniacal .............................................................. 95 ii 8.5. Compuestos de fósforo ................................................................. 97 8.6. Solidos disueltos totales ................................................................ 99 8.7. Elementos Tóxicos y Metales Pesados ....................................... 101 8.7.1. Arsénico ............................................................................... 101 8.8. Organismos................................................................................. 102 8.9. Análisis Taxonómico y Cuantitativo del Plancton......................... 104 8.9.1. Plancton en cuerpos de agua ............................................... 104 9. COMPARACIÓN CON LOS CRITERIOS ECOLÓGICOS DE CALIDAD DEL AGUA CE-CCA-001/89 .............................................. 106 9.1. Calidad de agua para riego agrícola............................................ 107 9.2. Calidad de agua de riego para protección de la vida acuática ..... 109 9.3. Calidad de agua para acuacultura ............................................... 111 9.4. Recomendaciones para la mitigación de contaminantes en el agua de la presa La Vega (Boro y Arsénico). .............................................. 112 9.4.1. Plantas de tratamiento de aguas residuales domésticas en comunidades en el área de influencia de la presa La Vega. ........... 112 9.4.2. Bioremediacion (humedales) ................................................ 112 9.4.3. Osmosis inversa ................................................................... 114 9.4.4. Resina macroreticular........................................................... 115 10. RESULTADOS Y DISCUSIÓN DEL ANÁLISIS DE SUELOS IRRIGADOS CON AGUA DE LA PRESA LA VEGA ........................... 116 10.1. Parámetros de suelo ................................................................. 116 10.1.1. Materia Orgánica (MO) ....................................................... 117 10.1.2. Textura ............................................................................... 117 10.1.3. Contenido de aniones y cationes ........................................ 117 10.1.4. Conductividad eléctrica ...................................................... 118 10.1.5. pH en el extracto de saturación .......................................... 120 10.1.6. Boro ................................................................................... 123 10.2. Distribución espacial de parámetros de suelo ........................... 125 10.2.1. Materia Orgánica (MO) ....................................................... 125 10.2.2. Textura ............................................................................... 127 12.2.3. Conductividad eléctrica ...................................................... 132 10.2.4. pH en el extracto de saturación .......................................... 134 10.2.5. Boro ................................................................................... 136 10.3. Contenido de Boro en la caña de azúcar................................... 139 11. Recomendaciones para el manejo de los problemas de toxicidad por boro y salinidad .................................................................................. 140 11.1. Lavado de Boro ......................................................................... 140 11.2. Cambio a un cultivo más tolerante al boro ................................. 142 11.3. Prácticas culturales ................................................................... 145 iii 13.4. Combinar el agua de riego con agua con menor cantidad de iones tóxicos 148 12. CONCLUSIONES ........................................................................ 149 13. BIBLIOGRAFÍA CONSULTADA ................................................... 153 iv INDICE DE FIGURAS FIGURA 2.1.ESCALA DE PH QUE SE PUEDE ENCONTRAR EN LOS DIVERSOS COMPUESTOS.............................................................................................. 10 FIGURA 2. 2. CICLO DEL NITRÓGENO. .................................................................... 21 FIGURA 2. 3. DEFICIENCIA DE BORO EN A) REMOLACHA Y B) PAPA. FUENTE:SHARMA, 2006. ......................................................................................................... 42 FIGURA 2. 4. SÍNTOMAS DE TOXICIDAD POR BORO EN CAÑA DE AZÚCAR. ................. 45 FIGURA 6. 1. PRESA LA VEGA Y SU ÁREA DE INFLUENCIA (CEA, 2012) ..... 49 FIGURA 6. 2. ÁREA DE DRENAJE DEL EMBALSE DE LA PRESA LA VEGA...... 50 FIGURA 6. 3. SITIOS DE MUESTREO SELECCIONADOS, AFLUENTES A LA PRESA LA VEGA, DENTRO DE LA PRESA, RIO AMECA Y LA RED DE CANALES DE RIEGO............................................................................................ 52 FIGURA 6. 4. SITIOS DE MUESTREO DE SUELO EN EL ÁREA DE DRENAJE DEL EMBALSE DE LA PRESA LA VEGA...................................................... 63 FIGURA 7. 1.F RESULTADOS DE LA DETERMINACIÓN DEL ICA, EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO. ....................................................................... 66 FIGURA 7. 2. VALORES DE CONDUCTIVIDAD ELÉCTRICA EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RED DE CANALES DE RIEGO Y EL RIO AMECA. ......................................................................................... 68 FIGURA 7. 3. VALORES DE SAR ENCONTRADOS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO............................................................................................ 70 FIGURA 7. 4. REPRESENTACION ESPACIAL DE LOS VALORES DE SAR ENCONTRADOS EN LOS AFLUENTES A LA PRESA Y DENTRO DE LA PRESA LA VEGA. ....................................................................................... 71 FIGURA 7. 5. REPRESENTACION ESPACIAL DE LOS VALORES DE SAR ENCONTRADOS EN LA RED DE CANALES DE RIEGO. ........................... 72 FIGURA 7. 6. VALORES DE CSR ENCONTRADOS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y LA RED DE CANALES DE RIEGO............................................................................................ 73 FIGURA 7. 7. VALORES DE CSR ENCONTRADOS EN LOS DIVERSOS SITIOS DE MUESTREO DENTRO DE LA PRESA Y SUS AFLUENTES......................... 74 FIGURA 7. 8. VALORES DE CSR ENCONTRADOS EN LOS DIVERSOS SITIOS DE MUESTREO, EN EL RIO AMECA Y LA RED DE CANALES DE RIEGO. ........ 75 v FIGURA 7. 9. VALORES DE PH ENCONTRADOS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y LA RED DE CANALES DE RIEGO............................................................................................ 76 FIGURA 7. 10. VALORES DE ALCALINIDAD TOTAL OBTENIDOS EN AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y LA RED DE CANALES DE RIEGO. ...................................................................................... 77 FIGURA 7. 11. CONCENTRACIÓN DE CLORUROS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA, RIO SALADO Y RED DE CANALES DE RIEGO. ....................................................................... 79 FIGURA 7. 12. CONCENTRACIÓN DE SULFATOS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO............................................................................................ 81 FIGURA 7. 13. CONCENTRACIÓN DE BORO EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA, RIO SALADO Y RED DE CANALES DE RIEGO............................................................................................ 83 FIGURA 7. 14. DISTRIBUCIÓN ESPACIAL DE LAS CONCENTRACIONES DE BORO EN LA PRESA LA VEGA Y SUS PRINCIPALES AFLUENTES. .................... 84 FIGURA 7. 15. DISTRIBUCIÓN ESPACIAL DE LAS CONCENTRACIONES DE BORO EN LA RED DE CANALES DE RIEGO Y RIO AMECA. .............................. 84 FIGURA 7. 16. CONCENTRACIÓN DE NITRITOS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA, RIO SALADO Y RED DE CANALES DE RIEGO. ....................................................................... 86 FIGURA 7. 17. CONCENTRACIÓN DE NITRATOS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA, RIO SALADO Y RED DE CANALES DE RIEGO. ....................................................................... 87 FIGURA 8. 1. TEMPERATURA (ºC) OBSERVADA EN LOS AFLUENTE A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO. ...... 89 FIGURA 8. 2. CONCENTRACIÓN DE OXÍGENO DISUELTO EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA, RIO SALADO Y RED DE CANALES DE RIEGO. ....................................................................... 90 FIGURA 8. 3. UNIDAD NEFELOMÉTRICA DE TURBIDEZ (UNT) EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO. ....................................................................... 92 FIGURA 8. 4. GRADOS HIDROMÉTRICOS FRANCESES (DUREZAS) EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA, RIO SALADO Y LA RED DE CANALES DE RIEGO. ........................................ 93 FIGURA 8. 5. CONCENTRACIÓN DE TKN EN LOS AFLUENTES, DENTRO DE LA PRESA, RIO AMECA Y RED CANALES DE RIEGO. ................................. 95 vi FIGURA 8. 6. CONCENTRACIÓN DE NITRÓGENO AMONIACAL EN LOS DIFERENTES SITIOS DE MUESTREO, AFLUENTES, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO. ........................................ 96 FIGURA 8. 7. CONCENTRACIÓN DE FÓSFORO TOTAL EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CALANES DE RIEGO............................................................................................ 98 FIGURA 8. 8. CONCENTRACIÓN DE ORTOFOSFATOS EN LOS AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO............................................................................................ 99 FIGURA 8. 9. SOLIDOS DISUELTOS TOTALES EN LAS MUESTRAS DE AGUA, AFLUENTES A LA PRESA, DENTRO DE LA PRESA, RIO AMECA Y RED DE CANALES DE RIEGO. ..................................................................... 100 FIGURA 8. 10. GÉNERO Y/O ESPECIES DE FITOPLANCTON IDENTIFICADAS EN LAS MUESTRAS DE AGUA DE LOS DIFERENTES SITIOS DE MUESTREO DENTRO DE LA PRESA LA VEGA. .................................................... 105 FIGURA 9. 1. HUMEDAL PARA EL TRATAMIENTO DE AGUAS RESIDUALES DOMÉSTICAS. ............................................................................... 113 FIGURA 9. 2. RESINA DE INTERCAMBIO IÓNICO PARA LA REMOCIÓN DE METALES PESADOS EN AGUA. .........¡ERROR! MARCADOR NO DEFINIDO. FIGURA 10. 1.INTERACCIÓN ENTRE LA CE EN LAS PROFUNDIDADES DE 0 A 5 CM Y 5 A 35 CM DE PROFUNDIDAD. ................................................ 118 FIGURA 10. 2. ...................................................................................... 120 FIGURA 10. 3. INTERACCIÓN ENTRE EL PH EN LAS PROFUNDIDADES DE 0 A 5 CM Y 5 A 35 CM DE PROFUNDIDAD. ................................................ 121 FIGURA 10. 4. INFLUENCIA DEL PH SOBRE LA DISPONIBILIDAD DE NUTRIMENTOS PARA LAS PLANTAS Y EL RANGO DE 7.2 A 8.3 QUE LA MAYOR PARTE DE LOS SUELOS DE LA ZONA DE RIEGO DE LA PRESA LA VEGA. ......................................................................................... 122 FIGURA 10. 5. ...................................................................................... 123 FIGURA 10. 6. ...................................................................................... 125 FIGURA 10. 7. DISTRIBUCIÓN DEL CONTENIDO DE MATERIA ORGÁNICA DE SUELO EN LA PROFUNDIDAD DE: A) 0 A 5 Y B) 5 A 35 CM DEL ÁREA DE RIEGO DE LA PRESA LA VEGA, DE AMECA, JALISCO......................... 127 FIGURA 10. 8. DISTRIBUCIÓN DEL CONTENIDO DE ARCILLA EN EL SUELO EN LA PROFUNDIDAD DE A) 0 A 5 Y DE B) 5 A 35 CM DEL ÁREA DE RIEGO DE LA PRESA LA VEGA, DE AMECA, JALISCO. ...................................... 130 vii FIGURA 10. 9. DISTRIBUCIÓN DEL CONTENIDO DE ARENA EN EL SUELO EN LA PROFUNDIDAD DE A) 0 A 5 Y DE B) 5 A 35 CM DEL ÁREA DE RIEGO DE LA PRESA LA VEGA, DE AMECA, JALISCO. ........................................... 131 FIGURA 10.10. DISTRIBUCIÓN DE LA CONDUCTIVIDAD ELÉCTRICA DEL SUELO EN LA PROFUNDIDAD DE 0 A 5 Y DE 5 A 35 CM DEL ÁREA DE RIEGO DE LA PRESA LA VEGA, DE AMECA, JALISCO. ........................................... 134 FIGURA 10. 11. DISTRIBUCIÓN DEL PH DEL SUELO EN LA PROFUNDIDAD DE 0 A 5 Y DE 5 A 35 CM DEL ÁREA DE RIEGO DE LA PRESA LA VEGA, DE AMECA, JALISCO. ......................................................................... 135 FIGURA 10. 12. DISTRIBUCIÓN DEL CONTENIDO DE BORO DEL SUELO EN LA PROFUNDIDAD DE 0 A 5 Y DE 5 A 35 CM DEL ÁREA DE RIEGO DE LA PRESA LA VEGA, DE AMECA, JALISCO. ........................................... 139 FIGURA 11. 1. EFECTO DE LA FORMA DEL SURCO EN LA GERMINACIÓN DE CULTIVOS Y DESARROLLO DE CULTIVOS (ACEVES, 2011). ............... 147 viii 1. INTRODUCCIÓN El agua es uno de los recursos naturales más importantes relacionados directamente a la calidad de vida de la población y un recurso primordial para el funcionamiento de los sistemas productivos agropecuario y/o industrial. Ha sido considerado un bien público de acceso libre, sin embargo recientemente se ha tomado conciencia de su escasez y ahora es considerado como uno de los factores limitantes más importantes para la mayoría de las actividades económicas. En México existen 14,000 cuerpos de agua (naturales y artificiales) la mayoría localizados en la zona centro occidente del país, específicamente en los estados de Jalisco y Michoacán, siguiendo en importancia la región centro sur y norte. Dentro de los sistemas laguneros se incluyen a los embalses naturales y artificiales, sin embargo los embalses artificiales se destacan por su abundancia. Los embalses artificiales son construidos para almacenar agua durante la estación lluviosa y para distribuirla durante la estación seca, ocupan 67.1% de los cuerpos de agua y cubren 188,781 hectáreas, lo cual representa el 14.7% de la superficie inundada de aguas continentales (De La Lanza, 2002). El almacenamiento de agua, resuelve los requerimientos y necesidades de agua para diversas actividades de los núcleos urbanos y agropecuarias. Sin embargo, los cuerpos de agua responden de manera diferente de acuerdo a las condiciones físicas, geológicas y químicas del lugar y son el reflejo de las actividades que se llevan a cabo en la cuenca de influencia. La calidad del agua es un factor crítico para los cultivos, el conocimiento de la misma, sirve para predecir y manejar el efecto de los contaminantes presentes como es el caso de las sales, las cuales pueden impactar de manera negativa a los diferentes cultivos lo que se refleja en su rendimiento. En general, la calidad del agua de riego es un factor crítico para entender que prácticas de manejo es necesario cambiar o mejorar para mantener la productividad del suelo y el rendimiento del cultivo a largo plazo. En este sentido, la calidad del agua de un cuerpo de agua puede disminuir por diversas fuentes contaminantes. El caso específico de la 1 presa La Vega, embalse utilizado principalmente para riego agrícola, donde los productores han experimentado bajas en los rendimientos de caña de azúcar en los terrenos que son irrigados con agua del embalse. Se aprecia la presencia sales en la superficie del suelo, en voz de los agricultores de la zona que utilizan el agua de este embalse, la productividad de sus parcelas ha disminuido, pero es en los últimos años cuando se ha observado el mayor deterioro. Este problema se intensifica en los meses de primavera y verano, antes del comienzo del temporal de lluvia, por la evaporación del agua de riego lo cual favorece que las sales afloren a la superficie. Atendiendo la demanda de los productores para identificar con certeza el origen del problema en los terrenos agrícolas irrigados con agua de la presa La Vega, el INIFAP propuso la realización de un diagnóstico que diera respuesta a las preguntas que se han generado al respecto. En este documento se presentan los resultados del diagnóstico de la evaluación de la calidad del agua de la presa La Vega, sus afluentes, la red de canales de riego, así como las condiciones que guardan los terrenos agrícolas que utilizan el agua del embalse como agua de riego. Así mismo, se presentan algunas recomendaciones tanto para mejorar la calidad de agua de riego, como para restaurar y conservar los suelos en condiciones favorables para mejorar el rendimiento de los cultivos. 2. ANTECEDENTES 2.1. Importancia de la calidad del agua Los estándares de calidad de agua de un país proveen la base para el control de actividades contaminantes y sirven como guías para identificar niveles tróficos y desarrollar criterios de calidad. Estos pueden ser utilizados para tratar con las fuentes existentes de contaminación de manera sistemática, pero no fueron diseñados para predecir las necesidades de cambio asociados con las actividades que provoca el crecimiento económico el desarrollo de las cuencas 2 hidrográficas y otros efectos a largo plazo. Por esta razón es importante desarrollar estándares de calidad de agua adecuados de acuerdo al uso designado del cuerpo de agua, sus características físicas y localización geográfica. De esta manera, puede designarse apropiadamente el uso del cuerpo de agua y el manejo de su cuenca hidrográfica (Heiskary y Wilson, 2005). Aguas superficiales con alta concentración de nutrientes puede ocasionar impacto indeseable en el estado trófico del mismo, en su apariencia y finalmente en su uso. Los nutrientes como el nitrógeno, fósforo y potasio, conocidos también como macro-nutrientes son esenciales para el crecimiento de los organismos y pueden ser los factores limitantes para la productividad primaria de un cuerpo de agua. Las características biológicas y geoquímicas del fósforo y nitrógeno juegan un papel primordial en los procesos de eutrofización de los lagos. El resultado del exceso de nutrientes en cuerpos de agua es el proceso de eutrofización el cual es ocasionado por el excesivo crecimiento de plancton. En general, el nitrógeno presente en las aguas superficiales se encuentra en la forma de nitratos, nitritos y amonio. La presencia de estos compuestos puede provenir de varias fuentes tales como escurrimientos de terrenos agrícolas, aguas residuales domésticas e industrias (Tchobanoglous y Schroeder, 1987). El fósforo al igual que el nitrógeno, es un elemento esencial para los organismos vivos. Las principales fuentes de contaminación por fósforo son los desechos domésticos con la utilización de detergentes, de la excreta humana y animal, así como de escurrimientos superficiales provenientes de zonas agrícolas y escapes de depósitos naturales (De la Lanza, 2002). La determinación de las concentraciones de compuestos de nitrógeno y fósforo en cuerpos de agua es importante ya que permitirá predecir el nivel de crecimiento de algas en cuerpos de agua y sus posibles efectos (Tchobanoglous y Schroeder, 1987). 3 Hem (1985) mencionó que la última fuente de iones con mayor disolución está en el conjunto de minerales presentes en las rocas cerca de la superficie de la tierra. La importancia de la composición de la roca, es sin embargo, sólo una parte de la constitución final del agua, pues factores como la pureza y el tamaño de los cristales de minerales, la textura de la roca y porosidad, la estructura regional, el grado de agrietamiento, la duración de la exposición a los factores anteriores pueden influir en la composición del agua, pasando sobre y a través de la roca. Por otro lado, la temperatura de la roca aumenta con la profundidad del subsuelo y de la misma manera, el agua adquiere una temperatura substancialmente más alta que aquella localizada cerca de la superficie de la tierra, situación que provoca más solubilidad de iones y mayor tasa de disolución de minerales de las rocas; con el reciente interés en fuentes de energía geotérmica, se ha prestado atención renovada a estos efectos. La composición química del agua de los manantiales termales es fuente de información de las condiciones térmicas de las rocas en la profundidad del suelo. Muchas de las aguas termales que se encuentran en lugares donde el gradiente de temperatura con la profundidad tiene cambios anormalmente abruptos; el soluto disuelto contenido en dicha agua es normalmente mayor que en el agua no termal, constituida principalmente por sólidos en suspensión y cantidades inusuales de iones metálicos. La composición de algunas de estas aguas puede ser el resultado de la alteración metamórfica de rocas asociadas. 2.2. Estudios previos en la presa La Vega La presa La Vega se localiza a 5 km aguas abajo del río Ameca (el cual se caracteriza por la presencia de manantiales) y la cortina está localizada a 9.5 km al sur del poblado de Teuchitlán. El embalse tiene varios tributarios: del norte recibe las descargas municipales de este poblado y en el sureste descarga el rio Salado con las aguas provenientes de la industria azucarera. 4 Además, los terrenos circundantes al embalse son de uso agrícola, por lo que es común el empleo de insecticidas y herbicidas, los cuales llegan al embalse arrastrados por las corrientes de los escurrimientos generados durante la estación lluviosa en forma regular (López-López y Paulo-Maya, 2001). La presa La vega se localiza en el Municipio de Teuchitlán Jalisco, el cual pertenece a la cuenca del pacífico y a la subcuenca del río Ameca. Sus principales aporte es el rio Salado, y los arroyos Chapulimita, los Otates y El Aguilote. También cuenta con los manantiales de El Rincón, todas estas corrientes mencionadas desembocan en presa La Vega. Estudios previos han demostrado condiciones de anoxia en los meses de noviembre a marzo (Favari et al., 2003), condición que también sugiere altas concentraciones de minerales en el embalse, produciendo incremento del pH por arriba del neutro. La presencia de oxígeno disuelto (OD) controla el estado de oxidación-reducción (redox) de muchos elementos de importancia en la dinámica y producción lacustre, como es el caso del carbono (C), nitrógeno (N), fósforo (P), hierro (Fe) y azufre (S). El P es frecuentemente el nutriente limitante para la producción de fitoplancton, material abundante en el embalse que resulta una barrera para la dispersión de peces. En este caso solo los manantiales presentan condiciones apropiadas para el crecimiento de peces (López-López y Paulo-Maya, 2001). En el embalse de la presa La Vega se han reportado marcadas fluctuaciones en los factores fisicoquímicos con gradientes verticales y fluctuaciones estacionales como es el caso del oxígeno disuelto, conductividad, turbidez, fósforo, nitratos y nitritos. En el Cuadro 2.1 se presenta los resultados obtenidos por Favari et al., (2003) de la calidad del agua de la presa La Vega, con los promedios de varios puntos distribuidos a lo largo de la presa. Donde se observan concentraciones de nitrógeno y fósforo suficientes para el crecimiento de maleza acuática y plancton, este último responsable de la eutrofización. El florecimiento de lirio acuático y algas ha sido recurrente en la presa La Vega, por lo tanto, no se debe abordar con el simple control, sino que se deben buscar opciones de prevención 5 basada en el manejo integral de la cuenca y sus fuentes de contaminación (Favari et al., 2003). Cuadro 2.1. Resultados de estudios previos en la presa La Vega. Parámetro Temperatura (ºC) Oxigeno (mg/L) pH Turbiedad (UFT) Conductividad (mS/cm) Nitratos (mg/L) Nitritos (mg/L) Amoniaco (mg/L) Sulfatos (mg/L) Fósforo total (mg/L) Hierro (mg/L) Concentración 27.0 6.20 8.10 114 1.23 1.00 0.07 0.98 38.0 2.15 0.78 Fuente: Favari et al., 2003. La proliferación de las algas unicelulares, especialmente las algas verdes, provocan el aumento de la turbiedad en el agua lo cual impide que la luz penetre hasta el fondo del ecosistema. Como consecuencia en el fondo se hace imposible la fotosíntesis, a la vez que aumenta la actividad metabólica consumidora de oxígeno de los organismos. De esta manera en el fondo el oxígeno se agota rápidamente y el ambiente se vuelve anóxico. La alteración del ambiente que estos cambios provocan, hace inviable la existencia de la mayoría de las especies que previamente formaban el ecosistema (Favari et al., 2003). Pero las fuentes de contaminación no solo aportan nutrientes al cuerpo de agua, estas también pueden contener otras sustancias como metales pesados, sustancias químicas procedentes de las industrias, químicos utilizados en la limpieza de las casas habitación de zonas urbanas, 6 además de plaguicidas procedentes de la agricultura, entre otras. Por esta razón, en los estudios de contaminación se debe analizar posibles factores que puedan influir en la respuesta del suelo a los agentes contaminantes, como la vulnerabilidad, el poder de amortiguación, movilidad de los contaminantes, la biodisponibilidad, la persistencia de los contaminantes y la carga crítica que pueden modificar los denominados "umbrales generales de la toxicidad", para la estimación de los impactos potenciales y la planificación de las actividades permitidas e inclusive, aquellas que deberían ser prohibidas en cada medio (Gomes et al., 2007; Dale, 2009). Por otro lado, la respuesta biológica a la contaminación ambiental medible en un organismo ha sido considerada como la respuesta de un biomarcador. Algunos estudios con peces han evaluado los efectos de los contaminantes presentes en la presa La Vega, resultados obtenidos indican que los peces expuestos a varios contaminantes presentes en el agua del embalse fueron vulnerables a estas sustancias. Aunque es mayúscula X. helleri es una especie tolerante, (nombre común: espadas) la exposición a varios contaminantes puede conducir a una alteración de las actividades reproductoras y a cambios en el tamaño y en la estructura de la población de la especie (López-López y Maya, 2001). Por otro lado, la necesidad de producir mayor cantidad de alimentos es la razón principal de utilizar agua de baja calidad, como aguas residuales o aguas contaminadas. Aunque se reporta que no necesariamente el uso de aguas residuales tiene efectos negativos sobre la calidad de los suelos, en algunos casos la presencia en exceso de ciertos componentes en el agua residual (como los nutrientes) puede tener efectos positivos en un principio (Virto et al., 2007; RasconAlvarado et al., 2008). Sin embargo, si la aplicación de aguas residuales sobre terrenos agrícolas es por largos periodos, se han detectado efectos perjudícales como es la transferencia de los contaminantes a los cultivos en producción (Pérez-Olvera et al., 2008; Virto et al., 2007; Bautista-Cruz y Arnaud-Viñas, 2006). 7 Uno de los lugares típicos de México donde se ha desarrollado la agricultura con el uso de agua residual es el Valle del Mezquital en el estado de Hidalgo, zona donde se ha detectado acumulación de metales pesados con periodos prolongados de uso de aguas residuales en las tierras dedicadas a la agricultura (Vázquez-Alarcón et al., 2001) y presencia de estos metales pesados en cultivos agrícolas, como trigo y maíz (Vázquez-Alarcón et al., 2005), además de cambios en algunas propiedades físicas y químicas del suelo, como sales y pH (PrietoGarcía et al., 2009). También la presencia de Coliformes se han identificado en los suelos y cultivos bajo producción con aguas residuales (Cisneros et al., 2010). La Comisión Estatal del Agua (CEA) ha detectado elementos químicos en la cuenca de estudio, el Cuadro 2.2 se presentan los elementos y concentraciones encontrados. Se puede observar que la concentración de arsénico, cobre y zinc, se encuentran fuera de los límites máximos permisibles (LMP) que establecen los Criterios Ecológicos de Calidad del Agua (CE-CCA-001/89) en la cual se menciona como LMP para agua de riego lo siguiente; para el arsénico 0.1 mg/L, cobre 0.2 mg/L y el zinc 2.0 mg/L. Cuadro 2.2. Contaminación por elementos químicos encontrada en diversos sitios de muestreo de la Cuenca. Elementos químicos (mg/L) Rio el salado Descarga de Tala Rio Salado C/Descarga del ingenio y A.R. Tala Arsénico 0.245 0.382 0.365 Cobre Zinc 0.141 0.175 Fuente: Comisión Estatal del Agua, 2011. Rio Salado (antes de La Vega) Descarga ingenio (canal) 0.510 0.374 0.567 0.214 0.068 8 2.3. Parámetros de calidad del agua, importancia para la vida acuática, riego agrícola y el medio ambiente. 2.3.1. Temperatura El parámetro más común de evaluación de calidad del agua es la temperatura ya que impacta las características biológicas y químicas de las aguas superficiales. Afecta los niveles de oxígeno disuelto en el agua, la fotosíntesis de plantas acuáticas, afecta también el metabolismo de los organismos y la sensibilidad de estos organismos a la contaminación, parásitos y enfermedades (Brooks, 1996). Alta temperatura en el agua disminuye la capacidad de mantener el oxígeno disuelto en niveles óptimos (Caron et al., 1986). Por esta razón, la temperatura debe ser medida en campo en el mismo sitio donde el oxígeno sea medido. Esto permite hacer la correlación entre los valores encontrados de los dos parámetros (Marais Y Jenkins, 1992). 2.3.2. pH El pH es un factor muy importante porque procesos químicos se llevan a cabo solo a determinado pH. Un ejemplo son las reacciones del cloro que solo tienen lugar cuando el pH tiene un valor de entre 6,5 y 8. El pH es un indicador de la acidez de una sustancia. Está determinado por el número de iones libres de hidrógeno (H+) en una sustancia. La acidez es una de las propiedades más importantes del agua. El pH sirve como un indicador que compara algunos de los iones más solubles en agua. El resultado de una medición de pH viene determinado por una consideración entre el número de protones (iones H+) y el número de iones hidroxilo (OH-). Cuando el número de protones iguala al número de iones hidroxilo, el agua es neutra. Tendrá entonces un pH alrededor de 7 (Zawaideh Y Zhang, 1998). 9 El término pH es usado para indicar la alcalinidad o acidez de una substancia con un rango de 1.0 a 14.0 (Figura 2.1). Los diferentes organismos fluctúan en diferentes rangos de pH. En el ambiente acuático los organismos prefieren un rango de 6.5 a 8.0 (Yan et al., 2007). Figura 2.1 Escala de pH que se puede encontrar en los diversos compuestos. Un pH bajo también puede permitir a los elementos tóxicos y compuestos ser más móviles y disponibles para ser tomados por los organismos y plantas acuáticas. Esto puede producir condiciones que son tóxicas para la vida acuática, particularmente para las especies sensibles (Yan et al., 2007). Un pH en el rango de 6.0 y hasta 8.5 parece proveer protección a la vida de peces de agua dulce y de invertebrados en el fondo de los canales o cuerpos de agua. Especies más resistentes de peces pueden tolerar pH en rango de 4.0 a 10.0. En pH extremo, los huevecillos de peces pueden sobrevivir, pero deformaciones en los peces se producen con frecuencia (Yan et al., 2007). 10 2.3.3. Conductividad eléctrica La concentración total de sales en el agua es medida a través de la conductividad eléctrica (Langmuir, 1997). El parámetro de calidad con mayor influencia en la productividad de los cultivos es el riesgo por salinidad, medido como conductividad eléctrica (CE). El primer efecto que las altas concentraciones de conductividad tiene en los cultivos es la inhabilidad de las plantas por competir por los iones presentes en el agua y el suelo (sequia fisiológica). Mientras más alta es la CE, menos agua está disponible para las plantas aun cuando el suelo este aparentemente húmedo. Debido a que las plantas solo transpiran agua pura, el agua que las plantas pueden utilizar del suelo decrece dramáticamente con la CE alta. Aguas de irrigación con altas concentraciones de CE reduce el rendimiento de los cultivos, siendo más evidente el efecto a largo plazo (Sawyer et al., 1994). En el Cuadro 2.3, se mencionan las restricciones para la utilización de agua de riego dependiendo de la CE. Cuadro 2.3. Restricciones del uso del agua para riego agrícola de acuerdo a la Conductividad Eléctrica. Limitantes de uso Sin restricción Conductividad Eléctrica (dS/m)* ≤0.75 Algunas restricciones 0.76 - 1.5 Moderado 1.51 - 3.00 Severo *dS/m a 25ºC = mmhos/cm ≤3.00 Fuente: Ayers y Westcot, 1994. La CE mide la salinidad de todos los iones disueltos en el agua, esto incluye iones de cargas negativas (Cl-, NO-3) y iones de cargas positivas (Ca++, Na+). 11 2.3.4. Oxígeno Disuelto El oxígeno es el componente más importante en la superficie de la misma para los procesos de autodepuración y la vida acuática. Los niveles de oxígeno disuelto (OD) en aguas naturales dependen de la actividad física, química y bioquímica del sistema. El análisis de OD es una prueba clave en la contaminación del agua, ya que los niveles de OD condicionan la actividad tanto aeróbica como anaerobia de los organismos presentes en el cuerpo de agua, la concentración y porcentaje de saturación de oxígeno dependen de la temperatura del agua, salinidad y de la presión atmosférica. El problema de bajos niveles de oxígeno disuelto se magnifica cuando el ritmo del metabolismo de las plantas acuáticas se incrementa por consecuencia del incremento de la temperatura, incrementando así su demanda biológica de oxígeno (Fogler, 1992). El OD en lagos, ríos y océanos es crucial para los organismos acuáticos. Cuando la cantidad de OD decrece, debajo de los niveles normales en los cuerpos de agua, la calidad del agua se ve comprometida y los organismos empiezan a morir. De hecho el cuerpo de agua puede morir y a este proceso se le llama eutrofización. Aunque las moléculas de agua contienen átomos de oxígeno, el cual no es el que los organismos acuáticos necesitan para vivir en las aguas naturales. Una pequeña cantidad de oxígeno, arriba de 10 moléculas por un millón de agua, esta disuelta en agua (Fogler, 1992). 2.3.5. Turbiedad La turbiedad es la reducción de la claridad en el agua debido a la presencia de partículas suspendidas. La turbiedad es medida por la cantidad de luz que reflejan las partículas y es comúnmente usada como un indicador de la condición general de la calidad del agua, es un parámetro de calidad de agua muy fácil de medir en campo. La turbiedad está muy relacionada con los sólidos suspendidos totales 12 (SST), pero también incluye plancton y otros organismos, además de otros microorganismos que pueden interferir con el paso de la luz a través del agua. La turbiedad de las aguas naturales tiende a incrementarse durante las lluvias por los escurrimientos como resultado del incremento del flujo de los arroyos y la erosión. Los coloides o partículas suspendidas, comúnmente mencionadas como sólidos suspendidos totales (SST) son todas las extremadamente pequeñas sólidos suspendidos en el agua los cuales no sedimentan por gravedad. Los SST son medidos en una muestra de agua (la cual ya ha sido sedimentada) y son esas partículas que no pasan a través de un filtro muy fino (usualmente de 0.45 micras). La turbiedad por sí misma no es de preocupación para la salud, pero una turbiedad alta puede interferir con la desinfección y provee un medio para el crecimiento de los microorganismos. También puede indicar la presencia de microbios (Irie et al., 2012). 2.3.6. Durezas La dureza en el agua es una medida tradicional de la capacidad del agua de reaccionar con el jabón el cual es precipitado preferentemente por los iones calcio y magnesio. Otros cationes polivalentes tienen también esta capacidad, aunque suelen encontrarse en formas complejas como compuestos orgánicos y su influencia en la dureza puede ser difícil de determinar. De acuerdo con los criterios actuales, la dureza total del agua se define como la suma de las concentraciones de calcio y magnesio, ambos expresados como carbonato de calcio en mg/L. En agua dulce, la principal causa de durezas es la presencia de los iones calcio y magnesio, estroncio, hierro, bario y los iones de manganeso también contribuyen (Porta et al., 1994). La dureza es comúnmente expresada como el equivalente en la concentración de carbonato de calcio. Aunque la dureza es causada por cationes, es con frecuencia discutida en términos de dureza de carbonato y no-carbonato. La dureza de carbonato y bicarbonato puede 13 ser removida o precipitada de la solución por calentamiento. La dureza de no-carbonatos es causada por la asociación de los cationes con sulfatos, cloruros y nitratos. También se le conoce como dureza permanente porque no puede ser removida por calentamiento (Baccaro et al., 2006). La alcalinidad que es la capacidad de amortiguamiento del agua, está muy ligada con la dureza. En gran medida la alcalinidad es producida por aniones o especies moleculares de ácidos débiles, mayormente hidróxidos, bicarbonatos y carbonatos, otras fuentes como boratos, fosfatos, silicatos y ácidos orgánicos pueden contribuir en menor grado. La alcalinidad se expresa en términos de cantidad equivalente de carbonato de calcio (Baccaro et al., 2006). La dureza en el agua de riego se puede calcular utilizando un índice que valora el contenido de calcio y magnesio, mediante la siguiente ecuación: Los valores de dureza obtenidos se interpretan de acuerdo a los valores que se presentan en el Cuadro 2.4. Cuadro 2. 4. Valores para interpretación de dureza utilizando grados hidrométricos franceses. Tipo de agua Muy blanda Blanda Medianamente blanda Medianamente dura Dura Muy dura Fuente: Wurts, 1992. Grados hidrométricos Franceses Menos de 7 7 - 14 14 - 22 22- 32 32-54 >54 14 2.3.7. Solidos disueltos totales Partículas como arcillas, limo y otras, aunque no lleguen a estar disueltas, son arrastradas por el agua de dos maneras: en suspensión estable (disoluciones coloidales); o en suspensión que sólo dura mientras el movimiento del agua las arrastra. Las suspendidas coloidalmente sólo precipitarán después de haber sufrido coagulación o floculación que es la unión de varias partículas (Miller et al., 2002). Independientemente del tipo de suelo, el agua debe cumplir ciertos estándares de calidad en aguas naturales y solo en ciertas situaciones la calidad puede variar los márgenes establecidos considerando que esta no dañe o tenga un efecto negativo en el suelo. Para la evaluación de la calidad del agua de riego se han establecido parámetros indicativos de la calidad del agua que son una guía práctica y de uso generalizado. Con estos parámetros se obtendrá un indicador de los posibles problemas dependiendo de la calidad del agua de riego utilizada siendo importantes para la toma de decisiones (Miller et al., 2002). 2.3.8. Cloruros El ión cloruro es uno de los aniones inorgánicos principales en el agua. Tiene la capacidad de proveer al agua un sabor salado y depende de la composición química del agua, si el catión presente en el agua que acompaña al cloruro es sodio, se presenta un sabor salado con una concentración de 250 mg/L, en cambio, si el catión predominante es el calcio y el magnesio el sabor puede estar ausente hasta concentraciones de 1000 mg/L. El ión cloruro en exceso en el agua afecta el crecimiento vegetal, también puede dañar estructuras metálicas y conducciones, además limita el uso del agua en actividades industriales y alimenticias (Panno et al., 2006). 15 En áreas de irrigación, la adsorción de cloruros depende no solamente de la cantidad del agua, sino también de la presencia de cloruros en el suelo, controlados por la cantidad de escurrimiento que se ha llevado a cabo y la habilidad del cultivo para excluir los cloruros. Los cultivos tolerantes a los cloruros no están bien documentados como cultivos tolerantes a la salinidad. Los valores deberán ser cambiados de acuerdo a la experiencia local que indique que concentraciones o niveles diferentes ocasionan daño a los cultivos en el área. La relación de la concentración de cloruros y algunos efectos en cultivos se presenta en el Cuadro 2.5. Cuadro 2.5. Relación de la concentración de cloruros y el efecto el cultivos. Rango de Efectos en Cultivos Concentración (mg/L) Rango de calidad de Debería prevenir la acumulación de cloruro a niveles tóxicos aguas objetivo salvo en las plantas más sensibles, incluso cuando el cloruro <100 consumido es a través de la absorción de la hoja, esto es el follaje del cultivo es mojado. <400 Debería prevenir la acumulación de cloruro a niveles tóxicos salvo en las plantas más sensibles, cuando el cloruro consumido es a través de la absorción por las raíces, esto es el agua es aplicada a la superficie del suelo por lo tanto se excluye la humedad del follaje del cultivo. 140-175 Sólo problemas leves con la acumulación de cloruro a niveles tóxicos a los cultivos pueden ser esperados cuando el cloruro consumido es a través de la absorción de las raíces, esto es el agua es aplicada a la superficie del suelo por lo tanto se excluye la humedad del follaje del cultivo. 100-175 Los cultivos sensibles a la absorción de la hoja acumulan niveles tóxicos de cloruro cuando su follaje es humedecido. Ellos muestran daños en la hoja y disminución del rendimiento. Fuente: Iowa Department of Natural Resources, 2009. 16 2.3.9. Sulfatos El azufre (S) es un elemento esencial utilizado por las células en la síntesis de proteínas. Algunas formas del azufre son encontradas en la 2naturaleza y las principales son; el azufre (S0), sulfato (SO4 ), y el sulfuro de hidrogeno (H2S). La forma más esencial para la vida de las 2plantas es la forma inorgánica sulfato (SO4 ), la cual sirve como un nutriente secundario pero importante. Fuentes primarias de azufre en aguas superficiales incluye los minerales de manera natural, y la deposición proveniente de la atmosfera por precipitación y deposición seca, escurrimientos de la agricultura y áreas urbanas además de las interacciones con aguas subterráneas. En sistemas de agua dulce el azufre es generalmente suficiente para cumplir las demandas de varios organismos. Sin embargo, a diferencia del fósforo, el azufre no es un factor limitante para el crecimiento y el desarrollo de las plantas bajo la mayoría de las circunstancias (Schueneman, 2001). El azufre tiene un lugar singular en la naturaleza, ya que tiene directa o indirectamente efectos en el ciclo de otros elementos. El Azufre es activamente relacionado en el ciclo de los micronutrientes (hierro y manganeso) y los macronutrientes (fósforo y nitrógeno) que son importantes para la productividad y la salud en general de las plantas y los animales (Wetzel, 2001). 2.3.10. Alcalinidad (carbonatos y bicarbonatos) La alcalinidad en el agua se define como su capacidad para reaccionar o neutralizar iones hidrogeno (H+) amortigua valores de pH de 4,5. La alcalinidad es una propiedad que tienen las aguas naturales para amortiguar los cambios bruscos de pH por efecto de un ácido y se le llama efecto buffer. La alcalinidad se expresa como la suma de las bases (química) que pueden ser tituladas en una muestra de agua. La alcalinidad es causada por los bicarbonatos, carbonatos e hidróxidos presentes en las aguas naturales y estos se forman por la disolución del bióxido de carbono atmosférico (Wurts y Durborow, 1992). 17 Sin embargo algunas sales de ácidos débiles también pueden estar presentes y contribuir a la alcalinidad del agua, entre ellos podemos mencionar los boratos, silicatos, nitratos y fosfatos. Es común la asociación entre estos iones negativos mencionados anteriormente con iones positivos como es el caso del calcio, magnesio, potasio y sodio entre otros. Sin embargo, el bicarbonato es la forma química que mayormente contribuye a la alcalinidad del agua. La presencia de los carbonatos y bicarbonatos en el agua dulce se originan generalmente del desgaste y la disolución de rocas (piedra caliza) en la cuenca de influencia, eventualmente llegan a las aguas superficiales. La presencia de CO2 promueve la disolución de la piedra caliza, este reacciona con el agua y genera pequeñas cantidades de ácido carbónico el cual disuelve las rocas de carbonato a su alcance contribuyendo así a la alcalinidad del agua (Wurts y Durborow, 1992). La presencia de los compuestos mencionados está asociada al origen del agua, de esta manera se tiene la siguiente asociación presentada en el Cuadro 2.6. Sin embargo, independientemente de su origen la alcalinidad en las aguas naturales están directamente asociadas al sistema carbonato (carbonatos, bicarbonatos y ácido carbónico). La concentración de estas sustancias es un indicativo de la alcalinidad en el agua, también debe considerarse que la alcalinidad no es exclusiva del sistema carbonato. Para la determinación de la alcalinidad en el agua, se divide en alcalinidad a la fenolftaleína y alcalinidad total, el resultado envuelve los bicarbonatos, carbonatos e hidroxilos, (sin considerar ácidos débiles inorgánicos u orgánicos como el silicio, fosfórico y bórico). Esta clasificación supone cierta incompatibilidad entre la alcalinidad de hidroxilos y bicarbonatos (Truchot y Forgue, 1998). 18 Cuadro 2.6. Origen de compuestos asociados a diversos tipos de agua. Tipo de agua Compuesto Aguas naturales, aguas residuales e industriales Aguas naturales y aguas residuales Aguas naturales y aguas residuales Aguas subterráneas, aguas residuales y/o profundas Aguas subterráneas Aguas subterráneas Aguas subterráneas y de escurrimientos agrícolas Aguas subterráneas y de escurrimientos agrícolas Aguas subterráneas y de escurrimientos agrícolas Aguas residuales domésticas, escurrimientos agrícolas y aguas industriales Aguas residuales domésticas, escurrimientos agrícolas y aguas industriales Aguas residuales domésticas, escurrimientos agrícolas y aguas industriales Fuente: Wurts y Durborow, 1992. Los criterios de calidad de agua para riego establecen límites de aceptabilidad en el caso de la alcalinidad de acuerdo a la capacidad amortiguadora del agua (Cuadro 2.7). 19 Cuadro 2.7. Criterios establecidos como límites de aceptabilidad para la alcalinidad en agua de riego. Descripción Mínimo aceptable Pobremente amortiguadora Moderadamente amortiguadora Muy amortiguadora Alcalinidad Total mg/L CaCO3 20 <25 25-75 >75 Fuente: Ayers y Westcot, 1994. 2.3.11. Nitrógeno El nitrógeno es uno de los elementos más abundantes, aproximadamente el 78% del aire que respiramos es nitrógeno, además se encuentra en las células de todos los organismos vivos, es el mayor componente de las proteínas y constituyente de los ácidos nucleicos. De manera natural, el ciclo del nitrógeno se produce entre las formas orgánicas e inorgánicas. En este aspecto, las bacterias y las plantas juegan un papel muy importante, siendo las responsables de la producción de proteínas las cuales son componentes orgánicos que contienen cantidad importante de nitrógeno. Todos los componentes en el ciclo del nitrógeno son de gran interés en el campo del manejo de la calidad del agua. El nitrógeno junto con el carbono y el oxígeno, es un elemento requerido en grandes cantidades por los organismos. Los compuestos de nitrógeno que son de importancia significativa en el manejo de la calidad del agua son; nitrógeno orgánico, amonia (NH3), nitritos (NO2), nitratos (NO3) y nitrógeno gas (N2). En la Figura 2.2 se presenta la interrelación existente en el ciclo del nitrógeno (Tchobanoglous y Schroeder, 1987). Como se presenta en la Figura 2.2, la atmósfera sirve como reservorio para el nitrógeno. El nitrógeno es removido por la fijación de las 20 bacterias y las algas en los cuerpos de agua. El nitrógeno es retornado a la atmósfera a través de la denitrificación de las bacterias. La conversión de las bacterias de amonia a nitritos y después a nitratos es conocida como nitrificación. Los nitratos son utilizados para la producción de nitrógeno orgánico en la forma de bacteria y plantas. Completando así el ciclo, los animales consumen las plantas y los microorganismos (Tchobanoglous y Schroeder, 1987). Figura 2.2. Ciclo del nitrógeno. 21 Nitrógeno Total. El nitrógeno es un nutriente que estimula el crecimiento de las plantas. Nitrógeno natural en suelos o el agregado con los fertilizantes son usualmente fuentes, pero el nitrógeno en las aguas de irrigación tiene el mismo efecto que lo agregado como fertilizante y el exceso puede causar problemas, iguales a los que ocasiona la aplicación de altas concentraciones en los fertilizantes. Si cantidades excesivas están presentes o son aplicadas, la producción de varios cultivos puede ser afectada debido a la sobre estimulación del crecimiento, retrasando madurez y al mismo tiempo obteniendo pobre calidad del producto. Las formas de nitrógeno con mayor disponibilidad son el nitrato y el amonio, pero los nitratos ocurren con mayor frecuencia en aguas de irrigación (Ferguson et al., 1991). El nitrógeno amoniacal esta rara vez presente en concentraciones arriba de 1 mg/L a menos que sea agregado fertilizante o aguas residuales a las fuentes de agua. La concentración en la mayoría de las aguas superficiales y aguas subterráneas es usualmente menos de 5 mg/L, sin embargo, en muy raras ocasiones la concentración en aguas subterráneas puede ser de hasta 50 mg/L (European Commission, 2002). En aguas de drenaje agrícola frecuentemente los niveles de nitrógeno son altos por el acarreo de los fertilizantes. Ya que el nitrógeno está presente en los escurrimientos procedentes de las unidades agrícolas, así como en el agua de riego. Se recomienda que la concentración de nitrógeno en las aguas de irrigación sea monitoreada y que la concentración presente en el agua sea considerado como parte de la fertilización de los cultivos, en ese caso la aplicación de fertilizantes se ajustaría a la contenida en el agua. Las aguas residuales domésticas, especialmente las que proceden de las fuentes de alimento, son conocidas por las altas concentraciones de nitrógeno, los niveles van de 10 a 50 mg/L (Cahn et al., 2011). El nitrógeno total kjeldahl (TKN por sus siglas en inglés) es la suma del nitrógeno orgánico y el amonio, concentraciones altas indican aguas 22 residuales y descargas. Además, generalmente la concentración total de TKN en una muestra de agua residual equivale al 15-20% de la demanda biológica de oxígeno. El nitrógeno orgánico es generalmente removido en los lodos sedimentados (Bauder et al., 2011). Nitrógeno amoniacal. El compuesto amonia es una forma de nitrógeno inorgánico el cual puede ser encontrado en el agua y es la forma de nitrógeno preferida por las algas y las plantas para su crecimiento. El amonia es la forma de nitrógeno más reducida, las bacterias rápidamente lo oxidan a nitratos el cual es llamado proceso de nitrificación. Otros tipos de bacteria producen amonia al descomponer la materia orgánica. Niveles altos pueden ser tóxicos para la vida acuática, dependiendo de la temperatura y el pH en el agua. Además, la concentración alta de ammonia en el agua puede estimular el crecimiento excesivo de plantas acuáticas lo cual es un indicativo de contaminación. Fuentes importantes de ammonia en lagos y arroyos incluyen; fertilizantes, desechos humanos y animales, y subproductos de procesos industriales (Shuh-Ren, et al., 2001). Algunas técnicas para la prevención de concentraciones altas, incluye la filtración de las aguas residuales, el apropiado mantenimiento de fosas sépticas y otras acciones relacionadas con la fertilización excesiva de los cultivos (Shutes et al., 2001). Los compuestos del nitrógeno actúan como nutrientes en los arroyos y ríos. Sin embargo, las reacciones de los nitratos en agua dulce o agua fresca puede causar la disminución del oxígeno. De esta manera los organismos que dependen del suplemento de oxígeno en los ríos morirán. Los mayores aportes de nitrógeno en los cuerpos de agua son las aguas residuales municipales, industriales, desechos de granjas de animales, tanques sépticos. Las bacterias rápidamente convierten los nitritos en nitratos (Babourina y Rengel, 2011). Los nitratos pueden producir una condición seria en los peces llamada enfermedad de sangre café. Los nitratos también reaccionan directamente con la hemoglobina en los humanos y en otros organismos de sangre caliente llamado metahemoglobina. La cual destruye la habilidad de los glóbulos rojos de transportar el oxígeno en la sangre. Esta condición es 23 especialmente seria en bebes de menos de 3 meses de edad. También es conocida como la enfermedad del “bebe azul”, el agua con niveles mayores a 1 mg/L de nitratos no deben ser ingeridos por los bebes. Niveles menores de 0.5 mg/L de nitratos parece no tener ningún efecto negativo en los peces (Babourina y Rengel, 2011).La eutrofización es el lento enriquecimiento de nutrientes en los cuerpos de agua y es responsable del envejecimiento de los lagos y reservorios. Cantidad excesiva de nutrientes, especialmente nitrógeno y fósforo, aceleran el proceso de eutrofización. Cuando las algas crecen y después se descomponen agotando el oxígeno disuelto en el agua. Esta condición usualmente resulta en la muerte de peces, olores ofensivos, apariencia desagradable reduciendo el atractivo del cuerpo de agua para actividades recreativas y de uso público. Estas condiciones ocurren solamente cuando altas concentraciones de nutrientes están presentes, cierta cantidad de nitrógeno y fósforo sin embargo son esenciales para cualquier forma de vida acuática (Babourina y Rengel, 2011). Todos los organismos vivos de un modo u otro están conectados con el ciclo de los elementos. Por ejemplo, los animales comen plantas y los animales desechan productos que son convertidos después por los microorganismos en otros productos. Así mismo cuando los animales mueren sus restos son descompuestos por los microorganismos. Una gran variedad de organismos son capaces de convertir complejos compuestos orgánicos a simples substancias inorgánicas como son el amonia, sulfatos, dióxido de carbono y agua. El ciclo del nitrógeno, fósforo y sulfato son fundamentalmente importantes en el reciclado de estos elementos en la naturaleza, en cada caso el rol de los microorganismos es relevante (Babourina y Rengel, 2011). Estos nutrientes pueden ser del mismo ambiente acuático, o introducidos externamente a través de la utilización de fertilizantes en tierras agrícolas, por escurrimiento, por descargas de aguas residuales domesticas por el uso de detergentes, por materia orgánica y por precipitación entre otros. Altas concentraciones de materia orgánica o 24 los sedimentos en los lagos pueden servir como una fuente interna de nutrientes bajo ciertas condiciones químicas. La descomposición de algas muertas o el tejido de plantas acuáticas pueden también proveer otra fuente interna de nutrientes (Babourina y Rengel, 2011). Nitratos. Los nitratos son la forma de nitrógeno más común encontrada en las aguas naturales. Los nitratos y nitritos son compuestos que contienen el átomo de nitrógeno unido al átomo de oxígeno, los nitratos contienen 3 átomos de oxígeno y los nitritos contienen 2. En la naturaleza, los nitratos se convierten en nitritos y viceversa. Ellos tienden a asociarse con cationes o iones con carga positiva, para alcanzar la carga neutral y estar en balance. Los nitratos están naturalmente presentes en el suelo, agua y los alimentos. En el ciclo natural del nitrógeno, las bacterias convierten el nitrógeno en nitratos, los cuales son tomados por las plantas para incorporarlos a los tejidos. Los animales que comen las plantas utilizan los nitratos para la producción de proteínas. Los nitratos regresan al ambiente cuando los animales defecan, así como por medio de la degradación microbiológica de las plantas y animales cuando estos mueren. Después que las bacterias reducen los nitratos a nitritos en el ambiente, el ciclo del nitrógeno se completa cuando los nitritos son convertidos a nitrógeno. Normalmente en la naturaleza el ciclo del nitrógeno no permite que se acumule en el ambiente una cantidad excesiva de nitratos o nitritos. Sin embargo, las actividades humanas han incrementado la concentración de nitratos en el ambiente, la agricultura ha sido la mayor fuente de aporte. Esto incluye el uso excesivo de fertilizantes en la agricultura y la industria pecuaria (Drury et al., 1996). Los compuestos de nitritos y nitratos son muy solubles en agua y de gran movilización en el ambiente. Tienen un potencial alto para entrar en las aguas superficiales cuando llueve por el arrastre en áreas agrícolas, llegando eventualmente a los arroyos y cuerpos de agua superficiales. También pueden llegar a los mantos freáticos por filtración (Dunn et al., 2005). 25 Los nitratos por si solos no son tóxicos. Sin embargo, cuando son convertidos a nitritos pueden reaccionar con la hemoglobina en la sangre, oxidando su ion divalente al trivalente creando metahemoglobina. Esta metahemoglobina no se le puede unir el oxígeno lo cual decrece la capacidad de la sangre para transportar el oxígeno, de manera que menos cantidad de oxigeno es transportado de los pulmones a los tejidos, y esto causa una condición conocida como metahemoglobina (Algoazany et al., 2005). Los individuos normales tienen niveles bajos de metahemoglobina (0.5 a 2%) en la sangre. Sin embargo, cuando estos niveles se incrementan a 10%, la piel y los labios toman una coloración azul (cianosis), con niveles arriba de 25% pueden causar debilidad y pulso acelerado. Niveles arriba de 50 a 60%, una persona puede perder la conciencia, y llegar al coma y eventualmente morir. Los niños son mucho más sensibles que los adultos a los nitratos y nitritos, todas las muertes registradas por esta condición han sido en infantes. La exposición por tiempo largo a niveles bajos de nitratos y/o nitritos puede causar diuresis, incrementando la cantidad de orina. Se ha mencionado en la literatura la potencialidad de los nitratos/nitritos a la carcinogénesis humana, sin embargo su asociación no es clara hasta el momento (Mitchell et al., 2000). Por otro lado, la mayoría de los cultivos se ven afectados por concentraciones de nitritos arriba de 30 mg/L. Por ejemplo, la remolacha, es un cultivo sensible, el tamaño se incrementa con el exceso de fertilización sin embargo, el contenido de azúcar es menor, así la calidad total de producción de azúcar por hectárea puede reducirse (Algoazany et al., 2005). El cultivo de las uvas también es sensible, el rendimiento se puede reducir y tarda en madurar y también el contenido de azúcar disminuye. La sensibilidad de los cultivos varía de acuerdo a la etapa de crecimiento. Niveles altos de nitrógeno pueden beneficiar el crecimiento en las primeras etapas del cultivo, pero causa pérdidas en la etapa de floración. Alta concentración de nitrógeno en el agua puede ser utilizada como fertilizante en las primeras etapas de la estación de crecimiento. 26 Sin embargo, las necesidades de nitrógeno en los cultivos decrecen más tarde en la estación de crecimiento, de manera que el nitrógeno aplicado debe disminuir sustancialmente (Algoazany et al., 2005). Para los cultivos irrigados con agua que contiene nitrógeno, las proporciones de nitrógeno suplementado en los fertilizantes pueden reducirse en cantidad considerando la cantidad de nitrógeno disponible en el agua de riego. La rotación de cultivos puede ser planeada para utilizar el nitrógeno residual en el suelo en las estaciones de temporal. Reduciendo también el impacto en los años siguientes (Mitchell et al., 2000). Concentraciones de nitrógeno menores a 5 mg/L, tienen un efecto menor en cultivos sensibles, pero puede incrementar el crecimiento de algas y plantas acuáticas en arroyos, lagos, presas, canales y drenajes. Un rápido crecimiento de algas ocurre cuando la temperatura, la luz del sol y otros nutrientes se encuentran en concentraciones óptimas y disponibles (Algoazany et al., 2005). El resultado puede ser el taponamiento de válvulas e incluso causar daño en controles mecánicos, y en filtros, lo cual puede requerir medidas de control ya sea con controles mecánicos como pantallas y filtros, o controles químicos con la utilización de sulfato de cobre. El nitrógeno en el agua también incrementa el costo de mantenimiento al tener que limpiar canales y drenajes (Mitchell et al., 2000). 2.3.12. Compuestos de fósforo El fósforo es uno de los elementos clave necesarios para el crecimiento de las plantas y animales. El fósforo en su forma elemental es muy tóxico y es bioacumulable. Los fosfatos (PO4) son formados de este elemento. Los fosfatos existen en 3 formas: ortofosfatos, metafosfatos (o polifosfatos) y fosfatos unidos orgánicamente. Cada compuesto contiene fósforo en una formula química diferente. La forma de ortofosfatos es producida por procesos naturales y son encontrados en aguas residuales. La forma de polifosfato, es utilizado para tratar aguas 27 en contenedores y en detergentes. En el agua cambia a la forma de ortofosfato. Los compuestos de fósforo son importantes en la naturaleza, la frecuencia de su aparición puede resultar por el rompimiento de pesticidas orgánicos que contienen fosfatos. También existen en solución, como partículas y fragmentos perdidos (Tchobanoglous y Schroeder, 1987). La lluvia causa variación en la cantidad de fosfatos al ser arrastrados de los terrenos de cultivo a los causes y arroyos. Los fosfatos estimulan el crecimiento del plancton y de las plantas acuáticas las cuales son alimento para los peces. Este crecimiento puede causar un incremento en la población de peces y mejorar la calidad del agua. Sin embargo, si un exceso de fosfatos entra en los cuerpos de agua, las algas y las plantas acuáticas crecerán de manera desmedida, obstruyendo los canales naturales y utilizando grandes concentraciones de oxígeno. Esta condición es conocida como eutrofización o también sobrefertilización de los reservorios de agua (Kadlec, 2005). Por otro lado, los fosfatos no son tóxicos para los animales y los humanos, al menos que esté presente en altos niveles. Con concentraciones extremadamente altas de fosfatos se pueden tener problemas digestivos (De-Bashan y Bashan, 2004). 2.3.13. Riesgo por sodio (la proporción relativa de los iones de sodio, calcio y magnesio). Riesgo por sodio (problemas de infiltración/permeabilidad). Aunque el crecimiento de las plantas es primariamente limitado por los niveles de salinidad (CE) presentes en el agua de irrigación, la aplicación de agua con esas características de no balance de sodio puede reducir el rendimiento solo bajo ciertas condiciones de textura del suelo. Reducción en la infiltración del agua ocurre cuando el agua de irrigación contiene grandes cantidades de sodio en relación al calcio y magnesio. Esta condición llamada sodicidad resulta de la acumulación excesiva de 28 sodio en el suelo. Agua sódica no es lo mismo que agua salina. La sodicidad causa hinchazón y dispersión en el suelo y taponamiento de los poros de la corteza del suelo. Esta condición de estructura del suelo degradado obstruye la infiltración y puede incrementar el escurrimiento (Ayers y Westcot, 1994). La sodicidad causa un deterioro de la movilidad del agua en las diferentes capas del suelo y la raíz de las plantas en crecimiento pueden no tener agua adecuada, esto deja un charco de agua en la superficie del suelo después de la irrigación. El método más común para medir la sodicidad en el agua y el suelo es a través del cálculo de la proporción de sodio adsorbido (SAR, siglas en inglés). El SAR define la sodicidad en términos de la concentración relativa de sodio (Na) en comparación con la suma de los iones de calcio (Ca) y magnesio (Mg). El SAR evalúa los problemas de potencial de infiltración debido al desbalance de sodio en el agua. El SAR se representa matemáticamente en la ecuación 6.1, donde la concentración de los iones Na, Ca y Mg se estiman en milli-equivalentes por litro (meq/L) (Tanji, 1990). De acuerdo a los criterios internacionales establecidos para agua de irrigación (Ayers y Westcot, 1994) se utiliza una escala para determinar el riesgo por sodio en el agua (Cuadro 2.8). Cuadro 2.8. Escala de riesgo por sodio en agua de irrigación Riesgo Sodicidad Valor SAR Riesgo 0 - 10 11-17 18 - 26 más de 26 Fuente: Ayers y Westcot, 1994. Bajo Medio Alto Muy Alto 29 2.3.14. Carbonato Sódico Residual (CSR) El cálculo de carbonato sódico residual (CSR) se emplea para predecir la tendencia del calcio y magnesio a precipitar en el suelo cuando se riega con aguas altamente carbonatadas (Ayers y Westcot, 1994). Cuando esto ocurre, aumentará la proporción relativa de sodio presente en el suelo, es decir, aumentará el valor de SAR y por tanto, el riesgo de sodificación del suelo (Cuadro 2.9) a pesar de que la cantidad presente de sodio no ha variado. Cuadro 2.9. Interpretación de los valores de riesgo por Carbonato Sódico Residual en agua. Carbonato Sódico Residual CSR (meq/L) Riesgo <1.25 Bajo 1.25 – 2.5 Medio más de 2.5 Alto Fuente: Ayers y Westcot, 1994. Interpretación Recomendable Poco recomendable No recomendable 2.3.15. Elementos Químicos Los ecosistemas acuáticos, son el último reservorio de muchos contaminantes, incluyendo los metales pesados. La contaminación por metales pesados en los ecosistemas acuáticos es un problema que crece alrededor del mundo y recientemente está alcanzando dimensiones alarmantes. Existen varias fuentes de contaminación de metales pesados, algunas se originan por las actividades antropogénicas como los desechos de los hospitales y desechos de drenaje. Los metales pesados también ocurren en la naturaleza de manera natural en cantidades pequeñas y pueden llegar a los sistemas acuáticos a través del desgaste de las rocas, transportadas por el viento en forma de cenizas y de incendios. Como los metales pesados no se 30 degradan, continuamente se depositan e incorporan en los sedimentos y los organismos acuáticos (Ogoyi et al., 2011). Algunos de los elementos que son tóxicos para los cultivos incluyen; boro, sodio y los metales pesados (por ejemplo, arsénico, cobalto, cobre, plomo, niquel y zinc. Adicional al riesgo toxico, muchos elementos que requieren las plantas para su crecimiento crean un ambiente peligroso si están en exceso. Mientras el agua con altas concentraciones de nitratos y metales pesados puede causar daño a los humanos, agua con altas concentraciones de fosfatos puede resultar en la eutrofización de aguas naturales (Linnik y Zubenko, 2000). Boro. El boro en la naturaleza puede ser encontrado como ácido bórico, borato, o como borosilicato Ácido bórico, H3BO3, se comporta como una base débil en una solución acuosa Acepta iones hidroxilo del agua y libera un protón dentro de la solución. La disociación del ácido bórico en función del pH; arriba de pH de 9.24 unidades el anión B(OH) 4 es predominante, mientras que un pH debajo de las 9.24 unidades las especies sin carga son predominantes. El ácido bórico es soluble en agua (5.5 g / 100 g en solución a 25 °C) y la solubilidad se incrementa con la temperatura. En concentraciones abajo de 0.02 M (216 mg/L como B) solo las especies mononucleares B(OH)3 y B(OH)4 están presentes. Iones o estructuras anilladas pueden existir a concentraciones altas pero son muy raras en la naturaleza. Los principales usos industriales de los compuestos de boro son el la producción de fibra de vidrio utilizada como aislador, cristal borosilicato, y en detergentes. Otros usos incluyen la fabricación de los fertilizantes, metalurgia y protecciones nucleares . El boro es utilizado en la fabricación de detergentes y blanqueadores también. El boro en la forma de sodio perborato es agregado a los detergentes y a los agentes blanqueadores (Linnik y Zubenko, 2000). En aguas naturales, el boro existe primariamente como ácido bórico disociado y con algunos iones de borato. Las reacciones de absorción y 31 des-absorción son los únicos mecanismos que influencian el transporte del boro en el agua. La cantidad de boro absorbido en el suelo y sedimentos depende en gran medida del pH y la concentración del boro en la solución. La mayor absorción es generalmente cuando el valor del pH entre 7.5-9.0 unidades. La mayor concentración de boro en el planeta se encuentra en los océanos, con una concentración promedio de 4.5 mg/L . El boro en aguas subterráneas se encuentra ampliamente distribuido alrededor del mundo en concentraciones que van de <0.3 a <100 mg/L, concentraciones mayores de boro pueden ser encontradas en muchas partes del mundo particularmente con alta mineralización, y en aguas subterráneas carbonatadas (Ogoyi et al., 2011). Arsénico. El arsénico es uno de los contaminantes de mayor preocupación para la salud humana, especialmente en el agua para beber. Algunos estudios han mencionado la relación entre el arsénico en el agua para beber y el cáncer de páncreas, pulmón, piel y la próstata. Usualmente aguas profundas son más propensas a estar contaminadas con arsénico (Ogoyi et al., 2011). 2.3.16. Coliformes fecales y totales Las bacterias Coliformes totales son una colección de microorganismos relativamente no dañinos, que viven en gran número en el intestino de los humanos y animales de sangre caliente. Un subgrupo especifico de esta colección son las bacterias Coliformes fecales, y dentro de ellas la más común es la Escherichia Coli. Este organismo se separa del grupo total de Coliformes fecales por su habilidad de crecer a elevadas temperaturas y están asociadas solamente con la materia fecal de animales de sangre caliente (Erdal et al., 2003). 32 2.3.17. Análisis Taxonómico y Cuantitativo del Plancton Plancton en cuerpos de agua. Las algas de ecosistemas de agua dulce constituyen una comunidad dominada por diatomeas, Chlorophytas filamentosas y Cyanophytas que viven en asociación con una variedad de sustratos y también pueden formar material flotante en la superficie del agua. La comunidad de algas es un importante componente de la productividad primaria en lagos dinámicos. Las aguas de escurrimiento provenientes de la agricultura pueden causar el crecimiento de las algas y por consecuencia el detrimento de las aguas lenticas y loticas, por el uso indiscriminado de los agroquímicos y las malas prácticas agrícolas incrementan los efluentes de la agricultura a los ríos y posteriormente a los lagos o los océanos (Portielje y Van der Molen, 1999). El plancton ha sido utilizado extensivamente como una medida de los cambios y condiciones ecológicas en los cuerpos de agua. Además de su función como productor primario en la cadena alimenticia, tiene un gran impacto en la calidad del agua y juega un papel importante en muchos procesos ecológicos. Por esto el plancton es un factor fundamental en los procesos bioquímicos globales participando en la transformación y el ciclo de elementos clave como el nitrógeno y fósforo. Adicionalmente, la presencia de plancton afecta la turbiedad, puede disminuir el oxígeno en la columna de agua y afectar la productividad total del sistema. Aunque el plancton ha sido utilizado con mayor frecuencia como un indicador de cambios en la carga de los nutrientes, también es efectivo evaluando respuestas de otros muchos tensores ambientales, debido a su rápida respuesta en población a los cambios de calidad del agua, hidrología o clima (Portilla et al., 2009) 2.4. Efecto de la calidad del agua sobre la productividad agrícola Ayers y Westcot (1994) mencionaron que el agua para riego puede variar mucho en calidad dependiendo del tipo y cantidad de sales 33 disueltas que están presentes en el agua de riego en cantidades relativamente pequeñas, pero significativas, originadas por disolución en el subsuelo o erosión de las rocas y el suelo, acarreadas hasta los predios agrícolas donde el agua se utiliza. En el caso de riego, las sales se aplican con el agua y permanecen bajo el suelo hasta que el agua se evapora o es utilizada por el cultivo. La idoneidad de un agua para riego se determina no sólo por la cantidad total de sales presentes, sino también por el tipo de sal. Con el aumento de las sales en el suelo, se desarrollan varios problemas edáficos y en el cultivo, por lo que algunas prácticas de manejo especiales pueden ser necesarias para mantener el rendimiento aceptable de cosechas. La calidad del agua adecuada para el uso agrícola se evalúa según la gravedad de los problemas que se pueden desarrollar con su uso a largo plazo. Estos problemas varían en tipo y grado, y son modificados por el suelo, el clima y los cultivos, así como por la habilidad y el conocimiento de los usuarios en el uso del agua. Como resultado de esto, no se considera ningún límite sobre calidad del agua, sino que la condición idónea para la agricultura está determinada por las características de uso que afectan la acumulación de sales del agua y que podrían limitar el rendimiento del cultivo. Los problemas generados por la baja calidad del agua cuando se aplica en suelos agrícolas son los siguientes: a) Salinidad. Las sales en el suelo o el agua reducen la disponibilidad de agua para el cultivo, de tal manera que el rendimiento se ve afectado. b) Tasa de infiltración del agua. El elevado contenido de sodio o bajo contenido de calcio en el suelo o agua reduce la tasa a la cual el agua de irrigación entra al suelo hasta tal punto que no puede ser infiltrada suficiente agua para abastecer al cultivo adecuadamente. c) Toxicidad de iones específicos. Ciertos iones (sodio, cloruro o boro) acumulados en el suelo o del agua, en concentraciones suficientemente altas pueden causar daños a los cultivos y reducir los rendimientos. d) Misceláneo. Los nutrientes en cantidades excesivas tienen los siguientes efectos: 1) reducen el rendimiento o la calidad, 2) los 34 depósitos sobre la fruta o follaje resultan antiestéticos y reducen la venta de ellos, 3) producen corrosión excesiva del equipo lo que aumenta el mantenimiento y las reparaciones. 2.4.1. Salinidad del suelo y su efecto en los cultivos La acumulación de sales solubles en la zona radical de los cultivos es un factor limitante de la producción de la agricultura bajo riego. Teóricamente el incremento en la presión osmótica de la solución del suelo dificulta el abastecimiento de agua para las plantas, aunque se menciona que las plantas realizan ajustes para contrarrestar estos efectos, como cambios en la concentración del jugo celular por efecto de variación en las envolturas de hidratación de los solutos internos y externos de la planta, tal situación genera cambios en la concentración por diferencias de contenido de moléculas de agua en las envolturas de hidratación de los iones, además de otras consideraciones, como el hecho que algunas sales afectan las plantas de manera específica (Aceves, 2011). Es importante tomar precauciones antes de aplicar agua para el riego de los cultivos. Una de ellas es evaluar la calidad del agua e identificar las características fisicoquímicas de esta. Ayers y Westcot (1994) hacen referencia a una serie de directrices para la aplicación del agua de riego, con parámetros que se asocian al análisis que debe practicarse al agua en el laboratorio. Estos se muestran en el Cuadro 2.10. Normalmente, los suelos o cultivos no experimentan o se reconocen problemas cuando utilizan agua con valores inferiores a las que se muestran para "Ninguna restricción en el uso", del Cuadro 2.10, pero con restricciones de leve a moderada, aumentan poco a poco el cuidado que debe tenerse en la selección del cultivo y las alternativas de manejo para alcanzar el mayor potencial de rendimiento. Cuando se utiliza agua que iguala o supera los valores indicados para restricciones severas del Cuadro 2.10, el agricultor podría experimentar problemas en el suelo y el cultivo o se reducirá el rendimiento, pero incluso con el manejo del cultivo diseñado especialmente para hacer frente al agua de mala calidad, es necesario un alto nivel de capacidad 35 de manejo para lograr una producción aceptable. Si se encuentran valores de calidad de agua que se acercan o exceden los indicados para la categoría de restricción severa, se recomienda que antes de iniciar el uso del agua, se realicen una serie de estudios piloto en los terrenos agrícolas para determinar los efectos en la economía de la agricultura y las técnicas agrícolas que deben aplicarse (Ayers y Westcot, 1994). Entre los procesos que favorecen la salinización del suelo, están los siguientes (GAT, 2012): Cuadro 2.10. Interpretación de la calidad del agua para uso agrícola. Grado de restricción en el uso Problema Potencial de Irrigación Unidades Ninguna Salinidad (efectos sobre la disponibilidad de agua para el cultivo) ECw dS/m < 0.7 Ligera a moderada Severa 0.7 – 3.0 > 3.0 1 450 – TDS mg/L < 450 > 2000 2000 Infiltración (efectos sobre la tasa de infiltración dentro del suelo. Se evalúa utilizando 2 ECw y SAR juntos) y ECw = =0–3 > 0.7 0.7 – 0.2 < 0.2 SAR =3–6 = > 1.2 1.2 – 0.3 < 0.3 = 6 – 12 = > 1.9 1.9 – 0.5 < 0.5 =12 – 20 = > 2.9 2.9 – 1.3 < 1.3 =20 – 40 = > 5.0 5.0 – 2.9 < 2.9 >9 Toxicidad de ion especifico (efectos en cultivos sensibles) 2 Sodio (Na) SAR <3 3–9 meq/L <3 >3 Riego superficial meq/L <4 4 – 10 Riego por aspersión meq/L <3 >3 Boro (B) mg/L < 0.7 0.7 – 3.0 Riego superficial Riego por aspersión Cloro (Cl) Efectos 3 misceláneos (efectos > 10 > 3.0 en 36 cultivos sensibles) Nitratos (NO3 - N) 4 Bicarbonato (HCO3) mg/L <5 5 – 30 meq/L < 1.5 1.5 – 8.5 > 8.5 Rango normal 6.5 – 8.4 pH Fuente: GAT (2012). 1 ECw significa conductividad eléctrica, es una medida de la salinidad del agua; se reporta en deciSiemens por metro a 25°C (dS/m) o en milimhos por centímetro (mmho/cm). Ambas unidades son equivalentes. TDS significa Sólidos Totales Disueltos, es reportado en miligramos por litro (mg/L). 2 SAR significa Relación de Adsorción de Sodio. Para un SAR determinado, la tasa de infiltración aumenta a medida que aumenta la salinidad del agua. Para evaluar el problema potencial de infiltración por SAR este es modificado por ECw. El SAR se calcula con la siguiente fórmula: , donde Na, Ca y Mg, son el contenido de √ sodio, calcio y magnesio, respectivamente en el análisis de agua en meq/L. 3 Para el riego superficial, muchos árboles y plantas leñosas son sensibles al sodio y cloruro, utilizar los valores indicados. La mayoría de cultivos anuales no son sensibles, utilizar las tablas de tolerancia de salinidad (cuadros 4 y 5). Para la tolerancia de cloruro de frutales seleccionados, ver tabla 14. Con riego por aspersión y baja humedad (< 30 por ciento), el sodio y cloruro pueden absorberse a través de las hojas de los cultivos sensibles. Para la sensibilidad del cultivo para absorción, ver tablas 18, 19 y 20. 4 NO3 -N significa nitrógeno nítrico reportado en términos de nitrógeno elemental (NH 4 N y N-orgánico deben ser incluidos cuando se están probando las aguas residuales). a) Calidad del agua de riego y su manejo. La fuente principal del cloruro, el boro y el sodio es, en muchos casos, el agua de riego. El manejo correcto del riego puede reducir la toxicidad de estos elementos. b) Bombeo excesivo. Problema acentuado con pozos cercanos al mar. c) Lluvias escasas. Una baja pluviometría no asegura el lavado de las sales que se acumulan en el suelo como resultado del riego. No hay aportes de agua a los acuíferos. Se usa agua de menor calidad. d) Alta evaporación. En regiones con una tasa alta de evaporación las sales se concentran en la capa superior del suelo. e) Capa freática superficial. Las sales que contiene el agua que llega con facilidad a la superficie del suelo por capilaridad se concentran en la capa superior del suelo. 37 f) Alta capilaridad del suelo. Relacionado con los dos puntos anteriores. g) Tipo de suelo. Suelos arcillosos tienden a salinizarse con más facilidad. h) Depresiones del terreno. Las sales superficiales son arrastradas por el agua a las partes bajas del terreno. i) Baja capacidad de infiltración. Dificulta la lixiviación de las sales. j) Drenaje insuficiente. Para el lavado de las sales es necesario asegurar el drenaje interno y superficial. En el Cuadro 2.11. Se presenta el rendimiento potencial de cultivos de acuerdo a valores de EC en el suelo o agua de riego (Ayers y Westcot, 1994). Cuadro 2.11. Rendimiento potencial de cultivos cuando están influenciados por salinidad en el suelo (ECe) y el agua (ECw). 100% CULTIVOS ECe ECw Cebada (Hordeum vulgare) 90% EC EC e w 75% 50% ECe ECw ECe EC w 0% “max” ECe ECw 8 5.3 10 6.7 13 8.7 18 12 28 19 Sorgo (Sorghum bicolor) 6.8 4.5 7.4 5 8.4 5.6 9.9 6.7 13 8.7 Trigo (Triticum aestivum) 6.0 4.0 7.4 4.9 9.5 6.3 13 8.7 20 13 Soya (Glycine max) 5.0 3.3 5.5 3.7 6.3 4.2 7.5 5 10 6.7 Cacahuate (Arachis hypogaea) 3.2 2.1 3.5 2.4 4.1 2.7 4.9 3.3 6.6 4.4 Arroz (Oriza sativa) 3.0 2.0 3.8 2.6 5.1 3.4 7.2 4.8 11 7.6 Caña de azúcar (Saccharum officinarum) 1.7 1.1 3.4 2.3 5.9 4.0 10 6.8 19 12 Maíz (Zea mays) 1.7 1.1 2.5 1.7 3.8 2.5 5.9 3.9 10 6.7 Haba (Vicia faba) 1.5 1.1 2.6 1.8 4.2 2 6.8 4.5 12 8 38 Frijol (Phaseolus vulgaris) 1.0 0.7 1.5 1.0 2.3 1.5 3.6 2.4 6.3 4.2 Fuente: Ayers y Westcot, 1994 2.4.2. Manejo de agua salina para riego Siempre se debe tener en cuenta que el cultivo no se desarrolla en el agua de riego, sino en la solución del suelo, donde las sales pueden estar mucho más concentradas. Cuando se está obligado a usar agua con un nivel de salinidad relativamente alto, se debe evitar en lo posible la acumulación de sales en la zona radical y manejar el agua de riego de tal forma que se reduzca la absorción de elementos tóxicos. Por las características del riego por goteo, es el más indicado para su uso con agua salina. El riego por goteo permite mantener en la zona de raíces una humedad cercana a la capacidad de campo, lo que evita una concentración alta de sales. La zona del bulbo mojado que ocupan las raíces se lava continuamente, lo que previene la acumulación de sales, pero además, no se mojan las hojas con el agua de riego (las hojas de algunos cultivos absorben con facilidad las sales disueltas en el agua de riego) (GAT, 2012). En este contexto, cuando se tienen condiciones de salinidad en suelo, lograr un porcentaje de germinación adecuado se torna un problema. Existen prácticas de manejo para asegurar un alto porcentaje de germinación cuando el suelo está ensalitrado: 1) aumento de cantidad de semilla por hectárea, 2) si se usan surcos, sembrar en el talud y 3) seleccionar cultivos tolerantes a la salinidad (Aceves, 2011). 2.4.3. La salinidad en la producción de caña de azúcar Cuando existe un problema de salinidad, si la sal se acumula en la zona de raíces del cultivo a una concentración de tal magnitud que provoca una pérdida en el rendimiento. En zonas de regadío, estas sales a menudo proceden de un nivel freático cercano a la superficie con agua salina, o de las sales aplicadas en el agua (que puede tener un origen natural o antropogénico). La reducción de rendimiento ocurre cuando las sales se acumulan en la zona radical hasta el punto que el cultivo ya 39 no es capaz de extraer suficiente agua de la solución del suelo salado, provocando un estrés hídrico por un período significativo de tiempo. Si se reduce apreciablemente la absorción de agua, la planta disminuye su tasa de crecimiento. Los síntomas de la planta son similares en apariencia a los de la sequía, como marchitez, o un color más oscuro, verde azulado y en ocasiones las hojas gruesas y cerosas. Los síntomas varían con la etapa de crecimiento, siendo más sensible si las sales afectan la planta durante las primeras etapas de crecimiento. En algunos casos, los efectos leves de la sal pueden pasar inadvertidos completamente debido a una reducción uniforme en crecimiento en el predio entero. La mayor salinidad del agua requiere agua adicional para lograr una lixiviación importante, pero genera un problema potencial asociado con el drenaje y hace casi imposible lograr una solución a este problema a largo plazo. Si el drenaje es adecuado, el control de la salinidad se convierte simplemente en una necesidad de buenas prácticas de manejo para asegurar que el cultivo tenga un suministro de agua adecuado en todo momento, pero que además el agua aplicada produzca suficiente lixiviación para controlar el contenido de sales y que estén dentro del nivel de tolerancia del cultivo (Ayers y Westcot, 1994). La respuesta en rendimiento relativo de la caña de azúcar a la salinidad puede ser expresada por el nivel de la Conductividad Eléctrica en el suelo (ECe) y en el agua de riego (ECw), y su relación con el cultivo. Para lograr el 100% de rendimiento potencial, se requieren valores menores de 1.7 y 1.1 dS/m, respectivamente, pero no se logra rendimiento cuando la CE en el suelo y el agua de riego es mayor de 19 y 12 dS/m, respectivamente (Ayers y Westcot, 1994; Aceves, 2011). El rendimiento relativo para caña de azúcar estimado para condiciones de salinidad por medio de la CEe se puede utilizar la siguiente ecuación lineal: , para un intervalo de aplicación de: (Aceves, 2011). 2.4.4. Unidades de salinidad en el agua La concentración de sales se mide mediante la cantidad total de sólidos disueltos en el agua en miligramos de sal por Litro de agua (mg/L) o 40 gramos de sal por metro cúbico de agua (g/m3) (mg/L= gr/m3 = ppm). La concentración de sales también se puede medir mediante la conductividad eléctrica del agua de riego (ECi). Cuanto mayor sea la cantidad de sales disueltas en el agua, mayor será el valor de la conductividad eléctrica. La conductividad eléctrica se expresa normalmente en milimhos por centímetro (mmhos/cm) o deciSiemens por metro (dS/m) o microSiemens por centímetro (1dS/m=mmhos/cm=1000μS/cm). Otra manera de estimar la concentración de sales es mediante la medida de la conductividad eléctrica del agua extraída de una muestra saturada de suelo (ECe). La relación aproximada entre la conductividad eléctrica del agua de regadío (ECi) y la salinidad del suelo es ECe = 1.5 ECi, si existe alrededor de un 15% de agua suministrada para drenaje alrededor de la zona de la raíz de la planta. La relación entre la concentración de sales (C) y conductividad eléctrica (EC) es aproximadamente C = 640 EC. 2.4.5. Efecto del Boro en los cultivos El boro (B) fue reconocido desde principios del siglo pasado como un elemento esencial para las plantas y se clasifica como un micronutrientes, en virtud de que es requerido en muy pequeñas cantidades. Está involucrado en el transporte de azúcares a través de las membranas celulares, la síntesis e integridad estructural de la pared celular, el desarrollo y crecimiento de procesos reproductivos, el metabolismo de las plantas, así como en la estructura y funcionamiento de la membrana celular, pero además tiene influencia en la transpiración, debido al control de la formación de almidón y azúcar, participa en el desarrollo y elongación celular, así como en la utilización del calcio, lo que sugiere una estrecha relación entre el calcio y boro (Vargas et al., 2007). El boro tiene poca movilidad en el interior de las plantas y los contenidos son superiores en las partes basales respecto a las partes más altas de la planta, en particular si el boro está en exceso; el ritmo de la transpiración ejerce una influencia decisiva sobre el transporte de este elemento hasta las partes más altas de la planta, 41 pero en caso de deficiencia, el contenido de boro en los tejidos decrece rápidamente. Se admite que, más que un elemento móvil o inmóvil en el interior de las plantas, el boro es transportado vía xilema, pero se transporta con dificultad vía floema, razón por la cual no migra de las hojas a los nuevos puntos de crecimiento donde existe la necesidad de un suministro regular de éste y todos los nutrimentos (Alarcón-Vera, 2001; Brown y Hu, 1998). El boro está presente en la solución del suelo en diferentes formas: , , , y . La forma más importante de estas formas es el ácido bórico soluble sin disociación . En el pH citoplásmico común (7.5), más del 98% de boro se reporta que existe como ácido bórico libre y menos del 2%, como anión borato (Sharma, 2006). 2.4.6. Deficiencia de boro en las plantas Las plantas presentan una gran variación en los síntomas de deficiencia de boro; los principales ocurren en los puntos de crecimientos terminales y los tejidos blandos de la conducción (floema) del tallo, pero casi siempre están asociados con anormalidades anatómicas o histológicas. Generalmente, los síntomas de deficiencia de boro aparecen primero en los brotes terminales produciendo hojas pequeñas y deformes, con nacimientos de ramas muy condensadas (Figura 2.3). Figura a) Figura b) Figura 2.3.Deficiencia de Boro en a) remolacha y b) papa. Fuente:Sharma, 2006. 42 El crecimiento de los meristemos apicales es detenido y el brote del ápice se torna necrótico, dando lugar a múltiples ramas axilares que se necrosan. Esto le da a las plantas deficientes en boro, una apariencia tupida. El tallo de plantas deficientes en boro también se vuelve frágil y muestra fracturas longitudinales de la corteza. Hay grandes diferencias en la sensibilidad de las plantas a la deficiencia de boro, muchas crucíferas, leguminosas y solanáceas, muestran alta sensibilidad a la deficiencia de boro (Sharma, 2006). Los valores críticos se definen como la concentración de nutrientes en la planta para alcanzar una reducción en el rendimiento. Los síntomas de deficiencia son generalmente evidentes cuando las concentraciones de nutrientes disminuyen por debajo del valor crítico, los cuales juegan un papel importante en el establecimiento de límites inferiores de rangos de suficiencia. Para la caña de azúcar el valor crítico se establece en 4 mg/L. Por otro lado, la interpretación de los rangos de suficiencia ofrece ventajas significativas sobre el uso de valores críticos. Primero, el hambre oculta en la zona de transición puede ser identificada desde el principio del rango de suficiencia que está por encima del valor crítico. Los rangos de suficiencia tienen límite superior, que proporcionan una indicación de la concentración en la que el elemento puede estar en exceso y para la caña de azúcar es de 10 a 50 mg/L de boro (Campbell, 2000), aunque McCray et al. (2013) sugieren de 10 a 20 mg/L de boro. 2.4.7. Toxicidad por boro en las plantas La toxicidad de boro en las plantas es un problema importante en la agricultura que limita la productividad de los suelos y daño reportado en los cultivos de frijol (Ortega de Pelligrini, 1992), plátano (Vargas et al., 2007), tomate (Cervilla et al., 2012), ricino (Silva et al., 2008), aguacate (Salazar-García, 2002), pistacho (Brown y Hu, 1998), caña de azúcar (Quintero, 2004), entre otros. La toxicidad por boro ocurre en los cultivos con suelos ricos en boro o en suelos expuestos a aguas de riego, fertilizantes, lodo de aguas residuales o cenizas volcánicas volantes ricas en boro. Arriba de 50 mg/L de boro en la planta se rebasa el nivel de suficiencia para mantener un rendimiento óptimo de la caña de 43 azúcar, por lo que valores superiores a 50 mg/L de boro en la planta, puede considerarse el límite inferior comenzar a expresar síntomas de toxicidad por boro (Campbell, 2000; McCray et al., 2013). El problema de toxicidad prevalece en zonas semiáridas donde la lluvia no alcanza a lavar el contenido de boro acumulado en el perfil del suelo; esta complicación es originada de manera natural por: i) la elevada concentración de boro en suelos procedentes de sedimentos marinos o cenizas volcánicas y ii) por la aplicación de agua de riego de pozos profundos con alta concentración de boro, pero también por la aplicación excesiva de boro en suelos donde se identificó deficiencia, por la combustión de combustibles fósiles y deposición de cenizas y la aplicación de materiales, como aguas residuales con alto contenido de boro (Yau y Ryan, 2008). Un factor de confusión en la evaluación de la toxicidad de boro es la ocurrencia conjunta con toxicidad por salinidad. Suelos salinos a menudo contienen altos niveles de sales y boro (Nable et al., 1997), pero también en muchas áreas agrícolas del mundo, el agua subterránea para riego también contiene altos niveles de boro. El agua residual es cada vez más utilizada para el riego y esto puede representar una fuente adicional de boro y salinidad, no obstante que tanto las sales y el boro pueden ser lixiviadas de la zona radical en áreas que reciben altas precipitaciones, en regiones semiáridas tienden a permanecer en el suelo (Reid, 2013). Los síntomas típicos de plantas expuestas a exceso de boro son vigor reducido, desarrollo retardado, quemadura de las hojas (manchas cloróticas y necróticas en las hojas más viejas) y disminución del número, tamaño y peso de frutos (Figura 2.4). Sin embargo, a pesar de la importancia de la toxicidad de boro para la productividad de los cultivos, el mecanismo por el cual las plantas responden a boro exceso es poco entendido, por lo que se necesita más investigación. En este sentido, uno de los estudios más comunes en plantas sometidas a estrés abiótico es determinar los indicadores bioquímicos más confiables de la tolerancia con el fin de utilizarlos, como un criterio de 44 selección entre diferentes variedades (Cervilla et al., 2012; Quintero, 2004). Figura 2.4. Síntomas de toxicidad por boro en caña de azúcar. Fuente: Inifap 3. JUSTIFICACIÓN De acuerdo con la Comisión Nacional del Agua (CNA, 2011), en México la agricultura utiliza más del 76.7% del uso consuntivo del agua (61.7 km3), del cual 33.82% es agua subterránea. En el 2009, la superficie en unidades agrícolas de producción fue de 30.22 millones de hectáreas, de las cuales el 18% fue de riego y el resto tenía régimen de temporal, con un rendimiento de 2.2 a 3.6 veces mayor que la superficie de riego que en el régimen de temporal; la aportación de sector primario que engloba a la agricultura, ganadería, aprovechamiento forestal, pesca y caza al Producto Interno Bruto Nacional (PIB) fue de 3.8%, a precios constantes del 2003. Por otro lado, en la Encuesta Nacional de 45 Ocupación y Empleo (ENOE), la población ocupada en este subsector al cuarto trimestre del 2009 fue de 6.1 millones de personas, lo que representó el 13.7% de la población económicamente activa, donde se estima que dependen directamente de la actividad agrícola 30 millones de mexicanos, en su mayoría población rural. La agricultura es el uso que mayor demanda de agua supone a nivel mundial. El riego de tierras agrícolas supone la utilización del 70% de los recursos hídricos en el mundo. En los países en vías de desarrollo, muchas veces el agua utilizada para regadío represente el 95% del total de usos del agua, y juega un papel esencial en la producción y seguridad de los alimentos. A largo plazo, el desarrollo y mejora de las estrategias agrícolas para estos países está condicionado al mantenimiento, mejora y expansión de la agricultura de regadío. Sin embargo, el incremento de la presión sobre los recursos hídricos para la agricultura compite con el uso del agua para otros fines y representa una amenaza para el medio ambiente y utilización insostenible de los recursos hídricos del planeta (Radwan, 2002). La irrigación es vital para producir una calidad aceptable y buen rendimiento de los cultivos en áreas de clima semiárido. La irrigación suplementada también es vital para producir calidad aceptable en las zonas climáticas semiáridas, y subhúmedas durante periodos estacionales de sequía. El manejo completo de las aguas de irrigación por el usuario es una actividad necesaria para un mejor control ya que la irrigación de los cultivos es vital para la subsistencia de la sociedad (Radwan, 2002). 46 4. PROBLEMÁTICA Poco se conoce del impacto que ha generado el uso continuo del agua utilizada en la irrigación de las áreas agrícolas en el área de Ameca, pues experiencias similares en otras regiones del país ha mostrado un deterioro paulatino de las tierras con pérdida de productividad, incluso, transferencia de contaminantes a los cultivos producidos. Además de las condiciones de calidad de agua que se han determinado en trabajos previos, los habitantes en los alrededores de la presa y los usuarios perciben maleza acuática, olor y olor en el agua del embalse. En el caso del suelo, los productores usuarios, perciben la presencia de sales y detectan la reducción de la productividad. Aunque autoridades y la población civil han desarrollado acciones para mejorar la calidad del agua del embalse, como es el control de la maleza acuática, se requieren acciones de prevención asociadas con el saneamiento de aguas residuales e industriales vertidas al embalse aguas arriba, así como mejorar la prácticas de manejo en los terrenos agrícolas del área de la cuenca hidrográfica del embalse. Por otro lado, poco se conoce del impacto que ha generado el uso continuo del agua utilizada en la irrigación de las áreas agrícolas aguas abajo, pues las experiencias similares en otros regiones del país ha mostrado un deterioro paulatino de las tierras agrícolas con pérdida de productividad, e inclusive, transferencia de contaminantes a los cultivos producidos y efecto en la salud de la población que consume estos alimentos. 5. OBJETIVO Objetivo Principal Realizar un diagnóstico de la situación actual de la calidad del agua del embalse de la presa La Vega y los terrenos agrícolas en el área de estudio. 47 Objetivos Específicos 1. Evaluar las condiciones de calidad del agua que presentan los principales afluentes al embalse de la presa La Vega. 2. Evaluar la calidad del agua de escurrimiento en el área de drenaje de la cuenca hidrográfica de la presa La Vega. 3. Evaluar el impacto de la calidad del agua en los suelos y su productividad en el área de influencia de la presa La Vega. 6. 6.1. METODOLOGÍA Descripción del área de estudio Dentro de las regiones hidrológicas del estado de Jalisco, se encuentra la región-Ameca dentro de la cual se encuentra la presa La VegaCocula, el río Ameca-Atenguillo y el río Ameca-Ixtapa (Figura 6.1), con una cobertura de la superficie estatal mostrada en el Cuadro 6.1, el área de influencia de la presa La Vega abarca los siguientes municipios: Ameca, San Martin Hidalgo, Cocula, Tala, Teuchitlán, Ahualulco de Mercado, Villa Corona, Zapopan, el Arenal, Tequila, Magdalena, San Juanito de Escobedo, Etzatlán, Tecolotlán, Atemajac de Brizuela y Zacoalco de Torres. 48 Figura 6.1. Presa La Vega y su área de influencia (CEA, 2012) Cuadro 6.1. Región Ameca, cuencas y su porcentaje en superficie estatal. Región Cuenca Ameca Presa La Vega-Cocula 2.68 Rio Ameca-Atenguillo 4.90 Rio Ameca-Ixtapa 4.26 % de la superficie estatal Fuente: CEA (2012). La presa La Vega se localiza a 5 km aguas abajo del rio Ameca (el cual se caracteriza por la presencia de manantiales) y la cortina del mismo está localizada a 9.5 km al sur del poblado de Teuchitlán. El embalse tiene varios tributarios: del norte recibe el aporte del rio Teuchitlán el cual es permanente, sin embargo es también reservorio de las descargas municipales de Teuchitlán que desembocan finalmente en el embalse. También en el norte existe una serie de manantiales de El Rincón que desembocan en el embalse. En el oeste la presa La Vega se alimenta de los aportes del rio Grande o La Mora y el arroyo Chapulinita. Sin embargo, el mayor aporte es en el sureste el cual corresponde al rio Salado, siendo éste la mayor recarga permanente del embalse y que además transporta las aguas provenientes del Ingenio de Tala y las descargas municipales de la cabecera de Tala (CEA, 2008). 49 Figura 6.2. Área de drenaje del embalse de la presa La Vega Fuente: SEMARMAP (2011). El diagnóstico fue de tipo exploratorio, considerando el embalse de la presa y los terrenos agrícolas donde se utiliza el agua para riego. Se realizó un reconocimiento físico del área de estudio para la ubicación estratégica de los sitios de muestreo de agua y suelo. 6.2. Metodología para el análisis de agua La selección de sitios para muestreo de agua se realizó considerando los principales afluentes a la presa La Vega. Los afluentes son tributarios que desembocan en un cuerpo de agua como es el caso de la presa La Vega. Se seleccionaron los 5 afluentes principales a la presa La Vega, 1 sitio en la parte oeste, 3 en el norte y 1 en el sureste, se consideró una distancia de 200 m antes de su entrada al embalse para evitar la influencia del proceso de mezclado con agua de la presa. Para la selección de sitios dentro de la presa, se desarrolló un muestreo aleatorio, para lo cual s e 50 obtuvo una imagen satelital reciente del cuerpo de agua y la red de canales de riego, la imagen se dividió en cuadrantes de 1 km2 utilizando el software Google earthTM. Los cuadrantes fueron enumerados y por medio del paquete estadístico Minitab 16 se seleccionaron aleatoriamente 13 cuadrantes a lo largo de la presa, 26 sitios en la red y 3 en el rio Ameca. Para la recolección de muestras se utilizó una lancha dentro de la presa y vehículo terrestre para los ubicados en la red de distribución, los sitios fueron localizados utilizando un GPS (Etrex Marca Garmin®). La recolección de muestras de agua fue específica para cada parámetro a evaluar siguiendo los lineamientos técnicos establecidos en la Norma Oficial mexicana NOM-AA-14-1980 “Cuerpos receptores, muestreo” publicado en el Diario Oficial de la federación el viernes 27 de agosto de 1980. Se llevó a cabo por personal calificado del INIFAP, utilizando material de muestreo con las condiciones específicas de material y volumen requerido en cada parámetro a evaluar así como las especificaciones de preservación y traslado al laboratorio. La recolección de muestras de agua se llevó a cabo los días 24 y 25 de Mayo del 2012, entre las 8:00 y 12:00 horas del día. En el Cuadro 6.2 se presentan los parámetros que se analizaron y la metodología utilizada. Se incluyen análisis físico-químicos, metales pesados así como parámetros biológicos como Coliformes fecales y totales y análisis cuantitativo y cualitativo de plancton en un total de 48 sitios (Figura 6.4). 51 Figura 6.3. Sitios de muestreo seleccionados, afluentes a la presa La Vega, dentro de la presa, rio Ameca y la red de canales de riego. Elementos químicos y metales pesados analizados; arsénico, cadmio, cobre, cromo total, fierro, manganeso, mercurio, sodio, plomo, zinc, níquel, boro, calcio, magnesio y potasio. Se analizaron utilizando equipo de absorción atómica. 52 Cuadro 6.2. Parámetros físico-químicos y biológicos determinados en agua, afluentes a la presa, dentro de la presa, rio Ameca y red de canales de distribución. Parámetro Métodos en laboratorio Alcalinidad a la fenolftaleína (mg/L) Alcal. al anaranjado de metilo (mg/L) Alcalinidad total (mg/L) Cloruros (mg/L) Sulfatos (mg/L) Turbiedad (UNT) Dureza cálcica (mg/L) Dureza magnésica (mg/L) Dureza total (mg/L) Nitrógeno total (mg/L) Nitratos (mg/L) Nitrógeno amoniacal (mg/L) Nitritos (mg/L) Ortofosfatos (mg/L) Fosforo total (mg/L) Sólidos disueltos totales (mg/L) Sólidos volátiles (mg/L) Clorofila a (mg/L) Fitoplancton identificación Fitoplancton cuantificación Parámetros en campo Conductividad eléctrica (s/m) Temperatura (ºC) Oxígeno disuelto(mg/L) ph (unidades) Parámetros biológicos Coliformes totales (nmp) Coliformes fecales (nmp) Método analítico NOM-AA-036-SCFI-2001 NOM-AA-036-SCFI-2001 NOM-AA-036-SCFI-2001 NMX-AA-073-SCFI-2001 NMX-AA-074-1981 NMX-AA-038-SCFI-2001 NMX-AA-072-SCFI-2001 NMX-AA-072-SCFI-2001 NMX-AA-072-SCFI-2001 NMX-AA-026-SCFI-2010 NMX-AA-082-1996 NMX-AA-026-SCFI-2010 NMX-AA-099-SCFI-2006 NMX-AA-029-SCFI-2001 NMX-AA-029-SCFI-2001 Métodos estándar, método 2540 c Métodos estándar, método 2540 e Métodos estándar, método 2540 e Métodos estándar, método 10200 Métodos estándar, método 10200 f NMX-AA-093-SCFI-2000 NMX-AA-007-SCFI-2000 NMX-AA-012-SCFI-2001 NMX-AA-008-SCFI-2000 NOM-113-SSA1-1994 NOM-113-SSA1-1994 53 6.3. Análisis de resultados de agua 6.3.1. Determinación del Índice de Calidad del Agua (ICA) Para determinar la calidad del agua se utilizó el Índice de Calidad del Agua (ICA) el cual es un diseño sencillo que permite incluir “n” número de variables en la integración, previa ponderación de su magnitud, siendo entonces aplicable a series de datos tanto numerosas como pequeñas. Proporciona un valor global de la calidad del agua en función de los valores individuales a una serie de parámetros, para lo cual se realizan varias transformaciones numéricas en cada uno de los resultados a integrar. El primer procedimiento fué la normalización de los valores individuales que conforman el índice al establecer una correspondencia de los resultados obtenidos en cada uno de los parámetros, con una escala variable de 0 a 100 que se construye en función de los valores límite establecidos. Se asume como valor de 100 % al que indica condiciones naturales u óptimas en un cuerpo de agua y el 50 % corresponde al máximo permitido. Una valoración menor al 50 % significa que existen limitantes de importancia para su utilización. Los parámetros utilizados en el cálculo del ICA se presentan en los Cuadros 6.3 y 6.4, con la correspondiente normalización de parámetros (Conesa y Fernández, 1993). 54 Cuadro 6.3. Normalización de parámetros para la determinación del ICA. Valor Analitico 1/14 2/13 3/12 4/11 5/10 6/9.5 6.5 9 8.5 8 7 Oxígeno Disuelto 0 1 2 3 3.5 4 5 6 6.5 7 7.5 Dureza Total >1.500 1 800 600 500 400 300 200 100 50 <25 Sólidos disueltos >20.00 10 5 3 2 1.5 1 750 500 250 <100 Unidad Unidad mg/L mg/L CaCO3 mg/L Parámetro pH Cuadro 6.4. Normalización cálculo del ICA. Conductividad Valor >16.00 12 8 5 3 2.5 2 1.5 1.25 1 <750 0 10 20 30 40 50 60 70 80 90 100 µmhos/cm % de los parámetros utilizados en el Parámetro Sulfatos Nitratos Nitritos Cloruros Color Turbiedad Valor Valor Analitico >1.5 1 600 400 250 150 100 75 50 25 0 >100 50 20 15 10 8 6 4 2 1 0 >1 0.5 0.25 0.2 0.15 0.1 0.05 0.025 0.01 0.005 0 >1.500 1 700 500 300 200 150 100 50 25 0 >200 150 100 75 50 20 16 12 8 4 0 >100 70 50 30 20 10 8 6 4 2 0 0 10 20 30 40 50 60 70 80 90 100 Unidad mg/L SO4 mg/L NNO3 mg/L N-NO2 mg/L Esc. Pt.-Co. UTN % 55 El segundo procedimiento fué la asignación del peso numérico a cada parámetro de acuerdo a su importancia en los criterios normales de calidad. La determinación del peso de un parámetro se realiza de forma conjunta en un equipo especializado en la calidad del agua. Se aplicó los pesos asignados en trabajos previos en el Lago de Chapala (León, 1990) a fin de conservar el mismo marco referencial para posteriores comparaciones. En el Cuadro 6.5 se presentan los pesos asignados. Cuadro 6.5. Peso otorgado a los parámetros incluidos en la determinación del ICA. Parámetro Peso (Wi) Parámetro Peso (Wi) Oxígeno Disuelto 5.0 Nitrógeno de nitratos (NO3-1) 2.0 Conductividad 2.0 Color 1.0 Sulfatos 2.0 Dureza Total 1.0 Nitritos (NO2) 2.0 Potencial de Hidrogeno (pH) 1.0 Cloruros (CL-1) 0.5 Sólidos disueltos 0.5 Turbiedad 0.5 Fuente: León, 1990. Una vez obtenido los valores anteriores, se aplica la siguiente ecuación: Donde el subíndice i identifica a cada parámetro utilizado en el cálculo del ICA, por lo que i= 1,2,3………?? y n=1 56 Los resultados se interpretan de acuerdo al Cuadro 6.6 donde los intervalos de las categorías del ICA son: 0-39%, Altamente contaminado; 40-59%, Contaminado; 60-90% Levemente contaminado; 91-100% Aceptable. De esta manera se determinan los usos del agua en función de la escala del ICA obtenido. Cuadro 6.6. Cuadro con valores comparativos de acuerdo al valor ICA y sus limitantes de uso en las diferentes actividades. ICA 100 90 80 70 Pesca y vida acuática Uso Público Recreo Aceptable, no requiere de purificación Requiere de ligera purificación Aceptable para todo tipo de deporte acuático Aceptable para todo tipo de organismos Aceptable pero no recomendable Excepto especies muy sensibles Dudoso para especies sensibles Sin necesidad de tratamiento para la industria normal Solo para organismos muy resistentes Con tratamiento para la mayor parte de la industria Inaceptable Uso muy restringido Mayor necesidad de tratamiento 60 50 Dudoso 40 Inaceptable 30 20 Dudoso para contacto directo Sin contacto con el agua Muestras obvias de contaminación Inaceptable Industria Agrícola Aceptable no requiere de purificación Requiere de ligera purificación Inaceptable 10 0 Fuente: CNA, 2011. 57 6.3.2. Metodología para la determinación del riesgo por salinidad (SAR) y carbonato sódico residual (CSR) en agua para uso en riego agrícola Debido a que el principal uso del agua de la presa es el riego, el análisis de resultados también se orientó en este sentido con la determinación del riesgo por salinidad. Los especialistas en suelos utilizan los siguientes criterios para describir la calidad del agua de irrigación y sus efectos en los cultivos y su influencia en la calidad de los suelos. Riesgo por salinidad (contenido total de sal soluble) Riesgo por sodio (la proporción relativa de los iones de sodio, calcio y magnesio) pH (ácidos y bases) Alcalinidad (carbonatos y bicarbonatos) Iones específicos (cloruros, sulfatos, boro y nitratos) Es importante mencionar que estos autores manejan unidades de medición (meq/L, para el caso de cationes y aniones y dS/m, en el caso de conductividad) en los parámetros, los cuales se manejan con diferentes unidades en las Normas Oficiales Mexicanas y en la determinación del ICA. El Cuadro 6.7 muestra los parámetros importantes a determinar en la evaluación de la calidad del agua de riego según Ayers y Westcot, (1994). 58 Cuadro 6.7. Parámetros para determinar la calidad del agua de riego. Parámetros en agua Simbología Unidades Rango (para aguas de irrigación) Salinidad Conductividad eléctrica o Solidos disueltos totales ECw dS/m TDS mg/L Cationes y aniones Calcio Ca++ meq/L Magnesio Mg++ meq/L + Sodio Na meq/L -Carbonato CO 3 meq/L Bicarbonato HCO3 meq/L Cloruros Cl meq/L -Sulfatos SO4 meq/L Nutrientes Nitratos NO3-N mg/L Amoniaco NH4-N mg/L Fósforo PO4-P mg/L Potasio K+ mg/L Otros parámetros importantes Boro B mg/L pH pH 1–14 Absorción de sodio SAR (meq/L) Fuente: Ayers y Westcot, 1994. 0–3 0 – 2000 0 – 20 0–5 0 – 40 0 – .1 0 – 10 0 – 30 0 – 20 0 – 10 0–5 0–2 0–2 0–2 6.0 – 8.5 0 – 15 59 a) Proporción de Sodio Adsorbido (SAR, por sus siglas en ingles) Para el análisis de resultados se utilizó el cálculo de la proporción de sodio adsorbido (SAR, siglas en inglés). Representado con la ecuación √ donde sodio, calcio y magnesio en meq/L respectivamente, en el resultado de análisis de agua. b) Carbonato Sódico Residual (CSR), para predecir tendencias de precipitación de calcio y magnesio en suelo y se calcula con la siguiente ecuación; CSR=([CO32-] + [HCO3-]) – ([Ca2+] + ([Mg2+]) 6.3.3. Análisis comparativo con criterios establecidos para aguas de irrigación. Comparación con los Criterios Ecológicos de Calidad del agua CE-CCA001/89 (calidad para riego agrícola: grado de calidad del agua, requerido para llevar a cabo prácticas de riego sin restricción de tipos de cultivo, tipos de suelo y métodos de riego). 60 6.3.4. Utilización de estadística básica descriptiva y otras herramientas para la representación gráfica de la información en los resultados de muestras de agua Se realizó un análisis descriptivo de los parámetros evaluados, utilizando media y desviación estándar. Para obtener una representación visual apropiada se realizaron los gráficos con la información obtenida. Además, se utilizaron sistemas de información geográfica (GIS) para presentar de manera espacial los resultados. 6.4. Muestreo de suelos Se realizó un recorrido de campo en los terrenos sembrado con el agua del embalse de la presa La Vega. Se detectó residuos de material salino en estos terrenos, por lo que se optó por usar el pH como referencia para determinar el tamaño de muestra. Se utilizó un muestreo al azar en los terrenos sembrados con caña de azúcar dentro de la zona de riego de La presa la Vega. El tamaño de muestra se determinó utilizando la media y varianza de los primeros 30 muestras de suelo y posteriormente la aplicación de la fórmula siguiente (Daniel, 1997): n N S2 Z 2α 2 S2 Z 2α 2 N - 1 d2 Donde n es el tamaño de muestra, N es la población de productores, S2 es la varianza de la muestra, d es la magnitud del intervalo de confianza (por la distribución del pH se consideró 0.15 unidades con respecto a la media), Z es el coeficiente de confiabilidad de la muestra (95%). Los valores de pH promedio y su varianza que resultaron de la primeras 30 muestras fueron: 6.809 y 0.788, respectivamente. El total de productores N que utilizan el agua de presa se estimó en 2,500 productores. El tamaño de muestra que resultó fue de 100 predios. 61 El área para el muestreo de suelos se seleccionó cubriendo los terrenos que son irrigados con agua de la presa La Vega. La evaluación del impacto de la calidad del agua en los suelos irrigados con agua de la presa La Vega y su productividad, se realizó en dos etapas: 1) análisis de la condición salina en dos profundidades del suelo, y 2) análisis del efecto de la salinidad sobre la productividad de caña de azúcar, con base en el modelo de rendimiento relativo (Ayers y Westcot, 1994). 6.4.1. Análisis de la condición de salinidad y contenido de boro en el suelo. En la primera quincena del mes de mayo se realizó un muestreo de suelo en las profundidades de 0 a 5 cm y 5 a 35 cm. El número de muestras de suelo de terrenos agrícolas que utilizan el agua de la presa para el riego agrícola fue de 100 muestras, con una distribución mostrada en la Figura 6.4. Se utilizó un muestro al azar, pero consideró la distancia de alejamiento de la cortina de la presa y el canal principal y red de distribución de agua de riego. 62 Figura 6. 4. Sitios de muestreo de suelo en el área de drenaje del embalse de la presa La Vega. A las muestras de suelo se les realizó las determinaciones en el suelo y el extracto de saturación siguientes: a) en el suelo materia orgánica y textura (porcentaje de arena y arcilla), b) en el extracto de saturación: el contenido de boro, aniones (CO3, HCO3, Cl, SO4, NO3), cationes (Ca, Mg, Na, K), y conductividad eléctrica. Se estimó el valor del SAR, utilizando la ecuación mencionada anteriormente. El efecto combinado de las sales, expresado como SAR y CE sobre la capacidad de infiltración del suelo, se evaluó con la información del Cuadro 6.8. 6.4.2. Muestreo de plantas Se utilizó la misma información con que se determinó el tamaño de muestra para el suelo, solo se amplió el intervalo de confianza d a 0.5 63 unidades de pH con respecto a la media. El tamaño de muestra que resultó fue de 10 predios. Este muestreo fue realizado al azar, tomado la parte aérea de dos plantas de cada predio, posteriormente se secaron al aire libre, se molieron y se enviaron al laboratorio para su análisis. La determinación que se realizó fue el contenido de boro. Cuadro 6.8. Efecto combinado de la conductividad eléctrica y la proporción de adsorción de sodio (SAR) sobre la capacidad de infiltración en el suelo. Problema de infiltración del agua SAR en suelo Improbable cuando CE (dS/m) es mayor de: Probable cuando CE (dS/m) es menor de: 0–3 0.60 0.30 3–6 1.00 0.40 6 – 12 2.00 0.50 12 – 20 3.00 1.00 20 – 40 5.00 Fuente: Ayers y Westcot, 1994. 2.00 6.4.3. Análisis de información Se realizó un análisis descriptivo de las variables de suelo con los estadísticos: media y desviación estándar, además de histogramas de frecuencia. Para analizar la distribución espacial de las variables de suelo analizadas, se utilizó el sistema de información geográfica ARCVIEW, para las variables de suelo de 0 a 5 cm y de 5 a 35 cm de profundidad. 64 7. RESULTADOS 7.1. Índice de Calidad del Agua (ICA) Los resultados del ICA se presentan en la Figura 7.1. Como se puede observar los valores del ICA presentaron variabilidad en los sitios. Esta variabilidad no tiene un componente temporal debido a que la recolección de muestras de agua se realizó solo en una fecha (dos días consecutivos). Sin embargo, se observó variabilidad espacial, los afluentes en la parte norte de la presa presentaron los valores más altos (74-77) respecto al resto de los sitios, lo cual indica que los niveles de calidad fueron más elevados en estos afluentes. El valor del ICA dentro de la presa fluctuó entre 69 y 74, lo cual representa una disminución en las condiciones de calidad del agua respecto a los afluentes en la parte norte y oeste de la presa. La calidad del agua disminuye debido a la descarga directa de aguas residuales domésticas sin tratamiento procedente de Teuchitlán y la zona de restaurantes al margen de la presa. El valor del ICA disminuyó en el sitio 19 (ICA de 65 unidades) que corresponde al rio Salado, siendo el valor más bajo obtenido en todo el análisis. Este afluente transporta desechos domésticos y de la industria azucarera sin tratamiento, de manera que esto afecta negativamente la calidad del agua del rio. Se observó que el resultado del ICA en la red de canales de riego y el rio Ameca disminuye respecto a los valores obtenidos dentro de la presa. En este sentido, la entrada del rio Salado disminuye la calidad del agua de la presa al mezclarse cerca de la cortina de la misma (Figura 6.6). Cuando el agua sale de la presa hacia los canales de riego y el rio Ameca, se observa claramente una tendencia en la disminución del ICA. Por otro lado, utilizando la escala comparativa (Cuadro 6.6) se determinó que los resultados del ICA fluctuaron entre 60 y 80, lo cual indica condiciones de calidad aceptables, sin embargo los rangos también incluyen algunas restricciones para ciertas actividades (Cuadro 7.1). 65 Cuadro 7.1. Resultado del ICA y usos recomendables del agua. Usos del agua Uso para riego Recomendaciones de uso Calidad aceptable, no requiere tratamiento previo. Uso público (doméstico) Requiere tratamiento Recreación Aceptable pero no recomendable Pesca y vida acuática Se puede utilizar, excepto para especies muy sensibles, Dudoso para especies sensibles El uso principal del agua de la presa La Vega es el riego y de acuerdo al Cuadro 7.1 el agua cumple con niveles aceptable para este uso en particular. Figura 7.1. Resultados de la determinación del ICA, en los afluentes a la presa, dentro de la presa, rio Ameca y red de canales de riego. 66 7.2. Riesgo por salinidad (contenido total de sal soluble) 7.2.1. Conductividad Los resultados obtenidos de la CE se presentan en la Figura 7.1. Los resultados mostraron valores bajos de CE en los afluentes a la presa La Vega en la parte norte de la misma, donde se encuentra una serie de manantiales y la entrada en el oeste del río grande (sitios 1 al 5). Sin embargo, el sitio 2 presentó CE elevada (0.64 ds/m) respecto a los demás afluentes en la parte norte, éste corresponde al arroyo Chapulimita, al cual confluyen escurrimientos superficiales provenientes de la agricultura que le otorga características diferentes de calidad en comparación con los manantiales. Por otro lado, dentro del embalse se observó un incremento paulatino de la CE en los sitios más cercanos a la cortina de la presa y la entrada del rio Salado. El sitio 18 presentó el valor más elevado de CE dentro de la presa respecto a los demás, este se localiza cerca de una pequeña desviación del rio Salado que desemboca metros arriba de la desembocadura del rio Salado en el embalse lo cual le otorga características diferentes a los demás sitios localizados dentro del embalse. Considerando la totalidad de los sitios muestreados el 19 presentó el valor más elevado de CE, este sitio corresponde al rio Salado el cual desemboca en la parte Sureste de la presa transportando desechos domésticos e industriales. Comparando los resultados con los criterios y restricciones del uso del agua para riego, establecidos para CE (Cuadro 2.3), se obtuvo lo siguiente: a) Sin restricciones: afluentes parte norte de la presa. b) Algunas restricciones: canales de riego y rio Ameca. c) Riesgo moderado: rio Salado (para su utilización directa). 67 Figura 7.2. Valores de Conductividad Eléctrica en los afluentes a la presa, dentro de la presa, red de canales de riego y el rio Ameca. La CE en la red de canales de rio y el rio Ameca se incrementó ligeramente respecto a la observada en la presa y sus afluentes. También se puede observar en la Figura 7.2, que la CE en los sitios aguas abajo de la presa (red de canales de riego y al rio Ameca), los resultados mostraron un incremento en la CE una vez que se produce el proceso de mezcla con el rio Salado. De acuerdo con lo mencionado anteriormente y considerando que el agua sale directamente de la presa a los canales de riego, la CE presento poca variabilidad lo cual es una condición esperada. Los datos presentaron un valor promedio de 0.69 y desviación estándar de 0.14. 68 7.3. Riesgo por sodio (la proporción relativa de los iones de sodio, calcio y magnesio). 7.3.1. Proporción de Sodio Absorbido (SAR, Absorption Ratio por sus siglas en inglés) Sodium Los resultados de la determinación del SAR se presentan en el Cuadro 7.4. De acuerdo a los criterios establecidos para el valor del SAR (Cuadro 2.8) los resultados obtenidos mostraron que el 10.4% de los sitios presentó riesgo bajo, el 83.3% riesgo medio, mientras que el 4.1% presentó riesgo alto y solo el 2.0% riesgo muy alto. El riesgo bajo por sodicidad correspondió a los 4 afluentes a la presa La Vega localizados en la parte norte y 1 en el oeste de la misma. Estos resultados coinciden con los obtenidos en la determinación del ICA, donde estos mismos sitios presentaron valores más altos de calidad de agua. Los 40 restantes presentaron riesgo medio se localizan dentro de la presa y en la red de canales de riego. Solo 2 sitios presentaron riesgo alto los cuales corresponden al sitio 18 localizado dentro del embalse y cerca de la entrada de una bifurcación del rio Salado, lo cual le otorga características diferentes de calidad de agua respecto a los demás dentro de la presa y en la red de canales de riego. Por último el sitio 19 que correspondiente al rio Salado que sobresale respecto a los demás, se determinó un valor SAR considerablemente alto de 360. Esta condición está relacionada con las características del agua que transporta el rio provenientes de la industria azucarera y aguas residuales domesticas sin tratamiento (Figura 7.3). 69 Cuadro 7.1. Resultados del riesgo por sodicidad en los afluentes a la presa, dentro de la presa, rio Ameca y la red de canales de riego. Resultado del Riesgo de Sodicidad (SAR) Valor SAR Riesgo 0 - 10 11-17 18 - 26 más de 26 Bajo Medio Alto Muy alto Número de muestras 5 40 2 1 Figura 7.3. Valores de SAR encontrados en los afluentes a la presa, dentro de la presa, rio Ameca y red de canales de riego. 70 Se suguiere que los procesos de dilución actúan positivamente reduciendo la concentración de contaminantes del rio Salado cuando éste desemboca en el embalse (Shen, 1978). Sin embargo se observó el proceso inverso en el agua de la presa al incorporarse el rio Salado se incrementó el valor del SAR. Esto se observó en el incremento del SAR en la red de canales de riego. Este proceso provoca también que las caracteristicas del agua que sale de la presa para irrigación, se afecte de manera negativa, acarreando hasta los suelos irrigados concentraciones altas de algunos elementos no deseables en los cultivos y que incluso pueden provocar toxicidad. Las Figuras 7.4 y 7.5 muestran espacialmente los sitios de muestreo y el resultado del SAR. El promedio del valor SAR obtenido fue de 22.6, con una desviación estándar de 6.12. Figura 7.4. Representacion espacial de los valores de SAR encontrados en los afluentes a la presa y dentro de la presa La Vega. 71 Figura 7.5. Representacion espacial de los valores de SAR encontrados en la red de canales de riego. 7.3.2. Carbonato Sódico Residual (CSR) La Figura 7.6 muestra los resultados del Carbonato Sódico Residual (CSR) en todos los sitios muestreados, donde más del 95% de los sitios muestreados presentaron riesgo alto de precipitación de calcio y magnesio en el suelo y por lo tanto el riesgo de incremento del valor de SAR aumenta también. Se observó que solamente 1 sitio localizado al Norte de la presa presentó riesgo bajo, los 4 afluentes restante de la parte Norte presentaron valor CSR menor de 2, lo cual indica riesgo medio (Cuadro 7.6). Sin embargo, los sitios restantes dentro de la presa, rio Ameca, rio Salado y red de canales de riego, presentaron riesgo alto, lo cual indica que para este parámetro en particular el agua no es recomendable para su uso en irrigación. 72 Cuadro 7.2 . Resultados del riesgo de carbonato sódico residual (CSR), en los afluentes a la presa, dentro de la presa, el rio Ameca y la red de canales de riego. Resultado del riesgo de carbonado sódico residual (CSR) CSR (meq/L) Riesgo Número de muestras en cada nivel de riesgo <1.25 1.25 – 2.5 Bajo 1 4 más de 2.5 Medio Alto 43 Figura 7.6. Valores de CSR encontrados en los afluentes a la presa, dentro de la presa, rio Ameca y la red de canales de riego. En las Figuras 7.7 y 7.8, se muestran espacialmente los resultados obtenidos del cálculo del CSR, se determinó riesgo bajo y medio en los afluentes a la presa en la parte Norte. Sin embargo, en la totalidad de los sitios dentro de la presa representó riesgo alto para CSR. El valor más elevado (7.16) detectado correspondió al rio Salado, mientras el 73 más bajo correspondió a un afluente en la parte Norte de la presa (0.74). El valor CSR promedio encontrado fue de 3.64 y la desviación estándar de 1.12. Figura 7.7. Valores de CSR encontrados en los diversos sitios de muestreo dentro de la presa y sus afluentes. 74 Figura 7.8. Valores de CSR encontrados en los diversos sitios de muestreo, en el rio Ameca y la red de canales de riego. 7.3.3. pH Los resultados mostraron alta variabilidad en las unidades de pH en los diversos sitios (Figura 7.9) sin embargo, no se detectaron tendencias en el comportamiento de las muestras, el promedio fue de 8.33 y la desviación estándar de 0.16. Estos resultados no representan riesgo para la vida acuática existente en la presa, así como para los cultivos irrigados con agua de la misma. 75 Figura 7.9. Valores de pH encontrados en los afluentes a la presa, dentro de la presa, rio Ameca y la red de canales de riego. 7.3.4. Alcalinidad (carbonatos y bicarbonatos) Se puede observar en la Figura 7.10 la tendencia en los diversos sitios de muestreo respecto a la alcalinidad total. Los resultados mostraron valores bajos en los 3 primeros sitios que corresponden a los afluentes de la parte norte de la presa. Sin embargo, su valor se incrementa 3 veces dentro de la presa. Cierta homogeneidad se presentó dentro de la presa y los sitios en la red de distribución y el rio Ameca. En promedio el valor de la alcalinidad total correspondió a un valor de 23.10 y una desviación estándar de 4.40. Resultados encontrados mostraron variabilidad, considerando los criterios internacionales el rango varió de mínimo aceptable a moderadamente amortiguadora para el agua de la presa y sus afluentes. Lo cual indica cierta capacidad de resistir a los cambios de pH. Esta capacidad amortiguadora es una condición favorable para la vida acuática de la presa y el uso principal del agua, ya que al tener 76 esta capacidad disminuye los probables efectos que los cambios de pH provoca en el sistema acuático, estos efectos se mencionan de manera más amplia en la sección 7.4 correspondiente al pH. Figura 7.10. Valores de Alcalinidad Total obtenidos en afluentes a la presa, dentro de la presa, rio Ameca y la red de canales de riego. 7.4. Iones específicos; (Cloruros, sulfatos, boro y nitratos) 7.4.1. Cloruros En los resultados obtenidos se determinaron concentraciones de cloruros de 10 a 93 mg/L (Figura 7.11). Las concentraciones más bajos correspondieron a los afluentes de la parte Norte de la presa, sin embargo en el sitio 2 el cual corresponde al rio el ahogado la concentración se elevó considerablemente, al cual confluyen escurrimientos superficiales de la parte Norte de la presa donde los terrenos son cultivados con caña de azúcar principalmente. Según Virto 77 et al., (2007) la utilización excesiva de químicos en zonas agrícolas son transportados por los escurrimientos superficiales, los cuales llegan a los cuases de ríos y arroyos y contribuyen de manera importante a los niveles de contaminación de los cuerpos de agua superficiales. La concentración de cloruros más elevada dentro de la presa correspondió al sitio 18, el cual se localiza relativamente cerca de la entrada del rio Salado a la presa lo cual le otorga características diferentes al resto de los sitios dentro del embalse. La concentración de cloruros más elevada correspondió al sitio 19 (rio Salado) este resultado coincide con otros parámetros (SAR, CSR y pH) donde la concentración más elevada correspondió al mismo lugar. Debido a la carga de contaminantes que se incorporan a su paso por comunidades (Tala, Jalisco) e industrias (Industria azucarera) el rio Salado transporta y finalmente descarga en la presa La Vega estos contaminantes incrementando los ya existentes. Esto afecta de manera directa la concentración de cloruros en la red de canales de riego, la cual se incrementa después del proceso de mezcla con el rio Salado. El promedio de cloruros fue de 46.0 mg/L y la desviación estándar de 12.9. 78 Figura 7.11. Concentración de Cloruros en los afluentes a la presa, dentro de la presa, rio Ameca, rio salado y red de canales de riego. Uno de los problemas más comunes de toxicidad en aguas de irrigación son los cloruros. Los cloruros no se adsorben, ni son retenidos por el suelo, sin embargo se mueven en el complejo suelo-agua, son tomados por la planta y se mueven a lo largo de la planta, además se acumulan en las hojas. Si la concentración de cloruros en las hojas excede la tolerancia de la planta, se desarrollan síntomas de daño como hoja quemada o el tejido de la hoja aparece como quemado. Normalmente el daño ocurre primero en la punta de las hojas (lo cual es un efecto común de la intoxicación por cloruros) y el daño es progresivo de la punta a la base de la hoja incrementando severamente el daño. La necrosis del tejido es con frecuencia acompañado por la temprana caída de la hoja o defoliación (Palacios et al., 2010). En especies sensibles de cultivos, estos síntomas ocurren cuando las hojas acumulan niveles de 0.3 a 1.0 % de cloruros en base seca, pero la sensibilidad varía entre las diferentes especies de cultivos. Muchas cultivos por ejemplo 79 empiezan a ser dañados con concentraciones arriba de 0.3 % de cloruros en peso seco. Análisis químicos en el tejido de las plantas se utiliza para confirmar la toxicidad por cloruros. La parte de la planta que generalmente se analiza para confirmar la toxicidad por cloruros varía en cada cultivo, dependiendo de cuál de los valores de interpretación esté disponible para seguir, las hojas son los tejidos usados con mayor frecuencia (Mahmood et al., 2010). En este sentido, de acuerdo al Cuadro 2.5 las concentraciones de cloruros obtenidas en los sitios de muestreo no representan riesgo para los cultivos sin embargo se recomienda prevenir la acumulación de cloruros en el suelo. 7.4.2. Sulfatos Los resultados del contenido de sulfatos se muestran en la Figura 7.12. Como se puede observar, existe una variabilidad importante entre los sitios donde se recolectaron muestras de agua, sobresaliendo nuevamente el sitio 19 donde se determinó la concentración más elevada con 160 mg/L. El promedio fue de 44.9, y la desviación estándar de 29.5. 80 Figura 7. 12. Concentración de Sulfatos en los afluentes a la presa, dentro de la presa, rio Ameca y red de canales de riego. El azufre es un nutriente secundario para el crecimiento de las plantas y el cuarto nutriente primario en la producción de cultivos, después del nitrógeno, fósforo y potasio (Allison et al., 1997). Prácticas tradicionales (reportadas en el sur de la Florida) incluyen la aplicación de 20 a 40 lbs de sulfato de cobre. En los últimos años la University of Florida Institute of Food and Agricultural Sciences (IFAS) ha recomendado utilizar el azufre para bajar los niveles de pH, cuando el pH es mayor a 6.6 unidades, con el propósito de mejorar la disponibilidad de los macronutrientes necesarios para el crecimiento de la caña de azúcar. Actualmente, el IFAS recomienda como máximo 500-S/ha. Si la aplicación ocurre solo sobre vegetales cultivados en suelos con pH arriba de 6.6 (Schueneman, 2001). La caña de azúcar es un cultivo que requiere relativamente altas concentraciones de azufre como suplemento (94 kg/ha) comparada con 81 otros cultivos (maíz: 47 kg/ha, arroz: 20 kg/ha). Sin embargo estudios recientes realizados por la IFAS indican que las cantidades de azufre actualmente aplicado son bajos en comparación con los sugeridos por la IFAS (Schueneman, 2001). De acuerdo con los requerimientos de sulfato de la caña de azúcar en particular, las concentraciones detectadas no representan riesgo para el cultivo por el contrario contribuyen a su crecimiento (Schueneman, 2001). 7.4.3. Boro Las concentraciones de Boro en los diferentes sitios de muestreo se presentan en la Figura 7.13. Como se puede observar la parte norte de la presa La Vega que corresponde a 4 afluentes a la misma, presentó concentraciones por debajo de 1 mg/L, lo cual no representa riesgo para la vegetación o la vida acuática. Sin embargo, se observó el incremento de la concentración de más del 100% en los primeros 2 sitios de muestreo dentro de la presa también en el área Norte. La concentración se incrementó en el sentido norte sur del embalse hasta alcanzar un valor máximo de 7.22 mg/L dentro del embalse el cual corresponde al sitio 18, el cual se encuentra ubicado relativamente cerca al sitio 19 que corresponde al rio Salado y que presentó la concentración de Boro más elevada con 13.3 mg/L. Esta cercanía permite cierto grado de mezcla en estos dos puntos y ocasiona el incremento de la concentración del sitio 18. Las concentraciones en la red de canales de riego y el rio Ameca fluctuaron en un rango de 4 a 5.7 mg/L (Figura 7.14 y 7.15). 82 Figura 7.13. Concentración de Boro en los afluentes a la presa, dentro de la presa, rio Ameca, rio Salado y red de canales de riego. 83 Figura 7.14. Distribución espacial de las concentraciones de Boro en la presa La Vega y sus principales afluentes. Figura 7.15. Distribución espacial de las concentraciones de boro en la red de canales de riego y rio Ameca. (Allison et al., 1997). menciona que en Italia y España se han encontrado concentraciones de Boro de 0.5 a 1.5 mg/L y de 0.6 mg/L en Reino Unido. También en el Este de Europa se han determinado concentraciones altas de Boro, como por ejemplo en Rumania arriba de 10 mg/L, Georgia con concentraciones arriba de 9.48 mg/L y en Eslovenia concentraciones arriba de 5.5 mg/L (Allison et al., 1997). Los resultados presentados en este documento, coinciden con los encontrados en el Este de Europa y mencionados por Allison et al., (1997), también se ha mencionado que las altas concentraciones de Boro encontradas en aguas superficiales están relacionadas con agua con abundantes minerales, lo cual indica el origen natural del Boro (Allison et al., 1997). 84 En este contexto, es importante mencionar que el agua del rio Salado transporta agua proveniente del Bosque de la Primavera lo cual involucra un componente geológico significativo en su composición. La distribución espacial de la concentración de Boro se muestra en las Figuras 7.14 y 7.15. En el caso específico de los límites máximos permisibles (LMP) para agua de riego, establecidos en los Criterios Ecológicos de Calidad del Agua, que indica “Para riego de cultivos sensibles al Boro, el agua contendrá como máximo 0.75 mg/L de esta sustancia, excepto para otros cultivos donde se pueden aplicar concentraciones de hasta 3 mg/L”. Estadísticamente, el promedio de los valores de Boro encontrados en este trabajo fué de 4.22 mg/L. Se observó que estos valores exceden 4 veces los LMP. Los valores determinados exceden también en 1.22 mg/L a la concentración aplicable a cultivos tolerantes. La desviación estándar de los datos fue de 2.05. Esta condición le otorga condiciones especiales al agua de la presa, por lo que se sugiere se considere como no recomendable para su uso como agua de riego. 7.4.4. Nitritos y Nitratos Las Figuras 7.16 y 7.17 muestran los resultados de la concentración de nitritos y nitratos encontrados en los diferentes sitios de muestreo. Los resultados obtenidos en la concentración de nitritos fue homogénea con concentraciones por debajo de 0.50 mg/L. El promedio obtenido fue de 0.12 mg/L y desviación estándar de 0.53. Sin embargo, es importante considerar que el cambio de nitratos a nitritos y viceversa es un proceso que se lleva a cabo rápidamente. Considerando los estándares internacionales, el valor encontrado no representa riesgo para la salud humana, o para la vida acuática, 85 tampoco es riesgo para los cultivos que son irrigados aguas abajo de la presa (Ayers y Wescot, 1994). Figura 7.16. Concentración de Nitritos en los afluentes a la presa, dentro de la presa, rio Ameca, rio Salado y red de canales de riego. Los nitratos presentaron concentraciones de 0.8 a 9 mg/L. Se observa en la Figura 7.16 que los resultados presentaron variabilidad en los diferentes sitios de muestreo. Sin embargo su concentración no representa riesgo para salud o la vida acuática. Los nitratos son un elemento indispensable para el crecimiento de los cultivos y los resultados determinados no representan riesgo para los cultivos irrigados con agua del embalse. El promedio de la concentración de nitratos fue de 3.19 mg/L, y desviación estándar de 1.49. Los Criterios Ecológicos de Calidad del Agua CE-CCA-001/89, no presentan restricciones y/o LMP para el caso de la concentración de nitritos y nitratos en agua de riego. 86 Figura 7.17. Concentración de Nitratos en los afluentes a la presa, dentro de la presa, rio Ameca, rio Salado y red de canales de riego. La mayoría de los cultivos no son afectados hasta concentraciones por arriba de 30 mg/L de nitrógeno. Sin embargo, los cultivos sensibles pueden ser afectados por concentraciones de nitrógeno arriba de 5 mg/L. Por ejemplo, la remolacha es un cultivo sensible, el tamaño se incrementa con el exceso de fertilización sin embargo, el contenido de azúcar es menor, así la calidad total de producción de azúcar por hectárea se puede reducir (Algoazany, et al. 2005). El cultivo de las uvas también es sensible a la concentración de nitratos en agua de riego, el rendimiento y el contenido de azúcar se pueden reducir y tarda en madurar. La sensibilidad de los cultivos varía de acuerdo a la etapa de crecimiento. Sin embargo, se puede presentar el efecto opuesto ya que concentraciones altas de nitrógeno también pueden beneficiar el crecimiento en algunos cultivos (Algoazany, et al. 2005). 87 8. Otros parámetros de importancia de la calidad de agua 8.1. Temperatura Los resultados de la temperatura se muestran en la Figura 8.1. Los valores determinados mostraron variabilidad de 23.3 ˚C a 29.4 ˚C, con un promedio de 25.4 ˚C. Se observó homogeneidad en la temperatura dentro de la presa (sitio 6 al 18) con valores entre 24 y 26 ˚C. Sin embargo, se determinó cierta variabilidad en los canales de riego donde se presentaron algunos incrementos respecto a la presa, esto se atribuye principalmente a la poca profundidad y movimiento en loa canales de riego al momento del muestreo. Los valores fueron de 22 a 29 ˚C. En este sentido es importante mencionar que la mayor variabilidad en la temperatura se presenta temporalmente dependiendo del mes y la hora. En general la temperatura encontrada no representa riesgo en el caso de riego de cultivos y para la vida acuática presente en la presa La Vega (Yan et al., 2007). 88 Figura 8.1. Temperatura (ºC) observada en los afluente a la presa, dentro de la presa, rio Ameca y red de canales de riego. 89 8.2. Oxígeno Disuelto Los resultados de la concentración de OD se presentan en la Figura 8.2. Los valores máximos fueron de 5.8 a 6.1 mg/L y correspondieron a los afluentes a la presa en la parte Norte y Oeste de la misma. Dentro de la presa el OD decreció ligeramente, las concentraciones fueron de 5.1 a 5.7 mg/L. En la red de canales riego y el rio Ameca y rio Salado presentaron variabilidad, los valores fueron de 5.0 a 5.8 mg/L. Figura 8.2. Concentración de Oxígeno Disuelto en los afluentes a la presa, dentro de la presa, rio Ameca, rio Salado y red de canales de riego. 90 Smolders et al., (2006) menciona que los peces requieren usualmente concentraciones de OD de 5-6 mg/L, niveles menores (3 mg/L) causan stress en los organismos, mientras que a concentraciones menores de 2 mg/L los peces mueren. El oxígeno entra en los arroyos principalmente de la atmósfera, pero también a través de las aguas subterráneas y en las descargas en el curso de agua. La concentración de OD es un importante parámetro para evaluar aguas de irrigación y puede ser un factor limitante en algunos sistemas agrícolas intensivos. Bajas concentraciones de OD en el agua (por debajo de 5 mg/L) de irrigación puede tener consecuencias críticas ya que causa deficiencia de oxígeno en la raíz, lo cual puede resultar en problemas agronómicos (Gebremariam y Beutel, 2008). De acuerdo a los valores de OD requeridos por los cultivos mencionados en la literatura el OD determinado en los diversos sitios muestreados y para esta fecha en particular no representa riesgo para los organismos acuáticos y para los cultivos (Gebremariam y Beutel, 2008). 8.3. Turbiedad Los resultados de turbiedad encontrados se muestran en la Figura 8.3. Los resultados no presentaron tendencia en los valores de turbiedad, por el contrario se observó alta variabilidad en la turbiedad, el rango observado fue de 2 a 14.4 de Unidades Nefelométricas de Turbidez (UNT). El promedio fue de 7.78 y la desviación estándar de 3.32. La variabilidad observada en los resultados de debió a diversos factores, uno de los más importantes fue el movimiento del agua al momento del muestreo. El movimiento provoca la suspensión de partículas disueltas y por consecuencia mayor turbiedad, por el contrario el agua estancada permite la sedimentación de los sólidos disminuyendo los valores de la misma. En este sentido, la variabilidad observada fue esperada debido a que los sitios de muestreo presentaron características diferentes de movimiento. Los valores de turbiedad encontrados en los diversos sitios de muestreo para esta fecha en particular no representan riesgo para la vida acuática y los cultivos en el área (Irie et al., 2012). 91 Figura 8.3. Unidad Nefelométrica de Turbidez (UNT) en los afluentes a la presa, dentro de la presa, rio Ameca y red de canales de riego. 92 8.4. Dureza expresada en Grados hidrométricos franceses Los resultados de la dureza se muestran en la Figuras 8.4. Los resultados mostraron alta variabilidad, el valor más bajo correspondió al sitio 19 con una concentración de 0.07 ºF, mientras que el valor más elevado se obtuvo en el sitio 40 con una concentración de 7.76 ºF. Figura 8.4. Grados hidrométricos franceses (Durezas) en los afluentes a la presa, dentro de la presa, rio Ameca, rio Salado y la red de canales de riego. 93 Respecto a la determinación de los grados hidrométricos franceses, los resultados de todos los sitios de muestreo entraron en la clasificación de aguas muy blandas, ya que no se obtuvo resultado mayores de 14 grados hidrométricos franceses (Figura 8.4). Esto, significa básicamente que existen mínimas cantidades de sales disueltas. Este resultado coincide con el obtenido en el parámetro de conductividad donde el riesgo por sales disueltas se detectó como sin restricción y con alguna restricción en algunos casos. Sin embargo, es necesario mencionar que aun cuando el agua de riego contenga mínima cantidad de sales disueltas, con el uso constante de esta agua, las sales tenderán a acumularse en el suelo, lo cual puede provocar efectos no deseados en los cultivos. La principal fuente natural de durezas en el agua son las rocas sedimentarias, filtración y escurrimientos. En general, aguas duras originadas en áreas con suelo de capa superficial gruesa y formaciones de piedra caliza. Generalmente el agua subterránea es más dura que el agua superficial. El agua subterránea es rica en acido carbónico y oxígeno disuelto, por el contacto con suelo y rocas contiene una gran cantidad de minerales, como calcita, gypsum y dolomita, los niveles de dureza generalmente se elevan a miles en mg/L (Porta et al., 1994). Por otro lado, la dureza en el agua de riego implica alto contenido de calcio y magnesio, lo cual puede ocasionar problemas de precipitación y obstrucciones en los sistemas de riego, sobre todo cuando se utiliza riego por goteo, sin embargo, agua con alto contenido de calcio compensa los riesgos negativos de la presencia de sodio (Wurts, 1992). 8.4.1. Nitrógeno Total Las concentraciones de TKN encontrados en este diagnóstico, sugieren la presencia de aguas residuales de origen doméstico y escurrimientos agrícolas. Sin embargo, se observa un incremento de las 94 concentraciones en el rio Salado y los sitios de muestreo cercanos al mismo (Figura 8.5). El TKN como tal, no es considerado en las diversas normas oficiales, sin embargo si se mencionan LMP para el caso de nitratos, nitritos y nitrógeno amoniacal, parámetros que se discuten a lo largo del documento. El promedio del TKN fue de 4.10 y la desviación estándar de 1.42. Figura 8.5. Concentración de TKN en los afluentes, dentro de la presa, rio Ameca y red canales de riego. 8.4.2. Nitrógeno Amoniacal Los resultados de esta investigación mostraron variabilidad en las concentraciones de nitrógeno amoniacal, presentando concentraciones desde 0.1 a 1.0 mg/L. De acuerdo con la literatura concentraciones de nitrógeno amoniacal arriba de 1 mg/L se presenta cuando el agua contiene residuos de fertilizantes y/o aguas residuales. En este contexto, se sugiere que los afluentes a la presa aportan cierta cantidad 95 de nitrógeno amoniacal ya que se puede observar concentraciones cercanas a 1 mg/L en dos de los afluentes de la parte Norte de la presa (Figura 8.6). Figura 8.6. Concentración de Nitrógeno Amoniacal en los diferentes sitios de muestreo, afluentes, dentro de la presa, rio Ameca y red de canales de riego. En general, las concentraciones de nitrógeno amoniacal encontradas no representan riesgo para la los cultivos aguas debajo de la presa. Los Criterios Ecológicos de Calidad del Agua CE-CCA-001/89, no mencionan LMP para el caso de este parámetro en particular, sin embargo en el apartado de protección a la vida acuática el LMP es de 0.06 mg/L, por lo tanto las concentraciones encontradas en este diagnóstico representan un riego para la vida acuática presente dentro 96 del embalse. El promedio fue de 0.541 y la desviación estándar de 0.272. 8.5. Compuestos de fósforo Los resultados del análisis de fósforo mostraron concentraciones de 1.2 a 2.1 mg/L. Los resultados presentaron homogeneidad, algunos sitios presentaron concentraciones más elevadas como es el caso del rio Salado (sitio 19) y el sitio 18 dentro de la presa, el cual corresponde a la entrada de un escurrimiento. Este elemento es necesario para el crecimiento de las plantas, sin embargo no se mencionan las concentraciones límite en los criterios internacionales para aguas de irrigación. Este parámetro es mencionado en los Criterios Ecológicos de Calidad del agua CE-CCA-001/89, en el apartado específico de agua de riego, sin embargo se le da mayor importancia a los efectos por el desarrollo indeseable de especies biológicas dentro de los embalses con el propósito de controlar la eutrofización. Se mencionan concentraciones máximas de 0.025 mg/L dentro de embalses y lagos. En este sentido, se puede ver que los valores encontrados se encuentran fuera de estos límites, (Figura 8.7), lo cual incrementa de manera considerable las posibilidades de crecimiento de microalgas y efectos adversos en el cuerpo de agua. El promedio en concentraciones de fósforo total fue de 1.497 mg/L y la desviación estándar de 0.215. 97 Figura 8.7. Concentración de Fósforo Total en los afluentes a la presa, dentro de la presa, rio Ameca y red de calanes de riego. En el caso de los Ortofosfatos, las concentraciones presentaron poca variabilidad, el rango fue de 0.96 a 1.6 mg/L (Figura 8.8). El promedio fue de 1.199 y la desviación estándar de 0.143. El fósforo se ha detectado como nutriente limitante para el crecimiento del plancton en los sistemas acuáticos, por lo tanto la disponibilidad de este elemento permitirá el crecimiento de estos microorganismos. Si las concentraciones se mantienen incrementa el riesgo de los procesos de eutrofización. En este sentido es importante mencionar que el muestreo fue realizado en el mes de Mayo, que es la época de estiaje, por lo tanto los contaminantes se concentran a su máximo nivel. 98 Figura 8.8. Concentración de Ortofosfatos en los afluentes a la presa, dentro de la presa, rio Ameca y red de canales de riego. 8.6. Solidos disueltos totales Los resultados de TDS en este diagnóstico no representan un peligro para los cultivos, los resultados se presentan en la Figura 8.12. Sin embargo es importante mencionar que algunos metales pesados como el cadmio y el arsénico, pueden estar unidos a las partículas en suspensión y ser ingeridos por los peces. Las partículas que no son ingeridas, eventualmente sedimentan acumulando los contaminantes en las capas superficiales del mismo. El promedio de TDS fue de 232.7 mg/L, y la desviación estándar de 54.75. Alta desviación estándar debido a las diferencias encontradas en los primeros 5 sitios de muestreo, los cuales presentaron TDS muy bajos. 99 Figura 8.9. Solidos Disueltos Totales en las muestras de agua, afluentes a la presa, dentro de la presa, rio Ameca y red de canales de riego. No importando la fuente, el nitrógeno (N) es esencial para obtener el óptimo rendimiento en granos, forrajes y otros cultivos. Esto aplica también para el caso del fósforo (P) y otros nutrientes. Sin embargo, la aplicación excesiva de nitrógeno o fósforo a las tierras de cultivo, puede tener un efecto adverso en el ambiente. Alcanzando rendimientos óptimos sin aplicar exceso de nutrientes debe ser una meta para todos los agricultores. Sin embargo, nitrógeno y fósforo en exceso en las aguas superficiales ocasiona la eutrofización (crecimiento excesivo de algas) en aguas superficiales y problemas de salud en humanos y ganado como resultado de las altas ingestas de nitrógeno en forma de nitrato (Tchobanoglous y Schroeder, 1987). 100 8.7. Elementos Tóxicos y Metales Pesados Los elementos tóxicos que se analizaron en este diagnóstico se presentan en el Cuadro 9.1. En la 7.4 se discute a detalle los resultados de boro encontrados en las muestras de agua y sus posibles efectos tóxicos en los cultivos. En el caso del sodio y calcio que son elementos incluidos para determinar la sodicidad y la alcalinidad del agua respectivamente, se discuten en la 7.3.1 y 7.3.4, respectivamente. Por lo tanto, en esta sección se discutirán los resultados de arsénico encontrados en las muestras de agua. 8.7.1. Arsénico Cuadro 8.1. Elementos químicos analizados en diferentes sitios de muestreo, afluentes a la presa, dentro de la presa, rio Ameca, rio Salado y red de canales de riego. Determinación Unidades Resultado Arsénico Cadmio Cobre Cromo total Fierro Manganeso Mercurio Sodio Plomo Zinc Níquel Boro Calcio Magnesio Potasio mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L 0.183* < 0.002 < 0.01 < 0.01 0.146 0.142 < 0.001 79.80** < 0.001 < 0.01 < 0.01 4.251* 14.80** 6.93 27.1 101 *Concentraciones fuera de los LMP, para agua de riego, acuacultura y protección de la vida acuática. **Parámetros no mencionados los Criterios Ecológicos de Calidad del Agua, que se presentaron con niveles de riesgo para los cultivos irrigados con agua de la presa La Vega. La presencia de metales pesados compite con nutrientes en la planta, por ejemplo el arsénico con fósforo. 8.8. Organismos 8.8.1. Coliformes fecales y totales Los resultados fueron positivos en la detección de Coliformes totales y fecales, asi como para Escheriquia coli y Pseudomona spp. El Cuadro 9.2 presenta los promedios encontrados. Los Criterios Ecológicos de Calidad del Agua CE-CCA-001/89, mencionan límites máximos permisibles (LMP) para Coliformes fecales de 1000 (NMP/100 ml), en el caso de agua de riego, por lo tanto los resultados están claramente fuera de los límites permisibles. En el caso de protección a la vida acuática también se observan valores muy por encima de los LMP que son de 200 organismos por 100 ml. Además el análisis fue positivo en la detección de Escherichia coli y Pseudomona sp. 102 Cuadro 8.2. Resultado promedio de análisis microbiológico realizado en los diferentes sitios de muestreo, afluentes a la presa, dentro de la presa, rio Ameca, rio Salado y la red de canales de riego. Coliformes Totales NMP/100 ml Coliformes fecales NMP/100 ml Escherichia coli 994,615 548,308 Positivo Pseudomona sp. Positivo De acuerdo con la literatura la presencia de Coliformes fecales en los ambientes acuáticos indica que el agua ha sido contaminada con material fecal de humanos o animales. Al tiempo que esto ocurre, la fuente de agua ha sido contaminada por patógenos o bacterias o virus que producen enfermedades que también pueden existir en la materia fecal. Dentro de estos organismos patógenos que se transmiten por el agua están; la fiebre tifoidea, gastroenteritis viral o bacterial y la hepatitis tipo A. La presencia de contaminación fecal es un indicador del potencial riesgo a la salud existe por la exposición al agua. La bacteria Coliforme fecal, puede estar presente por la descarga de aguas residuales domésticas y por fuentes de contaminación difusa de humanos y animales. Los resultados en este diagnóstico evidencian la presencia de contaminación fecal en la presa La Vega. 103 8.9. Análisis Taxonómico y Cuantitativo del Plancton 8.9.1. Plancton en cuerpos de agua Los resultados mostraron a la división Chlorophyta como la más abundante (47.62%), seguida de las Crysophytas (23.81%), las Cyanophytas (14.29%), las Euglenophytas (9.52%) y por ultimo las división Phyrrophyta (Figura 8.13). La abundancia de la división Chlorophyta indica la presencia de especies generalmente se presentan en cuerpos de agua superficiales con cierto grado de eutrofización. De acuerdo a la literatura la presencia de Chlorophytas en un sistema acuático es indicativo de condiciones de calidad del agua aceptables. En este diagnóstico la división Chlorophyta presento el porcentaje más alto respecto a las demás divisiones, seguido por las Crysophytas. Es un grupo extremadamente diverso que colonizan todo tipo de hábitats: agua dulce y salada, nieve, tierra y en los árboles. Desarrollan estructuras corporales que van desde unicelulares hasta formas masivas, de varios metros de tamaño. Los pigmentos (clorofilas a y b) y las sustancias químicas en las paredes celulares de las algas verdes son muy parecidos a los de las plantas vasculares. Generalmente, almacenan su alimento como almidón. Sin embargo, es necesario el monitoreo constante del fitoplancton en las diferentes estaciones del año para determinar los patrones de comportamiento en la composición y abundancia a lo largo de la presa. Se debe evaluar la respuesta de los organismos a las condiciones ambientales locales y la entrada de nutrientes debido a que se puede esperar comportamiento estacional donde es probable que se presenten cambios drásticos en la distribución y abundancia. 104 4.76% 9.52% chlorophyta 14.29% crysophyta 47.62% cyanophyta euglenophyta phyrrophyta 23.81% Figura 8.10. Género y/o especies de fitoplancton identificadas en las muestras de agua de los diferentes sitios de muestreo dentro de la presa La Vega. Cuadro 8.3. Abundancia de especies de plancton encontrada en la presa La Vega. Genera/Especie Chlamydomonas spp Coelastrum reticulatum Closterium sp #1 Ulothrix sp Closterium kuetzingii Closterium aciculare Ulothrix sp Clorofita filamentosa Staurastrum longitudinatum Pteromonas cf angulosa Diatomea sp #1 División chl chl chl chl chl chl chl chl chl chl cry No. De Organismos 20000 12000 16000 2000 2000 2000 2000 2000 2000 2000 2000 105 Aulacoseira granulata Rhoicosphenia curvata Nitzschia sp Synedra sp Oscillatoria sp #1 Oscillatoria sp #2 granulosa Oscillatoria sp #3 Trachelomonas ovoides Euglena acus Ceratium hirundinella cry cry cry cry cya cya cya eug eug phy 4000 2000 8000 2000 4000 2000 2000 2000 4000 2000 Sera importante considerar la caracterización del fitoplancton como una herramienta de apoyo en el biomonitoreo para la determinación de condiciones extremas de calidad del agua en la presa de manera rápida y oportuna. 9. Comparación con los Criterios Ecológicos de Calidad del agua CE-CCA-001/89 Una de las Normas Oficiales Mexicanas (NOM) que determina los requerimientos de calidad de agua para diversos usos, son los Criterios Ecológicos de Calidad del agua CE-CCA-001/89. Con base en esto criterios la autoridad competente podrá calificar a los cuerpos de agua como aptos para ser utilizados como fuente de abastecimiento de agua potable, en actividades recreativas con contacto primario, para riego agrícola, para uso pecuario, en la acuacultura, o para la protección de la vida acuática En este caso en particular se dio énfasis en uso como agua de riego, agua para acuacultura y protección a la vida acuática, ya que el agua de la presa es utilizada en estos rubros. 106 9.1. Calidad de agua para riego agrícola El grado de calidad del agua, requerido para llevar a cabo prácticas de riego sin restricción de tipos de cultivo, tipos de suelo y métodos de riego. El Cuadro 9.1 muestra un comparativo de las concentraciones de los parámetros evaluados en este diagnóstico versus los límites máximos permisibles para agua de riego. En estos resultados se puede observar que la concentración de la mayoría de los parámetros evaluados se encuentra dentro los límites máximos permisibles. Con algunas excepciones como es el caso específico del arsénico y el boro. Cuadro 9.1. Comparativo de los CE-CCA-001/89 versus resultados obtenidos en diagnóstico. Sustancia o parámetro Arsénico (II) Boro (II) Cadmio (II) Cloruros (como Cl-) Cobre Coliformes fecales (NMP/100 ml) Conductividad eléctrica (mmhos/cm) Cromo hexavalente Fierro Níquel Nitratos (NO3 ) (como N) Nitritos (NO2) (como N) Nitrógeno amoniacal Oxígeno disuelto (XXX) Potencial de hidrógeno (pH) (XXXI) Riego agrícola Promedio obtenido 0.1 0.7(XI) 0.01 147.5 0.2 1000 0.146* 4.29* < 0.002 46 < 0.01 1.0(XX) 1 5 0.2 No se menciona No se menciona No se menciona No se menciona 4.5-9.0 0.696 < 0.01 0.078 < 0.01 3.194 0.120 0.541 5.482 8.333 107 Plomo Solidos disueltos Sulfatos (SO4 ) 5 500.0 (XXXV) 130 < 0.001 232.2 44.91 No se menciona 2 25.42 7.786 < 0.01 Temperatura (°C) Turbiedad (Unidades escala de silice) Zinc *Resultados fuera de los límites máximos permisibles II. La sustancia presenta persistencia, bioacumulación o riesgo de cáncer, por lo que debe reducirse a un mínimo la exposición humana. XI. Para riego de cultivos sensibles al boro, el agua contendrá como máximo 0.75 mg/L de esta sustancia, excepto para otros cultivos donde se pueden aplicar concentraciones de hasta 3 mg/L. XXX. Para oxígeno disuelto, los niveles establecidos deben considerarse como mínimos. XXXI. Para el potencial de hidrógeno (pH), los niveles establecidos deben considerarse como mínimos y máximos. Sin embargo los Criterios Ecológicos de Calidad del Agua no contempla algunos elementos que se encontraron en concentración importante en los diferentes sitios de muestro como: Cuadro 9.2. Concentraciones importantes de parámetros no mencionados en los CE-CCA-001/89. Elemento Resultado obtenido (mg/L) Sodio Calcio 124 15.6 Magnesio Potasio 8.30 15.8 Los elementos en el Cuadro 9.2, son importantes en la determinación del SAR y el CSR, además de la alcalinidad y las durezas. Estas determinaciones fueron mencionadas en las secciones anteriores. 108 Sección 7.3.1 para el SAR, 7.3.2 el CSR, 7.3.4 alcalinidades y 8.4 durezas. 9.2. Calidad de agua de riego para protección de la vida acuática Cuadro 9.3. Parámetros importantes para la protección de la vida acuática y organismos de agua dulce. Sustancia o parámetro Protección a la vida acuática Resultado obtenido Alcalinidad (como CaCO3 ) Arsénico Boro (II)* Cadmio (II)* Cloruros (como Cl-) Cobre Coliformes fecales (NMP/100 ml) Conductividad eléctrica (mmhos/cm) Cromo hexavalente Fierro Fosfatos (como PO4 ) Mercurio (Hg) (II)* Níquel Nitratos (NO3) (como N) Nitritos (NO2 ) (como N) Nitrógeno amoniacal Oxígeno disuelto (XXX)* Potencial de hidrogeno (pH) (XXXI)* Plomo Solidos disueltos Sulfatos (SO4 ) (VI) * 0.2 (como A 5III)* 23.15 0.184 4.290 <0.002 46 < 0.01 Temperatura (°C) (XIII) * 250 (XVII)* (XVIII)* 0.01 (XII)* 1 (XXV) * 0.00001 (XII)* (XXVII)* 0.06 5 (XXXII)* (XXXIV)* 0.005 CONDICIONES NATURALES + 1.5 0.696 <0.01 0.078 1.11 < 0.001 < 0.01 3.194 0.12 0.541 5.482 8.333 < 0.001 232.2 44.91 25.42 109 Turbiedad (Unidades escala sílice) Zinc (XIX)* (XXXVI)* 7.786 < 0.01 *VI. Para riego continuo de los suelos, el agua contendrá como máximo 0.1mg/ l de berilio, excepto para el caso de suelos alcalinos y de textura fina donde se pueden aplicar concentraciones de hasta 0.5 mg/L. **II. La sustancia presenta persistencia, bioacumulación o riesgo de cáncer, por lo que debe reducirse a un mínimo la exposición humana. *III. El nivel ha sido extrapolado mediante el empleo de un modelo matemático, por lo que en revisiones posteriores podrá ser modificado a valores menos estrictos. *XII. La concentración promedio de 4 días de esta sustancia, no debe exceder este nivel, más de una vez cada 3 años *XIII. La concentración promedio de cadmio de 4 días en µg/l no debe exceder más de una vez cada 3 años el valor numérico de la siguiente ecuación: (0.7852 [ln (dureza)] - 3.490) Cd (µ g/l) = e Dureza = mg/L como CaC03 *XVII. La concentración promedio de cobre de 4 días en µg/l, no debe exceder más de una vez cada 3 años el valor numérico de la siguiente ecuación: (0.8545 [ln (dureza)]- 1.465) Cu(µg/ ) = e Dureza = mg/L como CaCo3 *XVIII. Los organismos no deben exceder de 200 como número más probable en 100 mililitros (NMP/100 ml) en agua dulce o marina, y no más del 10% de las muestras mensuales deberá exceder de 400 NMP/100 ml. *XXVII. La concentración promedio de níquel de 4 días en µg/l no debe exceder más de una vez cada tres años el valor numérico de la siguiente ecuación: (0.8460 [ n (dureza)] + 1.1645) Ni (µg/ ) = e Dureza = mg como CaCO3 *XXXII. No podrá haber variaciones mayores a 0.2 unidades de pH, tomando como base el valor natural estacional. *XXXIV. La concentración promedio de plomo de 4 días en µg/l no debe exceder más de una vez cada 3 años el valor numérico de la siguiente ecuación: (1.273 [ n (dureza)] - 4.705) Pb (µg/ ) = e Dureza = mg/L como CaCO3 *XIX. Los sólidos suspendidos (incluyendo sedimentables) en combinación con el color, no deben reducir la profundidad del nivel de compensación de la luz para la actividad fotosintética en más de 10% a partir del valor natural *XXV. Los fosfatos totales, medidos como fósforo, no deberán exceder de 0.05 mg/ l. En influentes a lagos o embalses ni de 0.025 mg/ dentro del lago o embalse, para prevenir el desarrollo de especies biológicas indeseables y para controlar la eutroficación acelerada. *XXX. Para oxígeno disuelto, los niveles establecidos deben considerarse como mínimos. 110 9.3. Calidad de agua para acuacultura Cuadro 9.4. Límites máximos permisibles en CE-CCA-001/89, para diferentes especies de peces. Parámetro o sustancia Turbiedad Temperatura pH (XXXI) Sólidos Disueltos Oxígeno Disuelto Alcalinidad Dureza Amoniaco N- NO 2 N- NO3 Fósforo Total Coliformes Fecales Coliformes Totales Arsénico Cadmio Cromo Hexavalente Cobre Hierro Promedio obtenido Especie Unidades Tilapia UNT 100 °C Carpa Bagre 7.786 24-30 20-30 20-30 10-15 25.42 7-8 7-8.5 6.5-8 6.5-8.0 8.333 mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L NMP/100 ml. NMP/100 ml. mg/L mg/L Trucha Arcoiris 400 2.1 232.2 5 -4 7.8 54-200 100 20-200 5.0-31 23.15 50-100 300 20-150 0.42 5.0-200 42.87 0.541 0.12 3.194 4.877 0.55 1 0.05 mg/L 0.5 mg/L mg/L 0.02 0.5 5.482 4.877 <0.002 0.025 0.5 0.06 1 <0.01 <0.01 0.07 111 Los Cuadros 9.2 y 9.3, muestra el comparativo de los resultados obtenidos del diagnóstico versus los LMP establecidos por los CE-CCA001/89 para los diversos usos de la misma. Se puede observar que la concentración de la mayoría de los parámetros se encuentra dentro de los LMP, solo el caso del arsénico y boro se presentaron concentraciones más elevadas. Estos parámetros son discutidos a detalle a lo largo del documento. 9.4. Recomendaciones para la mitigación de contaminantes en el agua de la presa La Vega (Boro y Arsénico). 9.4.1. Plantas de tratamiento de aguas residuales domésticas en comunidades en el área de influencia de la presa La Vega. La presencia de Coliformes fecales y totales en concentraciones elevadas evidencia la contaminación de desechos humanos en el agua de la presa La Vega. Bajo estas condiciones la instalación de plantas de tratamiento en las poblaciones alrededor de la presa La Vega, es una necesidad primordial para la reducción de estos microorganismos patógenos. Sin embargo, plantas de tratamiento de aguas residuales convencionales no disminuyen elementos tóxicos como el boro y arsénico, los cuales requieren de sistemas de tratamiento especializados. 9.4.2. Bioremediacion (humedales) Una alternativa ecológica para la mitigación de los contaminantes son los humedales, estos sistemas han probado su capacidad de remoción de contaminantes especialmente nutrientes (fósforo y nitrógeno), así como de microorganismos patógenos y algunos metales pesados. 112 Estos sistemas son una alternativa de bajo costo de instalación y mantenimiento, además crean un ambiente para la vida silvestre. Estudios han evaluado la utilización de los humedales construidos para remover altas concentraciones de selenio, arsénico y boro. Factores importantes: tipo de planta y el material utilizado como soporte para la vegetación (zeolita y arcilla). Utilizando zeolita como soporte se logró remover 64%, 47% y 31%, para Selenio, Arsénico y Boro respectivamente. El costo aproximado de instalación de un humedal de una hectárea es de $ 3,000,000.00 . Una limitante es los humedales es el espacio que requieren para su instalación. Figura 9.1. Humedal para el tratamiento de aguas residuales domésticas. 113 9.4.3. Osmosis inversa Experiencias en tratamientos de agua con altas concentraciones de boro se han obtenido en países del Mediterráneo: Italia, Grecia, Francia, Chipre e Israel, donde la osmosis inversa ha sido utilizada con éxito en la reducción de concentraciones de boro. La Osmosis Inversa consiste en separar un componente de otro en una solución, mediante las fuerzas ejercidas sobre una membrana semipermeable. Su nombre proviene de "osmosis", el fenómeno natural por el cual se proveen de agua las células vegetales y animales para mantener la vida. Este sistema permite remover la mayoría de los sólidos (inorgánicos u orgánicos) disueltos en el agua (hasta el 99%). • Remueve los materiales suspendidos y microorganismos. • Realiza el proceso de purificación en una sola etapa y en forma continua. • Es una tecnología extremadamente simple. Es modular y necesita poco espacio, lo que le confiere una versatilidad excepcional en cuanto al tamaño de las plantas: 3 3 desde 1 m /día, a 1.000.000 m /día Cuadro 9.5. Reducciones concentración de contaminantes en agua tratada por osmosis inversa. Parámetro Alimentación Producto 5 6 Conductividad (m-mhos) 1900 120 Cloruros mg/L ClNa Sulfatos mg/L SO4Ca 485 798 38 28 Dureza mg/L CO3Ca 430 16 Sílice mg/L SiO2 0,93 0,12 Sólidos totales disueltos mg/L 1279 70 pH 114 Campos de aplicación: • Abastecimiento de aguas para usos industriales y consumo de poblaciones. • Tratamiento de efluentes municipales e industriales para el control de la contaminación y/o recuperación de compuestos valiosos reutilizables. • En la industria farmacéutica, para la separación de proteínas, eliminación de virus, etc. Una limitante de estos sistemas es el costo alto de instalación y 3 mantenimiento, un sistema de osmosis inversa de 240 m /día, requiere una inversión inicial del equipo de ósmosis inversa fue de 145,000.00 dólares aproximadamente. 9.4.4. Resina macroreticular La resina macroreticular de intercambio de iones de Boro: Amberlite XE243. Ha sido exitosamente utilizada para tratar agua salina y altas concentraciones de Boro en el Mediterráneo. Las resinas de intercambio iónico son materiales sintéticos, sólidos e insolubles en agua, que se presentan en forma de esferas o perlas de 0.3 a 1.2 mm de tamaño efectivo, aunque también las hay en forma de polvo. Están compuestas de una alta concentración de grupos polares, ácidos o básicos, incorporados a una matriz de un polímero sintético (resinas estirénicas, resinas acrílicas, etc.) y actúan tomando iones de las soluciones (generalmente agua) y cediendo cantidades equivalentes de otros iones. La principal ventaja de las resinas de intercambio iónico es que pueden recuperar su capacidad de intercambio original, mediante el tratamiento con una solución regeneradora. El intercambio iónico es una reacción química reversible. 115 10. Resultados y discusión del análisis de suelos irrigados con agua de la presa La Vega 10.1. Parámetros de suelo En el Cuadro 12.1 se muestran los estadísticos de media y desviación estándar de los resultados del análisis de suelos en dos profundidades de terrenos regados con agua de la presa La Vega, durante el 2012. La interpretación de estos resultados se hizo de acuerdo con la Norma Oficial Mexicana NOM-021-RECNAT-2000, que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudio, muestreo y análisis, para cada uno de estos parámetros. 116 Cuadro 10.1. Estadísticos media y desviación estándar de los resultados del análisis de suelo en las profundidades de 0 a 5 cm y 5 a 35 cm, de suelos regados con agua de la presa La Vega, durante el 2012. Profundid MO ad (%) Aren Arcill Lim CO3 HCO3 Cl SO4 NO3 Ca Mg Na K CE B RAS a a o (meq/ (meq/ (meq/ (meq/ (me (me (meq (meq (me (dS/m pH (mg/ (me (%) (%) (%) L) L) L) L) q/L) q/L) /L) /L) q/L) ) L) q/L) 0 a 5 cm Media 2.2 38.9 33.4 27.7 Desv. Est. 0.6 14.4 14.9 8.2 0.0 2.4 5.2 12.9 2.8 5.8 3.2 13.3 1.1 2.3 7.5 12.4 6.1 0.0 1.6 8.5 23.1 4.4 6.9 3.9 25.4 2.1 3.2 0.7 6.9 6.8 5 a 35 cm Media 1.7 37.9 37.1 24.9 Desv. Est. 0.5 15.5 17.6 9.1 0.0 1.6 1.1 3.5 0.6 1.1 0.6 4.7 0.3 0.7 7.6 8.5 5.2 0.0 1.0 1.0 4.7 0.7 1.2 0.6 4.5 0.4 0.8 0.5 5.1 3.6 10.1.1. Materia Orgánica (MO) De acuerdo con el Cuadro 10.1, en las profundidades de 0 a 5 y de 5 a 35 cm, el contenido de materia orgánica se considera un nivel medio. Este componente del suelo es importante por la capacidad de adsorción de iones, como el boro o arsénico. 10.1.2. Textura El porcentaje de arena, limo y arcilla, del suelo en las profundidades de prueba, identifica al suelo como franco-arcilloso. La arcilla se asocia a elementos como el boro, por la capacidad de adsorción de los minerales que pudieran contener. 10.1.3. Contenido de aniones y cationes La suma de cationes y cationes en la parte superficial (0 a 5 cm) es 23.3 y 23.4 meq/L, respectivamente, valores contrastantes a los observados en la profundidad de 5 a 35 cm del orden de 6.8 y 6.7 meq/L, 117 respectivamente. Esta situación muestra la alta concentración de sales en la parte superficial, resultado de la evaporación después de los riegos. 10.1.4. Conductividad eléctrica En el Cuadro 10.1, se muestra que la CE en la parte superficial del suelo fue de 2.3 dS/m, valor que lo identifica como moderadamente salino, donde solo cultivos con tolerancia a la salinidad pueden desarrollarse, mientras que en la parte de 5 a 35 cm de profundidad, la CE la clasifica con efectos despreciables a la salinidad (Navarro, 2011). La interacción entre la CE en las dos profundidades (Figura 10.1), muestra que casi el 70% de las muestras tiene efectos despreciables a la salinidad o condición muy ligeramente salina y solo en el 30% de las muestras se tienen problemas de salinidad. Figura 10.1. Interacción entre la CE en las profundidades de 0 a 5 cm y 5 a 35 cm de profundidad. Por otro lado, en las Figuras 10.2 a y b se muestra el riesgo de salinización de terrenos muestreados de la presa La Vega, en las profundidades de 0 a 5 cm y 5 a 35 cm, respectivamente. En la profundidad de 0 a 5 cm, solo el 15% de los terrenos no tiene riego de 118 salinización, el 66% tiene riesgo ligero a moderado y 19% tiene riesgo importante. En la profundidad de 5 a 35 cm, el 68% de los terrenos tiene riesgo de salinización nulo, el 30 % tiene riesgo ligero a moderado y solo 2% tiene riesgo importante. Esta situación es explicable por el comportante de movilidad de las sales a causa de la evaporación del agua, después de la aplicación de los riegos (Aceves, 2011; GAT, 2012). Para la caña de azúcar, el límite que afecta el rendimiento potencial es el siguiente: sin restricción cuando la EC es menor a 1.7 dS/m, restricción ligera a moderada de 1.7 a 19 dS/m, con máxima restricción cuando se tiene CE mayor a 19 dS/m. Para los terrenos muestreados de la presa La Vega, en la profundidad de 0 a 5 cm, el 63% no tiene restricciones de uso, el 36% tiene restricción de ligera a moderada y 1% tiene restricción máxima; en la profundidad de 5 a 35 cm, el 94% no tiene restricciones de uso y el 6% tiene restricción de ligera a moderada. Esta situación se atribuye al efecto de evaporación del agua de riego, la que produce la concentración de sales en la parte superficial del suelo agrícola regado con el agua de la presa La Vega. 119 Figura 10.1. Riesgo de salinización de terrenos muestreados de la presa La Vega, en las profundidades de a) 0 a 5 cm y b) 5 a 35 cm, respectivamente. Figura 10. 2. 10.1.5. pH en el extracto de saturación En la Figura 10.3 se muestra la interacción entre el pH a las profundidades del suelos muestreados de la presa La Vega, de 0 a 5 cm y 5 a 35 cm. La mayor proporción de pH en la interacción de 0 a 5 y 5 a 35 cm de profundidad se dio en 7.2 a 8.3, valores que hacen que se clasifique al suelo como alcalino. 120 Figura 10.3. Interacción entre el pH en las profundidades de 0 a 5 cm y 5 a 35 cm de profundidad. El pH del suelo es importante, porque de él depende el comportamiento químico de los nutrientes y su disponibilidad para la planta, como se muestra en la Figura 10.4. En esta figura se muestra que en el rango de 6 a 7, la mayor parte de los nutrientes está disponible, sin embargo, la mayor proporción de los suelos están en el rango de pH de 7.2 a 8.3, situación que implica mayor disponibilidad de cloro y molibdeno, pero posibles deficiencias de fósforo, hierro, cobre, manganeso y zinc. 121 Figura 10.4. Influencia del pH sobre la disponibilidad de nutrimentos para las plantas y el rango de 7.2 a 8.3 que la mayor parte de los suelos de la zona de riego de la presa La Vega. Efectos combinados de la Relación de Absorción de Sodio (RAS) y la Conductividad Eléctrica (CE) en el suelo. En la Figura 10.5 se muestra el efecto combinado del RAS y la CE para las profundidades de 0 a 5 cm y 5 a 35 cm, para estimar el problema de infiltración y reducción del rendimiento potencial. En la parte superficial (0 a 5 cm de profundidad), el 50 % de los terrenos muestreados tiene problemas ligeros a moderados de riesgos ocasionados por el agua de la presa La Vega, pero de 5 a 35 cm de profundidad el riesgo es mucho más alto, pues el 91 % de los terrenos tiene problemas de ligeros a moderados e importantes, por el agua de la presa La Vega. 122 Figura 10.2. Efecto combinado de la Relación de Adsorción de Sodio (RAS) y la conductividad eléctrica (CE) para las profundidades de 0 a 5 cm y 5 a 35 cm, para estimar el problema de infiltración y reducción del rendimiento potencial, en terrenos muestreados que riegan con agua de la presa La Vega. Figura 10. 5. 10.1.6. Boro De acuerdo con el Cuadro 10.2, el contenido de boro de 0 a 5 cm y de 5 a 35 cm es de 12.4 y 8.5 (mg/L de boro, respectivamente, condición que 123 hace al suelo con restricción severa para los cultivos, aun para los tolerantes al boro (Porta et al., 1999). Con respecto a la distribución del boro en los terrenos muestreados, el 93% tiene más de 4 mg/L de boro (Figura 12.6a), pero de 5 a 35 cm de profundidad el 79% tiene más de 4 mg/L de boro (Figura 12.6b) y en la interacción de las profundidades de 0 a 5 y 5 a 35 cm de profundidad, el 77% tiene más de 4 mg/L (Figura 12.6 c). a) b) c) 124 Figura 10.3. Distribución de boro en los terrenos muestreados del área de riego de la presa La vega, en las profundidades: a) 0 a 5 cm, b) 5 a 35 cm c) la interacción entre ambas profundidades. Figura 10. 6. Pero además del exceso de boro identificado en los predios muestreados en el área de riego de la presa La Vega, durante el muestreo de suelos se observó que muchas de las plantas presentaban los síntomas de toxicidad por boro en la caña de azúcar, principal cultivo en los terrenos muestreados. La fotografía de la Figura 2.3 muestra los síntomas característicos de la toxicidad por boro en caña de azúcar observados en predios del área de riego de la presa La Vega. 10.2. Distribución espacial de parámetros de suelo 10.2.1. Materia Orgánica (MO) La distribución de MO del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega se muestra en el Cuadro 5 y su distribución espacial en la Figura 12.7 a y b, respectivamente. En la parte superficial del suelo (0 a 5 cm de profundidad), prácticamente en toda la zona de riego se tiene de 1. 5 a 3.5 % de MO, en cambio de 5 a 35 cm de profundidad el estrato presenta menos de 1.5 % de Mo se 125 incrementa a 30.4 % y en el de 1.5 a 3.5 se reduce a 69.6%. Esto implica una importante superficie con pérdida de MO en el estrato de 5 a 35 cm donde el sistema radical tiene actividad y por consiguiente en la fertilidad del suelo. Cuadro 10.2. Porcentaje de la superficie con niveles de MO del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega. PV-2012. Estratos con porcentaje de MO Interpretación* % de Superficie 0 a 5 cm 5 a 35 cm < 1.5 % Bajo 2.4 30.4 1.5 - 3.5 % Medio 97.5 69.6 Alto 0.1 0.0 > 3.5 % * Adaptado de Ortíz y Ortíz (1988). 126 Figura 10.7. Distribución del contenido de materia orgánica de suelo en la profundidad de: a) 0 a 5 y b) 5 a 35 cm del área de riego de la presa La Vega, de Ameca, Jalisco. 10.2.2. Textura La superficie de los estratos con los porcentajes de partículas de los componentes texturales arcilla y arena del suelo, del área de riego de la presa La Vega, se muestran en el Cuadro 10.3. En general En la capa superficial del suelo (0 a 5 cm) predomina el estrato con 20 a 40% de arcilla con 62.6% del área de riego, seguido del estrato de 40 a 60% de arcilla que tiene 18% del área de riego. Para la capa de 5 a 35 cm de profundidad, el estrato de 20 a 40% de arcilla tiene una proporción de 46.4% del área de riego, pero en el estrato de 40 a 60% de arcilla el área de riego es de 31.4%. 127 Cuadro 10.3. Superficie de los estratos con los porcentajes de partículas de los componentes texturales arcilla y arena del suelo, del área de riego de la presa La Vega. PV-2012. Estratos con porcentaje de partículas % de Superficie del área de riego Arcilla en profundidad de: Arena en profundidad de: 0 a 5 cm 5 a 35 cm 0 a 5 cm 5 a 35 cm < 20 % 16.2 16.3 3.70 4.60 20 – 40 % 62.6 46.4 43.5 49.1 40 – 60 % 18.0 31.4 50.7 44.0 > 60 % 3.20 6.00 2.00 2.40 En la capa de 0 a 5 cm de profundidad, en el estrato de suelo con 20 a 40% de contenido de arena se tiene una superficie de 43.5 % del área de riego, en el estrato de 40 a 60% de contenido de arena la superficie del área de riego es de 50.7 %. La situación es muy similar de 5 a 35 cm de profundidad del suelo para los estratos de 20 a 40% y 40 a 60% de contenido de arena, con 49.1 y 44 %, respectivamente. Ambos componentes texturales del suelo (arcilla y arena) son importantes conocerlos para los suelos del área de riego de la presa La Vega, particularmente para considerarlo en el manejo agrícola, pues un elevado contenido de arena favorece la lixiviación de nutrimentos o elementos que pueden actuar como contaminantes de las aguas subterráneas. Por el contrario, suelos con elevado contenido de arcilla favorecen la retención de nutrimentos o contaminantes, además de favorecer la evaporación y concentración de sales o iones tóxicos en la capa superficial del suelo. En la Figura 10.8 a y b se muestra la distribución espacial de los estratos con partículas de arcilla en la profundidad de 0 a 5 y de 5 a 35 cm, respectivamente, del área de riego de la presa La Vega. En la Figura 10.9 a y b se muestra la distribución espacial de los estratos con 128 partículas de arena en la profundidad de 0 a 5 y de 5 a 35 cm, respectivamente, del área de riego de la presa La Vega. En estas figuras se tiene una distribución muy similar de arcilla, sin embargo es con la arena donde en la superficie y en el subsuelo tiene un comportamiento similar. 129 Figura 10.8. Distribución del contenido de arcilla en el suelo en la profundidad de a) 0 a 5 y de b) 5 a 35 cm del área de riego de la presa La Vega, de Ameca, Jalisco. 130 Figura 10.9.Distribución del contenido de arena en el suelo en la profundidad de a) 0 a 5 y de b) 5 a 35 cm del área de riego de la presa La Vega, de Ameca, Jalisco. 131 12.2.3. Conductividad eléctrica La conductividad eléctrica del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega se muestra en el Cuadro 10.4. En esta cuadro se observa que se tiene mayor concentración de sales en la superficie del suelo (0 a 5 cm de profundidad) se tiene un condición de moderadamente a salina a salina en casi el 40% de los terrenos de riego. En la profundidad de 5 a 35 cm la mayor parte de la superficie está libre de sales (86.7%) y solo 12.7% tiene un bajo nivel de sales. La distribución espacial de la CE se presenta en la Figura 12.9 a y b, para las profundidades de 0 a 5 y de 5 a 35 cm, respectivamente. Cuadro 10.4. Porcentaje de superficie con niveles de Conductividad Eléctrica (CE) en el suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega y su interpretación. PV-2012. Estratos CE dS/m Interpretación* % de Superficie 0 a 5 cm 5 a 35 cm Libre de sales 12.0 86.7 1–2 Muy bajo en sales 48.4 12.7 2–4 Moderadamente salino 29.1 0.6 Suelo salino 10.5 0.0 <1 >4 * Adaptado de Castellanos et al. (2000). 132 133 Figura 10.10.Distribución de la conductividad eléctrica del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega, de Ameca, Jalisco. 10.2.4. pH en el extracto de saturación El pH del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega se muestra en el Cuadro10.5. En la profundidad de 0 a 5 cm se tiene una condición de ligeramente ácido a neutro en 45.2% de la superficie y en 52.1% del área cambia de neutro a medianamente básico. En cambio en la profundidad de 5 a 35 cm la condición de pH para ser medianamente básico el 74.2% del área y solo 24.3% en condición ligeramente ácida a neutra. Cuadro 10.5. Porcentaje de superficie con pH en el extracto de saturación del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega y su interpretación. PV-2012. Estratos pH Interpretación* <5 % de Superficie 0 a 5 cm 5 a 35 cm Muy fuertemente ácido 0.0 0.0 5–6 Fuertemente a medianamente ácido 2.6 1.2 6–7 Ligeramente ácido a neutro 45.2 24.3 7–8 Neutro a medianamente básico 52.1 74.3 >8 Básico 0.1 0.2 * Adaptado de Porta et al. (1999). 134 Figura 10.11. Distribución del pH del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega, de Ameca, Jalisco. 135 La Figura 10.11 a y b, muestra la condición de pH en el extracto de saturación del suelo en las profundidades de 0 a 5 y de 5 a 35 cm, respectivamente. Las zonas con pH del extracto de saturación va de ligeramente ácido a neutro pueden asociarse con la textura arenosa que permite un mayor lavado de sales, en cambio cuando el pH va de neutro a ligeramente básico puede asociarse con la textura arcillosa que permite la acumulación de sales. 10.2.5. Boro El contenido de boro en el suelo para la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega se muestra en el Cuadro 12.6. La condición de boro en el suelo crítica en caso toda la superficie de riego de la presa La Vega, pues tanto en la superficie (0 a 5 cm) como subsuelo (5 a 35 cm) se tienen niveles que se consideran con daño severo a los cultivos, dependiendo de su tolerancia a este elemento (Ayers y Westcot, 1994). La parte superficial del suelo presenta una elevada concentración de boro en prácticamente toda el área de riego, situación asociada con la evaporación del agua de riego, que concentra el boro en los primeros 5 cm del suelo. Sin embargo, en la profundidad de 5 a 35 cm no es la excepción, de manera que la concentración boro es tan restrictiva como en la parte superficial para la mayoría de los cultivos para mantener su productividad. 136 Cuadro 10.6. Porcentaje de superficie con pH en el extracto de saturación del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega y su interpretación. PV-2012. Estratos con Boro (mg/L) Interpretación* <1 % de Superficie 0 a 5 cm 5 a 35 cm Bajo a moderadamente bajo 0.0 0.1 1-2 Medio a moderadamente alto 0.0 0.5 2-4 Alto a muy alto 0.3 10.1 4-8 Extremadamente alto 8.1 43.3 8 - 14 Excesivo 65.4 40.7 > 14 Tóxico 26.2 5.3 * Adaptado de Castellanos et al. (2000) y de Ayers y Westcot (1994). Ayers y Westcot (1994) mencionaron que los síntomas de toxicidad de boro normalmente se muestran primero en las hojas viejas como un amarillamiento, con manchas o secado de tejido foliar en las puntas y bordes (Figura 10.11). El secado y clorosis a menudo avanzan hacia el centro entre las venas (intervenales) cuando más y más boro se acumula con el tiempo. Muchos de los síntomas de toxicidad en los cultivo se producen después que las concentraciones de boro en las hojas superan los 250 a 300 mg/kg (de peso seco). Sin embargo, no todos los cultivos sensibles acumulan boro en las hojas, para ser detectados en un análisis foliar, pero pueden ser fácilmente dañadas por boro. En estos casos, debe confirmarse exceso de boro del suelo y análisis de agua, con los síntomas características en el cultivo y durante el crecimiento. En el presente estudio, el exceso de boro y elevado pH en el suelo se identifican como los principales problemas que enfrente la agricultura 137 del área de riego de la presa La Vega. La Figura 12.12 a y b, muestra la distribución espacial de la concentración de boro en el suelo para las profundidades de 0 a 5 y de 5 a 35 cm, respectivamente 138 Figura 10.12. Distribución del contenido de boro del suelo en la profundidad de 0 a 5 y de 5 a 35 cm del área de riego de la presa La Vega, de Ameca, Jalisco. 10.3. Contenido de Boro en la caña de azúcar Para validar el posible efecto de toxicidad por boro en la caña de azúcar, se muestrearon 10 predios con caña de 3 a 5 meses de ciclo de desarrollo, sin identificar si eran planta o soca. El contenido de B que se obtuvo del análisis de estas plantas se muestra en el Cuadro 10.7. La parte alta tuvo el mayor contenido de boro con 80.9 ppm boro, un valor menor en la parte media de la planta con 69.5 ppm boro y un valor medio en la parte inferior de la planta con 71.1 ppm boro. Todos los valores rebasan el límite de suficiencia de B (50 ppm) para la caña de azúcar (Campbell, 2000; McCray et al., 2013), por lo que puede decirse que se tiene un nivel de toxicidad en la caña de azúcar. 139 Cuadro 10.7. Contenido de boro en materia seca de tres niveles de caña de azúcar muestreados en plantas durante el 2012, en el Distrito de Riego de Ameca, Jalisco. Parte de la planta Promedio de Boro (ppm) Desviación estándar ALTA 80.9 34.55 MEDIA 68.5 22.07 BAJA 71.1 20.65 Promedio 73.5 26.14 11. Recomendaciones para el manejo de los problemas de toxicidad por boro y salinidad El enfoque más eficaz para prevenir la ocurrencia de problemas de toxicidad por boro (B) es utilizar agua de riego con bajo potencial para desarrollar una acumulación y finalmente toxicidad. En la zona de riego de la Presa La Vega, esta no es una opción viable, por lo que es necesario aplicar opciones de manejo para reducir la toxicidad por boro y mejorar los rendimientos y la productividad de los terrenos agrícolas. Entre las opciones para manejar el problema de toxicidad por B se encuentran los siguientes: lavado de boro, cambio a un cultivo más tolerante al boro, prácticas culturales y combinar el agua de riego con agua con menor cantidad de iones tóxicos (Ayers y Westcot, 1994). 11.1. Lavado de Boro Los iones potencialmente tóxicos en el suelo, como el sodio, el cloro o el boro, pueden reducirse por lixiviación de manera similar a la salinidad, pero la lámina de lavado requerida varía con el tipo de ión, de manera que en algunos casos podría llegar ser excesiva; en tal caso muchos agricultores prefieran cambiar a un cultivo más tolerante. De considerarse el lavado o el cambio de cultivo, en ambos casos se 140 intenta que la planta conviva con altos niveles de iones tóxicos, pero en tal caso podría requerirse de cambios extensivos en el sistema agrícola. Puede establecerse un paralelo entre salinidad y toxicidad. Los iones en cantidades tóxicas (cloruro, sodio y a un menor boro grado) son una parte importante de la acumulación normal de la salinidad en la zona de raíces de un cultivo. La toxicidad puede desarrollarse con pocos riegos o dentro de uno o más estaciones de crecimiento, dependiendo de la concentración de iones tóxicos en el agua de riego y la fracción lixiviada cumplida. Los síntomas de toxicidad observados en la planta junto con el análisis de suelo, agua y planta, son muy útiles para el monitoreo de la toxicidad potencial y la adecuación de prácticas de lavado y manejo del cultivo. Si los iones tóxicos están llegando en el agua de riego, debe hacerse énfasis en la prevención mediante la lixiviación adecuada o mejorar la eficiencia del sistema de irrigación. Por otro lado, el lavado de sales puede utilizarse para prevenir un problema de acumulación de iones o corregir el problema después que se ha reconocido por los síntomas en la planta o daños en el cultivo. Sin embargo, en zonas de riego continuo, la recuperación no será necesaria a menos que el lavado sea inadecuado y el exceso de iones tóxicos se acumule en concentraciones que afectan la producción del cultivo. El boro es mucho más difícil de lixiviar que otros iones, como el cloro o sodio. El boro se mueve más lentamente con el agua del suelo y requiere hasta tres veces más agua de lavado para reducirlo a una cantidad equivalente de cloro o salinidad. En muchas de las observaciones de campo, la concentración de boro en el extracto de saturación del suelo de la zona superior de la raíz se aproxima al agua de riego aplicado, razón por la cual con buen manejo de la irrigación, debería ser posible reducir y mantener esta zona cerca de la misma concentración de boro que el agua aplicada. La lámina de lavado para boro puede ser estimada con la ecuación de requerimiento de lixiviación de salinidad (Rhoades 1974), si se conoce la tolerancia al boro (Be en extracto de saturación) y el boro en el agua de riego (Bw). Se convierte entonces la ecuación de LR: 141 Ecuación 13.1. donde: LR(B) es el requerimiento mínimo de lavado necesario para controlar el boro con métodos ordinarios de riego superficial, Bw es la concentración de boro en el agua de riego aplicada en miliequivalentes por litro (meq/L), Be es la concentración de boro tolerado por el cultivo y determinado en el extracto de saturación del suelo y expresada en miliequivalentes por litro (meq/L En resumen, la clave para controlar un problema de toxicidad por boro es seleccionar una buena fuente de agua de riego y posteriormente lixiviar las sales según se requiera, para controlar la acumulación a niveles tóxicos que pudieran afectar la producción del cultivo. Si el manejo del riego es pobre y se desarrollan concentraciones perjudiciales de boro, será necesario realizar enmiendas y lavados de recuperación para restablecer la productividad del suelo. 11.2. Cambio a un cultivo más tolerante al boro Seleccionar un cultivo más tolerante al boro, ofrece una solución muy práctica para el problema de toxicidad de este ion. Hay grados de sensibilidad al boro, así como hay grados de sensibilidad a la salinidad. Aunque la información es limitada, alguna está disponible sobre la tolerancia relativa de cultivos al boro. El Cuadro 11.1 presenta de tolerancia la boro. Debe considerarse que esta información es una aproximación y condiciones agrícolas locales pueden modificarlos. Los factores que afectan la tolerancia al boro incluyen al clima, el manejo del riego, la fracción de lixiviación, el drenaje, la etapa de crecimiento del cultivo y la fecha de madurez del cultivo. La selección de cultivares o variedades es otra manera de cambiar el cultivo para hacer frente a las condiciones de toxicidad existentes. Ciertas variedades difieren en su capacidad para excluir a los iones de boro y producir buenas cosechas en condiciones menos que ideales. 142 Cuadro 11.1. Tolerancia relativa al boro de cultivos agrícolas. Lemon Blackberry Avocado Grapefruit Orange Apricot Peach Cherry Plum Persimmon Fig, kadota Grape Walnut Pecan Cowpea Onion Garlic Sweet potato Wheat Barley Sunflower Bean, mung Sesame Lupine Strawberry Artichoke, Jerusalem Bean, kidney Muy sensible (<0.5 mg/L) Limón Zarzamora Sensible (0.5 – 0.75 mg/L) Aguacate Toronja Naranja Albaricoque Durazno Cereza Ciruela Caqui Higo, kadota Uva Nogal Pacana Chícharo vaca Cebolla Sensible (0.75 – 1.0 mg/L) Ajo Papa dulce Trigo Cebada Girasol Haba de mung, Sésamo Lupino Fresa Alcachofa de Jerusalén Frijol Citrus limon Rubus spp. Persea americana Citrus X paradisi Citrus sinensis Prunus armeniaca Prunus persica Prunus avium Prunus domestica Diospyros kaki Ficus carica Vitis vinifera Juglans regia Carya illinoiensis Vigna unguiculata Allium cepa Allium sativum Ipomoea batatas Triticum eastivum Hordeum vulgare Helianthus annuus Vigna radiata Sesamum indicum Lupinus hartwegii Fragaria spp. Helianthus tuberosus Phaseolus vulgaris 143 Bean, lima Groundnut/Peanut Frijol lima Phaseolus lunatus Maní/cacahuete Arachis hypogaea Moderadamente sensible (1.0 – 2.0 mg/L) Pepper, red Pimiento rojo Capsicum annuum Pea Chícharo (Guisante) Pisum sativa Carrot Zanahoria Daucus carota Radish Rábano Raphanus sativus Potato Papa Solanum tuberosum Cucumber Pepino Cucumis sativus Moderadamente tolerante (2.0 – 4.0 mg/L) Lettuce Lechuga Lactuca sativa Cabbage Col Brassica oleracea capitata Celery Apio Apium graveolens Turnip Nabo Brassica rapa Bluegrass, Kentucky Pasto Kentucky Poa pratensis Oats Avena Avena sativa Maize Maíz Zea mays Artichoke Alcachofa Cynara scolymus Tobacco Tabaco Nicotiana tabacum Mustard Mostaza Brassica juncea Clover, sweet Trébol dulce Melilotus indica Squash Calabacita Cucurbita pepo Muskmelon Melón Cucumis melo Tolerante (4.0 – 6.0 mg/L) Sorghum Sorgo Sorghum bicolor Tomato Tomate Lycopersicon lycopersicum Alfalfa Alfalfa Medicago sativa Vetch, purple Vicia, púrpura Vicia benghalensis Parsley Perejil Petroselinum crispum Beet, red Remolacha roja Beta vulgaris Sugarbeet Remolacha azucarera Beta vulgaris Muy tolerante (6.0 – 15.0 mg/L) 144 Cotton Asparagus Algodón Espárrago Gossypium hirsutum Asparagus officinalis 11.3. Prácticas culturales Puesto que el lavado es el principal método de control de iones tóxicos, las prácticas culturales enfocadas al manejo del agua de riego en el predio son la clave del éxito. Las prácticas culturales que ofrecen mejor control y distribución de agua incluyen la nivelación de la tierra, el calendario de riego, forma del surco para la localización de la planta o semilla, fertilización adecuada, selección del sistema de riego con modificación de perfil del suelo para mejorar la eficiencia de aplicación del agua de riego y el drenaje artificial, si el drenaje natural es insuficiente. 1) El control de la salinidad y la acumulación de iones tóxicos. Es difícil si la tierra no está nivelada para permitir la distribución uniforme del agua. Las sales se acumulan en los puntos altos que tienen muy poca penetración y lixiviación ocurre cuando el agua no corre, mientras que el agua se acumula en las zonas bajas que causa el aniego y potenciales problemas de drenaje. 2) El calendario de riego, para evitar el estrés hídrico y mejorar las posibilidades de éxito cuando se utiliza agua con alta salinidad. El momento de riego podría incluir el aumento de la frecuencia de riego, el riego antes de una temporada de lluvias, humedad residual, riegos de presiembra u otras prácticas que ayuden la germinación y/ desarrollo del cultivo. La meta del calendario de riego es reducir la salinidad y evitar el estrés hídrico entre riegos. 3) El método de riego. Este afecta directamente la eficiencia del uso del agua y la forma en que se acumulan las sales. Los riegos por inundación y aspersión están diseñados para aplicar agua uniformemente sobre el área irrigada, lo que favorece que la mayoría de las sales se acumulen en la zona inferior de la raíz. El grado de acumulación de sales depende de la fracción de lixiviación, de manera que en los perfiles de salinidad típica de riego superficial de inundaciones o aspersor en lixiviación fracciones varía de 0.1 a 145 0.4. La severidad de un problema de toxicidad se aumenta cuando el cultivo absorbe agua del suelo y el suelo se seca entre riegos. Los iones se concentran en agua con un menor volumen, cuando se seca la capa superior del suelo. En este caso el cultivo debe extraer agua de las capas más profundas del suelo donde los iones tóxicos y salinidad suelen estar en mayor concentración. Aumentar la frecuencia de riego suministra una mayor proporción de las necesidades de agua del capa superior suelo, así como la dilución del agua de las capas más profundas y reducir así, el impacto tanto de la salinidad como de los iones tóxicos. 4) Los fertilizantes, estiércoles y enmiendas del suelo. Si los materiales contienen sales solubles en altas concentraciones y se colocan muy cerca de las plántulas en proceso de germinación o a la planta en crecimiento, el fertilizante puede provocar o agravar un problema de salinidad o toxicidad. Las prácticas de fertilización normalmente son pensadas para ofrecer poco beneficio para contrarrestar la salinidad, como en el caso de la toxicidad de boro en cítricos, muchos productores aplican nitrógeno adicional para estimular el crecimiento vegetativo. El boro se acumula primero en cantidades tóxicas en las hojas más antiguas para luego necrosarse y caerse, en consecuencia se reduce la capacidad fotosintética del árbol. En este caso, el nitrógeno se utiliza para estimular el nuevo crecimiento y restaurar el área foliar y la capacidad fotosintética del árbol. El análisis foliar para el nitrógeno es la guía para determinar el requerimiento de nitrógeno. 5) Desarrollo radical. Cuando se incrementa la concentración de iones en el suelo. Para reducir los efectos de la acumulación de iones tóxicos en la capa superficial debido a que estos se mueven con el frente de humedecimiento y por la evaporación del agua, es recomendable colocar la semilla o la planta en una posición del surco donde la concentración de sales es menor. Aceves (2011) hace referencia al efecto de la forma del surco y como este favorece la concentración de iones en la parte alta del surco, situación que se puede aprovechar para reducir los efectos de las sales en procesos 146 de germinación o desarrollo de cultivos, como la remolacha, lechuga u otros (Figura 11.1). Figura 11.1. Efecto de la forma del surco en la germinación de cultivos y desarrollo de cultivos (Aceves, 2011). 6) La nivelación de las tierras. Es una práctica importante en el control de la salinidad y la acumulación de iones tóxicos, pero es difícil si un campo no está nivelado para permitir la distribución uniforme del agua. Las sales se acumulan en los puntos altos que tienen muy poca penetración y lixiviación ocurre cuando el agua no escurre a las partes bajas, mientras que el agua se acumula en las zonas bajas que causa del anegamiento y potenciales problemas de drenaje suelen estar presentes. 7) Nivel freático superficial. Suelos con problemas de drenaje complican el control de salinidad y acumulación de iones como el Boro. Las capas freáticas superficiales ocurren con frecuencia debido a la presencia de una capa impermeable debajo de la superficie del suelo por una barrera de arcilla, tepetate o roca. Los problemas de drenaje más frecuentes son causados por excesos de agua de riego, pero también por filtración de canales de riego o 147 fugas en las zonas con pendiente ascendente. En tierras abiertas al cultivo, si se percibe un drenaje deficiente, se pueden anticipar problemas de drenaje mediante la formulación de planes para su control inmediato o futuro, en cambio con drenaje adecuado establecido, la salinidad del suelo superficial puede controlarse mediante la manejo del riego. 13.4. Combinar el agua de riego con agua con menor cantidad de iones tóxicos En los casos donde el problema de toxicidad no es demasiado grave, algunos cambios menores en las prácticas de cultivo pueden implementarse para minimizar el impacto. Uno de estas prácticas es utilizar una fuente alternativa de agua con bajo contenido de iones tóxicos y que podría combinarse para reducir el riesgo de toxicidad. El cambio de los suministros de agua es una solución drástica pero simple a un problema de calidad de agua. Pero sólo es posible si se dispone de una fuente de agua de mejor calidad. Por ejemplo, el agua subterránea de mala calidad generalmente está abandonada si existe un mejor suministro de agua con mejor calidad, aunque esto no ocurre si existe escasez en el suministro de agua. Bajo estas condiciones, debe considerarse que mezcla de agua de baja calidad con una de mayor calidad, aumentando así la cantidad total de agua útil disponible. La mezcla no reducirá la carga total de sal, pero puede permitir más área de cultivo a sembrar debido al aumento en el volumen de agua disponible causado por dilución. La evaluación de la utilidad del agua mezclada debe ser valorada cuidadosamente para asegurar que la cantidad total de agua adicional necesaria para el lavado del Boro o control de la salinidad (la exigencia adicional de lixiviación) no exceda a la cantidad de agua disponible para mezclada. 148 12. Conclusiones Los parámetros determinados en el diagnóstico aislados, no representan un riesgo para los usos que se le da a la presa La Vega, a excepción del boro que presento concentraciones elevadas y que de acuerdo a los Criterios ecológicos de calidad del agua, representa riesgo para la vida acuática y los posibles problemas de toxicidad en los cultivos. Sin embargo, cuando varios de los elementos se combinan como es el caso de la determinación del SAR y el CSR, el riesgo se incrementa considerablemente, aumentando su peligrosidad. Es importante mencionar que aun cuando el valor SAR en la mayoría de los sitios de muestreo presentó riesgo medio, el uso constante del agua en el riego de los cultivos con estas características provoca la acumulación de las sales en el suelo. Considerando que el agua de la presa La Vega se ha utilizado como agua de riego en la zona de Ameca para el cultivo de caña de azúcar por más de 30 años y los efectos se pueden observar a simple vista. Se requiere especial atención al rio Salado, ya que los aportes a la presa incrementan considerablemente la concentración de contaminantes, en especial de boro y arsénico. En este contexto, se presentan algunas recomendaciones para la mitigación de los mismos. La factibilidad de la implementación de estos sistemas está en función del costo-beneficio que los aportes en cantidad y calidad hace el rio Salado. Las concentraciones encontradas de boro y arsénico especialmente en el rio Salado, sugiere componentes de tipo geológico lo que hace probable que la contaminación sea principalmente de manera natural. Esto debido a que el rio Salado tiene su origen en el bosque La Primavera, donde se tiene características de tipo volcánico. Sin embargo, se requiere la identificación exacta del origen del boro, esto se obtendrá con el monitoreo y reconocimiento de la cuenca del rio Salado. 149 Por otro lado, la presencia de Coliformes totales y fecales evidencia contaminación de origen doméstico. El tratamiento del agua residual de las poblaciones alrededor de la presa es otro factor importante a considerar en la reducción de los contaminantes. Se sugiere que las concentraciones de nutrientes en el agua, particularmente los compuestos de nitrógeno y fósforo, se incluyan en los cálculos de los fertilizantes aplicados a los cultivos. Esto con el propósito de bajar la cantidad de fertilizantes aplicados y evitar los escurrimientos altamente contaminados. Por esta razón es de vital importancia el monitoreo de los mismos, especialmente en la época de riego. El muestreo en época de estiaje, lo cual incrementa la posibilidad de concentración de los contaminantes, por lo tanto es importante realizar el monitoreo constante, en las diferentes épocas de año para determinar tendencias en el comportamiento de los mismos. Se detectaron cambios mínimos en el comportamiento de los contaminantes en la red de canales de riego, este comportamiento es esperado ya que los canales primarios y secundarios están construidos con concreto, por lo tanto el agua no tiene contacto con el sustrato y por lo tanto los procesos de degradación de contaminantes son limitados. En el caso de los resultados obtenidos en los suelos se concluye lo siguientes. De acuerdo con los resultados del análisis de suelos muestreados en las profundidades de 0 a 5 y de 5 a 35 cm, de terrenos regados con agua de la presa La Vega, el contenido de materia orgánica se considera un nivel medio; el porcentaje de arena, limo y arcilla, del suelo lo identifica como franco-arcilloso. La suma de cationes y cationes en la parte superficial (0 a 5 cm) es 23.3 y 23.4 meq/L, respectivamente, valores contrastantes a los observados en la profundidad de 5 a 35 cm 150 del orden de 6.8 y 6.7 meq/L, respectivamente. Esta situación muestra la alta concentración de sales en la parte superficial, resultado asociado con la evaporación del agua después de los riegos. La Conductividad Eléctrica en la parte superficial del suelo lo identifica como moderadamente salino, donde solo cultivos con tolerancia a la salinidad pueden desarrollarse, mientras que en la profundidad de 5 a 35 cm, la CE la clasifica con efectos despreciables a la salinidad. La interacción entre la CE en las dos profundidades de muestreo, casi el 70% de las muestras tiene efectos despreciables a la salinidad o de condición muy ligeramente salina y solo en el 30% de las muestras se tienen problemas de salinidad. En la profundidad de 0 a 5 cm, el 63% no tiene restricciones de uso, el 36% tiene restricción de ligera a moderada y solo 1% tiene restricción máxima; en la profundidad de 5 a 35 cm, el 94% no tiene restricciones de uso y el 6% tiene restricción de ligera a moderada. Con respecto al riesgo de salinización de terrenos de la presa La Vega, en la profundidad de 0 a 5 cm, solo el 15% de los terrenos no tiene riego de salinización, el 66% tiene riesgo ligero a moderado y 19% tiene riesgo importante. En la profundidad de 5 a 35 cm, el 68% de los terrenos tiene riesgo de salinización nulo, el 30 % tiene riesgo ligero a moderado y solo 2% tiene riesgo importante. Con respecto al pH en el extracto de saturación del suelo, la mayor porcentaje en las profundidades de 0 a 5 y 5 a 35 cm, se tuvo en el rango de 7.2 a 8.3, valores que hacen que se clasifique al suelo como alcalino. Esta situación implica una mayor disponibilidad de cloro y molibdeno para los cultivos, pero posibles deficiencias de fósforo, hierro, cobre, manganeso y zinc. El contenido de boro en las profundidades de 0 a 5 cm y de 5 a 35 cm, resultó de 12.4 y 8.5 mg/L de boro, respectivamente. Este resultado clasifica al suelo con restricción severa en la productividad de los cultivos, aun para los tolerantes al boro. La distribución del boro en los terrenos muestreados, el 93% tiene más de 4 mg/L de boro, pero de 5 a 35 cm de profundidad el 79% tiene más de 4 mg/L de boro y en la interacción de las profundidades de 0 a 5 y 5 a 35 cm de profundidad, el 151 77% tiene más de 4 mg/L. Además del exceso de boro en los predios muestreados, también se observó en muchos predios con caña de azúcar presentaban los síntomas de toxicidad por boro, situación que se refleja en los elevados contenidos de boro en la planta mayores de 70 mg/L B, niveles superiores a los recomendados con suficiencia para la caña de azúcar (10 a 50 mg/L). Para cado uno de estos parámetros se identificó su distribución espacial en las profundidades de 0 a 5 cm y de 5 a 35 cm, con lo que es posible identificar las áreas con mayor problema. Se ofrecen algunas indicaciones para el manejo del problema de toxicidad por boro y salinidad, sin embargo, debe diagnosticarse de manera particular el problema en cada predio y las soluciones pertinentes. 152 13. BIBLIOGRAFÍA CONSULTADA Aceves, N.E. 2011. El ensalitramiento de los suelos bajo riego. 2da edición. Colegio de Posgraduados-Mundi Prensa México. 167 p. Alarcón-Vera, A.L. 2001. El boro como nutriente esencial. Ediciones de Horticultura. 155:36-47. Algoazany, A.S., Kalita, P.K., Mitchell, J.K., Cooke, R.A.C., Hirschi, M.C. 2005. A long-Term Monitoring of Agricultural Chemical Transport From A Allison, R.V., Byyan, O.C. and Hunter, J.H. 1997. The simulation of plant response on the raw peat soils of the Florida Everglades through the use of copper sulphate and other chemicals. Florida Agricultural Experiment Station Bulletin 190, University of Florida Gainesville, FL. 78 p. Ayers, R.S. and Westcot, D.W. 1994. Water Quality for Agriculture, Irrigation and Drainage. Food and Agriculture Organization of the United Nations, Rome. 135 p. Babourina, O., Rengel, Z. 2011. Nitrogen Removal from Eutrophicated Water by Aquatic Plants. Eutrophication: Causes, Consequences and Control. 355-372 p. Baccaro, K., Degorgue, M., Lucca M., Picone L. y E. Zamuner. 2006. Calidad del agua para consumo humano y riego en muestras del cinturón hortícola del Mar de la Plata. INTA, Argentina. RIA. 35:56-64. Bauder, T.A., Waskom, R.M., Sutherland, P.L. and Davis, J.G. 2011. Irrigation water quality criteria. Colorado State Univ. 506 p. Bautista-Cruz, A. y Rnaud-Viñas, M.R.. 2006. Elementos potencialmente tóxicos en suelos agrícolas con manejo de riesgo contaminante. Naturaleza y Desarrollo. 4(1):36-42. Brooks, P.C. 1996. Investigation of temperature effects on denitrifying bacterial populations in biological nutrient removal (BNR) system. MS. Thesis: Virginia Polytechnic Institute and State University, Blacksburg, Virginia, USA. 123 p. 153 Brown, P. and H. Hu. 1998. Boron mobility and consequent management in different crops. Better Crops 82:28-31. Cahn, M., English, M.J. and T. Hartz, T. 2011. Irrigation and nitrogen management web-based software for lettuce production. Annual conference proceedings, Tulare CA. 21 p. Campbell, C.R. 2000. Reference sufficiency ranges for plant analysis in the southern region of the United States. Tomado de: http://www.ncagr.gov/agronomi/saaesd/scsb394.pdf Fecha de acceso: 24-04-2013. Caron, D.A., Goldma, J.C., Dennett, M.R. 1986. Effect of temperature on growth, respiration and nutrient regeneration by an omnivorous microflagellate. Appl. Environ. Microbiol. 52(6):130-137. Castellanos, J.Z., Bueno X.U. y Aguilar, A.S. 2000. Manual de Interpretación de Análisis de suelos y aguas agrícolas, plantas y ECP. 2da. Edición. Instituto de Capacitación para la Productividad Agrícola. 201 p. Cervilla, L.M., Blasco, B., Rios, J.J., Rosales, M.A., Sánchez-Rodríguez, E. Rubio-Wilhelmi, M.M., Romero L. and Ruiz, J.M. 2012. Parameters Symptomatic for Boron Toxicity in Leaves of Tomato Plants. Journal of Botany. 2012:1-17. Cisneros, E.X., Gontes B.R., Nuño R.R. 2010. Contaminación de aguas y su efecto en el riego ejido San Andrés, Ocotlán, Jalisco. Comisión Estatal del Agua de Jalisco. 2008. Reportes de monitoreo y análisis de calidad del agua, Laboratorio de calidad del agua de la Comisión Estatal del Agua de Jalisco. 55 p. Comisión estatal del Agua. http://www.ceajalisco.gob.mx/cuencas/vega-cocula.html de acceso: 23-06-2011. 2011. fecha Comisión Estatal del Agua Jalisco. Reportes de monitoreo y análisis de calidad del agua, Laboratorio de calidad del agua de la Comisión Estatal del Agua de Jalisco, 2008. Comisión Nacional del Agua (CNA). 2011. Estadísticas del agua en México, edición 2011. Secretaría de Medio Ambiente y Recursos Naturales. México, D.F. 181 p. 154 Conesa V. y V. Fernández. 1993.Guía metodológica para la evaluación del impacto ambiental. Ediciones Mundiprensa. Madrid. 230 p. Criterios Ecológicos de Calidad del Agua. CCA-001-89. Dale, B. 2009. Eutrophication signals in the sedimentary record of dinoflagellate cysts in coastal waters. Journal of sea research 61:103–113. De-Bashan, L.E., Bashan, Y., 2004. Recent advances in removing phosphorus from wastewater and its future use as fertilizer (1997-2003). Water Research. 38:4222-4246. De la Lanza G. y J.L. García. 2002. Lagos y Presas de México, AGT. Editor, S.A. México, D.F. 287 p. Drury, C.F., Tan, C.S., Gaynor, J.D., Oloya, T.O. and T.W. Welacky. 1996. Influence of controlled drainage-sub-irrigation on surface and tile drainage nitrates loss. Journal of Environmental Quality. 25:317-324. Dunn, S.M., Vinten, A.J., Lilly, A., DeGroote, J., McGechan, M. 2005. Modelling nitrate losses from agricultural activities on a national scale. 51:319-27. Erdal, U.G., Erdal, Z.K., Randall, C.W. 2003. A thermal adaptation of bacteria to cold temperatures in an enhanced biological phosphorus removal system. Water Sci. Technol. 47:123-128. European Commission. 2002. Implementation of Council Directive 91/676/EEC Concerning the Protection of Waters Against Pollution Caused by Nitrates from Agricultural Sources. Office for Official Publications of the European Communities, Luxembourg. 44 p. Favari, P.L., Madrigal O. M., and López L.E. 2003. Efecto del agua del embalse de la vega en la lipopexidacion y los niveles de la acetilcolinesterasa en el hígado y el musculo de Xiphophorus helleri. Rev. Int. Contam. Ambient. 19(3):145-155. Ferguson, R.B., Shapiro, C.A., Hergert, G.W., Kranz W.L., Klocke, N.L., Krull, D.H., 1991. Nitrogen and Irrigation Management Practices to Minimize Nitrate Leaching from Irrigated. Corn. Journal of Production Agriculture. 4:186-192. 155 Fogler, H.S. 1992. Elements of Chemical Reaction Engineering. Prentice Hall. New Jersey. 240 p. GAT. 2012. Salinidad en cultivos agrícolas. Departamento agronómico. Tomado de: http://www.gatfertiliquidos.com/salinidad_cultivos.pdf Fecha de acceso: 20-03-2013 Gebremariam, Y.S., Beutel, W.M. 2008. Nitrate removal and DO levels in batch wetland mesocosms: Cattail (Typha spp.) versus bulrush (Scirpus spp.). Ecological engineering. 34:1-6. Gomes, F.J., Bricker B.S., Castro, S. T. 2007. Application and sensitivity testing of a eutrophication assessment method on coastal systems in the United States and European Union. Journal of Environmental Management. 82, 433–445. Heiskary, S.A., and Wilson, C.B. 2005. Minesota lake water quality assessment report: Developing pollution control agency. Minnesota Pollution Control Agency. Third Edition. 188 p. Hem, J.D. 1985. Study and interpretation of the chemical characteristics of natural water. Third edition: U.S. Geological Survey WaterSupply. 113 p. Iowa Department of Natural Resources. 2009. Water Quality Standards Review: Chloride, Sulfate and Total Dissolved Solids. 145 p. Irie, M., Kawachi, A., Tarhouni, J., Ghrabi, A. and Isoda, H. 2012. Sedimentation Trend and Behavior of Turbid Water in the Reservoir. Journal of Arid Land Studies. 22(1):92-94. Kadlec, R.H. 2005. Phosphorus removal in emergent free surface wetlands. J. Environ. Sci. 40:1293-1306. Langmuir, D. 1997. Aqueous Environmental Geochemistry, Prentice Hall, NJ. 280 p. Linnik, P.M., Zubenko, I.B. 2000. “Role of bottom sediments in the secondary pollution of aquatic environments by heavy metal compounds” Lakes and Reservoir: Research and Management. 5:11-21. López-López E. y Paulo-Maya J. 2001. Changes in the fish assemblages in the upper río Ameca, México. J. Fresh. Ecol. 16:179-187. 156 Mahmood, E.A. and Gholami, M. 2010. The effect of increased chloride (Cl) content in nutrient solution on yield and quality of strawberry (Fragaria ananassa Duch,) fruits. Journal of Fruit and Ornamental Plants research. 18:37-44. Marais, D., and Jenkins, D. 1992. The effects of MCRT and temperature on enhanced biological phosphorus removal. Water Sci. Technol. 26: 955-965. McCray, J.M., Rice, R.W., Ezenwa, I.V., Lang, T.A. and L. Baucum. 2013. Sugarcane plant nutrient diagnosis. SS-AGR-128 series of the Agronomy Department, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. 94 p. Miller, K.J., Rise, D.S. and C. McDonald. 2002. Groundwater and surface water quality, herbicide transport and irrigation practices Greenfields aquifer, Montana. Open-File Report 463. 125 p. Mitchell, J.K. McIsaac, G.F., Walker, S.E. and M.C. Hirschi. 2000. Nitrate in river and subsurface flows from an east central Illinois watershed. Transactions of the ASAE. 43:337-342. Nable, R.O., Banuelos, G.S., Paull, J.G. 1997. Boron toxicity. Plant Soil. 198:181–198. Norma Oficial Mexicana NMX-AA-007-SCFI-2000. Análisis de agua determinación de la temperatura en aguas naturales, residuales y residuales tratadas - método de prueba (cancela a la NMXAA-007-1980). Norma Oficial Mexicana NMX-AA-008-SCFI-2000. Análisis de agua determinación del pH - método de prueba (cancela a la NMXAA-008-1980). Norma Oficial Mexicana NMX-AA-012-SCFI-2001. análisis de agua determinación de oxígeno disuelto en aguas naturales, residuales y residuales tratadas - método de prueba (cancela a la NMX-AA-012-1980). Norma Oficial Mexicana NMX-AA-026-SCFI-2010. Análisis de agua medición de nitrógeno total Kjeldahl en aguas naturales, residuales y residuales tratadas - método de prueba - (cancela a la NMX-AA-026-SCFI-2001). 157 Norma Oficial Mexicana NMX-AA-029-SCFI-2001. Análisis de aguas determinación de fósforo total en aguas naturales, residuales y residuales tratadas - método de prueba (cancela a la NMX-AA029-1981). Norma Oficial Mexicana NMX-AA-038-SCFI-2001. Análisis de agua determinación de turbiedad en aguas naturales, residuales y residuales tratadas - método de prueba (cancela a la NMX-AA038-1981). Norma Oficial Mexicana NMX-AA-072-SCFI-2001. Análisis de agua determinación de dureza total en aguas naturales, residuales y residuales tratadas - método de prueba (cancela a la NMX-AA072-1981). Norma Oficial Mexicana NMX-AA-073-SCFI-2001. Análisis de agua determinación de cloruros totales en aguas naturales, residuales y residuales tratadas - método de prueba (cancela a la NMX-AA-073-1981). Norma Oficial Mexicana NMX-AA-074-1981. Análisis de agua determinación del ion sulfato norma oficial mexicana NOM-113SSA1-1994, bienes y servicios. Método para la cuenta de microorganismos Coliformes totales en placa. Norma Oficial Mexicana NMX-AA-082-1986. Contaminación del aguadeterminación de nitrógeno de nitrato-método espectrofotométrico ultravioleta. Norma Oficial Mexicana NMX-AA-093-SCFI-2000. Análisis de agua determinación de la conductividad electrolítica - método de prueba (cancela a la NMX-AA-093-1984). Norma Oficial Mexicana NMX-AA-099-SCFI-2006. Análisis de agua – determinación de nitrógeno de nitritos en aguas naturales y residuales – métodos de prueba (cancela a la NMX-AA-0991987). Norma Oficial Mexicana NOM-127-SSA1-1994. Salud ambiental, agua para uso y consumo humano. Límites permisibles de calidad y tratamientos a que debe someterse el agua para su potabilización. Diario Oficial de la Federación. 158 Norma Oficial Mexicana NOM-AA-036-SCFI-2001. Análisis de aguadeterminación de acidez y alcalinidad en aguas naturales, residuales y residuales tratadas- método de prueba (cancela a la NMX-AA-036-1980). Norma Oficial Mexicana NOM-113-SSA1-1994, bienes y servicios. Método para la cuenta de microorganismos Coliformes totales en placa. Norma Oficial Mexicana NOM-021-RECNAT-2000, que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudio, muestreo y análisis, Ogoyi, D.O., Mwita, C.J., Nguu, E.K. and M. Shiundu. 2011. Determination of Heavy Metal Content in Water, Sediment and Microalgae from Lake Victoria, East Africa. The Open Environmental Engineering Journal. 4:156-161. Ortega de Pelligrini, A.E. 1992. Intoxicación con boro en cultivos de poroto de Cachi, Valles Calchaquies, Salta. Panorama agropecuario. 41:12-22. Ortíz, V.B. y Ortíz, S.C.A. 1988. Edafología. 7a edición. Universidad Autónoma Chapingo. Departamento de suelos. 372 p. Palacios, M. A., Rodríguez, A.M.L., Barajas, O.G. 2010. Tratamiento electrostático (ESP) del agua para riego. Facultad de Ciencias Biológicas y Forestales Universidad Autónoma de Chihuahua. 154 p. Panno, S.V., Hackley, K.C., Hwang, H.H., Greenberg, S.E., Krapac, I.G., Landsberger, S., and O’Kelly, D.J. 2006, Characterization and identifcation of Na-Cl sources in ground water: Ground Water. 44:176–187. Pérez-Olvera, M. A., R. García-Mateos, A. Vázquez-Alarcón, T. ColinasLeón, M. Pérez-Grajales y H. Navarro-Garza. 2008. Concentración de pb, cd, ni y zn en suelos contaminados y su transferencia a la pella de brócoli. Terra Latinoamericana 26(3): 215-225. Porta, C.J., López-Acevedo Reguerín, M.Y., Roquero De Laburu, C.1994. Edafología para la Agricultura y el Medio Ambiente. Ed. -Mundi-Prensa. Madrid. 286 p. 159 Porta, J., M. López – Acevedo y C. Roquero. 1999. Edafología para la agricultura y el medio ambiente. 2a edición. Ediciones MundiPrensa. Bilbao, España. 126 p. Portielje, R., and Van der Molen, D. 1999. Relationships between eutrophication variables: from nutrient loading to transparency. Hydrobiologia. 408:375–387. Portilla, E., Tett, A. P., Gillibrand, P.A., Inall, M. 2009.Description and sensitivity analysis for the LESV model:Water quality variables and the balance of organisms in a fjordic region of restricted exchange. Ecological Modelling. 220:2187–2205. Prieto García, F., J. Prieto Méndez, S. de ita Gutiérrez, M.A. Méndez y A.D. Román-Gutiérrez. 2009. Correlación de potencial zeta y parámetros fisicoquímicos en extractos de saturación de suelos del distrito de riego-03, valle del Mezquital, Hidalgo, México. Tropical and subtropical Agroecosystems, 10(2):161-167. Quintero, D.R. 2004. Efectos de la aplicación de elementos menores en caña de azúcar en suelos del Valle de río Cauca. Centro de Investigación de la Caña de Azúcar de Colombia (CENICAÑA). Programa de agronomía. Documento de trabajo núm. 530. Santiago de Cali, Colombia. 14 p. Radwan, M. 2002. River water quality modeling as water resources management tool at catchment scale, Ph.D. thesis, KU Leuven, Belgium. 187 p. Rascón-Alvarado, E., E. Peña-Cervantes, R. López-Cervantes, M. Cantú-Sifuentes y E. A. Narro Farías. 2008. Impacto en algunas propiedades físicas del suelo por aplicación de aguas residuales. Terra Latinoamericana 26(1):69-74. Reid, R.J. 2013. Boron Toxicity and Tolerance in Crop Plants (Chapter 15). In: Crop Improvement Under Adverse Conditions (Tuteja, N., and S. S. Gill, eds.). Springer Science+Business Media. New York, USA. 150 p. Salazar-García, S. 2002. Nutrición del aguacate, principios aplicaciones. INPOFOS, INFAP. Querétaro, México. 165 p. Sawyer, y C.N., McCarty, P.L. and G.F. Parkin, Chemistry for Environmental Engineering, McGraw-Hill, New York, 1994. 310 p. 160 Schueneman, T.J. 2001. Characterization of sulfur sources in the EAA. Soil and Crop Sciences Society of Florida Proceedings, 60:4952. Sharma, C.P. 2006. Plant Micronutrients. Science Publishers. Enfield, New Hampshire. United States of America. 265 p. Shen, H.J., 1978, “Transient Mixing in River Channels”, Journal of the Environmental Engineering Division, 445-459 Shuh-Ren, J., Lin, Y.F., Der-Yuan Lee, Tze-Wen Wang. 2001. Nutrient removal from polluted river water by using constructed wetlands. Bioresource Technology, 76:131-135. Shutes, R.B.E., Revitt, D.M., Scholes L.N.L., Forshaw, M., Winter, B. 2001. An experimental constructed wetland system for the treatment of highway runoff in the UK. Water Science & Technology. 44:571-578. SEMARNAT. 2011. 03/17/2011. http://www.semarnat.gob.mx/. Consultado Silva, D. H., Lanzoni-Rossi, A., Enedi-Boaretto, N., de Lima-Nogueira, T. Muraoka. 2008. BORON AFFECTS THE GROWTH AND ULTRASTRUCTURE OF CASTOR BEAN PLANTS. Sci. Agric. (Piracicaba, Braz.). 65:659-664. Standard Methods for the Examination of Water and Waste Water. 1992. American Public Health Association. Washington D.C. 516 p. Tanji, K.K. 1990. Agricultural Salinity Assessment and Management. Manuals and Reports on Engineering Practice Number 71. American Society of Civil Engineers, USAb. 619 p. Tchobanoglous, G., Schroeder, E.D. 1987. Water Quality. University of California at Davis. Addison Wesley Longman. 280 p. Truchot, J.P, Forgue, J. 1998. Effect of water alkalinity on gill CO2 exchange and internal PCO2 in aquatic animals. Comp Biochem Physiol A Mol Integr Physiol. 119:131-6. Vargas, A., F. Arias, E. Serrano y O.M. Arias. 2007. Toxicidad de boro en plantaciones de banano (Musa AAA) en Costa Rica. Agronomía Costarricense. 31:21-29. Vázquez-Alarcón, A., Cajuste, I.J., Carrillo-González, R., ZamudioGonzález, B., Alvarez-Sánchez E. y J.Z. Castellanos-Ramos. 161 2005. Límites permisibles de acumulación de cadmio, níquel y plomo en suelos del Valle del Mezquital, Hidalgo. Terra Latinoamericana, 23(4):447-455. Vázquez-Alarcón, A.L. J. Cajuste, C Siebe-Grabach, G. AlcántarGonzález y M. I. de la Isla de Bauer. 2001. Cadmio, níquel y plomo en agua residual, suelo y cultivos en el Valle del Mezquital, Hidalgo, México. Agrociencia, 35:267-274. Virto, I., P. Bescansa, M. J. Imaz y A. Enrique. 2007. Riego con aguas residuales de la industria agroalimentaria y calidad del suelo en el valle del Ebro en Navarra, España. Terra latinoamericana 25 (3):239-250. Wetzel, R.G. 2001. Limnology: Lake and River Ecosystems, 3rd Edition. Academic Press, San Diego, CA. 1006 p. Wurts, W.A. and Durborow, R.M. 1992. Interactions of pH, carbon dioxide, alkalinity and hardness in fish ponds. Southern Regional Aquaculture Center. 464:1-4. Yan, L., Yinguang, C. and Qi, Z. 2007. Effect of initial pH control on enhanced biological phosphorus removal from wastewater containing acetic and propionic acids. Chemosphere. 66:123129. Yau, S.K. and J. Ryan. 2008. Boron Toxicity Tolerance in Crops: A Viable Alternative to Soil Amelioration. Crop Science. 48:854865. Zawaideh, L.L. and Zhang, T.C.1998. The effects of pH and addition of an organic buffer (HEPES) on nitrate transformation in Feo water systems. Water Sci. Technol. 38:107-115. 162 163 COORDINADORES DE LA INFORMACION Dr. Gerardo Salazar Gutiérrez M.C. Ramón Hernández Virgen REVISIÓN TÉCNICA Dr. Rubén Alfonso Saucedo Terán M.C. Rosa Martínez Pamatz Dr. Luis Mario Tapia Vargas Dr. Javier García Velasco EDICIÓN DISEÑO Y FORMACIÓN Dra. Celia De La Mora FOTOGRAFIAS Dr. Hugo Ernesto Flores López Dra. Celia De La Mora Orozco Código INIFAP MX-0-310205-13052506-6 Centros Nacionales de investigación Disciplinaria, Centros de Investigación Regional y Campos Experimentales Sede de Centro de Investigación Regional Centro Nacional de Investigación Disciplinaria Campo Experimental Esta Publicación se terminó de imprimir en el mes de Noviembre de 2013 en los talleres Gráficos de Prometeo Editores S.A. de C.V. Libertad 1457, Col Americana, Guadalajara, Jalisco C.P. 44160. Tel (33) 3826-2726 E-mail: [email protected] Su tiraje consta de 1000 ejemplares Impreso en México Instituto de Investigación Forestal Agrícolas y Pecuarias MC. Ramón Hernández Virgen Jefe de Campo Lic. Sandra Lucia Vega Iñiguez Jefe Administrativo Personal Investigador del Campo Experimental Centro Altos de Jalisco MC. Luis Eduardo Arias Chávez Dr. Rodolfo Barreto Hernández Dr. Juan de Dios Benavides Solorio MC. Alvaro Agustin Chávez Durán Dra. Celia de la Mora Orozco MC. Gerardo Domínguez Araujo MC. Eliab Estrada Cortes Dr. José Germán Flores Garnica Dr. Hugo Ernesto Flores López MC. Alberto Jorge Galindo Barboza MC. Laura Patricia Gómez Murillo MC. Javier Ireta Moreno MC. Alejandro Ledesma Miramontes MC. David Liceaga Rivera Dr. Miguel Luna Luna MVZ. Raúl Martínez López MC. David Arturo Moreno González MC. Luis Alberto Nájera Calvo Dr. Juan Francisco Pérez Domínguez Dr. José Luis Ramírez Díaz Biol. Gabriela Ramírez Ojeda Dr. José Ariel Ruiz Corral MC. Santiago Ruiz Ramírez Ing. Ernesto Alonso Rubio Camacho Dr. Agustín Rueda Sánchez Ing. José Martín Ruvalcaba Gómez Ing. Mario Antonio Vega Loera Ing. Jorge Humberto Villarreal Rodas MVZ. Fernando Villaseñor González Biol. Jaqueline Xelhuantzi Carmona Leche Carne de Rumiantes Manejo Forestal Sustentable y Servicios Ambientales Incendios Forestales Manejo Integral de Cuencas Carne de Cerdo Leche Incendios Forestales Manejo Integral de Cuencas Carne de Cerdo Incendios Forestales Trigo y Avena Maíz Carne de Rumiantes Pastizales y Cultivos Forrajeros Leche Manejo Forestal Sustentable y Servicios Ambientales Maíz Hortalizas Maíz Agrometeorología y Modelaje Maíz Maíz Manejo Forestal Sustentable y Servicios Ambientales Plantaciones y sistemas agroforestales Leche Pastizales y Cultivos Forrajeros Leche Leche Incendios Forestales WWW.INIFAP.GOB.MX