Reactividad general de quinolinas e isoquinolinas
Anuncio

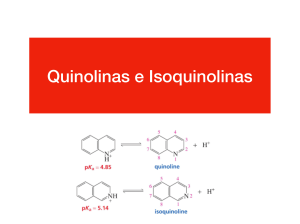
Reactividad general de quinolinas e isoquinolinas. • Reacciones en el átomo de nitrógeno: Ph−NH2 Quinolina Piridina Isoquinolina PKa= 4.6 4.93 5.23 5.40 Como se ve tienen basicidades similares a la de piridina; por lo tanto, sufren reacciones análogas: • Complejación con ácidos de Lewis . • Protonación a sales de (iso)quinolinio: QH+, iQH+. • N−alquilación y N−acilación dando sales de (iso)quinolinio cuaternarias. • Reacciones de SE: • Anillo de piridina desactivado, pero carbociclo no ! suceden en el carbociclo. • Además en el intermedio se conserva la aromaticidad del anillo Py ! mejor que en Py. • Posiciones favorecidas cinéticamente: C5 y C8 (postulado de Hammond!!. Representando intermedios). • Las SE del naftaleno también están favorecidas cinéticamente en C5 y C8 por razones análogas. • Condiciones y resultados: Gilchrist; tabla: 5.4; pág.:162. Algunas condiciones son similares a la serie bencénica, p.ej.: HNO3/H2SO4/0oC. • Un caso especial: SE con AN previa: Q + (1)HCl + (2)Br2/PhNO2/ ! 3−Br−Q. Mecanismo: • Reacciones de AN: Suceden en C2 de Q o en C1 de iQ con mayor facilidad que en Py, porque la mayor parte de la aromaticidad se retiene en el carbociclo. En general tiene lugar sobre sales de (iso)quinolinio: La reducción con DIBAH de quinolinas conduce a 1,2−dihidroquinolinas inestables: Por analogía puede incluirse en esta subsección las hidrogenaciones catalíticas: Suceden con igual facilidad que las hidrogenaciones de Py a piperidina y, lógicamente, en el anillo de mayor deficiencia electrónica (anillo Py). Se observará que se realizan sobre los cationes QH+ o iQH+, en analogía con el caso de la Py (sobre PyH+). La razón −en todos los casos− es que el par libre del N se complejaría con el catalizador, disminuyendo su actividad.(Recordar: el veneno del catalizador de Lindlar para la syn−hidrogenación de alquinos a alquenos, es precisamente Q). • Reacciones de SN Las reacciones de SN (salvo las que puedan transcurrir a través de hetarinos) suceden según una secuencia de AN−E; en consecuencia tienen lugar con mayor facilidad que en la Py (por una razón análoga a la comentada para las AN). • Posiciones favorecidas cinéticamente: C2 y C4 de Q; C1 (y en menor medida C3) de iQ. En todas ellas hay un resto de carga positivo como consecuencia del efecto −R del átomo de N. Analizando los correspondientes intermedios (ver más abajo), se ve que en los tres primeros casos, la carga negativa 1 se deslocaliza y llega al átomo de N, respetando la aromaticidad del carbociclo; sin embargo, en la posición C3 de iQ la carga negativa solo llega al átomo de N si se rompe la aromaticidad del carbociclo. Se representan los intermedios para la SN clásica , con salida de X−. • SN clásica Según lo dicho más arriba, no hay problema para efectuarlas en C2 y C4 de Q y en C1 de iQ con nucleófilos del tipo RO− (generalmente a reflujo de ROH), ArS−, aminas y carbaniones. La posición C3 de iQ requiere condiciones algo más duras, lo que se puede aprovechar para llevar a cabo desplazamientos regioselectivos (Gilchrist; fig.:5.43; pág.:163). • SN directa: • Con NH2− : van a temperatura muy baja en Q e iQ (con esta solo en C1). Las condiciones son tan distintas de las necesarias con la Py que algunos textos no dan a la reacción el nombre de Chichibabin. Para quinolina: • Con R−M (R = alquil, aril; M = Li, MgX). En C2 de Q y en C1 de iQ (lo que indica que hay una complejación previa M/par libre del N, como en el caso de la Py). Para la iQ: • Con OH−. No iban sobre Py, pero sí ahora (reflejo de la mayor facilidad de SN sobre Q e iQ) Gilchrist; fig.:5.44; pág.: 164. • Degradación oxidante Recordar: oxidación = pérdida de electrones ! suceden preferentemente en el carbociclo, cuya densidad electrónica es mayor que la del anillo Py. Condiciones: • Oxidación electrolítica (anódica). P.ej.: • KmnO4 / OH− / (Gilchrist; pág.:165) Derivados de quinolina e isoquinolina • N−óxidos • Preparación: Q e iQ + AcOH/H2O2 • Reactividad: • Derivados alquilados H bencílicos en C2 y C4 de Q y en C1 de iQ: relativamente ácidos ! procesos de alquilación, acilación y condensación aldólica. • Derivados hidroxilados 2−HO−Q y 4HO−Q ! 2− y 4−quinolonas. 1−HO−iQ ! 1−isoquinolona; 3−HO−iQ ! 3−isoquinolina. (Equilibrio no tan desplazado). Restantes: son formas hidroxi (comportamiento fenólico típico). La 8−HO−Q (nombre común: oxina [nombre que no puede usarse por ello para el pirano]), forma quelatos con cationes Mg2+, Cu2+, Zn2+ y Al3+; el quelato con Cu2+ se usa como fungicida. • Aminoderivados 2 Siempre amino (nunca imino). Se protonan en el N anular. 2− y 4−H2N−Q y también 1− y 3−H2N−iQ + NaNO2/H2SO4 aq. dil. ! [(i)Q−N+"N muy inestables] ! (iso)quinolonas Restantes: ! (i)Q−N+"N de estabilidad similar a Ar−N+"N ! reacciones usuales (Sandmeyer, etc.) • Ácidos carboxílicos 2−HOOC−Q ó 1−HOOC−iQ + calor ! Q ó iQ + CO2 (a través de iluros similares a los de Py−COOH). Quinolizinas y sales de Quinolizinio • Acridinas En el caso de acridina el C9 está especialmente activado por el átomo de nitrógeno del anillo. Las reacciones de adicción en las posiciones 9 y 10 tienen lugar con gran facilidad. • Fenantridinas Acidez relativa de los H en cadena lateral de C6: 1 1 3