A-036 - Universidad Nacional del Nordeste
Anuncio

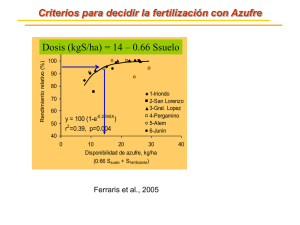
Resumen: A-036 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2006 Fertilización azufrada en soja, su relación con el nivel de nodulación y el grado de micorrización. Punos, Leonardo M. - Iglesias, Maria C. - Sotelo, Cristina Cátedra de Microbiología Agrícola - Facultad de Ciencias Agrarias - UNNE. Sargento Cabral 2131 - CP: 3400. Corrientes. Argentina. Tel./fax:+54( 03783) 427589 Correo electrónico: [email protected]; [email protected] Introducción y antecedentes La soja (Glycine max L.) es el cultivo de leguminosa de grano más importante en el mundo y Argentina, junto con Brasil, China y Estados Unidos son países de gran producción. El protagonismo actual de esta leguminosa tanto en nuestro país como en el mundo entero se debe, principalmente, a su calidad de alimento, e industrialmente, por la cantidad de productos derivados que de ella se extrae (Iglesias 2004). La simbiosis con capacidad de fijación biológica de Nitrógeno con mayor importancia agronómica se establece entre las plantas de la familia de la leguminosa (Glycine max L.) con bacterias de la familia Rhizobiaceas o rizobios (Bradyrhizobium japonicum) (Handi 1966). El cultivo de soja presenta la característica de generar estructuras nodulares en raíz, consecuencia de la asociación simbiótica con Bradyrhizobium japonicum. Dicha asociación le permite al cultivo abastecerse de nitrógeno proveniente del aire, cubriendo un 70 % de las necesidades de este cultivo (Weber 1966) Los órganos vegetativos que se producen en las raíces de las plantas al ingresar las bacterias, son llamados nódulos, estos son pequeñas tumoraciones donde las bacterias se transforman en bacteroides y fijan Nitrógeno (Fernández Canigia 2003). El azufre cumple funciones importantes en el metabolismo de los nódulos y forma parte importante de ciertas proteínas (Federroxina) que interviene en la reducción del nitrógeno. En condiciones de deficiencia el azufre se concentra en los nódulos. No se ha descrito el efecto directo del azufre sobre la nodulación. Sin embargo se observa incremento en la nodulación como respuesta a la fertilización azufrada en suelos deficientes en este elemento (Fernández Canigia 2003). El azufre es un elemento fundamental para lograr una buena nodulación de las leguminosas. De esta forma, en los suelos donde se encuentra una respuesta en soja a la fertilización azufrada, se produce un aumento en el tamaño y número de nódulos. Martínez y Cordone (2004), realizaron un ensayo de fertilización azufrada en soja en el que, además del rendimiento, monitorearon los niveles de nutrientes en las hojas. El azufre se encuentra en una alta proporción bajo formas orgánicas, manteniendo proporciones constantes con el nitrógeno del suelo. La relación nitrógeno azufre más frecuente es de 6-8:1. En las plantas los síntomas de deficiencia se presenta como amarillamiento de hojas jóvenes y menor desarrollo (INTA 1998). Los hongos formadores de micorrizas arbusculares pertenecen a la clase Zigomicetes y se caracterizan porque producen, a lo largo de su ciclo de vida, unas estructuras conocidas como arbúsculos (en todos los casos) y vesículas (en la mayoría de ellos). Las vesículas son unas estructuras globosas e irregulares que actúan como órgano de reserva de lípidos. El carbono del huésped (hexosas) está estimulado por una rápida conversión en lípidos, que están presentes tanto en hifas y vesículas, como en las esporas y constituyen el 95 al 100 % del pool de carbono en las esporas. Los arbúsculos son las estructuras responsables de la transferencia bidireccional de nutrientes entre los simbiontes, realizada en la interfase planta- hongo. (Becard 1991; Borie 1988). El mutualismo supone una relación beneficiosa para los dos organismos implicados, y tanto el hongo como la planta se ven favorecidos por la asociación: El hongo coloniza la raíz de la planta y le proporciona nutrientes minerales y agua, que extrae del suelo por medio de su red externa de hifas, mientras que la planta suministra al hongo sustratos energéticos y carbohidratos que elabora a través de la fotosíntesis. (Frioni 1990; Miller 1992). La utilización de micorrizas arbusculares (MA) no implica que se puede dejar de fertilizar, sino que la fertilización se hace más eficiente y se puede ahorrar cantidades importantes de fertilizantes minerales, al tiempo que se logra una mayor absorción de los nutrientes disponibles en el suelo por parte de las plantas. El objetivo del trabajo fue evaluar la dosis de sulfato de calcio en la que se halle la mayor infectividad de Bradyrhizobium japonicum, y cual de ellas es la que afecta en mayor medida el grado de micorrización. Materiales y métodos El lote destinado para el ensayo se encuentra ubicado en la colonia “Tres Palmas” al norte de la ciudad de Machagai, y a 400 metros de la ruta provincial Nº 10. El lote tiene una superficie de dos Has, el mismo presenta un historial agrícola de unos 50 años aproximadamente. La variedad que se utilizó es la Pioneer 9492 por que es la variedad preferida por el productor por sus características. Se inocularon las semillas con bacterias Bradyrhizobium japonicum, de la cepa E 109, en soporte líquido conteniendo 3*109 U.F.C. por mL de producto. El ensayo se realizó en parcelas de 10 metros de ancho y de 300 metros de largo, alternando los tratamientos: Resumen: A-036 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2006 1) Testigo. 2) 15 Kg S/ha. 3) 30 Kg S/ ha. La fertilización se realizó a los diez días de la emergencia al costado de la línea de siembra. Se tomó una muestra de suelo en la fecha de siembra, a la cual se le realizó el análisis de fertilidad. Se tomaron las dosis nombradas anteriormente por que teniendo en cuenta el trabajo final de graduación del Ing. Agr. Danilo Kochaniuk, (2004) realizado con un cultivo de soja en macetas las dosis que mejor se comportaron fueron la de 15 y la de 30 Kg S ha -1 respectivamente. El muestreo se hizo al azar sistemático en cada franja, con 10 repeticiones como mínimo en cada una. Los parámetros que se midieron son: En el primer muestreo: Altura de plantas, Número de nódulos en las raíces principales y número de nódulos en las raíces secundarias. En el segundo muestreo: Altura de plantas, número de nódulos en la raíz principal y número de nódulos en las raíces secundarias. En el tercer muestreo: Número de chauchas, número de granos. Para calcular el porcentaje de micorrización, lo que se hizo fue: extraer las plantas con raíces, se tomaron diez trozos al azar y se los trataron con azul de tripan, Método de Philips y Hayman, 1970 ( Honrubia et al, 1995 ), seguidamente se realizó la observación en microscopio con aumento de 400x, calculándose luego los porcentajes de micorrización. Análisis de datos: con los resultados se determinaron los distintos parámetros de posición. Se realizó el análisis de las diferencias entre medias con prueba de T de Student, siendo las comparaciones en relación con la parcela testigo. Resultados y discusión 1º muestreo Con respecto al la altura podemos ver que no hay diferencias estadísticamente significativas entre los tratamientos fertilizados con las distintas dosis, si las hay entre estos y el testigo, siendo superiores los tratamientos fertilizados. Si hablamos del número de nódulos de las raíces primarias, hay diferencias significativas entre los tres tratamientos, entre los tratamientos 2 y el 1, siendo superior el 2 (fertilizado con 15 kg S/ha),entre el 2 y el 3 no hay diferencias significativas, tampoco entre el 1 y el 3. En el caso de los nódulos de las raíces secundarias no se ven diferencias estadísticamente significativas entre los tratamientos, a pesar de eso, el mayor valor lo presento el 3 seguido por el 1 y por último el 2. M ico r r iz as %de i nf e c c i ón 100 80 60 40 20 0 1 2 3 T r a t a mi e nt os Gráfico 1: Porcentajes de micorrización. 2º muestreo 5 4 3 2 1 a a Nódulos de raices secundarias a 0 Número de nódulos Número de nódulos N ódul os e n r a í c e s p r i m a r i a s 8 6 4 2 0 b 1 1 2 a 2 ab 3 3 T r a t a mi e nt os Gráfico 2: Nª de nódulos en las raíces primarias. Tratam ientos Gráfico 3: Nª de nódulos de las raíces secundarias Con respecto a las micorrizas, se observó que en los tratamientos fertilizados hay un 100 % de infección y el testigo solamente presenta una infección del 70 %. No se ven diferencias estadísticamente significativas entre los tratamientos, de todas formas se ve que hay una mejor respuesta en los tratamientos fertilizados, destacándose entre ellos el 2, el testigo es el que menor valor presentó. No se observaron diferencias significativas entre el tratamiento 2 y 3, y el testigo y el 3, si las hay entre el 2 y el testigo. Con respecto a la altura el tratamiento 2 es el que mejor valor presentó pero no se presentaron diferencias estadísticamente significativas. Resumen: A-036 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2006 3º Muestreo Vainas 40 20 0 a 1 a 2 a 3 Número de granos Núm ero de granos 80 60 40 20 0 a 1 a 2 a 3 Tr a t a mi e nt os Tr a t a m i e n t os Gráfico 4: Número de vainas Gráfico 5: Número de granos Analizando el número de vainas vemos que no hay diferencias significativas entre los tratamientos, pero los fertilizados presentan mayores valores, en especial el tratamiento con la dosis más alta. En cuanto al número de granos también se puede apreciar la misma tendencia que la variable analizada anteriormente, los tratamientos fertilizados son los que mejores valores presentaron, sobre todo el 3. Conclusiones En las etapas vegetativas se presentaron diferencias estadísticamente significativas a favor de los tratamientos fertilizados en altura, nódulos de raíces primarias, no así en nódulos de raíces secundarias, en cuanto a la micorrización se marcó una tendencia favorable para los tratamientos fertilizados. En estadíos más avanzados, el tratamiento 2 con 15 Kg S ha-1 fue el que mayores valores presentó en todas las variables analizadas, pero diferencias estadísticamente significativas solo alcanzó en nódulos de raíces secundarias. A cosecha no se encontraron diferencias de consideración estadística. Referencias • Becar, G. Doner LW, Rli DB, Dousd DD, Pfeffer PE ( 1991 ) Identifictión and quantificatión of trehalosein vesicular-arbuscular micorrhizal fungi by in vivo NMR and HPLC analyses phitol. 547-552 p. • Borie, F.B.; Rubio, R.H.; Schalchi, C.O. 1998. Micorrizas arbusculares y la actividad fosfatasica de diez cultivares de trigo. Agricultura Técnica vol. 58 Nº 1. Chile.58.47p. • Cicore P et al. 2004. Materia seca nodular y nitrógeno acumulado en un cultivo de soja bajo diferentes condiciones de manejo. XIX Congreso de las Ciencias del Suelo – Paraná. p 322. • Cordone G. et. Martinez F. 2004. http://www.elsitioagricola.com/articulos /cordone. extraído de la Web el 16/02/04. • Ferraris G. et al. 2004. a. Soja: respuesta a la fertilización en el área sojera argentina. Resultados campaña 2000-01 y 2001-02 de la red de ensayos de fertilizar-INTA. http://www.fertilizar.org.ar/articulos/ SOJA: respuesta al fertilización en el área sojera argentina.htm extraído de la Web el 25/07/04. • Ferraris G. et al. 2004. b. Disponibilidad y respuesta de la soja de primera a la fertilización. INPOFOS. Información Agronómica Nº 23. p 21 – 22. • Ferraris G. et al. 2004. c. Disponibilidad y respuesta de la soja de primera a la fertilización. XIX Congreso de las Ciencias del Suelo – Paraná. p 144. • Fernández Canigia M. 2003. Factores determinantes de la nodulación. DEPARTAMENTO DE INVESTIGACIÓN Y DESARROLLO NITRAGIN ARGENTINA S.A. • Fernández Canigia M. et Díaz Zorita M. 2004. Nodulación y producción de soja en la región pampeana. XIX Congreso de las Ciencias del Suelo – Paraná. p 301. • Fontanetto H. 2004. Inoculación en la región centro-este de Santa Fé (INTA Rafaela) .Resultados de Investigación en Argentina Campaña 2003-04. NITRAGIN. p 19. • Frioni L.1990. Ecología microbiana del suelo. Departamento de publicaciones y ediciones de la universidad de la república. Montevideo. Uruguay. 519p. • Frioni L. 1999. Procesos Microbianos. Tomo I y II. Fundación de UNRC. Río Cuarto. Córdoba. • García F. 2004. SOJA: Nutrición del cultivo y fertilización. http://www.fertilizar.org.ar/articulos/ SOJA: Nutrición del cultivo y fertilización.htm extraído de la Web el 25/07/04. • Handi Y. A. 1985. La fijación del nitrógeno en la explotación de los suelos. Bol. De suelos FAO Nº 49. • Honrubia, M; Torres, P.; Díaz, G. y Morte, A. 1995. Biotecnología forestal: Técnicas de micorrización y macropropagación de plantas. Universidad de Murcia.85p. • Iglesias M. 2004. Inoculación en la región N.E.A. . Resultados de Investigación en Argentina Campaña 200304. NITRAGIN. p 21. • INTA 1998. Fertilización de soja. http://www.ppi-far.org/informefertilizarsoja 1ª2001.doc-resultados. extraído de la Web el 16/02/04. Resumen: A-036 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2006 • Ledesma L. L. et al. 1972 Republica Argentina suelos del chaco /2. Departamento Maipú. • Madigan M.T., Martinico J.M. Parker J. 1997. Brock Biología de los microorganismos. 8ª edición. • Martínez F. 2004. Fertilización azufrada en trigo y soja de segunda. http://www.aaprotrigo.org/tecnologia/fertilización/fertazutrig.htm. extraído de la Web el 16/02/04. • Martinez et Gordone 2004. Azufre y Magnesio. http://www.fertilizar.org.ar/ articulos/Cordone/ AzufreyMagnesio.htm extraído de la web el día 28/05/04. • Melgar R. y Gearhart M. 2004. Manejo del azufre y fertilizantes azufrados en Siembra Directa http://www.fertilizar.org.ar/ articulos/ ManejodeazufreyfertilizantesazufradosenSD.htm extraído de la Web el 16/02/04. • Miller, S.L. and Allen, E.B.1992 mycorrhizal functioning. M.F. Allen Ed. Chapman & may. 301,332-534p. • Primavesi A. 1984. Manejo ecológico del suelo. 5ª edición. P 285-286. • Piccolo et al. 2004. Transformaciones del nitrógeno y azufre en un ultisol con cultivo de yerba mate. XIX Congreso de las Ciencias del Suelo – Paraná. p 140. • Tejeda , Tamara; F. Soto et G Guerrero. 1998. Utilización de algunas variantes de infección micorrizica como alternativas nutricionales en la obtención de posturas de cafeto mediante vías orgánicas. Cultivos Tropicales (La Habana ) 19 ( 1 ): 28-32p. • Trucco V. 2003. Soja en siembra directa . AAPRESID. • Ventimiglia L. et al. 2004. Azufre: Un caballo sin domar. http://www.fertilizar.org/articulos/Azufre Un Caballo sin Domar.htm extraído de la Web el 09/08/04. • Weber, C.R. 1966. Nodulation and nonodulation de soybean isolines. Agron. P 43-49.