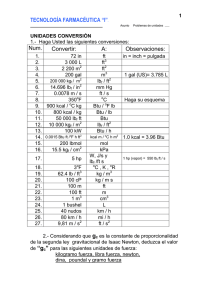
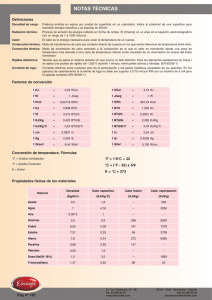
dQ=dE Q=E2E1 Wsf =(ΔE f +ΔK+ΔP) Q=ΔU=u2u1=(h2 ( p2 v2) J
Anuncio

PROCESO ISOMÉTRICO Consideremos un proceso isométrico (o isocórico, o a volumen constante) que es interiormente reversible (cuasiestático, si es sin flujo), en el que interviene una sustancia pura. En el caso de un sistema cerrado sin flujo v = c, dQ=dudW n y dw n= p dv=0 ; por consiguiente, Q = Δu. La ecuación de calor específicotambién da Q= c v dT. Si se consideran variedades de energía almacenada distintas de la molecular, entonces: ∫ dQ=dE Q= E 2−E 1 o bien (a) donde E = U + P + K. En un proceso isométrico de flujo constante y estado estable (por ejemplo, con un fluido incompresible), ecuación Q=U E f K PW sf se reduce a (sf indica steady flow = flujo constante). W sf =− E f K P (b) porque con Q = ΔU estos términos se cancelan. Es importante observar aquí que el calor Q es independiente de si existe flujo o no, en el caso de un proceso dado. Una vez que se ha establecido el proceso y fijado los puntos extremos del mismo, Q es constante para un fluido dado, independientemente de si hay flujo o no. En el caso de un gas ideal entre dos estados cualesquiera se observa que Q = ΔU sólo para el proceso isométrico cuasiestático. U =∫ c v dT ; pero La ecuación del proceso en el plano pV (o bien, pv) es V = c (o bien, v = c). Integrando ds = dQ / T = cv dT/T, con cv constante, se obtiene: s=c v lnT C (c) donde C es una constante de integración y (c) la ecuación de una curva isométrica en el plano Ts cuando el calor específico permanece igual. Si se tiene un vapor sobrecalentado (punto de estado 1) que se enfría a volumen constante hasta que parte de él se condensa, los croquis en los planos pV y TS deben mostrar las líneas del líquido y vapor saturados. En la resolución de problemas con frecuencia es necesario emplear la relación definitoria del proceso, en este caso: v 1=v 2=v g− y 2 v fg 2=v f x 2 v fg 2 (d) Mediante esta ecuación se puede hallar la calidad x2, obteniendo v1 de una tabla de vapor. Conociendo esta calidad y una propiedad adicional, se determinan otras propiedades del vapor en 2. Puesto que el valor de ∫ p dV es cero, el calor será: Q=U =u 2−u 1= h2− p2 v 2 p v ¿−h1− 1 1 J J (e) EJEMPLO – PROCESO ISOMÉTRICO (REVERSIBLE) Una masa de 1 lb (0.45 kg) de fluido a 15 psia (1.05 kgf/cm² abs.), 300 ºF (149 ºC) se calienta reversiblemente [v = C hasta que su temperatura es 600 ºF (316 ºC)]. Determinar p2, Q, W, Δh y Δs si a) El proceso es sin flujo y el fluido es (1) aire, considerado como gas ideal, o bien, (2) agua; asimismo, resuelva el problema si el proceso es: b) De estado estable y flujo constante con ΔP = 0, ΔK = 0 y el fluido es (1) aire, gas ideal o bien, (2) agua. SOLUCIÓN a) (1) El aire como gas ideal (sin flujo): de pv = RT con v = c p 2= p1 T 2 /T 1 =151060/ 760=20.92 psia=1.47 kgf /cm2 abs. De B 1: Q=U =c v T 2−T 1 =0.17141060−760=51.42 Btu/lb=28.56 kcal /kg De las Tablas de Gas: Q=U =183.29−129.99=53.30 Btu /lb=40 kcal /kg De B 1: h=c p T 2−T 1 =0.241060−760=72 Btu /lb=40 kcal / kg De las Tablas de Gas: h= h2−h1 =255.96−182.08=73.88 Btu /lb=41.04 kcal /kg De B 1: s=∫ dQ /T =c v ∫ dT /T =c v ln T 2 /T 1=0.1714 ln 1060 /760=0.0570 Btu /lb · ºR=0.0570 kcal / kg · K De las Tablas de Gas: s= −R ln p2 / p1=0.76496−0.68312−53.34/778ln 20.92/15=0.059 Btu /lb ·ºR=0.059 kcal /kg · K Solución para (a) (2). Agua (sin flujo): Utilizando B 15, en el estado 1, se tiene: v 1=29.899 ft / pd Para el estado 2, h 1=1192.5 Btu / pd s1 =1.8134 Btu / pd · ºR v 2 =v 1=29.899, t 2=600 ºF. Interpolando en B 15 se obtiene: p 2=21.24 h 2=1334.8 h=h 2−h 1=1.334.8−1192.5=142.3 Btu/ pd s 2=1.9335 s=1.9335−1.8134=0.1201 Btu / pd · ºR u = h− pv=142.3−29.899144/ 77821.24−15=107.8 Btu / pd W n=0 Q= u=107.8 Btu / pd O sea, p2 = 1.49 kgf/cm² abs., Δh = 79.05 kcal/kg, Δs = 0.1201 kcal/kg · K, Q = 59.9 kcal/kg, Wn = 0. Solución para (b) (1). Estado estable y flujo constante (ΔP = 0, ΔK = 0), aire: De (a) (1), p2 = 20.92 psia, Q sf =Q n =51.42 Btu / pd (por las tablas, 53.30). s=0.0570 Btu / pd · ºR (por tablas, 0.0590) Δh = 72 Btu/pd (port ablas, 73.88) W sf =−∫ vdp=−V p2− p1 =−R T 2−T 1 =−53.34/7781060−760=−20.56 Btu / pd también W sf =− E f P K =− E f =− pv W sf =− h− u =−72−51.42=−20.58 Btu / pd Es decir, p2 = 1.47 kgf/cm² abs., Δh = 40 kcal/kg, Δs = 0.0570 kcal/kg · K, W sf =−11.42 kcal /kg. Q sf =28.56 kcal / kg y Solución para (b) (2). Estado estable, y flujo constante (Δp = 0, ΔK = 0), agua : De (a) (2), p 2=21.24 psia ,Q sf =Q n=107.8 Btu / pd s=0.1201 Btu / pd · ºR h=142.3 Btu / pd W sf =− E f P K =− E f =− pv W sf =− h− u =−142.3107.8=−34.5 Btu / pd O sea: p2 = 1.49 kgf/cm² abs. Δh = 79.05 kcal/kg, Δs = 0.1201 kcal / kg · K Q sf =59.88 kcal /kg W sf =−19.16 kcal / kg BIBLIOGRAFÍA MORING, Faires Virgil Termodinámica Limusa Noriega Editores p.p. 167 - 170 u=107.8 Btu/ pd