Principales patologías, específicas de la especialidad: Distrés
Anuncio

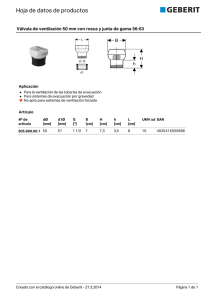
El enfermo crítico 2. Respiratorio Principales patologías, específicas de la especialidad: Distrés respiratorio del adulto. Reagudización de EPOC. DISTRÉS RESPIRATORIO DEL ADULTO (SDRA). DEFINICIÓN EL SDRA es el paradigma de enfermedad crítica. Su desarrollo ha sido paralelo al de las UCIs y la Medicina Intensiva como especialidad. Fue descrita por primera vez por Ashbaugh en 1967 como la asociación de disnea de comienzo súbito, hipoxemia refractaria al oxígeno y alteraciones de la mecánica respiratoria. Su nombre deriva de la similitud con lo que ocurre con los niños recién nacidos prematuros Esta definición coincidió con la creación de las primeras UCIs y con la consecuente posibilidad de tratar la insuficiencia respiratoria asociada. Pero a falta de una definición unánime en el campo de la investigación predominó un gran desorden de resultados y metodología en los años siguientes hasta que se estableció Oficialmente la definición de SDRA en 1994 en el American-European Consensus Conference como el desarrollo agudo: a) alveolares bilaterales en la radiografía simple de tórax, b) hipoxemia caracterizada por una relación PaO2/FiO2 <200 c) ausencia de hipertensión en la aurícula izquierda (insuficiencia cardiaca). Paralelamente se definió un nuevo término, que es el Daño Pulmonar Agudo, que tiene las mismas características, pero con una menor insuficiencia respiratoria PaO 2/FiO2 <300. A esta definición se le adjudica una sensibilidad del 75% y una especificidad del 84%, mayor cuando el origen del cuadro es extrapulmonar (84% vs 61% -sensibilidad- y 78% vs 69% -especificidad).Esta significó obviamente un gran paso adelante pero encierra problemas: no se define exactamente qué es “desarrollo agudo”; emplea la relación PaO2/FiO2 independiente del soporte ventilatorio aplicado (PEEP); ofrece poca precisión en los criterios radiográficos; y encierra cierta dificultad para distinguir este síndrome del edema hidrostático En el año 2011 como iniciativa de la European Society of Intensive Care Medicine, la American Thoracic Society y la Society of Critical Care Medicine crearon la definición de Berlín. Ésta se formuló en base a un desarrollo (o empeoramiento de la situación respiratoria) en menos de una semana de una agresión; afectación radiológica bilateral; tras descartar la posibilidad de insuficiencia cardiaca y sobrehidratación por medios objetivos (medición de presiones o bien ECO). Se establecieron tres categorías basándose en el grado de hipoxemia: leve ( PaO2/FIO2 ≤ 300 mm Hg), moderada (PaO2/FIO2 ≤ 200 mm Hg), y severa (PaO2/FIO2 ≤ 100 mm Hg) (en todos los casos con PEEP o CPAP > 5 cmH2O). Estos niveles de gravedad se asociaron a diferente mortalidad (27%; 32%; 95% y 45%) y con la duración de la ventilación mecánica (5, 7 y9 días respectivamente). 05. Principales patologías específicas de las especialidad 1 - 20 El enfermo crítico 2. Respiratorio En conjunto las principales novedades que aporta la Definición de Berlin son: a) se elimina el concepto de lesión pulmonar aguda y se sustituye por SDRA leve; y b) introduce en la definición el parámetro PEEP. Aunque es quizás pronto para decirlo, esta definición es más capaz de predecir la mortalidad que la anterior y por otro lado ya recibe severas críticas basadas en que la relación entre la PaO2/FIO2 y la FIO2 que se aplica no es lineal. .(JAMA. 2012;307(23):2526-2533 y J Thorac Dis 2013;5(3):326-334.) Actualmente se están haciendo esfuerzos para validar esta definición incluyendo algún parámetro bioquímico de daño pulmonar que incremente la validez de ésta. Por otro lado hay que subrayar el valor de las imágenes TC que permiten definir con mayor exactitud la extensión y localización de los infiltrados pulmonares que suelen observarse en las zonas posterobasales, evaluar la extensión y el porcentaje de la zona dañada, y la existencia de neumotórax y otras complicaciones no visibles en la RX simple de tórax. Teóricamente se distinguen dos tipos de SDRA, en base a su etiología: los de origen pulmonar y extrapulmonar. Mientras que el primer tipo está relacionado con fenómenos inflamatorios locales, el segundo lo está con el Síndrome de Respuesta Inflamatoria Sistémica. En estos dos grupos, se ha querido apreciar diferencias en su imagen radiológica (patrón difuso en las de origen extrapulmonar y menos uniforme en las pulmonares), en la validez del diagnóstico sindrómico en relación con la histología, en la respuesta en la ventilación en prono y en su pronóstico… Daño Pulmonar Directo o Causas comunes: Neumonías. Aspiración de contenido gástrico. o Causas menos comunes: Contusión pulmonar. Embolismo graso. Lesión por inhalación. Ahogamiento. Edema pulmonar de reperfusión tras transplante pulmonar o embolectomia pulmonar. Daño Pulmonar Indirecto Causas comunes: Sepsis.Trauma severo no pulmonar con Shock.Politransfusión. o Causas menos comunes: Sobredosis de drogas. Pancreatitis aguda. By pass cardiopulmonar. o de: www.monografias.com/sdra 05. Principales patologías específicas de las especialidad 2 - 20 El enfermo crítico 2. Respiratorio DIAGNÓSTICO DIFERENCIAL El diagnóstico de SDRA debe establecerse después de excluir otros posibles diagnósticos, especialmente la insuficiencia cardiaca/hiperhidratación por su frecuencia y porque el tratamiento es muy diferente. Además de una valoración cuidadosa de la clínica, de los antecedentes y de las manifestaciones radiológicas puede ser útil la determinación de péptido netriurético (un nivel de BNP plasmático por debajo de 100 pg / ml hablan a favor de SDRA, pero los niveles más altos ni confirman ni excluyen este síndrome) y/o la realización de ECOcardiograma ( la detección de la disfunción valvular aórtica severa, de disfunción severa de la válvula mitral, o de una reducida fracción de eyección del ventrículo izquierdo hablan más a favor de edema pulmonar cardiogénico aunque no de un modo concluyente). EDEMA CARDIOGÉNICO EDEMA NO CARDIOGÉNICO HC, EX, F, LAB Antecedentes cardiológicos, edema, ingurgitación yugular, bajo gasto elevación de enzimas cardiacas, BNP elevada Antecedentes de infección, aspiración, estado hiperdinámico, leucocitosis, BNP con determinaciones normales RX DE TORAX Cardiomegalia, hilio vascular pulmonar ensanchado, edema difuso, derrame pleural, redistribución vascular,, líneas de Kerley, ausencia de broncograma No cardiomegalia, hilio pulmonar normal, edema alveolar parcheado o periférico, no reditribución vascular, no broncograma aéreo ECOCARDIOGRAMA Dilatación de cavidades. Disminución de la FE. Alteraciones valvulares Normal SWAN-GANZ PCP> 18 mmHg PCP< 18mmHg Síndrome de Dificultad Respiratoria del Adulto. Libro Virtual IntraMed: www.intramed.net Una vez excluida esta posibilidad hay que considerar otras entidades como las neumonías (se caracterizan por tos, fiebre y disnea); hemorragia alveolar difusa ( que puede estar asociada con un descenso no explicado en la concentración de hemoglobina y el hematocrito, con importante cantidad de macrófagos con contenido hemático en el líquido BAL); la neumonía aguda eosinofíllica (con clínica indiferenciable de la neumonía bacteriana pero con un gran número de eosinófilos en el líquido BAL, sin eosinofilia en sangre), la neumonía intersticial aguda (S de Hamman-Rinch) y la forma rápidamente progresiva del cáncer pulmonar, tuberculosis miliar etc… Una vez establecido el diagnóstico de SDRA se debe buscar de forma concomitante sus posibles causas, para poder aplicar el tratamiento específico y considerar su pronóstico. 05. Principales patologías específicas de las especialidad 3 - 20 El enfermo crítico 2. Respiratorio ETIOLOGÍA SDRA El SDRA no es una enfermedad, sino un síndrome. De hecho, es provocado por diferentes causas de un grupo de enfermedades muy heterogéneo. Más de 60 posibles causas de SDRA han sido identificadas. Entre ellas destacan: La Sepsis. Es la causa más común, especialmente en enfermos alcohólicos. Microaspiración de contenido digestivo La neumonía adquirida en la comunidad. Es probablemente la causa extrahospitalaria más frecuente de SDRA. Destacan como los patógenos más habituales Streptococcus pneumoniae, Legionella pneumophila, Pneumocystis jirovecii (antes llamado Pneumocystis carinii). La neumonía nosocomial. Fundamentalmente las producidas por las bacterias más agresivas como Staphylococcus aureus, Pseudomonas aeruginosa y otras Gram negativas Politraumatismos. Especialmente si concurren una serie de circunstancias: contusión pulmonar bilateral, embolia grasa después de las fracturas de huesos largos, las infecciones secundarias al traumatismo, las grandes pérdidas hemáticas y la terapia politransfusional tanto la derivada de su número (>15 concentrados) como la producida por acción directa de injerto contra huésped (TRALI). SDRA puede ocurrir después de una sobredosis de fármacos como la aspirina, cocaína, opiáceos, fenotiazinas y antidepresivos tricíclicos. Las reacciones idiosincrásicas a otros fármacos (como la protamina, nitrofurantoína ), incluyendo ciertos agentes quimioterápicos, ocasionalmente pueden producirlo. Los medios de contraste radiológicos también pueden provocar SDRA en individuos susceptibles. Otros factores: cirugía cardiaca con by-pass cardiaco, pancreatitis, ahogamiento, posoperatorio de cirugía abdominal, pancreatitis, eclampsia,… el El riesgo de distrés aumenta si junto a los factores y marcadores de riesgo el paciente tiene condiciones predisponentes: 1. 2. 3. 4. 5. 6. 7. la edad avanzada, el sexo femenino, el abuso crónico del alcohol, el tabaquismo, la enfermedad pulmonar crónica, la severidad de la enfermedad subyacente, y predisposición genética. Algunos datos sugieren que los pacientes con Diabetes Mellitus pueden tener una incidencia disminuida del SDRA. DAÑO PULMONAR: HISTOLOGÍA La base histológica es el daño alveolar difuso pudiendo haber distintos patrones histológicos heterogéneos superpuestos en diferentes regiones pulmonares. Los hallazgos histológicos en una primera fase muestran edema intersticial y alveolar, los neumocitos tipo 1 se muestran edematosos y denudados (primeros tres días). Le sigue una segunda fase (3º-7º día) donde la necrosis de los neumocitos tipo I dará lugar a las membranas hialinas, hay infiltración celular en el espacio intraalveolar. Y se distingue 05. Principales patologías específicas de las especialidad 4 - 20 El enfermo crítico 2. Respiratorio una tercera fase (>7º día), fase proliferativa, donde destaca una proliferación de fibroblastos, depósito de colágeno, e hiperplasia de los neumocitos tipo II. A) Alveolos de apariencia normal, de septos delgados; B) membranas hialinas revistiendo el alveolo; C) neumocitos tipo 2 de estructura cuboidea y prominentes que revisten el alveolo en la fase respiratoria; D) intersticio ensanchado con proliferación de fibroblastos1 EPIDEMIOLOGÍA La incidencia ajustada por edad se calcula en 86 casos por cada 100.000 personas-año; aumentando con la edad, de 16 por 100.000 años-persona entre los individuos de 15 a 19 años a 306 por 100.000 años-persona entre los individuos de 75 a 84 años de edad. Dentro de las unidades de cuidados intensivos, aproximadamente del 10 al 15 por ciento de los pacientes ingresados y hasta un 20 por ciento de los pacientes con ventilación mecánica cumple con los criterios de SDRA. La incidencia de SDRA puede estar disminuyendo gracias a un mejor control y tratamiento de la causas desencadenantes, especialmente en lo referente a la mejora en las estrategias de ventilación y política de transfusión sanguínea. De cualquier forma el desarrollo de este síndrome señala a los pacientes más graves independientemente de su causa. 1 De: Med. Intensiva 2006; 30 n.5 05. Principales patologías específicas de las especialidad 5 - 20 El enfermo crítico 2. Respiratorio FISIOPATOLOGIA ESPECÍFICA SDRA El endotelio capilar pulmonar es selectivamente permeable. Los fluidos atraviesan las membranas bajo el control de las fuerzas hidrostáticas y oncóticas. Mientras que las proteínas séricas permanecen dentro del torrente sanguíneo se cumple la Ecuación de Starling, jugando con ello un papel decisorio una constante de permeabilidad, la presión hidrostática, y las presiones oncóticas de la sangre, y del intersticio. En el SDRA se produce por daño alveolar secundario a la acción de citoquinas proinflamatorias como el factor de necrosis tumoral, y las interleukinas IL -1, IL-6 y IL-8. Estas substancias dañan el endotelio capilar y el epitelio alveolar permitiendo a las proteínas escapar del espacio vascular, produciéndose un desequilibrio secundario de presiones y así edema intersticial y secundariamente alveolar. Se añade dentro de este mecanismo, la apoptosis, incrementando el daño epitelial y la inflamación subsiguiente. Debe considerarse siempre, y aún a pesar del patrón radiológico, la heterogenicidad en la afectación pulmonar especialmente en los pacientes ventilados mecánicamente: mientras que habrá zonas muy aireadas (hiperinsufladas) otras se podrán encontrar colapsadas. La lesión alveolar tiene numerosas consecuencias: Deterioro del intercambio gaseoso producido fundamentalmente por desequilibrio entre la ventilación y la perfusión. Al existir alveolos perfundidos y no ventilados existe una mezcla mayor o menor de sangre en la circulación venosa pulmonar que ha podido, o no, ser oxigenada correctamente. Conforme avanza la evolución suceden fenómenos secundarios que agravan el intercambio gaseoso: vasoconstricción, localizada en los alveolos no ventilados, y más adelante microtrombosis de éstos. Mientras que en una primera fase destaca la hipoxemia, la hipocapnia y la alcalosis respiratoria; en una segunda, se asocia hipoxemia extrema con hipercepnia y acidosis respiratoria por agotamiento muscular La disminución de la distensibilidad pulmonar al tener mayor rigidez las zonas de pulmón no aireadas Aumento de la presión arterial pulmonar por vasoconstricción hipóxica y compresión vascular por la presión positiva si se aplica ventilación mecánica. El aumento de la resistencia a las vías aéreas es también una característica del SDRA, aunque su significado clínico es incierto. Hay que añadir a lo anterior el efecto que conlleva la ventilación mecánica y el encamamiento. El decúbito prono reduce de hecho el volumen pulmonar, con colapso de la zona más declives e incremento así del shunt. La PEEP (presión positiva al final de la espiración) aun partiendo de valores tan bajos como 5-7 cmH2O, mejora la apertura alveolar, la ventilación y disminuye el efecto shunt. Otro de los efectos beneficiosos de este parámetro se relaciona con un menor índice de apertura-colapso-apertura de los alveolos, lo que lleva a un menor estrés de esta pared alveolar y menor daño secundario. Dado que las zonas colapsadas pueden precisar de mayores presiones para abrirse, se ha propuesto la realización de maniobras de reclutamiento alveolar. De no producirse este reclutamiento podría incrementarse el grado de insuficiencia respiratoria al aumentar el shunt por un mayor número de alveolos sobredistendidos. 05. Principales patologías específicas de las especialidad 6 - 20 El enfermo crítico 2. Respiratorio CLÍNICA Y EVOLUCIÓN En mayor o menor medida, las manifestaciones clínicas propias del SDRA se asocian con las del proceso desencadenante: sepsis, politraumatismos... Las alteraciones respiratorias generalmente se desarrollan a las 48-72 horas del proceso desencadenante y presentan un rápido deterioro. Los hallazgos clínicos incluyen disnea, taquipnea e hipoxemia. El examen físico por lo general revela taquicardia, cianosis, taquipnea y estertores difusos. Estas manifestaciones pueden agravarse haciendo necesaria la aplicación de ventilación mecánica. Los gases arteriales suelen detectar una alcalosis respiratoria aguda, hipoxemia, y un elevado gradiente alvéolo-arterial de oxígeno. Otros hallazgos analíticos pueden ser leucocitosis, coagulación intravascular diseminada y acidosis láctica. Como hemos dicho las manifestaciones radiológicas se caracterizan por la aparición de infiltrados alveolares bilaterales de forma progresiva. No existe una relación estrecha, muchas veces, entre la gravedad de estos infiltrados y la insuficiencia respiratoria. Radiológicamente es llamativa la ausencia de signos de insuficiencia cardiaca: redistribución bascular, líneas B de Kerley y/o derrame pleural. En los días siguientes, siguiendo una buena evolución, van disminuyendo sus manifestaciones de forma gradual. En un porcentaje de casos (la fase fibroproliferativa u organizativa puede tener una gran expresividad en algunos pacientes) persiste la gravedad de la insuficiencia respiratoria y la necesidad de ventilación mecánica, haciendo más probables sus posibles complicaciones: barotrauma, neumonía nosocomial asociada a ventilación mecánica y otras como desnutrición, trombosis venosa profunda, hemorragia digestiva… PRONÓSTICO La mortalidad varía en las series desde un 26-58%. Se sabe que la mortalidad depende de la causa que ha motivado el desarrollo de este síndrome, que excepcionalmente los pacientes fallecen por insuficiencia respiratoria, y que la neumonía nosocomial y la sepsis secundaria son las causas de muerte más frecuentes en estadíos más evolucionados. También hay certeza de que la supervivencia ha mejorado en los últimos años gracias a una mejor comprensión de lo que significa este síndrome y a la mejora en las técnicas de ventilación artificial especialmente gracias a la generalización del empleo de volúmenes inspiratorios bajos dentro de lo que se ha denominado estrategia protectora. Se han identificado una serie de “factores pronóstico”, entre los que destacan: 1. la edad; a mayor edad, generalmente, mayor mortalidad, 2. parece que la ausencia de mejora de la oxigenación durante el curso precoz (sin embargo, la gravedad inicial de la hipoxemia no parece ser un predictor fiable de supervivencia), 3. la infección y la disfunción orgánica secundaria son los mejores predictores de la mortalidad, 4. la gravedad de la enfermedad desencadenante, 5. un balance positivo de líquidos, 6. aun de forma controvertida, la administración precoz de corticoides, 7. la transfusión de concentrados de hematíes, 8. la neumonía nosocomial asociada a ventilación mecánica. 05. Principales patologías específicas de las especialidad 7 - 20 El enfermo crítico 2. Respiratorio Respecto a los supervivientes, se sabe que un porcentaje importante de ellos muestran alteraciones en la función pulmonar y deterioro de su calidad de vida en los siguientes dos años. Aun así se considera que el SDRA es una patología reversible. TRATAMIENTO SDRA. Los pacientes con SDRA precisan en la mayor parte de los casos tratamientos complejos: MEJORA EN LA OXIGENACIÓN. MEJORA DEL APORTE DE OXÍGENO A LOS TEJIDOS. Desde un punto de vista más amplio, nuestro objetivo debe consistir en mantener el aporte de O2 a nivel tisular, actuando en cualquiera de los puntos de la ecuación del transporte y aporte de O2 a los tejidos. Aunque la mayor parte de los pacientes son ventilados mecánicamente, la ventilación no invasiva puede ser una opción y de hecho hay experiencias registradas –pequeñas- en la literatura que la apoyan. La forma ventilatoria básica debe ser la controlada por volumen, frecuencia y presión, de forma preferente a otras formas ventilatorias con menor asistencia, por lo menos en los primeros días del proceso. Uno de los cambios más importantes que se ha producido en los últimos años en relación con el SDRA es la idea de que la ventilación mecánica puede dañar a un pulmón sano o ya dañado previamente, y puede retardar su curación. A/ Incremento de la oxigenación pulmonar: La mayor parte de los pacientes precisan de FiO2 elevadas, hasta un 100% y siendo este el principal motivo por el que precisan ser intubados y ventilados mecánicamente. En los pacientes con SDRA, no es posible mantener una adecuada PaO2 aumentando simplemente la FiO2 (incrementándose además la toxicidad por el oxígeno) por lo que se utiliza cifras variables de PEEP que permiten el reclutamiento de alveolos colapsados, mejorando la relación ventilaciónperfusión, disminuyendo el estrés de la pared alveolar y mejorando la mecánica respiratoria. La ventilación con bajos volúmenes corrientes (Volumen Tidal inicial de 4-6 ml / kg), conocida también como ventilación de protección pulmonar. La ventilación por medio de volúmenes corrientes pequeños tiene menos probabilidades de generar sobredistensión alveolar, una de las principales causas de lesión pulmonar asociada a la ventilación mecánica, y causa de agravamiento y persistencia del cuadro. El estudio multicéntrico ARMA y un meta-análisis de seis ensayos clínicos aleatorios (1297 pacientes) encontraron que esta estrategia ventilatoria mejoró significativamente la mortalidad (22%) en comparación con la ventilación mecánica convencional. Otros autores anteponen a esta estrategia ventilatoria el fenómeno de reclutamiento/desreclutamiento que se podría producir con esta modalidad ventilatoria al emplear volúmenes bajos. La lesión subsiguiente podría ser mayor que la que se produce por sobredistensión en algunas series experimentales en animales. En la práctica, y en resumen, la concepción actual de “VM protectora” implica un ajuste individualizado de la PEEP y el Vt que parece ser ventajosa mientras que la presión meseta del respirador no excede los 30 cmH2O Hipercapnia permisiva - La modalidad ventilatoria anterior implica muchas veces hipoventilación alveolar con el fin de mantener una presión alveolar baja y minimizar las complicaciones asociadas y de este modo tanto la hipercapnia como la acidosis respiratoria son consecuencias de ésta. El grado de hipercapnia puede minimizarse mediante el uso de la mayor frecuencia respiratoria. Las maniobras de reclutamiento - Está demostrado que la PEEP previene el desreclutamiento alveolar, pero cada vez también lo está que los bajos niveles de PEEP 05. Principales patologías específicas de las especialidad 8 - 20 El enfermo crítico 2. Respiratorio comúnmente utilizados (< 20 cm H2O) en la práctica diaria reclutan solo una pequeña porción del volumen pulmonar total. Estas maniobras consisten en la aplicación de una elevada de presión inspiratoria, como por ejemplo de 35 a 40 cm H2O durante 40 segundos, para obtener un mayor grado de reclutamiento alveolar (abrir los alvéolos que se han colapsado). El impacto de las maniobras de reclutamiento en los resultados clínicos de rutina no está claro. Las maniobras de reclutamiento pueden ser especialmente beneficiosas después de una desconexión del ventilador, ya que incluso un breve momento sin PEEP puede conllevar un brusco colapso alveolar.La búsqueda de una PEEP ideal es una estrategia pendiente. La aplicación de cualquiera de estas medidas supone una elevación de la presión alveolar y transpulmonar que condiciona una alteración en la circulación pulmonar y una sobrecarga del ventrículo derecho. Dentro de la estrategia ventilatoria protectora del ventrículo derecho se debería monitorización de la mecánica pulmonar y hemodinámica a la hora de plantear la estrategia ventilatoria más oportuna. (Med Intensiva. 2012;36(2):138--142) Empleo de ventilación en decúbito prono es una forma de mejorar la relación entre ventilación y perfusión. Hay autores que afirman que es una técnica segura que producen un incremento significativo de la PaO2 en un 60-80% de los pacientes. A pesar de ello no ha demostrado una disminución de la mortalidad, y su uso debe considerarse como opcional. B/ Disminuir el consumo de oxígeno. No debe olvidarse que la insuficiencia respiratoria se explica en el SDRA por desequilibrios entre la ventilación y la perfusión, manteniendo perfundidos alveolos no ventilados se produce la mezcla de sangre oxigenada con otra que no lo ha podido hacer en alveolos no ventilados. Este fenómeno es aún más grave si la SvO2 es muy baja por “sobreconsumo” periférico. Las causas más comunes de incremento del consumo de oxígeno incluyen la fiebre, la ansiedad, el dolor y el uso de los músculos respiratorios. Por lo tanto, la saturación arterial puede mejorar después del tratamiento con anti-antipiréticos, sedantes, analgésicos, y/o relajantes musculares. C/ Mejorar el transporte y el aporte tisular de O2 Este pilar del tratamiento depende de un adecuado soporte hemodinámico para optimizar el gasto cardiaco, de una administración adecuada de líquidos, incluyendo la posibilidad de transfusión sanguínea cuando la concentración de hemoglobina cae por debajo de 6-7 g / dl. Se han postulado las siguientes medidas complementarias en caso de hipoxemia refractaria: Aumento de la relación I: E Por medio de una prolongación del tiempo inspiratorio puede mejorar la oxigenación (ejem. 1:1, o bien 2:1). Esta técnica incrementa la presión media en la vía aérea, gracias a un incremento de la autoPEEP (por acortamiento del tiempo espiratorio).. La presión elevada sostenida en la vía aérea puede reclutar el pulmón colapsado y disminuir la ventilación del espacio muerto. La PEEP alta por encima de valores habituales puede ser una alternativa ya que muchos pulmones pueden tener áreas heterogéneas que puedan reclutarse con presiones mayores. Pero no se ha llegado a determinado adecuadamente su cuantía. De forma global, el empleo de PEEP mayores que las convencionales, aunque mejoran la oxigenación y es seguro, no se asocia a una mayor supervivencia. Se han puesto de manifiesto dos situaciones en las que una PEEP elevada (mayor que la convencional) puede disminuir la mortalidad: en el síndrome de distrés respiratorio agudo y grave; y cuando se calcula por medio de las curvas referentes a la mecánica pulmonar 05. Principales patologías específicas de las especialidad 9 - 20 El enfermo crítico 2. Respiratorio Valoración de las curvas inspiratorias-espiratorias para aplicar la PEEP y la Presión Inspiratoria óptimas. La insuflación más allá del punto de inflexión superior puede dar lugar a la sobredistensión alveolar y barotrauma pulmonar, así como disminución de la precarga y del aporte de oxígeno; y la PEEP por debajo del punto de reclutamiento alveolar favorecen los ciclos apertura-cierre alveolar y así persistencia (o incluso agravamiento) del daño a este nivel. Se ha postulado que el bloqueo neuromuscular puede beneficiar a los pacientes con SDRA mediante la eliminación de la asincronía con el respirador y la reducción de la elastancia de la pared torácica, lo que lleva a una presión transpulmonar favorables y la distribución equitativa del gas entregado. MEDIDAS GENERALES 1. SEDACIÓN. Mejora la tolerancia a la ventilación mecánica y disminuye el consumo de O2. Son de elección los fármacos de acción prolongada y en perfusión (Midazolam). Igualmente es aconsejable la combinación de fármacos sedantes y analgésicos, siendo de elección los opiáceos (fentanilo o morfina). En ocasiones fármacos tales como el haloperidol y el propofol pueden ser alternativas útiles. Una vez normalizada la situación respiratoria, es conveniente ir disminuyendo durante unas horas al día la sedación en unos periodos “ventana” para minimizar en lo posible la duración de la ventilación mecánica y empezar los más precozmente el destete. La sedación excesiva y prolongada se ha asociado con una mayor mortalidad. 2. RELAJACIÓN MUSCULAR. En casos de grave insuficiencia respiratoria, a pesar de extremar los parámetros del respirador y la dosificación de sedantes, y durante cortos periodos de tiempo pueden estar indicada y ser potencialmente beneficiosa la relajación muscular. 3. SOPORTE Y CONTROL HEMODINÁMICO. En caso necesario para mantener una perfusión adecuada (ausencia de acidosis láctica, diuresis adecuada, TAs en rango aceptable…) puede ser necesaria la administración de fármacos vasoactivos (Noradrenalina) y/o inotropos (Dubutamina, Dopamina). Hoy por hoy, no parece indicada la colocación de catéter pulmonar Swan-Ganz en estos pacientes ya que no aporta beneficios y si una mayor tasa de complicaciones en relación con la simple estimación de la PVC a través de un catéter venoso central. 4. ADECUADA ADMINISTRACIÓN DE LÍQUIDOS. Dado que la presión hidrostática es uno de los determinantes del edema alveolar, una estrategia plausible aun en enfermos no hiperhidratados, es disminuir todo lo posible el balance hídrico, evitando por otro lado la hipoperfusión y la hipotensión. Hay que recordar que un balance hídrico positivo y reiterado es uno de los factores de mal pronóstico más frecuentemente señalados. 5. SOPORTE NUTRICIONAL. Si el tracto digestivo es funcionante siempre es preferible la dieta enteral en términos de seguridad y eficacia. Especialmente cuando son alimentados por sonda nasogástrica es obligatorio mantenerlos en la cama semiincorporados para disminuir el riesgo de broncoaspiración y de neumonías. 6. CONTROL DE LA GLUCEMIA. La hiperglucemia (y también el control demasiado estricto de ésta) se asocia a mayor mortalidad. Son preferibles cifras entre 110150 mg/dl y por otro lado la perfusión de insulina rápida a las dosis intermitentes. 7. CONTROL Y VIGILANCIA MICROBIOLÓGICA. El uso rutinario de antibióticos profilácticos en el paciente no inmunodeprimido no está justificado. Dado que la neumonía nosocomial asociada a ventilación mecánica implica una mayor morbilidad y mortalidad (hasta un 50% en algunas series), es importante su 05. Principales patologías específicas de las especialidad 10 - 20 El enfermo crítico 2. Respiratorio prevención; pero también la administración de tratamiento antibiótico de forma precoz y certera; y valorar adecuadamente los resultados de las muestras bacteriológicas obtenidas. La descontaminación selectiva del tubo digestivo o de la tráquea disminuye su colonización pero la influencia en la mortalidad no se ha demostrado. La aspiración continua subglótica es una excelente estrategia profiláctica para disminuir la incidencia de neumonía asociada a la ventilación. El tratamiento antibiótico, de ser posible, debe guiarse por el resultado de los estudios bacteriológicos. 8. PROFILAXIS DE LA TROMBOSIS VENOSA PROFUNDA Y DE LA ÚLCERA DE STRESS. Así como del resto de complicaciones asociadas. NUEVAS TERAPIAS EN EL SDRA En la actualidad, ninguno de los tratamientos revisados aquí ha demostrado beneficio clínico de un modo consecuente y claro. AGONISTAS BETA. Parece que la administración estos productos de forma IV (no de forma inhalada) se asocia a menor cantidad de agua intrapulmonar y así a mejor pronóstico. SURFACTANTE EXÓGENO. Modificaría la tensión superficial alveolar y previene las atelectasias. Además de proteger frente a los radicales de oxígeno y puede tener efectos antiinflamatorios. Aunque su administración es bien tolerada, en ningún caso se ha observado resultados alentadores. VASODILATADORES (Óxido Nítrico y Prostaciclina). Su uso puede valorarse en la idea de que servirían para dilatar vasos de las zonas mejor ventiladas, mejorando así la oxigenación y disminuyendo la hipertensión pulmonar secundaria. Ambos fármacos se toleran bien, y aunque demuestran sus efectos beneficiosos, no existe evidencia de que esto implique una mejora significativa en la supervivencia. Por ello parece que la evidencia científica solo apoya su uso en pacientes intratables, con hipoxemia refractaria al tratamiento convencional. OTRAS FORMAS VENTILATORIAS a) Ventilación con alta frecuencia. Basada en usar bajos volúmenes corrientes con mayores frecuencias respiratorias extremando las técnicas de protección alveolar. Los beneficios potenciales de ventilación de alta frecuencia incluyen una reducción de barotrauma, mejor adecuación de V / Q, y un menor riesgo de compromiso hemodinámico. b) Ventilación líquida. Los pulmones se llenan con un perfluorocarburo, un líquido denso, incoloro capaz de transporte de gas. Los beneficios potenciales incluirían una mejor oxigenación, disminución de barotrauma, y la mejora de daño alveolar difuso. Esta modalidad no puede ser recomendada ya que no hay evidencia científica que apoye estos beneficios. c) Técnicas extracorpóreas. No han mostrado ninguna mejora respecto a las formas ventilatorias convencionales. d) ECMO. - La oxigenación por membrana extracorpórea (ECMO) no ha mostrado tampoco ninguna diferencia en supervivencia. e) La eliminación de CO2 extracorpórea (ECCO2R) utiliza un circuito veno-venoso para permitir la eliminación de CO2 con un flujo más bajo que el ECMO. La experiencia es limitada pero por ahora no ha obtenido los resultados que se requerían 05. Principales patologías específicas de las especialidad 11 - 20 El enfermo crítico 2. Respiratorio TERAPIAS ANTIINFLAMATORIAS. . Se ha planteado la hipótesis de que los agentes capaces de suprimir la inflamación y promover la reparación de pulmón podrían repercutir positivamente el resultado de SDRA a) Corticoides. Se han implicado en las fases precoces como antiinflamatorio y en las tardías como inhibidor de la síntesis de fibrinógeno. Aunque hay algún resultado alentador hoy por hoy se desconoce cuál debe ser la dosis, que fármaco, en qué fase y la duración del tratamiento óptimos. Hoy por hoy no existe suficiente justificación para tratar a los pacientes con SDRA con corticoides en cualquiera de sus fases de un modo sistemático. Aunque en algún estudio ofrece cierta mejoría gasométrica ésta no se traduce en un aumento de la supervivencia. En cambio si que ésta demostrado la relación existente entre su administración y el incremento de la gravedad de la neuromiopatía. b) Las Estatinas. Como estabilizadores de membrana. Parecen mejorar la oxigenación pero sin cabios relevantes demostrados en la supervivencia. c) Prostaglandina E1. Es un potente mediador endógeno antiinflamatorio y vasodilatador. La experiencia con este fármaco por ahora es muy limitada, d) Inhibidores de la elastasa de los neutrófilos. e) Inhibidores del ácido araquidónico. f) Ketoconozol. g) Ibuprofeno. Aun siendo un fármaco muy estudiado no ha demostrado su uso disminución ni de la mortalidad ni de la duración de la ventilación mecánica. h) Antioxidantes i) Glutation j) Suplementos de aceite en la dieta. Aunque inicialmente parecía que arrojaban resultados ilusionantes, no han demostrado finalmente su beneficio. 05. Principales patologías específicas de las especialidad 12 - 20 El enfermo crítico 2. Respiratorio REAGUDIZACION DE EPOC DEFINICIÓN La EPOC se caracteriza esencialmente por una limitación crónica al flujo aéreo no totalmente reversible. Su manifestación principal es la disnea. Se define una exacerbación de la enfermedad pulmonar obstructiva crónica (EPOC) como un aumento agudo de la sintomatología que le es propia: a) la tos, b) la producción de esputo y modificaciones en su aspecto, c) la disnea. Más allá de su variación diaria, y de inicio agudo. Es necesario distinguir una nueva agudización de un fracaso terapéutico previo de una recaída para lo que se exige no haber recibido tratamiento para alguna otra reagudización en las últimas cuatro semanas y se hayan descartado teóricamente otras causas de disnea. Su importancia es obvia si pensamos que es la cuarta causa de muerte (aunque en las últimas décadas parece que hay una tendencia a disminuir tanto en hombres como en mujeres); que su prevalencia alcanza alrededor de un 10% de los adultos entre 40-80 años (10.2% en España) y los enormes gastos que supone su asistencia (el coste medio directo por paciente con EPOC se estima entre 1.712 y 3.238 euros/año). Desde un punto de vista fisiopatológico, presentan estos pacientes un aumento de la resistencia de la vía aérea, hiperinsuflación pulmonar e incremento del espacio muerto anatómico. Ello supone un incremento del trabajo respiratorio que cuando sobrepasa la capacidad muscular puede conllevar fracaso respiratorio, precisando en muchos casos el inicio de ventilación mecánica. Generalmente se asocia a una serie de enfermedades (comorbilidades), entre las que destacan las enfermedades cardiovasculares (cardiopatía isquémica, insuficiencia cardíaca o ictus), la hipertensión, la diabetes mellitus, la insuficiencia renal, la osteoporosis, las enfermedades psiquiátricas (ansiedad y depresión), el deterioro cognitivo, la anemia o las neoplasias, en especial y el cáncer de pulmón.. Su presencia complica el tratamiento y agrava su pronóstico, siendo muchas veces la verdadera causa de muerte. Además su importancia deriva de que la atención de estos pacientes, sobre todo en el momento de decidir la intubación y ventilación mecánica, siempre acarrea grandes problemas en la esfera de la Bioética. Clásicamente se han considerado a estos pacientes como poco tributarios a ser ventilados mecánicamente al relacionar esta necesidad con estadios finales de la enfermedad. Se sabe que no siempre es así y hay en este sentido estudios que lo demuestran. Es vital conocer los factores pronóstico para poder valorar y pronosticar el desenlace de los pacientes en el momento del ingreso en UCI y la procedencia, o no, de su intubación y del inicio de ventilación invasiva. VALORACIÓN GENERAL ENFERMO CON REAGUDIZACIÓN La muy reciente (2012) la Guía Española de la EPOC recomienda la siguiente línea de actuación. La valoración general de un paciente con EPOC reagudizada consta de una serie de fases: 05. Principales patologías específicas de las especialidad 13 - 20 El enfermo crítico 2. Respiratorio Extraído de: Guía española de la enfermedad pulmonar obstructiva crónica (GesEPOC). Diagnóstico y tratamiento hospitalario de la agudización. Emergencias 2013;25:301-317 ¿Se trata de una reagudización de EPOC? Para contestar a esta pregunta son esenciales: a) un diagnóstico previo de EPOC, b) empeoramiento de su clínica habitual, especialmente la disnea, c) no haber recibido tratamiento alguno en las últimas cuatro semanas por este motivo. Se realizará el diagnóstico diferencial con otras patologías que pueden simularla. Extraído de: Guía española de la enfermedad pulmonar obstructiva crónica (GesEPOC). Diagnóstico y tratamiento hospitalario de la agudización. Emergencias 2013;25:301-317 En la actualidad no existe suficiente evidencia para recomendar el uso sistemático de ningún biomarcador: PCR, procalcitonia. Sin embargo puede servir de ayuda en el diagnóstico diferencial las determinaciones de proBNP, troponina T o de D-dímero 05. Principales patologías específicas de las especialidad 14 - 20 El enfermo crítico 2. Respiratorio ¿Qué gravedad tiene el paciente? Debe hacerse una amplia valoración constatando sus antecedentes, su situación funcional previa y las manifestaciones de la exacerbación. Tenemos que auxiliarnos de la inspección, la exploración, de la realización de una RX de tórax y de la extracción analítica, para bioquímica completa, gasometría arterial, ECG y hemograma. Hay distintos protocolos, pero inevitablemente este paso recae en el criterio personal del facultativo. Por otro lado se obtendrán las muestras bacteriológicas oportunas (esputo vs aspirado bronquial).La realización de un cultivo de esputo estará indicada en aquellos casos de reagudización grave, si son frecuentes, con necesidad de ventilación mecánica o tras fracaso del tratamiento antibiótico. El criterio que mejor predice la contaminación bacteriana es la purulencia del esputo/aspirado bronquial. 05. Principales patologías específicas de las especialidad 15 - 20 El enfermo crítico 2. Respiratorio ¿Cuál es la causa de la reagudización? Reconocer la causa no es tan sencillo. En un 50-70% de los casos la causa es una sobreinfección del árbol bronquial. Los gérmenes más frecuentemente implicados son S pneumonie, H influenzae, M catarralis, Ps aeruginosa, virus y hongos (especialmente en enfermos inmunocomprometidos). Las infecciones víricas representan cerca del 30% de todas las exacerbaciones de causa infecciosa, aunque algunos estudios recientes, que emplean técnicas diagnósticas más precisas, elevan hasta el 50% el número de exacerbaciones infecciosas causadas por virus. Hasta una 30% de los casos existe coinfección vírica-bacteriana, la infección vírica facilitaría la sobreinfección bacteriana posterior. Pero, no es el único motivo: un 20 a 30 % se deben a la polución o a causas como el embolismo pulmonar, neumotórax, traumatismos, ingesta de sedantes, intervención reciente, desnutrición o la presencia de enfermedades cardiovasculares asociadas (insuficiencia cardíaca o embolismo pulmonar) o simplemente a una etiología desconocida (hasta un 30% de los casos). INDICACIONES DE INGRESO EN UCI Las indicaciones más frecuentes de ingreso en UCI son: a) disnea grave que no responde adecuadamente al tratamiento en el S de Urgencias; b) confusión, letargia y coma; c) hipoxemia, hipercapnia, acidosis grave o que empeora a pesar del O2, o incluso de la ventilación no invasiva; d) necesidad de ventilación mecánica invasiva; e) inestabilidad hemodinámica, uso de vasopresores. Destacando el agravamiento de la insuficiencia respiratoria y así la necesidad de ventilación mecánica invasiva. A pesar de que es uno de los motivos más frecuentes de ingreso en UCI, y que tiene indudablemente un gran impacto económico, los criterios de ingreso y las estrategias terapéuticas en UCI no están del todo definidas Obviamente esta decisión está ligada a su pronóstico a corto y medio plazo. En la actualidad no hay evidencia alguna para considerar que la EPOC no es una enfermedad tributaria de intubación traqueal y ventilación mecánica en situaciones de insuficiencia respiratoria de riesgo vital debidas a una agudización. La única limitación puede ser la voluntad del paciente competente tras ser informado por su médico .( J.F. SOLSONA ET AL.– LOS CRITERIOS DE INGRESO EN UCI DEL PACIENTE CON EPOC.DOCUMENTO DE REFLEXIÓN SEMICYUC-SEPAR. MEDICINA INTENSIVA, VOL. 25, NÚM. 3, 2001) No hay guías universalmente avaladas que sirvan para predecir el pronóstico vital al ingreso, aunque se han identificado diversos factores de mal pronóstico: la gravedad de la insuficiencia respiratoria, el valor del pH, la necesidad de ventilación mecánica, la edad, el FEV1, los valores de albúmina, de sodio, el cociente entre PaO 2/FiO2, el índice de masa corporal, el desarrollo de cor pulmonale, el estado funcional, los hallazgos radiológicos, la comorbilidad… En general se estima la aplicación de ventilación mecánica es el factor que acarrea peor pronóstico: una supervivencia de un 37% a los 6 meses, en los que ingresan en UCI y de un 43% en los que se precisa ventilación mecánica. Se contabiliza que los enfermos que ingresan por hipercapnia y acidosis presentan una mortalidad de un 10%, en el primer año tras requerir soporte ventilatorio es del 40% y de un 27% de forma aguda si fracasa la VMNI. Es quizás el estudio SUPPORT el más amplio al incluir 1016 pacientes con reagudización, y este encontró que la puntuación APACHE, el índice 05. Principales patologías específicas de las especialidad 16 - 20 El enfermo crítico 2. Respiratorio de masa corporal, la albuminemia, la edad, la relación entre PaO 2/FiO2, la presencia de insuficiencia cardiaca como causa de la descompensación o de cor pulmonale y la calidad de vida en las dos semanas previas eran los principales factores pronóstico. Toda esta variedad de factores nos obliga a una evaluación individual del paciente. De cualquier modo los factores que se emplean para decidir el ingreso en UCI o no, son en la mayor parte de las ocasiones: 1. Edad > 80 años 2. VEMS < 25% 3. PaCO2 > 55 mmHg en los últimos 6 meses 4. Portador de oxígeno domiciliario en los últimos 6 meses 5. Un ingreso en el SMI el mismo año 6. Dos o más ingresos en el SMI el mismo año 7. Tabaquismo activo 8. Calidad de vida muy mala percibida por el paciente 9. Calidad de vida objetiva muy mala (por índices) 10. Que el paciente no lo desee La introducción y desarrollo de la ventilación no invasiva ha supuesto un gran avance en el tratamiento de la enfermedad, puesto que se puede evitar el ingreso en UCI de una gran parte de estos pacientes. Es una alternativa muy válidas para estos pacientes, especialmente para los de peor pronóstico, mejorando indiscutiblemente éste especialmente de la mano de una menor necesidad de intubación. OBJETIVOS FUNDAMENTALES DEL TRATAMIENTO 1. Identificar y tratar la causa de la exacerbación aguda, si es posible. 2. Optimizar la función pulmonar mediante la administración de broncodilatadores y otros agentes farmacológicos. 3. Asegurar una adecuada oxigenación y el aclaramiento de las secreciones respiratorias, evitando la necesidad de intubación, si es posible. 4. Prevenir las complicaciones de la inmovilidad, como la tromboembolia y la atrofia muscular. 5. Responder a las necesidades nutricionales evitando la desnutrición. TRATAMIENTO FARMACOLÓGICO Hay que diferenciar el tratamiento farmacológico del EPOC en situación estable del que presenta una crisis. Los broncodilatadores. En la agudización de la EPOC de cualquier intensidad, la principal intervención es optimizar la broncodilatación, aumentando la dosis y/o la frecuencia de los broncodilatadores de acción corta y rápida. Los broncodilatadores de acción corta son los de elección para el tratamiento de la agudización. Los β2 adrenérgicos de acción corta y rápida como los agonistas beta-2 adrenérgicos (salbutamol y terbutalina) son de elección, y se pueden añadir al tratamiento, si fuera necesario, los anticolinérgicos de acción corta (ipratropio). Se comprueba que son más activos por vía inhalatoria que intravenosa y con menores efectos secundarios. Y que el beneficio de un segundo inhalador se consigue tras obtener dosis máximas del primero. 05. Principales patologías específicas de las especialidad 17 - 20 El enfermo crítico 2. Respiratorio La inyección subcutánea de agonistas beta-adrenérgicos se reserva para situaciones en las que la administración inhalada no es posible. El uso parenteral de estos agentes provoca un efecto inotrópico y cronotrópico positivo, que puede causar arritmias o isquemia de miocardio en personas susceptibles. Tampoco parecen de elección broncodilatadores, aunque su eficacia real no está bien valorada. Se recomienda la administración de corticoides, ya que parece disminuir el porcentaje de pacientes con mala evolución y así de la necesidad de ventilación mecánica e intubación. Además acortan el tiempo de recuperación y mejoran la FEV1 y la hipoxemia. Están recomendados con una evidencia fuerte tanto en las reagudizaciones graves como en las que no lo son tanto. En los que ya estaban tratados con estos fármacos estos beneficios son mucho más dudosos. La dosis óptima de los glucocorticoides sistémicos es desconocida pero hay una evidencia creciente que apoya el uso de dosis tan solo moderadas: Prednisona 30 a 60 mg, una vez al día, o Metilprednisona 60 a 125 mg, dos a cuatro veces al día. La duración óptima del tratamiento con glucocorticoides sistémicos no está claramente establecida y, a menudo depende de la gravedad de la exacerbación y la respuesta observada al tratamiento. También hay alguna experiencia favorable con el empleo de altas dosis de corticoides en estos pacientes por vía inhalatoria. El empleo de metilxaninas IV son consideradas como terapia de segunda línea: amilofilina y teofilina. No se recomiendan de entrada. Dado que la causa principal de reagudización son la sobreinfección bronquial con bacterias (51%), el tratamiento antibiótico debe ser una pieza habitual en el tratamiento de estos pacientes. De hecho disminuyen la mortalidad un 77%, el fracaso del tratamiento inicial un 55% y la purulencia del esputo un 44%. Pero esto no está exento de controversia especialmente en aquellos casos en que el esputo no es purulento. El tiempo recomendado es generalmente de 5 – 10 días. Siguiendo las recomendaciones SEPAR 2012 podemos afirmar que: Se recomienda utilizar un antibiótico durante una agudización siempre que el esputo sea purulento, como ex-presión indirecta de posible infección bacteriana (evidencia alta, recomendación fuerte a favor). En la agudización moderada o grave también estará indicado cuando, en ausencia de purulencia, haya incremento de la disnea y del volumen del esputo (evidencia moderada, recomendación fuerte a favor). En las agudizaciones muy graves, cuando el paciente requiere asistencia ventilatoria, la cobertura antibiótica es obligada, ya que ha demostrado reducir la incidencia de neumonía secundaria y también disminuir de forma significativa la mortalidad (evidencia baja, recomendación fuerte a favor). La elección del antibiótico depende de la etiología teóricamente más probable, del patrón de resistencia antibiótica, de la gravedad de la reagudización, de si conocemos el agente causante o no y del riesgo de que la bacteria implicada sea Ps aeruginosa (uso de más de 4 ciclos de tratamiento antibiótico en el último año, una función pulmonar con un FEV1 < 50%, la presencia de bronquiectasias significativas o el aislamiento previo de Pseudomonas en esputo en fase estable o en una agudización previa). Hay pocas evidencias que apoyen el empleo de fármacos mucoactivos (por ejemplo, la N-acetilcisteína) en las exacerbaciones agudas de la EPOC. 05. Principales patologías específicas de las especialidad 18 - 20 El enfermo crítico 2. Respiratorio OXIGENOTERAPIA Y TÉCNICAS DE ASISTENCIA VENTILATORIA El suplemento de oxígeno es un componente esencial de la terapia aguda. Generalmente no son precisas FiO2 muy elevadas. Debe administrarse de forma prudente ya que muchos de estos pacientes al depender el centro respiratorio de la hipoxemia, corrigiendo ésta, puede agravar una grave hipercapnia. En casos de descompensación severa la administración de O2 tiene que seguirse al poco tiempo de la valoración de los resultados de una gasometría arterial. La incapacidad para corregir la hipoxemia con bajas FiO2 debería llevarnos a considerar otras alternativas diagnósticas como la embolia pulmonar, el síndrome de dificultad respiratoria aguda, el edema pulmonar o la neumonía. Debe considerarse el soporte ventilatorio (invasivo o no) en los casos en los que exista un fracaso ventilatorio grave, alteración del nivel de conciencia, intensa disnea, acidosis respiratoria severa; todo ello a pesar de un tratamiento médico óptimo La ventilación mecánica (invasiva o no invasiva) tienen como principales objetivos la mejora del intercambio gaseoso, pero también la de proporcionar suficiente descanso de la musculatura respiratoria tras el agotamiento de la musculatura respiratoria mientras se resuelve la causa de la exacerbación bronquial. Sus indicaciones principales son el fracaso ventilatorio grave, alteración relacionada del nivel de conciencia, disnea invalidante o acidosis respiratoria. La ventilación mecánica puede ser administrada de forma no invasiva (VNI) o invasiva (VI). Hay numerosos estudios que apoyan la estrategia basada en el empleo de la ventilación no invasiva en estos pacientes. Con su empleo incrementa el porcentaje de éxito en el tratamiento en un 80-85%, mejora la acidosis respiratoria, disminuye la estancia hospitalaria, la mortalidad y la necesidad de intubación. Las indicaciones más claras para establecer este tipo de ventilación incluyen la EPOC complicada con acidosis hipercápnica, el edema cardiogénico (grado 1A) y fallo respiratorio (grado 2B). Las contraindicaciones incluyen la inestabilidad hemodinámica, las graves alteraciones del nivel de conciencia(con excepción de la encefalopatía hipercápnica severa) y la existencia de alteraciones en la permeabilidad de las vías aéreas (tumores, quemaduras, traumatismos). La mortalidad en los pacientes a los que se les aplico VMNI con éxito fue del 12% mientras que la que se registró en los casos en que no se empleó o ésta fracasó fue de un 27%. En conclusión: parece recomendable la utilización de ventilación mecánica no invasiva en todos aquellos pacientes con insuficiencia respiratoria por exacerbación de EPOC. Un enfoque razonable es iniciar la VMNI con una presión inspiratoria de 8 a 12 cm de H2O, y una presión espiratoria de 3 a 5 cm de H2O. La presión inspiratoria se incrementará gradualmente según sea necesario para lograr el alivio de la disnea y la buena sincronía paciente-ventilador. El deterioro gasométrico, que no responde a medidas conservadoras e incluso a la ventilación no invasiva y la disnea insostenible son las razones más habituales para la intubación y la ventilación mecánica invasiva. Otras son la parada cardiaca, la disminución del nivel de conciencia o grave agitación psicomotriz, broncoaspiración y la inestabilidad hemodinámica severa. No existen criterios claramente definidos para iniciar dicho soporte en la EPOC y el asma, las indicaciones podrían ser al menos dos de las siguientes: a) disnea moderada-severa, con uso de la musculatura accesoria y respiración abdominal; b) acidosis hipercápnica (pH < 7,35, y c) taquipnea > 25 rpm. 05. Principales patologías específicas de las especialidad 19 - 20 El enfermo crítico 2. Respiratorio La decisión de aplicar este tipo de medida debe basarse en muchas variables pero a través de un juicio individualizado. Pueden servir de ayuda la historia clínica (calidad de vida previa y la existencia de comorbilidades, hallazgos clínicos como (somnolencia, tiraje intercostal, respiración paradójica, etc.) y la acidosis respiratoria son predictores de un próximo agotamiento muscular del paciente, también tiene un significado relevante la respuesta al tratamiento inicial. Una vez producido el agotamiento muscular, la aplicación de ventilación mecánica debe evitar el exceso de trabajo respiratorio, pero al mismo tiempo una excesiva atrofia de la musculatura respiratoria. Esto se puede conseguir con formas ventilatorias asistidas: CMV-asistida, IMV, PSV. Es recomendable que el tiempo espiratorio sea mayor, bien disminuyendo la relación I:E, o bien con bajas frecuencias respiratorias para disminuir el atrapamiento aéreo y así la PEEP intrínseca. Puede ser útil la adición de PEEP extrínseca en aquellos pacientes en los que se demuestra atrapamiento aéreo al final de la espiración (autoPEEP o PEEP intrínseca). El parámetro guía será el pH y no la pCO2, evitando la alcalemia, especialmente en retenedores crónicos. La indicación de administrar bicarbonato para resolver una acidosis respiratoria es cuando menos dudosa y debería acompañarse de un aviso de precaución, especialmente si el enfermo presenta inestabilidad hemodinámica o hipertensión endocraneana. Es conveniente que esta asistencia sea menor, forzando el destete lo antes posible, una vez que ha mejorado el proceso que condicionó la insuficiencia respiratoria. CUIDADOS PALIATIVOS EN LA EPOC Los objetivos de este tratamiento es aminorar los síntomas de la enfermedad, las repercusiones psicológicas y los efectos secundarios de la medicación. Estos cuidados deben iniciarse cuando la expectativa de vida es pésima en unos pocos meses y deben estar en función de las necesidades del paciente y de sus familiares. La información y la comunicación son herramientas esenciales en esta fase, aunque no se debe obligar a ello al paciente si él no lo precisa. Los síntomas guías a tratar son fundamentalmente la disnea y el dolor. Para ello puede ser útil la administración de dosis bajas de opiáceos. Para las crisis de pánico respiratorio es útil el lorazepam en dosis de 0,5-1 mg por vía oral o sublingual. La depresión y la ansiedad deben tratarse de forma convencional aunque se debe estar más vigilante de los efectos secundarios y de las interacciones medicamentosas. 05. Principales patologías específicas de las especialidad 20 - 20