Virologìa [Modo de compatibilidad]
Anuncio
![Virologìa [Modo de compatibilidad]](http://s2.studylib.es/store/data/006753832_1-bacace40fb6fead442003b31ba6995cd-768x994.png)
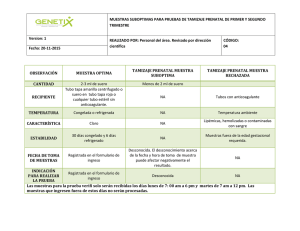
ACTUALIZACION TOMA DE MUESTRAS VIROLOGICAS Abril 2014 MV. Judith Mora R. Jefe Subdepto. Enfermedades Virales ISP METODOS DE DIAGNOSTICO VIRAL A. DETECCION DE VIRUS •Aislamiento viral en cultivos celulares. •Inoculación en animales de laboratorio •Inoculación en huevos embrionados B. DETECCIÓN INDIRECTA O PRODUCTOS VIRALES. •Inmunofluorescencia (IFD). •Inmunoensayo enzimático (ELISA) C. DETERMINACION DE ANTICUERPOS Métodos serológicos (sueros pareados o muestra única) •ELISA (IgM –IgG) •Inmunofluorescencia (IFI). D. DETECCION DE MATERIAL GENETICO VIRAL • Reacción de polimerasa en cadena (PCR) CONSIDERACIONES PARA TOMA Y ENVIO DE MUESTRAS PARA ESTUDIO VIROLOGICO • PERIODO OPTIMO DE RECOLECCION – Ej: Aislamiento viral en fase aguda • TIPO DE MUESTRA – Ej: Sangre c/EDTA • SITIO DE OBTENCION – Ej: Deposición • TECNICA DE OBTENCIÓN DE LA MUESTRA – ANF vs Tórula faríngea • RECOLECCION DE LAS MUESTRAS – Envase estéril, cierre hermético, etc • TRANSPORTE DE LAS MUESTRAS – Temperatura, medio transporte, etc 1º Tº 2º: protege el embalaje/envase secundario de los daños físicos durante el transporte. 3º identificar al remitente y al destinatario. Incluir formularios de datos relativos a la muestra Organigrama Subdepartamento Enfermedades Virales Laboratorio Nacional de Referencia y cumple acciones de vigilancia establecidas en el Reglamento sobre Notificación de Enf. Transmisibles de Declaración Obligatoria . R.R.H.H: Profesionales 26 Técnicos, Auxiliares, Administrativos 24 Total 50 32.000 muestras Exámenes por Algoritmos Diagnósticos Virus Entéricos • Vigilancia PFA Apoyo a erradicación del virus Polio Último caso en América 1991 (Perú) • Meningitis Viral Estudio brotes Diarreas agudas con diferentes etiologías: • Vigilancia Rotavirus Hospitales centinelas (V, VIII, RM) MINSAL-OPS • Vigilancia Gastroenteritis virales (Norovirus, ADV, Astrovirus, Rotavirus): – Centinelas ambulatorios – Estudio Brotes Nombre exámen / Prestación Método Tipo de muestra Requisitos previos Volumen de muestra Transporte y conservación Plazo de respuesta en días hábiles Deposición: envase estéril, tapa rosca. sin medio de transporte Aislamiento Aislamiento LCR: envase estéril, 0-5 días de de en cultivos tapa rosca. evolución Enterovirus celulares Liq.pericárdico: envase estéril tapa rosca Deposición: Congelar (-18º 1 cuch. de té a -20ºC) o LCR o Líq refrigerar (2º a Pericard: 1 8ºC) con envio ml ped inmediato 2 ml adulto 15 Vigilancia Aislamiento Poliovirus en cultivos (sospechos celulares os PFA) Congelar (-18º 10 grs. (1 a -20ºC) y cuch. de té) enviar en frío 2º a 8ºC. . 15 Deposición sin medio de transporte en 0-14 días de envase estéril tapa evolución rosca Vigilancia de Virus * Deposición sin * 0-3 días de Gastroenteri medio de transporte en evolución en cos: Inmunoquím envase esteril tapa niños menores 5 10 grs. (1 Adenovirus ica y RT-PCR rosca . años : cuch. de té) entéricos, **5 a 10 muestras por Centinelas Astrovirus, Brotetificado) ambulatorios Norovirus y otros Técnicas Vigilancia Serológicas Deposición sin medio Rotavirus Inmunoenzi de transporte, envase (Centros máticas esteril tapa rosca Centinelas) ytipificación 0-5 días de evolución en niños, hasta 5 años de edad, hospitalizados Congelar (-18º a -20ºC) y enviar en frío 2º a 8ºC. . 21 Congelar (-18º 10 grms. (1 a -20ºC) y cuch. de té) enviar en frío 2º a 8ºC. . 21 Virus Respiratorios • Vigilancia Virus Respiratorios : ADV, VRS, PI , Metapneumovirus) e Influenza A y B – IRAG complicación frecuente de la Influenza – Red Lab. Hosp. Centinelas IFI – Red Lab. Regionales PCR – Centro Nacional Influenza para OMS Aislamientos Recepción hasta 12:00 hrs por tipo procesamiento Nombre exámen / Prestación Método Aislamiento Aislamiento de Influenza en cultivos AyB celulares Aislamiento Virus Respiratorio Sincicial , Adenovirus, Parainfluenza Inmunofluorescencia Indirecta para Virus Influenza A, B Aislamiento en cultivos celulares Tipo de muestra a) Gargarismo b) Aspirado ANF Máximo 3 días de c) Tórula con evolución secreción NF d) Biopsia tejidos a) ANF b) Tórula secreción NF c) Biopsia tejidos Hasta 5 días de d )ADV: Tórula evolución secreción conjuntival Inmunofluore Frotis fijado scencia Aspirado NF PCR para Influenza A, B PCR Requisitos previos Aspirado nasofaríngeo o tórula secreción nasofaríngea o biopsia pulmón Hasta 3 días de evolución Otros VR :Hasta 5 días de evolución Hasta 3 días desde inicio de los síntomas Volumen de Transporte y muestra conservación Medio transporte viral Hanks´s 0,5% gelatina +antibiótico en frío c/refrigerante s T° 2 – 8 C Medio transporte viral Hanks´s 0,5% gelatina +antibiótico en frío c/refrigerante s T° 2 – 8 C Plazo de respuesta en días hábiles 15 15 En frío con refrigerantes. T° 2-8°C 3 Medio transporte viral Hanks´s 0,5% gelatina c/antibiótico c/refrigerante s T° 2 - 8 C 5 Virus Exantemáticos • Vigilancia Integrada Sarampión-Rubéola: • Pacientes con exantema macular que puede ser acompañado de fiebre, conjuntivitis, artralgia, linfoadenopatías , etc • SRC malformaciones congénitas (1er trimestre embarazo) Recomendaciones: – Muestra para aislamiento ideal Aspirado – En su defecto, orina: mínimo 50 ml, enviar siempre junto a la muestra de suero. • Otras: CMV, Herpes Nombre exámen / Prestación Método Requisitos Tipo de muestra previos Volumen Volumen de de muestra muestra adulto pediátrica Suero extraído 1 ml en forma estéril Enviar ELISA, IF, 2 ml suero. suero. enviar en tubo muestras con aislamiento, ANF en ANF en estéril tapa formulario de Vigilancia Sarampión RT-PCR medio de medio de rosca. En casos vigilancia con la Rubeola (según transport transporte seleccionados totalidad de los e viral o viral o 50 algoritmo ANF antecedentes ISP) 50 ml ml orina (Orina a solicitados orina solicitud) Estudio Inmunidad Sarampión Vigilancia Síndrome Rubeola Congénita . Suero extraído Inmunofluor en forma estéril escencia enviar en tubo No tiene (IF) (IgG) estéril tapa rosca ELISA IgM (algoritmo ISP) Serología IgG RubéolaELISA IgG Suero en tubo estéril tapa rosca . Suero, en tubo estéril tapa rosca . 1 ml 2 ml Recién nacidos 1 ml de < 1 año suero 1 ml de suero 3 ml suero Transporte y conservación Plazo de respue sta en días hábile s Aspirado con medio de transporte viral Hanks´s con 0,5% gelatina mas antibiótico. Enviar con unidades refrigerantes Tº 2-8ºC. 4 En frío Tº 2-8ºC. Con unidades refrigerantes 5 En frío Tº 2-8ºC. Enviar con unidades refrigerantes En frío Tº 2-8ºC. Enviar con unidades refrigerantes 10 10 Nombre exámen / Prestación Requisitos previos Método Tipo de muestra ELISA Suero en tubo estéril tapa rosca . Estudio transplante Serología IgM Citomegalovirus ELISA suero, en tubo estéril tapa rosca. IgM recién nacidos < 3 meses con Síndrome de TORCH Aislamiento de Citomegalovirus Orina,Recolecciò Aislamiento n: segundo 24 horas de en cultivos chorro. Envase evolución celulares estéril, tapa hermética Aislamiento Herpes Simplex a) LCR en tubo estéril tapa rosca o de goma b) Contenido Aislamiento vesicular en cultivos De 0- 2 días (Líquido de celulares lesión) c) Tórula Secreción Vaginal Serología IgG CITOMEGALOVIRUS Aislamiento Aislamiento de Virus Tórula de lesión en cultivos Hasta 3 días Varicela Zoster vesicular celulares Volumen de Volumen de Transporte y muestra muestra conservación pediátric adulto a Plazo de respu esta en días hábile s En frío Tº 2-8ºC. Enviar con unidades refrigerantes 10 1 ml de suero En frío Tº 2-8ºC. Enviar con unidades refrigerantes 10 3 ml 3 ml Refrigerar sin medio de transporte viral 21 LCR: 1 ml Con medio de transporte viral Hanks´s con 0,5% gelatina mas antibiótico. Enviar con refrigerantes T° 2–8C 7 En frío Tº 2-8ºC. Enviar con unidades refrigerantes 15 1 ml de suero LCR: 1 ml 3 ml suero SIDA • Enfermedad causada por VIH: Confirmación de muestras reactivas al tamizaje en el país Verificar clave en CI • Diagnostico SIDA pediátrico (< 2 años) Recepción lu a Ju por tipo procesamiento • Estudios Genotipificación, FRVIH http://formularios.ispch.cl NOMBRE DE LA PRESTACIÓN ENSAYOS TIPO DE MUESTRA REQUISITOS PREVIOS CRITERIO DE VOLUMEN ACEPTACION, MUESTRA ALMACENAMIENTOTRANSPORTE PLAZO DE RESPUESTA (DIAS HABILES) Suero o plasma: En frío Tº 2 - 8ºC. Enviar Determinación * Suero o plasma con unidades de Ag HIV (Técnicas Técnicas Muestra refrigerantes. Ac IgG anti HIV serológicas) serológic doblemente 12 días, VIH ADULTO as: 1 ml * Sangre con reactiva al Sangre con 90,6% año CONFIRMACION Ácidos Técnicas anticoagulante tamizaje de VIH anticoagulante: 2013) nucleicos: EDTA (téc. molecula Temperatura ambiente provirus y res: 4 ml moleculares) (15-25 ºC) no más de RNA de HIV 48 hrs desde la extracción. Detección de AntígenoSangre con VIH PEDIATRICO anticuerpo virus anticoagulante CONFIRMACION VIH, Ag P24, EDTA virus VIH (PCR , RNA) En > 2 años a solicitud. En <2 años, hijos de madres VIH (+), protocolo 4 ml diagnóstico de sida pediátrico (Resolución Minsal). Temperatura ambiente (15-25 ºC) no más de 48 horas desde la extracción. 14 DOCUMENTO REQUERIDO Formulario de envío de muestra para Confirmación de VIH Formulario de envío de muestra para Confirmación de VIH pediátrico Virus Hepáticos Detección hepatitis virales: HBsAg, VHC: Hepatitis que pueden evolucionar a cronicidad, cirrosis y carcinoma hepático. Confirmación Muestras reactivas al tamizaje http://formularios.ispch.cl/Extern o/FormularioExterno.aspx Estudio de brotes Hepatitis A: (3 a 5 casos). Hepatitis de transmisión entérica, no desarrollan infección crónica. Nombre exámen / Prestación Método Tipo de muestra ConfirmaciónELISA, Suero en tubo Antígeno de neutralización estéril tapa rosca Superficie (según de goma Hepatitis B algoritmo ISP) ELISA, RTConfirmaciónPCR, de Virus Inmunoblot Hepatitis C (según Algoritmo) Vigilancia brotes de Hepatitis A ELISA (IgM) Volumen de Requisitos previos muestra pediátrica Muestra con tamizaje o 1 ml doblemente reactivo a HBsAg Volume Transporte y n de muestra conservación adulto 3 ml En frío Tº 28ºC. Enviar con unidades refrigerantes En frío Tº 28ºC. Enviar Plasma con con unidades anticoagulante refrigerantes. 3 ml de 5 ml (EDTA) o Sangre Sangre no más Muestra sangre sangre con EDTA (enviar de 24 hrs. Doblemente (EDTA) y 1 (EDTA) y desde la dentro de 24 hrs. reactiva a Ac-VHC. ml de 3 ml ). En tubo estéril extracción plasma plasma tapa rosca o de hasta la goma recepción en el laboratorio Suero en tubo 0-10 días desde 1 ml de estéril tapa rosca . inicio los síntomas suero 3 ml suero En frío Tº 28ºC. Enviar con unidades refrigerantes Plazo de respuest a en días hábiles 15 15 7 Virus Enf. Emergentes: Hantavirus Enf. Febril que puede producir SCPH compromiso respiratorio y evolucionar a shock y muerte. Transmitido por O. longicaudatus (*) Recepción 24 horas • Virus Dengue : Enf febril aguda con cefalea, mialgias, erupción , etc transmitida por Aedes aegypti Vigilancia y casos importados • Virus Nilo Occidental Enf febril con manifestaciones neurológicas como cefalea a encefalitis. El vector mosquitos (Culex pipiens), se mantiene en la naturaleza mediante un ciclo de transmisión mosquito-ave-mosquito Nombre exámen / Prestación Método Tipo de muestra Requisitos previos a)Sangre con EDTA (tubo tapa lila) y Sangre sin ELISA, RT- anticoagulante (tubo PCR tapa roja) Vigilancia Infección Caso (según sospechoso por Hantavirus algoritmo b)Tejido de pulmón del ISP) en tubo estéril tapa rosca, sin presevantes. (punción cardiaca) Volumen Volumen de Transporte y de muestra muestra conservación adulto pediátrica 3 ml de sangre 5 ml sangre En frío Tº 2 8ºC. Enviar con unidades refrigerantes 3 ml En frío con refrigerantes. T° 2 -8°C Plazo respues ta ds hábiles 3 Con 6 o más días de evolución. * ELISA *Aislamient Suero extraído en Identificaciòn Vigilancia Dengue / o/ PCR forma estéril. En tubo Brote 2 ml Fiebre Amarilla (según estéril tapa rosca . muestra algoritmo dentro de los del ISP) 3 primeros días de evolución Técnicas LCR y Suero en Vigilancia Virus del Serológicas tubo estéril tapa Nilo Occidental rosca . ELISA 1 ml En frío de 2 -8 3 ml suero > a 8 días de suero y 1 ºC con y 2 ml de evolución. ml de unidades LCR LCR refrigerantes 10 10 Virus Oncogénicos, otros • Vigilancia HTLV I/II (Virus linfotrópico de células T humano) Confirmar muestras reactivas tamizaje país y casos sospecha de Leucemia Linfotrópica y Paraparesia Espástica http://formularios.ispch.cl/Externo/Form ularioExterno.aspx • Diagnóstico y estudios Virus Papiloma Humano : El VPH puede causar verrugas genitales y ciertos cánceres (CaCu). • Estudio brotes Parotiditis : infección aguda con aumento volumen glándula parótida. gp46 HTLV-I 9 5 CELLULAR RECEPTOR k d Tax (p40), Rex (p27,p21) HTLV-I p14 Nombre exámen / Prestación Método Tipo de muestra Requisitos previos Confirmación HTLV I/II Muestra Doblemente reactiva y casos de ELISA , IF, Sangre con PCR (según anticoagulante sospecha de algoritmo) (EDTA o citrato) Leucemia Linfotrópica y Paraparesia Espástica Volumen de Volumen Transporte y muestra de muestra conservación pediátric adulto a 3ml 5 ml En frío Tº 2-8ºC. Enviar con unidades refrigerantes. No más de 4 ds. desde extracción a la recepción en laboratorio Estudio de Brotes de Serología, Parotiditis PCR En frío de 2 a 8 ºC con unidades 1 ml Suero o plasma Sólo estudio de 3 ml suero refrigerantes. No suero y 3 y Orina en tubo brote según y 3 ml de más de 4 ds. ml de estéril circular MINSAL orina desde extracción orina a la recepción en laboratorio Virus Papiloma Humano (VPH) Tórula de lesión o raspado de zona sospechosa de infección genital / Biopsias de tejidos / condiloma ; tubo estéril tapa rosca con medio de transporte. PCR En frío de 2 a 8 ºC con unidades refrigerantes. No más de 4 ds. desde extracción a la recepción en laboratorio Plazo de respu esta en días hábil es 15 7 10 RABIA • Sd neurológico agudo (encefalitis ) que progresa a coma , insuficiencia respiratoria y muerte. Pacientes con antecedentes contacto con animal sospechoso. •Estudio de inmunidad en mascotas . •Vigilancia virus Rábico: Animales sospechosos: murciélagos, perros, gatos (*) Recepción 24 horas •Caracterización antigénica para determinar variantes virales circulantes Recomendaciones: Cumplir normas de transporte, bioseguridad • Diagnóstico de Rabia en humanos NOMBRE DE LA TIPO DE MUESTRA PRESTACIÓN REQUISITOS PREVIOS Sangre s/anticoagulante, o suero en un tubo INMUNIDA plástico estéril con D PARA tapa rosca o tapón RABIA de goma. ESTUDIO En caso de sospecha de rabia humana (*) Animal VIRUS RABICO En caso de VIGILANCI sospecha de rabia A humana (*) VOLUMEN MUESTRA ADULTO PEDIATRICO 30 días después de 2 ml de la sangre o 1 vacunación ml suero antirrábica. Sospecha No Aplica de rabia. * Ver siguiente tabla PLAZO DE DESCRIPCION DE ALMACENAMIENTOTRAN RESPUESTA PRESTACION SPORTE (DIAS HABILES) <8ºC. Enviar con unidades refrigerantes. <8ºC. Enviar con unidades refrigerantes. 12 Detección de Ac antirrábicos neutralizantes por la tecnica de inhibición de focos fluorescentes (RIFFT) 5 Detección de Ag rábico por la técnica de inmunofluorescenci a directa Muestras para diagnóstico en caso sospecha de encefalitis rábica en humanos Muestras antemortem (anticuerpos, antígeno y ácidos nucleícos) Muestra Suero (3 ml) LCR Condiciones de envío 4ºC /-20ºC 4ºC /-20ºC (1 a 2 ml) Saliva (1-2ml) Biopsia nuca, Folículo piloso Congelada-20ºC Congelada-20ºC Técnica Detección Frecuencia Anticuerpos 2 veces por semana RIFFT Anticuerpos 2 veces por semana RT-PCR Nested Ácidos nucleicos RT-PCR Nested Ácidos nucleicos IFD Antígeno RIFFT RT-PCR Nested Ácidos nucleicos Muestras postmorten (antígeno y ácidos nucleícos) Biopsia: cerebro: Corteza cerebral, Cuerpo calloso, Cerebelo, Médula espinal Diariamente 2 veces por semana Factores a revisar: • Demora en envío de las muestras desde laboratorio • Cumplir indicaciones de envío (BS, envase, Tº). Muestras sin refrigerantes recibidas fuera de rango Tº indicado causal de rechazo • Identificación correcta del paciente • Formulario indicado y vigente • Completar antecedentes del formulario: – – – – – – Fecha obtención muestra Inicio síntomas (ds evolución) Resultados exámenes solicitados (Ej. Absorbancias) Vacunas (Ej: Polio) Correo @ de responsable envío Etc. • Diferencias entre el código del tubo y del antecedente. • Volumen de muestra solicitado • Estafeta Acreditado: El retiro de resultado no siempre es periódico Gracias