Resumen de formulación inorgánica H2 O2 H2O
Anuncio
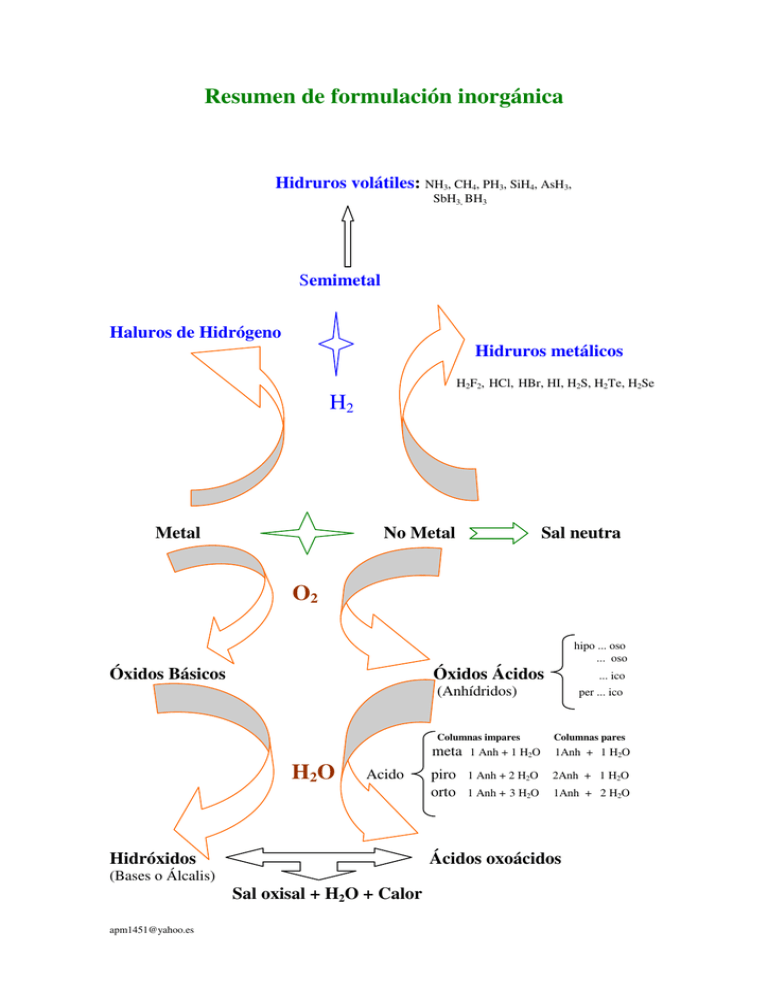
Resumen de formulación inorgánica Hidruros volátiles: NH3, CH4, PH3, SiH4, AsH3, SbH3, BH3 Semimetal Haluros de Hidrógeno Hidruros metálicos H2F2, HCl, HBr, HI, H2S, H2Te, H2Se H2 Metal No Metal Sal neutra O2 hipo ... oso ... oso Óxidos Básicos Óxidos Ácidos H 2O Acido Hidróxidos (Anhídridos) per ... ico Columnas impares Columnas pares meta 1 Anh + 1 H2O 1Anh + 1 H2O piro orto 1 Anh + 2 H2O 2Anh + 1 H2O 1 Anh + 3 H2O 1Anh + 2 H2O Ácidos oxoácidos (Bases o Álcalis) Sal oxisal + H2O + Calor [email protected] ... ico Valencias más frecuentes I II a b a III b IV a b a V b VI a b a VII b a VIII b H a Fe Li Be B C N(1, 2, 4) O(2) F(1) Co Na Mg Al Si(4) P S Cl Ni K Cu(2) Ca Zn Ga Ge As Se Br Rb Ag Sr Cd In(1) Sn Sb Te I Cs Au(3) Ba Hg(1) Tl(1) Pb Bi Fr NH b Ra 1 (2, 3 : 4, 5, 6) Cr 2 3 2,4 Os Ir + 4 3,5 2,4,6 (2, 3 : 4, 6, 7) Pt Mn 1,3,5,7 Óxidos especiales: Hiperóxidos (o superóxdos): Se forman con el O 2 y tienen el doble número de Ox. que la valencia del metal.pe.: KO2, NaO2, CaO2, ... − Ozónidos: Se forman con el O 3 . Tienen el triple de oxígenos que la valencia del metal: KO3, − RbO3, CsO3, ... −2 Peróxidos: Se forman con el O 2 . El Oxígeno actua con valencia -1. Na2O2, H2O2, BaO2, ... Óxidos dobles: Se forman con la agrupación de 2 ó más óxidos: FeO + Fe2O3 → Fe3O4 Tetraóxido de trihierro, Óxido de hierro (II y III), Oxido ferroso-férrico (magnetita) Ácidos Polihidratados Valencias impares Meta: 1 Anhídrido + 1 H2O Piro: 1 Anhídrido + 2 H2O Orto: 1 Anhídrido + 3 H2O Meta: Piro: Orto: Valencias pares 1 Anhídrido + 1 H2O 2 Anhídrido + 1 H2O 1 Anhídrido + 2 H2O Peroxoácidos: Se forman con 1 anhídrido + H2O2 Tioácidos: Cuando se substituye uno o más oxígenos por otros tantos átomos de azufre. Diácidos: Se multiplica el ácido por 2, y se resta 1 H2O Triácidos: Se multiplica el ácido por 3, y se restan 2 H2O, ... Sales binarias: Ácido Ácido ... hídrico Sales terciarias: Ácido Hipo ... oso oso ico per ... ico [email protected] Sal ... uro ... Sal Hipo ... ito ito ato per ... ato 2,3 2,4





