FORMULACIÓN Y NOMENCLATURA INORGÁNICA.− Ideas Generales:
Anuncio
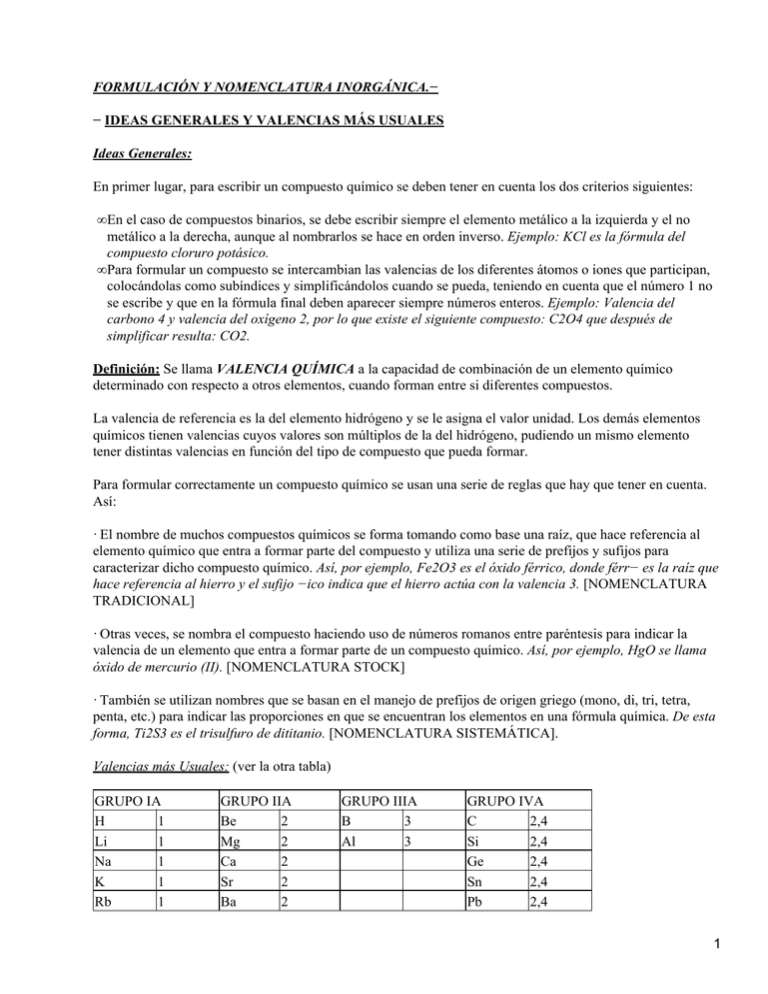
FORMULACIÓN Y NOMENCLATURA INORGÁNICA.− − IDEAS GENERALES Y VALENCIAS MÁS USUALES Ideas Generales: En primer lugar, para escribir un compuesto químico se deben tener en cuenta los dos criterios siguientes: • En el caso de compuestos binarios, se debe escribir siempre el elemento metálico a la izquierda y el no metálico a la derecha, aunque al nombrarlos se hace en orden inverso. Ejemplo: KCl es la fórmula del compuesto cloruro potásico. • Para formular un compuesto se intercambian las valencias de los diferentes átomos o iones que participan, colocándolas como subíndices y simplificándolos cuando se pueda, teniendo en cuenta que el número 1 no se escribe y que en la fórmula final deben aparecer siempre números enteros. Ejemplo: Valencia del carbono 4 y valencia del oxígeno 2, por lo que existe el siguiente compuesto: C2O4 que después de simplificar resulta: CO2. Definición: Se llama VALENCIA QUÍMICA a la capacidad de combinación de un elemento químico determinado con respecto a otros elementos, cuando forman entre si diferentes compuestos. La valencia de referencia es la del elemento hidrógeno y se le asigna el valor unidad. Los demás elementos químicos tienen valencias cuyos valores son múltiplos de la del hidrógeno, pudiendo un mismo elemento tener distintas valencias en función del tipo de compuesto que pueda formar. Para formular correctamente un compuesto químico se usan una serie de reglas que hay que tener en cuenta. Así: · El nombre de muchos compuestos químicos se forma tomando como base una raíz, que hace referencia al elemento químico que entra a formar parte del compuesto y utiliza una serie de prefijos y sufijos para caracterizar dicho compuesto químico. Así, por ejemplo, Fe2O3 es el óxido férrico, donde férr− es la raíz que hace referencia al hierro y el sufijo −ico indica que el hierro actúa con la valencia 3. [NOMENCLATURA TRADICIONAL] · Otras veces, se nombra el compuesto haciendo uso de números romanos entre paréntesis para indicar la valencia de un elemento que entra a formar parte de un compuesto químico. Así, por ejemplo, HgO se llama óxido de mercurio (II). [NOMENCLATURA STOCK] · También se utilizan nombres que se basan en el manejo de prefijos de origen griego (mono, di, tri, tetra, penta, etc.) para indicar las proporciones en que se encuentran los elementos en una fórmula química. De esta forma, Ti2S3 es el trisulfuro de dititanio. [NOMENCLATURA SISTEMÁTICA]. Valencias más Usuales: (ver la otra tabla) GRUPO IA H 1 Li 1 Na 1 K 1 Rb 1 GRUPO IIA Be 2 Mg 2 Ca 2 Sr 2 Ba 2 GRUPO IIIA B 3 Al 3 GRUPO IVA C 2,4 Si 2,4 Ge 2,4 Sn 2,4 Pb 2,4 1 Cs 1 GRUPO VA N 1,2,3,4,5 P 1,3,5 As 1,3,5 Sb 1,3,5 Bi 1,3,5 Ra 2 GRUPO VIA O 2 S 2,4,6 Se 2,4,6 Te 2,4,6 ELEMENTOS DE TRANSICIÓN Cu 1,2 Zn 2 Ag 1 Cd 2 Au 1,3 Hg 1,2 Ti 2,3,4 Mn 2,3,4,5,6,7 Cr 2,3,4,5,6 V 2,3,4,5 GRUPO VIIA F 1 Cl 1,3,5,7 Br 1,3,5,7 I 1,3,5,7 Fe Co Ni 2,3 2,3 2,3 Pd Pt 2,4 2,4 − Compuestos Binarios del Hidrógeno: HIDRUROS Son las combinaciones del elemento hidrógeno con otro elemento distinto, donde el hidrógeno siempre actúa con valencia 1. Dependiendo de la naturaleza de este último elemento, tendremos dos tipos de hidruros: a) Hidruros de un metal El nombre tradicional es el de hidruro del metal y se utilizan los sufijos −oso e −ico para la menor y la mayor valencia del metal, respectivamente. En el caso de que el metal sólo tenga una valencia se suele utilizar la terminación −ico para hacer referencia a dicho metal Se pueden utilizar también los nombres derivados del uso de la valencia con números romanos entre paréntesis o la que indica la proporción de cada elemento mediante prefijos. La fórmula general de esta combinación es: Me1 Hx Ejemplos: • NiH3: Hidruro niquélico, trihidruro de níquel o hidruro de níquel (III). • CaH2: Hidruro cálcico o dihidruro de calcio • NaH: Hidruro sódico • FeH2: Hidruro ferroso o dihidruro de hierro o hidruro de hierro (II) • PtH4: Hidruro platínico o tetrahidruro de platino o hidruro de platino (IV) • PbH2: Hidruro plumboso o dihidruro de plomo o hidruro de plomo (II) • AlH3: Hidruro alumínico o trihidruro de aluminio b) Hidruros de un no metal En la nomenclatura tradicional, los hidruros de los elementos de los grupos VIA (S, Se, Te) y VIIA (F, Cl, Br, I) se denominan HIDRÁCIDOS y se nombran empleando la palabra ácido seguida de la raíz del no metal y la terminación −hídrico. Se emplea esta denominación siempre que el hidruro esté en disolución acuosa, pues es cuando aparecen sus propiedades ácidas. Se denominan ácidos hidrácidos. 2 De forma general, la manera más utilizada de nombrar estos compuestos es colocar al sufijo −uro a la raíz del no metal seguido del prefijo mono−,di−,tri−,etc., delante de la palabra hidrógeno, para indicar el número de átomos de hidrógeno que intervienen, aunque ello suele omitirse a veces. La fórmula general de esta combinación es: Hx NoMe1 El no metal utiliza por norma general su menor valencia. NOTA: No obstante, para algunos hidruros se sigue utilizando el nombre tradicional. Excepto para el agua, la fórmula general es: NoMe1 Hx Agua: H2O; Amoniaco: NH3; Fosfina: PH3; Metano: CH4 Silano: SiH4; Arsina: AsH3; Estibina: SbH3; Borano: BH3 Ejemplos: Nombre en disolución acuosa Nombre General − HF: Ácido fluorhídrico Fluoruro de hidrógeno − HCl: Ácido clorhídrico Cloruro de hidrógeno − HBr: Ácido Bromhídrico Bromuro de hidrógeno − HI: Ácido Yodhídrico Ioduro de hidrógeno − H2S: Ácido sulfhídrico Sulfuro de hidrógeno Ejemplos: Nombre Tradicional Nombre General − NH3: Amoniaco Trihidruro de nitrógeno − PH3: Fosfina o fosfamina Trihidruro de fósforo − CH4: Metano Tetrahidruro de carbono − SiH4: Silano Tetrahidruro de silicio (RESOLVER LOS EJERCICIOS PROPUESTOS) EJERCICIOS PROPUESTOS. HIDRUROS FORMULAR NOMBRAR CH4 H2Se FeH3 HBr(ácido) MgH2 3 PbH2 AlH3 HCl(ácido) H2Te CuH RbH CdH2 LiH FeH2 NH3 SnH4 AuH PtH2 H3Sb H3P HI(ácido) HBr AgH CuH2 H2S Ácido clorhídrico Hidruro de cobre (II) Hidruro de potasio Tetrahidruro de platino Trihidruro de boro Hidruro niquélico Sulfuro de hidrógeno Hidruro ferroso Hidruro cobáltico Hidruro de oro (I) Hidruro plúmbico Ácido fluorhídrico Dihidruro de estroncio Trihidruro de antimonio Hidruro áurico Hidruro cúprico Hidruro estannoso Cloruro de hidrógeno Ácido sulfhídrico Amoniaco Metano Seleniuro de hidrógeno 4 Teleniuro de hidrógeno Hidruro de hierro (III) Hidruro plumboso Hidruro mercurioso Hidruro de aluminio − Combinaciones Binarias de un Metal con un No Metal: SALES BINARIAS Como su propio nombre indica, estos compuestos están formados por dos elementos: uno metálico y el otro no metálico. En estos compuestos, el símbolo del metal se escribe en primer lugar y, a continuación, el símbolo del no metal. En las sales binarias, el no metal, al igual que lo hace con las combinaciones con el hidrógeno, siempre utiliza su menor valencia y se nombra con la terminación −uro. La fórmula general de esta combinación es: Mex NoMey Ejemplos: • FeCl3: Cloruro férrico o tricloruro de hierro o cloruro de hierro (III). • FeCl2: Cloruro ferroso o dicloruro de hierro o cloruro de hierro (II). • NaCl: Cloruro sódico (no se usa −−> monocloruro de sodio) • AuBr: Bromuro auroso o monobromuro de oro o Bromuro de oro (I). • AuBr3: Bromuro áurico o tribromuro de oro o Bromuro de oro (III). • CoS: Sulfuro cobaltoso o monosulfuro de cobalto o sulfuro de cobalto (II). • Co2S3: Sulfuro cobáltico o trisulfuro de dicobalto o sulfuro de cobalto (III). • PbS: Sulfuro plumboso o monosulfuro de plomo o sulfuro de plomo (II) • PbS2: Sulfuro plúmbico o disulfuro de plomo o sulfuro de plomo (IV). (RESOLVER LOS EJERCICIOS PROPUESTOS) EJERCICIOS PROPUESTOS. SALES BINARIAS FORMULAR NOMBRAR NaBr BaF2 NiCl2 CuCl2 SrS NH4Cl Cs2S KI AgBr NiCl3 MnF3 ZnSe PdSe 5 HgS PbCl4 K2S BeSe FeF2 Al2Se3 SnI2 Rb2S Fr3Sb FeCl2 Mg3N2 SnSe2 Dicloruro de zinc Seleniuro sódico Sulfuro ferroso Ioduro de calcio Difluoruro de magnesio Seleniuro de berilio Cloruro cúprico Ioduro estánnico Cloruro potásico Seleniuro de aluminio Sulfuro de zinc Cloruro de Rubidio Cloruro ferroso Bromuro mercurioso Fluoruro ferroso Nitruro magnésico Seleniuro estánnico Cloruro férrico Ioduro cobaltoso Arseniuro de cadmio Bromuro niqueloso Antimoniuro áurico Seleniuro platínico Nitruro bórico Fluoruro de francio Fosfuro de aluminio Bromuro platínico − Combinaciones Binarias del Oxígeno: ÓXIDOS 6 Son combinaciones del oxígeno con otro elemento de la tabla periódica, donde el oxígeno actúa siempre con la valencia 2. pueden ser de dos tipos: a) Óxidos de un metal Estos óxidos se nombran de forma totalmente análoga a los hidruros metálicos, sustituyendo la palabra hidruro por óxido, es decir: El nombre tradicional es el de óxido del metal y se utilizan los sufijos −oso e −ico para la menor y la mayor valencia del metal, respectivamente. En el caso de que el metal sólo tenga una valencia se suele utilizar la terminación −ico para hacer referencia a dicho metal Se pueden utilizar también los nombres derivados del uso de la valencia con números romanos entre paréntesis o la que indica la proporción de cada elemento mediante prefijos. La fórmula general de esta combinación es: Me2 Ox Ejemplos: • FeO: Óxido ferroso o monóxido de hierro o óxido de hierro (II) • Fe2O3: Óxido férrico o trióxido de dihierro o óxido de hierro (III) • Cu2O: Óxido cuproso o óxido de dicobre o óxido de cobre (I) • CuO: Óxido cúprico o monóxido de cobre o óxido de cobre (II) • HgO: Óxido mercúrico o monóxido de mercurio o óxido de mercurio (II) • CaO: Óxido cálcico o óxido de calcio b) Óxidos de un no metal (anhídridos) Puesto que hay elementos no metálicos que pueden actuar con 4 valencias distintas, los nombres tradicionales usan el sistema de prefijos y sufijos siguiente: Prefijo Sufijo Valencia: hipo− −oso −oso de menor a −ico mayor per− −ico En el caso de elementos no metálicos con tres valencias, se utilizan las tres primeras combinaciones, y en el caso de elementos con sólo dos valencias no se emplea el sistema de prefijos. La fórmula general de esta combinación es: NoMe2 Ox Ejemplos: • Cl2O: Óxido de dicloro o óxido de cloro (I) o anhídrido hipocloroso • Cl2O3: Trióxido de dicloro o óxido de cloro (III) o anhídrido cloroso • Cl2O5: Pentaóxido de dicloro o óxido de cloro (V) o anhídrido clórico • Cl2O7: Heptaóxido de dicloro o óxido de cloro (VII) o anhídrido perclórico 7 • SO: Monóxido de azufre o óxido de azufre (II) o anhídrido hiposulfuroso • SO2: Dióxido de azufre o óxido de azufre (IV) o anhídrido sulfuroso • SO3: Trióxido de azufre o óxido de azufre (VI) o anhídrido sulfúrico NOTA: La denominación de anhídrido esta prácticamente en desuso hoy en día. c) Otro tipo de óxidos: PERÓXIDOS Los peróxidos son combinaciones de un metal o del hidrógeno con el grupo peroxo: O2−2, y responden al conjunto −O−O−. Para nombrar estos compuestos, basta añadir el prefijo per− el nombre del óxido. La fórmula general de esta combinación es: Mex O2 Ejemplos: • H2O2: Peróxido de hidrógeno (agua oxigenada) • Na2O2: Peróxido de sodio • CaO2: Peróxido de calcio • CuO2: Peróxido de cobre (II) • K2O2: Peróxido de potasio • MgO2: Peróxido de magnesio • SrO2: Peróxido de estroncio • BaO2: Peróxido de bario Se puede observar que en estos compuestos no se puede aplicar la regla de simplificación al escribir la fórmula del mismo, pues se destruiría la agrupación de los dos átomos unidos de oxígeno, que es lo característico de los mismos. (RESOLVER LOS EJERCICIOS PROPUESTOS) EJERCICIOS PROPUESTOS. ÓXIDOS Y PERÓXIDOS FORMULAR NOMBRAR Br2O5 K2O SeO Fe2O3 ZnO P2O3 SnO Co2O3 PbO CO2 HgO Na2O K2O2 8 SnO2 Cl2O5 SrO2 MgO2 CuO SO3 Li2O N2O5 P2O3 PtO2 BeO Al2O3 Dióxido de carbono Dióxido de manganeso Anhídrido fosfórico Monóxido de mercurio Óxido de yodo (VII) Óxido plúmbico Óxido de azufre (IV) Peróxido de potasio Anhídrido hipobromoso Peróxido de sodio Óxido de sodio Anhídrido sulfuroso Óxido de magnesio Óxido de boro (III) Óxido plumboso Óxido de carbono (II) Óxido de litio Monóxido de nitrógeno Óxido de calcio Pentaóxido de dicloro Óxido de platino (IV) Óxido de estroncio Anhídrido arsenioso Anhídrido perclórico Anhídrido sulfuroso Anhídrido fosforoso Peróxido de hidrógeno − Combinaciones Ternarias de Hidrógeno, Metal y Oxígeno: HIDRÓXIDOS 9 Son compuestos formados por la unión de un metal con el ión hidroxilo: OH−, que actúa en su conjunto con valencia igual a 1. La fórmula general de esta combinación es: Me1 (OH)x Ejemplos: • Cu(OH)2: Hidróxido de cobre (II) o hidróxido cúprico o dihidróxido de cobre • Cu(OH): Hidróxido de cobre (I) o hidróxido cuproso o monohidróxido de cobre • Na(OH): Hidróxido de sodio • Ca(OH)2: Hidróxido de calcio o dihidróxido de calcio • Fe(OH)2: Hidróxido de hierro (II) o hidróxido ferroso o dihidróxido de hierro • Fe(OH)3: Hidróxido de hierro (III) o hidróxido férrico o trihidróxido de hierro • Cd(OH)2: Hidróxido de cadmio o dihidróxido de cadmio • Pt(OH)4: Hidróxido de platino (IV) o hidróxido platínico o tetrahidróxido de platino • Ag(OH): Hidróxido de plata • Co(OH)2: Hidróxido de cobalto (II) o hidróxido cobaltoso o dihidróxido de cobalto • NH4OH: Hidróxido de amonio El hidróxido de amonio NH4OH está formado por la combinación del catión amonio NH4+ y el anión hidroxilo OH−. (RESOLVER LOS EJERCICIOS PROPUESTOS) EJERCICIOS PROPUESTOS. HIDRÓXIDOS FORMULAR NOMBRAR Au(OH) Ca(OH)2 Hg(OH)2 Pt(OH)4 K(OH) Rb(OH) Ba(OH)2 Sr(OH)2 Cu(OH)2 Al(OH)3 Sn(OH)4 Cu(OH) Cs(OH) Zn(OH)2 Be(OH)2 Ra(OH)2 Pb(OH)4 Pb(OH)2 Sr(OH)2 Cd(OH)2 10 Fe(OH)2 Fe(OH)3 Cs(OH) Fr(OH) Ag(OH) Hidróxido sódico Hidróxido de hierro (II) Trihidróxido de aluminio Hidróxido ferroso Hidróxido áurico Hidróxido de magnesio Hidróxido plumboso Hidróxido de radio Hidróxido de oro (III) Hidróxido cobaltoso Hidróxido de aluminio Hidróxido platínico Hidróxido potásico Hidróxido de litio Hidróxido de berilio Hidróxido bórico Hidróxido estannoso Hidróxido férrico Hidróxido mercurioso Hidróxido cuproso Hidróxido de platino (II) Hidróxido de plata Hidróxido auroso Hidróxido plúmbico Hidróxido de cobalto (III) Hidróxido mercúrico Hidróxido cúprico − Combinaciones Ternarias de Hidrógeno, no Metal y Oxígeno: OXOÁCIDOS O ÁCIDOS OXÁCIDOS Tienen la fórmula general HxNMyOz, donde NM es no metal o un metal de transición como el cromo (Cr) o el manganeso (Mn). Para ayudar a formular se puede suponer que tiene lugar la reacción siguiente, aunque en muchos casos no ocurre en la realidad: Óxido de un no metal (anhídrido) + H2O = Oxoácido El correspondiente oxoácido se nombrará igual que el supuesto óxido de procedencia, pero cambiando la 11 palabra óxido por ácido. Ejemplos: Nombre N2O3 + H2O = HNO2 (después de simplificar) Ácido nitroso N2O5 + H2O = HNO3 (después de simplificar) Ácido Nítrico SO2 + H2O = H2SO3 Ácido sulfuroso SO3 + H2O = H2SO4 Ácido sulfúrico CO2 + H2O = H2CO3 Ácido carbónico Cl2O + H2O = HClO (después de simplificar) Ácido hipocloroso Cl2O3 + H2O = HClO2 (después de simplificar) Ácido cloroso Cl2O5 + H2O = HClO3 (después de simplificar) Ácido clórico Cl2O7 + H2O = HClO4 (después de simplificar) Ácido perclórico CrO3 + H2O = H2CrO4 Ácido crómico MnO3 + H2O = H2MnO4 Ácido mangánico Mn2O7 + H2O = HMnO4 (después de simplificar) Ácido permangánico Casos especiales: • Ácidos del P, As y Sb: A los ácidos oxácidos formados por estos elementos, se les puede sumar una, dos o tres moléculas de agua, y se utilizan entonces los prefijos: meta−, piro− y orto−. Ejemplo: +H20 HPO2 (Ácido metafosforoso) P2O3 +2H2O H4P2O5 (Ácido pirofosforoso) Anhídrido fosforoso +3H2O H3PO3 (ácido ortofosforoso) Para el As y el Sb ocurre lo mismo. • Ácidos del Mn: Las valencias del elemento manganeso son: 2, 3, 4, 6, 7 Cuando dicho elemento forma parte de un oxoácido sólo actúa con sus dos valencias mayores (6 Y 7), es decir: 12 MnO3 + H2O = H2MnO4 (Ácido mangánico) Mn2O7 + H2O = HMnO4 (Ácido permangánico) • Ácidos del Cr: Las valencias del elemento cromo son: 2, 3, 6 Cuando dicho elemento forma parte de un oxoácido sólo actúa con la valencia 6, es decir: CrO3 + H2O = H2CrO4 (Ácido crómico) 2CrO3 + H2O = H2Cr2O7 (Ácido dicrómico) (RESOLVER LOS EJERCICIOS PROPUESTOS) EJERCICIOS PROPUESTOS. OXOÁCIDOS O ÁCIDOS OXÁCIDOS FORMULAR NOMBRAR SOLUCIONES EJERCICIOS. HIDRUROS FORMULAR NOMBRAR CH4 H2Se FeH3 HBr(ácido) MgH2 PbH2 AlH3 HCl(ácido) H2Te CuH RbH Tetrahidruro de carbono Seleniuro de hidrógeno Hidruro férrico Ácido bromhídrico Hidruro de magnesio Hidruro plumboso Hidruro alumínico Ácido clorhídrico Teleniuro de hidrógeno Hidruro cuproso Hidruro de rubidio 13 CdH2 LiH FeH2 NH3 SnH4 AuH PtH2 H3Sb H3P HI(ácido) HBr AgH CuH2 H2S Hidruro de cadmio Hidruro de litio Hidruro ferroso Trihidruro de nitrógeno Hidruro estannico Hidruro auroso Hidruro de platino (II) Antimoniuro de hidrógeno Fosfuro de hidrógeno Ácido iodhídrico Bromuro de hidrógeno Hidruro de plata Hidruro cúprico Sulfuro de hidrógeno Ácido clorhídrico Hidruro de cobre (II) Hidruro de potasio Tetrahidruro de platino Trihidruro de boro Hidruro niquélico Sulfuro de hidrógeno Hidruro ferroso Hidruro cobáltico Hidruro de oro (I) Hidruro plúmbico Ácido fluorhídrico Dihidruro de estroncio Trihidruro de antimonio Hidruro áurico Hidruro cúprico Hidruro estannoso Cloruro de hidrógeno Ácido sulfhídrico Amoniaco Metano Seleniuro de hidrógeno Teleniuro de hidrógeno Hidruro de hierro (III) Hidruro plumboso Hidruro mercurioso Hidruro de aluminio HCl CuH2 KH PtH4 BH3 NiH3 H2S FeH2 CoH3 AuH PbH4 HF SrH2 SbH3 AuH3 CuH2 SnH2 HCl H2S NH3 CH4 H2Se H2Te FeH3 PbH2 HgH AlH3 14 SOLUCIONES EJERCICIOS. SALES BINARIAS FORMULAR NOMBRAR NaBr BaF2 NiCl2 CuCl2 SrS NH4Cl Cs2S KI AgBr NiCl3 MnF3 ZnSe PdSe HgS PbCl4 K2S BeSe FeF2 Al2Se3 SnI2 Rb2S Fr3Sb FeCl2 Mg3N2 SnSe2 Bromuro sódico Fluoruro de bario Cloruro niqueloso Cloruro cúprico Sulfuro de estroncio Cloruro de amonio Sulfuro de cesio Ioduro de potasio Bromuro de plata Cloruro niquélico Fluoruro de manganeso (III) Seleniuro de zinc Seleniuro de paladio (II) Sulfuro mercúrico Cloruro plúmbico Sulfuro potásico Seleniuro de berilio Fluoruro de hierro (II) Seleniuro de aluminio Ioduro estannoso Sulfuro de rubidio Antimoniuro de francio Cloruro ferroso Nitruro magnésico Seleniuro estannico Dicloruro de zinc Seleniuro sódico Sulfuro ferroso Ioduro de calcio Difluoruro de magnesio Seleniuro de berilio Cloruro cúprico Ioduro estánnico Cloruro potásico Seleniuro de aluminio Sulfuro de zinc Cloruro de Rubidio Cloruro ferroso Bromuro mercurioso ZnCl2 Na2Se FeS CaI2 MgF2 BeSe CuCl2 SnI4 KCl Al2Se3 ZnS RbCl FeCl2 HgBr 15 Fluoruro ferroso Nitruro magnésico Seleniuro estánnico Cloruro férrico Ioduro cobaltoso Arseniuro de cadmio Bromuro niqueloso Antimoniuro áurico Seleniuro platínico Nitruro bórico Fluoruro de francio Fosfuro de aluminio Bromuro platínico FeF2 Mg3N2 SnSe2 FeCl3 CoI2 Cd3As2 NiBr2 AuSb PtSe2 BN FrF AlP PtBr4 SOLUCIONES EJERCICIOS. ÓXIDOS Y PERÓXIDOS FORMULAR NOMBRAR Br2O5 K2O SeO Fe2O3 ZnO P2O3 SnO Co2O3 PbO CO2 HgO Na2O K2O2 SnO2 Cl2O5 SrO2 MgO2 CuO SO3 Li2O N2O5 P2O3 PtO2 BeO Al2O3 Anhídrido brómico Óxido potásico Anhídrido selenioso Óxido férrico Óxido de zinc Óxido de fósforo (III) Monóxido de estaño Óxido cobáltico Óxido plumboso Óxido de carbono (IV) Óxido mercúrico Óxido de sodio Peróxido de potasio Óxido estannico Anhídrido clórico Peróxido de estroncio Peróxido de magnesio Óxido cúprico Anhídrido sulfúrico Óxido de litio Óxido de nitrógeno (V) Anhídrido fosforoso Óxido de platino (IV) Óxido de berilio Óxido de aluminio 16 Dióxido de carbono Dióxido de manganeso Anhídrido fosfórico Monóxido de mercurio Óxido de yodo (VII) Óxido plúmbico Óxido de azufre (IV) Peróxido de potasio Anhídrido hipobromoso Peróxido de sodio Óxido de sodio Anhídrido sulfuroso Óxido de magnesio Óxido de boro (III) Óxido plumboso Óxido de carbono (II) Óxido de litio Monóxido de nitrógeno Óxido de calcio Pentaóxido de dicloro Óxido de platino (IV) Óxido de estroncio Anhídrido arsenioso Anhídrido perclórico Anhídrido sulfuroso Anhídrido fosforoso Peróxido de hidrógeno CO2 MnO2 P2O5 HgO I2O7 PbO2 SO2 K2O2 Br2O Na2O2 Na2O SO2 MgO B2O3 PbO CO Li2O NO CaO Cl2O5 PtO2 SrO As2O3 Cl2O7 SO2 P2O3 H2O2 SOLUCIONES EJERCICIOS. HIDRÓXIDOS FORMULAR NOMBRAR Au(OH) Ca(OH)2 Hg(OH)2 Pt(OH)4 K(OH) Rb(OH) Ba(OH)2 Sr(OH)2 Cu(OH)2 Al(OH)3 Sn(OH)4 Cu(OH) Hidróxido auroso Hidróxido de calcio Hidróxido mercúrico Hidróxido platínico Hidróxido potásico Hidróxido de rubidio Hidróxido de bario Hidróxido de estroncio Hidróxido de cobre (II) Hidróxido alumínico Hidróxido estánnico Hidróxido cuproso 17 Cs(OH) Zn(OH)2 Be(OH)2 Ra(OH)2 Pb(OH)4 Pb(OH)2 Sr(OH)2 Cd(OH)2 Fe(OH)2 Fe(OH)3 Co(OH)2 Fr(OH) Ag(OH) Hidróxido de cesio Hidróxido de zinc Hidróxido de berilio Hidróxido de radio Hidróxido platínico Hidróxido plumboso Hidróxido de estroncio Hidróxido de cadmio Hidróxido de hierro (II) Hidróxido férrico Hidróxido cobaltoso Hidróxido de francio Hidróxido de plata Hidróxido sódico Hidróxido de hierro (II) Trihidróxido de aluminio Hidróxido ferroso Hidróxido áurico Hidróxido de magnesio Hidróxido plumboso Hidróxido de radio Hidróxido de oro (III) Hidróxido cobaltoso Hidróxido de aluminio Hidróxido platínico Hidróxido potásico Hidróxido de litio Hidróxido de berilio Hidróxido bórico Hidróxido estannoso Hidróxido férrico Hidróxido mercurioso Hidróxido cuproso Hidróxido de platino (II) Hidróxido de plata Hidróxido auroso Hidróxido plúmbico Hidróxido de cobalto (III) Hidróxido mercúrico Hidróxido cúprico Na(OH) Fe(OH)2 Al(OH)3 Fe(OH)2 Au(OH)3 Mg(OH)2 Pb(OH)2 Ra(OH)2 Au(OH)3 Co(OH)2 Al(OH)3 Pt(OH)4 K(OH) Li(OH) Be(OH)2 B(OH)3 Sn(OH)2 Fe(OH)3 Hg(OH) Cu(OH) Pt(OH)2 Ag(OH) Au(OH) Pb(OH)4 Co(OH)3 Hg(OH)2 Cu(OH)2 18