Versión para imprimir - ESCUELA NACIONAL DE CIENCIAS
Anuncio

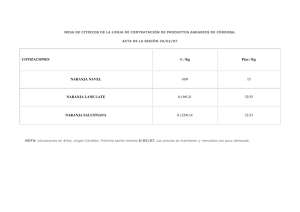
Efecto de las condiciones de cultivo sobre la biodegradación del azocolorante Naranja II en un sistema combinado anóxico/óxico. Gutiérrez, Rodríguez, Rodríguez y Barragán EFECTO DE LAS CONDICIONES DE CULTIVO SOBRE LA BIODEGRADACIÓN DEL AZOCOLORANTE NARANJA II EN UN SISTEMA COMBINADO ANÓXICO/ÓXICO. (1) Carolina Gutiérrez L, (2)Odín Rodríguez N., (3)Felipe N. Rodríguez, (4)Blanca E. Barragán Ingeniera en Sistemas Ambientales (2Laboratorio de la gestión de la calidad del aire, (3)Laboratorio de la gestión de la calidad del agua,(4)Laboratorio de la gestión de residuos peligrosos, Departamento de Ingeniería en Sistemas Ambientales. Escuela Nacional de Ciencias Biológicas. Av. Wilfredo Massieu S/N. Col Unidad Profesional Adolfo López Mateos. CP 07735 [email protected] (1) RESUMEN Durante el procesamiento de textiles, la ineficacia del teñido, conduce a la eliminación de grandes cantidades los colorantes textiles sobre las aguas de desecho de la planta. Se estima que del 10 al 15 % de los colorantes son eliminados durante los procesos de teñido, lo que causa un gran problema de contaminación ambiental. De los colorantes aplicados en la industria textil, los azocolorantes ocupan el 70% de la cantidad total utilizada. Los colorantes azo, son compuestos orgánicos recalcitrantes que requieren la combinación de procesos anaerobios y aerobios para alcanzar su completa degradación (mineralización). Con el uso secuencial de procesos anaerobios y aerobios puede lograrse la mineralización de los azocolorantes, aplicando generalmente consorcios microbianos. Existen pocos reportes que muestren la capacidad de microorganismos facultativos para mineralizar colorantes azoicos, así como el efecto de las condiciones de cultivo. En el presente trabajo, se aplicó un diseño factorial de 23 para analizar el efecto de la agitación, presencia de nutrientes y presencia de oxigeno en el medio sobre la degradación de Naranja II y el acido sulfanílico, uno de sus productos de reducción del Naranja II, por medio de Enterobacter sp. De acuerdo con los resultados, la cepa reduce el Naranja II en condiciones anóxicas pero no tiene efecto significativo sobre el Ac. sulfanílico en las mismas condiciones, que es degradado en condiciones óxicas. La presencia de nutrientes no es significativa en ninguno de las dos condiciones, lo que sugiere que Enterobacter sp. es capaz de utilizar Naranja II como única fuente de carbono y energía. Palabras clave: Enterobacter sp., azocolorantes, anóxico-oxico, diseño factorial SUMMARY During the textile processing, the inefficiency of dyeing, leads to the elimination of great amounts of textile dyes in the wastewater. It is considered that 10 to 15% of the dyes are eliminated during the dyeing processes, which causes a great problem of environmental pollution. The azodyes represent the 70% the total amount of the dyes applied in the textile industry. The azodyes, are recalcitrant organic compounds that require the combination of anaerobic and aerobic processes to reach their complete degradation (mineralization). With the sequential use of anaerobic and aerobic processes the mineralization of the azodyes can be obtained, applying generally microbial consortia. There are a few reports about the capacity of facultative microorganisms to mineralize azodyes, as well as the effect of the culture conditions. In the present work, a factorial design of 23 was applied to analyze the effect of the agitation, aeration and presence of nutrients on the degradation of Orange II and sulfanílic acid, one of its products of reduction of Orange II, by Enterobacter sp. According with the results, this strain reduces Orange II in anoxic conditions, but it does not have significant effect on the sulphanilic acid in the same conditions, which is degraded in oxic conditions. The presence of nutrients is not significant in both conditions, which suggests Enterobacter sp. is able to use Orange II as sole source of carbon and energy. Keyword: Enterobacter sp, azodyes, Orange II, anoxic-oxic, factorial design Efecto de las condiciones de cultivo sobre la biodegradación del azocolorante Naranja II en un sistema combinado anóxico/óxico. INTRODUCCIÓN Debido a la creciente explosión demográfica y lo que esto demanda, a partir de la revolución industrial, con la aparición de las maquinas, en general los recursos tanto renovables como no renovables se han visto afectados en cantidad y en calidad. Año con año se reportan valores mas bajos del agua disponible para el consumo humano, esto derivado de la contaminación a cuerpos de agua dulce tales como ríos, lagos, etc. Esto es principalmente por las descargas de aguas residuales con condiciones no controladas por parte de industrias y poblaciones enteras. Desde siempre la humanidad ha utilizado colorantes para pintar y teñir su cuerpo, pieles y ropa. Hasta a mediados del siglo XIX todos los colorantes utilizados eran de origen natural. Los colorantes naturales por su origen orgánico han adquirido a través del tiempo una gran importancia por sus múltiples utilidades especialmente con los colorantes textiles, estos son aromáticos y en su mayoría obtenidos de plantas, de insectos y de algunos hongos. La importancia de los colorantes naturales en la industria textil desapareció con el uso de los colorantes sintéticos empleados en distintas fibras. La producción de nuevas fibras textiles y de colorantes sintéticos trajo consigo problemas de salud en un pequeño porcentaje del publico usuario quien ha presentado reacciones alérgicas a las fibras y colorantes antes mencionados. Gutiérrez, Rodríguez, Rodríguez y Barragán cromóforos, termino creado en 1876 a partir de las raíces griegas chroma, “color” y foros, “soportar”. Se observó también que la presencia de algunos otros grupos daba lugar a una intensificación de color. Estos grupos fueron denominados auxocromos (del griego auxanein, “aumentar”). Actualmente sabemos que estos grupos auxocromos son entidades que no pueden experimentar transiciones pero si transiciones de electrones n. Los azocolorantes son un grupo extenso de colorantes sintéticos que se forman a partir de la anilina, todos los compuestos azo tienen la fórmula general de un colorante pero con la característica del grupo - N=N – en medio de dos anillos aromáticos: Ar-N=N-Ar. La eliminación de estos compuestos se da por dos mecanismos: Reducción: es una reacción química correspondiente a la acción de un cuerpo oxidante sobre un cuerpo reductor, que da lugar a la reducción del oxidante y a la oxidación del reductor. Al reducirse la especie química gana uno o más electrones. Mineralización: es la degradación de materia orgánica a dióxido de carbono, agua o hidrácidos, óxido o sales minerales de otros elementos existentes, que se da por la acción de los microorganismos degradadores de los ecosistemas. Durante los últimos 10 o 15 años, el uso de los colorantes sintéticos en el ámbito mundial se ha incrementado en forma casi explosiva, debido a la exigencia de su utilización en las industrias alimenticias, farmacéuticas y cosméticas establecidas por las legislaciones de los diferentes países. La reducción de los azo-colorantes se da preferentemente en condiciones anóxicas (medios sin oxígeno) y la mineralización de las aminas resultantes en condiciones óxicas (medios con oxígeno). Con el uso secuencial de procesos anaerobios y aerobios puede lograrse la mineralización de los azocolorantes, aplicando generalmente consorcios microbianos. La mayoría de los colorantes se deben a la absorción de ciertas longitudes de onda de luz visible por los compuestos orgánicos, antes de que se desarrollaran las teorías de las transiciones electrónicas, se había observado que ciertos tipos de estructuras orgánicas tendían a originar color mientras que otras no. Estas estructuras parciales necesarias para la aparición de color (que no son si no grupos insaturados capaces de experimentar transiciones o n) fueron denominas Existen pocos reportes que muestren la capacidad de microorganismos facultativos para mineralizar colorantes azoicos, así como el efecto de las condiciones de cultivo. En el presente trabajo, se aplicó un diseño factorial de 23 para analizar el efecto de la agitación, presencia de nutrientes y presencia de oxígeno en el medio sobre la degradación de Naranja II y el ácido sulfanílico, uno de los productos de reducción del Naranja II, por Revista Sistemas Ambientales, Vol. 1, No. 2, 2007 p. 40-47 medio de el Enterobacter sp. microorganismo facultativo estado físico: polvo amarillo, punto de fusión: 164 C, solubilidad en agua: soluble (116 g/l), código de identificación: salud: 1, inflamabilidad: 0, reactividad: 0. o El Naranja II es un azocolorante de formula química C16H11N2NaO4S, peso molecular: 350,32mol/gr, Estructura del Azo Colorante Naranja II Rombo de Seguridad del Azo Colorante Naranja II El mecanismo de reducción microbiológica de dicho compuesto es el siguiente: H2O Ácido sulfanílico Reducción del Azo colorante Naranja II. La medición de la amina formada en la reducción es poco viable, por lo que un método mas conveniente para medir la mineralización del azocolorante, es valorando la aparición y disminución del ácido sulfanílico. El mecanismo de mineralización del colorante a partir de su reducción y la consecuente formación de ác. sulfanílico es: H2O + H+ + CO2 + NO-3 + SO42- O2 ácido sulfanílico Mineralización del Ácido sulfanílico. Para la remoción de los colorantes en los efluentes de agua se han planteado diversas técnicas las cuales abarcan desde tratamientos fisicoquímicos como son: filtración con membrana, coagulación / floculación, precipitación, flotación, absorción, intercambio iónico, extracción por par iónico, mineralización ultrasónica, electrólisis, oxidación fotocatalítica, así como reducción química; por otra parte se encuentran las técnicas biológicas que incluyen la biosorción y biodegradación bacteriana y fúngica en tratamientos aerobios, anaerobios y anóxicos. Efecto de las condiciones de cultivo sobre la biodegradación del azocolorante Naranja II en un sistema combinado anóxico/óxico. Para el caso de los tratamientos fisicoquímicos, se debe tener otro tratamiento o realizar una disposición final del residuo, lo cual solo cambia el lugar la contaminación mas no el problema real, por lo que pueden llegar a ser demasiado costosos o no viables. (P. van der Zee Frank, 2002). Así, las técnicas mencionadas de forma individual no proporcionan una eficiencia de decoloración aceptable por lo que se han investigado otros procesos como el de adsorción-biodegradación que han dado buenos resultados (Barragán et al., 2007). A pesar de ello se requiere un mayor estudio sobre las condiciones de proceso que garanticen la transformación de los contaminantes a subproductos no tóxicos o mejor aún hacia su la mineralización. Es precisamente de este punto de donde estriba la importancia del presente proyecto; ya que al plantear una mineralización del mineralización del Naranja II se pretende la eliminación del mismo sin generación de productos más tóxicos o contaminantes al medio ambiente y a la salud humana. Se sabe por las investigaciones realizadas por O´Neill C, et al. (2000) que la decoloración de lo Medio NARANJA II Acido Sulfanílico Tratamiento Con nutirentes Sin nutrientes Con nutrientes Sin nutrientes Nutrientes (1) 3 3 Gutiérrez, Rodríguez, Rodríguez y Barragán azocolorantes se da en condiciones anóxicas y la eliminación de las aminas resultantes de dicho proceso se da en condiciones óxicas, por lo que es clave para el planteamiento de cualquier sistema de tratamiento para estos compuestos basados en estas condiciones es tener el conocimiento de las variables a controlar para alcanzar la mayor eficiencia, para lo cual se requiere de un estudio multifactorial entre las principales variables que afectan el crecimiento, reproducción y metabolismo de la especie bacteriana en estudio a fin de seleccionar las variables que controlan significativamente el proceso (agitación, nutriente y oxígeno), tomando como modelo al azocolorante Naranja II. Objetivo Determinar mediante un diseño factorial el efecto de la presencia de nutrientes, agitación y oxígeno en la mineralización del azocolorante Naranja II utilizando la bacteria facultativa Enterobacter sp. METODOLOGÍA Se prepararon los medios de cultivo para el análisis factorial: nutritivo y mineral con Naranja II, así como nutritivo y mineral con ac. sulfanílico, con la siguiente composición: Sales (2) 3 3 3 3 Naranja II 30mg 30mg Sulfanílico 30mg 30mg (1) Nutrientes 9 9 (2) Sales 9 9 9 9 9 110mg/L Extracto de Carne 30mg/L de Urea 28mg/L K2HPO4 7mg/L NaCl 4mg/L CaCL 2mg/L MgSO4 30mg/L Naranja II ó Ácido sulfanílico Una vez preparados los medios a cada matraz se le agregaron 20mL del medio (1/3 de su capacidad), los que se sometieron a ambiente anóxico se sellaron con tapones de hule y arillos de aluminio para evitar infiltraciones de oxígeno y se realizó el cambio de atmósfera con nitrógeno. Para los matraces cuyo tratamiento fue óxico se agrego la misma cantidad de medio y solo se taparon con algodón y capuchones de aluminio. Con los matraces ya listos se inoculó con 1mL de concentrado de células en condiciones de asepsia. Se separaron los que serian sometidos a agitación y Revista Sistemas Ambientales, Vol. 1, No. 2, 2007 p. 40-47 fueron puestos en una incubadora a 96 rpm a una temperatura de 30ºC, misma temperatura a la que se mantuvieron los matraces que no requerían agitación Por último se procedió al análisis de los resultados obtenidos por medio de un software estadístico. RESULTADOS Y DISCUSIÓN Se realizó la toma de lecturas iniciales de absorbancia para las variables de respuesta mediante una espectrofotómetro a diferentes longitudes de onda, para Naranja II a 480nm, Acido sulfanílico a 247 nm y biomasa a 600nm. Los tratamientos se mantuvieron por 21 días y se obtuvieron las lecturas finales de las variables de respuesta, con dichas lecturas de absorbancia se obtuvieron las concentraciones por medio de la curva tipo de cada una de las variables. El estudio multifactorial aplicado tanto Naranja II como a Ácido sulfanílico arrojo los datos que en las siguientes tablas se presenta, cabe mencionar que en la tabla 1 se presentan los datos del % de remoción y de la concentración de ácido sulfanílico presente en el tratamiento de Naranja II ya que el producto de la reducción del colorante es el ácido sulfanílico. Tabla 1.Tratamientos con Naranja II Porcentaje de remoción de Naranja II, y concentración de ácido sulfanílico Naranja II sulfanílico Naranja II sulfanílico TRATAMIENTO %R [mg/L] TRATAMIENTO %R [mg/L] ANOXICO/SA/CN 33,07±0,91 17,838±0,477 ÓXICO/SA/CN 4,31±0,93 6,609±0,109 ANOXICO/SA/SN 32,23±3,83 17,073±0,939 ÓXICO/SA/SN 7,56±1,06 9,533±0,541 ANOXICO/CA/CN 38,02±4,37 18,317±0,430 ÓXICO/CA/CN 4,48±1,22 10,021±0,819 /ANOXICOCA/SN 30,32±1,03 18,478±0,969 ÓXICO/CA/SN 4,19±0,95 8,470±0,964 En la grafica 1 se puede observar que en los medios anóxicos el porcentaje de remoción del colorantes es mucho mayor que en el caso de postratamientos anóxicos, lo cual se ve corroborado con las concentraciones de acido sulfanílico que se formaron en los medios por la reducción del Naranja II MULTIFACTORIAL NARANJA II 45 40 35 30 25 20 15 10 5 0 SA/CN SA/SN CA/CN CA/SN TRATAMIENTO % de Remoción de Naranja II ANOXICO mg/L de Acido Sulfanilico Formado ANOXICO % de Remosión OXICO mg/L de ACIDO Sulfanilico Formado OXICO Grafica 1. Resultados para el tratamiento con Naranja II Efecto de las condiciones de cultivo sobre la biodegradación del azocolorante Naranja II en un sistema combinado anóxico/óxico. En la tabla 2 se muestran los resultados obtenidos para los distintos sistemas con ácido sulfanílico, Gutiérrez, Rodríguez, Rodríguez y Barragán expresados como % de remoción que se refiere a la transformación del ácido. Tabla 2. Tratamientos con Ácido sulfanílico Promedios tratamiento ácido sulfanílico sulfanílico TRATAMIENTO % Remoción TRATAMIENTO ANOXICO/SA/CN 11,92±1,97 ÓXICO/SA/CN ANOXICO/SA/SN 20,55±0,91 ÓXICO/SA/SN ANOXICO/CA/CN 21,72±0,61 ÓXICO/CA/CN /ANOXICOCA/SN 18,02±0,79 ÓXICO/CA/SN % Remoción 39,65±2,2224 32,62±1,5114 30,77±0,2494 25,56±1,3182 MULTIFACTORIAL AC. SULFANILICO 45 40 35 % de Remosión 30 25 20 15 10 5 0 SA/CN SA/SN CA/CN Tratamiento CA/SN ANÓXICO ÓXICO Grafica 2. Resultados para el tratamiento con acido sufanílico En el caso de la remoción de ácido sulfanílico se puede observar que, por el contrario que en el caso de Naranja II el mayor porcentaje este se da en condiciones óxicas jugando entones, la presencio o ausencia de oxigeno un papel fundamental en la mineralización del colorante Naranja II. Los resultados de biomasa para ambas sustancias se muestran en las graficas 3 y 4: Revista Sistemas Ambientales, Vol. 1, No. 2, 2007 p. 40-47 Biomasa Multifactorial Naranja II 0,7 0,6 0,5 Δ Abs. 0,4 0,3 0,2 0,1 ÓXICO/CA/SN ÓXICO/CA/CN ANÓXICO/CA/SN ANÓXICO/CA/CN ÓXICO/SA/SN ÓXICO/SA/CN ANÓXICO/SA/SN ANÓXICO/SA/CN 0 Grafica 3. Biomasa en tratamientos con Naranja II Biomasa Multifactorial Ac.Sulfanilico 0,3 0,25 0,15 0,1 0,05 Grafica 4. Biomasa en tratamientos con acido sulfanílico ÓXICO/CA/SN ÓXICO/CA/CN ANÓXICO/CA/SN ANÓXICO/CA/CN ÓXICO/SA/SN ÓXICO/SA/CN ANÓXICO/SA/SN 0 ANÓXICO/SA/CN Δ Abs. 0,2 Efecto de las condiciones de cultivo sobre la biodegradación del azocolorante Naranja II en un sistema combinado anóxico/óxico. Por ultimo se puede observar en las graficas 3 y 4 que el mayor crecimiento bacteriano se dio en las condiciones optimas de reducción tanto para el colorante Naranja II (anóxico) y para el ácido sulfanílico (oxico) incrementándose esta tendencia con la presencia de nutrientes. CONCLUSIONES Después de desarrollada la fase experimental del proyecto se obtuvo que: ¾ Para la reducción del azocolorante Naranja II es necesario que el medio no tenga presencia de oxígeno, es decir un medio Anóxico. ¾ Para la transformación del ácido sulfanílico es necesario que en el medio haya la presencia de oxígeno, es decir un medio óxico. ¾ La presencia o no de agitación o nutrientes no tienen un efecto significativo (p>0.05) en la reducción ni en la mineralización del Naranja II y ác. sulfanílico respectivamente. ¾ La presencia de nutrientes no es significativa (p>0.05), en ninguno de las dos condiciones, lo que sugiere que Enterobacter sp. es capaz de utilizar al colorante como única fuente de carbono y energía. Bibliografía Barragán H. Blanca., C. Costa., M. Carmen Márquez. 2007. Biodegradaction of azo dyes by bacteria inoculated on solid media. Dyes and Pigments 75: 73-81. Boll Argüello G., Lemos Pastrana A. y Mejía Coahuila T., 2004, Manual de Laboratorio de Microbiología Ambiental. Isik Mustafa y Sponza Delia T, 2002, Effect Of Oxygen On Decolorization Of Azo-Dyes By Escherichia coli And Pseudomona sp. And Fate of Aromatic Amines, Process Biochemistry 00: 1-10 O’Neill C., López A., Esteves S. y Hawkes F.R., 2000, Azo-Dye Degradation In An AnaerobicAerobic Treatment System Operating On Simulated Gutiérrez, Rodríguez, Rodríguez y Barragán Textile Effluent, Appl Microbiol Biotechnol, 53:249-254 P. Ekici, Leupold G. y Parlar H., 2004, Degradability of Selected Azo Dye Metabolites In Activated Sludge Systems, Chemosphere, 44: 721728 P. van der Zee F., 2002, Anaerobic Azo Dye Reduction, Thesis Wagenengen University, Wageningen, The Netherlands with Summary in English and Dutch. Pereira E. y Durrant L, 2001, Decolorization of Azo Dyes by Phanerochaete chysosporium and Pleurotus sajorcaju, Enzyme And Microbial Technology, 29: 473-477 Razo Flores E., Luijten M., Donlon B., Lettinga G. y Field J., 1997, Complete Biodegradation of The Azo Dye Azodisalicylate Under Anaerobic Conditions, Enviro Sci. Technol, 31: 2098-2103. http://www.pasqualinonet.com.ar/Colorantes.htm#L os%20colorantes%20artificiales http://translate.google.com/translate?hl=es&sl=en& u=http://www.chemexper.com/chemicals/supplier/c as/633-965.htmL&prev=/search%3Fq%3D%2B%2522orange %2B7%2522%26num%3D50%26hl%3Des%26lr% 3D%26as_qdr%3Dall http://www.iib.unsam.edu.ar/IIBINTECH/htmL/docencia/Microbiologia/EcologiaMi crobianaBN.pdf http://www.fagro.edu.uy/microbiologia/docs/Proces os Microbianos.pdf http://www.fagro.edu.uy/microbiologia/docs/Proces os%20Microbianos.pdfhttp://images.google.com/im gres?imgurl=http://www.ch.ic.ac.uk/vchemLib/mol/ glossary/azo.gif&imgrefurl=http://www.ch.ic.ac.uk/ vchemLib/mol/glossary/&h=249&w=492&sz=3&tb nid=duB_P6LGhqMJ:&tbnh=64&tbnw=127&hl=en &start=4&prev=/images%3Fq%3Dazo%26svnum% 3D50%26hl%3Den%26lr%3D%26as_qdr%3Dall http://images.google.com/imgres?imgurl=http://ww w.ch.ic.ac.uk/vchemLib/mol/glossary/azo.gif&imgr efurl=http://www.ch.ic.ac.uk/vchemLib/mol/glossar y/&h=249&w=492&sz=3&tbnid=duB_P6LGhqMJ: &tbnh=64&tbnw=127&hl=en&start=4&prev=/imag es%3Fq%3Dazo%26svnum%3D50%26hl%3Den% 26lr%3D%26as_qdr%3Dall