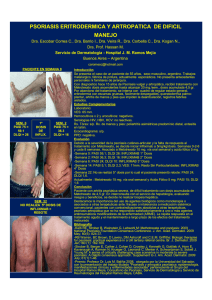
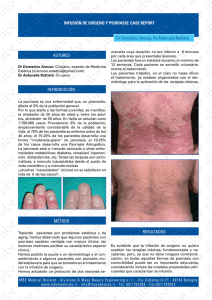
APREMILAST en psoriasis en placas moderada o grave
Anuncio

Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 1 APREMILAST en psoriasis en placas moderada o grave Informe para la Comisión de Medicamentos de Alto Impacto Servicio de Salud del Principado de Asturias Mayo 2016 Glosario: BSA: “Body surface area” (área de superficie corporal afectada). DLQI: “Dermatology Life Quality Index” (índice de Calidad de Vida dermatológica). PASI “Psoriasis Area and Severity Index” (índice de gravedad y área afectada de psoriasis). PGA: “Physician`s Global Assessment” (evaluación global del médico). 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Apremilast (CC10004) Indicación clínica solicitada: Tratamiento de la psoriasis en placas crónica de moderada a grave que no han respondido o tienen contraindicado o no toleran el tratamiento sistémico incluyendo ciclosporina, metotrexato o psoraleno y luz ultravioleta A (PUVA). Autores / Revisores:, Ana Isabel Plano Sánchez, Tania Rubio Alfonso. Tipo de informe: original Declaración de conflicto de Intereses de los autores: Ninguno. 2.- SOLICITUD Y DATOS DEL PROCESO DE EVALUACIÓN Justificación de la solicitud: se realiza este informe a solicitud de la Comisión de Evaluación de los Medicamentos de Alto Impacto. 3.- AREA DESCRIPTIVA DEL MEDICAMENTO Y DEL PROBLEMA DE SALUD 3.1 Área descriptiva del medicamento Nombre genérico: Apremilast Nombre comercial: Otezla® Laboratorio: Celgene Europe Ltd Grupo terapéutico. Agentes inmunosupresores selectivos Vía de administración: Oral 1 Código ATC: L04AA32 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 2 Tipo de dispensación: Dispensación hospitalaria sin cupón precinto. Información de registro: Registro centralizado EMA. Presentaciones y precio Forma farmacéutica y dosis ® Otzela comp 10, 20 30 mg ® Otzela comp 30 mg Nº de unidades por envase 27 56 Código 704966 704968 Coste por unidad PVL + IVA -7,5% RD 14,08 14,08 3.2 Área descriptiva del problema de salud 3.2.a Descripción estructurada del problema de salud Descripción del problema de salud (1) (2) Definición Principales manifestaciones clínicas Incidencia y prevalencia La psoriasis es una enfermedad cutánea crónica y recidivante. Actualmente es considerada como una enfermedad sistémica con manifestaciones predominantemente cutáneas. El curso clínico es variable y la historia poco conocida, sin embargo, se ha visto que en ella está implicada la respuesta inmune donde los linfocitos T y las células dendríticas juegan un importante papel. La descamación y el eritema son el resultado de la hiperproliferación y diferenciación anormal de la epidermis con infiltrados celulares y cambios vasculares. Si se compara con la epidermis normal, destaca: incremento de células madre epidérmicas, vida corta celular de los queratinocitos y un tiempo de cambio de epidermis reducido (4 días para las células del estrato córneo mientras que en una piel sana serían 27 días). Puede aparecer a cualquier edad pero existen picos de incidencia en la segunda y tercera décadas de la vida. La presentación más frecuente es la psoriasis en placas. Se distinguen varios tipos de psoriasis: Pustulosa, crónica en placas, eritrodérmica, en gotas, del cuero cabelludo, ungueal e invertida. La presentación más frecuente es la psoriasis en placas (psoriasis Vulgaris) que afecta cuero cabelludo, zonas de extensión (codos y rodillas), genitales, lumbosacra y retroauricular con placas simétricas, eritematosas con bordes bien definidos y descamación perlada. Las placas pueden variar de tamaño, desde 1 cm a más de 10 cm de diámetro. En la mayoría de los casos son asintomáticas, aunque los pacientes suelen quejarse de prurito. En España se estima una prevalencia de 2,3%(3) (en torno a 1.080.000 casos), aunque la incidencia internacional varía de manera importante dependiendo del clima y la herencia genética de la población, se estima en un 2 – 3% de afectados en la población mundial. La enfermedad puede aparecer a cualquier edad aunque es menos común en niños que en adultos. Se han observado dos picos a lo largo de la vida, uno entre los 30 y 39 años y otro a los 50-59 años. Parece que la incidencia está en aumento en los últimos años según varios estudios realizados aunque los cambios en los patrones de diagnóstico constantes parece que puedan contribuir a este incremento en la incidencia. 2 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: Evolución / Pronóstico Grados de gravedad / Estadiaje Carga de la enfermedad* 4.0 10-12-2012 3 Es una patología benigna de larga evolución pero que afecta al aspecto social de las personas. Cursa con remisiones y exacerbaciones y en ocasiones refractariedad al tratamiento. Existe una mayor incidencia de eventos cardiovasculares (no se ha encontrado asociación con el uso de biológicos). También se ha asociado con algunas enfermedades sistémicas tales como cáncer, síndrome metabólico, diabetes, enfermedad inflamatoria intestinal, hipertensión y depresión. Un tercio de los pacientes diagnosticados desarrollan artritis. Se ha concluido que sufren una mayor limitación social los pacientes con afectación palmoplantar independientemente del grado de extensión. Para definir la gravedad de la enfermedad cutánea en la práctica clínica dermatológica se utiliza el PASI (Psoriasis Area and Severity Index) o el porcentaje de superficie corporal afectada (BSA). Existen otros instrumentos de medida como el Physician´s Global Assessment (PGA) y Dermatolgy Life Quality Index (DLQI). La gravedad de la psoriasis se puede diferenciar en: - Leve: si afecta a < 5 % del BSA o PASI <10 - Moderada: si afecta entre el 5-10% del BSA o PASI10 - Grave: si afecta más del 10% del BSA o PASI>20 Así mismo, es importante valorar la zona afectada porque puede influir en la calidad de vida del paciente independiente del BSA. Se considera psoriasis grave cuando está localizada en áreas con alta repercusión funcional o de difícil tratamiento tópico (cara, genitales, manos, cuero cabelludo). De acuerdo con un estudio realizado sobre la realidad terapéutica de la psoriasis moderada - grave en España, el 6.8 % de los pacientes atendidos en consulta presentarían psoriasis moderada- grave, de los que el 45.8 % estarían tratados con un fármaco sistémico y el 22.9 % con un biológico. Aproximadamente la mitad de los pacientes haría un cambio de tratamiento de sistémico a biológico siendo la causa más frecuente la pérdida de efectividad y aparición de efectos adversos. Entre los criterios imprescindibles a considerar para la elección de un tratamiento óptimo estarían la eficacia y seguridad (82.9 y 28% respectivamente).(4) 3.2.b Tratamiento actual de la enfermedad: evidencias (5) (6) (7) La psoriasis es una enfermedad crónica, inflamatoria, de afectación predominantemente cutánea, aunque en ocasiones, produce afectación sistemática de curso crónico con exacerbaciones. Los tratamientos disponibles pueden hacer desaparecer las lesiones u ocasionar gran mejoría pero no existe un tratamiento que alcance una curación definitiva. La exposición solar controlada y diaria, hidratación de la piel y reducir el nivel de estrés son elementos clave para el manejo de las lesiones. El tratamiento inicial comienza en la terapia tópica y sistémica convencional. El tratamiento tópico resulta adecuado en la psoriasis localizada y limitada, mientras que la enfermedad moderadasevera requiere tratamiento sistémico (ciclosporina, metotrexato y acitretina).Éstos, junto con la fototerapia suelen ser efectivos pero generan toxicidad a largo plazo así como refractariedad en algunos tipos de pacientes. Para definir la gravedad, se utiliza normalmente el PASI (Psoriasis Area and Severity Index) o el BSA (porcentaje de superficie corporal afectada). Existen otros instrumentos de medida como el PGA (Phisycian´s Global Assessment) y el DLQI (Dermatology Life Quality Index). 3 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 4 PASI: las placas son estatificadas con base a tres criterios: eritema, grosor y escama. La gravedad se cuantifica para cada índice en una escala de 0 a 4 (0 sin compromiso y 4 para compromiso extenso). El cuerpo se divide en 4 regiones: cabeza, tronco, extremidades superiores e inferiores, cada fracción se califica y cuantifica de 0 a 6 (0 sin compromiso y 6 un 90% de compromiso). Proporciona una escala global que va desde 0 (ausencia) a 72 (grave). BSA: corresponde al porcentaje de la superficie corporal real afectada con lesiones valorada por el médico (considerando la plama de la mano como un 1% de dicha superficie). Varía entre 0 y 100%. Según esto se considera psoriasis leve si afecta a menos del 5% del BSA, moderada entre 5-10%, y grave si afecta a más del 10%. PGA: valoración médica global, es una escala simple que proporciona una valoración subjetiva de la gravedad de la enfermedad. Se emplea una puntuación comprendida entre 0-5. La psoriasis del paciente se valora como aclaramiento (0), mínima (1), leve (2), moderada (3), grave (4), severa (5), en base a la induración, eritema y descamación. DLQI: no es exclusivo para la psoriasis, es una herramienta validada que mide el impacto de la enfermedad en la vida de los pacientes. Consta de 10 puntos que cubren los síntomas, la actividad diaria, recreación, trabajo y estudio, relaciones personales y tratamiento. Una puntuación > 10 (0-30) indica una afectación importante en la calidad de vida. El PASI 75 (mejoría de la situación igual o mayor al 75% con respecto al PASI basal) se utiliza como parámetro de elección para determinar la eficacia de los nuevos tratamientos con biológicos en los ensayos clínicos.(8) (9) NICE establece que entre los criterios de selección para la terapia con biológicos deben encontrarse el PASI y el DLQI utilizados para la medida de eficacia de los mismos. Con respecto a la evaluación de la calidad de vida relacionada con la salud, el DLQI es el índice más utilizado mundialmente, pero se ve limitado por su carácter unidimensional y su variable adaptación transcultural. 1. TERAPIA TÓPICA (7) - Emolientes: hidratar la piel después de la ducha ayuda para el picor y reducir las lesiones. Los aceites y cremas hidratantes ayudan a prevenir la irritación. Están indicados en el tratamiento preventivo y de mantenimiento, en ningún caso para los brotes. Corticoterapia: efecto antiinflamatorio, antiproliferativo e inmunosupresor. En función de la zona afectada se selecciona la potencia del corticoide. Cuero cabelludo-canal auditivo: potencia intermedia (clobetasona, fluocinolona). Cara: baja potencia (hidrocortisona, fluocortina). Superficies extensas o placas extensas: potencia alta (beclometasona, betametasona y metilprednisolona). Para los casos de afectación ungueal suelen ser refractarios al tratamiento tópico con corticoide, es conveniente asociarlos con calcipotriol o ácido salicílico. Análogos de la vitamina D tópicos (calcipotriol, calcitriol y tacalcitol): inhiben la proliferación y promueven la diferenciación de queratinocitos. En casos de psoriasis en placas son más efectivos las asociaciones como calcipotirol y dipropionato de betametasona. Breas/alquitrán: efecto antiproliferativo aunque se desconoce el mecanismo de acción 2. FOTOTERAPIA Se utiliza en casos de amplia extensión de la enfermedad fundamentalmente en miembros y tronco. El mecanismo de acción es antiproliferativo y antiinflamatorio. Riesgo de melanoma y cáncer de piel. Ultravioleta A, B y PUVA (psoralenos + ultavioleta A). 4 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 5 3. TERAPIA SISTÉMICA Metotrexato: antagonista de ácido fólico, inhibe la síntesis de DNA en las células epidérmicas e inmunosupresor de las células T activadas. Dosis entre 7.5-25 mg semana/vo-im-iv. Monitorizar la hepatotoxicidad cada 3 meses y asociar ácido fólico. Hasta los 3 meses de tratamiento no se nota mejoría clínica. Efectos adversos: toxicidad medular y pulmonar. Retinoides (acitretina): derivados de la vitamina A. Están indicados para casos graves incluidos las formas eritrodérmica, pustular y pacientes con VIH. Cuando se asocia a PUVA los pacientes tienen una respuesta mayor y mejor. Las dosis son entre 25 mg cada dos días hasta 50 mg diarios. Efecto teratógeno, vigilar hipertrigliciridemia y hepatotoxicidad. También se han descrito ojo seco, blefaritis y cataratas entre los efectos adversos. Ciclosporina: supresor de células T. Dosis 3-5 mg/kg/día/vo. La mejoría suele aparecer a partir de las 4 semanas. Vigilar la toxicidad renal y la hipertensión. No se encontraron diferencias significativas entre metotrexato y ciclosporina, (Felman.SR 2011). Algoritmo de tratamiento para la psoriasis (NICE,Noviembre 2012).(10) 5 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 6 4. TERAPIAS BIOLÓGICAS (5) (6) (9) Las terapias biológicas son una opción terapéutica aceptada en los pacientes con psoriasis en placa moderada a grave que no responden o no toleran los tratamientos sistémicos. El tratamiento con agentes biológicos puede definirse en dos fases: la fase de inducción y la de mantenimiento. Por lo general, la fase de inducción corresponde hasta la semana 16 aunque dependiente del fármaco y dosis puede incluirse hasta la semana 24, momento en el que se alcanza la meseta de eficacia para todos lo fármacos biológicos. A partir de este momento se considera que entra en la fase de mantenimiento y han de tenerse en cuenta las características especiales a largo plazo. La psoriasis moderada o grave se define como PASI ≥ 10, BSA ≥10 o DLQI > 10 o PGA ≥3 (escala 0-5). Al iniciar el tratamiento biológico, ha de elaborarse una historia clínica completa que incluya antecedentes personales, exposición a enfermedades infecciosas y medicamentos así como pruebas para descartar contraindicaciones (tuberculosis, VHC, VHB, VIH, embarazo, enfermedades desmielinizantes o neoplasia maligna en los últimos 5 años). 6 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 7 Actualmente están disponibles 5 medicamentos biológicos para el tratamiento de la psoriasis: - Inhibidores de factor de necrosis tumoral (anti-TNF): adalimumab, infliximab y etanercept. - Inhibidor de la interleukina 12 y 23: ustekinumab. - Inhibidor de la interleukina 17-A: secukinumab. Adalimumab: dosis 80 mg semana 0, seguida de 40 mg la semana 1 y posteriormente cada 15 días. Medida de la respuesta inicial a las 16 semanas. Etanercept: 25 mg dos veces por semana o 50 mg a la semana. Medida de la respuesta inicial a las 12 semanas. Infliximab: 5 mg/kg semanas 0, 2 y 6 y después cada 8 semanas. Medida de la respuesta inicial a las 10-14 semanas. Ustekinumab: 45 mg semanas 0 y 4 y después cada 12 (si peso < 100 kg). Dosis 90 mg semanas 0 y 4 y después cada 12 si peso > 100 kg. Medida de respuesta inicial a las 1628 semanas. Secukinumab: 300 mg semanas 0,1,2,3 y después cada mes. Medida de la respuesta inicial a la semana 12. Criterios de inicio de tratamiento (NICE,2012): Se recomienda inicio de terapia biológica en los pacientes que no toleran, no responden o tienen contraindicada otras terapias sistémicas (incluyendo ciclosporina, metotrexato y fototerapia) con los siguientes criterios: Para etanercept, adalimumab e ustekinumab: PASI basal > 10, DLQI >10. Para infliximab:PASI basal > 20 y DLQI > 18. Una adecuada respuesta al tratamiento vendría definida como la reducción del PASI ≥ 50% (o % del BSA donde el PASI no es aplicable) y una mejora de más de 5 puntos en DLQI o una reducción del 75% del PASI comparada con el PASI inicial. En el periodo de inducción, infliximab presenta mayor rapidez de acción (frente a ustekinumab, adalimumab, adalimumab y etanercept), podría ser valorado como primera opción en pacientes con mayor gravedad. Ustekinumab 45 mg y adalimumab se consideran similares en el periodo de inducción, así como adalimumab y etanercept 50 mg. En el periodo de mantenimiento, adalimumab, etanercept 25 mg bisemanal, ustekinumab 45 mg e infliximab se consideran de eficacia similar. Secukinumab 150 mg (11), ustekinumab 90 mg y adalimumab se consideran alternativas terapéuticas equivalentes en función del PASI 75. Secukinumab (12) también se consideró ATE con infliximab 5 mg/kg en eficacia según PASI 75. Fracaso terapéutico primario: se define por la incapacidad de alcanzar una respuesta PASI 50 (50 % de mejora con respecto al valor basal) o ‘umbral de eficacia durante la fase de inducción al tratamiento (hasta la semana 16 de tratamiento o 24, dependiendo del fármaco). Fallo secundario: pérdida de respuesta PASI 50 durante la fase de mantenimiento del tratamiento aunque pueden establecerse definiciones alternativas. NiCE recomienda recomienda la retirada del tratamiento: - Etanercept: Si ausencia de respuesta a la semana 12, (pese a esta recomendación, existen diferentes estudios que avalan el hecho de que etanercept alcanza la eficacia máxima a la semana 24)(6). - Infliximab: Si ausencia de respuesta a la semana 10. - Adalimumab y ustekinumab: Si ausencia de respuesta a la semana 16. En este caso, según el estudio PHOENIX 1, se evaluó la eficacia de ustekinumab mediante el PASI 75 a la semana 12 y 28 y no se obtuvieron diferencias significativas por lo que se considera razonable evaluar la efectividad a la semana 12. - Secukinumab a la semana 12. El fracaso terapéutico se considera indicación de sustitución de tratamiento. Para los pacientes en los que el tratamiento es eficaz, se recomienda evaluación de respuesta y seguridad cada 3 meses. 7 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 8 3.3 Características comparadas con otras alternativas similares Alternativas disponibles en el Hospital para la misma indicación. Características diferenciales comparadas con otras alternativas similares Nombre SECUKINUMAB ETANERCEPT INFLIXIMAB ADALIMUMAB (13) (14) (15) (16) Presentación Posología Indicación aprobada en FT Efectos adversos Utilización de recursos Conveniencia Otras características diferenciales USTEKINUMAB APREMILAST (17) (18) 150 mg/ml jeringas, plumas precargadas, vial 300 mg semanas 0, 1, 2 , 3 y 4 Después 300 mg cada mes 25 mg, 50 mg Vial 100 mg 40 mg jeringas y Vial 45 mg/ 0.5 10 mg, 20 mg, 30 mg Jeringas plumas mL comprimidos precargadas precargadas recubiertos 25 mg 2 veces 5 mg/kg Semana 0: 80 mg Peso < 100 kg: 30 mg 2 veces al día por semana o 50 semanas 0, 2 Semana 1: 40 mg 45 mg Es necesario un mg semanales y 6 después Después 40 mg / 2 Peso > 100 kg: programa inicial de Puede cada 8 semanas 90 mg escalado de dosis administrarse 50 semanas como se muestra en la mg 2 Administrar Tabla 1 veces/semana semanas 0 y 4, durante las después cada 12 primeras 12 semanas semanas Tratamiento de la Tratamiento de la psoriasis en placas de moderada a grave en los adultos que no responden, tienen psoriasis en placa contraindicada o no toleran otras terapias sistémicas, incluyendo ciclosporina, metotrexato y de moderada a fototerapia (PUVA: psoraleno más luz ultravioleta A) grave en adultos Artritis psoriásica activa y progresiva en pacientes adultos cuando la Artritis psoriásica candidatos a respuesta a la terapia previa con FAMEs no ha sido adecuada activa, solo o en terapia sistémica. combinación con FAME, en adultos con Artritis psoriásica respuesta activa en inadecuada/intolerancia pacientes adultos a FAME cuando la Íd. psoriasis a -Psoriasis Psoriasis respuesta a la partir de los 6 pediátrica en pediátrica en terapia previa con años de edad placas a partir de placa a partir de FAMEs ha sido los 4 años de edad. los 12 años de inadecuada. edadInfección de vías Reacción en el Reacción Reacción en el Infección Diarrea, nauseas, respiratorias lugar de infusional. lugar de inyección respiratoria de infección tracto superiores, diarrea inyección, Cefalea, (dolor, vías altas. respiratorio superior, y síndrome infección infección enrojecimiento). Celulitis, bronquitis, dolor de pseudogripal respiratoria, respiratoria, Cefalea, infección faringolaringitis, espalda, nasofaringitis, urinaria, herpes, respiratoria/urinaria, congestión nasal, migraña, cefalea, tos, cutánea, alergia, diarrea herpes, diarrea depresión, vómitos autoanticuerpos mareos, diarrea, cefalea, prurito, exantema, urticaria, autoanticuerpos Administración Permite la auto-administración IV que obliga Permite la auto-administración Administración oral que a que se permite la toma en realice por domicilio personal especializado en un hospital Administración SC Perfusión IV Administración SC Administración oral (2h) Después del escalado Administración inicial de la dosis, no es en hospital de necesario un redía escalado de la dosis. Administración cada mes Administración cada semana Diana terapéutica: IL-17ª Diana terapéutica: TNF Administración cada 8 semanas Diana terapéutica: TNF 8 Administración cada 2 semanas Administración cada 12 semanas Administración diaria. Diana terapéutica: TNF Diana terapéutica: IL-12/IL-23 Diana terapéutica: Fosfodiesterasa 4 (PDE 4) Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 9 4.- AREA DE ACCIÓN FARMACOLÓGICA.(18) 4.1 Mecanismo de acción. Apremilast es un inhibidor oral de la fosfodiesterasa 4 (PDE4). La inhibición de la PDE4 da como resultado el aumento de los niveles de AMPc intracelular, que a su vez regula disminuyendo la respuesta inflamatoria mediante la modulación de la expresión de la IL-23,IL-17, TNF-alfa. Estos mediadores están implicados en la psoriasis y artritis psoriásica. 4.2 Indicaciones clínicas formalmente aprobadas y fecha de aprobación. AEMPS y EMA: Autorizado.[15/01/2015]. Comercializado [enero 2016] Artritis psoriásica: Sólo o en combinación con Fármacos Antirreumáticos Modificadores de la Enfermedad (FAMEs). Está indicado para el tratamiento de la artritis psoriásica (AP) activa en pacientes adultos que han tenido una respuesta inadecuada, o han presentado intolerancia al tratamiento previo con un FAME. Psoriasis: Está indicado en el tratamiento de la psoriasis en placas crónica de moderada a grave en pacientes adultos que no han respondido o tienen contraindicado o no toleran otro tratamiento sistémico, incluyendo ciclosporina, metotrexato o psoraleno y luz ultravioleta A (PUVA) FDA: [21/12/2015]. Artritis psoriásica: Tratamiento de pacientes adultos con artritis psoriásica activa. Psoriasis: pacientes con psoriasis en placa moderada-grave que no son candidatos a fototerapia o terapia sistémica. 4.3 Posología, forma de preparación y administración. Para reducir el riesgo de síntomas gastrointestinales, se recomienda el siguiente esquema de dosificación: Día 1: 10 mg en la mañana. Día 2: 10 mg en la mañana y 10 mg en la noche. Día 3: 10 mg en la mañana y 20 mg en la noche. Día 4: 20 mg en la mañana y 20 mg en la noche. Día 5: 20 mg en la mañana y 30 mg en la noche. Día 6 en adelante: 30 mg dos veces al día. 4.4 Utilización en poblaciones especiales. Pediatría: La efectividad y seguridad en pacientes menores de 18 años no ha sido establecida Mayores de 65 años: De los 1.493 pacientes reclutados en los ensayos clínicos fase III, un total de 146 pacientes eran mayores de 65 años, incluyendo 19 pacientes con edad igual o superior a 75 años. No se observaron diferencias globales en el perfil de seguridad entre los pacientes mayores de 65 años con respecto a los pacientes menores de 65 años. Insuficiencia renal: En Insuficiencia renal grave (aclaramiento de creatinina <30 ml / minuto) se ajustará la dosis de la siguiente forma: Dosis Inicial: Día 1-3:10 mg por la mañana. Día 4-5: 20 mg en la mañana. Día 6 y siguientes: 30 mg por la mañana. Insuficiencia hepática: No precisa ajuste de dosis. 4.5 Farmacocinética. Absorción: - Apremilast tiene una biodisponibilidad absoluta en torno al 73%. - tmáx: 2,5 horas. - La administración conjunta con alimentos no altera la absorción de apremilast. 9 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 10 Distribución: La unión a proteínas plasmáticas es de aproximadamente 68%. Volumen aparente de distribución (Vd): 87 L. Metabolismo: hepático, principalmente a través de CYP3A4: vías de menor importancia incluyen CYP1A2 y CYP2A6. Eliminación: - Urinaria: 58% (3% inalterado). - Heces: 39% (7% inalterado). El aclaramiento plasmático de apremilast es de aproximadamente 10 L/h en sujetos sanos, con una semivida de eliminación de aproximadamente 6-9 horas. 5.- EVALUACIÓN DE LA EFICACIA. 5.1.a Ensayos clínicos disponibles para la indicación clínica evaluada Se realizó una búsqueda en PubMed y en clinicaltrials.gov para localizar estudios que compararan eficacia y seguridad de apremilast. Se seleccionaron los estudios para el análisis de la eficacia con los siguientes criterios de inclusión: - Ensayos clínicos controlados y aleatorizados realizados en pacientes adultos. - Fármaco: apremilast en el tratamiento de psoriasis en placa moderada a grave. - Ensayos fase III y IV. Se excluyeron las comunicaciones a congresos. Se dispone de dos ensayos clínicos pivotales fase III, (PSOR-008 y PSOR-009), ambos comparados con placebo para la evaluación de la eficacia de apremilast en monoterapia para el tratamiento de la psoriasis en placa moderada a grave. En el informe EPAR de la EMA (febrero, 2016) se incluyen los dos ensayos pivotales fase III. En el CDER de la FDA se incluyen 6 ensayos clínicos, dos de ellos fase 2, abiertos (PSOR-001 Y PSOR-004), otros 2 aleatorizados, doble ciego (PSOR-003 y PSOR-005-E-LTE) y los dos ensayos pivotales fase 3 (PSOR-008 y PSOR-009). El PSOR-008, PSOR-009 y PSOR-005, se encuentran actualmente en extensión. -PSOR-008 y PSOR-009(19) (20): estudios multicéntricos, aleatorizados, controlados con placebo y doble ciego en los que participaron un total de 1257 pacientes con psoriasis en placa de moderada a grave con un PASI > 12, un BSA > 10 %, sPGA ≥ 3 y que eran candidatos a fototerapia y/o tratamiento sistémico. Aproximadamente el 30 % de los pacientes habían recibido fototerapia previa, un 54% tratamiento sistémico convencional y/o biológico previo (de éstos, 37% recibieron terapia sistémica convencional y 30% fueron tratados con terapia biológica). Un tercio de los pacientes no habían recibido ningún tratamiento previo. Como variable principal se evaluó el PASI 75 a la semana 16. -NCT01690299 (PSOOR 10) (21): estudio actualmente en curso, fase 3b, doble ciego, aleatorizado 1:1:1 (apremilast 30 mg cada 12 horas, etanercept 50 mg semanal y placebo), donde la variable principal es la proporción de pacientes tratados con apremilast comparados con placebo que alcanza respuesta PASI 75 a la semana 16. Se incluyeron un total de 250 pacientes donde el 39.8% de los tratados con apremilast presentaron respuesta PASI 75 vs placebo (11,9%). A parte de éstos, se encuentran registrados en clinicaltrials.gov: -NCT02425826 (UNVEIL)(22): fase IV, multicéntrico, aleatorizado, doble ciego, controlado con placebo para evaluar eficacia y seguridad de apremilast en pacientes no tratados con terapia sistémica. No hay resultados disponibles en el momento en el que se realiza el informe. -NCT01988103(23): fase IIb, multicéntrico, aleatorizado, doble ciego, controlado con placebo para evaluar la eficacia y seguridad de apremilast 20 mg y 30 mg en pacientes japoneses con psoriasis en placa moderada a grave. 10 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 11 -NCT00773734 (24): fase IIb, multicéntrico, aleatorizado, doble ciego, controlado con placebo para evaluar la eficacia y seguridad de diferentes dosis de apremilast (10 mg, 20 mg, 30 mg y placebo). 5.1.b Variables utilizadas en los ensayos Variables empleadas en los ensayos clínicos STEEM-1 Y STEEM-2 EFICACIA Enunciado Descripción Variable principal % pacientes que alcanzan PASI 75 Porcentaje de pacientes que lograron una mejora en el PASI de al menos un 75% a la semana 16 respecto al valor basal. Variable secundaria % pacientes con sPGA “aclaramiento completo” o “prácticamente completo” Variable secundaria Cambio en el BSA % Media ±desviación estándar semana 16. Valoración global del investigador aclaramiento completo o mínimo aclaramiento: valores 0-1, a la semana 16 Conseguir una mejora mayor o igual a 2 puntos con respecto al valor basal Media de la proporción de cambio en la puntuación del BSA con respecto a la basal a la semana 16. Variables secundaria Cambio del PASI% Media ±desviación estándar semana 16 Media de la proporción de cambio en la puntuación PASI con respecto a la basal a la semana 16. % pacientes que alcanzan PASi 50 Porcentaje de pacientes que lograron una mejora en el PASI de al menos un 50% a la semana 16. Variable secundaria Tipo de variable Variable final Variable final Variable final Variable final Variable final Variable secundaria Cambio en el DLQI, media± DE Media de la proporción de cambio en la puntuación en el DLQi con respecto al valor basal a la semana 16. Variable secundaria Cambio en el prurito en VAS (mm) media ± DE . Reducción del prurito en base a la puntuación de la escala VAS a la semana 16. SEGURIDAD Enunciado Descripción Variable principal % de pacientes con efectos adversos % efectos adversos relacionados con apremilast en función de la gravedad hasta la semana 16. Variable final Variable final Tipo de variable Variable final Variable secundaria % efectos adversos ocurridos en > 5 % de los pacientes Porcentaje de efectos adversos que han tenido lugar en más del 5% hasta la semana 16. Variable secundaria % pacientes que discontinuaron el tratamiento por eventos adversos Proporción de pacientes que suspenden tratamiento por eventos adversos hasta la semana16. % pacientes con eventos adversos graves Proporción de pacientes en el grupo de tratamiento registrados con efectos adversos graves en el periodo controlado con placebo hasta la semana 16. Variable secundaria Variable final Variable final Variable final PASI: Psoriasis Area and Severity Index. El PASI evalúa la gravedad de la psoriasis en una escala que va de 0 (ausencia de psoriaris) a 72 (grave), valora el eritema, la induración y la descamación de las lesiones por separado en diferentes zonas del cuerpo (cabeza y cuello, extremidades superiores, tronco, extremidades inferiores incluyendo glúteos) y las relaciona con el área afectada en cada una de ellas. sPGA: PGA (Phisycian´s Global Assessment): valoración médica global, proporciona una información subjetiva de la gravedad, se pueden utilizar escalas estáticas y dinámicas, usualmente estimadas entre 0 y 7 (0 piel sana y 1-7 compromiso en incremento). BSA: BSA (porcentaje de superficie corporal afectada): corresponde al porcentaje de la superficie corporal real afectada con lesiones valorada por el médico y varía entre 0 y 100%. DLQI: Dermatology Lilfe Quality Index (índice de calidad de vida dermatológico). El DLQI consiste en un cuestionario de 10 ítems que determina si la psoriasis afecta a la calidad de vida descrita por el paciente, con unas puntuaciones que van de 0 (en absoluto) a 30 (muchísimo). 11 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 12 5.2.a Resultados de los ensayos clínicos RESULTADOS ESTEEM 1(25): Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized,controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1) ( J Am Acad Dermatol 2015;73:37-49.) Evalúa la eficacia y seguridad de apremilast oral en pacientes con psoriasis en placa de moderada a grave. -Nº de pacientes:844 -Diseño: fase III, multicéntrico, doble ciego, controlado con placebo. El ensayo se diseño en 3 periodos. PERIODO A: fase controlada con placebo. Semana 0 a la 16. Pacientes aleatorizados 2 : 1(apremilast 30 mg/12h vs placebo) PERIODO B: fase de mantenimiento. Semana 16 a la 32. Pacientes con placebo, cambian a apremilast 30mg/12h. PERIODO C: fase de retirada del tratamiento aleatorizado. Semana 32 a la 52. Los pacientes que recibieron apremilast y que tuvieron respuesta PASI 75 o mayor en el periodo A, fueron reasignados aleatoriamente a apremilast 30 mg /12h o placebo (1:1). Los pacientes que fueron tratados con placebo en la semana 32 que perdieron respuesta PASI 75 reanudan con apremilast hasta la 52. -Los pacientes fueron aleatorizados 2:1 (apremilast 30mg/12h vs placebo) en el periodo A, en el periodo B el grupo placebo cambió tratamiento a apremilast y en el periodo C, los pacientes de la primera fase que recibieron apremilast con respuesta PASI 75 se reasignaron a apremilast vs placebo,mientras que los pacientes que pierden respuesta con placebo en la semana 32 se reintroduce el tratamiento con apremilast. -Criterios de inclusión: pacientes ≥ 18 años diagnosticados de psoriasis en placa moderada a grave con al menos 12 meses de evolución. Cumplir los siguientes criterios basales: BSA ≥ 10, PASI ≥ 12, sPGA ≥ 3 y ser candidatos a tratamientos sistémico y/o fototerapia. -Criterios de exclusión: tener otro tipo de patología, embarazo, antígeno de superficie + para VHB, VIH + o cualquier inmunodeficiencia congénita o adquirida, anticuerpos anti-hepatitis C, tuberculosis activa o historia de tratamiento incompleto, alteraciones significativas en el ECG, brote de psoriasis hasta 4 semanas antes del screening, tratamiento con biológicos entre las semanas 12 y 24 antes del screening, uso de agentes tópicos para la psoriasis 2 semanas antes del screening y exposición prolongada al sol o luz UV. -Pérdidas: se produjeron pérdidas por abandono de tratamiento, aparición de efectos adversos, pérdida de eficacia y falta de consentimiento informado. -Tipo de análisis: intención de tratar - Cálculo de tamaño muestral: Se requería un total de 189 pacientes para obtener una diferencia del 20% entre apremilast y placebo para alcanzar el PASI75 a la semana 16 con una potencia del 90%. Resultados a LA SEMANA 16 Variable evaluada en el estudio Resultado principal % de pacientes que alcanzan PASI 75 Resultados secundarios de interés Apremilast 30 mg/12h N (562) Placebo N (282) p Apremilast NNT RAR (IC95%) (IC 95%) Diferencia Riesgo absoluto 186 (33.1%) 15 (5.3%) p <0.0001 27.8%(23.1-32.5) 4(3-4) % de pacientes que alcanzan sPGA de 0 a 1 (con al menos una reducción de 2 puntos con respecto al valor inicial). 122 (21.7%) 11 (3.9%) p <0.0001 17.8%(13.7-21.9) 6(5 -7) Cambio en el BSA % Media ±desviación estándar 47.8± 38.4 6.9± 38.9 p <0.0001 Cambio del PASI% Media ±desviación estándar -52.1 ± 32.8 -16.7 ± 31.5 p <0.0001 PASI 50, n(%) 330 (58.7) 48 (17.0) p <0.0001 41.7%(35.7-47.7) 2(2-3) Cambio en el prurito en EVA(mm) media ± DE -31.5 ± 32.43 -7.3± 27.08 p <0.0001 Cambio en el DLQI, media± DE - 6.6 (6.66) -2.1 (5.69) p <0.0001 12 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 13 Este gráfico representa (26), el porcentaje de pacientes que alcanzan respuesta PASi 75 hasta la semana 32 con respecto a la puntuación basal. Se puede observar que a la semana 32 el grupo placebo/apremilast alcanzan prácticamente la misma respuesta.Aquí hay que tener en cuenta que a partir de la semana 16 ya no existe comparador puesto que los pacientes que recibían placebo comienzan con apremilast. 13 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 14 RESULTADOS ESTEEM 2(27) Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate-to-severe plaque psoriasis over 52 weeks: aphase III, randomized controlled trial (ESTEEM 2) British Journal of Dermatology (2015)173, pp1387–1399 Evalúa la eficacia y seguridad de apremilast oral en pacientes con psoriasis en placa de moderada a grave. -Nº de pacientes:411 -Diseño:fase III, multicéntrico, doble ciego, controlado con placebo. El esnsayo se diseño en 3 periodos. PERIODO A: fase controlada con placebo. Semana 0 a la 16. Pacientes aleatorizados 2 : 1(apremilast 30 mg/12h vs placebo) PERIODO B: fase de mantenimiento. Semana 16 a la 32. Pacientes con placebo, cambian a apremilast 30mg/12h. PERIODO C: fase de retirada del tratamiento aleatorizado. Semana 32 a la 52. Los pacientes que recibieron apremilast y que tuvieron respuesta PASI 50 o mayor en el periodo A, fueron reasignados aleatoriamente a apremilas 30 mg /12h o placebo (1:1). Los pacientes que fueron tratados con placebo en la semana 32 que perdieron respuesta PASI 50 reanudan con apremilast hasta la 52. -Los pacientes fueron aleatorizados 2:1 (apremilast 30mg/12h vs placebo) en el periodo A, en el periodo B el grupo placebo cambió tratamiento a apremilast y en el periodo C, los pacientes de la primera fase que recibieron apremilast con respuesta PASI 50 se reasignaron a apremilast vs placebo,mientras que los pacientes que pierden respuesta PASI 50 con placebo en la semana 32 se reintroduce el tratamiento con apremilast. -Criterios de inclusión: pacientes ≥ 18 años diagnosticados de psoriasis en placa moderada a grave con al menos 12 meses de evolución. Cumplir los siguientes criterios basales: BSA ≥ 10, PASI ≥ 12, sPGA ≥ 3 y ser candidatos a tratamientos sistémico y/o fototerapia. -Criterios de exclusión: tener otro tipo de patología, embarazo, antígeno de superficie + para VHB,VIH + o cualquier inmunodeficiencia congénita o adquirida, anticuerpos anti-hepatitis C, tuberculosis activa o historia de tratamiento incompleto, alteraciones significativas en el ECG, brote de psoriasis hasta 4 semanas antes del screening, tratamiento con biológicos entre las semanas 12 y 24 antes del screening, uso de agentes tópicos para la psoriasis 2 semanas antes del screening y exposición prolongada al sol o luz UV. *Se permitió el uso de corticoides tópicos de baja potencia para la cara, axila ingles, así como champú y acido salicílico para el cuero cabelludo y uso de emolientes hasta 24 antes de la visita. -Pérdidas:se produjeron pérdidas por abandono de tratamiento, aparición de efectos adversos, pérdida de eficacia y falta de consentimiento informado. -Tipo de análisis:intención de tratar - Cálculo de tamaño muestral: Se requería un total de 189 pacientes para obtener una diferencia del 20% entre apremilast y placebo para alcanzar el PASI75 a la semana 16 con una potencia del 90%. Resultados a LA SEMANA 16 Variable evaluada en el estudio Resultado principal % de pacientes que alcanzan PASI 75 Resultados secundarios de interés Apremilast 30 mg/12h N (274) Placebo N (137) p Apremilast NNT RAR (IC95%) (IC 95%) Diferencia Riesgo absoluto 79 (28.8%) 8(5.8%) p <0.0001 23%(16.3-29.6) 4(3-6) % de pacientes que alcanzan sPGA de 0 a 1 (con al menos una reducción de 2 puntos con respecto al valor inicial). 56 (20.4%) 6 (4.4%) p <0.0001 16.1(10.2-21.9) 6(5-10) Cambio en el BSA % Media ±desviación estándar -48.4 ± 40.7 -6.1 ± 47.5 p <0.0001 Cambio del PASI % Media ±desviación estándar -50.9± 34 -15.8± 41.3 p <0.0001 PASI 50 n(%) 152 (55.5) 27(19.7) p <0.0001 35,8(26,9-44,7) 3(2-4) Cambio en el prurito en EVA(mm) media ± DE -33.5 ± 35.4 -12.2± 30.9 p <0.0001 Cambio en el DLQI, media -6.7 -2.8 p <0.0001 El siguiente gráfico muestra los resultados de eficacia de ambos estudios a la semana 16, en función de la variable principal PASI 75 y del PASI 50 y cambio en el sPGA (0-1). 14 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 15 La siguiente tabla muestra el mantenimiento del efecto de los pacientes aleatorizados a apremilast en la semana 0 y los reasignados a apremilast en la semana 32 hasta la semana 52. 15 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 16 El siguiente gráfico muestra la proporción de pacientes que obtuvieron respuesta PASI 50, PASI 75 y PASI 90 hasta la semana 32 (ESTEEM 2)(27). 5.2.b Evaluación de la validez y de la utilidad práctica de los resultados A. Validez interna. Limitaciones de diseño y/o comentarios: El diseño de los estudios ESTEEM 1 y ESTEEM 2 son muy similares. Ambos son estudios en fase III, multicéntricos, doble ciego, controlados con placebo, aleatorizados 2:1 a recibir apremilast 30 mg cada 12 horas o placebo hasta la semana 16, y divididos en 3 periodos de tratamiento. Las características demográficas de los pacientes, la historia de la enfermedad y los parámetros de psoriasis en placa moderada a grave en ambos estudios son similares. La población es representativa a la de otros ensayos llevados a cabo para los pacientes con esta patología, aunque, se excluyeron del los dos estudios a los pacientes con patologías significativas asociadas (insuficiencia cardiaca, hepática, inmunológica, renal, psiquiatrica, neurológica y hematológica), esto podría ser considerado como una limitación en relación con la población real a tratar. Respecto a los tratamientos previos, en ambos estudios, la proporción de pacientes tratados con otras terapias fueron similares. Aproximadamente un 55% de los pacientes había recibido tratamiento sistémico (biológico y/o convencional), de éstos, el 40% fueron tratados con terapia sistémica convencional y el 30% con terapia biológica, mientras que un tercio de los pacientes eran naive (a terapia sistémica y/o fototerapia). Si consideramos la indicación aprobada, (pacientes que no han respondido, esté contraindicada o no toleren la terapia sistémica convencional incluyendo ciclosporina, metotrexato,o psoraleno y PUVA), podríamos considerar otra limitación del estudio, ya que un tercio no han recibido ningún tratamiento previo y menos de la mitad de los pacientes han sido tratados con terapia sistémica convencional. Por otra parte, el comparador de ambos estudios (placebo) no es el adecuado ya que existen otros tratamientos indicados para esta indicación con los que realizar la comparación. En cuanto a la eficacia, la variable principal (PASI 75 para ambos estudios) es la adecuada así como la variable secundaria principal (puntuación sPGA entre 0 y 1). A partir de la semana 32, los pacientes tratados con apremilast al inicio del estudio que lograron respuesta PASI 75 (ESTEEM 1) o PASI 50 (ESTEEM 2) fueron reasignados aleatoriamente de nuevo a apremilast 30 mg dos veces al día o placebo 1:1.Los pacientes reasignados a placebo que perdieron respuesta PASI 75 (ESTEEM 1) o PASI 50 (ESTEEM 2) volvieron a recibir tratamiento dos veces al día. Según el diseño de los estudios, desde la semana 16 a la 32 todos los pacientes recibieron tratamiento con apremilast, y a partir de la semana 32, los pacientes que no alcanzaron PASI 75 (ESTEEM 1) o PASI 50 (ESTEEM 2) pudieron utilizar tratamientos tópicos y/o fototerapia además 16 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 17 del tratamiento con apremilast. Todo esto sería otra limitación del estudio, ya que hasta la semana 52, todos los pacientes acaban recibiendo tratamiento, por lo tanto a partir de la semana 16 no habría comparador. El siguiente gráfico muestra el diseño de los estudios ESTEEM 1 y ESTEEM 2. (28) Las siguientes tablas muestran la evaluación del riesgo de sesgo de los ensayos pivotales. El diseño de ambos fue adecuado, con la limitación de que el comparador no es el idóneo ya que existen otras alternativas disponibles para realizar la comparación. Tabla unificada de sesgos (Colaboración Cochrane) Evaluaciones del riesgo de sesgo del ensayo ESTEEM 1. Item Sesgo de selección Generación de la secuencia de aleatorización Ocultación de la asignación Sesgo de realización Cegamiento de los participantes y del personal Descripción Apoyo para la valoración Evaluación del riesgo de sesgo Cita: “Subjects were randomised in a 2:1 ratio to receive either apremilast 30 mg BID or placebo, using the IVRS. After 16 weeks of treatment, all subjects originally randomised to placebo were switched to receive apremilast 30 mg BID. In order to evaluate the time to relapse/loss of effect, at Week 32, subjects who were initially randomised to apremilast 30 mg BID and had achieved a response, were re-randomised to either placebo or apremilast 30 mg BID in a 1:1 ratio. No stratification factor was utilized in these studies“. Se asignaron de forma aleatorizada. Se describió el método de aleatorización de los pacientes. Bajo riesgo Cita: “Subjects were randomised in a 2:1 ratio to receive either apremilast 30 mg BID or placebo, using the IVRS”. Asignación aleatorizada 2:1 Bajo riesgo Cita: “This study was a randomized, double-blind, placebo-controlled, parallel-assigment phase 3 trial.” Doble ciego controlado con placebo Bajo riesgo 17 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: Sesgo de detección Cegamiento de los evaluadores Cegamiento de los evaluadores del resultado Sesgo de desgaste Manejo de los datos de resultado incompletos Sesgo de notificación Notificación selectiva de resultados 4.0 10-12-2012 18 Cita: “This study was a randomized, double-blind, placebo-controlled, parallel- assigment phase 3 trial.” Cita: “This study was a randomized, double-blind, placebo-controlled, parallel- assigment phase 3 trial.” Doble ciego Bajo riesgo Doble ciego Bajo riesgo Cita: “ Figura 2” Apremilast, an oral phosphodiesterase 4 (PDE4)inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast inPsoriasis [ESTEEM] 1) clinicaltrials.gov De los 844 pacientes incluidos en el ensayo, hubo 92 pérdidas a la semana 16,14 discontinuaron después de la semana 16 , 32 a partir de la semana 32 y 34 después de la semana 32. Bajo riesgo Cita: “These studies consist of 4 treatment phases (see Figure 5 and 6): a 16-week, randomized, double-blind, placebo-controlled phase; a 16-week double-blind maintenance phase; a 20-week randomized, double-blind treatment withdrawal phase; and a 208-week, open-label long-term safety extension phase. Overall study duration is 5 years. The application contains data from the initial 52 weeks of dosing, spanning the first 3 treatment phases. The long-term extension phases across both studies are ongoing...” No proporcionan los resultados a largo plazo. Riesgo poco claro Otros sesgos No se encuentran Tabla unificada de sesgos (Colaboración Cochrane) Evaluaciones del riesgo de sesgo del ensayo ESTEEM 2. Item Sesgo de selección Generación de la secuencia de aleatorización Ocultación de la asignación Sesgo de realización Cegamiento de los participantes y del personal Sesgo de detección Cegamiento de los evaluadores Cegamiento de los evaluadores del resultado Descripción Apoyo para la valoración Evaluación del riesgo de sesgo Cita: “Subjects were randomised in a 2:1 ratio to receive either apremilast 30 mg BID or placebo, using the IVRS. After 16 weeks of treatment, all subjects originally randomised to placebo were switched to receive apremilast 30 mg BID. In order to evaluate the time to relapse/loss of effect, at Week 32, subjects who were initially randomised to apremilast 30 mg BID and had achieved a response, were re-randomised to either placebo or apremilast 30 mg BID in a 1:1 ratio. No stratification factor was utilized in these studies “. Se asignaron de forma aleatorizada. Se describió el método de aleatorización de los pacientes. Bajo riesgo Cita: “Subjects were randomised in a 2:1 ratio to receive either apremilast 30 mg BID or placebo, using the IVRS”. Asignación aleatorizada 2:1 Bajo riesgo Cita: “This study was a randomized, double-blind, placebo-controlled, parallel-assigment phase 3 trial.” Doble ciego controlado con placebo Bajo riesgo Cita: “This study was a randomized, double-blind, placebo-controlled, parallel- assigment phase 3 trial.” Cita: “This study was a randomized, double-blind, placebo-controlled, parallel- assigment phase 3 trial.” Doble ciego Bajo riesgo Doble ciego Bajo riesgo 18 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: Sesgo de desgaste Manejo de los datos de resultado incompletos Sesgo de notificación Notificación selectiva de resultados 4.0 10-12-2012 19 Cita: “Apremilast, an oral phosphodiesterase 4 (PDE4)inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 2). Clinicaltrials.gov De los 411 pacientes incluidos en el ensayo, hubo 62 pérdidas a la semana 16, 9 discontinuaron durante la fase 1632 y 17 después de la semana 32. Bajo riesgo Cita: “These studies consist of 4 treatment phases (see Figure 5 and 6): a 16-week, randomized, double-blind, placebo-controlled phase; a 16-week double-blind maintenance phase; a 20-week randomized, double-blind treatment withdrawal phase; and a 208-week, open-label long-term safety extension phase. Overall study duration is 5 years. The application contains data from the initial 52 weeks of dosing, spanning the first 3 treatment phases. The long-term extension phases across both studies are ongoing..” No proporcionan los resultados a largo plazo. Riesgo poco claro Otros sesgos No se encuentran B. Aplicabilidad del ensayo a la práctica del hospital CUESTIONARIO SOBRE LA APLICABILIDAD DE UN ENSAYO CLÍNICO ENSAYOS ESTEEM 1 Y ESTEEM 2 SI /NO JUSTIFICAR ¿Considera adecuado el comparador? ¿Es NO El comparador es placebo. Lo adecuado sería comparar el tratamiento control adecuado en nuestro apremilast frente a las alternativas activas disponibles para la medio? indicación estudiada (anti-TNF, anti-IL12 anti IL23 y IL17A) ¿Son importantes clínicamente los resultados? SI Los datos son estadísticamente significativos y esta mejora es clínicamente relevante (al límite) a las 16 semanas en la variable principal y en las variables secundarias principal (PASI, sPGA) comparado con placebo. En ambos ensayos el mantenimiento de PASI 75 en la fase de mantenimiento (16-32) no se puede comparar con placebo porque todos los pacientes están con apremilast. Se han empleado como variable principal PASI 75 que es la variable final y es la que suele usarse en la práctica clínica para evaluar la evolución y la gravedad de los pacientes con psoriasis en placa de moderada a grave. Criterios similares a otros ensayos clínicos de psoriasis. Los pacientes incluidos en los estudios son representativos de los pacientes con psoriasis en placa de moderada a grave. ¿Considera adecuada la variable de medida SI utilizada? ¿Considera adecuados los criterios de inclusión y/o exclusión de los pacientes? SI ¿Cree que los resultados pueden ser aplicados directamente a la práctica clínica? SI Otros sesgos o limitaciones encontradas en el estudio SI Ambos estudios incluyen pacientes naive a tratamiento sistémico o biológico, previamente tratados con inmunosupresores habituales (biológicos y anti-TNF), así como aquellos que no han respondido a éstos. Son estudios multicéntricos. No disponemos de los datos a largo plazo de ambos estudios en cuanto a eficacia y seguridad. Otra limitación de ambos estudios es que no incluye resultados de la variable principal de eficacia por subgrupos según el tratamiento previo recibido, luego no podemos evaluar los resultados según la terapia previa recibida. Un tercio de los pacientes era naive. No se conoce la efectividad de los tratamientos biológicos después de recibir tratamiento con apremilast. 19 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 20 C. Relevancia clínica de los resultados C.1 Valorar si la magnitud del efecto del tratamiento es de relevancia clínica. En ambos estudios, los sujetos tratados con apremilast alcanzaron una respuesta PASI 75 a la semana 16 con significación estadística (p< 0.0001). Los resultados fueron para placebo y apremilast 5.3% y 33.1% (ESTEEM 1) y 5.8% y 28.8% (ESTEEM 2) respectivamente. En cuanto al RAR (IC 95), en ambos estudios los resultados fueron: - ESTEEM 1: 27%(23,1-32,5) ESTEEM 2: 23%(16.3-29.6) Aunque no existe un consenso en la literatura sobre la mínima diferencia en el PASI 75 que sería considerada clínicamente relevante para el tratamiento en psoriasis en placa moderada grave, en determinados estudios y guías consideraron el valor del 20% como límite de la relevancia clínica en términos de PASI 75 (6). Los resultados en ambos estudios son favorables para apremilast estando al límite de la relevancia clínica. En cuanto a la variable secundaria principal (sPGA), los resultados alcanzados en ambos estudios fueron favorables para apremilast (p<0.001), con unas tasas de respuesta para placebo y apremilast de 3.9% y 21.7% (STEEEM-1) y 4.4 % y 20.4% (ESTEEM-2) respectivamente. Actualmente, hay un ensayo fase IIIb, aleatorizado 1:1:1 (apremilast 30 mg dos veces al día, etanercept 50 mg y placebo). Sólo hay disponible el resultado de eficacia PASI 75 de apremilast comparado con placebo (variable principal del estudio), donde el 39.8 % de los pacientes con apremilast alcanzaron respuesta frente el 11.9% con placebo con una diferencia estadísticamente significativa (p< 0.001). Ya que no hay resultados disponibles en relación a la eficacia de apremilast con un comparador activo(30), se considera difícil e inadecuado establecer la eficacia y la seguridad de apremilast frente a las otras terapias sistémicas. C.2 La evidencia de equivalencia terapéutica. No existen hasta el momento estudios que avalen la equivalencia terapéutica con el resto de alternativas disponibles. C.3 Alternativas terapéuticas equivalentes (ATE) En el informe de Génesis de secukinumab,(12) se llevó a cabo una comparación indirecta que incluyó apremilast. Los resultados que hacen referencia a apremilast se muestran a continuación: Se elige como variable principal para la evaluación de alternativas terapéuticas equivalentes (ATE) el PASI 75, por considerar el 75% de la reducción del valor del valor del PASI como una reducción suficiente para considerar el éxito del tratamiento y por su relevancia clínica. Se concluyó que, según el algoritmo de la Guía ATE, apremilast y etanercept 25 mg 2x25 mg y 2x50 mg semanal, obtendrían un posicionamiento “G: diferencia relevante”. Existen diferencias estadísticamente significativas y clínicamente relevantes con respecto a los comparadores que fueron infliximab y secukinumab 300 mg. Por lo tanto no se pueden considerar ATE puesto que todas las alternativas disponibles son más eficaces que apremilast. Por otra parte, en una revisión publicada, se cita un network metanálisis que incluye a apremilast como la alternativa con la probablidad más baja de alcanzar respuesta PASI. (infliximab 85% > ustekinumab 45 mg 77%> adalimumab 62% > etanercept 43%> apremilast > placebo)(36). 5.2.c Evaluación de las pruebas de cribado utilizadas No procede. 5.3 Revisiones sistemáticas publicadas, comparaciones indirectas y sus conclusiones 20 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 21 5.3.a Revisiones sistemáticas publicadas Se realizó una búsqueda bibliográfica en Pubmed con los siguientes criterios: - “psoriasis AND systematic review AND apremilast”, 1. Efficacy and Safety of Systemic Long-Term Treatments for Moderate-to-Severe Psoriasis: A Systematic Review and Meta-Analysis Alexander Nast, Anja Jacobs, Stefanie Rosumeck and Ricardo N. Werner. Journal of Investigative Dermatology (2015), Volume 135.(31) Esta revisión tiene como objetivo el análisis de eficacia y seguridad de los tratamientos a largo plazo para la psoriasis moderada a grave. Incluye 25 estudios con un total de 11.279 pacientes aleatorizados. Diez de los estudios eran controlados con placebo, en 11, el tratamiento control era con placebo y tratamiento activo y 4 de ellos tuvieron al menos un tratamiento activo como control. Concluyen que la terapia biológica y apremilast han demostrado eficacia clínica frente a placebo. Con respecto a la seguridad a largo plazo no hay diferencias significativas para adalimumab, etanercept e infliximab. Para secukinumab, ustekinumab y apremilast no hay resultados de seguridad a largo plazo disponibles. En el análisis de las comparaciones indirectas en relación a la variable de eficacia PASI 75, los mejores resultados fueron para infliximab, secukinumab y ustekinumab seguido de adalimumab y etanercept. Apremilast demostró la tasa más baja de respuesta PASI 75. Se concluye que, son necesarios más estudios que permitan comparaciones directas de eficacia y seguridad. Además son escasos los estudios con resultados a largo plazo. 2. New developments in the management of psoriasis and psoriatic arthritis: a focus on apremilast. Andrew C Palfreeman Kay E McNamee Fiona E McCann The Kennedy Institute of Rheumatology, Nuffield Department of Orthopedics, Rheumatology and Musculoskeletal Sciences, University of Oxford, London, UK (32) La revisión resume que apremilast ha demostrado conseguir respuesta PASI 75, sin embargo son ensayos controlados con placebo, y las tasas de respuesta de apremilast comparadas con la terapia biológica son inferiores. El tratamiento con apremilast alcanza un máximo de respuesta PASI 75 del 41% comparado con el 75% en los pacientes tratados con adalimumab y un 80% para infliximab. También se obtiene mejores resultados para secukinumab (entre un 75 y 85 %) y para ustekinumab (67 -82%). 5.3.b Comparaciones indirectas (CCII) 5.3.b.1 Comparaciones Indirectas publicadas 21 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 22 No se han localizado comparaciones indirectas que incluyan apremilast. 5.3.b.2 Comparaciones indirectas de elaboración propia Se extraen las tablas comparativas de las alternativas terapéuticas con agentes biológicos y apremilast realizadas en el informe Génesis para secukinumab:(12) En primer lugar, se compararon secukinumab 150 mg, secukinumab 300 mg, adalimumab, ustekinumab 45 mg, ustekinumab 90 mg, apremilast, etanercept 25 mg/ semana, etanercept 2x25 mg/ semana, etanercept 2x50 mg/ semana e infliximab 3 mg/kg frente a infliximab 5 mg/kg, utilizado como comparador común. Se eligió infliximab 5 mg/Kg como comparador por tener el RAR mayor en la variable principal PASI 75 medida en la semana 12. Como limitación, en el caso de infliximab, la variable principal PASI 75 en los estudios se valoró en la semana 10 y en el caso de apremilast se valoró en la semana 16. COMPARACIÓN INDIRECTA AJUSTADA SECUKINUMAB, ADALIMUMAB, APREMILAST, USTEKINUMAB Y ETANERCEPT FRENTE A INFLIXIMAB 5 mg/kg Resultados Variable Secukinumab Secukinumab Adalimumab Ustekinumab 45 Ustekinumab 90 evaluada 150 mg 300 mg RAR(IC 95%) mg mg (semana RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) 12) Resultado principal 14 11 PASI75 3 (-3.72 a 9.72) 16 (9.89 a 22.10) 16 (9.89 a 22.10) (1.13 a 20.86) (7.59 a 20.40) Los resultados que se presentan con signo positivo son favorables a infliximab -Software ITC Wells GA, Sultan SA, Chen L, Khan M, Coyle D.Indirect treatment comparison [computer program]. Version 1.0. Ottawa: Canadian Agency for Drugs and Technologies in Health; 2009. COMPARACIÓN INDIRECTA AJUSTADA SECUKINUMAB, ADALIMUMAB, APREMILAST, USTEKINUMAB Y ETANERCEPT FRENTE A INFLIXIMAB 5 mg/kg Resultados Variable Apremilast Etanercept 2x25 Etanercept 2x50 Etanercept 25 mg Infliximab 3 evaluada RAR(IC 95%) mg mg RAR(IC 95%) mg/kg (semana RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) 12) Resultado principal 53 48 33 69 13.2 PASI75 (45.92 a 60.07) (41.27 a 54.72) (25.56 a 40.43) (61.07 a 76.92) (1.11 a 25.28) Los resultados que se presentan con signo positivo son favorables a infliximab -Software ITC Wells GA, Sultan SA, Chen L, Khan M, Coyle D.Indirect treatment comparison [computer program]. Version 1.0. Ottawa: Canadian Agency for Drugs and Technologies in Health; 2009. En azul: sin diferencias estadísticamente significativas respecto a infliximab 5 mg/kg En rojo: Diferencia estadísticamente significativa favorable a infliximab 5 mg/kg Existen diferencias estadísticamente significativas en la variable principal elegida (PASI 75) para determinar la equivalencia en todos los fármacos comparados a favor de infliximab 5 mg/kg, excepto para secukinumab 300 mg, donde se determina que no hay diferencia estadísticamente significativa. En segundo lugar, se compararon secukinumab 150 mg, adalimumab, ustekinumab 45 mg, ustekinumab 90 mg, apremilast, etanercept 25 mg/ semana, etanercept 2x25 mg/ semana, etanercept 2x50 mg/ semana e infliximab 3 mg/kg frente a secukinumab 300 mg, utilizado como comparador común. Se eligió secukinumab 300 mg como comparador por ser el fármaco evaluado y la dosis elegida 300 mg, por ser la dosis habitual aprobada en la ficha técnica de secukinumab para la indicación estudiada 22 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 23 COMPARACIÓN INDIRECTA AJUSTADA SECUKINUMAB 150 mg, ADALIMUMAB, APREMILAST, USTEKINUMAB, ETANERCEPT E INFLIXIMAB 3 mg/kg FRENTE A SECUKINUMAB 300 MG Resultados Variable Secukinumab Adalimumab Ustekinumab 45 Ustekinumab Apremilast evaluada 150 mg mg 90 mg (semana RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) 12) Resultado principal 13 50 PASI75 11(4.97 a 17.02) 13 (7.29 a 18.70) 8 (-1.61 a 17.61) (7.29 a 18.7) (43.27 a 56.72) Los resultados que se presentan con signo positivo son favorables a secukinumab 300 mg -Software ITC Wells GA, Sultan SA, Chen L, Khan M, Coyle D.Indirect treatment comparison [computer program]. Version 1.0. Ottawa: Canadian Agency for Drugs and Technologies in Health; 2009. COMPARACIÓN INDIRECTA AJUSTADA SECUKINUMAB 150 mg, ADALIMUMAB, APREMILAST, USTEKINUMAB, ETANERCEPT e INFLIXIMAB 3 mg/kg FRENTE A SECUKINUMAB 300 MG Resultados Variable Etanercept 2x25 mg Etanercept 2x50 mg Etanercept 25 mg Infliximab 3 mg/kg evaluada RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) RAR(IC 95%) (semana 12) Resultado principal PASI75 45 (38.63 a 51.36) 30 (22.89 a 37.10) 66 (54.16 a 77.83) 10.2 (-1.68 a 22.08) Los resultados que se presentan con signo positivo son favorables a secukinumab 300 mg -Software ITC Wells GA, Sultan SA, Chen L, Khan M, Coyle D.Indirect treatment comparison [computer program]. Version 1.0. Ottawa: Canadian Agency for Drugs and Technologies in Health; 2009. No diferencias estadísticamente significativas respecto a secukinumab 300 mg Diferencia estadísticamente significativa favorable a secukinumab 300 mg Existen diferencias estadísticamente significativas en la variable principal elegida (PASI 75) para determinar la equivalencia en todos los fármacos comparados a favor de secukinumab 300 mg, excepto para ustekinumab 90 mg e infliximab 3 mg/kg, donde se determina que no hay diferencia estadísticamente significativa. 5.4 Evaluación de fuentes secundarias 5.4.1 Guías de Práctica clínica En la actualidad, las guías de práctica clínica no incluyen apremilast para la psoriasis en placa moderada- grave. NICE (10): guía clínica para psoriasis 2012. Establece un algoritmo de tratamiento donde figura: Terapia biológica en pacientes que no responden, son intolerantes o tiene contraindicada otras terapias sistémicas, incluido ciclosporina, metotrexato y PUVA. Con PASI > 10 y DLQI > 10 adalimumab, etanercept o ustekinumab. Con PASI > 20 y DLQI >18 adalimumab, etanercept, infliximab o ustekinumab Recomiendan medir la respuesta para infliximab a las 10 semanas, a las 12 para etanercept y a las 16 para adalimumab o ustekinumab. Si hay respuesta, se debe mantener el tratamiento, si no alcanzan respuesta (PASI <75 o PASI 50 y DLQI 5 puntos menos que el valor basal), cambio a otro tratamiento biológico. SCOTTISH INTERCOLLEGIATE GUIDELINES NETWORK:(33) tratamiento de la psoriasis y artritis psoriasica (2012). 23 Guía del diagnóstico y Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 24 Los pacientes con psoriasis moderada a grave que no han respondido, son intolerantes o tienen contraindicada la fototerapia y/o las terapias sistémicas incluyendo ciclosporina y metotrexato, han de ser tratados con terapia biológica siempre y cuando no esté contraindicada o sea mayor el riesgo que beneficio. -Nivel de evidencia A: adalimumab 40 mg cada 15 días, etanercept 25 mg o 50 mg semanal, infliximab 5 mg/kg, semanas 0,2,6 seguido de cada dos meses (especialmente cuando se requiere un control rápido de la enfermedad). UP TO DATE:(1) Recomiendan para los pacientes con psoriasis en placa moderada o grave el tratamiento con fototerapia y en caso de fracaso o contraindicación, el tratamiento sistémico incluyendo retinoides, metotrexate, ciclosporina, apremilast o agentes biológicos. No posicionan apremilast en un lugar específico de la terapéutica. AGENCIA DE EVALUACIÓN DE TECNOLOGÍAS SANITARIAS (AETSA): En el periodo de inducción infliximab presenta mayor rapidez de acción y por lo tanto podría ser valorado para pacientes con mayor gravedad inicial (PASI ≥20). Ustekinumab 45 mg y adalimumab pueden considerarse similares en el periodo de inducción así como adalimumab y etanercept. Sin embargo, ustekinumab 45 mg y etanercept 50 mg bisemanal no presentan eficacia similar. Para el fase de mantenimiento cualquiera de los 4 fármacos puede utilizarse en este periodo por considerarse similares (grado de evidencia D). 5.4.2 Evaluaciones previas por organismos independientes Se dispone de un IPT(34) de la Agencia Española de Medicamentos y Productos Sanitarios, el cual declara que en base al modesto perfil de eficacia observado hasta la fecha, apremilast es una opción de tratamiento oral en pacientes que no responden a la terapia sistémica convencional, cuando otras alternativas disponibles no sean adecuadas. En el informe de evaluación del NICE, (10)(noviembre 2015): no recomienda el tratamiento con apremilast en el marco de su autorización de comercialización. Establece el uso de terapia tópica seguida terapia sistémica convencional y o fototerapia. Si no hay respuesta, recomienda el uso de agentes biológicos, si hay fallo a alguno, cambiar de biológico. Por último, si no responden a las alternativas bIológicas disponibles, propone recibir tratamiento de soporte. La Scottish Medicines Consortium (SMC)(35): ha aprobado el uso restringido de apremilast en el NHS escocés únicamente para el tratamiento de artritis psoriásica activa que han tenido una respuesta inadecuada a al menos dos terapias anteriores FAME o que son intolerantes a estas terapias. 6. EVALUACIÓN DE LA SEGURIDAD. 6.1.a Descripción de la búsqueda bibliográfica Se revisaron los efectos adversos registrados en los dos ensayos pivotales (ESTEEM 1 y ESTEEM 2)(25) (27). 6.1.b Descripción de los efectos adversos más significativos En los estudios realizados hasta la comercialización, (ESTEEM 1 y ESTEEM 2) los efectos adversos más frecuentes fueron gastrointestinales (diarrea 15,7% y náuseas 13,9%), nasofaringitis, infección respiratoria superior y dolor de cabeza. La mayor parte de estas reacciones fueron de intensidad leve a moderada, con un 0,3 % de náuseas y diarrea clasificados 24 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 25 como severos. Estas reacciones adversas tuvieron lugar en las dos primeras semanas de tratamiento y en general remitieron a las 4 semanas. Otras reacciones adversas notificadas con mayor frecuencia fueron infecciones del tracto respiratorio superior (8,4%), cefalea (7,9%) y cefalea tensional (7,2%). Durante el periodo controlado con placebo de los ensayos clínicos, el 1,2 % (14/1184) de los pacientes tratados con apremilast notificó depresión, en comparación con el 0.5% (2/418) de los pacientes tratados con placebo. Ninguno de estos casos de depresión fue grave. En general, la mayoría de las reacciones registradas fueron consideradas de intensidad leve a moderada, la incidencia de efectos adversos graves fue baja y sin afectación a ningún órgano específico. Las reacciones adversas más frecuentes que dieron lugar a la interrupción durante las primeras 16 semanas de tratamiento fueron diarrea (1,7 %) y náuseas (1,5 %). Fallecieron 3 sujetos tratados con apremilast y uno con placebo. En la tabla adjunta se expone los efectos adversos en los diferentes periodos de exposición agrupando los datos de los dos ensayos. EPAR de Apremilast(30) Resultados de seguridad de los pacientes tratados entre la semana 0 -16 con apremilast Variable de seguridad evaluada Apremilast Placebo RAR (IC 95%) Diferencia en el estudio N (832) N (418) Riesgo Absoluto * Presencia de algún efecto adverso Diarrea Naúseas Infección respiratoria superior Nasofaringitis Dolor de cabeza tensional Dolor de cabeza Vómitos Fatiga Dispepsia Pérdida de apetitp Artralgia Sinusitis Dolor de espalda Migraña Dolor abdominal 573(68,9%) 148(17,8%) 138(16,6%) 70(8,4%) 61(7,3%) 61(7,3%) 48(5,8%) 31(3,7%) 25(3,3%) 25(3,0%) 23(2,8%) 14(1,70%) 18(2,2%) 20(2,4%) 17(2,0%) 18(2,2%) 239(57,2%) 28(6,7%) 28(6,7%) 27(6,5%) 29(6,7%) 14(3,3%) 14(3,3%) 7(1,7%) 6(1,4%) 4(1,0%) 4(1,0%) 7(1,7%) 6(1,4%) 4(1,0%) 4(1,0%) 6(1,4%) 11,7% (6 a 17,4) 11,1% (7,6 a14,6) 9,9%( 6,4 a 13,4) 2%(: -1,1 a 5) 0,4% ( -2,6 a 3,4) 4% (1,5 a 6,5) 2,4% ( 0,1 a 4,8) 2,1%(0,3 a 3,8) 1,6%(-0,1 a 3,2) 2%(0,6 a 3,5) 1,8%(0,4 a 3,3) 0%(-1,5 a 1,5) 0,7%(-0,8 a 2,2) 1,4%(0,0 a 2,8) 1,1%(-0,3 a 2,4) 0,7%(-0,8 a 2,2) EPAR de Apremilast(29) Resultados de seguridad de los pacientes tratados entre la semana 0 -52 con apremilast Variable de seguridad evaluada en el estudio Apremilast a la semana 52 N (1184) -Presencia de algún efecto adverso 793(67,0%) -Diarrea 186(15,7%) -Naúseas 164(13,9%) -Infección respiratoria superior 100(8,4%) -Nasofaringitis 89(7,5%) -Dolor de cabeza tensional 85(7,2%) -Dolor de cabeza 59(5,0%) -Vómitos 39(3,3%) -Fatiga 32(2,7%) -Dispepsia 31 (2,6%) -Pérdida de apetitp 28(2,4%) -Artralgia 25(2,1%) -Sinusitis 25(2,1%) -Dolor de espalda 25(2,1%) -Migraña 25(2,1%) -Dolor abdominal 24(2,0%) 25 NNH o NND (IC 95%) 9(6 a 17) 9( 7 a 13) 10 ( 7 a 16) Versión: GENESIS-SEFH 4.0 10-12-2012 26 Programa MADRE versión 4.0 Fecha: Informe Base Página: En las siguientes tablas se muestran los efectos adversos registrados en función de la gravedad en cada uno de los dos ensayos pivotales durante todos los periodos de exposición. Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized,controlled trial (25) Resultados (semana 0 – 16) Apremilast 30 RAR ajustada (IC95%) Variable de seguridad Placebo NNH Apremilast 30 (Calculadora mg BID Placebo vs. Apremilast evaluada en el estudio N = 282 CASPe) N = 560 30 mg - ≥ 1 EA - ≥ 1 EA moderado - ≥ 1 EA grave EA con una frecuencia ≥5% en cualquier grupo: - Diarrea - Infección resp vías altas - Nauseas - Nasofaringitis - Dolor de cabeza tensional - Dolor de cabeza EA que provocaron la interrupción en > 1 paciente en cualquier grupo de tratamiento: - Diarrea - Nauseas - Psoriasis - Vómitos 157 (55,7%) 9 (3.2%) 8 (2.8%) 388 (69,3%) 20 (3,6%) 12 (2.1%) 13,6%(6,7-20,6) 0,4 (-2,2% a 2,9%) -0.7 (-3% a 1,6%) 20 (7.1%) 21 (7,4%) 19 (6,7%) 23 (8,2%) 12 (4,3%) 13 (4,6%) 105 (18,8%) 57 (10,.2%) 88 (15.7%) 41(7,3%) 41(7,3%) 31(5,5%) 11,7% (7,3% a 16,1%) 2,7% (-1,2 a 6,7%) 9% (4,8% a 13,2%) -0,8(-4,7 a 3) 3,1(-0, a 6,3) 0,9(-2,2, a 4,0) 1 (0,4%) 1 (0,4%) 1 (0,4%) 0 (0,0%) 7 (1,3%) 10 (1.8%) 2 (0,4%) 1(0,2%) 0 0 0 1 (0,2%) 0 0 7(5-15) EA graves que ocurrieron > 1 paciente en cualquier grupo de tratamiento: -Infarto agudo de miocardio -Enf.coronaria arterial -Nefrolitiasis Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized,controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1) Resultados (periodo de exposición a apremilast (semana 0-52) Variable de seguridad Apremilast 30 mg BID evaluada en el estudio N = 804 - ≥ 1 EA - ≥ 1 EA grave - ≥ 1 EA moderado EA con una frecuencia ≥5% en cualquier grupo: - Diarrea - Infección resp vías altas - Nauseas - Nasofaringitis - Dolor de cabeza tensional - Dolor de cabeza EA que provocaron la interrupción en > 1 paciente en cualquier grupo de tratamiento: - Diarrea - Nauseas - Psoriasis - Vómitos EA graves que ocurrieron > 1 paciente en cualquier grupo de tratamiento: 633 (78,7) 34 (4,2%) 48 (6.0%) -Infarto agudo de miocardio -Enf.coronaria arterial -Nefrolitiasis 2 (0,2%) 3 (0.4%) 3 (0,4%) 150 (18,7%) 143 (17,.8%) 123(15.3%) 108(13,4%) 77(9,6%) 52(6,5%) 10 (1,2%) 14 (1.7%) 6 (0,7%) 4(0,5%) 26 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 27 Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate-to-severe plaque psoriasis over 52 weeks: aphase III, randomized controlled trial (ESTEEM 2) British Journal of Dermatology (2015)173, pp1387–1399(27) Resultados (semana 0-16) Variable de seguridad Placebo Apremilast 30 mg BID evaluada en el estudio N = 136 N = 272 - ≥ 1 EA - ≥ 1 EA moderado - ≥ 1 EA grave EA con una frecuencia ≥5% en cualquier grupo: - Diarrea - Infección resp vías altas - Nauseas - Nasofaringitis - Dolor de cabeza tensional - Dolor de cabeza - Dolor de espalda EA que provocaron la interrupción en > 1 paciente en cualquier grupo de tratamiento: - Nauseas - Psoriasis - Dolor de cabeza Alteraciones en marcadores de laboratorio> limite sup de normalidad (% -ALT>3 X ULN -AST>3 X ULN -Trigliceridos >3.4mmol L-¹ or 301,2 mg dL-¹ 82 (60,3%) 6 (4,4%) 3(2.2%) 185(68,0%) 12 (4,4%) 5 (1,8%) 8 (5,9%) 6 (4,4%) 9 (6,6%) 6 (4,4%) 2 (1,5%) 1 (0,7%) 2 (1,5%) 43 (15,8%) 13(4,8%) 50 (18,4%) 20(7,4%) 20(7,4%) 17 (6,3%) 6 (2,2%) 0 (0,0%) 3 (2,2%) 0 (0,0%) 3 (1.1%) 2 (0,7%) 2 (0,7%) 0/130(0.0) 2/130(1.5) 10/121(8.3) 0/263(0.0) 0/263(0.0) 31/248(12.5) Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate-to-severe plaque psoriasis over 52 weeks: aphase III, randomized controlled trial (ESTEEM 2) British Journal of Dermatology (2015)173, pp1387–1399 Resultados (periodo de exposición a apremilast (semana 0-52) Variable de seguridad Apremilast 30 mg BID evaluada en el estudio N = 380 - ≥ 1 EA - ≥ 1 EA moderado - ≥ 1 EA grave EA con una frecuencia ≥5% en cualquier grupo: - Diarrea - Infección resp vías altas - Nauseas - Nasofaringitis - Dolor de cabeza tensional - Dolor de cabeza - Dolor de espalda EA que provocaron la interrupción en > 1 paciente en cualquier grupo de tratamiento: - Nauseas - Psoriasis - Dolor de cabeza Alteraciones en marcadores de laboratorio> limite sup de normalidad (%) -ALT>3 X ULN -AST>3 X ULN -Trigliceridos >3.4mmol L-¹ or 301,2 mg dL-¹ 296 (7,9) 18(4,7%) 33 (8.7%) 55 (14,7%) 35 (9,2%) 63(16,6%) 55(14,5%) 29(7,6%) 22(5,8) 20(5,3) 3 (0,8%) 3 (0,8%) 2(0,5%) 2/370 (0,5%) 6/370 (1.6%) 62/357 (17,4%) 27 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 28 En la siguiente tabla se muestra la seguridad a largo plazo (semanas 52 a 104) durante el estudio ESTEEM 1. Two-Year Safety of Apremilast, an Oral Phosphodiesterase 4 Inhibitor, in Patients With Moderate to Severe Psoriasis: Results From a Phase 3, Randomized, Controlled Trial (ESTEEM 1) (36) Resultados (periodo de exposición a apremilast (semana 52-104) Variable de seguridad Apremilast 30 mg BID evaluada en el estudio N = 444 - ≥ 1 EA - ≥ 1 EA grave - ≥ 1 EA moderado EA con una frecuencia ≥5% en cualquier grupo: - Diarrea - Infección resp vías altas - Nauseas - Nasofaringitis - Dolor de cabeza tensional - Dolor de cabeza EA que provocaron la interrupción en > 2 pacientes en cualquier grupo de tratamiento: - Nauseas - Psoriasis - Dolor de cabeza Efectos adversos graves en > 2 pacientes en cualquier grupo de tratamiento (%) -Infarto agudo de miocadio -Osteoartritis -Nefrolitiasis Efectos adversos graves: infecciones, neoplasias.. -Eventos cardiacos -Neoplasia piel -Abceso cerebral 257 (57,9) 24(5,4%) 14 (3.2%) 8 (1,8%) 43 (9,7%) 3(0,7%) 30(6,8%) 7(1,6%) 3(0,7%) 0 (0,0%) 4 (0,9%) 1(0,2%) 1 (0,2%) 2 (0,5%) 1 (0,2%) 3 (0,7%) 2 (0,5%) 1 (0,2%) 6.4 Precauciones de empleo en casos especiales - - Pacientes con edad avanzada: no se requiere ajuste de dosis en esta población de pacientes. No se observaron diferencias globales entre el perfil de seguridad de los pacientes ≥65 años y el de los pacientes adultos más < 65 años en los estudios clínicos. Pacientes con insuficiencia hepática: no se evaluó el perfil de seguridad en pacientes con insuficiencia hepática e insuficiencia hepática. Pacientes con insuficiencia renal: el perfil de seguridad observado en pacientes con insuficiencia renal leve fue comparable al de los pacientes con función renal normal. No se evaluó la seguridad en los pacientes con psoriasis e insuficiencia renal moderada o grave en los estudios clínicos. No es necesario realizar ajuste de dosis en pacientes con insuficiencia renal leve a moderada. Se debe reducir 30 mg al día en pacientes con insuficiencia renal grave. Población pediátrica: no se ha establecido la eficacia y seguridad de apremilast de 0 a 17 años. No se dispone de datos. Contraindicaciones: hipersensibilidad al principio activo o a alguno de los excipientes.Embarazo. Interacciones: 28 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: - - 4.0 10-12-2012 29 Inductores enzimáticos del CYP3A4: rifampicina, fenobarbital, carbamazepina , fenitoína y hierba de San Juan pueden disminuir los niveles de apremilast lo que puede dar lugar a una respuesta clínica reducida. Dabrafenib: Puede disminuir los niveles de los sustratos del CYP3A4. Manejo: Cuando sea posible buscar alternativas al sustrato CYP3A4. Si la terapia concomitante no puede evitarse, se deberá vigilar los efectos terapéuticos del sustrato. Riesgo D: Considerar cambio de tratamiento. Deferasirox: Puede disminuir los niveles de los sustratos del CYP3A4. Riesgo C: Monitorizar. Siltuximab: Puede disminuir los niveles de los sustratos del CYP3A4. Riesgo C: Monitorizar. Tocilizumab: Puede disminuir los niveles de los sustratos del CYP3A4. Riesgo C: Monitorizar. Monitorización de efectos adversos y precauciones: Se debe monitorizar el peso de los pacientes que al inicio con apremilast tengan un peso inferior al normal. En caso de pérdida de peso significativa se debe considerar la evaluación del paciente y la interrupción del tratamiento. 7. AREA ECONÓMICA 7.1 Coste tratamiento. Coste incremental 29 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 30 Comparación de costes del tratamiento evaluado frente a otra/s alternativa/s (PVL-descuento oficial del 7,5% )+ IVA 4% MEDICAMENTO Apremilast (18) Adalimumab(16) Secukinumab (13) Etanercept (14) Pluma Precargada Pluma precargada 150 mg Jeringa 40mg Precargada 50mg Precio unitario (PVL+IVA) * 14,08 € 484,60 € 549,78€ 227,81 € (BotPlus) 300 mg sc semanas 0, 1, 2 , 25mg sc 2 40 mg sc cada 2 3, Posología 30 mg/12 horas veces / sem o semanas después 300 mg mensuales 50mg/semana empezando en la semana 4 n" unidades/ administraciones-año Coste tratamiento completo o tratamiento/año Costes directos asociados Coste global o coste global tratamiento/año Coste incremental (diferencial) respecto a la terapia de referencia 730 dosis 26 dosis Primer año: 15 dosis Años siguientes: 12 10.285,44 € 12.599,6€ Primer año: 16.493,4€ Años siguientes: 13.194,72€ #Costes de dispensación hospitalaria: #Costes de dispensación hospitalaria: #Costes de dispensación hospitalaria: No relevantes No relevantes 12.599,6€ 10.285,44 € -1.120,03 € + 2.030,6€ 30 No relevantes Primer año: 16.493,4€ Años siguientes: 13.194,72€ Primer año: +6.207,96€ Años siguientes: +2.909,28€ 52 dosis 11.846,49€ #Costes de dispensación hospitalaria: No relevantes 11.846,49€ REFERENCIA Infliximab(15) 1 mg. Cálculo con vial optimizado Ustekinumab(17) Jeringa Precargada 45mg 5,159€ 2.936,28€ 5mg/Kg iv sem 0, 2 y 6, y Posteriormente c/8 sem. Primer año: 8 dosis Años siguientes: 6,5 dosis 45mg sc semanas 0, 4 y posteriormente c/ 12 sem. Primer año: 5 dosis Años siguientes: 4,3 dosis Primer año 60 Kg: 12.381,6 € 70 Kg: 14.445,2 € Primer año: 80 Kg: 16.508,8 € 14.681,42€ Años siguientes Años siguientes 60 Kg: 10.060,05 € 12.626€ 70 Kg: 11.736,73 € 80 Kg: 13.413,4 € (Documento CAM) Coste medio preparación MIV #Costes de dispensación SF 6,83 €. hospitalaria: Coste medio administración en Hospital de Día: 110,93 € No relevantes Total primer año: 942,08 € Total años siguientes: 765,44 Primer año 60 Kg: 13.323,68 € 70 Kg: 15.387,28 € Primer año: 80 Kg: 17.450,88 € 14.681,42€ Años siguientes Años siguientes 60 Kg: 10.825,49 € 12.626€ 70 Kg: 12.502,17 € 80 Kg: 14.178,84 € Primer año 60 Kg: +2.754,68€ 70 Kg: + 4.818,28 € Primer año: 80 Kg: + 6.881,88€ + 2.834,93 € Años siguientes Años siguientes: 60 Kg: +256,49 € +779,51 € 70 Kg: +1.933,17 € 80 Kg: +3.609,84 € Versión: GENESIS-SEFH 4.0 10-12-2012 31 Programa MADRE versión 4.0 Fecha: Informe Base Página: MEDICAMENTO Apremilast 8 11 11 Infliximab biosimilar . Remsina®, Inflectra®. Infliximab biosimilar . Remsina®, Inflectra®. 1 mg. Cálculo con vial optimizado Se estima un 30% 1 mg. Cálculo con vial optimizado 47 de descuento frente al innovador Análisis de sensibilidad: 40% de descuento frente al innovador Precio unitario (PVL+IVA) 14,08 € 3,611 € 3,0954€ Posología 30 mg/12 horas 5mg/Kg iv sem 0, 2 y 6, y posteriormente cada 8 semanas 5mg/Kg iv sem 0, 2 y 6, y posteriormente cada 8 semanas n" unidades/administracionesaño 730 dosis Primer año: 8 dosis Años siguientes: 6,5 dosis Primer año: 60 Kg: 8.667,12 € 70 Kg: 10.111,64 € 80 Kg: 11.556,16 € Sucesivos: 60 Kg: 7.042,035 € 70 Kg: 8.215,71 € 80 Kg: 9.389,38 € Primer año: 8 dosis Años siguientes: 6,5 dosis Coste tratamiento tratamiento/año Costes directos asociados. Cada administración: Coste global o coste global tratamiento/año 10.285,44 € No relevantes 10.285,44 € Primer año: - 60 Kg: +676,24 € - 70 Kg: -768,28 € - 80 Kg: -2.212,80 € Coste incremental (diferencial) respecto a la terapia de referencia Sucesivos: - 60 Kg: +2.477,96 € - 70 Kg: +1.304,29 € - 80 Kg: -130,62 € 31 Primer año: 60 Kg: 7.428,96€ 70 Kg: 8.667,12 € 80 Kg: 9.905,28 € Sucesivos: 60 Kg: 6.036,03 € 70 Kg: 7.042,04 € 80 Kg: 8.048,04 € Coste medio preparación MIV SF 6,83 €.; Coste medio administración en Hospital de Día: 110,93 € Total primer año: 942,08 €; Total años siguientes: 765,44 € Coste medio preparación MIV SF 6,83 €.; Coste medio administración en Hospital de Día: 110,93 € Total primer año: 942,08 €; Total años siguientes: 765,44 € Primer año: 60 Kg: 9.609,2 € 70 Kg: 11.053,72 € 80 Kg: 12.498,24 € Sucesivos: 60 Kg: 7.807,475 € 70 Kg: 8.981,14 € 80 Kg: 10.154,82 € Primer año: 60 Kg: 8.371,04 € 70 Kg: 9.609,2 € 80 Kg: 10.847,36 € Sucesivos: 60 Kg: 6.801,47 € 70 Kg: 7.807,48 € 80 Kg: 8.813,48€ REFERENCIA 1 REFERENCIA 2 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 32 7.2.a Coste eficacia incremental. Estudios publicados No hay disponible estudios publicados de coste eficacia incremental que incluyan a apremilast. 7.2.b Coste eficacia incremental (CEI). Datos propios El coste eficacia incremental sólo podría realizarse frente a placebo por lo que no tendría sentido. En las comparaciones indirectas es menos eficaz que la terapia biológica, con lo cual tampoco es útil realizar el análisis coste eficacia incremental. 7.3 Estimación del número de pacientes candidatos al tratamiento en el hospital No procede. 8. EVALUACIÓN DE LA CONVENIENCIA. 8.1 Descripción de la conveniencia Posología y vía de administración: Apremilast: 1 comprimido cada 12 horas. Vía oral. Las otras alternativas terapéuticas se administran vía subcutánea excepto para infliximab que es intravenoso y se administra en hospital de día. La frecuencia de administración es diferente para cada una de ellas: - Adalimumab: cada 2 semanas. - Etanercept: semanal (50 mg) o dos veces por semana (25 mg). - Ustekinumab: cada 12 semanas. - Secukinumab: cada 4 semanas. La principal diferencia de apremilast con el resto de las alternativas terapéuticas es la administración oral frente a las terapias subcutáneas e intravenosas indicadas que existen en la actualidad. La vía oral podría considerarse como ventaja aunque también como un probable inconveniente para la adherencia ya que la administración es cada 12 horas. Referente a la dispensación es hospitalaria al igual que el resto de alternativas terapéuticas. Como ventaja se podría señalar que no es necesario pre-screening y monitorización. 8.2 Influencia de la conveniencia en la efectividad del tratamiento En los estudios realizados hasta la fecha, no se ha evaluado la adherencia al tratamiento y su posible influencia en la efectividad o eficacia del tratamiento con apremilast. Por otro lado, tampoco comparan el fármaco con el resto de alternativas terapéuticas. 9. AREA DE CONCLUSIONES. 9.1 Resumen de los aspectos más significativos respecto a la alternativa y propuestas A) Aspectos clínico-terapéuticos La eficacia de apremilast se ha analizado en dos ensayos pivotales fase 3 controlados con placebo en pacientes con psoriasis en placa de moderada a grave candidatos a fototerapia y/o terapia sistémica. Estos estudios muestran eficacia estadísticamente significativa frente a placebo, no obstante y a pesar de la situación favorable para apremilast, la diferencia obtenida en el PASI 75 se encuentra en el límite de la relevancia clínica y es bastante menor a los resultados obtenidos con los fármacos biológicos autorizados. Además, la comparación de eficacia frente a placebo es una limitación importante ya que existen alternativas terapéuticas suficientes con las 32 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 33 que realizar los estudios de eficacia comparativa. Existe un ensayo, fase IIIb, aleatorizado 1:1:1 que compara apremilast, etanercept y placebo, sin embargo, la variable principal de este estudio es el PASI75 frente a placebo, por lo que el comparador sigue siendo inadecuado. Un network metanálisis que comparaba la eficacia de apremilast frente a las alternativas disponibles de la terapia biológica, mostró que apremilast tenía la probabilidad más baja de alcanzar respuesta PASI (50, 75 y 90), siendo infliximab el fármaco con más probabilidad de respuesta (infliximab 85% > ustekinumab 45 mg 77%> adalimumab 62% > etanercept 43%> apremilast > placebo). Por otro lado, de los pacientes incluidos en los estudios, menos de la mitad habían sido tratados con terapia sistémica convencional, un 30% habían recibido terapia biológica y un tercio de ellos eran naive. Esto sería otra limitación, ya que las características de estos pacientes no se corresponden con la indicación aprobada para apremilast, que hace referencia a pacientes que no toleren, no respondan o tengan contraindicada la terapia sistémica convencional incluida la fototerapia. Tampoco hay datos de resultados de eficacia por subgrupos pretratados ni datos de la respuesta a la terapia biológica en pacientes que sean tratados con apremilast previamente En relación a la seguridad y tolerabilidad, los principales efectos adversos registrados son gastrointestinales, infección respiratoria superior y dolor de cabeza, no obstante, no hay datos de evidencia de que apremilast sea mejor tolerado que la terapia biológica así como de la seguridad y tolerabilidad a largo plazo. Sólo en el estudio PSOOR-10, se han registrado los efectos adversos de apremilast y etanercept, donde los pacientes de apremilast tenían más efectos adversos a la semana 16. B) Coste, Coste eficacia incremental e Impacto presupuestario. El coste de tratamiento al año con apremilast es inferior frente a todas las terapias biológicas excepto a infliximab biosimilar. Al no existir datos comparativos y siendo la eficacia menor, no se puede realizar un análisis coste eficacia incremental, pero se prevee que la relación coste beneficio no sea favorable. 33 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 34 10. BIBLIOGRAFÍA 1. Treatment of psoriasis .Disponible en: http://www.uptodate.com/contents/treatment-of-psoriasis 2. Guía clínica de Psoriasis. Disponible en: http://www.fisterra.com/guias-clinicas/psoriasis/ 3. Prevalencia de la psoriasis en España en la era de los agentes biológicos | Actas DermoSifiliográficas. Disponible en: http://www.actasdermo.org/es/pdf/S0001731014000180/S300/ 4. Moreno-Ramírez D, Fonseca E, Herranz P, Ara M. Treatment of Moderate-to-Severe Psoriasis in Clinical Practice: A Survey of Spanish Dermatologists. Actas Dermo-Sifiliográficas Engl Ed. enero de 2010;101(10):858-65. 5. Informe antiTNF Derma definitivo 27-11-2012 - dermatologia.pdf . Disponible en: http://sescam.castillalamancha.es/sites/sescam.castillalamancha.es/files/documentos/farmacia/dermat ologia.pdf 6. Tratamiento con agentes biológicos en pacientes adultos con psoriasis en placas moderada-grave Aetsa_2_1_2013_Farmacoter_Psoriasis.pdf. Disponible en: http://www.juntadeandalucia.es/salud/servicios/contenidos/nuevaaetsa/up/Aetsa_2_1_2013_Farmacot er_Psoriasis.pdf 7. Guía clínica de Psoriasis Disponible en: http://www.fisterra.com/guias-clinicas/psoriasis/ 8. CDER apremilast.pdf. Disponible en http://www.accessdata.fda.gov/drugsatfda_docs/nda/2014/206088Orig1s000MedR.pdf 9. Directrices españolas basadas en la evidencia para el tratamiento de la psoriasis con agentes biológicos, 2013. I. Consideraciones de eficacia y selección del tratamiento. Disponible en: http://www.sciencedirect.com/science/article/pii/S0001731013001579 10. NICE guidance on biologic drugs for the treatment of psoriasis - October 2012.pdf. 11. Apremilast - apremilast.pdf. Disponible en http://www.juntadeandalucia.es/servicioandaluzdesalud/hrs3/fileadmin/user_upload/area_atencion_alp rofesional/comision_farmacia/informes/apremilast.pdf 12. Secukinumab_psoriasis_def_GENESIS_SEFH_20_10_2015 (1).doc. 13. Ficha técnica Cosentyx, INN-secukinumab - WC500183129.pdf Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_Product_Information/human/003729/WC500183129.pdf 14. Ficha técnica Enbrel, INN-etanercept - WC500027361.pdf. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR__Product_Information/human/000262/WC500027361.pdf 15. Ficha técnica Remicade, INN-infliximab - WC500050888.pdf. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR__Product_Information/human/000240/WC500050888.pdf 16. Ficha técnica Humira, INN-adalimumab - WC500050870.pdf. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR__Product_Information/human/000481/WC500050870.pdf 17. Ficha técnica Stelara, INN-ustekinumab - WC500058513.pdf]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR__Product_Information/human/000958/WC500058513.pdf 34 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 35 18. Ficha técnica Otezla, INN-apremilast - WC500182627.pdf. Disponible en http://www.ema.europa.eu/docs/es_ES/document_library/EPAR__Product_Information/human/003746/WC500182627.pdf 19. Study to Evaluate Safety and Effectiveness of Oral Apremilast (CC-10004) in Patients With Moderate to Severe Plaque Psoriasis. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01194219?term=APREMILAST+AND+PSORIASIS&rank=2 20. Study to Evaluate Safety and Effectiveness of Oral Apremilast (CC-10004) in Patients With Moderate to Severe Plaque Psoriasis. -. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01232283?term=APREMILAST+AND+PSORIASIS&rank=7 21. Phase 3b Safety and Efficacy Study of Apremilast to Treat Moderate to Severe Plaque-plaque Psoriasis - Full Text View -. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01690299?term=APREMILAST+AND+PSORIASIS&rank=1 22. A Phase 4 Study of Efficacy and Safety of Apremilast in Subjects With Moderate Plaque Psoriasis. - Disponible en: https://clinicaltrials.gov/ct2/show/NCT02425826?term=APREMILAST+AND+PSORIASIS&rank=10 23. Efficacy and Safety Study of Two Doses of Apremilast (CC-]. Disponible en: https://clinicaltrials.gov/ct2/show/NCT01988103?term=NCT01988103&rank=1 24. Efficacy and Safety Study of Apremilast (CC-10004) in Subjects With Moderate-to-Severe PlaqueType Psoriasis (Core Study) . Disponible en: https://clinicaltrials.gov/ct2/show/NCT00773734?term=NCT00773734&rank=1 25. Papp K, Reich K, Leonardi CL, Kircik L, Chimenti S, Langley RGB, et al. Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). J Am Acad Dermatol. julio de 2015;73(1):37-49. 26. Paul C, Cather J, Gooderham M, Poulin Y, Mrowietz U, Ferrandiz C, et al. Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate‐to‐severe plaque psoriasis over 52 weeks: a phase III, randomized controlled trial (ESTEEM 2). Br J Dermatol. 1 de diciembre de 2015;173(6):1387-99. 27. Microsoft PowerPoint - AAD 2015_ESTEEM 1 2 16wk Pooled Efficacy by Subpopulation EPoster_02.20.15 Final - getFile.aspx [Internet]. [citado 26 de abril de 2016]. Recuperado a partir de: https://www.aad.org/eposters/Submissions/getFile.aspx?id=1099&type=sub 28. AAD 2015_ESTEEM 1 2 16wk Pooled Efficacy by Subpopulation E-Poster_02.27.15 FINAL.pdf. 29. Otezla, INN-apremilast - WC500177381.pdf .Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Risk-managementplan_summary/human/003746/WC500177381.pdf 30. Nast A, Jacobs A, Rosumeck S, Werner RN. Efficacy and Safety of Systemic Long-Term Treatments for Moderate-to-Severe Psoriasis: A Systematic Review and Meta-Analysis. J Invest Dermatol. noviembre de 2015;135(11):2641-8 31. Palfreeman A, McNamee, McCann. New developments in the management of psoriasis and psoriatic arthritis: a focus on apremilast. Drug Des Devel Ther. marzo de 2013;201 32. Diagnosis and management of psoriasis and psoriatic arthritis in adults. (SIGN Guideline No 121) sign121.pdf .Disponible en: http://www.sign.ac.uk/pdf/sign121.pdf 35 Versión: GENESIS-SEFH Programa MADRE versión 4.0 Fecha: Informe Base Página: 4.0 10-12-2012 36 33. Informe de Posicionamiento Terapéutico de apremilast (Otezla®) en psoriasis cutánea y artritis psoriásica - IPT-apremilast-Otezla.pdf 34.Apremilast__Otezla__psoriatic_arthritis_FINAL_May_2015_REVISED_010615_for_website.pdf Disponible en: https://www.scottishmedicines.org.uk/files/advice/apremilast__Otezla__psoriatic_arthritis_FINAL_May_ 2015_REVISED_010615_for_website.pdf 35. AAD 2015_ESTEEM 1 Two-Year Safety E-Poster_02.24.15. Disponible en: https://www.aad.org/eposters/Submissions/getFile.aspx?id=1055&type=sub 36. Sebastian Hinde:Ros Wade;Stephen Palmer;Nerys Woolacott;Eldon Spackman. Apremilast for the Treatment of Moderate to Severe Plaque Psoriasis: A Critique of the Evidence. PharmacoEconomics DOI 10.1007/s40273-016-0382-3. 36