Cuantificacion de proteinas farmacia
Anuncio

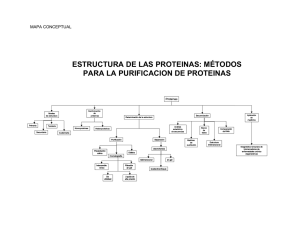
Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas • Selección de fuente • Fraccionamiento de células • Centrifugación Cromatografía • Cromatografía en capa fina • Cromatografía en columna • Cromatografía de intercambio iónico • Cromatografía de exclusión molecular o filtración en gel • Cromatografía de afinidad Electroforesis • Electroforesis en acetato de celulosa • Electroforesis en geles de acrilamida (SDS-PAGE) Procedimiento estudio de proteínas Selección de la fuente 1º) Aislamiento de las proteínas Disgregación del tejido Ruptura celular 2º) Purificación Cromatografía Electroforesis 3º) Determinación de su actividad 3º) Determinación de la estructura primaria 3º) Determinación de sus niveles de expresión Selección de la fuente Tejido Disgregación del tejido: (Colagenasa, quelantes del Ca++....... ) Separación de las células Cultivos celulares Cultivos primarios Líneas celulares Fraccionamiento de las células Químicos Mecánicos Lisis osmótica Homogenización Detergentes Sonicación Disolventes orgánicos (acetona, etanol, TCA) Congelación Separación componentes celulares por CENTRIFUGACIÓN • Homogenado se somete a altas velocidades de giro • Separación por tamaño y densidad • Las moléculas mayores se depositan antes Estabilización de las proteínas: • pH • Degradación proteolitica • Temperatura Fraccionamiento celular por CENTRIFUGACIÓN Homogenado 1000g x 10 min c. enteras, núcleos y citoesqueleto Separación en función del tamaño 20.000g x 20 min mitocondrias, lisosomas y peroxisomas 80.000g x 1h microsomas y pequeñas vesículas 150.000g x 3h ribosomas, virus y grandes macromoléculas Aumento de la velocidad de centrifugación Separación y purificación de proteínas Se basa en la diferente: Solubilidad CROMATOGRAFÍA Tamaño Carga eléctrica Densidad Afinidad por otras moléculas ELECTROFORESIS Cromatografía Papel (capa fina): Aminoácidos y Azúcares Cromatografía Columna: Aminoácidos y Proteínas Cromatografía sobre papel (Cromatografía de reparto) Cromatografía CROMATOGRAFÍA EN COLUMNA Las diferentes proteínas se retrasan según sus interacciones con la matriz, de acuerdo a su carga, hidrofobicidad, tamaño o unión a grupos químicos Muestra aplicada El solvente se aplica contínuamente a la boca de la columna Matriz sólida Moléculas fraccionadas eluídas y recogidas Tapón poroso Tubo de ensayo tiempo http://www.accessexcellence.org/AB/GG/cellBreak1.html Cromatografía TRES CLASES DE CROMATOGRAFÍA EN COLUMNA A) Intercambio iónico: B) Filtración en gel: en base a la carga Flujo de solvente C) de Afinidad: en base a interacción en base al tamaño Flujo de solvente Flujo de solvente Partícula cargada positivamente Molécula cargada negativamente unida Molécula cargada positivamente libre Partículas porosas Molécula pequeña retrasada Molécula grande no retrasada Partícula con sustrato unido covalentemente Molécula de enzima unida Otras proteínas pasan de largo http://www.accessexcellence.org/AB/GG/cellBreak1.html Cromatografía de intercambio iónico Las proteínas se separan según su carga a un pH determinado (Ej: intercambio catiónico) Proteínas cargadas positivamente se unen a la matriz cargada negativamente Proteínas cargadas negativamente pasan sin unirse Cromatografía de filtración en gel o exclusión molecular Las proteínas se separan según su tamaño Matriz de polímeros de carbohidratos Moléculas pequeñas entran entre los espacios acuosos dentro de la matriz Moléculas grandes no entran dentro de los espacios de la matriz Cromatografía de afinidad Las proteínas se separan en función de la especificidad de unión a un ligando Moléculas que unen glucosa se unen a residuos de glucosa (G) de la matriz Adición de glucosa (G) Moléculas se liberan tras la adición de glucosa Enzima - Sustrato Antígeno - Anticuerpo Hormona - Receptor Electroforesis Papel, acetato de celulosa Electroforesis Gel: proteínas (SDS-PAGE) y ac. nucleicos Electroforesis en acetato de celulosa Proteínas plasmáticas Albúmina 45-55% total 5-8% Globulinas: a1 a2 8-13% b 11-17% g 15-25 % Electroforesis en geles de poliacrilamida con SDS (SDS-PAGE) Formación de un gel de poliacrilamida Electroforesis en geles de poliacrilamida con SDS (SDS-PAGE) Dodecil sulfato sódico Electroforesis en geles de poliacrilamida con SDS (SDS-PAGE) Electroforesis en geles de poliacrilamida con SDS (SDS-PAGE) Marcadores de peso molecular Electroforesis en geles de poliacrilamida con SDS (SDS-PAGE) Proteínas teñidas con Azul de Comassie tras SDS-PAGE Determinación de las masas moleculares Electroforesis en geles de poliacrilamida con SDS (SDS-PAGE) Proteínas presentes en los sucesivos estadios de purificación de una enzima Carril 1: extracto de partida Resto de carriles: proteínas obtenidas después de fraccionamiento cromatográfico de la muestra del carril anterior