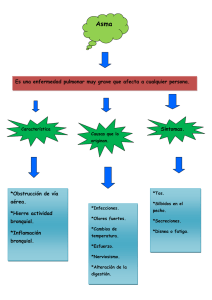
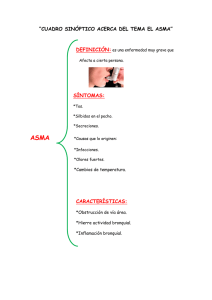
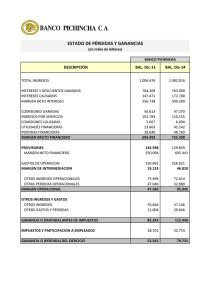
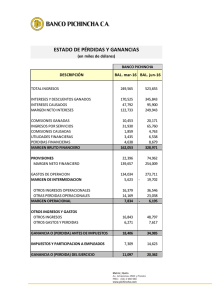
Broncoscopia. Técnicas diagnósticas
Anuncio

10 Broncoscopia. Técnicas diagnósticas I. Alfageme Michavila, N. Reyes Núñez, J. Lima Alvarez, M. Merino Sánchez INTRODUCCIÓN A principios de los 70 se comercializó el fibrobroncoscopio flexible (BF) y rápidamente se introdujo en la práctica clínica; desde entonces, se ha incrementado notablemente nuestro conocimiento de las enfermedades pulmonares, se ha revolucionado la práctica de la neumología y se ha consolidado como el procedimiento invasivo diagnostico más utilizado habitualmente en neumología. Las ventajas del BF sobre el broncoscopio rígido incluyen la mayor visión del árbol traqueobronquial, su mayor facilidad de manejo y el poder prescindir de la anestesia general o de un quirófano para su empleo. Actualmente la broncoscopia (BC) con los BF es una técnica tan difundida y utilizada entre los neumólogos, que no se concibe una unidad de neumología, por elemental que sea, que no incluya esta exploración entre sus prestaciones. Nos permite realizar una inspección visual del árbol bronquial y la toma de muestras cuando es necesario. La BC debe realizarse en un hospital, aunque sea con carácter ambulatorio; el hospital no sólo ofrece los medios idóneos para una correcta exploración endoscópica y un óptimo procesamiento de las muestras obtenidas, sino también los medios adecuados para solventar las complicaciones potenciales derivadas del procedimiento, ofreciendo al paciente las máximas garantías. INDICACIONES Las indicaciones diagnósticas de la BC se recogen en la tabla I. Algunas de estas se derivan de la misma exploración como es el caso de la valoración de las vías respiratorias altas y en otros casos es el medio para obtener una muestra que puede conducir al diagnóstico. CONTRAINDICACIONES No existen contraindicaciones estrictas para la realización de una BC, siempre es un equilibrio entre las ventajas esperadas y los riesgos que suponen al enfermo. No obstante las siguientes situaciones se consideran de alto riesgo y hay que valorar cuidadosamente el potencial beneficio ante el riesgo: tal es el caso de arritmias potencialmente mortales, en las 4 semanas siguientes a un infarto agudo de miocardio y si hay angina inestable; en los casos de hipoxemia refractaria; cuando existan coagulopatías no corregidas o recuento de plaquetas inferior a 50.000; en caso de insuficiencia renal grave; en presencia de enfermedades infecciosas trasmisibles (por ejemplo con tuberculosis -TB- pulmonar activa) y en los casos de enfermos no cooperadores. La no obtención del consentimiento por escrito es una contraindicación para la BC. 113 114 I. Alfageme Michavila, N. Reyes Núñez, J. Lima Alvarez, M. Merino Sánchez Tabla I. Indicaciones diagnósticas de la BF. Valoración signos y síntomas Hemoptisis Pito localizado Tos inexplicable Parálisis de cuerda vocal Valoración de enfermedad endobronquial Tumor Cuerpo extraño Fístula Tapón mucoso Citología de esputo sospechosa de malignidad Valoración de radiografía de tórax alterada Masa pulmonar Infiltrado pulmonar focal o difuso Atelectasia pulmonar Derrame pleural Parálisis frénica unilateral Diagnóstico microbiológico de infecciones respiratorias En pacientes inmunodeprimidos En no inmunodeprimidos Valoración de vías respiratorias altas Valoración de adenopatías mediastínicas con/sin ultrasonido endobronquial Monitorización de enfermedad conocida Trasplante pulmonar Estadificación del cáncer de pulmón Neoplasia de esófago En unidades de cuidados intensivos Problemas asociados al tubo orotraqueal Infecciones en pacientes con ventilación invasiva INSTRUMENTACIÓN Fibrobroncoscopios (BF) y Videobroncoscopios (VBF) El BF es un instrumento flexible, fabricado con haces de fibra óptica, encastrados en una cubierta de vinilo también flexible, que transmiten luz y proporcionan una imagen magnificada a través de un sistema de lentes. A todo lo largo del tubo flexible, en su parte interna, discurre el canal ope- rador o de trabajo. Los últimos 2,5 cm. del BF son de angulación dirigible, lo que permite la visión desde diferentes ángulos. Tanto el diámetro externo del tubo flexible como el del canal de trabajo son variables según el tipo de BF. Los tamaños más utilizados en adultos son los que tienen de 5,2-6 mm de diámetro externo, con un diámetro interno del canal de trabajo de 2,0-2,8 mm respectivamente. Desde final de los años 80, los clásicos BF de fibra óptica están siendo sustituidos por VBF provistos de un sensor de imagen en su extremo distal que la trasmite a un procesador de video para su exhibición en un monitor. Esta nueva generación de VBF permite una mayor resolución y el almacenamiento de la imagen en formato digital. Material accesorio Los requerimientos mínimos de material para la realización de esta técnica son el propio BF o VBF y su conexión a una fuente de luz fría. También se consideran material accesorio, las pinzas, cepillos de citología y microbiología y las agujas de punción transbronquial (estos últimos de uso único). Existen BF que disponen de una batería que actúa como fuente de luz fría lo que facilita el transporte del instrumento fuera de la sala de endoscopia. Es obligatorio disponer de equipo de resucitación en la sala que permita afrontar potenciales complicaciones. Aunque no es necesario rutinariamente disponer de fluoroscopia, en los casos de lesiones pulmonares localizadas su uso aumenta la rentabilidad de la biopsia transbronquial. La comunicación con el resto de los servicios y la docencia, se facilitan por la grabación de las imágenes EQUIPO DE TRABAJO Y SALA DE ENDOSCOPIA Son necesarios además del neumólogo, dos ayudantes, siendo uno de ellos un/una enfermero/a cualificado. Aunque esto variará dependiendo del número de exploraciones que se realicen y de si se realizan terapias endoscópicas. El espacio físico dedicado a la broncoscopia debe incluir: un espacio para la preparación y recuperación del paciente que permita una cierta privacidad; un área de trabajo para realizar el proce- Broncoscopia. Técnicas diagnósticas dimiento con suficiente espacio para maniobrar y permitir el acceso a un equipo de reanimación y un área de limpieza y mantenimiento con buena ventilación. El tamaño y la distribución dependen del número y tipos de pruebas que se realicen en una institución en particular, sin embargo no es necesario un quirófano, y la mayor parte de las exploraciones se realizan en una sala específica para ello. PREPARACIÓN, INFORMACIÓN Y CONSENTIMIENTO Se recomienda una valoración clínica por parte del broncoscopista antes de la prueba. Se considera esencial disponer de una radiografía de tórax reciente en todos los pacientes. Las pruebas de función pulmonar o la determinación de gases arteriales, sólo serán necesarias en los casos en que haya una sospecha clínica de alteración funcional importante. Los pacientes en los que se sospeche EPOC deben tener una espirometría reciente y si el FEV1 es inferior al 40% o la SaO2 inferior al 93%, se recomienda una gasometría arterial. Los pacientes con asma bronquial deben premedicarse con un broncodilatador antes de la prueba. No son necesarios de forma rutinaria los estudios de coagulación, excepto en los casos de pacientes con factores de riesgo conocido o cuando se vaya a realizar una biopsia trasbronquial (BTB). En pacientes tratados con anticoagulantes orales que precisen biopsias, se deben suspender los anticoagulantes al menos 3 días antes de la realización de la prueba o revertir los efectos con dosis bajas de vitamina K; si no es posible prescindir de la anticoagulación, el INR debe reducirse por debajo de 2,5 y se debe iniciar tratamiento con heparina. Con respecto a los antiagregantes, se ha demostrado que no existe incremento del riesgo de sangrado con la administración de aspirina, sin embargo, con otros más recientes como el clopidogrel no existe suficiente información hasta el momento. Los pacientes deben mantener ayuno de sólidos por boca en las 4 horas previas a la realización de la exploración y pueden permitirse líquidos hasta 2 horas antes del examen. El médico debe facilitar al enfermo información sobre la prueba en un len- 115 guaje que sea fácilmente comprensible por él mismo, incluyendo los posibles riesgos y la probabilidad de alcanzar un diagnostico con la misma, sobre todo en los casos en que se contemple la realización de una biopsia transbronquial. Esta comunicación ayuda al paciente a aceptar la exploración, mejora la tolerancia al procedimiento y permite obtener la máxima colaboración del mismo. El paciente y sus familiares deben tener la oportunidad de preguntar cualquier duda antes de otorgar el consentimiento por escrito. Este documento debe permanecer en la historia del paciente junto al informe de la prueba No se recomienda de forma rutinaria la profilaxis antibiótica para la endocarditis previa a la realización de una BC, aunque sí para la broncoscopia rígida. Sin embargo, se consideran pacientes con alto riesgo los portadores de valvulopatías izquierdas, válvulas cardiacas artificiales, cardiopatías congénitas cianóticas o historia previa de endocarditis. PREMEDICACIÓN, SEDACIÓN, ANALGESIA Y MONITORIZACIÓN Se debe canalizar una vena periférica en todo enfermo antes de administrar la sedación, que se mantendrá hasta el final del periodo de recuperación. La atropina sigue siendo utilizada por muchos grupos antes del inicio de la exploración, con el objeto de reducir las secreciones de la vía aérea, prevenir la bradicardia y los fenómenos vasovagales. La dosis utilizada ha sido la misma, tanto en caso de administración intravenosa, intramuscular, subcutánea o sublingual. En estudios recientes efectuados en adultos que reciben concomitantemente sedación con benzodiacepinas, no se encuentran diferencias en la disminución de secreciones, confort del paciente o frecuencia de complicaciones en comparación con placebo, por lo que su administración habitual es controvertida y no necesaria de forma rutinaria. Se debe ofertar la sedación a todos los pacientes si no hay contraindicación. Su uso tiende a ser cada vez más difundido, no reemplaza a la anestesia tópica, sino que prepara al paciente en condiciones óptimas. Los efectos de la sedación buscados son la amnesia, la relajación y la cooperación del paciente. Los 116 I. Alfageme Michavila, N. Reyes Núñez, J. Lima Alvarez, M. Merino Sánchez fármacos empleados suelen ser benzodiacepinas siendo el midazolam la droga de elección por su vida media más corta, mayor potencia sedante, inicio rápido de la hipnosis, gran volumen de distribución y rapidez de aclaramiento, que se traduce en amplia manejabilidad de dosis, además de la facilidad para revertir sus efectos con el flumazenilo. Las dosis de midazolam son las necesarias para lograr una sedación consciente (una dosis inicial de 2 mg seguidos a los 2 minutos de incrementos de 1 mg/min.) según la respuesta del paciente. Aunque antes se asociaba un analgésico opiáceo, con este tipo de sedación es accesorio. La monitorización cardiaca no es necesaria de forma rutinaria, pero debe considerarse en caso de pacientes con historia de cardiopatía grave o en los casos en que persista la hipoxemia a pesar de la oxigenoterapia. Durante la BC suele producirse una caída de la PO2 de alrededor de 20 mmHg, esta caída es más pronunciada en los casos en que se realiza lavado broncoalveolar (BAL) y si se utilizan grandes volúmenes de liquido en el mismo. El mecanismo responsable es la alteración del cociente ventilación/perfusión (resultado de la obstrucción parcial de la vía aérea causada por el BF, la aspiración o la instilación de soluciones anestésicas o BAL) y la hipoventilación secundaria a la sedación. La hipoxemia se ha relacionado con mayor riesgo de arritmias; se recomienda la monitorización de la SaO2 y la administración de oxigeno, que debe prolongarse según el tipo de sedación empleado y en los casos en que haya alteración importante de la función pulmonar. La administración de oxígeno se realiza mediante una cánula nasal a un flujo de 2 litros/min. para mantener una SaO2 de al menos el 90%, con particular atención a los posibles retenedores de CO2, por lo que un monitor transcutáneo de CO2 puede ser útil. En los casos de pacientes con hipoxemia importante en los que sea necesaria la realización de BC se puede utilizar ventilación con presión positiva vía máscara facial. La administración concomitante de oxigeno y de sedación intravenosa pueden aumentar el CO2 arterial, por lo que debe evitarse la sedación si la gasometría arterial pre-BF muestra importante elevación del CO2 y el oxigeno se debe administrar a flujos bajos y con extrema precaución. ANESTESIA TÓPICA La Lidocaína es el anestésico tópico utilizado de forma generalizada. Sus efectos tóxicos implican al SNC (convulsiones) y cardiovascular (hipotensión, bradicardia, arritmia y colapso cardiovascular). Se metaboliza a través del hígado. Cuando se instila en el árbol traqueobronquial es rápidamente absorbida al torrente sanguíneo, sin embargo una parte no cuantificada es eliminada a través de la aspiración durante la exploración. La dosis total de lidocaína debe limitarse a 8.2 mg/Kg. en adultos (aproximadamente 29 ml de una solución al 2% para un paciente de unos 70 Kg.). Hay que ser cauto en ancianos y en pacientes con enfermedades cardiacas o hepáticas, en los que se recomienda no sobrepasar la dosis de 5 mg/Kg. Para la anestesia de la fosa nasal se utiliza en forma de gel (al 2%) preferiblemente al spray. Para la anestesia de las cuerdas puede emplearse un spray (Xilonibsa® al 10%) o bien utilizar la inyección transtraqueal (en la membrana cricotiroidea) de 50 mg de lidocaína, otra posibilidad es el empleo de la lidocaína nebulizada al 2%. Durante el procedimiento suelen instilarse pequeños bolos de lidocaína al 2% a través del fibrobroncoscopio según la necesidad, tendiendo a utilizar la mínima cantidad necesaria. VÍAS DE INSERCIÓN Y EXPLORACIÓN DEL ÁRBOL BRONQUIAL La vía de inserción más habitual es la vía nasal, previa anestesia tópica de una de las fosas nasales; la introducción se efectúa a través del meato medio, entre el cornete medio e inferior. Permite la exploración completa de las vías respiratorias (altas y bajas) y la visualización de su dinámica. Es fácil de realizar y permite mayor autonomía al broncoscopista. La alternativa es la vía oral, siendo necesario en ese caso utilizar un abrebocas rígido que proteja el instrumento de posibles mordeduras. Igualmente es recomendable el uso de abrebocas cuando se introduce el BF a través de tubos orotraqueales en pacientes con ventilación mecáni- Broncoscopia. Técnicas diagnósticas ca. Es conveniente valorar el aspecto y movilidad de las cuerdas vocales. Una vez atravesada la glotis debe realizarse una exploración completa sistematizada de ambos árboles bronquiales, empezando por el presuntamente sano, incluyendo la búsqueda de anomalías estructurales o patológicas y anormalidades dinámicas. En la tabla II se resumen las principales alteraciones endobronquiales. TÉCNICAS COMPLEMENTARIAS A LA EXPLORACIÓN La BF es un procedimiento que permite obtener muestras cuyo análisis posterior conducirán a un diagnostico. La obtención de muestras requiere el uso de accesorios y técnicas que complican la exploración y aumentan el tiempo y los riesgos del examen. El orden en el que deben realizarse no está plenamente establecido si bien bastantes autores proponen el siguiente orden: broncoaspirado (BAS) o lavado broncoalveolar (BAL), cepillado y biopsia. Justifican esta secuencia defendiendo la idea de que el sangrado originado por la biopsia sería mayor que el originado por el cepillado y esto podría contaminar de sangre las citologías obtenidas con el BAS, BAL y cepillado. Cuando hay sospecha de malignidad debe realizarse cepillado, lavado (o broncoaspirado) y biopsias. En presencia de lesión endoscópica maligna, la rentabilidad diagnostica considerando la combinación de biopsia, cepillado y broncoaspirado debe ser de al menos el 80%. Broncoaspirado (BAS) Es la técnica más simple, consiste en la obtención de secreciones bronquiales desde que se introduce el BF en el árbol bronquial, a través del canal de aspiración y su recogida en un colector diseñado a tal fin. Suele considerarse contaminado con secreciones de vías altas por lo que su utilidad diagnóstica microbiológica es limitada. También se utiliza para estudio citológico en los casos de sospecha de enfermedad neoplásica. Se acompaña de lavados con pequeñas cantidades de suero fisiológico, no más de 5-10 ml en cada embolada, cuando la cantidad de secreción es escasa o ausente. 117 Biopsia bronquial (BB) Consiste en la obtención de muestras procedente de una alteración endobronquial o de la mucosa bronquial. El lugar en que se toma la biopsia depende de los hallazgos, suelen ser lesiones sospechosas de malignidad o alteraciones anatómicas encontradas en la exploración. Dado lo inespecífico de la morfología de las lesiones endobronquiales, se recomienda obtener biopsia siempre que se halle alguna alteración, puesto que el diagnostico final siempre será anatomopatológico; igualmente se recomienda evitar biopsiar las zonas blanquecinas en la superficie de las tumoraciones que suelen corresponder a necrosis. Cada vez se popularizan más las pinzas desechables, aunque su coste es elevado. Hay pinzas con gran variedad de diseños, cambia la forma de la cucharilla (con dientes, redonda o fenestrada) el tipo de apertura (con movilidad lateral que facilitan la toma de biopsias en lugares difíciles como las paredes de la traquea) o que incorporan un arpón entre las cucharillas para poder clavarlo en la lesión y evitar que resbalen. El uso de una u otra dependerá de la disponibilidad y del tipo de lesión. En casos de lesión endoscópica sospechosa de malignidad se recomienda un mínimo de 5 muestras. Casi siempre tras la toma de biopsia se produce un pequeño sangrado, sobre todo en neoplasias, que puede controlarse con suero frío o instilaciones de adrenalina; en caso de hemorragias importantes, el manejo es el mismo que en las hemoptisis masivas. Es importante no terminar la exploración sin haber comprobado el cese de la hemorragia. Biopsia trasbronquial (BTB) Consiste en obtener una muestra de tejido pulmonar a través del BF. Está indicada en el diagnóstico de masas de localización periférica y de enfermedades pulmonares intersticiales difusas (EPID), en enfermos no inmunodeprimidos, inmunodeprimidos y para monitorizar el rechazo en pacientes con trasplante pulmonar. En casos de masa periférica, el diagnostico aumenta mucho con el uso de la fluoroscopia para localizar el bronquio adecuado. En los casos de EPID el bronquio elegido corresponde a una zona alterada radiográfica- 118 I. Alfageme Michavila, N. Reyes Núñez, J. Lima Alvarez, M. Merino Sánchez Tabla II. Alteraciones endobronquiales elementales. Alteración Tipo de alteración Posible diagnóstico Coloración de la mucosa Anormalmente pálida Rojo vivo uniforme Rojo vivo localizado Negruzco Anemia, asma Inflamación, cardiopatía Inflamación, neoplasia Antracosis, metástasis de melanoma Alteraciones de la movilidad bronquial Disminuida generalizada Disminuida localizada Colapso espiratorio distal Colapso espiratorio central Enfisema, paquipleuritis Postinflamatoria,neoplásica EPOC Traqueobroncomalacia Secreción Valorar cantidad escasa o moderada Valorar localización difusa o predominante Valorar características serosa mucosa mucopurulenta caseum Valorar olor (fetidez) Asma, edema, EPOC, postcirugía Bronquiectasias Tuberculosis Infección por anaerobios Grosor de la pared • Engrosamiento carinas • Desaparición relieve cartílagos • Disminución luz bronquial Discreto: borramiento incompleto de relieve de cartílagos Moderado: borramiento completo + ligera ↓ calibre bronquial Importante: ↓ franca de luz bronquial. imposible ver bronquios segmentarios Grados de infiltración mucosa (según sospecha malignidad) Baja 1 de las siguientes: Perdida de brillo localizada ↑ de grosor liso/uniforme ↑ vascularización local Intermedia ≥ 2 de las siguientes: - ↑ grosor mucosa - superficie irregular - enrojecimiento local - “stop” de pliegues - estenosis bronquial Tipos de masa Características endoscópicas Sospecha de benignidad Sospecha de baja malignidad Sospecha de alta malignidad Coloración rosada. Superficie lisa Coloración rosada. Superficie granulosa (“fresa”) Coloración irregular. Superficie irregular, mamelonada con zonas “blancas” mente y que sea fácil de canalizar, sin necesidad de forzar el BF. Una vez elegido el bronquio, se enclava la punta del BF y se avanza la pinza de biopsia hasta localizar radiográficamente la lesión (en dos planos). En los casos en que no se utilice la Alta ≥3 de las descritas en la anterior fluoroscopia, una vez enclavado el BF, se avanza la pinza 2-3 cm., entonces se abre y se avanza 1-2 cm. más, hasta notar resistencia, entonces se cierra la pinza y suave y lentamente se tracciona la pinza o el BF como un todo (en vez de dar un tirón). Broncoscopia. Técnicas diagnósticas No son necesarias las maniobras respiratorias que se han preconizado por algunos. Se prefieren pinzas sin dientes que dañan menos el tejido; el tamaño de la pinza no influye en el rendimiento, pero si el numero de muestras obtenidas, que debe ser entre 4 y 6 en los casos de EPID y de al menos 6 en casos de lesiones periféricas. Algunos autores recomiendan no mantener una aspiración intensa puesto que esto podría dificultar la formación de un coagulo, aconsejan por el contrario mantener el BF enclavado para cortar la hemorragia en caso de que se produzca. Es la técnica con mayor riesgo de complicaciones: sangrado, neumotórax e hipoxemia persistente. Se recomienda la realización de una radiografía de tórax una hora tras el procedimiento para excluir neumotórax, además es conveniente advertir al paciente de forma verbal y escrita del riesgo potencial de neumotórax tras abandonar el hospital y la recomendación de que sea vigilado por un familiar. Cepillado bronquial El cepillado bronquial, es una de las técnicas empleadas en la broncoscopia para la obtención de muestras, principalmente en el diagnóstico del carcinoma broncogénico. Actualmente sólo se utilizan cepillos con funda y desechables para evitar riesgo de contaminación cruzada y errores diagnósticos. La positividad del cepillado depende del número de cepillados, y del tamaño y localización del tumor. Si se pasa de uno a dos cepillados el rendimiento aumenta del 72% al 86%, llegando al 89% si se hacen cinco. El rendimiento disminuye en neoplasias menores de 3 cm. y en las localizadas en segmentos apicales de LLSS o segmentos basales de LLII. Es particularmente útil en presencia de lesiones con gran componente necrótico, como ocurre con frecuencia en el carcinoma indiferenciado de células pequeñas (CICP) y en lesiones periféricas en las que la pinza de biopsia no llega hasta la lesión y el cepillo puede hacerlo al poseer mayor flexibilidad y menor diámetro. Las complicaciones del cepillado son muy poco frecuentes pero se ha descrito sangrado, rotura del cepillo y neumotórax. El sangrado es la más frecuente por lo que se recomienda en los casos en 119 que existan alteraciones de la hemostasia, realizar un suave cepillado que resulte menos agresivo para la mucosa. Ante una lesión endoscópicamente visible, se deja el extremo distal del BF a unos 2 cm. de la lesión, se saca el cepillo hasta dejarlo sobre la lesión y a continuación se presiona fuertemente y se frota de forma vigorosa, tras ésto suele observarse un pequeño sangrado o una zona de eritema lo que indica la realización correcta de la técnica. En situaciones con lesiones endoscópicas de aspecto necrótico en que no se espera obtener resultados positivos, algunos autores recomiendan realizar el cepillado tras la biopsia endobronquial, ya que esta retiraría parte del supuesto tejido necrótico y se expondría a la luz bronquial tejido viable. Si lo único visible es un bronquio distal estenosado, es conveniente cepillar más proximal a este hallazgo ya que al cepillar sobre la estenosis se puede producir edema de la mucosa y obstruir completamente la luz de bronquio. Si no hay lesiones endoscópicas visibles, lo ideal es cepillar con control fluoroscópico, se puede cepillar la zona requerida y al mismo tiempo podemos controlar no cepillar demasiado distal, disminuyendo así el riesgo de provocar un neumotórax. Cepillo telescópico ocluido (CTO) Se utiliza para la obtención de muestras microbiológicas estériles del árbol bronquial sin contaminación de las vías aéreas altas o del broncoscopio. Es deseable no aspirar por el canal y no instilar lidocaína a través del canal del BF antes de la introducción del catéter. El cepillo consiste en un catéter insertado en otro catéter con un cepillo de toma de muestras en su porción central, lleva un tapón similar a la cera que previene la contaminación del catéter y del cepillo antes de la toma de muestras. El tapón se disuelve sin consecuencias al ser expulsado. Una vez obtenida la muestra de la zona deseada, generalmente la coincidente con la alteración radiográfica, se limpia con alcohol al 70% la funda y con una tijera estéril se corta la funda externa, se corta después la funda interna y por último el cepillo, depositándolo en un tubo estéril con 1 ml de suero salino estéril, para realizar cultivo cuantitativo. 120 I. Alfageme Michavila, N. Reyes Núñez, J. Lima Alvarez, M. Merino Sánchez Lavado broncoalveolar, El lavado broncoalveolar (BAL) consiste en lavar un segmento de un pulmón con una solución salina fisiológica, obteniendo un fluido representativo de los componentes celulares y acelulares de esos alvéolos; unos 100 ml. de lavado en bronquios segmentarios toma muestra de aproximadamente 106 alvéolos. Por esta razón el uso del BAL ha ido creciendo considerablemente como herramienta diagnóstica en pacientes con sospecha de infecciones oportunistas, cáncer de pulmón, y enfermedades intersticiales. Tras una inspección completa del árbol traqueobronquial, el BF se enclava en un bronquio segmentario, en los casos de enfermedad focal en el bronquio correspondiente y en los casos de enfermedad difusa en la língula o el LM por su facilidad para recoger el fluido y su menor repercusión en la caída de la PO2. A través de la válvula de biopsia se instilan entre 150-200 ml de suero fisiológico estéril, en alícuotas de 50 ml, bien mediante una jeringuilla o bien conectando a la válvula un sistema de perfusión i.v. Tras cada instilación se aspira, con una presión de unos 20 cm. H2O, para evitar el colapso bronquial. El fluido recogido suele ser algo más del 50% del instilado; esta recuperación disminuye en fumadores y en pacientes con EPOC. Una alternativa consiste en realizarlo a través de un catéter protegido con un balón en la punta para impedir la contaminación, aunque los volúmenes de líquido suelen ser menores, está más indicado en la obtención exclusivamente de muestras para microbiología. Se han descrito una serie de requisitos y factores de riesgo (Tabla III) que deben valorarse en el contexto del enfermo. Muchos pueden minimizarse con las terapéuticas pertinentes, una correcta monitorización, la restricción del volumen de lavado al mínimo necesario y la disponibilidad de una fácil hospitalización y reanimación. El BAL es una técnica bien tolerada con escasa morbilidad, comparable a la de cualquier BC. Los efectos indeseables son, en general, explicables por defectos técnicos, indicación discutible o incorrecta preparación del enfermo. La incidencia de fiebre unas horas después del BAL se ha cifrado entre el 3-30%, depende del volumen de líquido instilado, no tiene una causa infecciosa y suele remitir con antipiréticos. Se ha descrito la aparición de densidades alveolares transitorias en el territorio del BAL en relación con el volumen de líquido retenido. Es frecuente que el BAL produzca una afectación de la función respiratoria, disminución de la capacidad vital, de los flujos espiratorios y de la PaO2. Estos cambios obligan a un adecuado estudio previo de la función respiratoria y, en caso necesario, a la administración de broncodilatadores y oxígeno. Otras complicaciones: sangrado, neumotórax, enfisema mediastínico, son excepcionales. Para estudio de una EPID (Tabla IV) en que se quiere analizar la población celular, la primera parte del BAL se desecha para evitar la contaminación con moco y células ciliadas (puede utilizarse para investigación de células neoplásicas). La celularidad se expresa en porcentaje y los valores normales corresponden a 80-90% de macrófagos, 515% de linfocitos, menos de un 3% son polinucleares neutrófilos y menos de un 1% son eosinófilos y basófilos. La mayoría de linfocitos obtenidos en el BAL son linfocitos T (CD3), de éstos hay más facilitadores (CD4) que supresores (CD8). Se consideran normales los márgenes siguientes: CD3: 60-90%, CD4: 40-50%, CD8: 20-30%, cociente CD4/CD8 de 1,4-1,8, linfocitos B: 5-10% y linfocitos killer: 5-10%, con un pequeño número de células no etiquetadas. En cuanto al diagnóstico microbiológico, en pacientes con SIDA, sospecha de neumonía por pneumocystis y negatividad del esputo inducido, el BAL es la técnica de elección, con un rendimiento diagnóstico del 95%, que cae al 70% en los casos tratados con pentamidina aerosolizada. El BAL tiene mayor precisión diagnóstica en casos de sospecha de TB que el BAS, probablemente porque el BAL tiene menor concentración de lidocaína que el BAS. La BTB sería de utilidad en casos de TB miliar, donde unido al BAS y/o BAL oscila entre 73% y 86% en diagnosticar TB. Punción transbronquial (PTB) La punción transbronquial (PTB) es una técnica relativamente reciente que permite la obtención de muestras citológicas o histológicas de 121 Broncoscopia. Técnicas diagnósticas Tabla III. Requisitos y factores de riesgo del BAL. FEV1>50% del valor teórico o no inferior a 1.000 ml, SaO2 superior al 90% no agudización asmática reciente, Facilidades de reanimación cardiorrespiratoria y de cuidados intensivos. Factores de riesgo densidades radiológicas que afecten más del 50% de los campos pulmonares PaO2 inferior a 60 mmHg hiperreactividad bronquial tiempo de protrombina < 50% y menos de 20.000 plaquetas Insuficiencia cardíaca, arritmias y cardiopatía isquémica no controladas. lesiones adyacentes al árbol traqueobronquial. Se utiliza en la estadificación del cáncer de pulmón, como ayuda en tumores de crecimiento peribronquial, masas hiliares o mediastínicas, neoplasias periféricas y ciertas neoplasias de presentación endobronquial. El rendimiento en los casos de tumor endoscópicamente visible es similar al de la biopsia, sin embargo puede ser más sensible en carcinomas que infiltran la submucosa y áreas peribronqiales. Para su realización es conveniente disponer de una TAC que permita la exacta localización de la lesión y facilita la vía de abordaje. Puede utilizarse para diagnóstico de adenopatías mediastínicas, su limitación es la localización del ganglio que debe estar en íntimo contacto con la pared bronquial. Su rendimiento oscila entre un 69% en los casos de malignidad y un 37% en los casos de enfermedad benigna, dependiendo este rendimiento, de la presencia de malignidad, del tamaño de la lesión, y del tipo de neoplasia (mayor en el CICP, hasta el 87%), con escaso numero de complicaciones. La adición de la ultrasonografia endobronquial (USB) a la realización de la PTB aumenta de forma significativa el rendimiento en los casos de adenopatías de localización no subcarinal (se incrementa de un 58% a un 84%), mientras que en los casos de adenopatías subcarinales no varía de forma significativa (74% y 86%). La PTB guiada por USB detecta enfermedad no evidente por TAC, evitando estudios más invasivos. Es un procedimiento más seguro que la mediastinoscopia y puede llegar a sitios difíciles de acceder con la mediastinoscopia cervical (estaciones posteriores y ventana aorto-pulmonar). Tabla IV. Valor diagnóstico del BAL. Procesos diagnosticables con BAL Proteinosis alveolar Histiocitosis Eosinofilias pulmonares Procesos en los que el BAL es de ayuda diagnostica Sarcoidosis Linfocitosis CD4/CD8>3,5 Alveolitis Alérgicas Extrínsecas Linfocitosis, mastocitosis, CD4/CD8↓ FPI Neutrofília con/sin eosinofilia Enfermedad por fármacos Fórmula variable, CD4/CD8↓ NOC Linfocitosis con Neutrofília/eosinofilia CD4/CD8 ↓ NID, BR/EPID Macrófagos pigmentados Asbestosis Neutrofília con/sin eosinofilia Cuerpos ferruginosos BAL: lavado broncoalveolar. FPI: Fibrosis Pulmonar idiopática. NOC: neumonía organizada criptogenética, NID: neumonía intersticial descamativa. BR/EPID: bronquiolitis respiratoria con enfermedad pulmonar intersticial difusa. 122 I. Alfageme Michavila, N. Reyes Núñez, J. Lima Alvarez, M. Merino Sánchez COMPLICACIONES La BC realizada en las condiciones y entorno antes mencionado, es un procedimiento bien tolerado y de bajo riesgo. Las complicaciones se clasifican según su gravedad en mayores o menores. Se consideran mayores las que requieren intervención o interrupción del procedimiento (neumotórax, caídas en la saturación de oxígeno permanentes, apneas) y menores, las que no afectan o impiden su realización (epistaxis, tos, náuseas, laringoespasmo o broncoespasmo transitorios o descensos transitorios en la saturación de oxígeno). En la tabla V se recogen las principales con su manejo. Con frecuencia hay aparición de fiebre en las 24 h siguientes al procedimiento, especialmente tras la realización del BAL que se ha atribuido a la liberación de citocinas por las células alveolares. DOCUMENTACIÓN Se debe recoger por escrito en la historia clínica el resultado de la exploración, incluyendo los fármacos y dosis empleados en la sedación, una estimación de la dosis de anestesia tópica, los procedimientos de obtención de muestras y las complicaciones. BRONCOSCOPIA DIAGNÓSTICA EN UCI Las indicaciones diagnósticas de la BC en la UCI, incluyen la obtención de muestras para el diagnostico de infecciones pulmonares, el diagnostico de neoplasia pulmonar y el diagnóstico de infiltrados pulmonares de origen incierto. En los pacientes con ventilación asistida se deben realizar una serie de ajustes previos a la exploración y que incluyen: aumentar la FiO2 a 1, incremento del volumen corriente un 40-50% y suprimir la presión positiva teleespiratoria (PEEP) o reducirla al mínimo valor que permita mantener una oxigenación adecuada. Se utiliza un adaptador entre el tubo endotraqueal y el respirador (con tapón de goma que se adapte de forma estrecha a la sonda) de forma que no hayan perdidas de aire. El diámetro interno del tubo endotraqueal a través del que se va a introducir el BF debe ser lo suficientemente grueso para que permita la entrada de aire adecuada y no produzca una PEEP excesiva. Los pacientes de UCI deben ser considerados de alto riesgo para el desarrollo de complicaciones y se debe practicar la exploración con monitorización múltiple (SaO2, ECG, toma intermitente de TA, etc.). El BF debe ser lubricado con gel hidrosoluble o spray de silicona para evitar el daño de las fibras. Debe elegirse el tamaño adecuado de BF para minimizar el roce y disminuir la obstrucción de las vías respiratorias. En ocasiones, puede tolerarse mejor el procedimiento desconectando al paciente del ventilador, y procediéndose a su ventilación con bolsa. Una vez finalizada la exploración, el ventilador debe programarse nuevamente según los parámetros previos a la técnica y realizarse una gasometría y, en ocasiones, un control radiológico de tórax. Como norma general el procedimiento debe ser de corta duración, y en ocasiones será necesario realizarlo en exploraciones cortas intermitentes, para que el paciente tenga tiempo de recuperación entre ellas. CONTROL DE LA INFECCIÓN Protección del personal de Broncoscopia Se aconseja vacunación ante la hepatitis B y la TB. Durante la exploración, todo el personal debe llevar ropa protectora (batas, mascarillas con/sin protección ocular y guantes). Las mascarillas deben filtrar partículas de 1 mm cuando se trate de pacientes con TB multiresistente o en los considerados de alto riesgo, y si es posible se recomienda disponer de presión negativa en la sala de BC. Las exploraciones a pacientes con sospecha de TB deben realizarse en ultimo lugar. Procesado de los instrumentos Aunque una revisión exhaustiva de este tema esta fuera de lugar en este capitulo y se pueden encontrar instrucciones detalladas sobre el tema en guías y publicaciones, hay que insistir en la importancia que tiene este apartado en la práctica de la BC y la responsabilidad del broncoscopista en el mantenimiento adecuado de todo el material. Cada vez se tiende más a utilizar material accesorio desechable pero el BF necesita un procesamiento adecuado. Este procesado incluye la comprobación de 123 Broncoscopia. Técnicas diagnósticas Tabla V. Complicaciones de la broncoscopia flexible. Tipo de complicación Alteración en la fisiología Respiratoria Hipoxia Manejo O2 suplementario Hipercapnia Aspiración de secreciones Ajustar líquido de BAL Disminuir tiempo de exploración Arritmias O2 suplementario Atropina (si existe bradicardia por estimulación vagal) Adecuada anestesia tópica Laringoespasmo/ Broncoespasmo Adecuada anestesia tópica Broncodilatador inhalado Bacteriológicas Infección cruzada Bacteriemia transitoria/sepsis Adecuada protección del personal, limpieza, desinfección y esterilización del instrumento Profilaxis de endocarditis y antibioticoterapia en pacientes de alto riesgo (inmunodeprimidos) Mecánicas Epistaxis Taponamiento nasal y/o instilación de adrenalina tópica Lesiones en la mucosa Evitar aspiración vigorosa y fija bronquial Hemoptisis Lavados con suero fisiológico frío o con alícuotas de 2-3 ml de adrenalina 1:1000 (1 ml en 20 ml de suero fisiológico) Neumotórax Retirada del instrumento y manejo del mismo Anestésicas Hipoventilación-apneas Ventilación con bolsa y reversión con antídotos Neurológicas, arritmias Limitar la dosis de lidocaína su integridad, limpieza, desinfección y esterilización en caso de ser necesario. La limpieza y desinfección del BF debe llevarse a cabo por personal entrenado, en la habitación disponible a tal efecto, al inicio de las exploraciones, al final y entre los distintos pacientes. Antes de proceder con la limpieza, es recomendable comprobar la integridad del BF, ya que la presencia de una fuga a través del canal de trabajo puede dañar las estructuras internas y favorecer la acumulación de microorganismos. La limpieza es un proceso fisicoquímico de eliminación de restos de materia orgánica adheridos al instrumental, sigue siendo la fase inicial más importante del proceso. Debe hacerse tras cada uso del instrumento, como paso previo obligado antes de la desinfección o esterilización. La más eficaz es la realizada de forma manual y sistematizada. Las soluciones recomendadas son jabón neutro o enzimático y agua. La desinfección es un procedimiento químico que consiste en la eliminación de microorganismos potencialmente patógenos. Los BF y VBF se consideran material semicrítico, (en contacto con mucosas, cavidades no estériles o piel no intacta) y deben someterse a un proceso de desinfección de alto nivel después de cada uso. Igualmente se incluyen en este apartado las válvulas de succión, las válvulas de biopsia reutilizables, y el material accesorio reutilizable. Se aceptan como desinfectantes de alto nivel que no dañan el instrumental, los productos químicos a base de glu- 124 I. Alfageme Michavila, N. Reyes Núñez, J. Lima Alvarez, M. Merino Sánchez taraldehído y ácido peracético, que destruyen todos los microorganismos, excepto algunas esporas bacterianas. Esta desinfección puede realizarse a través de inmersión o mediante máquinas automáticas. Si se utiliza la inmersión en glutaraldehído, es necesario al menos 60 minutos en los casos de pacientes con sospecha de estar infectados por micobacterias atípicas, o por el VIH. Es esencial que se utilice para el aclarado de los BF agua estéril o libre de bacterias (filtrada a través de un filtro de 0.2 _m). Si hay dudas sobre la calidad del agua, las superficies externas del BF deben limpiarse con una gasa con alcohol al 70% y debe aspirarse alcohol al 70% por el canal de succión; esto destruye bacterias no formadoras de esporas y micobacterias, se evapora rápidamente y deja las superficies secas. La limpieza con alcohol se recomienda al final de la sesión y antes del almacenamiento. La esterilización es un procedimiento fisicoquímico que destruye todos los microorganismos, en los instrumentos flexibles esta contraindicado el uso de calor, por lo que la esterilización se realiza en frío con gas de etileno (óxido de etileno). Este método esta discutido por su toxicidad para el medio ambiente y su excesiva lentitud (4 h de esterilización y 12 de aireación). BIBLIOGRAFÍA Mantenimiento Los BF son instrumentos costosos y frágiles que requieren un manejo cuidadoso que permita garantizar su función el mayor tiempo posible. Deben guardarse secos, siempre en posición vertical recta para prevenir el desarrollo de angulaciones del eje, en un armario bien ventilado y evitando la luz solar directa, la humedad elevada, las temperaturas extremas o la radiación. Son obligados los controles bacteriológicos del BF para ofrecer la máxima garantía, aunque su periodicidad no está bien establecida; sería ideal un control mensual y siempre que se sospeche una contaminación. En caso de que el control bacteriológico sea positivo, debe analizarse la calidad del agua del aclarado, realizar un control de la máquina automática (en caso de utilizarla) y esterilizar con óxido de etileno. 10. Meyer KC. The role of bronchoalveolar lavage in interstitial disease. Clin Chest Med 2004, 25: 637-649. 1. Bilaceroglu S, Mehta A, Light R. Transbronchial needle aspiration for diagnosis of sarcoidosis. J Bronchol 2004; 11: 54-61. 2. British Thoracic Society. British Thoracic Society guidelines on diagnostic flexible bronchoscopy. Thorax 2001; 56 (suppl): i1-21. 3. Burgués C, Carrillo B, Puzo C, Sastre A. Limpieza, desinfección y esterilización del instrumental de broncoscopia. En: Manual SEPAR de Procedimientos. Madrid: LUZÁN 5, S. A.; 2002. p. 4-13. 4. Castella Riera J, Ancoechea Bermúdez J, Puzo Ardanuy C, Sanchís Aldás J, Sueiro Bendito A, Xaubet Mir A. Lavado broncoalveolar. En: Caminero Luna J, Fernández Fau L, eds. Recomendaciones SEPAR. Barcelona: Doyma SA.; 1998. p. 79-100. 5. Chhajed PN, Glanville AR. Management of hypoxemia during flexible bronchoscopy. Clin Chest Med 2003; 24: 511-516. 6. Culver DA, Gordon SM, Metha AC. Infection control in the bronchoscopy suite. A review of outbreaks and guidelines for prevention. Am J Respir Crit Care Med 2003; 167:1050-1056. 7. Disdier V.C, Rodríguez de Castro F. Punción transbronquial aspirativa. Arch Bronconeumol 2000; 36: 580-593. 8. Herth F, Becker HD, Ernst A. Conventional vs Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration: A Randomized Trial. Chest 2004; 125: 322-325. 9. Herth F, Becker HD, Ernst A. Aspirin does not increase bleeding complications after transbronchial biopsy. Chest 2002; 122. 1461-1464. 11. Pac J, Canalis E, Castella J, Diaz P, Freixenet J, Rivas J, Zalacain R. Requisitos mínimos para una unidad de endoscopia respiratoria. Recomendaciones SEPAR 1996. Arch Bronconeumol 1997; 33:92-98. 12. Sharafkhaneh A, Baaklin W, Gorin AB, Green L. Yield of Transbronchial Needle Aspiration in Diagnosis of Mediastinal Lesions Chest 2003; 124: 2131-2135. 13. Venkateshiah SB, Mehta AC. Role of Flexible Bronchoscopy in the Diagnosis of Pulmonary Tuberculosis in immunocompetent individuals. J Bronchol 2003, 10: 300-308. 14. Win T, Stewart S, Groves AM, Pepke-Zaba J, Laroche CM. The Role of Transbronchial Needle Aspiration in the Diagnosis of Bronchogenic Carcinoma. Respir Care 2003; 48(6):602–605. 15. Wood-Baker R, Burdon J, McGregor A, Robinson P, Seal P. Fibre-optic bronchoscopy in adults: A position paper of the thoracic society of Australia and New Zealand. Intern Med J 2001; 31: 479–487.