BALANCE DE MATERIA CON REACCIÓN QUÍMICA
Anuncio

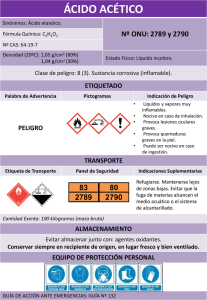
BALANCE DE MATERIA CON REACCIÓN QUÍMICA. HIDRATACIÓN DE ANHÍDRIDO ACÉTICO 1. PROBLEMA Se desea producir 4.5 gramos de ácido acético en solución acuosa en un reactor intermitente, ¿Durante qué tiempo debe operar el reactor para cumplir este requerimiento? 2. PARTE EXPERIMENTAL 2.1 Medidas de higiene y seguridad El anhídrido acético líquido y sus vapores son corrosivos y tóxicos, por lo que se deberá evitar su inhalación y contacto directo con la piel. Se recomienda el empleo de lentes de protección durante todo el desarrollo del experimento, Usar bata o ropa protectora. Emplear guantes para el manejo del anhídrido acético concentrado. 2.2 Materiales Reactor de vidrio de 1000 ml de capacidad, con chaqueta de calentamiento y/o enfriamiento con tapa de 3 bocas para adición de reactivos, sensor de temperatura y agitación mecánica respectivamente. Agitador mecánico con flecha de 20” de longitud 1/32 HP y 1750 r.p.m. Baño con termostato para control de la temperatura de reacción. Matraces Erlenmeyer de 125 ml, 10 piezas. jeringas de 25 mL con extensión de 25 cm. Buretas automáticas de 50 ml, 2 piezas. Balanza granataria electrónica. Vaso de precipitados de 4 litros 2.3 Sustancias Anhídrido acético, R.A. Agua destilada. Anilina, R.A. Hidróxido de sodio, solución al 0.05 N. Fenolftaleina en solución en etanol , 0.1% peso. Azul de bromotimol, solución alcohólica al 0.1 % Hidroxido de sodio. Solución concentrada para neutralización. 2.4 Servicios auxiliares Agua de enfriamiento 2.5 Descripción del equipo El sistema de reacción consiste de un reactor de 1000 mL de capacidad, enchaquetado, construido de vidrio pyrex, equipado con sistema de recirculación de agua, para trabajar a temperatura constante, conexiones para medición de temperatura y toma de muestras. Consta además con agitador mecánico (1), Boquilla para adición de reactivos (2), Boquilla para toma de muestras (3). 2.6 EQUIPO EXPERIMENTAL 1 . . 2 3 . . . . 2.7 Desarrollo experimental Preparación del equipo: 1. Preparar previamente a la toma de muestras dos series de matraces Erlenmeyer: * 2 matraces con 10 ml de agua destilada. * 8 matraces con 10 ml de agua destilada saturada con anilina. (15 g. de anilina en 500 ml de agua, agitar vigorosamente y dejar reposar 20 min.) Operación del equipo: 2. El proceso se llevará a cabo a temperatura ambiente. A ésta temperatura, se cargan al reactor 750 ml de agua destilada y se inicia la agitación. 3. Adicionar al reactor 5 ml (5.41 g.) de anhídrido acético concentrado (99% pureza), registrar éste tiempo como tiempo inicial, a partir del cual se tomarán las muestras. 4. Tomar 3 a 5 ml de solución del reactor a períodos regulares de tiempo. 5. Colocará cada una de las muestras al matraz correspondiente el cual deberá estar previamente tarado e identificado. 6. Registrar tiempo y peso de la muestra. (completar tabla 1 de datos). Paro del equipo: El procedimiento experimental se dará por terminado una vez que se toman las muestras requeridas para su posterior valoración. Al final de la experimentación todos los accesorios del equipamiento deberán quedar apagados, en OFF y el reactor limpio. Poner en apagado, OFF, el baño de recirculación y el control del motor del agitador La descarga de la mezcla de reacción, para dejar el reactor listo para un próximo uso, se llevará a cabo abriendo la llave localizada en el fondo del reactor, hasta permitir el escurrimiento total de la solución ácida resultante, recibiendo ésta en un vaso de precipitados de 4 litros. Para la disposición final de esta solución, previamente deberá ser neutralizada con solución concentrada de NaOH, agregando 5 gotas de solución alcohólica de fenolftaleina, agitando moderadamente, hasta el cambio de coloración de transparente a rosa. MÉTODO DE ANÁLISIS. Volumetría: El análisis de muestras se basa en la determinación cuantitativa de ácido acético formado, tanto en las muestras recibidas en matraces con agua, como en los matraces que contienen solución saturada de anilina. La reacción de hidratación de anhídrido acético produce ácido acético. En la reacción entre anhídrido acético y anilina también se produce ácido acético, sin embargo, esta última reacción es instantánea es decir, es mucho más rápida que la reacción de hidratación. Esta afirmación es fundamental para la determinación de del consumo de anhídrido acético con respecto al tiempo. Tanto las muestras colectadas en matraces con agua como las colectadas en matraces con solución de anilina serán tituladas con solución valorada de hidróxido de sodio 0.05 N. RECOMENDACIONES. Seleccionar intervalos de tiempo adecuados para la toma de la muestra ( por ejemplo cada minuto). Considerar que el volumen permanece constante durante todo el desarrollo experimental, para lo cual, tomar la cantidad adecuada de muestra (tal que el volumen no sea significativo respecto al volumen total). Para resolver el problema se consigue mayor precisión pesando las muestras en lugar de medir su volumen. Las muestras pueden ser de diferente masa, sin embargo, la cantidad de producto y reactivo es proporcional a la masa total. En el cociente mL NaOH (0.05N) / gmuestra para la muestra tomada a cualquier tiempo, mL NaOH (0.05N) corresponde a moles de ácido acético que reaccionan al neutralizarse por gramo de muestra. 2.8 Información experimental Tabla 1. Registro de datos experimentales 1 Tiempo 2 3 4 7 Masa de Volumen de Volumen de Anhídrido Acético Muestra (g) Titulante gastado Titulante Sin reaccionar (mL) gastado (mL/gM) (mol /L) (min) 0.5 1.0 AGUA 1.5 2.0 AGUA 2.5 3.0 AGUA 3.5 5.0 7.0 AGUA 10.0 12.0 AGUA 13.0 15.0 18.0 AGUA 20.0 3. CUESTIONARIO 1. Para la muestra t = 3 min, (para el matraz con agua) ¿ Cuántas moles de NaOH (0.05N) se consumen ?. ¿Con cuántas moles de ácido acético reaccionaron ? 2. Para la muestra t = 3.5 min, (para el matraz con anilina) ¿ Cuántas moles de NaOH (0.05N) se consumen ?. ¿Con cuántas moles de ácido acético reaccionaron ? 3. Explique la ventaja de relacionar el volumen gastado del titulante por el peso de la muestra (columnas 3 y 4 de la tabla 1 de datos). (mL) titulante gastado / g muestra 4. ¿Cómo son los valores en el consumo de titulante en las muestras recibidas en matraces con agua, mL NaOH (0.05N) / g muestra ? , ¿ Hay diferencia en estos valores o son constantes?. ¿Qué concluye de esto?. 5. Compare los valores de la solución de mL NaOH (0.05N) empleada para neutralizar las muestras recibidas en matraces con solución saturada de anilina, mL NaOH (0.05N) / g muestra. ¿ Son valores constantes o hay diferencia entre ellos?. ¿Cómo explica sus resultados?. 6. Al consumirse la totalidad del anhídrido acético a las condiciones experimentales seleccionadas, ¿ Qué concentración de ácido acético se obtiene en la mezcla de reacción?. Expresarla en mol / L. Si la densidad de la mezcla de reacción es aproximadamente de 1 g / cm3 , expresar el resultado anterior en g /gmuestra . 7. Compare los resultados obtenidos en moles de ácido acético / L, obtenidos para muestras recibidas en matraces con agua y anilina respectivamente, para tiempos consecutivos, por ejemplo para los tiempos 3 y 3.5 minutos. ¿ Son iguales, hay diferencia entre ellos ? . Explique su respuesta. 8. Repita el procedimiento anterior para los valores encontrados al titular los demás matraces de anilina. 9. ¿Qué cantidad de anhídrido acético, mol / L deberá reaccionar para tener en la mezcla de reacción 4.5 gramos de ácido acético, a sus condiciones experimentales. 10. ¿ En qué tiempo se producen estos 4.5 g de ácido acético ?. 11. Proponga usted las reacciones que ocurren al titular las muestras recibidas en matraces con anilina y con agua. 4.0 NOMENCLATURA gmuestra gramos de la muestra tomada N solución normal 5.0 BIBLIOGRAFÍA Eldridge, JW., Piret, E.L., Continuous-flow stirred-tank reactor system I. Design equations for homogeneous liquid phase reactions. Experimental data. Chemical Engineering Progress 46, 290 (1950) . Asprey, S.P., Wojciechowski, B.W,. Rice, N.M., Dorcas, Aplications of temperature scanningin the kinetics investigations: the hydrolisis of acetic anhydride. Chemical Engineering Science 51 (20), 1996, 4681-4692.