Clase18
Anuncio

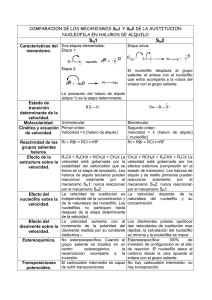
PROPIEDADES Y REACCIONES DE LOS HALOALCANOS (II): LA SUBSTITUCIÓN NUCLEOFÍLICA UNIMOLECULAR SN1 Y LAS ELIMINACIONES E1 Y E2 REACCIONES SN1 : SOLVOLISIS DE HALUROS DE ALQUILO SECUNDARIOS Y TERCIARIOS Ya hemos visto q que la velocidad de las reacciones SN2 disminuye y drásticamente cuando el centro de reacción cambia de primario a secundario o terciario (que practicamente no reaccionan). Sin embargo, esas observaciones son pertinentes únicamente para la sustitución bimolecular. Los haluros de alquilo secundarios y, sobre todo los terciarios , sufren sustitución, pero a través de otro mecanismo. De hecho, tales sustratos se transforman fácilmente, en presencia incluso de nucleófilos débiles, para dar productos de sustitución. Reacciones de Sustitución Unimoleculares: SN1 Recuerda que Los procesos SN2: muestran una cinética de 2° orden; generan los productos estéreoespecificamente con inversión de la configuración y muestran una reactividad para R-X en el orden: 1° > 2° > 3° (que no reaccionan). Las solvólisis de haluros de alquilo, al contrario: muestran una cinética de primer orden, no son estereoespecíficas y muestran , hacia los haluros de alquilo una reactividad inversa a la observada en las reacciones SN2. Cinética de 1 1° Orden Mecanismo: Primer paso: 2° Paso: 3° Paso: P El hecho fundamental y diferenciador de una reacción SN1 es la formación de un carbocatión en el primer paso, determinante de la velocidad de la reacción Estereoquímica en los procesos SN1 Efectos del solvente, Grupo Saliente y Nucleófilo sobre la reacción SN1 Los solventes polares aceleran la Reacción SN1 : La apertura heterolítica del enlace C-X en el paso determinante de la velocidad en la reacción SN1 implica una estructura del estado de transición que está altamente polarizada (ver abajo) y que da lugar, finalmente, a dos iones totalmente cargados. En contraste, en el estado de t transición i ió de d una reacción ió SN2 típica, tí i no se crean cargas sino i que hay h una dispersión di ió de d las l mismas Debido a su estado de transición polar, la velocidad de la reacción SN1 aumenta a medida que lo hace la polaridad del solvente. Los solventes próticos aceleran la reacción SN1 debido a que estabilizan al estado de transición por formación de enlaces por puentes de hidrógeno con el grupo saliente. Recuerda que, en contraste, la reacción SN2 es acelerada por disolventes polares apróticos, debido , principalmente al efecto del solvente sobre la reactividad del nucleófilo Las reacciones SN1 se aceleran a medida que aumenta la bondad del grupo saliente como tal La fortaleza del nucleófilo afecta a la distribución de productos, pero no a la velocidad de la reacción SN1 Puesto que el paso determinante de la velocidad del reacción SN1 no incluye al nucleófilo, el cambio de su estructura (o concentración) no altera la velocidad de desaparición del haloalcano. Sin embargo, cuando dos o mas nucleófilos compiten por la captura del carbocatión intermedio, sus fuerzas y concentraciones relativas pueden afectar en gran manera la distribución de productos. d P ej.: P. j Efecto del grupo alquilo sobre la reacción SN1: la estabilidad del carbocatión Los sistemas secundarios sufren ambas, reacciones SN1 y SN2 Un caso de desplazamiento SN1 estereoselectivo , poco usual, en la síntesis del fármaco anticancer Aclacinomicina A aklavinona Reacciones de β Eliminación Los haloacanos y, en general cualquier sustrato portando un buen grupo saliente y poseyendo E l Enlaces C H vecinos C-H i es capaz de d sufrir f i aún ú otro t tipo ti de d reacción: ió la l β eliminación li i ió para dar d alquenos; un proceso que también puede ocurrir a través de varios mecanismos. El nucleófilo (usualmente solvente), actúa como base el Reacciones de Eliminación Unimoleculares E1 Las reacciones E1, compiten con las reacciones SN1 y, de hecho, el paso determinante de la velocidad de reacción es el mismo en ambos procesos : la disociación a un carbocatión. carbocatión Este intermedio tiene ahora otra posible ruta a seguir en su enfrentamiento con el nucleófilo: la pérdida de un protón desde un carbón adyacente a aquel que porta la carga positiva. Como era de esperar, la naturaleza del grupo saliente no influye en la proporción de productos procedentes de las reacciones competitivas SN1 y E1, ya que el carbocatión intermedio formado, es el mismo en ambos casos. La Reacción de Eliminación Bimolecular E2 En presencia de nucleófilos que sean a la vez bases fuertes, los haloalcanos pueden dar alquenos por aún otro proceso de eliminación que presenta ahora una cinética bimolecular (E2). Esto es, la velocidad de formación de alqueno se hace ahora proporcional a la concentración , tanto del haloalcano como de la base. Este es, por tanto, un proceso que compite con la correspondiente reacción SN2. 2 ¿Q Que es lo q que causa este cambio de mecanismo ?: las bases fuertes ( tales como hidróxidos -OH, o alcóxidos, -OR ), pueden atacar a los haloalcanos antes de que se forme el carbocatión. El objetivo es un átomo de hidrógeno sobre un átomo de carbono vecino a aquel que porta el grupo saliente. Este mecanismo de reacción no está restringido a los haluros terciarios, terciarios aunque en sistemas secundarios y primarios debe competir con procesos SN2 Los tres cambios tienen lugar simultaneamente: La reacción E2 is un proceso concertado que ocurre en un solo paso Estereoquímica de las Reacciones E2 Como mostrado arriba, la reacción de eliminación E2 transcurre rápidamente cuando el halógeno y el hidrógeno eliminados poseen una estereoquímica relativa anti (trans diaxial); diaxial) por el contrario es muy lenta para una estereoquímica relativa trans diecuatorial. ¿Por qué ?. Cuando examinamos la conformación de silla mas estable para el compuesto cis, encontramos que hay dos átomos de hidrógeno localizados anti al bromo axial. axial Esta geometría es muy similar a la requerida por el estado de transición E2 ( ver descripción orbitálica mas arriba) y, consecuentemente, la eliminación es fácil. Por el contrario, el sistema trans no tiene enlaces C-H alineados en anti al grupo saliente ecuatorial y, y así, así la eliminación E2 requeriría bien un cambio al confórmero diaxial, o bien eliminación del hidrógeno “gauche” al bromo (eliminación Syn); situaciones ambas energeticamente desfavorables. Observa que los mecanismos E1 y E2 son muy similares, diferenciándose solamente en el orden de los acontecimientos. En la reacción bimolecular, la abstracción del protón y la marcha del grupo saliente son simultáneas simultáneas. En el proceso E1 el haluro sale primero y luego ocurre el ataque por la base. Un buen modo de pensar acerca de la diferencia es imaginar que la base fuerte participando en la reacción E2 es mas agresiva, no espera a que el haluro terciario o secundario se disocie disocie, sino que ataca directamente al sustrato Esta observación implica que el enlace al grupo saliente está parcialmente roto en el estado de transición COMPETICIÓN ENTRE SUBSTITUCIÓN Y ELIMINACIÓN Los múltiples p mecanismos - SN2,, SN1,, E2,, E1 - q que p pueden seguir g los haloalcanos en presencia de un nucleófilo, pueden parecer confusos a la hora de predecir cual será el resultado de una reacción determinada. Consideraciones sobre la fuerza básica del nucleófilo y sobre la la voluminosidad de la especie reaccionante pueden ayudarnos a decidir si predominará la sustitución o la eliminación Los Nucleófilos debilmente básicos dan sustitución Nucleófilos menos básicos que el anión hidróxido, hidróxido dan buenos rendimientos de productos SN2 con haluros primarios y secundarios y de productos SN1 con sustratos terciarios. Ejemplos incluyen: I-, Br-, N3-, RCOO- y R3P Nucleófilos débiles tales como el agua y los alcoholes reaccionan, a velocidad apreciable, solamente con haluros terciarios y secundarios, sustratos que son capaces de seguir g el mecanismo SN1. En estos casos, la eliminación unimolecular es usualmente una reacción secundaria minoritaria. Nucleófilos fuertemente básicos dan mas producto de eliminación a medida que aumenta el impedimento estérico en el sustrato. sustrato La reacción de haluros 1°s simples con Nus fuertemente básicos da productos SN2 mayoritariamente. mayoritariamente Cuando aumenta el impedimento estérico en torno al C, la sustitución se retarda con respecto p a la eliminación ya que el ataque al C está mas impedido que le ataque al H. La SN2 no es una opción para los haluros 3°. SN1 y E1 compiten en condicones neutras o debilmente básicas. Sin embargo, altas concentraciones de bases fuertes dan exclusivamente reacción E2 Nucleófilos básicos impedidas estéricamente favorecen la Eliminación, incluso en sistemas primarios Dos ejemplos de bases impedidas estericamente son terc-butóxido de potasio y di-isopropilamiduro de litio (LDA). Cuando usados en reacciones de eliminación son disueltos, frecuentemente, en sus respectivos ácidos conjugados: terc-butanol y diisopropilamina RESUMEN