Prueba de laboratorio: Ensayo a la llama Objetivo Materiales
Anuncio

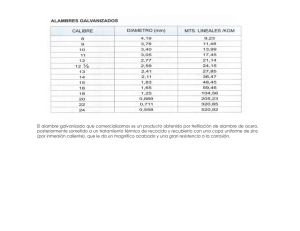
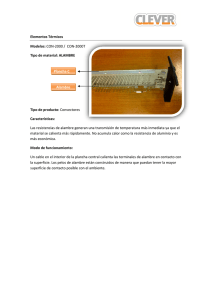
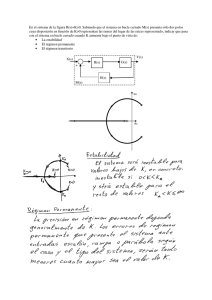
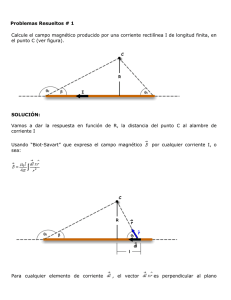
Prueba de laboratorio: Ensayo a la llama PSI Química Nombre_________________________________ Objetivo Utilizar la prueba de Ensayo a la llama para determinar la identidad del catión en una solución desconocida (sal) en base a su color característico. Materiales Mechero de Bunsen Vaso de precipitados pequeño Alambre para test de llama - de cromo-níquel con un bucle 6 platos pequeños de pesaje HCl ( 3M) NaCl, KCl, LiCl, BaCl2, CuCl2, SrCl2, CaCl2 Procedimiento 1. Haz una tabla de datos de dos columnas. En una columna etiqueta al nombre del metal y la otra del color de la llama. 2. Limpia el bucle del alambre de cromo-níquel y alternativamente calienta el alambre en la llama del mechero y sumérgelo en una solución de ácido clorhídrico concentrado. Repite hasta que la llama se mantenga casi incolora cuando se calienta el alambre. 3. Sumerge el bucle de alambre en el ácido clorhídrico, luego colócalo en una de las sales de modo que una pequeña cantidad de cristales de la sal permanezca en el bucle del alambre. Lleva el bucle hasta el borde de la llama azul para producir el color y registra en la tabla de datos. (Ten cuidado de no dejar caer los cristales de sal en el mechero) 4. Repite con las sales restantes. Concluye la realización de un ensayo a la llama con una sal desconocida y ten en cuenta el color. Análisis y conclusiones 1. ¿Qué metal es el desconocido? 2. Cada sal tiene un color único. ¿Esperarías esto basado en la visión moderna del átomo? Explica. www.njctl.org Química Estructura atómica 3. Algunos braseros a gas comerciales poseen llamas de color rojo y/o verde. Sobre la base de los datos recabados, ¿qué elementos podrían ser responsables de estas llamas de colores? 4. Los fuegos artificiales contienen pólvora y sustancias químicas que producen los colores. ¿Qué elementos contienen para producir los siguientes colores? a. Rojo carmesí b. Amarillo Metal Color de la llama Desconocido www.njctl.org Química Estructura atómica Para los profesores: Color de la llama de los metales Ca- Rojo ladrillo/ rojo naranja Na- Amarillo Sr- Rojo carmesí Ba- Verde pálido Cu- Verde Li- Rojo carmín K- Lila/ violeta pálido Esta prueba se puede realizar con hisopos de algodón también. Caliente el hisopo hasta que la llama quede incolora. Recomiende a los estudiantes que intenten con el sodio al último para que no contamine y puedan apreciar los otros colores. Humedezca el hisopo en agua antes de introducirlo en la sal. Luego coloque en la llama. www.njctl.org Química Estructura atómica