1 Balanceo de ecuaciones químicas por el método Redox
Anuncio

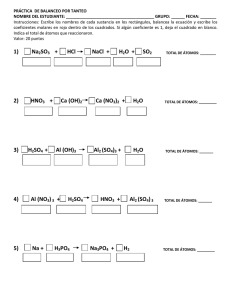
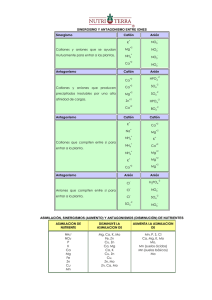
Balanceo de ecuaciones químicas por el método Redox. Consideraciones previas. Las moléculas reaccionan formando distintos tipos de compuestos. Las moléculas están formadas por átomos que tienen una energía determinada. Esa energía depende de cómo estén ordenados los electrones. En la tabla periódica vemos el resultado de ese orden energético. A la derecha tenemos el croquis del pueblo de Periodia, en donde hay barrios y personajes dignos de ser conocidos, a la izquierda vemos con detalle los barrios y los personajes que en él habitan. Los átomos al tener el mismo número de protones positivos y electrones negativos son eléctricamente neutros; es decir tienen carga eléctrica cero. Como mnemotecnia es conveniente decir que protón se escribe con p de positivo. No es lo mismo tener carga eléctrica cero que estabilidad electrónica que depende del acomodo de los electrones en las órbitas; los gases raros, al tener su última órbita completa son estables y no reaccionan con ningún elemento. 1 Helio Argón Xenón Kriptón Radón Si por mantener la estabilidad electrónica -tener completa su última órbitaganan electrones, la carga se vuelve negativa. A los iones negativos se les llama aniones que se escribe con n de negativo, en la siguiente gráfica vemos a los halógenos a los que es más fácil tomar un electrón para llenar su última órbita formando aniones que dejar salir 7. Flúor Cloro Iodo Bromo Astato Cuando un átomo por mantener la estabilidad electrónica pierde electrones, se transforma en ión positivo pues ha perdido cargas negativas. A los iones positivos se les llama cationes. Los metales alcalinos forman cationes con facilidad pues es más fácil que dejen ir su único electrón a que reciban 7: Hidrógeno Litio Sodio Cesio Potasio Francio Rubidio A los electrones, como a nosotros; no nos gusta estar solos tristes, abandonados sin que nadie nos comprenda; por eso emigran de las órbitas donde hay pocos a las órbitas donde hay muchos. En la siguiente gráfica vemos cómo el Sodio Na “vive” en un barrio de Periodia; Sodio tiene un sólo electrón en su última órbita que oye la fiesta que tiene el Cloro en el barrio de los Halógenos que está más allá de la barranca de Periodia y decide irse. En ese momento el Sodio se ioniza quedando Na+ y el Cloro también se ioniza 2 quedando Cl- . Por atracción de cargas opuestas su unen mediante enlace iónico formando el Cloruro de Sodio NaCl Na Cl Las moléculas también tienen carga eléctrica cero pues están formadas por átomos o por iones de carga contraria. Hay elementos que tienen valencia fija pues tienen todas sus órbitas completas excepto la última. Si en la última órbita hay un solo electrón su valencia será +1 y es el caso de los metales alcalinos y el hidrógeno y +2 para los alcalino-térreos. +2: alcalino-térreos, Hidrógeno Litio Sodio Berilio Potasio Magnesio Calcio Rubidio y -2 para el oxígeno que es el gandaya del barrio de los No-Metales: va a tomar los electrones que necesita a cualquier costo. -2 para el oxígeno 3 y cero (0) para los gases raros, nobles o inertes que viven en el exclusivo fraccionamiento residencial de Periodia. Helio Neón Kriptón Argón Xenón Cuando sus órbitas internas están incompletas, así como la última; hablamos de un elemento de valencia variable. Unos ejemplos de ordenamiento electrónico de átomos de valencia variable son: Ión Órbita Órbita Órbita Órbita Órbita Órbita Nombre K L M N O P Cu+1 2 8 18 1 Cuproso Cu+2 2 8 17 2 Cúprico Fe+2 2 8 14 2 Ferroso +3 Fe 2 8 13 3 Férrico Au+1 2 8 18 32 18 1 Auroso Au+3 2 8 18 32 16 3 Áurico Hg+1 2 8 18 32 17 1 Mercuroso Hg+2 2 8 18 32 16 2 Mercúrico Mn+1 2 8 13 2 Hipomanganoso Mn+4 2 8 11 4 Manganoso Mn+6 2 8 9 6 Mangánico Mn+7 2 8 8 7 Permangánico Esto es interesante porque el hierro de la hemoglobina de la sangre es oxidado por el oxígeno de la respiración y se transforma en ferroso, cuando carga al 4 bióxido de carbono se reduce y actúa como férrico. Los elementos de valencia variable pueden ser positivos o negativos. Oxidación-Reducción Se conoce como oxidación a la pérdida de electrones, es decir aumento en cargas positivas, que es al mismo tiempo disminución en cargas negativas. El oxígeno es el principal agente oxidante y toma los electrones de los metales. La reducción es la ganancia de electrones produciendo simultáneamente un incremento en las cargas negativas que es al mismo tiempo una pérdida de cargas positivas. Toda oxidación genera una reducción; y toda reducción una oxidación como dialéctico complemente de contrarios, generando el fenómeno redox. En toda reacción donde exista un elemento monomolecular y se obtenga de él un compuesto binario ( de dos moléculas ) o viceversa, además de obtener protóxido de hidrógeno ( agua ) sucede el fenómeno redox. Podemos cuantificar el número de cargas negativas y positivas que intercambiaron los reactivos para formar los reactantes. En la reacción: Cu+HNO3 ⎯⎯ → Cu( NO3 )2 +NO+H2 O Lo primero que haremos es anotar la valencia de los símbolos empezando por las valencias fijas que conocemos. Anotaremos cero al elemento monomolecular porque su carga eléctrica es cero que en este caso es el Cobre Cu: 0 Cu+HNO3 La molécula de ácido nítrico HNO3 , también es eléctricamente neutra así es que tenemos 6 cargas negativas del Oxígeno: 0 +1 -2 Cu+HNO3 +1 -6 (-2 de su valencia por el número de subíndice 3 en la fórmula) que deben de ser neutralizadas por igual número de cargas positivas 5 ¿Cuántas cargas positivas necesito para neutralizar 6 negativas si ya cuento con una positiva del hidrógeno? +1 +5 neutralizan –6. +1 +5 -2 HN O3 +6 -6 Para los reactantes empezaremos por el nitrato cúprico Cu( NO3 )2 que se ha formado haciendo lo mismo, recordando que el subíndice 2 del paréntesis me indica la valencia del Cu y que hay ahora 6 Oxígenos presentes que multiplicaremos por la valencia –2 del Oxígeno: +2 ⎛ -2 ⎞ Cu⎜ NO3 ⎟ +2 ⎝ -6 ⎠2 -1 2 Nos dan 12 cargas negativas repartidas en los 2 oxígenos de los dos nitratos NO3 que deben ser neutralizadas por +2 del Cu; necesito 10+ para el Nitrógeno para contrarrestar las -12. +2 ⎛ -2 ⎞ Cu⎜ N O3 ⎟ +2 +10 −12 ⎝ ⎠2 que por estar dos veces como nos lo indica el subíndice del paréntesis, cada nitrógeno tiene valencia 5+ : +2 ⎛ +5 -2 ⎞ Cu⎜ N O3 ⎟ +2 +10 −12 ⎝ ⎠2 quedándonos de la siguiente manera: +2 +5 -2 ⎛ ⎞ Cu⎜ N O3 ⎟ ⎝ ⎠2 Al óxido nitroso NO lo conocemos como el gas de la risa por producir ese efecto a nivel de sistema nervioso central. Al NO óxido nitroso, le hacemos el mismo cómputo antes que nos haga cosquillas: Sabemos que el oxidante oxígeno necesita ávidamente dos electrones que comparte alegremente con el nitrógeno, por eso un oxígeno necesita a un sólo nitrógeno. +2 -2 NO Al protóxido de hidrógeno mejor conocido como agua calculamos sus valencias y se computa al final siempre. 6 +1 -2 H2 O +2 -2 De tal manera que la ecuación nos queda así: 0 +1+5 -2 +2 +5 -2 ⎛ ⎞ +2 -2 +1 -2 Cu+HN O3 ⎯⎯ → Cu⎜ N O3 ⎟ +N O+H2 O +2 -2 ⎝ ⎠2 Analizando los cambios que hubo de valencias entre los reactivos y los reactantes o productos vemos que el Cu aumentó en +2 sus cargas, dado que entró con cero y salió con +2 0 +2 +5 -2 +1+5 -2 ⎛ ⎞ +2 -2 +1 -2 Cu+HN O3 ⎯⎯ → Cu⎜ N O3 ⎟ +N O+H2 O +2 -2 ⎝ ⎠2 en tanto que el nitrógeno del óxido nitroso disminuyó en 3 sus cargas ya que entró +5 en el ácido nítrico HNO3 y salió +2 en el óxido nitroso NO: 0 +1 +5 -2 +2 +5 -2 ⎛ ⎞ +2 -2 +1 -2 Cu+H N O3 ⎯⎯ → Cu⎜ N O3 ⎟ + N O+H2 O +2 -2 ⎝ ⎠2 por tanto disminuyó en 3 sus cargas positivas; o ¿no será aumentó en 3 sus cargas negativas?; se puede expresar en términos contrarios y también sería cierto. Lo que también es verdad es que el Cu se oxidó pues el N se redujo ya que han intercambiado cargas, por tanto aplicaremos el cambio del Cu (2) en el N y el cambio del N (3)en Cu como coeficientes en los reactantes ( productos cruzados ): Cu+HNO3 ⎯⎯ → 3 Cu( NO3 )2 +2NO+H2 O Si salieron 3 cobres Cu en los reactantes, debieron de haber entrado 3 cobres Cu en los reactivos por la Ley de la Conservación de la Materia y la Energía: 3 Cu+HNO3 ⎯⎯ → 3 Cu( NO3 )2 +2NO+H2 O Han salido 6 nitrógenos del Nitrato Cúprico Cu( NO3 )2 y 2 nitrógenos del Óxido Nitroso NO3 , son 8 nitrógenos en los reactantes, eso quiere decir que debe haber 8 nitrógenos en los reactivos: 3Cu+8 HNO3 ⎯⎯ → 3Cu( NO3 )2 +2NO+H2 O Ahora conviene hacer una tablita de los elementos que entran como productos que deben de ser igual en número a los que hemos obtenido, recordando que los coeficientes indica el número de veces que se presenta una molécula: 7 Elementos Reactivos Reactantes Cu 3 3 H 8 2 N 8 3(2)+2=8 O 8(3)=24 3(3)(2)+2+1=21 Si colocamos un 4 para el agua y contamos Oxígenos nos queda así: 3Cu+8HNO3 ⎯⎯ → 3Cu( NO3 )2 +2NO+4 H2 O ¿Pero de dónde salió el 4? Recordemos que dijimos que lo último que hacemos es contar al agua. Sin el oxígeno del agua son 20 oxígenos que salen y 24 que entran. La diferencia entre ambos da 4 que es el coeficiente para el agua de los reactantes. Elementos Reactivos Reactantes Cu 3 3 H 8 2 N 8 3(2)+2=8 O 8(3)=24 3(3)(2)+2+4=24 Si ahora si contamos los hidrógenos vamos ver que están en igual número y la nuestra ecuación está balanceada. Elementos Reactivos Reactantes Cu 3 3 H 8 2(4)=8 N 8 3(2)+2=8 O 8(3)=24 3(3)(2)+2+4=24 8 3Cu+8HNO3 ⎯⎯ → 3Cu ( NO3 )2 +2NO+4H2 O Otro ejemplo puede ser el siguiente: FeSO4 + KMnO4 + H2 SO4 → KHSO4 +MnSO4 + Fe2 ( S0 4 )3 + H2 O Escribimos sus valencias en la parte superior: +2 +6 -2 +1 +7 -2 +1 +6 +2 +1 +1+6 -2 +2 +6 -2 +3 ⎛ +6 -2 ⎞ +1 -2 Fe SO4 + KMnO4 + H2 S O4 → KH SO4 +Mn S O4 + Fe2 ⎜ S0 4 ⎟ + H2 O ⎝ ⎠3 Determinamos quien cambió y cuántas veces: +2 +7 +2 +3 ⎛ ⎞ Fe SO4 + K Mn O4 + H2 SO4 → KHSO4 + Mn SO4 + Fe2 ⎜ S0 4 ⎟ + H2 O ⎝ ⎠3 El hierro Fe tuvo un cambio de 1 pero en 2 átomos su cambio es 2 ⎛ ⎞ Fe SO4 + K Mn O4 + H2 SO4 → KHSO4 +2 Mn SO4 + 5 Fe2 ⎜ S0 4 ⎟ + H2 O ⎝ ⎠3 Salen 10 hierros Fe en total debieron de haber entrado: ⎛ ⎞ 10 FeSO4 + KMnO4 + H2 SO4 → KHSO4 +2MnSO4 + 5 Fe2 ⎜ S0 4 ⎟ + H2 O ⎝ ⎠3 Salieron 2 manganesos Mn debieron de haber entrado: ⎛ ⎞ 10 FeSO4 + 2 KMnO4 + H2 SO4 → KHSO4 +2MnSO4 + 5 Fe2 ⎜ S0 4 ⎟ + H2 O ⎝ ⎠3 Ahora vemos que han entrado 2 potasios K y debieron de haber salido: ⎛ ⎞ 10 FeSO4 + 2KMnO4 + H2 SO4 → 2 KHSO4 +2MnSO4 + 5 Fe2 ⎜ S0 4 ⎟ + H2 O ⎝ ⎠3 Para encontrar el coeficiente del ácido sulfúrico no lo tomamos en cuenta en el cómputo y son 10 Azufres que entran y 19 que salen. La diferencia me da 9: ⎛ ⎞ 10 FeSO4 + 2KMnO4 + 9 H2 SO4 → 2KHSO4 +2 MnSO4 + 5 Fe2 ⎜ S0 4 ⎟ + H2 O ⎝ ⎠3 Para encontrar el coeficiente del agua contamos todos los oxígenos menos el del agua y son: 1° miembro: 10 O4 +2º4+9º4=40+8+36=84 2° miembro: 204+2O4+5(O4)3=8+8+60=76 84-76=8 ⎛ ⎞ 10 FeSO4 + 2KMnO4 + 9 H2 SO4 → 2KHSO4 +2MnSO4 + 5 Fe2 ⎜ S0 4 ⎟ + 8 H2 O ⎝ ⎠3 Ejercicios: 9 K2 Cr2 O7 + HCl → KCl+CrCl3 + Cl2 + H2 O SO2 + Cr2 O7 +H2 O → H2 SO4 + Cr HNO3 + I2 → HIO3 + NO2 + H2 O K2 Cr2 O7 + H2 SO4 + H2 S → KHSO4 + Cr ( SO4 )3 + H2 O FeSO4 + HBrO+HCl → FeCl3 + H2 SO4 + HBr+H2 O 10