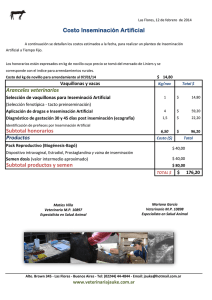
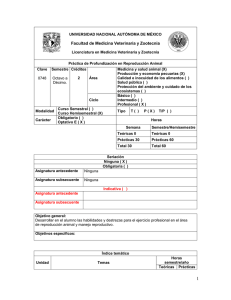
MODULO REPRODUCCION ANIMAL AVANZADA EDWIN
Anuncio

MODULO REPRODUCCION ANIMAL AVANZADA EDWIN MANUEL PAEZ BARON Médico Veterinario Zootecnista Esp. en Sanidad Animal MSc en Educación Superior Estudiante Doctorado en Desarrollo Sostenible Universidad Nacional Abierta y a Distancia Escuela de Ciencias Agrícolas, Pecuarias y del Medio Ambiente CEAD TUNJA 2012 TABLA DE CONTENIDO UNIDAD 1. CONTROL DE LA ACTIVIDAD REPRODUCTIVA. CAPITULO 1. CONTROL DE LA ACTIVIDAD OVARICA. Lección 1. Ovogénesis. Lección 2. Foliculogénesis. Lección 3. Ondas de desarrollo folicular. Reclutamiento. Lección 4. Selección. Lección 5. Dominancia CAPITULO 2. INDUCCIÓN Y SINCRONIZACIÓN DE CELO. Lección 6. Técnicas de sincronización del celo Lección 7. Inducción y sincronización del celo en bovinos. Lección 8. Inducción y sincronización del celo en equinos. Lección 9. Inducción y sincronización del celo en ovinos. Lección 10. Inducción y sincronización del celo en porcinos. CAPITULO 3. PROGRAMAS DE INSEMINACON ARTIFICIAL A TIEMPO FIJO Lección 11. Aspectos generales Lección 12. Protocolo de sincronización de celo mediante el uso de GnRH (ovsynch). Lección 13. Variantes del protocolo Ovsynch. Lección 14. Protocolo de sincronización de celo mediante el uso de dispositivos intravaginales. Lección 15. Protocolo de sincronización de celo para IATF y resincronización para una segunda IATF. UNIDAD 2. INSEMINACION ARTIFICIAL Y TRANSFERENCIA DE EMBRIONES CAPITULO 1. COLECTA Y EVALUACION DE SEMEN. Lección 16. Aspectos generales. Lección 17. Evaluación de la libido. Lección 18. Colecta y evaluación de semen. Lección 19. Colecta y evaluación de semen bovino y ovino. Lección 20. Colecta y evaluación de semen porcino. CAPITULO 2. INSEMINACION ARTIFICIAL. Lección 21. Historia de la inseminación artificial Lección 22. Técnica de Inseminación artificial. Lección 23. Técnica de Inseminación artificial en equinos. Lección 24. Técnica de Inseminación artificial en ovinos. Lección 25. Técnica de Inseminación artificial en porcinos. CAPITULO 3. TRANSFERENCIA DE EMBRIONES Lección 26. Selección y manejo de donantes y receptoras. Lección 27. Colecta y evaluación de embriones Lección 28. Transferencia de embriones Lección 29. Criopreservación de embriones. Lección 30. Transferencia de embriones en equinos. UNIDAD 3. ULTIMAS BIOTECNOLOGIAS REPRODUCTIVAS APLICADAS A LA PRODUCCION ANIMAL. CAPITULO 1. FERTILIZACION IN VITRO. Lección 31. Aspectos generales. Lección 32. Obtención de ovocitos. Lección 33. Maduración de ovocitos in vitro Lección 34. Fertilización in vitro. Lección 35. Maduración y transferencia de embriones. CAPITULO 2. CLONACION Y TRANSGENESIS. Lección 36. Aspectos generales Lección 37. Métodos de clonación. Lección 38. Técnica de clonación. Lección 39. Transgénesis. Lección 40. Técnicas de obtención de animales transgénicos. CAPITULO 3. SEXAJE DE SEMEN, QUIMERAS, ICSI, CELULAS MADRE Lección 41. Aspectos generales Lección 42. Sexaje de semen. Lección 43. Producción de quimeras. Lección 44. Inyección intracitoplasmática de semen. Lección 45. Producción de células madre LISTADO DE FIGURAS Fig 1. Folículo primordial. Fig. 2. Folículo primario. Fig. 3. Folículo secundario. Fig. 4. Folículo terciario. Fig 5. Dinámica folicular durante un ciclo estral bovino. Fig. 6. Protocolo Ovsynch. Fig. 7. Protocolo Cosynch. Fig. 8. Órganos internos del aparato reproductor masculino. Fig. 9. La libido representa el impulso sexual del macho. Fig. 10. La evaluación morfológica del semen. Fig. 11. Anormalidades espermáticas. Fig. 12. Medición de la concentración espermática. Fig. 13. Hemotocitómetro o cámara de Neubauer. Fig. 14. Colecta de semen de carnero. Fig. 15. Colecta de semen del verraco. Fig. 16. Determinación del tiempo de monta o inseminación. Fig. 17. Selección de la pajilla. Fig. 18. Proceso de inseminación artificial. Fig. 19. Seguimiento ecográfico de la ovulación. Fig. 20. Inseminación artificial en la yegua. Fig. 21. Inseminación artificial en la oveja. Fig. 21. Inseminación artificial laparoscópica en la oveja. Fig. 22. Inseminación artificial laparoscópica en la oveja. Fig. 23. Inseminación artificial en la cerda. Fig. 24. Lubricación del catéter. Fig. 25. Inserción del catéter. Fig. 26. I.A en la Cerda. Fig. 27. Diversos tipos de catéter utilizados en la I.A porcina. Fig. 28. Termos de inseminación. Fig. 29. Ovarios superovulados. Fig. 30. Proceso de colecta de embriones. Fig. 31. Embriones en diferentes etapas de desarrollo. Fig. 32. Embriones colectados. Fig. 33. T.E en equinos. Fig. 34. Proceso de FIV. Fig. 35. Proceso de clonación. Fig. 36. Clonación por transferencia nuclear. Fig. 37. Enucleación. Fig. 38. Transferencia nuclear. Fig. 39. Ovocito con núcleo. Fig. 40. Electrofusión. Fig. 41. Cultivo. Fig. 42. Transferencia embrionaria. Fig. 43. Clonación en las diferentes especies. Fig. 44. Oveja Dolly y su creador. Fig. 45. Lady, la primera ternera clonada. Fig. 46. Pampa mansa. Fig. 47. Manuel. Fig. 48. Victoria. Fig. 49. Prometea y su progenitora. Fig. 50. Snuppy. Fig. 51. El primer cachorro clonado comercial. Fig. 52. Caninos clonados. Fig. 53. Citómetro de flujo. Fig. 54. Citometría de flujo en la producción de semen sexado. Fig. 55. Inyección del espermatozoide. Fig. 56. ICSI. Fig. 57. Producción de células madre. LISTADO DE TABLAS Tabla 1. Protocolo Ovsynch. Tabla 2. Protocolo Cosynch. Tabla 3. Protocolo Cosynch 72 horas. Tabla 4. Protocolo para novillas. Tabla 5. Protocolos para vacas en lactancia. Tabla 6. Dispositivo intravaginal + GnRH. Tabla 7. Protocolos de sincronización de celo para IATF y resincronización Novillas. Tabla 8. Protocolos de sincronización de celo para IATF y resincronización Vacas en lactancia. Tabla 9. Protocolos de sincronización de celo para IATF y resincronización de los retornos al celo para una segunda IATF Novillas. Tabla 10. Protocolos de sincronización de celo para IATF y resincronización de los retornos al celo para una segunda IATF Vacas en lactancia. Tabla 11. Protocolo de superovulación y sincronización del celo (vacas). Tabla 12. Protocolo de superovulación y sincronización del celo (Novillas). Tabla 13. Protocolo de superovulación con eCG. Tabla 14. Desarrollo del embrión. Tabla 15. Escala de clasificación embrionaria. Tabla 16. Avances de la transgénesis. INTRODUCCION El curso de reproducción avanzada comprende el conocimiento de las biotecnologías de la reproducción aplicada a la producción de las especies domesticas. Se hace un recorrido desde los inicios de la biotecnología con los procesos de conocimiento de la fisiología ovárica y su manipulación, pasando por la inseminación artificial, la sincronización de celo, la transferencia de embriones, la fertilización in vitro y las últimas biotecnologías disponibles en el mercado, tales como el semen sexado, la inyección intracitoplasmática de semen, la clonación, la transgénesis y la producción de células madre embrionarias. El objetivo del curso es que el estudiante conozca, aplique y verifique las diversas técnicas disponibles para el mejoramiento de la eficiencia y la rentabilidad de las explotaciones pecuarias. Se pretende brindar un conocimiento acerca de la evolución de las biotecnologías y su aplicación en los diversos campos de la producción animal, en este sentido, el estudiante debe conocer las herramientas disponibles y con base en su propio criterio definir cuáles pueden ser aplicadas en la producción animal. El estudiante es el responsable de su proceso de aprendizaje, y en tal sentido el curso brinda las herramientas necesarias para el desarrollo de las habilidades y destrezas que requiere para su futuro desempeño como profesional de las ciencias pecuarias. El curso involucra actividades individuales y grupales, desarrollas en las tres fases de aprendizaje (reconocimiento, profundización y transferencia) que permitirán al estudiante explotar sus diversas capacidades y habilidades de conocimiento con el fin de dar solución práctica a los casos que va a tener que enfrentar en su vida profesional. Es importante señalar que la educación a distancia involucra la participación de múltiples medios y mediaciones pedagógicas, entre las cuales se destacan: los videos, las presentaciones, las animaciones, los encuentros sincrónico y asincrónico (foros, chat), las prácticas pedagógicas, las visitas, las lecciones, los cuestionarios, entre otros. El curso pretende brindar al estudiante la guía para desarrollar su proceso de aprendizaje, y con base en este pueda investigar, conocer, aplicar y desarrollar un conocimiento profundo en las biotecnologías de la reproducción aplicadas a la producción animal. UNIDAD 1. CONTROL DE LA ACTIVIDAD REPRODUCTIVA OBJETIVOS • • • Comprender los cambios fisiológicos ocurridos en el ovario y sus estructuras durante el ciclo estral. Identificar las hormonas y los elementos que producen dichos cambios durante el ciclo estral. Identificar los protocolos y productos utilizados en los programas de sincronización de celo e inseminación artificial a tiempo fijo. ESTRUCTURA CAPITULO 1. CONTROL DE LA ACTIVIDAD OVARICA. Lección 1. Ovogénesis. Lección 2. Foliculogénesis. Lección 3. Ondas de desarrollo folicular. Reclutamiento. Lección 4. Selección. Lección 5. Dominancia CAPITULO 2. INDUCCIÓN Y SINCRONIZACIÓN DE CELO. Lección 6. Técnicas de sincronización del celo Lección 7. Inducción y sincronización del celo en bovinos. Lección 8. Inducción y sincronización del celo en equinos. Lección 9. Inducción y sincronización del celo en ovinos. Lección 10. Inducción y sincronización del celo en porcinos. CAPITULO 3. PROGRAMAS DE INSEMINACON ARTIFICIAL A TIEMPO FIJO Lección 11. Aspectos generales Lección 12. Protocolo de sincronización de celo mediante el uso de GnRH (ovsynch). Lección 13. Variantes del protocolo Ovsynch. Lección 14. Protocolo de sincronización de celo mediante el uso de dispositivos intravaginales. Lección 15. Protocolo de sincronización de celo para IATF y resincronización para una segunda IATF. UNIDAD 1. CONTROL DE LA ACTIVIDAD REPRODUCTIVA CAPITULO 1. OVOGÉNESIS Y DINÁMICA FOLICULAR . Lección 1. Ovogénesis. La ovogénesis consiste en el proceso de formación y desarrollo del ovocito. Este proceso inicia en las fases tempranas de la vida fetal de la hembra bovina, aproximadamente entre los 120 y 140 días de gestación y finaliza con la formación de un determinado número de folículos primordiales. La ovogénesis involucra tres fases: una fase proliferativa en que las ovogonias (OO) se dividen activamente, una fase meiótica que permite la formación de los ovocitos primarios y una tercera fase de intensa degeneración de las células germinales primordiales (CGP). Los ovocitos que sobreviven a ésta fase degenerativa son detenidos en el estado de diploteno de la primera división meiótica y están rodeados por una simple capa de células de la granulosa (CG), ésta estructura recibe el nombre de folículo primordial (Peña, Góngora y Estrada, 2007). De acuerdo a lo reportado por Gigli, Russo y Agüero (2006), las ovogonias se diferencian en ovocitos cuando comienzan la meiosis, en embriones de ratón la división por mitosis comienza alrededor del día 14-16 de gestación y culmina el día 20, dando lugar a la división meiótica; en el bovino se observan figuras meióticas a partir del día 82 de gestación; en el equino, la multiplicación de las ovogonias por mitosis comienza alrededor del día 50 de gestación y continúa hasta el día 150-160. A partir del día 102 se observan en el ovario de embrión equino todos los estadios de división meiótica si bien son pocos los folículos primordiales que se forman, ya que la mayoría de los ovocitos se degeneran antes de rodearse de las células de la granulosa. Por otro lado, Fernández (2003) plantea que en casi todas las especies de mamíferos no se produce división mitótica de la célula germinal femenina después del nacimiento, de manera que, el número de ovocitos presentes al nacimiento representa el total disponible durante la vida del animal. A diferencia del macho en el cual se puede producir celular sexuales en la vida posnatal. En el feto bovino, la ovogonia se desarrolla de las células primordiales germinales que han migrado hasta el ovario durante la embriogénesis temprana y prolifera alrededor del día 50 hasta el día 130 de la gestación. Un proceso de degeneración ovogonial comienza alrededor del día 95 de la vida fetal y la mayoría de los ovocitos producidos durante este período (60% o más) son eliminados del ovario antes del parto. Un segundo evento de desarrollo se inicia a los 80 días de la vida fetal cuando la ovogonia inicia la meiosis. Este proceso se detiene en todos los ovocitos en el estadio diploteno de la profase meiótica. Acompañando estos cambios nucleares están la formación del folículo primordial, la diferenciación de una capa de células aplanadas que lo envuelven conocida como células de la granulosa, el establecimiento de una lámina basal rodeando la granulosa y la diferenciación de una capa de células de teca exteriores a la lámina basal. La población de folículos primordiales puede considerarse como una cuenta en la cual la foliculogénesis es un retiro, comenzando al inicio de la vida fetal y continuándose en la pubertad y en los períodos reproductivos de la vida del animal (Fernández, 2003). Lección 2. Foliculogénesis La foliculogénesis o desarrollo folicular es un proceso continuo que se da en las hembras de todas las especies domésticas, y que da como resultado la ovulación de un folículo maduro o la regresión o involución del mismo. Este proceso es el resultado de la interacción de múltiples componentes celulares que constituyen el folículo y de múltiples factores que son producidos en el ovocito, en las células de la granulosa (CG) o en las células de la teca (CT), y que son controlados bajo el influjo de diferentes factores autocrinos, paracrinos o endocrinos (Velásquez y Mendieta, 1999). En la foliculogénesis, un folículo primordial entra al grupo de crecimiento, y es conducido a uno de dos hechos: la degeneración por atresia (sufrida por el 99% o más) o la ovulación alcanzada por muy pocos (menos del 1%). El periodo de tiempo que se requiere desde la activación de un folículo primordial durmiente hasta su ovulación, es de aproximadamente 180 días en los bovinos. Los folículos primordiales, se caracterizan por el ovocito I detenido en la profase de su primer división meiótica (diploteno) rodeado por una capa plana de células de la granulosa. Estos folículos forman la reserva gametogénica o población de folículos de reserva, que una hembra va a utilizar en toda su historia reproductiva, a partir de estos folículos de reserva se originan los folículos de crecimiento, en las potrancas se estima la existencia de entre 36.000-46.000 folículos primordiales en el ovario, en los bovinos de 25.000 a 42.000 folículos primordiales (Gigli, Russo y Agüero 2006). Fig 1. Folículo primordial. Este se encuentra rodeado por una capa plana de células de la granulosa. Fuente: http://www.telmeds.org/AVIM/Aembrio/Imagenes/Foliculo%20primordial.jpg Posteriormente el folículo primordial continúa su desarrollo a los denominados folículos preantrales: folículo primario y folículo secundario. En el folículo primario las células planas de la granulosa antes de comenzar a dividirse por mitosis se diferencian en una capa de células de forma cúbica que rodea al ovocito I y la teca interna comienza su diferenciación. El folículo secundario, es aquel en el cual se completa la proliferación de las células de la granulosa y las mismas aumentan de tamaño. Fig. 2. Folículo primario. Las células planas se convierten en células de forma cubica. Fuente: http://virtual.ujaen.es/atlas/ovario/ova rio100x1foliculos1.jpg Fig. 3. Folículo secundario. En este las células de la granulosa aumentan de tamaño. Fuente: http://lh4.ggpht.com/_1tDfjMtTyDc/Ro76fLp5srI/AAAAAAAAABQ/dq3 -PMEe-cA/ foliculo+primario2.jpg Posteriormente, se produce la formación de la cavidad del folículo, y el folículo se denomina antral o terciarios, estos folículos antrales se pueden encontrar en el ovario bovino con diámetros comprendidos en el rango de 0.1 a 20 mm (Fernández, 2003). Los folículos terciarios se caracterizan por estar rodeados de varias capas cúbicas de células de la granulosa que comienzan a secretar un trasudado que se denomina líquido folicular, que al acumularse produce un reordenamiento de las mismas en células del cúmulo y murales (Gigli, Russo y Agüero 2006). Fig. 4. Folículo terciario. Las células de la granulosa comienzan a secretar un trasudado que se denomina líquido folicular. Fuente: http://www.telmeds.org/AVIM/Aembrio/foliculo_de_De_Graaf.gif Por último se encuentran los folículos preovulatorios o folículos de De Graaf, los cuales son los folículos que se encuentran listos para ovular. En la yegua el folículo preovulatorio es mayor a 35 mm, en la vaca entre 10 a 20 mm y en la llama entre 10 a 18 mm (Gigli, Russo y Agüero, 2006). En los mamíferos, la hembra cuenta con una reserva de ovocitos que han interrumpido su crecimiento en los folículos primordiales, única fuente de ovocitos para ser ovulados durante su vida reproductiva. Los folículos primordiales se forman durante la vida fetal en bovinos (130 días), ovinos y porcinos (70 días), o alrededor del nacimiento en roedores (Espinoza y col, 2007). Dentro de este marco, es válido señalar que gracias a la utilización de la ultrasonografía, se logró determinar que el desarrollo folicular se produce de manera periódica en las denominadas ondas de desarrollo folicular. Lección 3. Ondas de desarrollo folicular Una onda de desarrollo folicular se define como el desarrollo armónico y simultáneo de un pool de folículos antrales (terciarios) pequeños, en promedio 24 por onda con un rango de 8 a 41, funcionando en tres fases a saber: reclutamiento, selección y dominancia folicular (Fernández, 2003). En los bovinos durante un ciclo estral normal se puede observar la presencia de dos o tres ondas foliculares por ciclo. A continuación se detallan las fases que componen las ondas de desarrollo folicular: Reclutamiento: Esta fase es un proceso regulado por la Hormona foliculoestimulante (FSH), consiste en que un conjunto de folículos antrales tempranos (2-3 mm de diámetro) comienzan a crecer en un medio con suficiente soporte gonadotrófico que les permita progresar a la ovulación. El reclutamiento folicular se refiere a la formación de una población de folículos antrales de donde uno o varios, dependiendo de la especie (monotoca o politoca), es seleccionado para la ovulación. En cada ciclo ovárico es reclutado un grupo de folículos primordiales que crecen de manera continua debido a los incrementos en las concentraciones de FSH. Cuando la FSH alcanza el pico de concentración, los folículos más grandes de la onda tienen un diámetro de aproximadamente cuatro (4) mm (Espinoza, et al, 2007). Lección 4. Selección. En este proceso uno de los folículos que ha iniciado su crecimiento, evade la atresia y adquiere la competencia para alcanzar la ovulación. La selección folicular ocurre al final de la fase común de crecimiento. El folículo dominante crece a una tasa constante y el resto de los folículos subordinados sufren atresia o temporalmente crecen a una velocidad menor y posteriormente dejan de hacerlo. A este fenómeno se le ha denominado desviación. La desviación durante la oleada folicular en bovinos empieza con una reducción en la tasa de crecimiento de los folículos subordinados; en contraste, se presenta una tasa de crecimiento constante en el folículo dominante (Espinoza, et al, 2007). Lección 5. Dominancia. En esta fase el folículo seleccionado inhibe o impide el reclutamiento de una nueva serie de folículos. La dominancia folicular en la vaca se caracteriza por dos fenómenos: la divergencia en el crecimiento entre el folículo mayor y el segundo mayor; y una disminución del número de folículos perqueños correlacionada con el crecimiento del folículo mayor. Fuente: http://www.scielo.org.ve/img/fbpe/inci/v32n2/art06fig1.jpg Fig. 5. Dinámica folicular durante un ciclo estral bovino El desarrollo folicular es controlado por diversas hormonas y proteínas provenientes de la hipófisis, el cuerpo lúteo y de los folículos. De acuerdo con Bó (2006), se ha observado que cada onda folicular está siempre precedida por un pico de FSH, razón por la cual se cree que este pico es fundamental para que los folículos antrales pequeños ingresen al pool de folículos grandes que se observan en la onda folicular. Una vez se ha dado inicio a la onda, el folículo dominante comienza a producir grandes cantidades de estradiol e inhibina que actuarán a nivel hipotalámico-hipofisiario inhibiendo la liberación de FSH, con poca FSH circulante los folículos subordinados comienzan a regresar. Al mismo tiempo, el folículo dominante puede seguir creciendo debido a que es más eficiente en la utilización de la baja FSH circulante y la adquisición de receptores de Hormona luteinizante (LH) en las células de la granulosa (además de los que se encuentran en la teca). CAPITULO 2. INDUCCIÓN Y SINCRONIZACIÓN DE CELO EN LAS ESPECIES DOMÉSTICAS. Lección 6. Técnicas de sincronización de celo. El conocimiento de la dinámica folicular es importante para la aplicación y el éxito de sincronización de celos. Actualmente existen tres (3) tipos de técnicas de sincronización: Prostaglandina F2 alfa (PGF2∞) y sus análogos; Progesterona o progestágenos sintéticos combinados con estrógenos y gonadotropina coriónica equina (eCG o PMSG); Hormona liberadora de Gonadotropinas (GnRH). Técnicas de sincronización mediante el uso de prostaglandinas y sus análogos. Las técnicas de sincronización de celos con PGF2∞ o sus análogos; se emplean rutinariamente en las diversas especies domésticas. Se basan en la capacidad de las prostaglandinas para provocar la regresión morfológica y funcional del cuerpo lúteo del ciclo (luteolisis); como consecuencia de su acción sólo se puede aplicar en animales cíclicos y durante la fase luteal del ciclo. (Fernández, 2003). El tiempo que tarda en producirse el celo y la ovulación desde que baja el nivel de progesterona es inversamente proporcional al tamaño del folículo dominante en el momento de aplicación de la prostaglandina. Técnicas de sincronización mediante el uso de progestágenos. Este método de inducción y sincronización de celos se desarrolló a principios de los años setenta, mucho antes de tener un conocimiento exacto de la dinámica folicular. La mayoría de productos viene en forma de dispositivo (Intravaginal o auricular). Su mecanismo de acción se basa en la simulación de la acción del cuerpo lúteo, por ende, el progestágeno o progesterona tiene como misión producir un bloqueo del hipotálamo, de manera que impedirá, independientemente de la existencia de un cuerpo lúteo, que se produzcan ovulaciones mientras que los animales conserven el dispositivo. Además provoca una repleción de gonadotrofinas hipofisarias que se liberan bruscamente al retirarlo. Técnicas de sincronización mediante el uso de GnRH. La propuesta básica de este método consiste en lograr sincronizar eficientemente una onda folicular para llevarla a la ovulación en un momento esperado, permitiendo inseminar los animales aún sin presencia de celo evidente, ya que lo que interesa es tener un óvulo en el útero y no un celo en el animal (Fernández, 2003). A continuación se describen los programas de sincronización de celo en las principales especies domésticas. Lección 7. Sincronización de celo en bovinos. La sincronización de celo en bovinos, ha sido un tema de varios estudios encaminados a estandarizar una técnica que permita la manipulación del ciclo estral con el objetivo de programar los eventos reproductivos del hato o de la explotación y con ello contribuir a mejorar la eficiencia reproductiva. Los primeros intentos y ensayos de manipulación del ciclo estral en bovinos fueron realizados en 1948, en ese entonces Christian y Casida utilizaron la progesterona con el fin de bloquear la función reproductiva de los animales tratados, una vez suspendieron su aplicación, un gran número de los animales presentaron síntomas de celo Posteriormente, Wiltbank y Kasson en el año de 1968, adicionaron al inicio del tratamiento con progesterona, la aplicación de un estrógeno: el Valerato de estradiol, el cuál cumplia una función de efecto luteolítico, con lo cual se incrementó el porcentaje de presentación de celos en los animales tratados, además de permitir una reducción en el tiempo de aplicación de la progesterona (Becaluba 2007). Posteriomente, en el año de 1972, Rowson y col. (citado por Becaluba, 2007) ensayaron un protocolo para la sincronización de celo en bovinos utilizando Prostaglandina F2α, la cual gracias a un efecto luteolítico inducia la regresión del cuerpo lúteo, y permitía el inicio de un nuevo ciclo estral. Con base en estos estudios previos, es que se han establecido una gran variedad de protocolos encaminados a la manipulación del ciclo estral y a su duración, ya sea acortando la fase luteal (agentes luteolíticos) o alargando la fase luteal (agentes progestágenos). Sincronización con Prostaglandina F2α. La utilización de la PGF2α y sus análogos en los programas de sincronización de celo, ha sido ampliamente desarrollada en los últimos años, en gran parte debido a los bajos costos que representa su uso. Su efecto fisiológico consiste en causar la regresión del Cuerpo lúteo (CL) a partir del día 5 del ciclo estral y su efecto luteolítico es máximo entre los días 12 y 17 del ciclo. Sin embargo, el estadio del folículo dominante en el momento de la aplicación de la PGF2α va a producir una variación del momento del celo y la ovulación de 2 a 7 d. Los tratamientos tradicionales con PGF2α utilizan dos dosis con 11 a 14 días de intervalo y detección por 5-7 días después de la segunda aplicación de PGF2α. Teóricamente, estas dos aplicaciones de PGF2α son efectivas cuando hay una gran proporción de hembras ciclando y un 80% de ellas deberían ser observadas en celo, pero los problemas de detección de celos hace que el porcentaje real de hembras detectadas en celo, no superen el 50% (Bó, et al, 2004). Sincronización con GnRH y PGF. Protocolo Ovsynch. La utilización de GnRH ha sido un tratamiento hormonal muy popular de control del desarrollo folicular en los últimos tiempos. Se ha demostrado que la GnRH inducirá la ovulación del folículo dominante presente al momento del tratamiento, y se han desarrollado protocolos que utilizan GnRH y PGF2α para IATF en ganado de carne o leche. Este protocolo es conocido con el nombre de Ovsynch, y se explicará en en capitulo de Inseminación a tiempo fijo (IATF). Sincronización con Progestágenos. Los progestágenos son compuestos similares a la progesterona que están en el mercado desde hace varios años y se usan para sincronizar el celo en programas de IATF. El uso de estrógenos y progestágenos para controlar el desarrollo folicular se basa en el potente efecto de la combinación de estos esteroides sobre las gonadotrofinas. El protocolo más utilizado, consiste en administrar 2 mg de benzoato de estradiol (BE) por vía intramuscular (IM) en el momento de la inserción del dispositivo intravaginal con progesterona (P4; día 0), para sincronizar el desarrollo folicular. En el día 7 se retira el dispositivo intravaginal y se administra PGF2α (para inducir la luteólisis), y en el día 8 se coloca 1 mg de BE para sincronizar la ovulación. Se realiza la IATF entre las 52 y 56 h del retiro del dispositivo ya que la mayoría de los animales ovulan en promedio a las 66 h (Bó, et al, 2004). Lección 8. Inducción y sincronización de celo en equinos. En los equinos la sincronización de celo, se realiza con el fin de suprimir el estro en aquellas yeguas de exposición o competencia. Así como para inducir en celo, en yeguas con problemas de anestro o celos silentes. Sincronización de celo mediante el uso de progestágenos. La sincronización de celo en las yeguas se puede hacer mediante el uso de progestágenos de usos oral, uno de los progestágenos más utilizados es el altrenogest, la dosis a administrar es de 0.044 mg/kg una vez al día. La duración del tratamiento depende del objetivo que se quiera lograr mediante el mismo (Intervet, 2009). Si se desea adelantar o acelerar la presentación del celo regular, la yegua debe estar en celo contar con uno o varios folículos de 20 mm o más de diámetro en alguno de sus ovarios, si esto es así, se suministra altrenogest, durante un periodo de 15 días. Para la sincronización del celo en yeguas cíclicas, se debe suministrar altrenogest, durante 10 días, posteriormente al día 11 se aplica una dosis de prostaglandina con el fin de causar la lisis de algún cuerpo lúteo que produzca progesterona endógena. Si se desea suprimir la presentación del celo, en yeguas que van a participar en eventos deportivos (salto, carreras, etc.). Existen dos protocolos de tratamiento: 1. Administrar altrenogest durante 15 días y luego permitir a la yegua entrar en calor. Después de la ovulación, se presenta el diestro, que dura aprox. 2 semanas y durante el cual no se requiere la administración de altrenogest. Después de transcurridas las 2 semanas se inicia nuevamente el tratamiento durante 15 días. Este tratamiento puede adaptarse a cada yegua en particular. 2. Si se quiere suprimir el celo una sola vez: Se debe iniciar el tratamiento por lo menos 4 días antes de la competencia (0.044 mg/kg p.v.) e interrumpirlo después de la misma. O se puede administrar altrenogest durante 60 días seguidos e interrumpir el tratamiento para permitir a la yegua entrar en calor. Una vez terminado éste, se puede iniciar nuevamente la administración del producto. El tratamiento puede iniciarse en cualquier día, sin importar si la yegua está en calor o no. Si la yegua esta en calor cuando se empieza a administrar altrenogest, tardará por lo menos 3 días después de iniciado el mismo, en salirse de calor (Intervet, 2009). Sincronización de celo mediante el uso de dispositivos intravaginales. Se han realizado diversos estudios para evaluar el uso de dispositivos intravaginales en los programas de sincronización de celo en yeguas, y estos han tenido diversos resultados. Uno de los protocolos más utilizados es aquel en el que se utiliza el dispositivo intravaginal de uso bovino que contienen progesterona de lenta liberación (PRID®, DIV-B®, TRIUB®) ya que no existen comercialmente dispositivos para uso en equinos. El dispositivo debe insertarse via vaginal de la manera más higiénica posible, y se mantiene por un tiempo de doce (12) días, al cabo al cabo de los cuales es retirado. El celo puede observarse a partir de las 24 hasta las 94 horas después del retiro del dispositivo (Wilde, De la Vega y Cruz, 2002). Lección 9. Inducción y sincronización de celo en ovinos En Colombia, la explotación ovina se ha desarrollado de una manera tradicional, con un manejo de tipo extensivo y poco tecnificado, sin embargo, gracias al avance de la biotecnología y a la búsqueda de nuevas alternativas y nuevos mercados, este tipo de explotación ha adquirido gran importancia durante los últimos años, conllevando a las búsqueda de alternativas para incrementar la eficiencia y productividad de la explotación. En este sentido, la sincronización de celo se constituye en una herramienta biotecnológica que recién se está implementando en nuestro país, aunque está es una práctica tradicional en otros países con vocación ovina, tales como Uruguay y México. A continuación se describen los principales métodos de sincronización de celo en ovinos. Sincronización mediante el uso de prostaglandinas. Consiste en la aplicación de dos dosis de prostaglandina F2alfa (PGF2∞) con un intervalo de 10 días entre la primera y la segunda aplicación. La presentación del celo se puede dar entre las 40 y 70 horas posteriores a la última dosis aplicada (Raso, Buratovich y Villa, 2004). . Sincronización mediante el uso de progestágenos. Consiste en la aplicación intravaginal de dispositivos o esponjas impregnados con acetato de medroxiprogesterona (MAP), el cual es un analógo sintético de la progesterona, estos se deben dejar durante 12 días consecutivos, al cabo de los cuales se retira el dispositivo y se aplican 300 Unidades internacionales (UI) de Gonadotropina coriónica equina (eCG o PMSG). La presentación del celo se dará entre las 24 y 72 horas posteriores a la aplicación de la eCG (Raso, Buratovich y Villa, 2004). En nuestro país no se encuentran disponibles comercialmente este tipo de dispositivos, por lo cual muchas veces son elaborados con espuma y nilón, y luego son impregnados con el MAP. Lección 10. Inducción y sincronización de celo en porcinos La sincronización de celo en cerdas se pretende utilizar al máximo las instalaciones de una granja porcina, sobre todo en aquellas de ciclo completo, ya que al sincronizar en celo y por ende que entren en calor un grupo de cerdas para que se les de servicio, permitirá conocer con anticipación algunos eventos tales como: fecha probable de parto, fecha probable de destete, fecha probable de venta (Ángeles, 1999). A continuación se señalan algunos de los protocolos de inducción de celo en las cerdas: Sincronización de celo mediante el uso de progestágenos por vía oral. En los programas de sincronización de celo en cerdas prepuberes se ha utilizado el altrenogest, el cual es un progestágeno sintético de uso oral (Mazarri, 1984). En cerdas nulíparas que se encuentren ciclando la dosis a suministrar es de 20 mg diarios durante 18 días consecutivos, al cabo de los cuales se suspende su suministro y se dará lugar a la presentación del celo de 3 a 5 días después. En cerdas multíparas el tratamiento se inicia en el momento del destete, suministrando 20 mg diarios durante 5 días consecutivos, el celo se podrá presentar entre los 2 y 3 días después de que se suspende el tratamiento. Es importante señalar que la presentación del celo podrá variar de acuerdo a las condiciones medioambientales y al manejo productivo y reproductivo de cada explicación (Intervet, 2009). Sincronización de celo mediante el uso de agentes luteolíticos. El uso de la prostaglandina como sincronizador de celo en los porcinos es muy limitado. Lo anterior, debido a que en la cerda, el cuerpo lúteo solo es sensible a la prostaglandina a partir del día 12. Si se aplica prostaglandina en cerdas la respuesta dependerá de la fase del ciclo estral en la que se encuentre el animal. Sincronización de celo mediante el uso de gonadotropinas. Para la sincronización del celo en cerdas también se pueden utilizar productos de origen esteroidal, tales como eCG o PMSG (gonadotropina coriónica equina) que contiene FSH (Hormona folículo estimulante). La dosis es de 400 UI por vía parenteral y 96 horas después se aplican 200 UI (misma vía) de hcG (gonadotropina coriónica humana que contiene LH (hormona luteinizante) . La presentación del estro ocurrirá de 40 a 42 horas después del tratamiento (Ángeles, 1999). Otro protocolo mediante el uso de gonadotropinas, se realiza mediante la aplicación de 1250 Unidades Internacionales (UI) de gonadotropina coriónica equina (eCG) (Folligon®; Novormon®) 24h después del destete. Posteriormente, a las 72 horas de aplicación de esa primera inyección se administran 750UI de Gonadotropina Coriónica Humana (hCG). A partir de los dos días después de la inyección con eCG se procede a detectar el celo. (Martínez y cols. 2002) CAPITULO 3. PROGRAMAS DE INSEMINACION ARTIFICIAL A TIEMPO FIJO Lección 11. Aspectos generales. El entorno actual en el que se desarrolla la ganadería, con la globalización de los mercados y el alto grado de competitividad, exigen al productor el mejoramiento en sus condiciones de productividad y eficiencia. Asimismo, la declaración de país libre de aftosa, da lugar a la apertura de nuevos mercados y por consiguiente es necesaria la búsqueda de alternativas para mejorar e incrementar la rentabilidad de las explotaciones. De acuerdo a lo señalado por Cutaia (2006), la optimización de la eficiencia reproductiva es uno de los principales factores que contribuyen para mejorar las ganancias. A pesar de haber consenso general entre los productores y técnicos de que la Inseminación Artificial (IA) es la técnica más apropiada para acelerar el avance genético, el porcentaje de las explotaciones bovinas incluidas en estos esquemas en el mundo continúa siendo bajo. Las principales limitaciones para el empleo de la IA en el ganado manejado en condiciones extensivas son fallas en la detección de celos, anestro posparto y pubertad tardía. Ventajas de la IATF LA IATF presenta muchas ventajas entre las cuales se resaltan (Ben, Goitia y Mujica, 2006): Una concentración del trabajo reproductivo y mayor aprovechamiento del personal de manejo en otras labores. Manejo de lotes homogéneos al mercado. Proyección y programación de partos. Permite la utilización de toros de alta genética Permite la disminución del número de reproductores a tener en la ganadería. Evita las labores de detección de celo y las perdidas consecuentes por la falla en la detección del mismo. Disminución del pisoteo de los potreros y del movimiento de los lotes. Lección 12. Protocolo de sincronización de celo mediante el uso de GnRH (protocolo Ovsynch). Uno de los protocolos de sincronización e IATF de mayor uso a nivel mundial es el Ovsynch, el cuál se basa en la utilización de GnRH. Tabla 1. Protocolo Ovsynch DIA 0 Aplicación GnRH DIA 7 Aplicar 1 dosis de PGF2∞ DIA 9 Aplicación GnRH DIA 10 IATF (16 a 24 horas de la segunda aplicación de GnRH retirado el dispositivo) GnRH: Hormona liberadora de gonadotropinas La primera dosis de GnRH se da para inducir la ovulación y promover la formación de un nuevo cuerpo lúteo (CL) y una nueva onda folicular, es decir, lo que se hace es devolver a la vaca al comienzo de un nuevo ciclo estral. La prostaglandina suministrada el día 7, causa la luteolisis o regresión de ese CL, y la GnRH suministrada la día 9, induce la ovulación del nuevo folículo. La inseminación se lleva a cabo alas 16 o 24 horas posteriores a la última dosis de GnRH (López, 2007). El protocolo “Ovsynch” ha sido más eficaz en vacas lecheras en lactancia que en novillas, siendo aún desconocida la causa de estas diferencias pero la ovulación en respuesta a la primera aplicación de GnRH ocurrió en el 85% de las vacas y en solo el 54% de las vaquillas (Pursley et al., 1995, citado por Huanca, 2001). Sin embargo, este protocolo de sincronización ha sido ampliamente usado en diversos establecimientos ganaderos de EEUU y de América latina. Fuente: http://www.abspecplan.com.br/upload/imagens/06-02-2007_iatf_figura01.jpg Fig. 6. Protocolo Ovsynch Con el protocolo Ovsynch, la mayoría de los animales no muestran celo durante el tratamiento. Lección 13. Variantes del protocolo ovsynch Se han realizado diversos estudios para evaluar las tasas de preñez, mediante la modificación del tiempo en que se realiza la IATF, uno de estos es el denominado protocolo “Cosynch”, en el cual la IATF se realiza al tiempo que se aplica la segunda dosis de GnRH al día 9. Sin embargo, las tasas de preñez obtenidas mediante este protocolo han sido menores, que las obtenidas con el protocolo “Ovsynch”. Tabla 2. Protocolo Cosynch DIA 0 Aplicación GnRH DIA 7 Aplicar 1 dosis de PGF2∞ DIA 9 Aplicación GnRH e IATF Asimismo se ha evaluado, otra variante del Cosynch, con la aplicación de la inseminación y la segunda dosis de GnRH 72 horas después de la aplicación de la Prostaglandina. El objetivo es dar lugar a un día mas para el desarrollo del folículo y dar lugar a una mayor maduración del ovocito y la ovulación de un folículo mas grande. Sin embargo se debe estar en observación de los animales que entren en celo durante el protocolo para proceder a inseminarlos. Tabla 3. Protocolo Cosynch 72 horas DIA 0 Aplicación GnRH DIA 7 Aplicar 1 dosis de PGF2∞ DIA 10 Aplicación GnRH e IATF (72 horas después de la PGF2∞ Fuente: http://www.abspecplan.com.br/upload/imagens/06-02-2007_iatf_figura04.jpg Fig. 7. Protocolo Cosynch Lección 14. Protocolo de sincronización de celo, mediante el uso de dispositivos intravaginales. Existe en el mercado una gran variedad de dispositivos intravaginales, los cuales varían en forma, concentración de progesterona, y numero de usos. Algunos son: DIV-B®, TRIUB®, CIDR®, PRID®. Asimismo se han experimentado múltiples portocolos, sin embargo, datos reportados en la bibliografía indican son dos los protocolos que han arrojado mejores resultados a la IATF en vacas en lactancia (Veneranda et al., 2006, citado por Cutaia, 2006). Tabla 4. Protocolo para novillas. DIA 0 Dispositivo + 2mg de BE + 1 dosis de PGF2∞ DIA 8 Retirar dispositivo + 1 dosis de PGF2∞ DIA 9 1 mg de BE DIA 10 IATF (52 a 56 horas de retirado el dispositivo) DIA 28 Inicio de la detección de celos e I.A DIA 38 Fin de la detección de celos DIA 42 Diagnóstico de preñez a las que no retornaron al celo (reinicio del tratamiento a las que quedaron vacías) BE: Benzoato de estradiol Resultados Esperados: Porcentaje de preñez esperado a la IATF: 50 a 60 % Porcentaje de retorno/vacías: 60% Porcentaje de concepción 2da IA: 50% Porcentaje de Preñez General (2 ciclos): 70 a 80 % Días destinados a la detección de celos: 10 Tabla 5. Protocolos para vacas en lactancia. DIA 0 Dispositivo + 2mg de BE DIA 8 Retirar dispositivo + 1 dosis de PGF2∞ + 400 UI eCG DIA 9 1 mg de BE DIA 10 IATF (58 a 62 horas de retirado el dispositivo) DIA 28 Inicio de la detección de celos e IA DIA 38 Fin de la detección de celos DIA 42 Diagnóstico de preñez a las que no retornaron al celo (reinicio del tratamiento a las que quedaron vacías) BE: Benzoato de estradiol eCG: Gonadotropina coriónica equina. Resultados Esperados: Porcentaje de preñez esperado a la IATF: 35 a 45 % Porcentaje de retorno/vacías: 40% Porcentaje de concepción 2da IA: 40% Porcentaje de Preñez General (2 ciclos): 45 a 55 % Días destinados a las detección de celos: 10 Otro protocolo experimentado hace uso de la GnRH. Tabla 6. Dispositivo intravaginal + GnRH. DIA 0 Dispositivo + 2mg de BE DIA 7 Retirar dispositivo + 1 dosis de PGF2∞ DIA 9 Aplicar GnRH y 12 horas después I.A DIA 27 Inicio de la detección de celos e IA DIA 37 Fin de la detección de celos DIA 41 Diagnóstico de preñez a las que no retornaron al celo (reinicio del tratamiento a las que quedaron vacías) GnRH: Hormona liberadora de Gonadotropinas Resultados Esperados: Porcentaje de preñez esperado a la IATF: 30 a 40 % Porcentaje de retorno/vacías: 40% Porcentaje de concepción 2da IA: 40% Porcentaje de Preñez General (2 ciclos): 40 a 50 % Días destinados a las detección de celos: 10 Protocolos de sincronización de celo para IATF y resincronización de los retornos al celo. Tabla 7. Protocolos de sincronización de celo para IATF y resincronización Novillas DIA 0 Dispositivo + 2mg de BE + 1 dosis de PGF2∞ DIA 7 Retirar dispositivo + 1 dosis de PGF2∞ DIA 9 Aplicar 1 mg de BE DIA 10 IATF (52 a 56 horas de retirado el dispositivo) DIA 23 Reinserción del Dispositivo DIA 30 Retirar dispositivo DIA 31 Inicio de la detección de celos e IA DIA 35 Fin de la detección de celos DIA 42 Diagnóstico de preñez a las que no retornaron al celo (reinicio del tratamiento a las que quedaron vacías) BE: Benzoato de estradiol Resultados Esperados: Porcentaje de preñez esperado a la IATF: 50 a 60 % Porcentaje de retorno/vacías: 80% Porcentaje de concepción 2da IA: 50% Porcentaje de Preñez General (2 ciclos): 75 a 85 % Días destinados a las detección de celos: 5 Tabla 8. Protocolos de sincronización de celo para IATF y resincronización Vacas en lactancia. DIA 0 Dispositivo + 2mg de BE DIA 7 Retirar dispositivo + 1 dosis de PGF2∞ + 400 UI eCG DIA 9 Aplicar 1 mg de BE DIA 10 IATF (58 a 62 horas de retirado el dispositivo) DIA 23 Reinserción del Dispositivo + 1 mg de BE DIA 30 Retirar dispositivo DIA 31 Inicio de la detección de celos e IA DIA 35 Fin de la detección de celos DIA 42 Diagnóstico de preñez a las que no retornaron al celo (reinicio del tratamiento a las que quedaron vacías) BE: Benzoato de estradiol eCG: Gonadotropina coriónica equina. Resultados Esperados: Porcentaje de preñez esperado a la IATF: 35 a 45 % Porcentaje de retorno/vacías: 50% Porcentaje de concepción 2da IA: 40% Porcentaje de Preñez General (2 ciclos): 50 a 55 % Días destinados a la detección de celos: 5 Lección 15. Protocolos de sincronización de celo para IATF y resincronización de los retornos al celo para una segunda IATF. Tabla 9. Protocolos de sincronización de celo para IATF y resincronización de los retornos al celo para una segunda IATF Novillas DIA 0 Dispositivo + 2mg de BE + 1 dosis de PGF2∞ DIA 8 Retirar dispositivo + 1 dosis de PGF2∞ DIA 9 Aplicar 1 mg de BE DIA 10 IATF (52 a 56 horas de retirado el dispositivo) DIA 26 Reinserción del Dispositivo DIA 31 GnRH DIA 38 Diagnóstico de preñez por Ultrasonografía + 1 dosis de PGF2∞ a las novillas vacías DIA 40 GnRH + IATF (12 horas después de la GnRH) BE: Benzoato de estradiol GnRH: Hormona liberadora de gonadotropinas Resultados Esperados: Porcentaje de preñez esperado a la IATF: 50 a 60 % Porcentaje de retorno/vacías: 100% Porcentaje de preñex 2da IATF: 50% Porcentaje de Preñez General (2 ciclos): 75 a 85 % Días destinados a las detección de celos: 0 Tabla 10. Protocolos de sincronización de celo para IATF y resincronización de los retornos al celo para una segunda IATF Vacas en lactancia. DIA 0 Dispositivo + 2mg de BE DIA 8 Retirar dispositivo + 1 dosis de PGF2∞ + 400 UI eCG DIA 9 Aplicar 1 mg de BE DIA 10 IATF (58 a 62 horas de retirado el dispositivo) DIA 26 Reinserción del Dispositivo DIA 31 Aplicación de GnRH DIA 38 Inicio de la detección de celos e IA DIA 40 Diagnóstico de preñez por Ultrasonografía + 1 dosis de PGF2∞ a las novillas vacías DIA 42 GnRH + IATF (12 horas después de la GnRH) BE: Benzoato de estradiol GnRH: Hormona liberadora de gonadotropinas eCG: Gonadotropina coriónica equina. Resultados Esperados: Porcentaje de preñez esperado a la IATF: 35 a 45 % Porcentaje de retorno/vacías: 100% Porcentaje de concepción 2da IA: 40% Porcentaje de Preñez General (2 ciclos): 65 a 65 % Días destinados a las detección de celos: 0 Por último, es importante señalar que la sincronización de celo en ganado bos indicus, muestra resultados muy variables, tal como lo reporta Salgado, González y Simanca (2007), según los cuales los porcentajes de preñez mediante IATF pueden variar desde 31,4% hasta 62%. Lo anterior, debido a la intervención de múltiples variables (Técnica, operario, animales, etc) que pueden afectar el resultado final del programa de sincronización. UNIDAD 2. INSEMINACION ARTIFICIAL Y TRANSFERENCIA DE EMBRIONES OBJETIVOS • • • Identificar el proceso de colecta y evaluación del semen. Conocer y aplicar el proceso de inseminación artificial en las principales especies domésticas. Comprender las técnicas, los procesos, las ventajas, las desventajas, los elementos y los procesos de la transferencia de embriones. ESTRUCTURA CAPITULO 1. COLECTA Y EVALUACION DE SEMEN. Lección 16. Aspectos generales. Lección 17. Evaluación de la libido. Lección 18. Colecta y evaluación de semen. Lección 19. Colecta y evaluación de semen bovino y ovino. Lección 20. Colecta y evaluación de semen porcino. CAPITULO 2. INSEMINACION ARTIFICIAL. Lección 21. Historia de la inseminación artificial Lección 22. Técnica de Inseminación artificial. Lección 23. Técnica de Inseminación artificial en equinos. Lección 24. Técnica de Inseminación artificial en ovinos. Lección 25. Técnica de Inseminación artificial en porcinos. CAPITULO 3. TRANSFERENCIA DE EMBRIONES Lección 26. Aspectos generales Lección 27. Selección y manejo de donantes y receptoras. Lección 28. Técnica de transferencia de embriones. Lección 29. Criopreservación de embriones. Lección 30. Transferencia de embriones en equinos. UNIDAD 2. INSEMINACION ARTIFICIAL Y TRANSFERENCIA DE EMBRIONES CAPITULO 1. COLECTA Y EVALUACION DE SEMEN. Lección 16. Aspectos generales. Los programas de inseminación artificial fundamentan su técnica en la transferencia de semen (fresco, congelado o refrigerado) al tracto reproductivo de la hembra. En tal sentido, se requiere de una adecuado proceso de colecta y evaluación de la calidad del semen, con el fin de garantizar que el mismo pueda lograr la fertilización del ovulo de la hembra. Todo programa de colecta de semen, requiere la evaluación del reproductor (evaluación Andrológica), con el fin de descartar problema de tipo sanitario y reproductivo que puedan disminuir o afectar el éxito del programa reproductivo. La evaluación andrológica involucra tres pasos fundamentales: la evaluación física (conformación general, órganos sexuales internos y externos), la evaluación de la libido, y la colecta y evaluación de semen. Evaluación física El examen físico incluye la observación del toro en movimiento, la conformación de las patas y la condición corporal general. Una vez que el toro es confinado, la evaluación física continúa con una observación general y un examen de los órganos sexuales internos y externos de los ojos. Durante la época reproductiva, los machos tendrán que caminar mucho (especialmente los toros cebuinos manejados en explotación extensiva), por lo que la sanidad de las patas y manos es esencial para una monta exitosa o para un proceso de colecta adecuado. (Larson, 2007). Ojos. Los ojos son otro factor importante en el proceso de evaluación, ya que el macho, especialmente el toro, se guía por el estimulo visual para identificar las hembras en celo. Saco escrotal y cordón espermático. Se debe observar la forma e integridad del escroto, su suavidad al tacto, verificar la presencia de cicatrices que evidencien traumatismos o daños severos causados por garrapatas o gusaneras. El cordón espermático se debe palpar en toda su longitud, no debe ser muy corto de manera que acerque los testículos al abdomen ni tan largo y colgante que los predisponga a constantes traumatismos. Lo recomendable es que el fondo del escroto no sobrepase la línea de los corvejones (Vilanova y Ballalares, 2005). Testículos y epidídimos. Se exploran mediante palpación minuciosa. Los testículos deben mostrarse lisos y firmes al tacto, no presentar focos de endurecimiento ni reblandecimiento, y su exploración no debería causar molestias al animal. Se debe comprobar su capacidad de desplazarse hacia arriba y abajo dentro del saco escrotal, lo cual descarta adherencias y demuestra una buena regulación de la temperatura testicular. Este aspecto es muy importante ya que testículos sometidos durante ciertos períodos a temperaturas elevadas como resultado de infecciones crónicas febriles podrían desarrollar un cuadro de degeneración testicular, lo cual podría ser motivo de descarte del macho. Con relación a los epidídimos, se deben verificar y examinar cuidadosamente sus tres porciones (cabeza, cuerpo y cola), las cuales deberán presentar una consistencia firme y homogénea. Debe descartarse la presencia de calor, dolor, aumentos de volumen, adherencias, etc (Vilanova y Ballalares, 2005). Medidas testiculares. Están representadas por el perímetro escrotal o circunferencia escrotal y la altura testicular. Ambas medidas representan un elemento muy importante a la hora de seleccionar un toro, ya que el tamaño de los testículos ha sido asociado positivamente con la producción de espermatozoides. El tamaño testicular medido a través de la circunferencia escrotal se constituye en el principal elemento para la selección de los toros. El tamaño de los testículos se correlaciona positivamente con la producción espermática e influye en la maduración sexual más temprana de sus hijos (machos y hembras), lo que determina que sea el factor de mayor importancia en evaluación y selección de reproductores. En este sentido, las hembras hijas de machos con un mayor tamaño testicular, alcanzarán más temprano la pubertad, tendrán un parto con una edad menor y por ende llegaran más temprano a la producción. la bolsa escrotal debe observarse para identificar que no haya lesiones o traumatismos. Pene y prepucio. El pene se explora por palpación bajo la piel del abdomen, desde la inserción del escroto y en dirección al ombligo, siendo muy importante observarlo directamente en el momento de la erección o cuando se exterioriza para la colección de semen. Se debe observar la conformación del prepucio, lo ideal es que o esté muy penduloso, ya que puede lesionarse y causar problemas de infección o inflamación que pueden causar el cierre del orifico prepucial causando irritación por acumulación de la orina. Posteriormente debe realizarse un examen de los órganos sexuales internos, mediante palpación rectal. Mediante este examen es posible identificar anormalidades en las estructuras internas palpables (uretra pelviana, próstata, vesículas seminales). En estos órganos deberá descartarse la presencia de focos de endurecimiento o reblandecimiento, así como calor o aumentos de tamaño dolorosos o no a la palpación (Vilanova y Ballalares, 2005). Cuando existen problemas infecciosos (actinomyces, brucelosis, entre otras) a nivel reproductivo, casi siempre se produce inflamación de las vesículas seminales (vesiculitis). Es necesario identificar este tipo anormalidades y en caso de confirmarse con un examen de laboratorio debe tratarse medicamente o eliminarse estos animales. Fuente: Boletín informativo del Serida N° 2 Fig. 8. Órganos internos del aparato reproductor masculino. Asimismo se debe realizar la toma de muestras para el envío al laboratorio, con el fin de descartar enfermedades que puedan afectar la reproducción, tales como: leucosis, brucelosis, Diarrea viral bovina, Rinotraqueitis infecciosa bovina, tricomoniasis, leptospirosis, neospora, etc. Para esto se toma una muestra de sangre en un tubo sin anticoagulante, y se hace un lavado prepucial (tricomoniasis, vibriosis), estas muestras deben ser enviadas al laboratorio antes de 8 horas para evitar el daño de las mismas y falla en el diagnóstico. Lección 17. Evaluación de la libido La evaluación de la libido se realiza en animales que van a servir como reproductores para monta directa. Es necesario con el fin de evaluar sin el macho va a servir para montar a las hembras en celo. Fuente: http://www.serbiotec.com.ar/images/Celo.JPG Fig. 9. La libido representa el impulso sexual del macho. La libido ó impulso sexual, es una característica de comportamiento que se puede medir. Las pruebas se basan generalmente en la explotación de varias ó más de los siguientes hallazgos (Chenowet, 2003): 1. La libido en toros tiene un gran componente genético. 2. Los toros son polígamos y tienden a distribuir sus servicios entre hembras receptivas. 3. El más grande estímulo único para que un toro trate de montar y servir es el tren posterior inmóvil de una hembra, ó algo que el perciba como similar. 4. La preestimulación de los toros incrementa su respuesta sexual. 5. La competencia entre toros puede incrementar su respuesta sexual. La prueba reportada por Chenowet (2003), está conformada por los siguientes pasos: En un corral dos hembras se sujeta un grupo con hembras atadas, que no se encuentren en celo. La proporción toro: vaca es de 5:2 ó 5:3. Se dejan en el corral por por 40 a 60 minutos. Se califica con base en los servicios realizados durante el período de observación. De acuerdo a lo observado en la prueba, los toros son clasificados en cuatro grupos: Grupo 1: Toros que sirven satisfactoriamente Grupo 2: Toros que hicieron intentos de monta pero no culminaron en servicio, debido a inexperiencia, falta de técnica de apareamiento o factores patológicos. Grupo 3: Toros que montaron pero que no llegaron al servicio debido a falta de cooperación de la hembra. Puede reflejar factores tales como inexperiencia baja libido o uso de una hembra inadecuada. Grupo 4: Toros en los que no existe registro de habilidad de monta debido a falta de suficiente actividad para hacer una estimación. Lección 18. Colecta y evaluación de semen Colecta de semen. La tercera fase en el proceso de evaluación andrológica es la colecta y la evaluación del semen, una vez finalizada la exploración genital se procede a la recolección de semen, la cual puede hacerse por medio de una vagina artificial o por electroeyaculación. La vagina artificial es el método de preferencia, aunque para usarla es necesario que el toro haya sido entrenado previamente, este es un método fisiológico ya que imita el proceso de la monta natural. Se debe contar con vaginas artificiales en muy buen estado de higiene y conservación, lo cual garantiza por una parte la calidad de la muestra recogida, y por la otra, que el toro no rechace este método. En equinos, este es el único método de colecta disponible. En ovinos, caprinos y bovinos es muy común el uso de este método de colecta. El otro método es a través del electroeyaculador, el cual es un aparato que consta de un electrodo de uso transrectal (llamado bala) conectado a una batería que genera pequeños pulsos eléctricos, los cuales estimulan los órganos genitales internos produciendo la emisión del semen. Antes de aplicar la electroeyaculación se deben eliminar las heces presentes en el recto y seguidamente introducir el electrodo debidamente lubricado. Las descargas eléctricas deben ser aplicadas rítmicamente cada 3 a 5 segundos, seguidas de un reposo de otros 3 a 5 segundos. Debe tenerse presente que la respuesta de cada animal a la electroeyaculación es muy particular, la cual se observa en el tiempo de estimulación y en la cantidad de pulsos eléctricos necesarios para recolectar el semen (Vilanova y Ballalares, 2005). Evaluación del semen. Una vez se ha colectado el semen se procede a realizar el análisis en laboratorio, en el mismo se evalúan algunas características macroscópicas y microscópicas. Características macroscópicas Olor: No debe tener mal olor, si lo hubiese puede ser indicativo de algún tipo de infección. Color: Varía de acuerdo a la concentración espermática: puede ir desde un líquido blanquecino claro, hasta un líquido lechoso oscuro. Volumen: Varía de acuerdo a la especie, en los bovinos puede obtenerse de 2 a 12 ml por eyaculado, en los porcinos, hasta 350 ml, en Características microscópicas Motilidad: masal e individual Morfología Concentración Motilidad: La motilidad es uno de los parámetros más importantes de la analítica seminal. Hasta hace pocos años el estudio de la motilidad espermática se hacía exclusivamente mediante métodos semicuantitativos. Estos métodos evalúan el porcentaje de espermatozoides móviles, así como el tipo de movimiento que presentaba la media de una población espermática. (Hidalgo, Tamargo y Diez, 2006). La motilidad masal se observa colocando una pequeña gota de semen sobre una placa portaobjetos a temperatura de 37°C y observándola en el microscopio en aumento de 10X o 40X, allí se observa la formación de “olas”. Esta motilidad está directamente relacionada con la concentración espermática, así a mayor cantidad de espermatozoides, se formara una mayor cantidad de olas. Se expresa en una escala de calificación de 1 a 5. La motilidad individual se determina colocando una pequeña gota de semen sobre una placa portaobjetos y sobre ella se coloca una placa cubreobjetos, y observándola en el microscopio, en aumento de 40X. La motilidad individual mide el porcentaje de espermatozoides que presentan un movimiento rectilíneo y continuo. El valor se expresa en porcentaje, el valor mínimo aceptado es de 50%. Hoy en día también existen sistemas automáticos de medición de imágenes, los cuales se basan en la captura sucesiva de espermatozoides en movimiento provenientes de un microscopio. Estas imágenes se digitalizan identificando las células espermáticas que contienen la primera imagen. Luego se procede al seguimiento de estas células en imágenes sucesivas y al establecimiento de trayectorias definitivas. Las trayectorias se procesan matemáticamente, obteniendo así resultados numéricos precisos (Hidalgo, Tamargo y Diez, 2006). Morfología y viabilidad: El análisis morfológico de los espermatozoides es uno de los principales componentes de la evaluación de las características de una muestra seminal. La valoración de la morfología del espermatozoide se basa en la relación directa que haya entre la proporción de espermatozoides anormales en el eyaculado, el tipo de defecto morfológico y su relación con la fertilidad in vivo de los machos (Hidalgo, Tamargo y Diez, 2006). La evaluación se realiza a través de una tinción con eosina-nigrosina o con tinta china. Fuente: http://www.ansc.purdue.edu/swine/porkpage/repro/sp200204.jpg Fig. 10. La evaluación morfológica del semen. En la evaluación morfológica es necesario determinar la cantidad y el tipo de anormalidades, se aceptan máximo un 30% de anormalidades. Fuente: http://www.ivf.com/images/mb61.gif Fig. 11. Anormalidades espermáticas. Concentración: Existe una alta correlación significativa entre el número de espermatozoides inseminados y la fertilidad del toro. La presencia de un mayor número de espermatozoides, siempre y cuando sus características sean normales, incrementa la posibilidad de fertilización. Existe una variabilidad muy grande en la concentración de un eyaculado a otro, y de un toro a otro, siendo importante conocer el número de espermatozoides por eyaculado, ya que de este parámetro depende el número de hembras a inseminar (Hidalgo, Tamargo y Diez, 2006). La concentración puede medirse por varios métodos: la espectrofotometría, la colorimetría, la citometría de flujo y el uso de cámara de recuento celular, como las de Bürker, Neubauer o Thoma. En nuestro país el método mas utilizado es el de la cámara de Neubauer. Fuente: www.thepigsite.com/.../09-03SwineConf5.jpg Fig. 12. Medición de la concentración espermática. Fuente: www.digilablaboratorio.com.br/.../neubauer2.jpg Fig. 13. Hemotocitómetro o cámara de Neubauer Lección 19. Colecta y evaluación del semen bovino y ovino Colecta de semen por vagina artificial La vagina artificial es una imitación de la vagina de la vaca y de la oveja, que proporciona el estimulo térmico y mecánico para la erección del pene del macho y que son, igualmente, necesarios para producir la eyaculación. La vagina artificial consiste de una caperuza externa (de 50 cm x 5,5 cm para el toro, de 20 x 5,5 cm. para el carnero y 15 x 5,5 cm. para el macho cabrío) fabricada con goma fuerte, plástico u otro material sintético que tenga propiedades aislantes, y un conducto interno fabricado de goma o material sintético apropiado. Después de cada uso se debe lavar, enjuagar con agua destilada y secarla profundamente; si se pasa, por el interior, una delgada película de alcohol al 70% en agua destilada, se secará, luego, mejor. A continuación se llena la mitad del depósito con agua a 48-50°, a través del tampón colocado en el lateral y con la ayuda de un embudo o jeringa de 100 ml (el calor del agua contribuirá a evaporar el alcohol). Si se llena demasiado de agua, se saldrá, cuando se deje la vagina en posición vertical. Se debe evitar que el agua penetre en el tubo interno ya que puede ser la causa de mortalidad de los espermatozoides. La temperatura de la vagina artificial, deberá ser de 42-45 °C, lo que se puede controlar mediante la inserción de un termómetro limpio. Si la vagina se encuentra demasiado fría, se debe rellenar con agua más caliente con el fin de evitar el shock por frio. Fuente: http://www.agrovetmarket.com/Library/Images/sawdc.jpg Fig. 14. Colecta de semen de carnero. Antes de la recogida de semen, se debe limpiar, cuidadosamente, el prepucio del macho, para evitar cualquier contaminación de aquel, en los bovinos se realiza un lavado prepucial con solución salina. En los ovinos y caprinos, los movimientos vigorosos hacia arriba y hacia delante significan que se ha producido la eyaculación. Se debe dejar que el macho retire el péne de la vagina antes de intentar retirar esta (Bearden y Fuquay, 1982; Salamón, 1990). En el bovino, se produce el denominado “golpe de riñón”, el cual es indicativo de que la eyaculación se produjo. Colecta de semen por electroeyaculador (estimulador eléctrico) Existen diferentes tipos de electroeyaculadores, El aparato más comúnmente utilizado en nuestro país es el “electrojac”. Se trata de un estimulador accionado por baterías que proporciona una salida de 10 ó 15 voltios. Para la colección de semen, el macho ovino y caprino se debe colocar en decúbito lateral, sobre una mesa o en el suelo, siempre que este limpio. Se deben cortar el pelo o lana que bordee la vaina y el prepucio se debe limpiar correctamente. La sonda se humedece o lubrica con vaselina y se inserta en el recto a una profundidad de 1520 cm. procurando no lesionar la mucosa (Bearden y Fuquay, 1982; Salamón, 1990; Mejia y Hernández, 1996). En los bovinos, el macho debe inmovilizarse en un brete y se debe realizar el lavado prepucial, la zona o bala se introduce vía rectal. En ovinos y caprinos el pene se debe extender por enderezamiento de la flexura sigmoidea de tal forma que el glande del péne se pueda sujetar con la mano, limpia, y liberar el péne del prepucio. Por detrás del glande se coloca una pieza de gasa y se introduce el glande y el proceso uretral en un tubo de ensayo estéril. Lo mejor es sujetar el péne y el tubo de ensayo con la misma mano dejando la otra libre para dar masaje en el péne en dirección hacia delante entre para cada estimulo eléctrico (Bearden y Fuquay, 1982; Salamón, 1990; Mejia y Hernández, 1996). Un ayudante debe presionar sobre la sonda hacia el suelo de la pelvis, aplicándose luego cortos estímulos (3-8 segundos) a intervalos de 15-20 segundos. Después de unos cuantos estímulos fluirá la secreción de las glándulas accesorias y luego el semen. Cuando se obtenga inicialmente grandes cantidades de liquido claro, se deben desechar para evitar diluciones innecesarias del semen (Bearden y Fuquay, 1982; Salamón, 1990; Mejia y Hernández, 1996). Lección 20. Colecta y evaluación del semen porcino. Se debe contar con una área de 9 a 15 metros cuadrados para la extracción del semen, este lugar debe estar alejado de las instalaciones de alojamiento de los otros animales, se debe evitar los factores de distracción para el animal. Asimismo debe existir una superficie no deslizante para evitar golpes y fracturas de los reproductores (IMV (2000). Se debe utilizar el potro de monta, lo suficientemente robusto para soportar el peso del animal. Este puede untarse con secreciones vaginales de la hembra con el fin de estimular la monta. Una vez el macho realiza la monta se debe tomar el pene y sostenerlo de una manera firme y con presión, sin llegar a causar lesiones en el mismo. Para esto el operario debe utilizar guantes de vinilo o plástico, y no utilizar guantes de caucho o látex, porque estos tienen efecto espermicida. Fuente: http://cdn.wn.com/o25/ph//2009/05/01/ddb84ae6fac97f10ed67095f347727e6-grande.jpg Fig. 15. Colecta de semen del verraco. La recogida del semen se debe hacer en un termo o recipiente con filtro, para evitar la mezcla del material seminal con la fracción postespermática. Una vez acaba la extracción, el material debe ser enviado al laboratorio para su evaluación. La criopreservación de semen porcino no es una técnica nueva; sin embargo, esta tecnología reproductiva no se ha desarrollado lo suficiente como para estar disponible a nivel comercial como en la ganadería bovina. Esto ha sido causado por diversos factores entre los cuales se encuentran: escasos rendimientos reproductivos, elevada variabilidad entre verracos en la respuesta a la congelación, y alta concentración espermática en las dosis de inseminación (Martín, 2000, citado por Roa et al, 2005). El proceso de criopreservación y descongelación del semen se ha adoptado una tecnología que presenta pocas modificaciones, por lo que varios investigadores (Fuentes, 2000; Pacheco, 2001 y Echegaray, 2003, citados por Roa et al, 2005), aseguran que la base de los protocolos actuales de congelación siguen siendo las siguientes: Proceso de criopreservación. Colecta de semen, tomando la fracción rica del eyaculado y mezclando con diluyente a 32º C. Evaluación de la calidad y concentración seminal (a partir de esta cifra, las dosis que se pueden obtener del eyaculado y cantidad de diluyente de congelación a emplear). Equilibrio previo a la centrifugación (23º C y 15º C). Centrifugación a 800 revoluciones por 10 minutos en centrifuga refrigerada a 15º C. Resuspensión y eliminación de plasma seminal. Adición de diluyente a 15º C para evitar shock térmico. Equilibrio térmico a 5º C (Durante un periodo de 3 horas). Adición de diluyente con 3% de glicerol. Envasado. Congelación. Almacenamiento en nitrógeno líquido a - 196º C. Proceso de Descongelación: Junto con el proceso de descongelación, es necesario restituir el volumen de las dosis antes de la inseminación, para lo cual se utiliza un diluyente capaz de proteger las células espermáticas de daños durante la descongelación y proveer de sustancias que aumenten la supervivencia, viabilidad y poder fecundante (Roa, 2005) CAPITULO 2. INSEMINACION ARTIFICIAL Lección 21. Historia de la inseminación artificial. Los primeros reportes no registrados de la inseminación artificial datan de los Árabes, de quienes se dice utilizaban la inseminación artificial desde aproximadamente el año 1300, a través de la inseminación de las yeguas con semen que robaban de garañones de tribus vecinas. Posteriormente, en Europa, se encuentra el primer reporte escrito, el fisiólogo italiano Lázaro Spallanzani, hacia el año de 1780 realizó el experimento de colectar semen de un perro y depositarlo en el tracto reproductor de la hembra, con lo cual obtuvo la preñez de la misma. En 1782, Rossi y un profesor llamado Branchi repitieron con éxito el experimento de Spallanzani (Hafez y Hafez, 2000). Hacia el año de 1900, en Rusia se empezaron a realizar experimentos de inseminación en animales domésticos. El Dr. Ivanoff inició sus experimentos en equinos, sin embargo, fue el primero en inseminar con éxito a los bovinos y a los ovinos. Asimismo, se realizaron trabajos de inseminación en yeguas en Japón hacia el año de 1913. En el año de 1936 en Dinamarca se formó la primera asociación cooperativa de inseminación artificial. La inseminación artificial en los porcinos tuvo su desarrollo en Rusia a comienzos del siglo XX, posteriormente entre los años 1956 y 1966 se difunde esta técnica, gracias al desarrollo del catéter en forma de espiral por Melrose y Cameron (Calle, et al, 2006). Sin embargo, es hasta la década de los 90 del siglo pasado que se difunde de manera comercial, gracias a la aparición de la evaluación seminal, dando lugar a la implementación comercial de esta biotecnología. Hoy en día la inseminación artificial es una práctica común sobre todo en los países industrializados, en donde su utilización puede alcanzar hasta el 95% en el ganado bovino y el 80% en los porcinos (Calle, et al, 2006). La I.A en Colombia se inició en el año de 1937 con los doctores José Velásquez y Milciades Martínez, quienes inseminaron perras con buenos resultados. Posteriormente, en el año de 1946 el Ministerio de Economía Nacional adelanto trabajos de inseminación artificial en la granja de la Picota y preparó el primer grupo de profesionales en esta disciplina. A partir de esta época se empezó a inseminar ganado en diferentes regiones del país. El promedio nacional de inseminación artificial es de un porcentaje del 4%, siendo las zonas de Antioquia, altiplano Cundíboyacense y Eje Cafetero las de mayor implementación de la técnica y los llanos orientales y costa atlántica las de menor utilización (Alvarado, 2008). Ventajas y desventajas de la inseminación artificial Ventajas: La inseminación artificial presenta diversas ventajas entre las cuales se encuentran: Rápido mejoramiento genético, mejorando los rendimientos al utilizar reproductores sementales de alto valor genético. Disminución del riesgo de transmisión de enfermedades infectocontagiosa por vía de transmisión sexual. Permite la utilización de machos de alta calidad genética que se encuentran en áreas geográficas lejanas (Utilización de semen de toros alemanes o franceses de alta genética, utilización de semen de garañones de las zonas de vocación equina, como por ejemplo, Antioquia y Cundinamarca). Disminución de los costos de manejo y operario por mantenimiento de los reproductores en la explotación y por la disminución de los mismos. Producción de lotes homogéneos al mercado. Permite prescindir de machos difíciles de manejar. Es útil para realizar test o pruebas de progenie en machos. Evita la introducción de machos de otras explotaciones los cuales pueden trasmitir enfermedades infectocontagiosas. Desventajas: Algunas de las desventajas que se menciona son: Se requiere de personal capacitado en las técnicas y los procedimientos a desarrollar en la inseminación artificial. Los costos iniciales pueden ser elevados, estos incluyen la adquisición del equipo de inseminación, el termo de mantenimiento del material seminal, las pajillas, el nitrógeno líquido, entre otros. Si el material seminal utilizado no fue colectado y evaluado, se puede correr el riesgo de transmitir enfermedades de tipo infectocontagioso. Es necesario establecer un programa para la detección del celo. Cuando la intensidad de la selección es muy alta pueden surgir problemas de consanguinidad. Lección 22. Técnica de inseminación artificial. Técnica de inseminación artificial en bovinos. La inseminación artificial solo será efectiva si el espermatozoide se encuentra en "el lugar adecuado en el momento oportuno". Es necesario que en el momento que ocurra la ovulación, existan espermatozoides disponibles para fertilizar el óvulo. El celo, tiene una duración promedio de 6 a 10 horas. La ovulación en la vaca ocurre aproximadamente entre 10 a 14 horas luego de la finalización de los signos del celo y el óvulo puede sobrevivir infértil por 6 a 12 horas. A diferencia del espermatozoide, el cual puede vivir hasta 24 horas en el aparato reproductivo de la vaca (Infocarne, 2005). Por lo anterior, lo ideal es que la inseminación se realice entre las 8 y 12 horas después del inicio del celo. Fuente: http://www.infocarne.com/bovino/inseminacion_artificial2.asp Fig. 16. Determinación del tiempo de monta o inseminación Una práctica común para el mejor momento de realizar la inseminación artificial es la regla de "mañana-tarde": En esta, las vacas observadas en celo en la mañana se inseminan la misma tarde, y vacas observadas en celo durante la tarde se inseminan la mañana siguiente. Este protocolo es muy utilizado en ganaderías bos taurus, sin embargo en ganadería bos indicus puede no funcionar con la misma eficiencia, explicado por el hecho de que en este tipo de ganado, los celos generalmente son más cortos, y por ende la viabilidad del ovocito disminuye mas rápidamente. Por lo general en este tipo de ganaderías se utilizan animales receladores (machos desviados, hembras androgenizadas, machos con vasectomía) para determinar el celo, y una vez la vaca deje de manifestar la sintomatología del celo, es inseminada. La técnica de inseminación más utilizada en la vaca es la rectovaginal, los pasos que involucra esta técnica son (CENIAP, 1999): Identificar el animal que está apto para la inseminación. Inmovilizar la vaca a un brete o manga. Revisar los registros del animal con el fin de identificar y seleccionar el materila seminal a utilizar. Ubicar el semen a utilizar. Preparar el termo de descongelación con agua potable a 35 a 37°C. Extraer la pajilla de semen congelado del termo y sumergirla en el agua del termo de descongelación inmediatamente (allí debe permanecer por un tiempo de 40 segundos). Extraer y secar cuidadosamente la pajilla con una toalla de papel desechable (se debe eliminar cualquier resto de humedad, porque el agua es espermicida). Fuente: http://park.org/Netherlands/pavilions/typical_dutch/cows/cattle/nrs/picture s/plaat4.gif Fig. 17. Selección de la pajilla. Preparar la pistola de inseminación, la misma se debe frotar con una toalla de papel (esto con el fin de que la misma, se encuentre a una temperatura similar a la del semen, es decir 37°, y con ello evitar el choque térmico y la consecuente mortalidad espermática). Asimismo se debe retirar el émbolo de la pistola hacia atrás (15 a 20 cm). Se debe cortar el extremo de la pajilla, e insertar la misma en la pistola (debe evitarse el corte que deje puntas en la pajilla, porque estas puede lacerar el aparato reproductor de la hembra). Puede utilizarse fundas plásticas protectoras para evitar la contaminación del semen, durante su paso por el tracto reproductor de la hembra. Proteger la pistoleta cargada, del sol y del medio ambiente, envolviendo el extremo con una toalla de papel desechable (evitar la mortalidad espermática). Colocarse un guante de plástico desechable sobre el brazo de palpar (comúnmente el izquierdo). Lubricar ligeramente el guante de plástico, con lubricante, agua o estiércol de la misma vaca. Introducir la mano enguantada vía rectal con los dedos en forma de cuña. Eliminar el exceso de estiércol para limpiar el recto sin sacar la mano del recto, ya que de lo contrario se llenaría de aire. Si esto ocurre tratar de formar un pliegue del recto (mucosa) y proceder a halarlo hacia el ano. Localizar el cérvix, limpiar la zona vulvar una o más toallas de papel desechable (secas). Sólo en caso necesario lavar con agua, ya que el agua tiene efecto espermicida. Separar los labios vulvares, presionando hacia abajo y hacia atrás con el antebrazo desde el recto. Introducir la punta de la pistoleta de inseminación a través de la vulva en ángulo de 45°, dirigiéndola hacía el techo de la vagina, evitando penetrar por error el divertículo suburetral o la uretra, ubicada en el piso del vestíbulo vulvo-vaginal. Deslizar la pistola horizontalmente hacia delante, siguiendo la dirección de la vagina. Con la mano que se fija el cervix empujar ésta hacia adelante para estirar y eliminar los pliegues de la mucosa vaginal hasta llegar a la cervix. Localizar el orificio posterior de la cervix, cerrar los dedos (pulgar, índice y medio) en forma de círculo por detrás de la cervix, sirviendo como embudo, ubicándose el orificio hacia el centro, evitando los fondos del saco ciego alrededor del orificio del cervix. Si el método descrito falla, asegurar la cervix con sus dedos índice, medio y anular, abajo sobre el piso de la cavidad (sobre el pubis) o hacia el lado derecho (ileon). Usar el dedo pulgar para ubicar el orificio, sentir con el dedo la punta de la pistoleta, retirar el dedo e introduzca la pistola en el cervix. Al penetrar el cervix, se puede retraer el brazo con el cervix hacia atrás y manipularlo. No mover la pistola y mantenerla fija con una ligera presión, aplicar movimientos suaves de rotación al cervix para vencer los anillos internos (3-5 anillos), los cuales pueden sentirse al paso de la pistola. El punto blanco del inseminador puede ser fácilmente ubicado, colocando la yema del dedo índice por delante de la cervix y en el orificio anterior, donde podrá sentirse la punta de la pistola, una vez pasados los distintos pliegues de la cervix. Este punto se localiza a un centímetro de la salida del cérvix, en el cuerpo del útero. Se deposita el semen en el punto blanco del inseminador, presionando lentamente el émbolo de la pistoleta, teniendo cuidado de no halarla. Si el animal se mueve, esperar hasta que se tranquilice y asegúrese que la pistoleta se encuentre en el blanco del inseminador antes de proseguir depositando el semen. Fuente: http://www.partners-in-reproduction.com/images/ai.jpg Fig. 18. Proceso de inseminación artificial. Retirar la pistola, mantener el cervix con la mano y retirar la pistola suavemente. Inspeccionar la pistola y asegurarse que la pajilla esté completamente vacía, que no tenga trazas de sangre, pus o suciedad y que la identificación de la pajilla corresponda al toro asignado para el servicio de la vaca. Anotar el servicio, asegurándose que la fecha, identificación de la vaca, el semen utilizado y cualquier otra observación queden correctamente anotadas. Lección 23. Técnica de inseminación artificial en equinos La técnica de inseminación artificial en equinos, debe contar con la participación de personal capacitado que determine el momento preciso en el cual se debe realizar la inseminación. Para esto se debe realizar el seguimiento ecográfico al desarrollo folicular con el fin de determinar el momento exacto para realizar la inseminación. Fuente: http://albeitar.portalveterinaria.com/noticia.asp?ref=728 Fig. 19. Seguimiento ecográfico de la ovulación. En la izquierda se puede observar el folículo, 24 horas antes de la ovulación, en el centro el folículo ovulando, y en la derecha 24 horas después de ocurrida la ovulación. Lo anterior es muy importante debido a que es muy difícil conseguir semen criopreservado de garañones, debido a la alta tasa de variabilidad en los resultados del proceso de criopreservación, razón por la cual, se utiliza el semen refrigerado la mayoría de veces. Este semen refrigerado puede sobrevivir hasta 72 horas, en el medio de dilución, por lo tanto es necesario conocer el momento exacto de la ovulación con el fin de hacer el respectivo pedido y garantizar la llegada del material seminal a la explotación. Cuando se decide realizar la inseminación artificial la yegua es sometida a un examen reproductivo previo con el fin de valorar la integridad anatómica y funcional de su aparato reproductor y descartar aquéllas que presenten alteraciones que reduzcan la fertilidad. En los programas de IA se deberá ser más estricto en este sentido, para así obtener todos los beneficios que conlleva la técnica. Así, se deben descartar las hembras con anomalías congénitas o adquiridas, como las que presenten alteraciones del útero (Rodríguez, 2009). Es conveniente, contar con instalaciones adecuadas que permitan el manejo adecuado y seguro de la yegua, para esto se debe contar con un brete de inmovilización que permita desarrollar el proceso de seguimiento ecográfico y de inseminación de la yegua. Una vez se ha determinado el momento óptimo para la inseminación (este dependerá del tipo de material seminal utilizado, con semen refrigerado se realiza normalmente por exploración rectal ecográfica del aparato reproductor para identificar en un ovario la presencia de un folículo preovulatorio (FP), de tal manera que si está en celo y/o tiene un FP se insemina por primera vez y se repite a las 24 horas hasta que termine el celo o se observe la ovulación. Si el material utilizado es semen congelado conviene que la dosis se deposite en el útero entre las 6-8 horas anteriores a la ovulación o las 6 posteriores a la misma) se deben realizar los siguientes pasos para la técnica de inseminación vaginal: Inmovilizar a la yegua, para evitar que se lesione durante el proceso de la I.A. Se debe limpiar la totalidad del área vulvar, para ello se puede utilizar toallas de papel humedecidas o agua y papel periódico. El inseminador toma una manga de plástico y se aplica lubricante estéril no espermicida, a lo largo del guante. Tomar el catéter o la pipeta de inseminación (generalmente se utilizan catéteres rígidos de plástico unidos a una jeringa o botella). Introducirlo vía vaginal en dirección al techo de la vagina, con el fin de evitar que se dirija al meato urinario y se contamine el material seminal. Con el dedo índice se guía el catéter hasta el cérvix. En la entrada del cérvix se introduce el dedo aproximadamente 0.5 a 1 cm, con el fin de guiar el recorrido del catéter, luego se introduce el catéter aproximadamente 5 a 10 centímetros mas hasta llegar al cuerpo del útero. Allí se debe depositar el semen mediante la presión de la botella del material seminal o la inserción con la jeringa. Fuente: http://inseminacionequina.com/images/tecnicadeinseminacion.jpg Fig. 20. Inseminación artificial en la yegua Actualmente existe otra técnica de inseminación, y es la variante intrauterina profunda, esta técnica permite incrementar los porcentajes de fertilidad y reducir la concentración de espermatozoides de la dosis. Esta variante de inseminación está más indicada cuando se emplea esperma congelado. En este caso se pueden emplear catéteres largos semirigidos de pequeño volumen o se puede usar un endoscopio flexible adaptado que permite “regar” la papila tubárica con la dosis (Rodríguez, 2009). Lección 24. Técnica de inseminación artificial en ovinos La inseminación de la oveja puede ser vaginal, cervical ó intrauterina. Estos métodos presentan variaciones e cuanto su complejidad y tasas de preñez. La oveja presenta un ciclo estral con una duración aproximada de 17 días y la ovulación ocurre aproximadamente de 24 a 27 horas después del inicio del celo (Mejia y Hernández, 1996, citado por Bedoya et al, 2005). Cuando se deba inseminar artificialmente, por vía vaginal o cervical, se obtendrán mejores resultados si la inseminación se hace lo más cercano a la ovulación, por lo cual se recomienda que el momento óptimo para inseminar ovejas es 12-18 horas después de la aparición del estro (Hafez y Hafez, 2000). Inseminación vaginal. La inseminación vaginal en los ovinos consiste en la deposición del semen en la vagina anterior sin ningún intento de localizar el cervix. Los pasos que involucra esta técnica son: Inmovilización de la oveja y limpieza del área vulvar, esto con el fin de evitar la contaminación de la vagina al introducir la pipeta de inseminación. La pistola, pipeta o jeringa con catéter, se debe cargar con la dosis de semen requerida, luego de dejar una cámara de aire de 0,2 ml en la jeringa. La cámara de aire sirve que para las dosis completas de semen sea depositada en la vagina durante la inseminación. La punta de la pistola o catéter se introduce en la vagina a lo largo de la pared superior facilitando su entrada por la apertura suave de la válvula con la mano libre. Se deposita el semen en la vagina. Inseminación cervical. En la inseminación cervical, la disposición del semen se realiza en el cervix hasta una profundidad de 3 cm. Los paso a seguir son los siguiente: Inmovilización de la oveja, limpieza del área vulvar. Se introduce un vaginoscopio hasta una profundidad de 10-13 cm. Una vez que el cervix es localizado, la pistola de inseminación se introduce hasta la mayor profundidad posible, sin forzarla. Antes de descargar el semen, se retirara un poco el vaginoscopio hacia atrás a fin de facilitar el cierre de la vagina anterior evitando que el semen se derrame. Posteriormente se retirara primero la pistola y luego el vaginoscopio. Es importante limpiar la vagina de contaminación o mucus antes de depositar el semen. Fuente: http://www.cuencarural.com/img/varias/img7373.jpg Fig. 21. Inseminación artificial en la oveja Inseminación intrauterina. Cuando se va a realizar la inseminación intrauterina por laparoscopia, se debe realizar un ayuno de 12 horas o más (generalmente por una noche). Esto reduce el contenido del rumen, y facilita la localización de los ovarios y los úteros, evitando además la regurgitación desde el rumen durante la laparoscopia. Los pasos a seguir son: La oveja se presenta al inseminador, con el tren posterior levantado y la camilla inclinada de un ángulo de 45 grados. En primer lugar se introduce en la cavidad peritoneal el trocar de 7 ml y cánula a la izquierda de la línea media. Se debe tener especial cuidado de no perforar ningún órgano ni vena principal. Antes de introducir el trocar y cánula a la derecha de la línea media, es conveniente insuflar aire dentro del abdomen. La cavidad abdominal puede examinarse con posterioridad retirando el trocar y reemplazándolo por el endoscopio. El útero se localiza justo delante de la vejiga. A través de la cánula de 5 ml. se introduce la pistola de inseminación, con una cámara de aire de 0,3 ml. y el volumen requerido de semen. Fuente: http://www.inta.gov.ar/actual/ant/2004/insemina_1g.jpg Fig. 21. Inseminación artificial laparoscópica en la oveja Fuente: http://www.ceniap.gov.ve/ceniaphoy3/articulos/n9/arti/vasquez_b/imagen/image014.jpg Fig. 22. Inseminación artificial laparoscópica en la oveja Lección 25. Técnica de inseminación artificial en porcinos. El ciclo del estro en cerdos promedia 21 días, pero puede estar entre 17 a 25 días. El primer día cuando la cerda es receptiva al macho y se queda parada para ser montada es lo que llamamos día 0. A los dos o tres días en que la hembra es sexualmente receptiva se le llama Celo. Aunque la ovulación (liberación de los óvulos de los folículos del ovario) ocurre generalmente de 23 a 48 horas después de la iniciación del estro, este acontecimiento es extremadamente variable. En realidad, una cerda puede ovular antes de que ocurra el estro. Por esta razón es que los productores suelen inseminar a las hembras más de una vez. Inseminación artificial tradicional. La inseminación artificial en los porcinos es una técnica relativamente fácil, en la misma se debe garantizar todas las medidas de higiene con el fin de evitar la contaminación del material seminal. Los pasos a seguir para realizar esta técnica son (Calle, et al, 2006): El inseminador debe ubicarse sobre el dorso de la hembra con el fin de hacer presión y realizar un masaje en el flanco, para imitar la acción del macho durante la cópula. Esto permite que la hembra aumente sus contracciones uterinas, y con ello mejora el transporte del semen. También es posible conseguir en el mercado, dispositivos “manos libres, los cuales se componen de dos mochilas laterales que ejercen la función de la presión en los flancos y el dorso, y cuentan con un dispositivo para el sostén de la botella o bolsa con el material seminal. Fuente: www.avparagon.com/.../anatomia_aplicada _inseminacion_artificial.pdf Fig. 23. Inseminación artificial en la cerda Se debe limpiar la totalidad del área vulvar, para ello se puede utilizar toallas de papel humedecidas o agua y papel periódico. Tomar el catéter o la pipeta de inseminación y aplicar lubricante no espermicida en el extremo, se debe tener cuidado de no obstruir el orificio del catéter con el lubricante. Fuente: www.avparagon.com/.../anatomia_aplicada_inseminacion_artificial.pdf Fig. 24. Lubricación del catéter. Se debe aplicar lubricante no espermicida en la punta del catéter. Introducir la pipeta o el catéter vía vaginal, en ángulo de 45% dirigido hacia el techo de la vagina dirigiéndolo hasta el cérvix, esto con el fin de evitar que la pipeta o el catéter se vayan a través del meato urinario y se contamine con la orina. Fuente: www.avparagon.com/.../anatomia_aplicada_inseminacion_artificial.pdf Fig. 25. Inserción del catéter. El catéter debe insertarse en un ángulo de 45° dirigido hacia el techo vaginal. Al llegar al cérvix, se debe hacer una rotación del cateter en el sentido contrario a las agujas del reloj, esto permitirá que el mismo penetre en el cérvix. Par comprobar que está en el cérvix, se puede halar suavemente hacia atrás el catéter y allí se comprobará cierta resistencia. En este momento se debe conectar al catéter o pipeta la bolsa o botella que contiene el semen diluido, previa dilución del mismo con fin de homogenizar el material seminal. Luego se debe descargar lentamente el material seminal. En un comienzo puede ser necesario oprimir ligeramente la botella o bolsa para iniciar el proceso, pero después se debe dejar que el semen sea extraído por las contracciones del útero. El proceso de inseminación puede tardar entre 3 y 8 minutos. Si el material seminal es depositado de una manera rápida, puede causarse reflujo con la consecuente pérdida del semen, aunque generalmente se puede observar la pérdida de una pequeña cantidad de semen durante la I.A. En caso de que se observe la pérdida de una gran cantidad de semen, se debe verificar que la pipeta o el catéter este correctamente introducido en el cérvix. Fuente: www.avparagon.com/.../anatomia_aplicada_inseminacion_artificial.pdf Fig. 26. I.A en la Cerda. El proceso de inseminación puede tardar entre 3 y 8 minutos. Todo el proceso de inseminación debe hacerse con el menor estrés hacia la cerda, porque esto puede influir en los resultados finales de las tasas de preñez y en la prolificidad. Una vez se haya depositado todo el semen, se debe extraer el cateter o la pipeta haciéndola girar en el sentido de las agujas del reloj mientras se hala suavemente. Una vez se ha extraído el catéter se debe mantener a la hembra en un sitio tranquilo por 20 a 30 minutos, lejos de factores estresantes. Fuente: www.avparagon.com/.../anatomia_aplicada_inseminacion_artificial.pdf Fig. 27. Diversos tipos de catéter utilizados en la I.A porcina Inseminación artificial postcervical (IPC) intrauterina profunda (IIP). Gracias a los avances de la biotecnología en los últimos años, se han desarrollado nuevos sistemas de inseminación artificial en la especie porcina. Esto ha permitido la reducción de las dosis a utilizar en los proceso de inseminación artificial, contribuyendo a la obtención de un número mayor de dosis por colecta y con ello mejorar la productividad de las explotaciones. La inseminación post-cervical (IPC) consiste en la introducción de una cánula transcervical a través del cervix para alcanzar la porción anterior del cuerpo del útero, donde los espermatozoides son depositados (Watson y Behan, 2002, citado por Calle, et al, 2006). La dosis inseminante en el caso de esta técnica es de aproximadamente 750- 1000 millones de espermatozoides. La inseminación intrauterina profunda consiste en la deposición del semen en la parte anterior del cuerno uterino, en proximidades de la unión útero-tubárica. Este tipo de inseminación permite disminuir la cantidad de espermatozoides utilizados por I.A, asimismo disminuyendo la pérdida de material seminal por reflujo. La dosis inseminante en el caso de esta técnica es de aproximadamente 150 millones de espermatozoides (Cáceres, 2008). Por último es necesario hacer unas recomendaciones referentes al manejo de los termos de conservación de las pajillas de semen criopreservado. Los termos de nitrógeno con boca ancha, presentan el inconveniente de que presentan una tasa mayor de evaporación y pérdida de nitrógeno. Este tipo de termos son más recomendados para las casas productoras de pajillas, ya que facilitan la manipulación de las pajillas. Para las explotaciones ganaderas se recomienda el uso de termos de boca angosta, con el fin de disminuir la pérdida del nitrógeno, y por ende disminuir los costos de manejo de los mismos. Fuente: http://www.reproduccionanimal.com.mx/Galeria_RASA/Galeria45.jpg Fig. 28. Termos de inseminación. Los termos de boca ancha presentan una mayor tasa de pérdida de nitrógeno por evaporación. CAPITULO 3. TRANSFERENCIA DE EMBRIONES La transferencia de embriones es una biotecnología que ha crecido a un ritmo constante durante los últimos años, en Colombia se ha intensificado su uso, especialmente en el ganado bovino durante los últimos 18 años (Bolívar y Maldonado, 2008). Este es un método de reproducción artificial que consiste en la producción de varios embriones generados por una hembra donante y que serán posteriormente transferidos a hembras receptoras. Lección 26. Selección y manejo de donantes y receptoras Quizá uno de los aspectos mas importantes dentro de la transferencia de embriones es la adecuada selección de las donantes y receptoras. En la selección de donantes, es necesario tener en cuenta dos criterios fundamentales: Animales de alta genética, superiores a los otros. Excelente estado reproductivo Donantes: La selección de donantes debe hacerse de manera estricta, las donantes deben estar reproductivamente sanas y en un balance nutricional adecuado, de lo contario el programa podría fracasar, las vacas demasiado flacas o muy gordas (condición corporal menor de 2.5 o mayor de 4.5 en escala 0 a 5). Las vacas no deben estar con ternero, si en el momento del inicio del programa tiene ternero, el mismo debe ser separado. De igual manera no es aconsejable utilizar vacas con menos de 60 días posparto, ya que estas pueden presentar ciclo irregulares (Albeiro, 2001). Receptoras: La selección de unas buenas receptoras es otro de los puntos críticos dentro del programa e T.E. Las receptoras deben estar clínicamente sanas, libres de cualquier enfermedad, y con un tracto reproductivo en óptimas condiciones, se requieres que tengan buena habilidad materna y capacidad productora láctea. Estas receptoras serán las encargadas de mantener el embrión desde el día 7 hasta su nacimiento y posterior amamantamiento. Por lo anterior deberá ser una hembra que no sea propensa a partos distócicos y que tenga una buena producción láctea. El tamaño de la receptora depende del tipo de embrión que se transferirá. En cuanto a la edad, se difiere aún en lo recomendable, algunos autores piensan que es mejor novillas y otros en vacas que ya hayan parido al menos una vez. Las novillas permiten obtener tasas de preñez mayores a las vacas, sin embargo pueden presentar problemas durante la gestación, el parto y la lactancia. Mientras que el uso de vacas con historia de parto permitirá conocer el comportamiento que tendrá la receptora durante y después de la gestación y el parto (Albeiro, 2001). Programa de Sincronización del celo entre la donante y la receptora y superovulación de la donante En condiciones normales, las vacas tienen una ovulación por ciclo, aunque algunas pueden alcanzar hasta dos ovulaciones (hasta un 8% según la raza). Lo que se busca con esta biotecnología es incrementar el número de ovulaciones consideradas fisiológicas para la especie, a través de la aplicación de hormonas exógenas que estimulen el desarrollo y la ovulación de un numero amplio de folículos (Cyagra, 2008). Para los programas de superovulación en bovinos se puede hacer uso de dos hormonas que ejercen este efecto: la Hormona foliculoestimulante (FSH, la cual viene en combinación con LH) y la Gonadotropina Coriónica equina (eCG, o PMSG). Protocolo mediante el uso de Hormona foliculoestimulante (FSH). La hormona foliculoestimulante ha sido la hormona de predilección en los programas de superovulación en bovinos. La dosis de aplicación varía de acuerdo con la raza, algunas son más susceptibles a la acción de la hormona y responden a su acción con menos dosis. Los productos disponibles comercialmente son hormonales de origen porcino u ovino, los cuales contienen FSH en combinación con LH. La presencia de LH se explica de acuerdo a lo expresado por Calier (2008) en lo siguiente: a grandes dosis la LH provoca la ovulación; a pequeñas dosis, actúa en sinergia con la FSH en el desarrollo folicular. Los folículos menores de 9 mm de diámetro son FSH-dependientes, lo que se evidencia por la presencia de receptores FSH en las células de la granulosa, pero cuando superan los 9 mm, adquieren receptores de LH, y el crecimiento folicular pasa a depender de la LH. Por lo tanto, la LH es necesaria para los estadios finales del desarrollo folicular. Las dosis comúnmente empleadas en la superovulación de vas varia de acuerdo a la siguiente relación: Ganadería bos taurus (Razas lecheras): 800-1000 UI Ganadería bos taurus (Razas cárnicas): 600-800 UI Ganadería bos taurus (Novillas): 500 UI Ganadería bos indicus: 250 UI En dosis decrecientes, cada 12 horas, durante 4 días, aplicando una PG al 3º o 4º día por la mañana. Protocolo de superovulación y sincronización del celo (vacas) Tabla 11. Protocolo de superovulación y sincronización del celo (vacas). DIA HORA DIA 0 08:00 horas DOSIS DONANTE RECEPTORA Dispositivo intravaginal 1ª Dosis PGF2α o auricular + progesterona + benzoato de estradiol DIA 4 DIA 5 DIA 6 08:00 horas 3.0 ml 150 UI 20:00 horas 3.0 ml 150 UI 08:00 horas 2.5 ml 125 UI 20:00 horas 2.5 ml 125 UI 08:00 horas 1.5 ml 75 UI + PGF2α + 2ª Dosis PGF2α Retiro del dispositivo DIA 7 DIA 8 20:00 horas 1.5 ml 75 UI 08:00 horas 1 ml 50 UI 20:00 horas 1 ml 50 UI Detección de celo Inseminación artificial Detección de celo 08:00 horas (I.A) + GnRH DIA 15 20:00 horas I.A 08:00 horas Colecta de embriones Transferencia de embriones Protocolo de superovulación y sincronización del celo (novillas) Tabla 12. Protocolo de superovulación y sincronización del celo (Novillas). DIA HORA DIA 0 08:00 horas DOSIS DONANTE RECEPTORA Dispositivo intravaginal 1ª Dosis PGF2α o auricular + progesterona + benzoato de estradiol DIA 4 DIA 5 DIA 6 08:00 horas 2.0 ml 100 UI 20:00 horas 2.0 ml 100 UI 08:00 horas 1.5 ml 75 UI 20:00 horas 1.5 ml 75 UI 08:00 horas 1 ml 50 UI + PGF2α + 2ª Dosis PGF2α Retiro del dispositivo DIA 7 DIA 8 20:00 horas 1 ml 50 UI 08:00 horas 0.5 ml 25 UI 20:00 horas 0.5 ml 25 UI Detección de celo Inseminación artificial Detección de celo 08:00 horas (I.A) + GnRH DIA 15 20:00 horas I.A 08:00 horas Colecta de embriones Transferencia de embriones Protocolo mediante el uso de Gonadotropina Coriónica equina (eCG, o PMSG). La eCG (Folligon®, Novormon®) es una hormona producida en las copas endometriales de la yegua durante los días 42 a 150 de la gestación. Esta hormona tiene una acción FSH y LH, con una vida media larga de aproximadamente 5 días. Debido a su vida media larga, puede desencadenar una sobreestimulación ovárica la formación de quistes foliculares. La dosis empleada para inducir la superovulación es de 2000 UI en novillas y de 3000 UI en vacas. Tabla 13. Protocolo de superovulación con eCG. DIA HORA DIA 1 08:00 horas DOSIS OBSERVACION Dispositivo intravaginal o auricular + progesterona + benzoato de estradiol DIA 7 2000 UI Aplicación IM de eCG Retiro dispositivo + aplicación de PGF2α DIA 9 1000 μG DIA 10 I.A + Aplicación de anti-PMSG (anti-eCG) Progesterona: 50mg, benzoato de estradiol: 2.5μ Fuente: www.avparagon.com/.../anatomia_aplicada_inseminacion_artificial.pdf Fig. 29. Ovarios superovulados. Lección 27. Colecta y evaluación de embriones Los embriones bovinos, pueden ser recuperados a través de métodos no quirúrgicos. Inicialmente, la recuperación de embriones se hacía por medios quirúrgicos, y se requería de anestesia general y/o local, para luego realizar una incisión a nivel de la línea media y extraer los cuernos uterinos con los ovarios y se realizaba el lavado de los cuernos para extraer los embriones (Palma, 2001). Sin embargo estas técnicas producían lesiones con formación de fibrina y adherencias de los varios y cuernos a las paredes de la cavidad abdominal, produciendo la pérdida reproductiva del animal. Hoy en día es posible realizar la extracción de los embriones, por medio de técnicas no quirúrgicas (método transvaginal). Para la colección no quirúrgica de embriones se han inventado variedades de instrumentos pero los más comunes son los catéteres Foley de 2 vías y el modelo Neustadt/. Las diferencias fundamentales entre ellos redica en el largo y en la consistencia. El modelo Neustadt/Aish es 27 cm. más largo y es más duro que el Foley (Del campo, 2000). La sonda Foley es el elemento utilizado en nuestro país para la recuperación de los embriones. Técnica En el proceso de lavado y colecta de embriones se debe contar con los siguientes elementos: Circuito de lavado Sonda Foley (Con estilete) Medio de lavado (PBS) Dilatador de cérvix Mangas de palpación Filtro de recolección Jeringas Lidocaína al 2%, agujas 16G o 18G Cajas de petri Microestereoscopio Medio holding Pajillas Congeladora de embriones Pistola de transferencia Se debe inmovilizar a la donante en un brete o carral, se realiza la palpación rectal o la evaluación ecográfica para determinar el número de cuerpos lúteos presentes en cada ovario. Se limpia y desinfecta la región perineal y vulvar. Se aplica la anestesia epidural baja (5 ml, de lidocaína al 2%). Se introduce un brazo por vía rectal y con el otro se introduce la sonda Foley (con el estilete) vía vaginal, se pasa el cérvix y se infla el balón o globo con 10-15 ml de aire o de solución salina o PBS, esto con el fin de evitar la salida de la sonda y/o líquido de lavado durante el proceso (En algunas vacas será necesario producir una dilatación del cérvix para facilitar el paso de la sonda, esto se realiza con el dilatador de cérvix). La sonda debe ser ubicada de forma tal que no exista perdida de líquido durante el proceso, y se procede a introducir el medio de lavado (Este medio debe introducirse a temperatura corporal, 37°C, en volúmenes de 20 a 100 ml, luego se procede a realizar el masaje por todo el cuerno con el fin de arrastrar los embriones, luego este liquido debe ser colectado y pasa a través de un filtro en donde van a ser colectados los embriones. Este procedimiento se repite entre 3 y 6 veces en cada uno de los cuernos. Una vez se ha terminado de colectar los embriones se deba aplicar una dosis de prostaglandina, con el fin de inducir la luteolisis y así evitar que ocurra una preñez de embriones que hayan podido quedar dentro del tracto reproductivo posterior al lavado. Fuente: Guzmán et al, 2008 Fig. 30. Proceso de colecta de embriones Los embriones colectados en el filtro son llevados al laboratorio, para allí realizar la búsqueda, evaluación y clasificación de los mismos. A nivel de laboratorio se realiza la búsqueda de embriones (Viables y no viables) y estructuras no fertilizadas en el estereoscopio, para esto se extrae el contenido del filtro en cajas de petri. Los embriones viables son separados en otra caja de petri mas pequeña que contiene medio PBS, posteriormente se realiza el lavado de los embriones por medio del pase de los mismos en medio durante 8 a 10 veces. Evaluación de embriones La evaluación morfofológica es un aspecto importante para definir cuáles son aptos para la transferencia y/o crio preservación. Por lo anterior es importante realizar un repaso por los estadios de desarrollo del embrión durante los 9 primeros días. Desarrollo del embrión en los bovinos Tabla 14. Desarrollo del embrión. TIEMPO DESARROLLO 36-48 horas 2 células 3 día 4 – 8 células 4 día 8 – 16 células 4-5 día Mórula temprana 5-6 día Mórula compacta 6-7 día Blastocisto temprano 7-8 día Blastocisto expandido 8-9 día Blastocisto eclosionado A nivel del laboratorio se procede a realizar la clasificación de los embriones de acuerdo a su calidad, para esto se establece una escala de clasificación de 1 a 5. Escala de clasificación de la sociedad internación de Transferencia de embriones Tabla 15. Escala de clasificación embrionaria. Fuente: Evangelista et al, 2007. Los embriones aptos para criopreservación son los tipo 1, los aptos para la transferencia en fresco son los tipo 1, 2 y 3. Y los demás no son viables. Si se va a realizar la criopreservación son empajillados en medio de Etilenglicol, si van a ser transferidos en fresco se empajillan en medio PBS. Fuente: http://artbreeding.com/Graphics/BovineFlush.jpg Fig. 31. Embriones en diferentes etapas de desarrollo. Fuente: http://www.hamiltonthorne.com/products/lasers/xyclone/images/hatched -bovine-embryos.JPG Fig. 32. Embriones colectados. Lección 28. Transferencia de embriones La transferencia es no quirúrgica. Las pajuelas conteniendo al embrión son cargadas en un pistolete de transferencia, el cual es cubierta con una camisa sanitaria de plástico. La receptora es ubicada en un brete, encepada y anestesiada con una inyección epidural. Luego de ser palpada en búsqueda del cuerpo lúteo, el pistolete es insertado hasta la mitad del cuerno uterino (lo más profundo posible) y el embrión es depositado allí. Los porcentajes de preñez esperados son de un 60 al 65 %, cuando se transfieren embriones en fresco, y del 50 al 55%, cuando los embriones transferidos son congelados (Cyagra, 2008). Tomar una pajilla de 0,25 ml y cargar en ella el embrión en el siguiente orden: 1. 1ra. columna de PBS con suero fetal al 10%. 2. 2da. columna, pequeña burbuja de aire. 3. 3ra. columna de PBS con medio de congelación. 4. 4ta. columna, pequeña burbuja de aire. 5. 5ta. columna, cargar el embrión en su medio. 6. 6ta. columna, pequeña burbuja de aire. 7. completar el resto de la pajuela con medio de congelación. La pajilla se carga en la pistola de transferencia de embriones y ésta dentro de la pipeta plástica estéril. Introducir una mano vía y sujetar el cérvix a través de la pared del recto. La pistola se introduce vía vaginal en el canal cervical y su extremo se ubica, con ayuda de la mano izquierda, en el cuerno ipsilateral al Cuerpo lúteo. Una vez en la posición deseada (un poco más allá del cuerpo del útero) el embrión es depositado suavemente y la pistola se retira lentamente. Todo este procedimiento debe realizarse lo más rápido y delicadamente posible. El exceso de manipulación producirá daño a la mucosa del útero, que se traducirá en una baja en los resultados (Del campo, 2000) Lección 29. Criopreservación de embriones De acuerdo a lo expresado por Celestinos y Gatica (2002), el empleo de embriones congelados posibilita la utilización eficiente de las donantes y receptoras; permite la incorporación de alta genético a bajo costo (comparando los valores del embrión y el de su transporte frente a los animales en pie), permite la transferencia de algunos embriones y la conservación del resto hasta poder analizar los registros de producción de la descendencia; facilita el control de enfermedades exóticas (reemplazando la importación de animales en pie por la de embriones congelados libres de ellas), y permite la creación de bancos de embriones de valor pecuario, entre otras ventajas. Los registros de la Sociedad Internacional de Transferencia de Embriones revelan que más del 50% de 500.000 embriones de bovino transferidos en los últimos años han sido usados después de ser congelados y descongelados (Thiber, 1997). La conservación de los embriones a temperaturas extremadamente bajas (-196 °C en nitrógeno líquido) permite detener casi por completo la actividad enzimática intercelular, respiración celular, metabolismo, crecimiento, multiplicación, etc.; es decir, reducen drásticamente la actividad fisiológica de la célula, así es posible almacenar embriones durante un largo período sin afectar su viabilidad y sin causarles cambios genéticos. En la actualidad, la crioconservación de embriones de mamíferos ha llegado a ser un procedimiento rutinario en biología, ganadería y medicina, pudiendo lograrse por procedimientos de congelación estándar y por vitrificación. La principal diferencia que tiene la vitrificación con el método estándar es que en este último la concentración de crioprotectores es menor y el descenso de temperatura se realiza de manera controlada mediante equipos programables (Fahning y García, 1992, citado por Celestinos y Gatica, 2002). Crioprotectores Durante el proceso de criopreservación, los embriones deben ser deshidratados parcialmente a fin de evitar la formación de cristales que lesionan las estructuras citoplasmáticas. Esta deshidratación se logra incorporando un agente crioprotector al medio de congelación. Existen dos clases de Crioprotectores: intracelulares o permebales y extracelulares o impermeables. Permeables o intracelulares: presentan bajo peso molecular, estos compuestos deshidratan la célula penetrando a ésta para ayudar a proteger el citoplasma. Entre estos se encuentran: Glicerol (G), Dimetilsulfóxido (DMSO), 1-2 propanodiol, etilenglicol (EG), propilenglicol (PG), polietilenglicol (PEG), etanol y otros alcoholes. Impermeables o extracelulares: Presentan alto peso molecular, estos compuestos extraen el agua libre intracelular utilizando la diferencia de presión osmótica sin penetrar a la célula; son efectivos para preservar la funcionalidad y estructura de las membranas a baja actividad de agua; deshidratan junto con el crioprotector las células de los embriones. Entre estos se encuentran: polivinilpirrolidona (PVP), glucosa, fructosa, ficol, dextrano sorbitol, sucrosa, lactosa, trealosa, rafinosa y otros azucares Los crioprotectores previenen la deshidratación total y la degeneración proteica, causada por la congelación del agua intra y extracelular durante el proceso. La etapa del desarrollo más apropiada para la vitrificación en etilenglicol es la mórula compacta y blastocisto temprano de embriones producidos in vivo o in vitro (Celestinos y Gatica, 2002). Técnica de criopreservación El método de congelación estándar fue desarrollado por Wilmut y Rowson en 1973, en este método la exposición de los embriones al medio de congelación (PBS + G) debe realizarse a temperatura ambiente (20 - 22 °C), en un solo paso, de 10 a 30 minutos de duración. Este período incluye el envasado de los embriones en pajillas plásticas. Esto permite realizar más rápidamente y con mayor precisión la inducción de la cristalización o “seeding”. Las pajillas deben ser colocadas en un equipo de congelación a -7 °C durante 5 minutos para equilibrar la temperatura de las pajillas con la del equipo; el seeding se realiza poniendo en contacto la superficie de la pajilla con una placa metálica enfriada con nitrógeno líquido (NL2); el agente refrigerante del equipo puede ser nitrógeno líquido alcohol o etanol enfriado por medio de un compresor (El no inducir la cristalización conduce a la formación de cristales de hielo bajo un estado de superenfriamiento y a una elevación repentina de temperatura (se genera calor latente de –10º a –15 ºC), resultando un severo trauma físico que puede dañar las células (Niemann, 1995, citado por Celestinos y Gatica, 2002). Una vez efectuado el seeding, se mantiene la temperatura estable durante 10 minutos (período de estabilización) y luego se desciende a una velocidad de entre 0.1 y 0.5 °C hasta -30 ó -35 °C para establecer un adecuado balance entre deshidratación y formación de hielo intracelular, en este momento las pajuelas pueden ser retiradas del equipo de congelación y sumergidas en nitrógeno líquido. La descongelación se realiza de manera rápida, sumergiendo las pajillas en baño María a 30 ó 35 °C durante 20– 30 segundos (Celestinos y Gatica, 2002). Existe otro método de congelación rápida que fue desarrollado por Chupin (1986). Los embriones son deshidratados parcialmente como ocurre en el método estándar, luego se les deshidrata nuevamente colocándolos en una solución mixta de glicerol y sucrosa. Esta segunda deshidratación deja a los embriones en condiciones de ser enfriados rápidamente. Las pajuelas son colocadas en el cuello del termo de nitrógeno, durante 5 minutos, posteriormente son sumergidas al NL. Por último, existe un proceso denominado vitrificación, el cual consiste en un proceso físico de solidificación utilizado para conservar órganos, tejidos y embriones. La solución vitrificante (SV) lleva incorporado crioprotectores en alta concentración. Al ser enfriada no cristaliza, sino que se torna viscosa y pasa del estado líquido a un estado sólido no estructurado similar al vidrio, tomando de ahí su nombre. Todo el procedimiento desde el equilibrio hasta la inmersión en NL no requiere más de 10 minutos Por otro lado De Luca (2007) describe la técnica de criopreservación de embriones bovinos de una manera más detallada: Selección del embrión. Separar mórulas de blastocistos. Lavar 10 veces con una solución de Dulbecco® modificado, con 10% de suero fetal bovino (Mórulas: sumergir durante 10 minutos el embrión en una solución de Dulbecco®, con 1,5 molar de glicerol, más 0,1 molar de sucrosa. Blastocistos: sumergir durante 10 minutos el embrión en una solución de Dulbecco®, con 1,5 molar de glicerol, más 0,2 molar de sucrosa). Tomar una pajilla de 0,25cc y cargar en ella el embrión en el siguiente orden: 8. 1ra. columna de Dulbecco® con suero fetal al 10%. 9. 2da. columna, pequeña burbuja de aire. 10. 3ra. columna de Dulbecco® con medio de congelación. 11. 4ta. columna, pequeña burbuja de aire. 12. 5ta. columna, cargar el embrión en su medio. 13. 6ta. columna, pequeña burbuja de aire. 14. completar el resto de la pajuela con medio de congelación. Llevar los embriones a la congeladora con una temperatura de entre -6°C a -7°C, donde permanecerán 10 minutos en stand by, hasta alcanzar los 35°C. A su término tocar la pajuela a la altura de la 3ra. columna con una pinza hemostática, previamente sumergida en nitrógeno líquido para que alcance en su extremo los -196°C. Este método (Seeding) evitará la muerte del embrión por sobrefusión. La corrida de temperatura será de 0,5°C por minuto hasta alcanzar los 35°C, momento en que se introducirá la pajuela en nitrógeno líquido (Plunging) Proceso de descongelación de las pajillas Tomar la pajilla con una pinza y exponerla a temperatura ambiente durante 1 segundo. Sumergir la pajuela en agua a 35°C durante 1 minuto. Sacar la pajilla del agua y secarla sin agitarla. Cortar el extremo con un cortador especial evitando agitarla. Cargar la pajilla en la pipeta de transferencia e implantar el embrión sobre el cuerno en que se presenta el cuerpo lúteo. Lección 30. Transferencia de embriones en equinos La técnica de transferencia de embriones en equinos es el procedimiento por el cual se recolecta uno o más embriones a través de un lavaje uterino transcervical de una yegua donante inseminada o servida por monta natural, 6 a 10 días postovulación, y se transfiere de manera no quirúrgica al útero de otra yegua receptora sincronizada previamente (Losinno 2007). La primera transferencia de embriones en equinos realizada con éxito fue comunicada por Oguri y Tsutsumi en 1972, pero no fue aceptado como procedimiento en la industria equina hasta comienzos de los años 80. En 1984 se realiza el 1° Simposio Internacional Equino en la Universidad de Cornell (U.S.A.), el 2° en Canadá en el año 1989, y el 3° en Argentina en 1992. Actualmente, a 11 años de este evento, en nuestro país se realiza con éxito el trasplante de embriones y cada día se acrecenta más la utilización de este método en la reproducción equina. Hoy día esta técnica es considerada a nivel mundial, como una de las técnicas de Reproducción Asistida más utilizada. Indicaciones de la T.E en equinos La T.E es una técnica que presenta mucho potencial en la explotación equina, en aras del mejoramiento de la eficiencia reproductiva, algunas de las indicaciones para la implementación de esta biotecnología son: Disminuir el intervalo generacional. Obtención de crías de hembras en exposición o competencia deportiva Obtención de crías de hembras con problemas o lesiones de tipo no reproductivo. Obtención de crías de hembras de avanzada edad o hembras muy jóvenes (entre dos y tres años de edad). Incrementar la producción de crías por hembra, lo cual permite la rápida multiplicación de crías por hembra. Disminuir los riesgos de la gestión y el parto en yeguas de alto valor. Fuente: http://www.transbio.com/images/trans0.jpg Fig. 33. T.E en equinos. Sin embargo la transferencia embrionaria en el equino no ha tenido el mismo éxito que en el bovino, ya que no existe un método seguro de superovulación en la yegua, esto implica que solo se puede obtener un embrión por ciclo si la yegua es preñada. (Losinno 2007). Sin embargo, esta técnica permite la obtención de 6 a 8 crías por año, pero aquí existe una limitante, y es que algunas asociaciones criadores restringen el número máximo de crías por año. Técnica Selección de Yeguas Receptoras. La selección de receptoras es uno de los factores que inciden en mayor proporción en el éxito de la técnica. Se debe seleccionar yeguas con una edad entre los 3 y 10 años, con buna condición corporal y conformación, deben tener un peso y tamaño igual o superior al de las yeguas donantes para poder llevar a buen término la gestación. Usualmente se eligen yeguas de razas pesadas o sus cruzas para aprovechar rusticidad, tamaño, temperamento y aptitudes maternas que facilitaran la cría del potro. Las receptoras seleccionadas son sometidas a un examen reproductivo en el cual se examina la integridad de los órganos sexuales, asimismo se realiza un seguimiento ecográfico de al menos dos ciclos para determinar la ciclicidad (actividad folicular, ovulación) y se someten a un régimen alimentario que les permita ganar peso después de la gestación. Selección de Yeguas donantes. Las yeguas donantes son yeguas seleccionadas por su alta genética, las mismas son sometidas a un completo examen reproductivo que incluye tamaño, tono y forma del útero. El cervix, se examina por vía vaginal y se realiza un cultivo cervical para obtener información del estado del mismo, si se identifican anormalidades deben ser tratadas antes de su introducción al programa de transferencia (Losinno 2007, Campos, 2007). Sincronización de celo (Donante – receptora) Es importante realizar un adecuado proceso de sincronización del celo entre la yegua donante y las receptoras. Una buena alternativa es la utilización de un progestágeno de suministro oral o alguno de los métodos alternativos, tal como se explicó en el capítulo de sincronización. Durante el celo de la yegua donante se la observa por ecografía para conocer el momento óptimo del servicio o inseminación artificial. Luego de éste se procede a la selección, también mediante ecografía, de 2 o más yeguas receptoras (de acuerdo a la disponibilidad de las mismas), y de éstas se elige una, que de acuerdo al crecimiento folicular y ovulación se encuentre mas sincronizada con la donante (Losinno 2007, Campos, 2007). Colecta y transferencia de embriones Al séptimo u octavo día post inseminación de la donante se realiza la colecta del embrión o embriones mediante lavado uterino transcervical. Para esto se debe seguir los siguientes pasos (Losinno 2007, Campos, 2007): Se coloca la yegua donante en un brete se venda la cola y se lava la región perineal con abundante agua y un detergente suave, se enjuaga y seca. El operador se coloca un guante de tacto estéril, con gel lubricante estéril, y procede a la introducción de un catéter (sonda Foley) de 80 cm de longitud, con un balón inflable de 30-60 cc.a través del cervix, ubicando en el cuerpo del útero el balón del catéter, que una vez allí es inflado con aire o suero. Se comprueba que esté en el sitio adecuado traccionando hacia atrás para que no haya reflujo de líquido. Se lava el útero introduciendo por el catéter 3 litros de PBS (phosphate buffer saline) o PBS modificado tibio a 30 a 35 °C. Luego se permite al liquido salir y pasar a través de un filtro para embriones. Mediante masajeo del útero vía rectal se logra obtener el 80% del total del líquido prefundido el cual si la yegua no tiene problemas uterinos debería ser claro, libre de restos celulares y sangre. La recuperación de líquido turbio indica endometritis. Al finalizar el lavado el contenido del filtro se vacía en una placa de petri para buscar el embrión bajo lupa estereoscópica con un aumento de 15X. Luego de localizado el embrión se lava 3 o 4 veces con líquido de enriquecimiento y se observa a mayor aumento para clasificarlo de acuerdo a una escala que va de 1 (excelente) a 4 (pobre) de acuerdo a las características de viabilidad embrionaria. Se introduce en una pajuela 0.5 o 0.25, (mediante aspiración a través de una pipeta dosificadora para embriones o una pajuela adosada a una jeringa) con medio de enriquecimiento y se mantiene a temperatura de 37 °C hasta el momento de la transferencia, preferentemente antes de 2 horas de su recolección. Se coloca la pajuela dentro de un inyector de Inseminación Artificial descartable, se protege éste con una camisa sanitaria estéril para evitar la contaminación durante el pasaje de la misma por la vagina. El operador, con un guante de tacto estéril, con lubricante también estéril, previo lavado y secado de los genitales de la yegua receptora, introduce la mano en la vagina con la punta del inyector protegida en la palma de la mano, rompe la camisa sanitaria y lo introduce a través del cervix en el cuerpo uterino. Se deposita el embrión lentamente. Es imprescindible siempre administrarle a la yegua donante Prostaglandina F2a para que esta retorne al estro, y asegurarnos que no se establezca la preñez en aquellas yeguas en la que no se pudo recolectar embrión. A los 7 días de realizada la transferencia, se realizan ecografías en las receptoras para diagnosticar preñez, que se repiten a los 20, 35, 50 y 60 días. La tasa de recuperación de embriones por cada intento de colecta varía entre un 20% a un 160%. La variabilidad de estas obtenciones se debe, entre otros factores, a la cantidad y calidad del semen utilizado, la edad y estado reproductivo de la donante, el día post-ovulación en el que se intente obtenerlo, el número de ovulaciones, la técnica de lavaje utilizada y el entrenamiento del operador (Lossino, 2007). UNIDAD 3. ULTIMAS BIOTECNOLOGIAS REPRODUCTIVAS APLICADAS A LA PRODUCCION ANIMAL OBJETIVOS Conocer la técnica y los procesos desarrollados en la Fertilización in vitro. Identificar las ultimas biotecnologías aplicadas a la reproducción y su estado actual a nivel mundial y a nivel local. ESTRUCTURA CAPITULO 1. FERTILIZACION IN VITRO. Lección 31. Aspectos generales. Lección 32. Obtención de ovocitos. Lección 33. Maduración de ovocitos. Lección 34. Fertilización in vitro. Lección 35. Maduración y transferencia de embriones. CAPITULO 2. CLONACION Y TRANSGENESIS. Lección 36. Aspectos generales Lección 37. Clonación. Lección 38. Últimos avances en clonación. Lección 39. Transgénesis. Lección 40. Últimos avances en transgénesis. CAPITULO 3. SEXAJE DE SEMEN, QUIMERAS, ICSI, CELULAS MADRE Lección 41. Aspectos generales Lección 42. Sexaje de semen. Lección 43. Producción de quimeras. Lección 44. Inyección intracitoplasmática de semen. Lección 45. Producción de células madre UNIDAD 3. ULTIMAS BIOTECNOLOGIAS REPRODUCTIVAS APLICADAS A LA PRODUCCION ANIMAL CAPITULO 1. FERTILIZACION IN VITRO Lección 31. Aspectos generales La biotecnología de la Fertilización in vitro (FIV) ofrece una nueva dimensión en la reproducción animal, esta técnica supera la inseminación artificial y la transferencia de embriones, lo cual permite ampliar las posibilidades de mejoramiento de la productividad y eficiencia de las explotaciones bovinas (Fernández, Bastidas y Trocóniz, 1997). La FIV es una biotecnología que durante los últimos 10 años se ha venido implementando de manera paulatina en ganaderías de alto valor genético. Su valro está representado en un mayor número de embriones obtenidos durante cada uno de los tratamientos, sin embargo su principal inconveniente radica en los costos, pues requiere de un equipamiento especial, para los procesos de maduración de ocovitos, fertilización in vitro y maduración embrionaria. Sin embargo, si se cuenta con animales de alta genética es una buena alternativa y puede implementarse en animales que no podrían ser utilizados en otras biotecnologías, tales como (Cyagra, 2008): Vacas refractaria a tratamientos superestimulatorios. Vacas que no dan embriones transferibles en programas de Superovulación y Transferencia de Embriones. Vacas con alteraciones anatómicas que impiden una correcta fecundación o anidación del embrión. (Ej: adherencias post-cesárea) Vacas de desecho (por enfermedad o accidente) Vacas o Novillas hasta el primer tercio de gestación Vacas en puerperio Terneras Prepúberes La fertilización in vitro comprende varias etapas, relacionadas de la siguiente forma: Obtención de ovocitos. Maduración de ovocitos. Fertilización in vitro. Maduración in vitro. Transferencia de embriones. Lección 32. Obtención de ovocitos. Durante el ciclo estral es posible encontrar un elevado número de folículos que inicia su desarrollo (Fase de reclutamiento) , sin embargo solo uno va a alcanzar la ovulación, los demás involucionan o se atresian e inicia un nuevo ciclo estral. Esto ocurre durante toda la vida reproductiva del animal, ocurriendo que solo unos pocos folículos llegaran a la ovulación y miles involucionaran. En este sentido, la recolección de ovocitos permite recuperar y aprovechar folículos no ovulatorios, que bajo condiciones fisiológicas se tornarían en folículos atrésicos, con el fin de aprovechar el máximo potencial genético de una donadora por procedimientos in vitro. La recolección de ovocitos para el procedimeitno de FIV se puede realizar en dos formas (Ramírez y Jiménez, 1999): Recolección en animales post-mortem. Recolección en animales vivos Recolección en animales post-mortem: los ovarios pueden provenir de vacas de alta genética que sufrieron algún accidente o trauma y requieren ser sacrificadas. En otros países estos ovarios pueden ser obtenidos de vacas de matadero, para obtener animales comerciales, sin embargo en nuestro país esto no es viable por el elevado valor de la técnica. Los ovocitos se pueden recoger por aspiración de folículos visibles o mediante el método de corte de la superficie e interior del ovario. La temperatura a la cual se deben transportar los ovarios desde el matadero o el sitio de colecta hasta el laboratorio, oscila entre 35 y 37 oC, y en esta temperatura pueden permanecer hasta 8 horas, sin llegar a afectar su maduración y fertilización. En la técnica de corte (Ramírez y Jiménez, 1999) se corta la superficie y el interior de los ovarios a lo largo y se hace remoción del tejido adyacente, del cuerpo lúteo y de sangre con lavados de solución salina y alcohol. En la técnica de aspiración los folículos superficiales visibles de 2 a 5 mm son aspirados mediante el uso de jeringas y agujas de 16G. Recolección en animales vivos: En animales vivos la recolección de ovocitos se puede realizar por aspiración trasvaginal guiada por ultrasonido (OPU, por sus siglas en inglés, Ovum Pick Up) y por laparoscopia / laparotomía. La técnica más común y menos traumática es la de OPU, y se puede realizar hasta 2 veces por semana y repetida durante 5 a 6 meses, y con una periodicidad de dos aspiraciones por semana o una semanal, sin ningún efecto adverso sobre la reproducción o sobre el bienestar del animal. Se ha demostrado que al final del periodo de aspiraciones los animales pueden retornar a sus ciclos estrales normales y ser incorporados a programas de cría (Rodríguez, 2006). Para el procedimiento, se debe aplicar anestesia epidural, con el fin de evitar contracciones abdominales y las facilitar la manipulación de los ovarios, se debe vaciar el recto y limpiar la región perineal. Se utiliza un ecógrafo con transductor de 5 ó 7.5 MHz que posee una aguja en la parte superior con punta ecogénica conectado a una bomba peristáltica de vacío que es introducido por vía vaginal. Se hace manipulación rectal de los ovarios y se colocan contra el transductor, se visualizan los folículos (mayores de 2 mm) y una vez localizados, la aguja atraviesa la pared vaginal y se recoge el aspirado folicular en tubos que contengan el medio de cultivo. En cada pasaje de la aguja se punciona solamente un folículo (Ramírez y Jiménez, 1999) Mediante aspiración folicular se pueden obtener de 4 a 20 oocitos por donante, los cuales se maduran, fertilizan y cultivan in vitro hasta el momento de la transferencia. Se ha visto, además, que después de la aspiración de los folículos terciarios, una nueva cohorte de folículos se desarrolla. La viabilidad de los embriones producidos a partir de oocitos obtenidos por aspiración es similar a la alcanzada por embriones producidos por otros procedimientos in Vitro, pero un poco más baja que la obtenida para embriones producidos por lavado, obteniéndose porcentajes de preñez que varían desde un 25 hasta un 45% (Rodríguez, 2006). Lección 33. Maduración de ovocitos in vitro Para el proceso de maduración es necesario realizar una buena selección de los ovocitos a madurar, en tal sentido se deben seleccionar aquellos con el citoplasma homogéneo, no granular, ni polarizado y con células del cúmulo intactas rodeando al gameto, ya que ellos representan los mayores porcentajes de maduración. Los ovocitos rodeados por un cúmulo compacto formado por varias capas de células, presentan mayores porcentajes de maduración, fecundación y de desarrollo hasta blastocistos, que los que carecen de cúmulo o los que están rodeados solamente por la corona radiata. La selección de los ovocitos se realiza generalmente en base a tres criterios: el diámetro del ovocito, el aspecto de su citoplasma y las características del cúmulo que los rodea. El diámetro de los ovocitos condiciona su capacidad para madurar, de tal forma que los ovocitos bovinos con un diámetro inferior a 110 μm se encuentran todavía en fase de crecimiento y no han adquirido aun la capacidad para madurar (Herradon et al, 2007). La maduración in vitro constituye una etapa decisiva en el rendimiento del proceso de producción de embriones in vitro. El medio de maduración en el que tradicionalmente se han madurado los ovocitos incluye TCM-199, suplementado -estradiol (Herradon et al, 2007). No obstante, los ovocitos bovinos reinician la meiosis en una gran variedad de medios que van desde una solución salina simple hasta medios más complejos, sin embargo, se prefiere estos últimos ya que se ha comprobado que el medio utilizado afecta no solamente la capacidad posterior de fecundación, sino que también el desarrollo embrionario (De los Reyes, 1994). El medio de maduración más comúnmente utilizado es el medio 199 (TCM199), adicionalmente se hace suplementación del medio con gonadotrofinas y estradiol, las cuales tienen un efecto favorable, especialmente en lo que se refiere al desarrollo post maduración. Las gonadotrofinas provocan un aumento significativo en la cantidad de AMPc en las células de la granulosa e inducen la maduración ovocitaria. La LH mejora las condiciones de maduración in vitro, modificando el ambiente nutricional ya que aumenta la energía disponible para el ovocito; adicionalmente impide los efectos inhibitorios que actúan sobre el gameto, logrando de ese modo la ruptura de la vesícula germinal. Por otro lado, la FSH induce la expansión de las células de cúmulo en bovinos, a través de la síntesis de piruvato y ácido hialurónico. Se ha sugerido además que la FSH y el estradiol participarían en el bloqueo a la poliespermía durante la fecundación, a través de la síntesis previa de los gránulos corticales (De los Reyes, 1994). La adición de esteroides no afectaría la maduración nuclear in vitro, ni la penetración espermática posterior de los ovocitos bovinos, lo que puede indicar que la maduración no sería mediada a través de los esteroides; sin embargo, los ovocitos que son madurados sin estradiol disminuyen su capacidad de segmentarse normalmente y lograr un desarrollo posterior (Sirotkin, 1992, citado por De los Reyes, 1994). El tiempo de incubación como también la temperatura, son parámetros importantes a considerar en los protocolos de maduración ovocitaria, la temperatura de incubación debe estar entre 37 y 39°C. La duración del proceso de maduración está entre 22 y 26 horas. Lección 34. Fertilización in vitro Este proceso dura aproximadamente 18 horas, se requiere inducir la capacitación espermática en los espermatozoides que van a ser utilizados para la fecundación, lo anterior debido a que la capacitación espermática ocurre normalmente a nivel del tracto reproductivo de la hembra, entonces se requiere imitar los efectos ocurridos normalmente durante el proceso de fecundación natural. Durante este proceso de capacitación el gameto sufre una serie de fenómenos que lo conducen a la hiperactivación y reacción acrosómica, procesos considerados vitales para la penetración espermática a la zona pelúcida y para la posterior fusión del espermatozoide con la membrana plasmática del ovocito. Para lograr el proceso de capacitación y reacción acrosómica, se han utilizado diverso métodos, uno de ellos es la separación celular previa mediante "swim up", hace que se recuperen los espermatozoides con mejor motilidad y la posterior incubación de éstos con heparina, mediante esta técnica se han obtenido altos porcentajes de fecundación in vitro. Otra alternativa de separación espermática es el gradiente de percol, que es equivalente a un "swim down", ya que se recuperan del fondo del tubo los espermatozoides más motiles (De los Reyes, 1994). La fecundación va a depender de que haya ocurrido una adecuada maduración nuclear y citoplasmática de los ovocitos bovinos, y una eficiente capacitación de los espermatozoides. Esta técnica se realiza en gotas de 50-100 µl de medio Tyrode tamponado (pH 7,8), utilizando una proporción de 10-15 ovocitos intactos o previamente denudados de las células del cúmulo, ya que ello podría favorecer la penetración espermática (Hawk y col., 1992, Herradon et al, 2007), con una dosis aproximada de 1 millón de espermatozoides por ml de medio. El medio para el desarrollo de esta técnica debe contener una atmósfera de CO 2 del 5% y una temperatura adecuada (39°C), durante un periodo comprendido entre 18 y 20 horas. Lección 35. Maduración de embriones (Cultivo in vitro) Los medios utilizados para el cultivo de los embriones bovinos han sido clasificados en tres categorías: Indefinidos, cuando se utiliza suero y cocultivo con células somáticas; Semidefinidos, cuando se omite el cocultivo y el suero se reemplaza por albúmina sérica; Definidos, cuando el suero se reemplaza por macromoléculas como el polivinil alcohol o la polivinil pirrolidona. Para la maduración de los embriones se procede a denudar los ovocitos que consiste en desprender del mismo a las células de la granulosa, las cuales lo rodean como si fuera una corona. De esta forma el ovocito fecundado, en el medio especifico, se lleva a una estufa cuya característica principal es el bajo porcentaje de oxigeno en su ambiente. Se inicia así la etapa que se denomina “Cultivo” en la cual, durante 6-7 días se llevará a cabo la división celular hasta llegar al estadio de mórula o blastocisto, evolución que denominamos desarrollo embrionario (Cyagra, 2008). Transferencia de embriones Finalmente los embriones obtenidos pueden ser criopreservados o transferidos en fresco a receptoras sincronizadas. Fuente: Hernández, Hugo (2004). Fig. 34. Proceso de FIV. CAPITULO 2. CLONACION Y TRANSGENESIS. Lección 36. Aspectos generales Desde que se produjo la primera clonación de un mamífero el año de 1996, con la oveja Dolly, se han realizado muchos experimentos en diversas especies, sin embargo aún se discute mucho en los aspectos legales, éticos, sociales y económicos que trae como consecuencia la implementación de esta biotecnología en la producción animal. La clonación puede definirse como el proceso por el que se consiguen copias idénticas de un organismo ya desarrollado, de forma asexual. Estas dos características son importantes: Se parte de un animal ya desarrollado, porque la clonación responde a un interés por obtener copias de un determinado animal que nos interesa, y sólo cuando es adulto conocemos sus características. Por otro lado, se trata de hacerlo de forma asexual. La reproducción sexual no nos permite obtener copias idénticas, ya que este tipo de reproducción por su misma naturaleza genera diversidad. Este proceso de clonación a partir de células adultas ya diferenciadas ha sido el resultado de mínimo 40 años de investigación en diferentes áreas del conocimiento, como la genética y la biología reproductiva. El sincronizar tanto la célula donante como la receptora permitió el éxito final de un procedimiento que se creía imposible. Este avance científico abrirá nuevos horizontes especialmente en el campo de la biotecnología (Serrano, 2004). Lección 37. Métodos de clonación De acuerdo a lo expresado por Chuaire, Sánchez y Franco (2004), existen básicamente dos métodos de clonación: la partición y la transferencia de células somáticas. Partición. En esta técnica se utilizan embriones octocelulares, en estado de preimplantación. Estos embriones son sometidos a una microcirugía que los divide, luego se toman las mitades o secciones y se introducen dentro de zonas pelúcidas naturales o artificiales. A continuación, se efectúa la implantación del producto en el endometrio. El número máximo de células del embrión, no puede ser superior a 8, porque a partir de este momento, se inicia la expresión del genoma embrionario. Los individuos obtenidos son prácticamente idénticos entre sí, aunque diferentes a los progenitores, por lo cual se considera que son el equivalente de los gemelos monocigóticos. Clonación por transferencia nuclear de células somáticas (SCNT: Somatic Cell Nuclear Transfer). En este tipo de clonación se utilizan dos tipos de células: somáticas o no sexuales, y sexuales femeninas, u ovocitos. Los núcleos de células somáticas de individuos postnatales son transferidos dentro de ovocitos o de cigotos enucleados. Esta técnica tiene la ventaja que permite conservar el genoma durante la diferenciación celular y la capacidad del citoplasma celular para reprogramar la actividad génica y aumentar la redireccionalidad de la diferenciación celular. Para clonar a un ser vivo mediante SCNT, se extrae el material genético de ambos tipos de células y, a continuación, se inyecta el núcleo de la célula somática que se desea clonar (donante), dentro del oocito previamente enucleado (receptor). El transplante de núcleos somáticos dentro de ovocitos enucleados tiene como fin reproducir los procesos bioquímicos y fisiológicos que, de manera natural, se desencadenan durante la fertilización. Fuente: www.produccionbovina.com/genetica...en.../11-clonacion.pdf Fuente: http://www.unav.es/cryf/clonacion3.png Fig. 35. Proceso de clonación. Lección 38. Técnica de clonación. Para poder lograr la clonación es necesario tener los siguientes elementos: Un núcleo que contenga la información hereditaria completa, El citoplasma de un óvulo que debe corresponder, en principio, a la misma especie que el núcleo trasplantado y Una madre receptora que anidará en su útero al embrión. Respecto al valor de la especie que anida el embrión, se debe notar que hay casos en que el útero de una especie puede anidar a un ejemplar de otra especie diferente, como el caso de una yegua que sirvió de madre huésped para una cebra, o el caso de osos pandas que pueden desarrollarse en úteros de hembras de otras especies de osos (Rojas, et al, 2004). Fuente: http://www.drogomedia.com/hemeroteka/archivos/200807254.pdf Fig. 36. Clonación por transferencia nuclear. La técnica de clonación por transferencia nuclear se llama así porque involucra transferir el núcleo (y, por lo tanto, la mayor parte del material genético) de una célula de un ser existente a un óvulo, con el fin de reemplazar el núcleo del óvulo. Este huevo, ahora un embrión, se divide por la aplicación de energía eléctrica, y es guiado por su nuevo material genético a desarrollarse como un ser que es genéticamente casi idéntico al cual se extrajo el núcleo. A continuación se explica este proceso paso a paso. Enucleación. Se toma una célula somática, mediante un proceso de microcirugía se extrae el núcleo que contiene todos los cromosomas (la información genética) Fuente: www.forodegeneticabovina.com/pdfs/03_rigali_florencia.pdf Fig. 37. Enucleación. Transferencia nuclear. Se toma un óvulo no fertilizado y se le extrae el núcleo. Fuente: www.forodegeneticabovina.com/pdfs/03_rigali_florencia.pdf Fig. 38. Transferencia nuclear. Ovocito con núcleo transferido. Mediante una microcirugía se transfiere el núcleo (la información genética). El citoplasma provee los nutrientes para el desarrollo del futuro embrión. Fuente: www.forodegeneticabovina.com/pdfs/03_rigali_florencia.pdf Fig. 39. Ovocito con núcleo. Fusión. Posteriormente se aplica una mínima corriente eléctrica para que la célula se empiece a dividir como si hubiese sido fertilizada (Electroestimulación). El ovocito se pega a las células somáticas mediante fusión eléctrica. Se espera un lapso de tres horas y después se provoca, mediante un procedimiento químico que genera la entrada de grandes cantidades de calcio, un engaño de fertilización en el óvulo. El núcleo que estaba contraído durante la fusión se dilata nuevamente y empieza a dividirse la célula, primero en dos, después en cuatro, hasta llegar a ocho (Fauba, 2007). Fuente: www.forodegeneticabovina.com/pdfs/03_rigali_florencia.pdf Fig. 40. Electrofusión. Cultivo embrionario. Las células se multiplican en un tubo de ensayo y son cultivadas durante un periodo de 7 días. Fuente: www.forodegeneticabovina.com/pdfs/03_rigali_florencia.pdf Fig. 41. Cultivo. Transferencia embrionaria. Al séptimo día es transferido el embrión en vacas receptoras sincronizadas para tal fin. Fuente: www.forodegeneticabovina.com/pdfs/03_rigali_florencia.pdf Fig. 42. Transferencia embrionaria. Avances de la clonación animal La clonación ha tenido un gran desarrollo durante los últimos años, desde que se realizó por primera vez con éxito en una oveja en el año 2007, son muchos los experimentos que se han realizado con diversos resultados en varias especies. A continuación se señalan los avances cronológicos que se han obtenido en las especies animales (Vivanco, 2009). Avance de la clonación en las diferentes especies 1997 Ovinos: La oveja “Dolly”, Escocia 1998 Vacunos: “Elsie” clon de “Lady”, NZ 1998 Ratones 1999 Caprinos 2000 Cerdos 2002 Conejo y gato 2003 Mula, Rata y Yegua (Prometea) 2004 Venado Rojo y Gato montés 2005 Perro 2006 Mink 2007 Lobo y Búfalo 2009 Camello Fuente: http://www.drogomedia.com/hemeroteka/archivos/200807254.pdf Fig. 43. Clonación en las diferentes especies. La clonación de Dolly En el año de 1997 en Escocia, se dio al mundo la noticia de la primera clonación con éxito, el científico responsable de este logro fue Ian Wilmut, quien logro la clonación de una oveja, a quien llamaron “Dolly”. Sin embargo el proceso de clonación de Dolly no fue fácil, este fue un proceso largo y complejo, resultado de decenas de experimentos en diversos laboratorios con un sinnúmero de fracasos. El primer paso fue obtener por medio de biopsia células mamarias de una oveja blanca en el tercer trimestre de preñez. Estas células fueron cultivadas in vitro y luego mantenidas durante cinco días en un medio pobre en suero para llevar el ciclo celular al borde de la apoptosis. Cada una de estas células en estado de casi hibernación fueron introducidas en un ovocito enucleado de una oveja de cabeza negra. Estos ovocitos habían sido obtenidos quirúrgicamente por perfusión de los oviductos después de una estimulación ovárica, durante la metafase II, en el momento de la ovulación. Después de aspirar el núcleo (incluso el cuerpo polar y algo de citoplasma) los ovocitos fueron puestos en cultivo a 37 °C y activados con un primer pulso eléctrico y luego fusionados con las células mamarias continuando con una serie de pulsos eléctricos, lo que permitía la formación de una nueva célula, un nuevo embrión. Mediante este proceso de obtuvieron 277 embriones, los cuales fueron introducidos en el oviducto previamente ligado de diversas hembras. Después de 6 días, 247 fueron recuperados, y de ellos únicamente 29 habían llegado a la etapa de blastocito. Estos 29 embriones fueron introducidos en el útero de 13 ovejas. En julio, un solo embrión había llegado a término, naciendo una oveja de cabeza blanca que recibía el nombre de Dolly (Dosne, 2001). Si bien el desarrollo de Dolly fue normal durante los primeros años, luego se manifestó una artritis severa a una edad precoz para su especie, y se observó, al igual que en los demás animales clonados por esta técnica, una disminución en la longitud de los telómeros. Este punto es de gran interés, ya que la longitud de los extremos de los cromosomas (los telómeros) podría funcionar como un reloj genético, lo que ha llevado a especular acerca de cual sería la edad real de Dolly. Finalmente, Dolly murió a los 6 años de edad (la vida media de una oveja es de alrededor de 12 años) debido a una afección pulmonar, sin que se haya podido establecer hasta el momento si esta enfermedad está relacionada a su origen clonal. Fuente: http://www.queciencia.com/wp-content/uploads/2007/12/01-ciencia-oveja-dolly.jpg Fig. 44. Oveja Dolly y su creador. Clonación en bovinos En el año de 1998 se dio el nacimiento del primer vacuno clonado en el mundo, el clon de la vaca Lady, en Nueva Zelanda en Agresearch/arTech Ruakura Research Station, la ternera fue llamada “Lady”. Fuente: http://www.rarebreeds.co.nz/enderby1.jpg Fig. 45. Lady, la primera ternera clonada. Posteriormente en el año 2002, se produjo el primer clon en el mundo de un toro probado, producido en Italia por el Dr. Cesare Galli en el Instituto Lázaro Spallanzani, el toro fue bautizado con el nombre de “Galileo” En el año 2002, se produjo el primer clon de un ternero en Argentina, se trató de un vacuno raza jersey, Pampa fue creada a partir de una célula somática (célula adulta) de un animal, que permitió obtener otro con idéntica información genética., A partir de este método de clonación nació luego Pampa Mansa, una vaca también de raza Jersey que porta el gen de la hormona de crecimiento humana (hGH: somatotropina) en sus células de la glándula mamaria. Fuente: http://www.pregonagropecuario.com.ar/assets/images/upload/ternera_PAMPA.jpg Fig. 46. Pampa mansa. En el año de 2008, Científicos de la Universidad de San Martín, Buenos Aires, clonaron por primera vez a un toro de raza Brangus, al que llamaron “Manuel”, producto de unas células de un toro llamado “ciruelo”. Sin embargo, este toro fué resultado de una gran cantidad de experimentos, ya que para lograr este resultado se tuvieron que implantar 20 embriones, de los cuales se lograron cinco preñeces, sin embargo, se presentaron 2 pérdidas embrionarias tempranas antes del día 60, posteriormente al día 120, solo habían dos preñeces y al octavo mes, sólo una, luego al día 280 de gestación se realizó la cesárea y se obtuvo el nacimiento del primer clon argentino. En la actualidad en Argentina, la empresa de biotecnología animal y vegetal Goyaike ya tiene 16 toros clonados de pedigrí con fines productivo en su propio rodeo y día a día se especializa más en brindar servicios de clonación a terceros, abriendo así el mercado de a compra y venta de ADN. Fuente: http://d.yimg.com/i/ng/ne/afp/20090708/09/3810366514-argentina-clona-mundo-toro-raza-brangus.jpg Fig. 47. Manuel En Chile en al año 2008, fue producido el primer bovino chileno a través de técnicas de clonación, una hembra de nombre "Victoria", enmarcado dentro de un proyecto impulsado y cofinanciado por la estatal Fundación para la Innovación Agraria (FIA) y por investigadores de la Facultad de Medicina Veterinaria de la Universidad de Concepción . Fuente: http://www.perulactea.com/panel/noticias/gallery/040808145terneroclon%20chil e.jpg Fig. 48. Victoria Clonación en equinos. En el año 2003, científicos italianos, lograron la primera clonación en equinos, una yegua a la que llamaron "Prometea", la yegua fue creada en el Laboratorio Especial de Técnicas Reproductivas de Cremona, en el sur de Italia. La madre nodriza de Prometea es a la vez la vez donante de las células para la producción de Prometea, es decir es su madre nodriza y su “original” de Prometea. Fuente: http://www.diariodenavarra.es/actualidad/20030806/culturaysociedad/culturaysociedad50_300.jpg Fig. 49. Prometea y su progenitora. Clonación en caninos. En Agosto del año 2005, el investigador Woo Suk Hwang, doctor en Medicina Veterinaria y Filosofía, exdirector del Departamento de Teriogenología y Biotecnología del Colegio de Medicina Veterinaria en la Universidad Nacional de Seaul, Corea del Sur, fue el primer científico en lograr la clonación de un perro de raza Afgano, llamado Snuppy. Aunque dos estudios de Hwang sobre células embrionarias humanas posteriormente resultaron ser falsos, Snuppy sí era un clon auténtico. El perrito clon se llama Snuppy, por su abreviatura de Seúl National University Puppy, es decir: cachorro de la Universidad Nacional de Seúl, la "maternidad" donde nació. Sin embargo, es importante señalar que más de mil embriones transferidos a 123 recipientes, sólo Snuppy sobrevivió. Uno terminó en aborto, y otro murió de neumonía a los 22 días de vida. Los investigadores no relacionaron esa dolencia con el hecho de que haya nacido por clonación. Fuente: http://greatdane.lt/var/greatdane/storage/images/media/images/snuppy/36113-1-lit-LT/Snuppy.jpg Fig. 50. Snuppy Posteriormente, en el año 2008 un cachorro labrador de 10 meses fue clonado por una empresa californiana en Corea del Sur, para una pareja estadounidense, constituyéndose en la primera clonación comercial del mundo. La empresa responsable de este proceso fue BioArts International en San Francisco, y el responsable del servicio de clonación, fue Lou Hawthorne. En este mismo año, Hawthorne clonó a su propia perra: Missy, una mezcla de border collie y husky, que había muerto en 2002 a los 15 años, con su material genético congelado se crearon tres hermanos, los tres cachorros se parecían a Missy y heredaron sus características, de acuerdo con Hawthorne. Hawthorne en 1997, luego del éxito en la clonación de la oveja Dolly, compró al equipo de Dolly la licencia mundial para clonar perros y gatos., en este sentido, en el año 2004 la firma de biotecnología de Hawthorne, llamada entonces Genetic Savings and Clone, inicio la clonación de gatos a pedido, por un valor cercano a los 50.000 dólares. Sin embargo, dos años después la empresa tuvo que cerrar porque el procedimiento no era rentable económicamente. Fuente: http://misionlandia.com.ar/blog/mascotas/files/perro-clonado.jpg Fig. 51. El primer cachorro clonado comercial. Fuente: http://www.elmundo.es/elmundo/2009/04/29/ciencia/1241005919.html Fig. 52. Caninos clonados. En Corea del sur, el año 2009 en un grupo de científicos consiguieron clonar cuatro perros transgénicos (de la raza beagle) cuya piel brilla con un color rojo fluorescente. El objetivo del experimento es demostrar la utilidad de esta técnica en la investigación biomédica. Los cuatro cachorros de beagle tienen la misma apariencia que cualquier otro beagle a la luz del día. Sin embargo, bajo rayos ultravioleta, brillan en la oscuridad con un tono rojizo, y tanto sus uñas como su vientre tienen este color incluso bajo una luz normal. Según el profesor Lee Byeong-chun, de la Universidad Nacional de Seúl, que ha dirigido al equipo científico responsable del experimento, asegura que se trata de los primeros perros transgénicos del mundo a los que se les ha implantado genes fluorescentes (El mundo, 2009). Clonación en ratones. En el año de 1998, los científicos japoneses Teruhiko Wakajama y Ryouzo Yanagimachi, de la Universidad de Hawai, presentaron al mundo unos ratones clónicos, y lo han logrado mediante un técnica distinta a la que utilizaron los investigadores del Instituto Roslin para crear a "Dolly". El primer ratón (que nació en octubre de 1997) fue bautizado como "Cumulina", se trasnfirieron mas de 800 embriones, sin embargo solo fue posible la obtención de un pequeño grupo de hembras de ratón sanas (10 ratones). Lección 39. Transgénesis Normalmente, en los organismos superiores animales o vegetales la información genética se transmite por mecanismos de reproducción sexual; es lo que se conoce como transmisión genética vertical. Sin embargo, hace aproximadamente treinta años se logró obtener los primeros ratones transgénicos mediante transferencia génica por inyección directa de ADN extraño en un cigoto obtenido por fecundación in vitro; es decir, se trataba de una transmisión genética horizontal, también llamada transgénesis. La transgénesis se puede definir como la introducción de ADN extraño en un genoma, de modo que se mantenga estable de forma hereditaria y afecte a todas las células en los organismos multicelulares. Generalmente, en animales, el ADN extraño, llamado transgen, se introduce en zigotos, y los embriones que hayan integrado el ADN extraño en su genoma, previamente a la primera división, producirán un organismo transgénico; de modo que el transgen pasará a las siguientes generaciones a través de la línea germinal (gametos) (Lacadena, 2002) Los estudios experimentales fueron iniciados por Gordon y Ruddle en 1980 (Lacadena, 2002) en los mismos inyectaron ADN de ratón en uno de los pronúcleos de un cigoto de la misma especie. En 1981, Gordon y Ruddle demostraron la integración y transmisión estable a través de la línea germinal de genes inyectados en pronúcleos de cigotos de ratón obtenidos por fecundación in vitro, desarrollando así los primeros ratones transgénicos. El paso siguiente consistió en probar que también se podían obtener ratones transgénicos que incorporaran en su genoma un gen (transgén) de otra especie. Así, Palmiter en el año de 1982 obtuvieron ratones transgénicos gigantes al inyectar en el pronúcleo de un cigoto el gen de la rata que codifica para la hormona del crecimiernto. Incluso, se obtuvieron también ratones transgénicos gigantes cuando el transgén introducido era el gen humano que codifica para la hormona de crecimiento (Lacadena, 2002). La transgénesis comprende la introducción de ADN exógeno en el genotipo de un animal, esta es una herramienta importante tanto para la agricultura, como para la farmacología, la biomedicina y la biotecnología. Una gran variedad de métodos han sido desarrollados para introducir ADN, entre ellos la inyección de ADN en embriones y la transfección de células somáticas seguidas del transplante nuclear o clonación (Salamone, 2005). Lección 40. Técnicas de obtención de animales transgénicos Las técnicas de obtención de animales transgénicos son: Microinyección de ADN en núcleo de ovocito Vectores virales o retrovirus Manipulación de células embrionarias Técnicas: Transgénesis por microinyección de ADN en núcleo de ovocito: Es una técnica fácilmente aplicable a una variedad de especies, el inconveniente radica en que el gen se inserta al azar en el genoma y que solo el 5% de los ovocitos dan lugar a un animal transgénico vivo. Par realizar la téncia en primer lugar se induce la superovulación en la hembra, a nivel del laboratorio se hace la fertilización in vitro. Se inyecta el nuevo gen en el núcleo del ovocito, posteriormente los ovocitos son reintroducidos en hembras receptoras, sin embargo, el porcentaje de embriones que sobreviven es muy bajo. Por último, tras el destete de los recién nacidos, éstos se chequean, para ver si ha ocurrido la incorporación del transgén. Transgénesis por Retrovirus: Mediante esta técnica se consigue que el trasgen esté presente en todas las células de individuo transgénico, sin embargo el gen también se inserta al azar. Cabe la posibilidad de que el retrovirus usado como transporte se reproduzca en el organismo transgénico dando lugar a la presentación de enfermedades. El proceso consiste en elegir un virus benigno y atenuarlo hasta eliminar su carga viral, se inserta en el virus el transgen que se desea introducir. El virus actúa como medio de transporte, cuando el virus comienza a replicarse al interior de las células se libera el transgen. Transgénesis por manipulación de células madre embrionarias: Este método es el menos aleatorio y se utiliza cuando es importante dirigir las secuencias genéticas a lugares específicos del genoma. Cuando las células están en cultivo es posible llevar a cabo modificaciones genéticas especificas como la eliminación o sustitución de un gen, por lo tanto se tiene la célula madre transgénica, y se realiza la respectiva modificación. Las células modificadas son inyectadas en embriones en fase de blastocisto, los individuos resultantes portan el gen transferido solo en un porcentaje de sus células. Avances en transgénesis Los fines que pretende la transgénesis, es la creación de animales genéticamente superiores, con diversos fines: animales para producción comercial, animales resistentes a enfermedades, animales gigantes, animales con fines terapéuticos (animales productores de medicamentos o donantes de órganos, animales pharming). El uso principal de la transgénesis en los animales ha sido su utilización como “laboratorios vivientes” para la producción de medicamentos, en tal sentido, los animales son utilizados como biorreactores para producir proteínas y sustancias biológicas de interés para la salud humana, las cuales son segregadas en la leche por el ganado. Por tal razón, en Estados Unidos, a las granjas de experimentación con animales transgénicos se les ha empezado a llamar "pharms", haciendo un juego de palabras que intercambia el significado original de la palabra granja (granja en inglés se dice "farm") por el de "pharmacy" (que quiere decir farmacia). Y es que una de las aplicaciones de la transgénesis. En el año 1990 en el Instituto Roslin de Escocia se creó la primera oveja transgénica, a cual segregaba alfa-1antitripsina en su leche. Esta enzima es empleada en el tratamiento del enfisema pulmonar, una enfermedad que suele tener carácter hereditario y que afecta a las fibras elásticas de los pulmones. La leche de estas ovejas contiene hasta un 30% de alfa-1-antitripsina, una sustancia que también se encuentra en experimentación en los Laboratorios PPL para el tratamiento de la fibrosis quística, luego esta enzima es aislada a nivel del laboratorio. La elaboración de productos farmacéuticos es uno de los resultados más visibles de las investigaciones con animales transgénicos, pero la mayor parte de este tipo de animales se destina a la investigación básica. Los ratones transgénicos, por ejemplo, han aportado una nueva visión a los científicos sobre cómo funciona el sistema inmune, el cerebro, la memoria, la formación de órganos y han sido especialmente valiosos en oncología (Lacadena, 2002). En el año 2002, en Argentina se logró la clonación de Pampa Mansa, una vaca Jersey a la cual se le agregó un gen para la producción de hGH (Somatotropina humana), por lo cual produce grandes cantidades de la hGH en su leche. Por otro lado, durante los últimos años los estudios en transgénicos se han enfocado hacia la producción de animales para consumo, el objetivo es introducirles genes que induzcan el crecimiento mayor, con menos cantidad de grasa y resistencia a las enfermedades, entre otros aspectos. Dentro de este marco, en el año 2006 se logró el nacimiento de algunos lechones con producción de ácidos omega 3, benéficos para la salud humana. Para obtener estos animales transgénicos, los investigadores transfirieron al núcleo de las células madre un gen llamado fat-1, responsable de la producción de una enzima que transforma en omega-3 los ácidos grasos omega-6, menos beneficiosos pero más comunes. Luego se usó el método de clonación empleado en 1996 con la oveja Dolly. De 1.633 embriones implantados en 14 cerdos, nacieron vivos 10 lechones, de los cuales seis tenían el gen fat-1 (Carletti, 2006). El 28 de mayo de 2009, en la revista Nature, científicos japoneses informaron la creación de micos tití transgénicos. Estos primates se incorporó un transgen de proteína verde fluorescente en la línea germinal y se logro la trasmisión en la descendencia, constituyéndose un gran avance para estudiar las enfermedades humanas y las posibles terapias (Margawati, 2009). Tabla 16. Avances de la transgénesis. MAMÍFEROS TRANSGÉNICOS: ANTECEDENTES Y CRONOLOGÍA 1938: Spemann propone experimento de transferencia nuclear 1949: Hammond mantiene embriones de ratón en cultivo in vitro 1961: Tarkowski obtiene ratones quiméricos agregando embriones 1966: Lin describe la técnica de microinyección de embriones de ratón 1980: Gordon, Ruddle y col. obtienen los primeros ratones transgénicos por microinyección de ADN en el pronúcleo de cigotos de ratón 1981 Gordon y Ruddle obtienen ratones transgénicos por microinyección de ADN en el pronúcleo de cigotos de ratón 1981: Evans y Kaufman obtienen células embrionarias totipotentes de ratón 1982: Palmiter y col. obtienen ratones transgénicos gigantes mediante transgenes de la hormona del crecimiento de la rata 1983 Palmiter y col. obtienen ratones transgénicos gigantes mediante transgenes de la hormona de crecimiento humana 1983: McGrath y Solter desarrollan una nueva técnica para experimentos de transferencia nuclear en ratón 1985: Hammer y col. obtienen animales de granja transgénicos (conejos, ovejas, cerdos) con el transgén de la hormona del crecimiento humano 1987: Thomas y Capecchi obtienen los primeros ratones knockout por recombinación homóloga 1989 Clark y col. obtienen ovejas transgénicas con el gen humano del factor IX de coagulación de la sangre mediante microinyección de ADN en el pronúcleo del cigoto 1991 Wright y col. obtienen ovejas transgénicas con el gen humano de la a -1antitripsina mediante microinyección de ADN en el pronúcleo de cigotos 1991 Ebert y col. obtienen cabras transgénicas con el gen AtPH humano (activador tisular de plasminógeno) mediante microinyección de ADN en pronúcleo de cigoto 1991 Krimpenfort y col. obtienen vacas transgénicas con el gen humano de la lactoferrina mediante microinyección de ADN en el pronúcleo de cigotos 1993: Nagy y Rossant obtienen ratones quiméricos por co-cultivo de embriones 1993: Schedl y col. obtienen ratones transgénicos con cromosomas artificiales de levaduras 1994: Brinster y col. obtienen ratones transgénicos por transplante de espermatogonias 1996: Campbell y col. obtienen ovejas clónicas por transferencia nuclear de células embrionarias en cultivo 1997: Wilmut y col. obtienen ovejas clónicas por transferencia nuclear de células diferenciadas fetales y adultas en cultivo 1997: Schnieke y col. obtienen ovejas clónicas transgénicas por transferencia nuclear a partir de células fetales diferenciadas 1998: Cibelli y col. obtienen vacas clónicas transgénicas por transferencia nuclear a partir de células fetales diferenciadas 1999 Baguisi y col. obtienen cabras transgénicas por transferencia nuclear 1999 Yanagimachi y col. obtienen ratones transgénicos mediante la co-inyección de cabezas de espermatozoides y ADN exógeno 2000 Marcación genética en ovejas 2002 Adición artificial de un cromosoma en una vaca (vaca trans-cromosómica) 2002 Se creó en Argentina, la vaca Pampa Mansa, la cual tiene un gen para la producción de Somatotropina. 2003 Obtención de cerdos transgénicos vía inyección lentiviral (Transferencia del trasngen dentro del zigoto) 2009 Científicos clonaron por primera vez perros transgénicos de color rojo fluorescente 2009 Científicos japoneses informaron la creación de micos tití transgénicos Fuente: Lacadena, 2002 CAPITULO 3. SEXAJE DE SEMEN, QUIMERAS, ICSI, CELULAS MADRE Lección 41. Aspectos generales. La biotecnología ha desarrollado herramientas muy útiles que permiten mejorar la eficiencia reproductiva de las explotaciones. Hoy, es fácil decidir que sexo va a tener la próxima cría de nuestro hato, utilizar reproductores de alta genética que presentan problemas de infertilidad y próximamente producir células madre con destino a la regeneración de tejidos específicos o producir animales con destino a la donación de órganos todo esto gracias a la biotecnología reproductiva. El mundo científico no se detiene, y mientras leemos esto un nuevo descubrimiento tiene la ciencia para nosotros. Así que aprovechemos de manera racional las herramientas que la biotecnología trae para mejorar la eficacia de las explotaciones pecuarias. Lección 42. Sexaje de semen. La producción de semen sexado es una realidad que ya se encuentra disponible comercialmente. Hoy en día es posible decidir el sexo que va a tener el nuevo ser antes de producirse la fecundación, algo que hasta hace menos de 20 años parecía un imposible. Así se podrá decidir el semen a utilizar de acuerdo con la finalidad de la explotación, en el caso de ganadería lechera, se querrá obtener hembras para reemplazo, al contrario en las explotaciones de ganadería de carne, se preferirá la obtención de machos para engorde. Pero, como se puede realizar esta técnica? es un procedimiento algo complejo: las células reproductivas femeninas aportan un cromosoma “X” y el espermatozoide puede aportar un cromosoma “X” o un cromosoma “Y”, por ende el espermatozoide es el que determina el sexo de las crías en los mamíferos. En este sentido, para que se produzca una hembra (XX) deberá un espermatozoide “X” fertilizar el óvulo. Por el contrario, si fuera el espermatozoide con cromosoma “Y” el que lo fertilizara, se produciría un macho (XY) (Velasco, 2004). Se estima que aproximadamente la mitad de los espermatozoides portan cromosoma “X” y la mitad “Y”, por lo tanto se obtiene aproximadamente un 50% de nacimientos por cada sexo El objetivo de esta biotecnología, es modificar esa proporción, y obtener animales de un determinado sexo, de acuerdo con los objetivos de la explotación. La técnica utilizada en la obtención del semen sexado es denominada: “citometría de flujo”, esta técnica fue desarrollada por Dr Johnson, y se fundamenta en las diferencias de ADN expuestas para hacer dicho sexaje (el espermatozoide de toro que contiene el cromosoma “X” tiene 3.8% más ADN que el que contiene el cromosoma “Y”). . La técnica consiste en primer lugar en una tinción que se hace a los espermatozoides con una solución fluorescente (con Hoechst 33342), por 45 minutos, lo cual hace que este tinte se una al ADN cuantitativamente. El espermatozoide “X” produce 3.8% más fluorescencia azul cuando es expuesto a un láser de cierta longitud de onda. El semen se separa razón de 90,000 gotas/segundo con un espermatozoide c/u, pasando a través de una boquilla muy fina a 100 Km./h. Los “X” se cargan positivamente y los “Y” negativamente. Los espermatozoides muertos y aquellos que no han podido ser sexados no son cargados. Los espermatozoides corren a través de placas cargadas, los “Y” son atraídos a la placa positiva, los “X” a la negativa, y las gotas sin carga son descartadas. Fuente: http://www.chemometec.com/global/files/file_12.jpg Fig. 53. Citómetro de flujo. Fue desarrollado en al año de 1970. Algunos de los avances que se han dado gracias esta técnica son: En el año de 1992, en Cambridge nace la primera ternera producida por fertilización in vitro y semen sexado, posteriormente hacia el año 1995, en la Colorado State University, nace la primera ternera producida por Inseminación artificial y semen sexado. En el año 2001, nace la primera ternera lechera con la utilización de semen sexado en Suiza. En el año 2001, en Sydney (Australia) nacen las primeras corderas, mediante la utilización de semen sexado (Velasco, 2004). Del computador al cargador de gotas Al computador Fuente: http://edis.ifas.ufl.edu/LyraEDISServlet?command=getScreenImage&oid=1746729 Fig. 54. Citometría de flujo en la producción de semen sexado. Una de las desventajas que presenta esta técnica es su elevado valor comercial, lo cual dificulta su aplicación en todas las explotaciones animales. Sin embargo, durante los últimos años se ha difundido mucho esta técnica, logrando la disminución de su valor y facilitando la consecución de semen sexado a precios accequibles. Lección 43. Producción de quimeras. Una quimera es un animal que tiene características de dos o más especies. La quimera se origina por la mezcla de células provenientes de especies diferentes y posee las características de los dos individuos que genéticamente lo originan. Las quimeras son aquellas logradas por métodos experimentales de manipulación embrionaria y pueden ser de diferentes especies o de una misma especie (Rojas, et al, 2004). De acuerdo con algunos autores se pueden diferenciar dos clases de quimeras: Primarias: aquellas naturales o artificiales que desde los estadios embrionarios presentan dos poblaciones celulares genéticamente diferentes Secundarias: aquellas en las que los tejidos u órganos de dos fetos o adultos diferentes se combinan. Un ejemplo de las quimeras secundarias es el caos de los trasplantes de órganos, en los que un órgano de la misma o de otra especie es introducido y se incorpora en el cuerpo de un animal. Tal como lo plantea Rojas y col. (2004) las primeras quimeras fueron desarrolladas en 1920, en el laboratorio de Hans Spemann por fusión de embriones tempranos de anfibios, pero los primeros experimentos que desarrollaron quimeras en mamíferos, se realizaron en la década de los años 60 y fueron logrados por Beatrice Mintz, empleando métodos de micromanipulación de embriones. Beatrice Mintz utilizó mórulas provenientes de cruzamientos de parejas de conejos albinos y también mórulas de parejas de conejos negros. Las mórulas fueron separadas de la zona pelúcida mediante tripsina, y luego fueron fusionadas. El blastocisto gigante resultante se colocó en el útero de una madre receptora, que había sido hormonalmente tratada para simular una gestación. El resultado fueron crías con cuatro padres (tetraparentales), que presentan una cubierta de pelos formada por manchones de pelo blanco y manchones de pelo negro. Más tarde, se produjeron de la misma forma quimeras en conejos y ovejas. Este método se emplea habitualmente cuando se fabrican los animales knock-out, los cuales pueden ser considerados también como quimeras. Pero no cabe duda de que dentro de las quimeras de mamíferos, el caso mas interesante ha sido el de la oveja-cabra creada en Cambridge (Inglaterra) por Fehilly y Willadsen. Estos investigadores utilizaron blastocistos de cabra y oveja. El embrioblasto de cabra fue introducido dentro del blastocisto de una oveja. El embrión así formado formado fue transferido a una oveja receptora. El animal que nació mostró una mezcla de ambas especies: lo más destacado fue su pelaje que presentaba las características de ambas especies: y sus cuernos que tenían la forma de los de la cabra, pero que aparecían enroscados como los de oveja. Asimismo, su sangre contenía células de ambas especies. Existían en este animal otras características interesantes, como que se parecía físicamente más a una cabra, aunque prefería la compañía de las ovejas. También el análisis de sus proteínas mostró que poseía características de ambas especies, pero que predominaban las de oveja. Respecto a su comportamiento reproductivo, demostró ser fértil aunque era capaz sólo de copular con ovejas. Los estudios realizados con quimeras son de gran interés para analizar el proceso embriológico, ya que se pueden fabricar quimeras utilizando embriones de diferentes edades. Por ejemplo, cuando se mezcla un embrión de cuatro células con uno de ocho, esta última forma el embrión, mientras el de cuatro células forma el trofoblasto. Al respecto, se debe notar que el trofoblasto es el que interactúa con el útero materno, por lo tanto, esta técnica podría ser usada potencialmente para producir transferencias embrionarias entre especies diferentes (Rojas, et al, 2004). Lección 44. Inyección intracitoplasmática de semen. La inyección intracitoplasmática de espermatozoides (ICSI) es una técnica que fue desarrollada en el año 1992, consiste en seleccionar un espermatozoide e inyectarlo directamente dentro del óvulo. Esta técnica se ha empleado a nivel de la medicina humana para problemas de infertilidad, en aquellos casos, en donde los espermatozoides no tienen la capacidad de penetrar al interior del ovocitos, o en caso de azoospermia. Sin embargo, en los últimos años se han realizado estudios experimentales para su implementación a nivel de la producción animal. Fuente: http://www.brusselsivf.be/user_docs/hi storiek/28)ICSI.jpg Fig. 55. Inyección del espermatozoide. Los pasos que involucra la ICSI son: 1. Estimulación de la ovulación 2. Aspiración folicular 3. Obtención de espermatozoides 4. Fecundación o fertilización 5. Transferencia embrionaria La ICSI es una herramienta con gran potencial aplicativo en diversos campos de la producción animal, entre los que destacan la producción de animales transgénicos de interés en ganadería o biomedicina, y la recuperación de razas en peligro de extinción. En la actualidad existen referencias de obtención de descendencia viva mediante esta tecnología en diversas especies, sin embargo, el rendimiento aún es muy bajo, posiblemente debido al desconocimiento de las condiciones idóneas para el desarrollo de la misma, y la dificultad de los cigotos para alcanzar el estadio de blastocisto in vitro (García, 2005). Ovocito sujetado Fuente: http://www.pacificfertilitycenter.com/images/lab_icsi_process_fig3.gif Fig. 56. ICSI De acuerdo a lo reportado por Lossino y Aguilar (2002), en el año de 1997 se reporto el nacimiento del primer potrillo obtenido por ICSI, con oocitos maduros recuperados de ovarios de una yegua post-mortem. Posteriomente, en marzo de 1998, McKinnon y col. (Citado por Lossino y Aguilar, 2002) en Australia, comunicaron el nacimiento de un potrillo también obtenido por ICSI, pero con oocitos maduros aspirados de una yegua, transportados refrigerados 200 km al laboratorio de la Universidad, fertilizados y mantenidos "in vitro", luego transportados nuevamente a una clínica y transferidos al oviducto de una receptora. En ese mismo año, investigadores de la Universidad de Louisiana reportaron el nacimiento de 2 potrancas producto de oocitos inmaduros colectados por aspiración transvaginal de yeguas preñadas, madurados "in vitro", fertilizados por ICSI y transferidos quirúrgicamente a una receptora. Lección 45. Producción de células embrionarias primarias pluripotenciales) madre embrionarias (Células Las células embrionarias primordiales pluripotenciales son células indiferenciadas derivadas del embrión en estadio temprano capaces de proliferar in vitro en forma indiferenciada e ilimitada, estas mantienen la habilidad de diferenciarse en todos los tipos celulares (Prelle y Wolf, 2001). De acuerdo lo expresado por Flores y Paniagua (2006), existen cuatro niveles de células madre: 1) las células madre embrionarias totipotenciales, 2) las células madre pluripotenciales, 3) las células madre multipotenciales y 4) las células madre progenitoras unipotenciales. El primer nivel, corresponde a las células más primitivas, producto inmediato de la fecundación con capacidad de diferenciarse hacia todos los tejidos que forman los órganos de un organismo. Las células del segundo nivel se desarrollan aproximadamente en el cuarto día de la fertilización y pueden diferenciarse a cualquier tipo celular, excepto a células totipotenciales y de la placenta. El tercer nivel celular se encuentra en la circulación periférica de un recién nacido y pueden ser recuperadas de sangre de placenta colectada del cordón umbilical. El cuarto nivel celular puede originar solamente un tipo celular, por ejemplo, una célula progenitora eritroide de diferencia solamente a eritrocito, generando células terminales. Las células madre embrionarias totipotenciales, solamente se pueden obtener durante los primeros cuatro días después de la fertilización, justo en el momento en el que el cigoto se ha constituido como mórula para comenzar el proceso de segmentación de 2 hasta 32 blastómeros (68 h), organizándose en una capa periférica denominada trofoblasto (Flores y Paniagua, 2006). Fuente: http://juanv.files.wordpress.com/2008/01/ stemcells2-gif.gif Fig. 57. Producción de células madre Actualmente, son muchos los laboratorios en todo el mundo que trabajan para obtener células totipotenciales embrionarias. Estas células son llamadas así porque tienen la potencialidad de originar todos los tipos celulares que existen en el cuerpo y se han convertido en una esperanza terapéutica para muchas enfermedades tanto del hombre como de los animales. Las células madres embrionarias son las únicas capaces de autorrenovarse y diferenciarse en muchas líneas celulares. Algunos tejidos adultos de mamíferos conservan también células madres, pero éstas son capaces de generar sólo un número limitado de tipos celulares. Las células madres obtenidas de embriones en la etapa de blastocisto tienen la capacidad de formar todas las células del cuerpo, porque mantienen el cariotipo normal, y una alta actividad telomerasa, además, logran en cultivo, un notable potencial de proliferación durante un largo período de tiempo, dando la posibilidad de una expansión ilimitada. Las células madres se obtienen del embrioblasto de un blastocisto y deben cultivarse “in vitro” para obtener líneas de células pluripotenciales. Estas células madre pueden seguir los siguientes dos caminos, dependiendo del medio de cultivo que se utilice: a) Mantenerse en un estado indiferenciado y b) Diferenciarse en líneas celulares más específicas, por ejemplo cardíacas, neurales, sanguíneas, etc. Es importante señalar que la investigación relacionada con células madres embrionarias se ha desarrollado ratones de laboratorio y algunos otros animales como conejos, ovejas y vacas. BIBLIOGRAFIA Albeiro, Ricardo (2001). Manejo de donantes y receptoras. Biotecnología de la Reproducción, INTA, Argentina, 2001. Alvarado, Javier (2008). Historia de la Inseminación artificial. Disponible en: http://javieralvaradomoreno.googlepages.com/articulosinteresantes. Ángeles, Marín, Álvaro (1999). Por qué y cómo sincronizar el celo en cerdas Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Barañao, Lino (2007). Biotecnología en Reproducción animal. Departamento de Fisiología, Biología Molecular y Celular. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. Becaluba, Facundo (2007). Métodos de sincronización de celo en bovinos. Bedoya, Cedeño Carlos; Hinojosa, Gustavo; Bedoya, Eduardo; González Eduardo; Arroyo, Edith; Chaves, Arturo y González Ezequiel (2005). Inseminación artificial en ovinos. Facultad de Medicina Veterinaria y Zootecnia. Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. Billanova, Lourdes y Ballalares, Pedro pablo (2008). La evaluación andrológica: justificación y métodos. Disponible en: http://avpa.ula.ve/docuPDFs/libros_online/manual-ganaderia/seccion6/articulo18s6.pdf Bó, Gabriel Almicar (2006). La Función Ovárica en las Terneras Prepúberes y Peripúberes. Disponible en: http://www.sinervia.com/library_files/1857887697_Dinamica%20folicular.pdf. Bó, Gabriel; Moreno, Dolores; Cutaia, Lucas; Caccia Mariana; Tribulo, Humberto y Tribulo, Ricardo (2002). Transferencia de embriones a tiempo fijo: tratamientos y factores que afectan los índices de preñez. Disponible en: produccionbovina.com.ar/.../92-metodos_sincronizacion.htm Bolívar P.A y Maldonado Estrada J.G. (2008). Análisis de costos de esquemas de transferencia de embriones bovinos utilizados en Colombia. Revista Colombiana de Ciencias Pecuarias 2008; 21:351-364 Ben G.A.; Goitia O.E; Mujica I.F (2006). Inseminación artificial a tiempo fijo: Manuel de procedimientos. Disponible en: http://www.imperiorural.com.ar/imperio/estructura/miriam%20archivos/Bovinos/ma nual_inseminacionartificialatfijo.htm Cáceres Cercamo, Walkiria Gissela (2008). Evaluación de la inseminación artificial intracervical y poscervical con semen congelado en cerdas multíparas. Disponible en: http://zamo-oti-02.zamorano.edu/tesis_infolib/2008/T2555.pdf Calier (2008). Pluset: Superovulación. Laboratorios Calier, S.A. – Registro Mercantil de Barcelona, Hoja nº 14.156, Folio 82, Tomo 1650, Libro 1.076, Sección 2ª, Inscripción 2ª. – C.I.F. a-08-226128. Calle, Jonathan; Corrales Juan David; Yepes Sergio Alejandro; Cañas Jhon Jacobo, Ramírez, Julián y Mesa Carolina (2006). Inseminación intrauterina profunda en cerdos. Facultad de Ciencias Agrarias, Universidad de Antioquía. Disponible en: kogi.udea.edu.co/.../inseminacion%20intrauterina%20profunda.doc. Campos, Fernando (2007). Trasplante de embriones en equinos. Disponible en: http://www.engormix.com/_que_es_transplante_s_articulos_519_CAB.htm Carletti, Eduardo (2006). Crearon cerdos transgénicos clonados, sanos como el pescado. Disponible en: http://axxon.com.ar/not/160/c-1600275.htm Celestinos, M y Gatica, R (2002). Vitrificación como técnica de crioconservación de embriones bovinos. Arch. Med. Vet. XXXIV, Nº 2, 2002 CENIAP (1999). Técnica de inseminación artificial en bovinos. Disponible en: http://www.ceniap.gov.ve/pbd/Monografias/cdinsebovinos/bovinos/contenido/tecnic adeinseminacioni.htm Chenowet, P.J (2003). Impulso sexual del toro y comportamiento reproductivo. Large Animal Clinical Sciences, College of Veterinary Medicine, Kansas State University, Manhattan, Kansas, USA. Traducido por C. Jiménez Escobar, Fac. de Medicina Veterinaria y de Zootecnia, Univ. Nacional de Colombia, Bogotá. Disponible en: http://www.ivis.org/advances/Repro_Chenoweth/chenoweth_es/IVIS.pdf Cutaia, Lucas (2006). Inseminación artificial a tiempo fijo (IATF): una herramienta para el mejoramiento genético. Instituto de Reproducción Animal Córdoba; Universidad Católica de Córdoba, Argentina. Cutaia, Lucas (2006). Inseminación Artificial a Tiempo Fijo en Rodeos Lecheros: Diferentes Estrategias de Implementación. Disponible en: http://www.repromax.com.mx/informesTecnicos/Manejo-Reproductivo-en-RodeosLecheros.pdf Chuaire, Lilian; Sánchez, Magda Carolina y Franco, María Liliana (2004). Clonación animal: avances y perspectivas. En: Revista Colombia médica, ISSN 1657-9534. Cyagra (2008). Fertilización in vitro. Disponible en: http://www.cyagra.cl/invitro.html De Luca, Leonardo (2007). http://www.produccionbovina.com/ Método de transplante. Disponible en: Del campo, Marcelo (2000). Transferencia de embriones. Disponible en: http://monografiasveterinaria.uchile.cl/CDA/mon_vet_completa/0,1421,SCID%253 D7958%2526ISID%253D419,00.html De los Reyes, Mónica (1994). Fecundación in vitro en bovinos: Avances en el manejo de gametos. Avances de Medicina Veterinaria, Vol.9, N°1, Enero-Junio, 1994 Dosne, Cristiane (2001). Clonación. Medicina - Volumen 61 - Nº 1, 2001. Academia Nacional de Medicina de Buenos Aires. Disponible en: http://www.medicinabuenosaires.com/revistas/vol61-01/1/clonacion.htm Embrios (2008). Definición y tipos de células madre. Disponible http://www.embrios.org/celulasmadre/definicion_celula_madre.htm en: El mundo (2009). Científicos surcoreanos clonan perros transgénicos de color rojo fluorescente. Disponible en: http://www.elmundo.es/elmundo/2009/04/29/ciencia/1241005919.html Espinoza Villavicencio, José Luis ; Pérez, Ricardo Ortega ; Espinosa, Alejandro Palacios ; Méndez, Javier Valencia ; Flores, Carlos Fernando Arechiga (2007). Ovarian follicular growth in domestic animals: a review. COPYRIGHT 2007 Interciencia Association. Evangelista, S; Cordero, A; Santiani, A; Vásquez, M; Huanca T; Cárdenas, O Y Huanca, W (2007). Efecto del tratamiento con progesterona-eCG sobre la calidad embrionaria en llamas. APPA - ALPA - Cusco, Perú, 2007. Fauba (2007). Clonación animal. Fauba - www.agro.uba.ar. Fernández Tubino, Álvaro (2003). Dinámica folicular: Funcionamiento y regulación. Departamento de Reproducción Animal, Facultad de Veterinaria, Montevideo, Uruguay. Disponible en: http://www.produccionbovina.com/informacion_tecnica/inseminacion_artificial/23ondas_foliculares.htm. Fernández, Adriana; Bastidas, Pedro y Trocóniz, Juan (1997). Fertilización in vitro de ovocitos recolectados de vacas cebú postmortem. Universidad Central de Venezuela, Facultad de Ciencias Veterinarias, Instituto de Reproducción Animal e Inseminación Artificial. Apartado Postal 4563, Maracay, Estado Aragua, Venezuela. Arch. Latinoam. Prod. Anim. 5(Supl. 1): 324-325 (1997) Flores, Fernando y Paniagua, Jorge (2006). Las células madre embrionarias totipotenciales. Disponible en: http://www.medigraphic.com/espanol/e-htms/efacmed/e-un2006/e-un06-6/em-un066d.htm García Roselló, Empar (2005). Análisis de diferentes factores que afectan al rendimiento de la inyección intracitoplasmática de espermatozoides (ICSI) en la especie porcina. Disponible en: www.tesisenxarxa.net/TDX/TDR_UM/TESIS/...//egr02de10.pdf Gigli, I, Russo, A. y Aguero, A (2006). Consideraciones sobre la dinámica ovárica en equino, bovino y camélidos sudamericanos. InVet (B. Aires), ene./dic. 2006, vol.8, no.1, p.183-204. ISSN 1668-3498. Guzmán, Alba Cielo; Barrera, Carlos; Gómez, Adriana; Patiño, Marina; Preciado, Johana y Gómez, Joaquín (2008). Transferencia de embriones: conceptos básicos y aplicaciones actuales, presentación curso Reproducción Animal Avanzada, UNAD, Colombia. Henao R, Guillermo y Trujillo A, Luis Emilio (2000). Establecimiento y desarrollo de la dominancia folicular bovina. Revista Colombiana de Ciencias Pecuarias Vol. 13 No.2 (2000); p. 108-120. Herradon, P.G; Quintela, L.A; Becerra,J.J; Ruibal, S y Fernández; M (2007). Fecundación in vitro: alternativa para la mejora genética en bovinos. Arch. Latinoam. Prod. Anim. Vol. 15 (Supl. 1) 2007 Hernández, Hugo (2004). Fecundación in vitro. Facultad de Ciencias Veterinarias. Universidad del Zulia. Venezuela. Hernández Leal, Cecilia (2003). Inyección intracitoplasmática del espermatozoide (ICSI). Una técnica de reproducción asistida con indicaciones. Revista colombiana de obstetricia y ginecología VolL. 54 No. 3. 2003 Hidalgo, Carlos Olegario; Tamargo, Carolina y Diez, Carmen (2006). Análisis del semen bovino. Boletín informativo del Serida N° 2. Huanca, Wilfredo (2001). Inseminación artificial a tiempo fijo en vacas lecheras. Rev Inv Vet Perú 2001; 12(2): 161-163. IMV (2000). Inseminación artificial porcina. http://mto.humeco.net/fotos/649029683rad7BE52.pdf Disponible en: Infocarne (2005). Detección de celo, servicio natural e inseminación artificial. Disponible en: http://www.infocarne.com/bovino/inseminacion_artificial2.asp Intervet (2009). REGUMATE. Disponible en: http://www.intervet.com.mx/productos/regumate_/020_informaci_n_del_producto.a sp Lacadena, Juan Ramón (2002). Animales http://www.prodiversitas.bioetica.org/des18.htm transgénicos. Disponible en: Larson, Bob (2007). Toros: examen sanitario y de aptitud reproductiva. American Angus journal. López, Hernando (2007). Consideraciones fundamentales para la implementación de programas de IATF. ABS México. Disponible en: http://www.absmexico.com.mx/articulos/consider.pdf Losinno Luis (2007). Transferencia embrionaria en equinos. Disponible en: http://www.congresoreproequina.com.ar/docs/transferencia_embrionaria_equinos. pdf Losinno Luis y Aguilar, Javier (2002). Reproducción y biotecnologías en la producción equina. Cátedra de Producción Equina, Depto. Producción Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto. Mangarwati, Engard (2009). Transgenic Animals: Their Benefits To Human Welfare. Disponible en: http://www.actionbioscience.org/biotech/margawati.html Mazzarri, Giorgio (1984). Control de la Reproducción e Inseminación Artificial en Cerdos. FONAIAP DIVULGA, N° 15. ABRIL, 1984. http://www.ceniap.gov.ve/pbd/RevistasTecnicas/FonaiapDivulga/fd15/texto/control. htm Munar, Carlos (2006). Colecta de ovocitos bovinos a campo con laboratorio móvil para fertilización in vitro y sexado de embriones. Disponible en: http://www.agroinnova.gov.ar/agroinnova/pdfs/Panel%204%220Biotecnolog%EDa/ 4.5.pdf Peña J, Miguel, Góngora O, Agustín and Estrada L, José. Growth factors in the follicular development, embryonic early and implantation. implications in the production of bovine embryos.Rev.mvz cordoba, Jan./June 2007, vol.12, no.1, p.942-954. ISSN 0122-0268. Prelle, Katja y Wolf, Eckhard (2001) Células embrionarias Biotecnología de la Reproducción, INTA, Argentina, 2001. tempranas. Ramírez O y Jiménez, C (1999). Recolección de oocitos para maduración in vitro en bovinos. Disponible en: http://www.encolombia.com/acovez24_recoleccion4.htm Raso, Miguel; Buratovich, Osvaldo y Villa, Martin. Comparación de 4 tratamientos de sincronización de celo en ovinos. Carpeta Técnica, Ganadería Nº 9, Abril 2004. EEA INTA Esquel Rigali, Florencia (2006). Animales clonados ventajas y problemas conocidos. Halitus biotecnología. Disponible en: www.forodegeneticabovina.com/pdfs/03_rigali_florencia.pdf Roa, Noris; Tamasaukas, Rita; Silva, Alba y Sánchez, Josefina (2005). Criopreservación de semen suino en Venezuela. Disponible en: http://www.veterinaria.org/revistas/redvet/n050505/050504.pdf. Rodríguez, Inmaculada (2009). Inseminación artificial o monta dirigida en la yegua. Universidad Departamento de Medicina y Cirugía Animal, Hospital Clínico Veterinario de la Universidad de Córdoba. Disponible en: http://albeitar.portalveterinaria.com/noticia.asp?ref=728 Rodríguez, Luis Alfonso (2006). Aspiración folicular guiada por ultrasonido. Disponible en: http://www.asoangusbrangus.org.co/tecnico7.htm Rojas, Mariana; Venegas, Felipe; Servey, Jean Luc y Guillomot, Michell (2004). Clonación, producción de quimeras y células pluripotenciales. Disponible en: http://www.scielo.cl/pdf/ijmorphol/v22n4/art18.pdf Salamone, Daniel (2005). Transgenesi y clonación en animales de granja. Laboratorio Biotecnología Animal. FA-Universidad de Buenos Aires, Argentina. Disponible en: http://www.inta.gov.ar/mercedes/info/JornadasEEA/Reprod05/Salamone.pdf Salgado, Roger, González, Marco y Simanca, Juan. Artificial insemination at fixed time in lactating cows brahman. Rev.MVZ Cordoba, July/Dec. 2007, vol.12, no.2, p.1050-1053. ISSN 0122-0268. Serizier Sosa, Andrés (2005). Fecundación in vitro, una Técnica de Reproducción Animal al Servicio del Mejoramiento Genético. Vitrogen, Venzuela. Serrano Díaz, Norma (2004). Aspectos específicos e implicaciones de la clonación. Disponible en: www.geosalud.com/Clonacion/clonacion_aspectos_cient%EDficos.htm Urrego, Rodrigo; Tarazona, Ariel; Olivera, Martha y Camargo, Omar (2008). Simplificación de la fertilización de ovocitos durante la producción in vitro de embriones bovinos. Rev Colom Cienc Pecua vol.21 no.3 Medellín July/Sept. 2008 Velazco Molina, Joel (2004). El sexaje de semen de toro: ¿un sueño o realidad? Disponible en: http://www.engormix.com/el_sexaje_semen_toro_s_articulos_220_GDL.htm Velázquez Domínguez, José Antonio y Mendieta Márquez, Enrique (1999). Factores que regulan el desarrollo folicular I: folículos preantrales. Departamento de Ciencias de la Salud, Laboratorio de Biología Molecular y Fisiología Gonadal, División de Ciencias Biológicas y de la Salud, UAM-Iztapalapa. Disponible en: http://www.encuentros.uma.es/encuentros99/foliculos.htm Vivanco, William (2009). Clonación en la reproducción y mejoramiento animal. Primera conferencia nacional de biotecnología animal, Mayo de 2009. Lima, Perú. Wilde, Oscar R; De la Vega, Adolfo C. y Cruz, María L. (2002). Uso de un dispositivo intravaginal para el control del estro en yeguas. Zootecnia Trop., 20(4):483-492. Univ. Nacional de Tucumán, Fac. de Agronomía y Zootecnia, Depto. de Producción Animal.