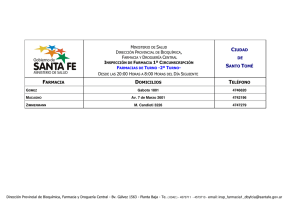
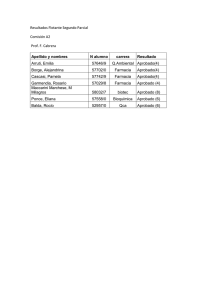
RESUMEN Toxoplasma gondii es un protozoo parásito intracelular
Anuncio

UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA RESUMEN Toxoplasma gondii es un protozoo parásito intracelular obligado, como Apicomplexa. todos Es de los miembros distribución del phylum universal y, probablemente, el agente más frecuente de infección protozoaria en el hombre. Este microorganismo se encuentra comúnmente en los gatos, los pájaros y la carne poco cocida, especialmente la de cerdo, cordero o venado. El gato actúa como hospedador definitivo, y los animales vertebrados intermediarios. y el hombre como hospedadores T. gondii puede producir una infección aguda en las personas sanas, toxoplasmosis congénita e infecciones graves en el paciente inmunodeprimido. La infección contraída durante el embarazo puede ser transmitida al feto durante la fase de parasitemia mediante el paso transplacentario directo del parásito. El tipo de manifestación varía en relación con el momento de la infección fetal. En el primer trimestre el paso de Toxoplasma gondii provoca regularmente aborto y daños graves al feto. En el segundo trimestre predominan lesiones compatibles con la vida pero funcionalmente graves: triada de Bamatter (hidrocefalia, calcificaciones endocraniales, MARIUXI MEDINA Q. CECILIA MUÑOZ P. 1 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA coriorretinitis). De la semana 25 hasta el término del embarazo las consecuencias de la infección toxoplásmica son menores, dada a una mejor capacidad del feto de defenderse, pero puede persistir el riesgo de secuelas neuro-psíquicas. En este trabajo consideraremos de especial interés determinar la concentración de anticuerpos IgG específicos a T. gondii, empleando la Técnica de Micro ELISA en las alumnas de la Escuela de Bioquímica y Farmacia de la Universidad de Cuenca. PALABRAS CLAVES: Toxoplasma gondii, Toxoplasmosis, ELISA, igG. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 2 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA INDICE CONTENIDO PAGINAS CAPITULO I 1. INTRODUCCION……………………………………….….………. 9 CAPITULO II 2. OBJETIVOS……………….…………………………..….………. 12 CAPITULO III 3. TOXOPLASMOSIS………….……………………….……..…….. 13 3.1. Reseña Histórica……………………………….….………...…. 13 3.2. Ubicación en la escala zoológica……………….……....….. 14 3.3. Definición…………………………………………......….…….. 16 3.3.1. Clasificación de los protozoarios……..…….……... 17 3.4. Agente etiológico…………………………………..….………… 19 3.4.1. Estructura…………………………………..….……….. 19 3.4.2. Estructura antigénica……………………..…..……… 24 3.4.3. Ciclo de vida………………………………..….……….. 25 3.4.3.1. Reproducción……………………..……...… 29 3.5. Patología………………………………………….…..…………. 30 3.5.1. Lesiones placentarias…………………..…….……… 33 3.5.2. Lesiones fetales…………………………..…….……… 35 3.6. Manifestaciones clínicas……………………………...……... 37 3.6.1. Toxoplasmosis aguda………………………….…..… 38 3.6.2. Toxoplasmosis ganglionar………………….……….. 39 3.6.3. Toxoplasmosis ocular………………………….…….. 40 3.6.4. Toxoplasmosis congénita…………………….……… 41 3.6.4.1. Infección generalizada………….……….. 43 3.6.4.2. Encefalitis aguda…………………….…….. 43 3.6.4.3. Secuelas irreversibles……………….……. 44 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 3 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.6.5. Otras localizaciones de la toxoplasmosis………. 45 3.6.6. Toxoplasmosis en el paciente inmunosuprimido. 47 3.7. Inmunidad…………………………………………….…………. 48 3.7.1. Inmunidad humoral frente a la infección……….. 50 3.8. Diagnóstico……………………………………………………… 53 3.8.1. Demostración directa del parásito……….……….. 55 3.8.2. Inoculaciones………………………………………….. 56 3.8.3. Métodos inmunológicos……………………………... 57 3.8.3.1. Inmunofluoresencia Indirecta…….…… 58 3.8.3.2. Prueba de ELISA….……………………….. 62 3.8.3.3. Hemaglutinación Indirecta (HIA)……… 63 3.8.3.4. Sabin y Feldman………………………….. 64 3.8.3.5. Fijación del Complemento………………. 66 3.8.3.6. Otras pruebas…………….……………….. 66 3.8.3.7. Toxoplasmina………………………………. 67 3.8.3.8. Detección de Antígenos………………….. 68 3.8.4. Hemograma……………………………………………. 68 3.8.5. Primoinfección materna…………………………….. 69 3.9. Epidemiología…………………………………………………. 70 3.9.1. Infección por ooquistes…………………………….. 71 3.9.2. Infección por quistes……………………………….. 72 3.9.3. Infección transplacentaria………………………… 72 3.9.4. Prevalencia de la infección………………………… 73 3.9.5. Prevalencia de la enfermedad congénita……….. 74 3.10. Prevención…………………………………………………….. 75 3.11. Tratamiento…………………………………………………… 76 3.11.1. Adulto inmunocompetente……………………………… 76 3.11.2. Embarazada………………………………………………… 76 3.11.3. Toxoplasmosis congénita……………………………….. 78 3.11.4. Tratamiento pleno………………………………………… 79 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 4 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CAPITULO IV 4. ENZIMOINMUNOENSAYO (ELISA)….………………………. 82 4.1. Reactivos………………………………………………………… 85 4.2. Ensayo de enlace competitivo………………………………. 87 4.3. Ensayo de enlace no competitivo………………………….. 90 4.4. Aplicación en el laboratorio…………………………….…… 91 4.5. Muestra………………………………………………………….. 93 4.6. Ensayo…………………………………………………………… 95 4.6.1. Principio…………………………………………………. 95 4.6.2. Interpretación de los resultados…………………… 96 4.6.3. Reactivos y contenidos………………………………. 97 4.6.4. Preparación de reactivos…………………………….. 98 4.6.5. Procedimiento………………………………………….. 98 4.6.5.1. Etapa 1……………………………………….. 98 4.6.5.2. Etapa 2……………………………………….. 99 4.6.5.3. Etapa 3……………………………………….. 100 4.6.6. Cálculo de valores de control y punto de corte… 100 4.6.7. Validación de la prueba…………………………….. 101 4.6.8. Interpretación de los resultados………………….. 101 4.6.8.1. Cualitativa………………………………….. 101 4.6.8.2. Cuantitativa………………………………… 102 4.6.9. Valores de referencia………………………………… 103 CAPITULO V 5. RESULTADOS….………………………………………………… 104 CAPITULO VI 6. CONCLUSIONES Y RECOMENDACIONES…………….…. 126 6.1. Conclusiones…………………………………………………… 126 6.2. Recomendaciones……………………………………….…….. 128 ANEXOS………………………………………………………………. 131 BIBLIOGRAFÍA……………………………………………………… 145 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 5 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA “Incidencia de Toxoplasma gondii en las alumnas de la Escuela de Bioquímica y Farmacia de la Universidad de Cuenca”. TESIS PREVIA LA OBTENCIÓN DEL TITULO DE DOCTORA EN BIOQUÍMICA Y FARMACIA. AUTORAS: MARIUXI MEDINA Q. CECILIA MUÑOZ P. DIRECTORA: Dra. SUSANA CALVO J. CUENCA – ECUADOR 2006 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 6 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA AGRADECIMIENTO A Dios por darnos sabiduría y perseverancia para conseguir nuestras metas. A nuestros padres por su sacrificio y entrega y por ser los pilares fundamentales en nuestra vida y por hacernos comprender que con paciencia y dedicación se pueden realizar nuestros sueños. A nuestros hermanos por su apoyo incondicional en todos estos años de estudio. A la Dra. Susana Calvo J., por su dedicación y por transmitirnos sus conocimientos para el desarrollo de este trabajo de investigación. A la Dra. Norma Cedillo A., por ser una gran amiga y un apoyo durante la realización de nuestro estudio. Mariuxi y Cecilia. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 7 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA DEDICATORIA A nuestros padres y hermanos ya que sin su apoyo este trabajo no se hubiera podido realizar. A nuestros amigos por todos estos años de haber compartido maravillosos momentos en las aulas universitarias. Mariuxi y Cecilia. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 8 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CAPITULO I 1.1. INTRODUCCIÓN: Toxoplasma gondii es un protozoo parásito intracelular obligado, como todos los miembros del phylum Apicomplexa. Es de distribución universal y, probablemente, el agente más frecuente de infección protozoaria en el hombre. Este microorganismo se encuentra comúnmente en los gatos, los pájaros y la carne poco cocida, especialmente la de cerdo, cordero o venado. El gato actúa como hospedador definitivo, y los animales vertebrados y el hombre como hospedadores intermediarios. T. gondii puede producir una infección aguda en las personas sanas, toxoplasmosis congénita e infecciones graves en el paciente inmunodeprimido. La toxoplasmosis afecta el cerebro y causa una enfermedad llamada encefalitis por toxoplasma. El microorganismo puede infectar y enfermar a otros órganos, entre ellos, los ojos y los pulmones. Si bien los gatos y los pájaros domésticos que tienen resultados negativos en los análisis de toxoplasmosis, MARIUXI MEDINA Q. CECILIA MUÑOZ P. 9 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA no representan un peligro; los que salen de la casa pueden traer el toxoplasma de afuera. La manipulación de los excrementos de pájaros, o de la arena de las cajas donde los gatos orinan y defecan, es una de las principales causas de infección. La infección contraída durante el embarazo puede ser transmitida al feto durante la fase de parasitemia mediante el paso transplacentario directo del parásito. El riesgo de la infección fetal varía con la edad gestacional y con las condiciones inmunológicas de la embarazada. El riesgo periconcepcional (hasta la 6ª semana) del pase del parásito al producto es de aproximadamente 1-2 %, aumentando a un 15-20 % en el período comprendido entre la 7ª y la semana 24, incrementándose gradualmente de la semana 25 hasta el termino del embarazo, hasta ser de un 75%. El riesgo global es del 60%. El tipo de manifestación varía en relación con el momento de la infección fetal. En el primer trimestre el paso de Toxoplasma gondii provoca regularmente aborto y daños graves al feto. En el segundo trimestre predominan lesiones compatibles con la vida pero MARIUXI MEDINA Q. CECILIA MUÑOZ P. 10 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA funcionalmente graves: triada de Bamatter (hidrocefalia, calcificaciones endocraniales, coriorretinitis, lesiones oculares y neurológicas. De la semana 25 hasta el término del embarazo las consecuencias de la infección toxoplásmica capacidad son del menores, feto de dada a defenderse una mejor (incremento significativo del pase transplacentario de la IgG específica materna, mejor estructuración fetal), pero puede persistir el riesgo de secuelas neuro-psíquicas. En este trabajo consideraremos de especial interés determinar la concentración de anticuerpos IgG específicos a T. gondii, empleando la Técnica de Micro ELISA en las alumnas de la Escuela de Bioquímica y Farmacia de la Universidad de Cuenca. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 11 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CAPITULO II OBJETIVOS: 2.1. Objetivo general: Determinación de Toxoplasma gondii en las alumnas de la Escuela de Bioquímica y Farmacia de la Universidad de Cuenca. 2.2. Objetivos específicos: • Evaluar los resultados obtenidos con las muestras. • Determinar el índice de toxoplasmosis en las alumnas de la escuela de Bioquímica y Farmacia en un periodo de cinco meses. • Dar a conocer los resultados obtenidos para concientizar al alumnado sobre el peligro de la enfermedad. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 12 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CAPITULO III TOXOPLASMOSIS 3.1. RESEÑA HISTÓRICA: La Toxoplasmosis es una infección producida por Toxoplasma gondii, protozoo intracelular de la subclase Coccidia. Fue descubierto en 1.908 Manceaux, en Túnez, en el por Nicolle y roedor africano Ctenodactylus gundi; simultáneamente Splendore en Brasil lo encontró en conejos. Durante aproximadamente 30 años, el parásito fue poco conocido y no se le dio la importancia desde el punto de vista humano. Janku en 1.923, en Praga, descubrió la corioretinitis toxoplasmósica y se informó el primer caso en una niña recién nacida. Hasta 1937, se los había aislado, de diversas especies animales, considerándose cada una como especie diferente, y en ese año Sabin y Olitsky comprobaron que era una sola especie al realizar la transmisión cruzada. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 13 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Posteriormente Wolf demostraron que y colaboradores el parásito en 1.939 causaba meningoencefalitis congénita. En 1940, se reporta el primer caso de toxoplasmosis adquirida del adulto en una manifestación generalizada grave. Un paso muy importante para el diagnóstico de la infección se dio 1.948, cuando Sabin y Feldman establecieron una reacción serológica. Un año después Frenkel descubrió una prueba de Hipersensibilidad, útil tanto para el diagnóstico de las formas crónicas como para los estudios epidemiológicos. En 1.970, Frenkel en Estados Unidos y Hutchison en Inglaterra, lograron establecer su verdadera forma de transmisión en la naturaleza, al encontrar que T. gondii era un parásito del intestino de los gatos y las formas infectantes salían en las materias fecales de estos animales. 9 3.2. UBICACIÓN EN LA ESCALA ZOOLÓGICA Después del descubrimiento del parásito se encontraron Toxoplasmas en diferentes animales; y partiendo del conocimiento intuitivo de que ese parásito MARIUXI MEDINA Q. CECILIA MUÑOZ P. 14 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA se reproducía por esquizogonia, pareció lo más natural considerarlo como un Esporozoario y dada la especificidad parasitaria de ese grupo de Protozoarios se eligieron diferentes especies de Toxoplasma de acuerdo a su hospedero, pero desde 1939 y gracias a los trabajos de Albert Sabin se sabe hoy que sólo hay una especie válida, el T. gondii. También se consideró al Toxoplasma como un flagelado, aunque no se ha encontrado evidencia de flagelos en su organismo. Por último Wenyon sugirió la posibilidad de que pueda relacionárselo con el Histoplasma, con el que puede establecerse alguna confusión no solo por el nombre sino por las apariencias histopatológicas. Ahora se sabe de modo definitivo que es un esporozoario y pertenece a la clase Toxoplasmea. Pero sería arriesgado considerar como Toxoplasma a organismos de morfología parecida a la descrita, especialmente si estos organismos se aíslan de pájaros en los que muchas veces se han encontrado elementos considerados como tales sin mayor examen. Existen cuatro características principales que permiten afirmar con certeza que determinado organismo es realmente T. gondii, ellos son: MARIUXI MEDINA Q. CECILIA MUÑOZ P. 15 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 1. Morfología y propiedades tintoriales propias del Toxoplasma. 2. Que sea un parásito que se multiplica en el interior de células. 3. Que sea patógeno para mamíferos y aves. 4. Que se relacione inmunológicamente con cepas reconocidas.8 3.3. DEFINICIÓN: La toxoplasmosis es una enfermedad infecciosa ocasionada por un parásito, el Toxoplasma gondii, protozoario intracelular obligado. La toxoplasmosis puede ser aguda o crónica, sintomática o asintomática. La infección aguda recientemente adquirida suele ser asintomática en niños mayores y adultos; y en caso de presentar síntomas y signos (enfermedad aguda) estos suelen ser de corta duración y autolimitados. En la mayoría de los casos persiste como quistes en los tejidos pero la persona no suele tener manifestaciones clínicas (infección crónica), pero en otros casos se MARIUXI MEDINA Q. CECILIA MUÑOZ P. 16 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA presenta con formas clínicas persistentes o recurrentes (enfermedad crónica). El parásito se presenta bajo tres formas diferentes: trofozoíto (antes taquizoíto), quistes tisulares y ooquistes. Estos últimos sólo se producen en los intestinos de los huéspedes definitivos. 3.3.1. CLASIFICACIÓN DE LOS PROTOZOARIOS Protozoarios de importancia clínica Phylum: Protozoario Subphylum: flagelos) Sarcomastigophora (seudópodos y Ciliosphora (cilias) Apicomplexa (complejo apical) Subphylum Sarcomastigophora Entamoeba Superclase Clase Sarcodinos Género Rizópodos (Seudópodos para Endolimax Locomoción) Iodomeba Dientamoeba Acantamoeba MARIUXI MEDINA Q. CECILIA MUÑOZ P. 17 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Noagleria Mastigóforos Zooflagelados Giardia (Flagelos para Chilomastix locomoción) Tichomonas Leishmania Tripanosomas Opalinidios (Sin importancia clínica) Ciliophora Balantidium Ciliados Apicomplexa Plasmodia Esporozoarios Toxoplasma Sarcocystis Isospora MARIUXI MEDINA Q. CECILIA MUÑOZ P. 18 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.4. AGENTE ETIOLÓGICO 3.4.1. ESTRUCTURA: Toxoplasma gondii pertenece al filum Apicomplexa, clase Sporozoa y familia Sarcocystidae, la cual incluye los géneros Sarcocystis y Toxoplasma. El parásito adopta diferentes estados según la fase de su desarrollo. Su nombre deriva de la palabra griega “toxon” que significa arco, por su morfología curva o de media luna. En la infección aguda se encuentra la forma proliferativa o taquizoito, término que se refiere a los parásitos extraepiteliales, que se multiplican rápidamente. Su tamaño es de 4 a 6 micras de longitud por 2 a 3 micras de ancho. Cuando se hacen coloraciones con Wright o Giemsa, además de observar su forma arqueada con un extremo más delgado, se encuentra que su citoplasma se tiñe de azul pálido y su núcleo para central, de color rojizo. En las infecciones crónicas los quistes son las formas predominantes, estos aparecen en el ciclo de vida del parásito incluidos por el estado inmunitario del huésped. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 19 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Los quistes poseen una membrana propia y miden entre 20 y 200 micras, forma generalmente redondeada algunas veces alargada. En su interior se encuentran cientos de parásitos conocidos como bradizoítos. Estos parásitos intraquísticos miden aproximadamente 7 micras de longitud por 2 de ancho. Endozoítos. — Etapas que se encuentran en los macrófagos y otras células huésped. Como se multiplican muy rápidamente se los conoce también por taquizoítos. Antiguamente se les denominaba trofozoítos o formas proliferativas. Estas etapas miden entre 4 a 7 por 2 a 4 micrómetros y tienen, en general, forma de media luna. Seudoquistes. — Están formados por un gran número de endozoítos incluidos en un macrófago u otra célula huésped. Los parásitos se hallan unidos por tejido de la célula huésped. Cistozoítos. — Etapas que se encuentran en los quistes. Como se multiplican lentamente reciben también el nombre de bradizoítos. Morfológicamente son similares a los endozoítos, pero contienen gran cantidad de una sustancia MARIUXI MEDINA Q. CECILIA MUÑOZ P. polisacárida y, por lo tanto, reaccionan 20 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA intensamente a la coloración con el método del ácido periódico-Schiff (PAS). Quiste. — Está constituido por una gran cantidad de parásitos incluidos dentro de una pared quística bien definida, compuesta por tejido parasitario. Puede estar localizado en cualquier órgano del cuerpo, y en general tiene forma esférica. La pared del quiste es argirófila. Esquízonte. — Etapa que da origen a los merozoítos. Este proceso de división se conoce con el nombre de esquizogonia. Merozoítos. — Etapas formadas como consecuencia del desarrollo asexual por división múltiple en las células epiteliales del intestino. La estructura básica de esta etapa es semejante a la de los endozoítos. Microgametocito. — Etapa masculina del parásito que se encuentra en las células epiteliales del intestino. El núcleo sufre muchas divisiones que conducen a la formación de microgametos. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 21 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Macrogametocito. — Etapa femenina del parásito que se encuentra en las células epiteliales del intestino. El núcleo no se divide y sólo da origen a un macrogameto. Ooquiste. — Etapa resistente del parásito que se forma como consecuencia de la gametogonia. Los ooquistes de Toxoplasma miden 9 x 13 micrómetros aproximadamente. Conoide. — Estructura hueca en forma de cono que se encuentra en el extremo anterior de los cistozoítos, endozoítos y merozoítos. Está cubierta por estructuras fibrilares dispuestas en espiral. Se cree en general que este órgano es utilizado por el parásito para penetrar en las células huésped. Rhoptrias. — Conocidas también como organelas apareadas. Son estructuras en forma de palo, electrodensas, localizadas en el extremo anterior de los endozoítos, cistozoítos y merozoítos. Se considera que estas estructuras producen enzimas necesarias para la penetración del parásito en el huésped. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 22 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Micronemas. — Conocidas también con el nombre de taxonemas. Son estructuras cordiformes, pequeñas, electro-densas, localizadas cerca del conoide. En un corte trasversal aparecen como cuerpos ovalados o esféricos. Su función es desconocida. (1) (2) MARIUXI MEDINA Q. CECILIA MUÑOZ P. (3) 23 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 1. Microfotografía electrónica de un Taquizoíto intracelular. C: conoide; pv: vacuola parasitófora; r: rhoptrias; n: núcleo; m: micronema; dg: gránulos densos. Figura 2. Quiste tisular de T. Gondii (Tomado de la Revista Microbiología Médica, 1997; 469-71.) Figura 3. Ooquiste no esporulado de T. gondii en heces de gato (Tomado de la Revista Parasitología Médica 1997:26579) 3.4.2. ESTRUCTURA ANTIGÉNICA La superficie del taquizoíto de T. gondii está dominada por 5 proteínas mayoritarias, que han sido implicadas como ligandos mediante los cuales se realiza el reconocimiento celular y la adhesión del parásito a la célula hospedera. De estas la P30 (SAG1) y la P22 (SAG2) son las más abundantes. La proteína de membrana SAG2 es la segunda en abundancia en la superficie del taquizoíto de T. gondii y, al igual que la SAG1 solo está presente en este estadio. Se ha sugerido que la SAG2 puede ser un ligando del parásito para acoplarse con los receptores de la célula hospedera y que está involucrada en los procesos de MARIUXI MEDINA Q. CECILIA MUÑOZ P. 24 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA invasión celular, específicamente en la reorientación apical del parásito. Estudios anteriores han obtenido resultados contradictorios en cuanto al papel de los anticuerpos monoclonales (AcM) dirigidos contra esta proteína en la invasión y multiplicación en las células del hospedero. Grimwood reportó que la utilización de 2 AcM contra la SAG2 favorece la invasión, y sugiere que los anticuerpos que reconocen la proteína causaron una acumulación de los taquizoítos sobre la membrana de la célula hospedera; mientras que Channon demostró que cuando se bloquea esta proteína con otro AcM, disminuye claramente la invasión. 3.4.3. CICLO DE VIDA El ciclo de T. gondii corresponde al de las Coccidias, las cuales presentan un ciclo entero-epitelial, en donde aparecen formas sexuadas y asexuadas. El gato y algunos felinos son los huéspedes definitivos de T. gondii. En estos animales ocurre el ciclo epitelial en el intestino delgado, principalmente en el íleon. En las células epiteliales se multiplican los taquizoítos por MARIUXI MEDINA Q. CECILIA MUÑOZ P. 25 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA esquizogonias sucesivas, con formación de esquizontes, merozoítos y posteriormente con la aparición de macro y microgametocitos que pasan finalmente a gametos. El taquizoíto mide 6 micras de longitud por 2 de ancho. Su forma es alargada y un poco arqueada, con una membrana externa y una interna, ambas interrumpidas en uno de sus lados por el microporo. El núcleo se tiñe con facilidad con colorantes comunes. Al microscopio electrónico en el citoplasma se visualiza el citoesqueleto con los microtúbulos y en la parte anterior se localizan las rhoptrias y los anillos polares. Tienen además, los micronemas, mitocondrias, aparato de Golgi y varios gránulos. En el intestino tiene reproducción sexuada y luego se desarrollan los ooquistes que salen con las materias fecales. Estos miden de 10 a 12 micras y son casi esféricos. En el medio ambiente los ooquistes maduran de 1 a 2 días y en su interior se forman 2 esporoquistes, cada uno de los cuales contiene 4 esporozoítos. En el gato y otros felinos, además del ciclo enteroepitelial, también pueden coexistir invasiones extraintestinales, pues los taquizoítos por vía linfática o hemática se diseminan a todos los órganos donde MARIUXI MEDINA Q. CECILIA MUÑOZ P. 26 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA forman quistes. El hombre y los animales se infectan mediante la ingestión de los ooquistes procedentes de las materias fecales de gato o de las formas quísticas presentes en tejidos de otros animales, en los cuales ocurren invasiones extra intestinales haciendo un ciclo incompleto, como huéspedes intermediarios. En estos casos existe inicialmente una infección aguda con reproducción intracelular de los taquizoítos. Cuando el huésped desarrolla inmunidad la infección se hace crónica y se forman los quistes con los bradizoítos. Los felinos se infectan al ingerir ooquistes y después de 20 a 24 días aparecen nuevas formas infectantes del parásito que salen en materias fecales. Si el animal ingiere tejidos con bradizoítos enquistados, como ocurre al comer un ratón infectado, el periodo patente se reduce 3 ó 4 días. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 27 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 4. Ciclo de vida del T gondií. 1. Huésped definitivo (gato); 2. Ooquiste no esporulado en heces de gato; 3. Quiste ingerido por el gato; 4. Quiste en huésped intermedio; 5. Quiste ingerido por el hombre; 6. Taquizoíto transmitido a través de la placenta; 7. Feto infectado; 8. Alimento y agua contaminada; 9. Huésped intermediario; 10. Ooquiste esporulado; 11. Ooquiste en agua y tierra; 12. Ingesta por huésped intermediario 3. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 28 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.4.3.1. Reproducción Los trofozoitos se multiplican por un proceso asexual denominado de endodiogenia, en la que dos células hijas se forman en el interior de una célula madre. La reproducción es rápida y por eso se los denomina taquizoitos. En el interior de los quistes la multiplicación es binaria, mucho más lenta y por eso se los denomina bradizoitos. Cuando los quistes son ingeridos por otro huésped o si se rompen dentro del mismo huésped por falla inmunitaria, los bradizoitos se comportan inmediatamente como taquizoitos o elementos de multiplicación rápida. Los ooquistes son el producto de la reproducción sexual, por gametocitos femenino y masculino que se forman en el intestino del gato, se unen y forman estos elementos que salen al medio ambiente. 9 Gametogonia. — Forma sexual de división que comprende la formación de microgametocitos y macrogametocitos. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 29 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Esporogonia. — Proceso de desarrollo de los esporozoitos, que son las etapas infecciosas del parásito. Esta forma de desarrollo tiene lugar fuera del huésped. Endodiogenia. — Forma asexual de división que origina dos células hijas dentro de una célula madre. Tanto los endozoítos como los cistozoitos se multiplican por este método. Endopoligenia. — Forma asexual de división observable en el intestino del gato. Este proceso se asemeja a la endodiogenia, pero difiere de ella por la formación de más de dos descendientes con múltiples divisiones nucleares que ocurren simultáneamente.1 3.5. PATOLOGÍA La severidad del síndrome clínico es determinada por el grado de necrosis celular y la reacción inflamatoria. El daño producido por el parásito en la fase aguda depende del número de taquizoítos que proliferan en las células. En la fase crónica ocurre una MARIUXI MEDINA Q. CECILIA MUÑOZ P. 30 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA reacción de hipersensibilidad al romperse los quistes con la salida de antígenos que reaccionan localmente. El parásito penetra la pared intestinal y siguiendo la vía linfática o hemática se disemina a una gran variedad de tejidos. Los taquizoítos se reproducen intracelularmente y pasan de célula a célula causando la muerte; esta proliferación constituye la forma activa de toxoplasmosis. La diseminación a los diferentes órganos se hace a partir del sitio de la infección, pasando a la circulación directamente o llevados por macrófagos, linfocitos o granulocitos. Después de 1 a 2 semanas cuando se desarrolla la inmunidad, la proliferación del parásito disminuye y comienzan a aparecer bradizoítos enquistados en los tejidos. Los parásitos intracelulares forman su propia pared, dando origen a los quistes, que cuando están íntegros, no tienen reacción inflamatoria alrededor. En cualquier tejido pueden aparecer los quistes, pero con mayor frecuencia se localizan en el cerebro, retina, miocardio y músculo esquelético. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 31 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Los ganglios están aumentados de tamaño, hay hiperplasia de las células reticulares, en el corazón y en el músculo esquelético puede haber invasión de células intersticiales y fibras musculares, con destrucción de las células en la fase aguda o formación de quistes en la crónica. Cuando hay diseminación a los pulmones, los macrófagos alveolares y otras células pueden estar parasitadas. En el sistema nervioso central T. gondii produce encefalitis, más frecuente en pacientes inmunosuprimidos. Hay invasión de Taquizoítos a las células nerviosas, muerte de la célula produciendo zonas de infarto, calcificaciones, etc. Los ojos constituyen una localización frecuente e importante del parásito se produce retinocoroiditis, la retina y la coroides muestran varios grados de necrosis y dentro de las células retinianas se observan los parásitos, en su mayoría en forma quística. En el embarazo cuando existe diseminación hematógena se puede infectar la placenta, en donde se MARIUXI MEDINA Q. CECILIA MUÑOZ P. 32 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA forman acúmulos de taquizoítos y quistes, algunos casos pueden ocurrir abortos o mortinatos. En el feto existe invasión de taquizoítos a las vísceras, incluyendo el Sistema nervioso central. La necrosis tisular puede ocurrir por infarto al existir un daño vascular. Aumento de la presión intracraneana e hidrocefalia. 3.5.1. LESIONES PLACENTARIAS: Los cambios patológicos producidos por T. gondii en la placenta suelen ser más frecuentes y de mayor importancia que las alteraciones del feto y, probablemente, son la causa primaria de la muerte del mismo. 3.5.1.1. Alteraciones macroscópicas: La lesión puede apreciarse macroscópicamente ya desde el primer mes de infección, como múltiples puntos o flecos blanquecinos de alrededor de 2 cm. de diámetro, más o menos dispersos en los cotiledones y bien delimitados respecto del tejido sano. Excepto en los cotiledones, no se detecta alteración en el resto del tejido placentario salvo, en ocasiones un ligero edema. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 33 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Con frecuencia, los cotiledones de una misma placenta difieren entre sí, presentándose algunos visiblemente alterados frente probablemente a otros afectados aparentemente con sanos, posterioridad. En infecciones recientes, el aspecto de los cotiledones suele ser totalmente normal y la lesión sólo puede detectarse por histología. 3.5.1.2. Alteraciones histológicas: La infección sólo afecta a los cotiledones placentarios. Comienza provocando múltiples focos microscópicos de necrosis en los septos carunculares, lo que permite el avance del parásito a los tejidos adyacentes. La infección de las vellosidades fetales estimula la hipertrofia e hiperplasia del trofoblasto afectado, con descamación de algunas porciones y necrosis coagulativa. Esto origina la liberación de los taquizoítos a las vellosidades contiguas, aunque algunos parásitos pueden quedar atrapados en el foco necrótico. En infecciones producidas a partir del segundo mes de gestación, como respuesta celular, se produce edema con acúmulo MARIUXI MEDINA Q. CECILIA MUÑOZ P. de células mononucleares en el 34 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA mesénquima de las vellosidades. En procesos avanzados hay regeneración conjuntiva con fibrosis e, incluso, calcificación de los focos necróticos cuya confluencia origina la fusión de vellosidades contiguas. 3.5.2. LESIONES FETALES: El órgano más afectado es el encéfalo, en el que pueden distinguirse dos tipos de lesiones, primarias y secundarias. • Las lesiones primarias: Son consecuencia directa de la multiplicación del parásito en los tejidos, que origina necrosis y hemorragias focales, localizadas fundamentalmente en la sustancia cerebral gris y, ocasionalmente, en las meninges. • Las lesiones secundarias: Son fundamentalmente cambios degenerativos de la sustancia blanca encefálica, detectables por la presencia de focos de leucoencefalomalacia. Estas lesiones se atribuyen a la anorexia tisular provocada por la lesión placentaria, y se consideran más directamente implicadas en la muerte del feto. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 35 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.5.2.1. Alteraciones macroscópicas: A diferencia de las lesiones placentarias, las producidas por Toxoplasma en los tejidos fetales no son macroscópicamente identificables. Además de una autolisis más o menos avanzada, con frecuencia se detecta edema subcutáneo, ocasionalmente serohemorrágico, y la presencia de líquido y grumos de fibrina en cavidades corporales. La hipertrofia ganglionar generalizada y la esplenomegalia son también hallazgos relativamente frecuentes. 3.5.2.2. Alteraciones histológicas: En la sustancia cerebral gris suelen apreciarse infiltrados de células de glia alrededor de los focos necróticos, así como acúmulos perivasculares de estas células y numerosos focos hemorrágicos. En la sustancia degenerativos se encefálica blanca, identifican como los focos zonas más interesantes eosinófilas, donde los núcleos de glia son más escasos que en el tejido sano circundante. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 36 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Estas lesiones degenerativas encefálicas suelen ir acompañadas de focos extramedulares de hematopoyesis en el hígado y el bazo y una disminución de la fracción mieloide/eritroide en la médula ósea, probablemente también atribuibles a la insuficiencia placentaria. Es frecuente también la detección de focos inflamatorios con infiltración de células linfoides en hígado, pulmón, miocardio y, con menor frecuencia, riñón y musculatura esquelética. 3.6. MANIFESTACIONES CLÍNICAS La mayoría de las infecciones ocurren de manera asintomática o con ligera sintomatología no específica. Son frecuentes los hallazgos ocasionales de anticuerpos circulantes, sin que previamente hubieran existido síntomas de infección inicial. Las infecciones crónicas son más frecuentes que las agudas. Las principales formas clínicas de la enfermedad son: MARIUXI MEDINA Q. CECILIA MUÑOZ P. 37 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.6.1. TOXOPLASMOSIS AGUDA La forma aguda generalizada o febril exantemática es rara y con frecuencia no se diagnostica. Después de un periodo de incubación de unos 5 a 18 días, aparece bruscamente un síndrome febril del tipo séptico, con fiebre alta, escalofríos, sudoración, cefalea, astenia y anorexia, rara vez el exantema. Es frecuente, además, el dolor faríngeo, tos y expectoración. En los casos severos se presentan trastornos gastrointestinales, como dolor abdominal, náuseas, vómito, diarrea o constipación. Existe compromiso de los ganglios mesentéricos, los cuales aumentan de tamaño. Si la vía de entrada por inoculación accidental es la mano, aparece linfoadenitis epitroclear y axilar y al tercer día erupción cutánea maculopapular generalizada, no pruriginosa, sin compromiso de palmas y plantas. Con frecuencia se presentan mialgias y artralgias. En los casos severos la enfermedad se puede manifestar clínicamente como una encefalitis, hepatitis o miocarditis. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 38 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.6.2. TOXOPLASMOSIS GANGLIONAR O LINFÁTICA Es la forma clínica más común de la toxoplasmosis adquirida y se presenta principalmente en los niños y adultos jóvenes. Puede transcurrir inicialmente en forma asintomática o con ligeros síntomas. El periodo de incubación varía entre dos semanas y dos meses. El cuadro clínica más frecuente es un síndrome febril con las características descritas en la forma aguda, en la cual predominan las poliadenopatías. Los ganglios linfáticos más fácilmente reconocibles son los cervicales, suboccipitales, de la cadena espinal y con menor frecuencia en otros sitios. Los ganglios están aumentados de tamaño, de consistencia dura y dolorosa. A veces está asociada a faringitis de tipo granulomatoso. En general, la evolución es benigna, pero después de varias semanas o meses, desaparece el cuadro característico pero persiste por mucho tiempo la astenia y las adenopatías. Excepcionalmente existen complicaciones graves. Durante la enfermedad se presenta anemia moderada y leucopenia con linfomonocitosis, que tarda varios MARIUXI MEDINA Q. CECILIA MUÑOZ P. 39 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA meses en desaparecer. La toxoplasmosis ganglionar puede confundirse con mononucleosis infecciosa. Las pruebas serológicas hacen el diagnóstico diferencial entre las dos entidades. 3.6.3. TOXOPLASMOSIS OCULAR Esta localización es muy común y muchas veces única manifestación de la toxoplasmosis. Se considera la causa de aproximadamente la tercera parte de coriorretinitis. La toxoplasmosis ocular aparece a cualquier edad y se considera que puede ser debida a una infección prenatal, con recidivas posteriores. La complicación a nivel popular puede ser debida tanto a manifestaciones agudas como crónicas. La lesión ocular se caracteriza por inflamación granulomatosa del tracto uveal, la cual comienza por la retina y luego compromete las coroides. Cuando existe la ruptura de un quiste la retinocoroiditis presenta reacción inflamatoria intensa que tiende a la cicatrización esta ruptura es súbita y desaparece en 4 a 6 semanas. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 40 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA La lesión es casi siempre redondeada con bordes pigmentados y la parte central blanquecina, se manifiesta en la mayoría de los casos de forma aguda, con disminución brusca de la visión y fenómenos inflamatorios. En casos severos se puede presentar desprendimiento de la retina y vítreo hemorrágico. En las lesiones crónicas existe inflamación difusa, la cual tiende a persistir por mucho tiempo, produciendo pérdida progresiva de la visión que en algunos pacientes puede llegar hasta la ceguera. 3.6.4. TOXOPLASMOSIS CONGÉNITA Cuando la madre se infecta por primera vez en el embarazo, los parásitos invaden las células y se presenta parasitemia por donde se hace invasión a todos los órganos, incluyendo la placenta y por lo tanto existe el riesgo de transmisión congénita en el 65% de los fetos cuyas madres tuvieron la infección en el último trimestre. Esta cifra baja a 25 y 17%, cuando la infección fue adquirida en el segundo y primer trimestre. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 41 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA La infección en la madre es generalmente benigna y transcurre asintomática. Si la infección fue adquirida antes de la gestación, el niño no desarrolla infección congénita. También se acepta que una madre que dio a luz un niño con toxoplasmosis, no vuelva a tener otro con la enfermedad. Se han descrito casos de abortos o mortinatos en infecciones recientes, pero no hay evidencia definitiva de abortos a repetición, asociados a la toxoplasmosis. La infección congénita ocurre casi exclusivamente cuando la mujer embarazada adquiere la infección siendo seronegativa. De los recién asintomáticos, nacidos 20% infectados. tienen una 70% forma son aguda generalizada o secuelas neurológicas y el 10% presentan compromiso ocular solamente. Los síntomas que aparecen en el recién nacido dependen del momento de la infección del feto. Existen tres etapas: • Infección generalizada. • Encefalitis aguda. • Secuelas irreversibles. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 42 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.6.4.1. Infección generalizada Si la infección ocurre al final del embarazo, se produce una forma generalizada aguda. Aproximadamente la mitad de los recién nacidos son prematuros o de bajo peso, con un cuadro clínico de tipo séptico caracterizado por fiebre, hepato y esplenomegalia, ictericia y en algunos casos miocarditis o neumonía intersticial. Alrededor del 80% de ellos tienen LCR normal. No se presenta exantema y raras veces existe compromiso neurológico y ocular. La mortalidad en estos niños es muy elevada y llega al 12% si no se hace tratamiento. En otras ocasiones la infección es poco manifiesta y aún pasa desapercibida, sólo se encuentra un niño prematuro sin ninguna otra sintomatología en el momento del nacimiento. 3.6.4.2. Encefalitis aguda Cuando la infección fetal ocurre alrededor de la mitad del embarazo, la etapa de generalización sucede dentro de la vida intrauterina y en el momento del nacimiento se encuentra sintomatología de la encefalitis. En los casos benignos el niño puede tener MARIUXI MEDINA Q. CECILIA MUÑOZ P. 43 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA peso normal y presentar pocas manifestaciones de la enfermedad, pero después de varias semanas vuelve apático, con dificultad para comer y ocasionalmente desarrolla convulsiones. En la toxoplasmosis subclínica la secuela más importante es la retinocoroiditis. Se encuentran el 75% de los casos con lesiones oculares a los 11 años después del nacimiento. Cuando hay hipertensión intracraneana se desarrolla hidrocefalia. En los casos graves es común encontrar al recién nacido con hidrocefalia y los signos y síntomas de encefalitis aguda, retinocoroiditis y anormalidades en el LCR. Las manifestaciones viscerales pueden existir, pero no son predominantes. Mas tarde se encuentran las manifestaciones intracraneanas y se observa retardo psicomotor. 3.6.4.3. Secuelas irreversibles En los casos en que la infección se hace al inicio del embarazo, cuando se está formando la placenta, el parásito pasa al feto y se desarrolla la enfermedad en la vida intrauterina. Toda la infección generalizada y MARIUXI MEDINA Q. CECILIA MUÑOZ P. 44 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA los daños ocurren en el feto y en momento del nacimiento el niño tiene las secuelas. Las manifestaciones de la enfermedad, encontradas al nacer, dependen del momento y de la intensidad de la invasión. En las formas leves las manifestaciones aparecen un tiempo después del nacimiento, en la edad escolar y aún más tarde. Si existe infección crónica, el paciente presenta pérdida progresiva de la visión, como consecuencia de la retinocoroiditis. En otros casos se encuentran lesiones más graves pero con manifestaciones tardías, como epilepsia, retardo en el desarrollo neurosíquico, retinocoroiditis y calcificaciones cerebrales. En los casos severos puede nacer el niño con macrocefalia y microcefalia, retraso en su desarrollo, microftalmía, estrabismo y placas de retinocoroiditis. 3.6.5. OTRAS LOCALIZACIONES DE LA TOXOPLASMOSIS En algunos casos la toxoplasmosis se manifiesta clínicamente como una enfermedad que afecta un solo órgano, distinta a las formas ocular o ganglionar, MARIUXI MEDINA Q. CECILIA MUÑOZ P. 45 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA descritas anteriormente. Esto puede ocurrir a pesar de que haya existido previamente una diseminación que transcurrió en forma subclínica o clínicamente no reconocida. Entre cuadros clínicos predominantes en un órgano se pueden mencionar: • Toxoplasmosis pulmonar, en la cual se presenta un cuadro de neumonía intersticial, especialmente en la infección congénita y en pacientes inmunocomprometidos. • Miocarditis enfermedad o pericarditis. está asociada Esta forma de principalmente con infección congénita, pacientes inmunosuprimidos ocasionalmente en infección aguda severa. • Toxoplasmosis especialmente cerebral, en pacientes que aparece inmunosuprimidos. Existe en estos casos una encefalitis clínica con o sin la enfermedad generalizada. En pacientes con SIDA casi siempre se presenta la encefalitis. • Hepatitis. Se ha sugerido esta localización como una entidad clínica independiente, que puede presentar focos de necrosis. Lo mismo puede ocurrir en otros órganos. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 46 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.6.6. TOXOPLASMOSIS EN EL PACIENTE INMUNOSUPRIMIDO Cuando existe una inmunosupresión, se pueden desarrollar dos tipos de enfermedad: • La infección primaria severa y • La infección crónica que se recrudece. En el primer caso el paciente que no estaba infectado, adquiere el parásito del suelo o la carne, o lo recibe por un trasplante; la infección se desarrolla sin que la inmunidad la controle y es generalmente fatal. En los casos de recrudecimiento, la infección es endógena. En estos últimos pacientes se desarrolla principalmente una encefalitis con lesiones múltiples y algunas veces focales, simulando un absceso o tumor. En otros miocarditis, pacientes puede retinocoroiditis ocurrir progresiva neumonía, u otras manifestaciones orgánicas. En pacientes con el síndrome de inmunodeficiencia adquirida (SIDA), la complicación más común ocurre también en el sistema nervioso central (SNC) y constituye una de las infecciones oportunistas más importantes en estos pacientes. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 47 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Se estima que la toxoplasmosis del SNC está alrededor del 40% de los enfermos de SIDA, según lo informan los distintos autores. El cuadro clínico de la encefalitis es de tipo focal en la mayoría de los casos. Las anormalidades neurológicas incluyen hemiparesia, hemiplejia, pérdida de sensibilidad, parálisis de nervios craneanos, convulsiones, afasia, ataxia, confusión y letargia. Los síntomas neurológicos pueden estar asociados a fiebre. En algunos casos existen síntomas meníngeos. En el LCR no se encuentran leucocitos o son escasos y la glucosa es normal. Ocasionalmente están aumentadas las proteínas. En los casos severos la toxoplasmosis es fatal. También pueden tener un recrudecimiento de la enfermedad los pacientes que reciben grandes dosis de corticoesteroides, inmunosupresión para un trasplante, terapia con antimetabolitos, agentes alquilantes para leucemia, linfoma o para tumores malignos. 3.7. INMUNIDAD Algunos animales presentan resistencia natural a la infección y todos los huéspedes, incluyendo al hombre, aumentan la resistencia con la edad; tal sucede con MARIUXI MEDINA Q. CECILIA MUÑOZ P. 48 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA las madres, que generalmente son asintomáticas, a diferencia de los niños, que con mayor frecuencia desarrollan la enfermedad. Los huéspedes que albergan el parásito, desarrollan gran actividad inmunitaria. Esto se logra en la infección inicial, por la activa reproducción intracelular y destrucción de las células con salida de los parásitos. A medida que se estimula la respuesta inmune, ésta induce al parásito a formar quistes en los tejidos; en este momento los taquizoítos extracelulares son lisados por la acción de los anticuerpos y el complemento. Aunque la inmunidad mediada por anticuerpos es efectiva contra el parásito, se considera más importante la inmunidad celular. Hay evidencia de que los linfocitos T secretan sustancias específicas que inhiben o matan los parásitos. Se ha demostrado que se produce gamma interferón que también actúa contra ellos y estimulan los macrófagos para inhibirlos o matarlos. Algunos autores dudan sobre el papel de los macrófagos en la inmunidad contra Toxoplasma. La hipersensibilidad de tipo retardado, que se comprueba MARIUXI MEDINA Q. CECILIA MUÑOZ P. con la toxoplasmina, tiene gran 49 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA importancia en algunos momentos de la infección, pues por este mecanismo las sustancias antigénicas, al interaccionar con los linfocitos sensibilizados, inician un proceso inflamatorio de tipo celular, que puede causar lesiones y aun necrosis. La inmunidad mediada por células es deprimida por la acción de corticoesteroides y otros inmunosupresores. Alrededor de los quistes intactos no existe reacción inflamatoria, pero cuando el equilibrio inmunológico se altera, especialmente por un estado de inmunodeficiencia, los quistes se rompen con liberación de bradizoítos y algunas sustancias presentes en el quiste desencadenan una intensa reacción inflamatoria. Los corticoesteroides, las drogas inmunosupresoras y ciertas enfermedades debilitantes, alteran la inmunidad del huésped y reactivan la toxoplasmosis. 3.7.1. INMUNIDAD HUMORAL respuesta inmunológica FRENTE A LA INFECCIÓN La del hospedero inmunocompetente a T gondii se desarrolla de manera secuencial a partir de las diferentes inmunoglobulinas así. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 50 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.7.1.1. IgM: Es la primera en aparecer ontogénicamente. Puede ser detectada dentro de las dos primeras semanas de haberse producido la infección; su vida media oscila entre cinco días y cuatro semanas y en un 5% de los pacientes puede persistir positiva hasta por tres años, motivo por el cual el diagnóstico de infección activa en la paciente embarazada es en ocasiones difícil. Por lo tanto los títulos de IgM elevados nos indican en la gran mayoría de las veces, aunque no siempre, que estamos frente a una toxoplasmosis en fase aguda. 3.7.1.2. IgG: Aparece una o dos semanas después de la primoinfección, y alcanza su pico máximo entre la sexta y octava semana. Los niveles de IgG luego decrecen gradualmente a títulos relativamente bajos, los cuales persisten durante toda la vida, lo que nos indica que si detectamos títulos de IgG estables, estamos frente a una toxoplasmosis latente, antigua o que ya hubo una infección superada. La IgG en niños menores de un año, no puede ser distinguida de anticuerpos maternos, los cuales pueden persistir en el niño por varios meses. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 51 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.7.1.3. IgA: La aparición de la IgA se presenta en fases tempranas de la infección (alrededor de las dos primeras semanas de haberse infectado), y su vida media es parecida a la IgM, e incluso puede desaparecer entre el tercer y noveno mes. 3.7.1.4. IgE: El tiempo de aparición de la IgE es igual al de la IgA pero al parecer la vida media es más corta, siendo positiva hasta las cuatro semanas posteriores a la infección, por lo cual puede ser útil en el diagnóstico de infección aguda. Así, para una apropiada interpretación de los títulos de anticuerpos circulantes, ésta debe hacerse en asocio de varias determinaciones. Por ejemplo, si se detecta IgM e IgA simultáneamente lo más probable es que la persona se encuentra en una fase aguda de la infección (aproximadamente siete días postinfección), lo que permitiría hacer una mejor evaluación del riesgo en la mujer gestante. La respuesta inmune específica del recién nacido es caracterizada por la presencia específica de IgM e IgA, ya que no atraviesan la placenta como lo hace la IgG. En la ausencia de estimulación antigénica, el nivel de MARIUXI MEDINA Q. CECILIA MUÑOZ P. 52 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA IgA en el primer año en los niños es solo el 20% del observado en adultos. Si se encuentran en mayor porcentaje, podría considerarse como indicio de toxoplasmosis congénita.4 3.8. DIAGNÓSTICO La toxoplasmosis es una enfermedad de difícil diagnóstico parasitológico, pues no es fácil demostrar el agente etiológico y establecer la relación entre infección y enfermedad. Clínicamente se debe diferenciar de varias entidades, de acuerdo a la localización de las lesiones predominantes. En la toxoplasmosis aguda se requiere hacer un diagnóstico diferencial con cualquier síndrome febril con o sin exantema, especialmente con aquellos que presentan infecciosa, adenopatías, por tener como cuadros mononucleosis clínicos que se confunden. También se pueden comportar como una fiebre tifoidea o una brucelosis. La forma ganglionar semeja con frecuencia linfomas incipientes. En los casos severos que presentan encefalitis, hepatitis, neumonitis o miocarditis, se MARIUXI MEDINA Q. CECILIA MUÑOZ P. 53 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA deben descartar otras etiologías que tengan estos mismos cuadros clínicos. Cuando existe compromiso ocular, es necesario considerar todas las causas de uveítis endógena, en especial tuberculosis, histoplasmosis, sífilis y citomegalovirus. La toxoplasmosis congénita presenta una amplia gama de manifestaciones clínicas, según la intensidad de la infección, el momento de su aparición y las secuelas. En el recién nacido se deben descartar enfermedades como sífilis, sepsis, eritroblastosis fetal, infecciones por virus de inclusión citomegálica y otras entidades. En todo niño con encefalitis es necesario pensar en toxoplasmosis. El laboratorio es básico para definir la etiología de la enfermedad. El diagnóstico de infección se puede establecer mediante las pruebas serológicas; para comprobar la enfermedad se requiere, además, el criterio clínico. Muchas veces es difícil separar lo que es infección por Toxoplasma y presencia de enfermedad. Existen varios procedimientos para demostrar el parásito en MARIUXI MEDINA Q. CECILIA MUÑOZ P. 54 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA forma directa y otros de tipo indirecto para la búsqueda de anticuerpos. 3.8.1. DEMOSTRACIÓN DIRECTA DEL PARÁSITO Aunque la observación del parásito es lo ideal, sólo es posible hacerlo en un reducido número de casos. Este puede encontrarse en LCR, ganglios linfáticos, médula ósea y ocasionalmente en otros tejidos. Cuando se obtiene material por punción, sé busca el parásito en fresco o coloreado. En los tejidos, las características morfológicas son difíciles de precisar, pues el estudio histopatológico muestra formas redondeadas o partes del parásito, según sea su posición y se requiere mucho tiempo, experiencia y cortes seriados para poder identificarlo; por este motivo ocurren errores de diagnóstico en favor o en contra del parásito. Se confunden sus estructuras con otros protozoos, hongos, pólenes, etc. En los ganglios se parecen a las células reticulares con inclusiones. Los quistes son de reconocimiento más difícil, se requiere diferenciarlos de pseudoquistes de T. cruzi, nidos de Leishmania, quistes de Sarcocystis, formas MARIUXI MEDINA Q. CECILIA MUÑOZ P. 55 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA de Encephalitozoon, acumules de hongos del género Candida e Histoplasma, etc. La coloración con Giemsa o hematoxilina-eosina ayuda a la diferenciación en cortes histológicos, así como la inmunofluorescencia directa y la inmunoperoxidasa. 3.8.2. INOCULACIONES El parásito se puede aislar de sangre, LCR, esputo y de los tejidos infectados, tales como ganglios linfáticos, músculos, placenta, ojos enucleados y vísceras. El procedimiento indicado para el aislamiento es la inoculación al ratón. Los tejidos se pueden homogeneizar o digerir mediante tripsina al 1%. Este material se lava con solución salina isotónica antes de ser inyectado al animal. Los líquidos, especialmente LCR, se inoculan directamente. La cantidad de material es de 0.5 ml para introducir por vía intraperitoneal. Después de la primera semana se estudia el exudado peritoneal para buscar el parásito, generalmente intracelular. Algunas veces se requieren pases ciegos con el exudado, para posteriormente encontrar MARIUXI MEDINA Q. CECILIA MUÑOZ P. Toxoplasma. Se recomienda tratar el 56 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA material para inocular, con penicilina y estreptomicina, para evitar peritonitis bacteriana y muerte del animal, antes de cumplir el tiempo de reproducción de los parásitos. Previamente importante asegurarse a las inoculaciones, serológicamente que es los animales de laboratorio estén libres de esta infección. Los taquizoítos pueden aparecer después de 4 a 8 días. Si los animales sobreviven, se examinan después de 4 a 6 semanas para buscar los quistes en cerebro. Se ha utilizado también la vía intracerebral en el ratón, los cultivos de tejidos y embrión de pollo; sin embargo, estos métodos son más difíciles de realizar. 3.8.3. MÉTODOS INMUNOLÓGICOS La demostración indirecta de T. gondii se hace por la búsqueda de anticuerpos. Su presencia indica que hay infección, pero no necesariamente enfermedad. Los anticuerpos detectados son principalmente IgM e IgG, los primeros indican infección reciente. La interpretación de los títulos de anticuerpos se debe hacer frente al cuadro clínico y la historia del paciente. El solo hecho de tener un resultado positivo de su serología, no indica que el paciente tenga la MARIUXI MEDINA Q. CECILIA MUÑOZ P. 57 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA enfermedad y el hecho de tener anticuerpos, no es criterio suficiente para hacer un tratamiento. Muchas veces los títulos de las reacciones no guardan relación con la gravedad de la enfermedad y el estudio serológico indica únicamente que la persona ha tenido o tiene el parásito. Las pruebas serológicas más utilizadas son las siguientes: 3.8.3.1. Inmunofluorescencia indirecta (IFI) Esta prueba se comporta en forma similar a la de Sabin y Feldman, con alta concordancia en cuanto a su sensibilidad y especificidad. En la práctica se prefiere por su fácil ejecución, porque no requiere trabajar con parásitos vivos, ni con factor accesorio que es difícil de conseguir. Para la inmunofluorescencia se utilizan taquizoítos muertos por formol o liofilizados. Los anticuerpos de la clase IgG presentes en el suero del paciente se adhieren a la pared del parásito, donde se detectan por medio de gammaglobulina antihumana conjugada con isotiocianato de fluoresceína. La reacción se lee al microscopio de luz ultravioleta y se determina el título en la última dilución del suero, en la cual se encuentra MARIUXI MEDINA Q. CECILIA MUÑOZ P. 58 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA fluorescencia de la pared del parásito. Los títulos pueden ser tan altos como en la reacción de Sabin y Feldman. Si se necesita buscar anticuerpos en algún animal, es necesario cambiar de gamma globulina de acuerdo a la especie. Esta reacción se emplea para el seguimiento de los pacientes y detecta anticuerpos después de 8 a 10 días de haberse iniciado la infección, se elevan rápidamente y decrecen después de 8 a 12 meses, pero queda positiva permanentemente y es frecuente encontrar títulos estables por mucho tiempo, además existen infecciones que evolucionan con títulos bajos. • Un título de 1:64 se interpreta como infección pasada o muy reciente. • Reacciones alrededor de 1:256 se consideran como títulos intermedios y pueden indicar infecciones estabilizadas o recientes. • Los títulos de 1:1.024 o mayores, sugieren infección activa. Esta prueba serológica confirma la actividad de la infección cuando aumentan en 2 a 4 semanas de MARIUXI MEDINA Q. CECILIA MUÑOZ P. 59 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA intervalo. Se consideran modificaciones significativas cuando el título se eleva 4 veces o más por encima del anterior. Un mismo suero en distintas determinaciones, con la misma prueba, puede presentar oscilaciones en su título, pero éstas no deben exceder en más de una dilución. Después del tratamiento de un paciente los títulos bajan muy lentamente; en algunos casos pueden subir después del tratamiento, pero luego descienden. La eficacia del tratamiento no se puede medir serológicamente sino por la clínica. Para demostrar la producción local de anticuerpos (Ac) en el ojo o en el sistema nervioso central, se aplica la siguiente ecuación para definir un coeficiente (C). Título Ac C = en líquido Concentración X gammaglobulina en suero Título Ac Concentración en suero gammaglobulina en líquido Si el coeficiente es 8 o más, indica que hay producción local de anticuerpos en el ojo o en el sistema nervioso MARIUXI MEDINA Q. CECILIA MUÑOZ P. 60 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA central, por lo tanto hay infección activa en estos tejidos.10 3.8.3.1.1. Anticuerpos IgG. Dosados por inmunofluoresencia indirecta (IgGIFA, “Indirect Fluorescent Antibody”). El título aumenta en el mes o en los dos meses que siguen a la infección, permanece alto durante los 6 – 12 meses, después disminuye de manera progresiva y se estabiliza en un título residual bajo.12 Un título alto de entrada (>300 UI/ml) o que se duplica en 3 semanas sugiere una infección reciente. El “dye test” (prueba de lisis de los parásitos) de Sabin – Feldman da resultados comparables. 3.8.3.1.2. Anticuerpos IgM. Dosados por prueba de Remington o de inmunofluoresencia indirecta (IgM – IFA). El título ya aumenta después de algunos días, alcanza un máximo en 2 a 4 semanas y se normaliza en 1 a 2 meses. La ausencia MARIUXI MEDINA Q. CECILIA MUÑOZ P. de IgM específicas permite descartar 61 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA infección evolutiva, pero su presencia no autoriza a afirmar que se trata de una infección reciente. En efecto, se requiere el análisis de dos sueros extraídos con 3 semanas de intervalo para demostrar la seroelevación.12 3.8.3.2. Prueba de ELISA (Enzyme-linked immunosorbent-assay). Es una prueba muy sensible y requiere una buena estandarización. En algunos casos los anticuerpos IgG se correlacionan con los detectados por IFI, Sabin y Feldman y la hemaglutinación indirecta, pero en otros no se tiene buena correlación. Se considera que una prueba de ELISA con menos de 10 unidades internacionales (UI) por ml es negativa; de 10 a 300 UI/ml indica infección pasada o en evolución, y más de 300 UI/ml se refiere a enfermedad activa o reciente. La prueba de ELISA-IgM es positiva en los casos de infección reciente. El método de captura de IgM o del doble anticuerpo es más sensible y específico. Este MARIUXI MEDINA Q. CECILIA MUÑOZ P. 62 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA procedimiento es un anticuerpo anti-IgM humano que recubre los pozos del microplato, para capturar la IgM del suero del paciente. La cantidad de antígeno toxoplásmico se mide inmunoquímicamente, lo cual constituye el método IgM-ELISA de doble capa o IgMELISA reversa. Si se usa aglutinación de los parásitos se llama ISAGA. La prueba IgM-ISAGA es más sensible y detecta anticuerpos IgM específicos más precozmente que IgM-ELISA. Estas pruebas de captura tienen menos reacciones falsas positivas o negativas. La captura de IgM da positiva por más tiempo que los otros métodos y detecta este tipo de anticuerpos hasta por 2 ó 5 años. Utilizando la prueba de ELISA se hace la detección de IgA específica. La DS- IgA-ELISA es más sensible que la IgM-ELISA para detectar infección congénita en el feto, en el recién nacido y en la mujer en embarazo. 3.8.3.3. Prueba de hemaglutinación indirecta (HAI) Mediante un antígeno soluble ligado a eritrocitos de carnero tamizados, se detectan anticuerpos circulantes evidenciados por la aglutinación de los eritrocitos preparados. La prueba es muy sensible y da títulos MARIUXI MEDINA Q. CECILIA MUÑOZ P. 63 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA elevados; se considera también específica aunque puede dar algunas especialmente cuando reacciones se estudian cruzadas, sueros de animales. La prueba es deficiente para detectar anticuerpos en la fase aguda de la infección. Se ha encontrado concordancia con la reacción de Sabin y Feldman y paralelismo con ella; sin embargo, se encuentran casos de reacciones positivas de esta última, con pruebas negativas a la hemaglutinación y viceversa. Esta prueba es deficiente para detectar anticuerpos en el recién nacido. 3.8.3.4. Prueba de Sabin y Feldman (S-F) Se llama también prueba del colorante. Es un método clásico y específico, pero tiene dificultades técnicas, por lo cual se ha limitado su uso. Como antígeno se utilizan parásitos vivos obtenidos de exudado peritoneal de ratones, con 2 a 3 días de inoculación. El suero del paciente se diluye progresivamente para poder determinar el título de anticuerpos. La reacción antígeno-anticuerpo se lleva acabo en unión del complemento sérico humano, lo que se ha MARIUXI MEDINA Q. CECILIA MUÑOZ P. 64 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA llamado factor accesorio, que se obtiene de personas sin anticuerpos para Toxoplasma. Al hacer las pruebas y cuando no hay anticuerpos, los parásitos se tiñen con azul de metileno, los cuales se observan al microscopio corriente o con contraste de fase. Los Toxoplasmas alterados por la acción de los anticuerpos no toman el colorante; si el 50% o más parásitos se encuentran sin teñir, la reacción se considera positiva. Se informa como título, la última dilución del suero en la cual se encuentra la reacción positiva. En infecciones activas los títulos están por encima de 1:1.024 y pueden llegar hasta 1:64.000 o mayores. La prueba aparece positiva desde los primeros días de iniciada la infección, mide principalmente anticuerpos IgG y permanece así durante toda la vida del paciente, con oscilaciones en su título que decrece lentamente después del tratamiento. No se encuentran reacciones cruzadas con otros protozoos o agentes infecciosos, por lo cual se considera de alta especificidad. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 65 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.8.3.5. Reacción de fijación del complemento Esta prueba es específica pero poco sensible. Se utiliza un antígeno soluble, los títulos de anticuerpos son generalmente bajos y pocas veces se elevan por encima de 1:256. La reacción tiene un valor limitado y se hace positiva más tardíamente que las pruebas anteriores, generalmente aparece de 3 a 4 semanas después de iniciada la infección. Se vuelve negativa precozmente, entre 6 y 9 meses. Se pueden encontrar reacciones falsas positivas en algunos casos. 3.8.3.6. Otras pruebas Diferentes reacciones se han desarrollado, pero no se utilizan de rutina, como son la prueba de látex, inmunodifusión en agar, aglutinación directa, etc. También se ha utilizado la prueba de Wester-blot para comparar los anticuerpos de la madre y del hijo, frente a diferentes antígenos de Toxoplasma, con el fin de esclarecer el diagnóstico de infección congénita. Recientemente se ha desarrollado la prueba conocida como ELIFA (Enzyme-linked immuno-filtration assay) en la cual se utiliza una membrana de microporo que permite MARIUXI MEDINA Q. CECILIA MUÑOZ P. estudiar anticuerpos específicos por 66 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA inmunoprecipitación e inmunofiltración, mediante anticuerpos marcados con una enzima. 3.8.3.7. Toxoplasmina. Esta prueba semejante es a de hipersensibilidad la tardía, tuberculina. Aparece positiva generalmente después de la quinta o sexta semana y permanece así indefinidamente. El antígeno que se inyecta es obtenido por lisis de parásitos procedentes de exudado peritoneal de ratón. Este antígeno se inyecta intradérmicamente en un antebrazo; como control se utiliza extracto de bazo de ratón, que se aplica en la misma forma en el otro antebrazo. La lectura se hace midiendo la induración que se presenta a las 48 horas. La prueba tiene poco valor para el diagnóstico de la enfermedad, aunque en casos de uveítis se encuentra una mejor correlación. En las formas crónicas, las lesiones se deben a reacciones de hipersensibilidad contra productos antigénicos del parásito. Cuando la prueba es negativa en un proceso de larga duración, puede ayudar a descartar la entidad, a menos que se trate de energía, como ocurre con pacientes en muy mal estado general MARIUXI MEDINA Q. CECILIA MUÑOZ P. 67 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA o que están recibiendo corticoesteroides. La utilidad principal de la prueba reside en el estudio epidemiológico de poblaciones para buscar contacto previo con el parásito. 3.8.3.8. Detección de antígenos La reacción en cadena de la polimerasa (PCR) se usa para amplificar ADN de T. gondii indicando la presencia del parásito en los líquidos o tejidos, inclusive en el líquido amniótico. Tiene mejor sensibilidad que el cultivo y es más rápida (demora de 2 a 3 días). En particular, se la utiliza para el diagnostico prenatal y en caso de inmusupresión.10 3.8.4. HEMOGRAMA • Forma adquirida: neutropenia, eosinofília, presencia de células mononucleares con citoplasma basófilo. • Forma congénita: anemia, eritroblastosis y, a veces, trombocitopenia. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 68 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.8.5. PRIMOINFECCIÓN MATERNA • Seropositividad antes del embarazo: no exige control, salvo en caso de inmunosupresión. • Seropositividad o serología desconocida al comienzo del embarazo: practicar examen serológico. - Resultado negativo: control mensual. - IgG estables e IgM – en dos exámenes sucesivos: inmunidad antigua. - IgM - y aparición de IgM en el segundo examen: seroconversión. - IgG + e IgM +: infección reciente o evolutiva. 3.8.5.1. Diagnóstico diferencial: mononucleosis infecciosa, enfermedad de Hodgkin, encefalitis virales, coriorretinitis, miocarditis, meningitis bacterianas. En la forma congénita: neonatal, congénitas traumatismo eritroblastosis del sistema fetal, obstétrico, mal nervioso. tetania formaciones El examen radiológico plantea el diagnóstico diferencial de esclerosis tuberosa, angiomatosis cerebral y tumores cerebrales calcificados. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 69 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.8.5.2. Pronóstico: en la forma congénita, la mortalidad es del 10% y las secuelas pueden ser graves: retardo mental, trastornos psicomotores, coriorretinitis. 3.9. EPIDEMIOLOGÍA La toxoplasmosis es una zoonosis y es el protozoario más difundido en el mundo. T. gondii es un parásito eurixeno, pues capaz de multiplicarse y desarrollarse en alrededor de 300 especies de mamíferos y 30 especies de aves. Sin embargo, en su ciclo sexual demuestra una gran especificidad pues solo lo cumple en el gato y en especies muy afines. Esta amplia diseminación se ve facilitada, por la resistencia de los ooquistes a las condiciones ambientales, pues permanecen viables e infectantes, durante casi un año, en suelos húmedos y con temperatura adecuada. También la persistencia de los ooquistes tisulares, por largos periodos de tiempo, en animales que sirven como alimento, contribuye de manera importante a la MARIUXI MEDINA Q. CECILIA MUÑOZ P. 70 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA diseminación. El ser humano se infecta naturalmente, por ooquistes, quistes, y por vía transplacentaria. 3.9.1. INFECCIÓN POR OOQUISTES El gato doméstico, y algunos felinos salvajes muy cercanos son los únicos huéspedes definitivos de T. gondii y excretan varios millones de ooquistes por día. Esta excreción es por lo general una sola vez en la vida del animal, aunque es posible que haya otros periodos mucho más cortos de eliminación por proceso de reinfección y falla inmunitaria del animal. Es necesario que el felino no sea inmune y por eso la producción de ooquistes es posible en animales de corta edad, menores de 6 meses, cuando el animal no se aleja del domicilio humano. Los ooquiste en el ambiente maduran, bajo condición de humedad, oxigenación y temperatura adecuadas. Son sensibles a la desecación, putrefacción dentro de la materia fecal, presencia de bacterias, acción directa de la luz solar, y temperaturas de extremo frío o calor. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 71 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Las lluvias son fundamentales para la diseminación de los ooquistes, los liberan de la materia fecal y los distribuyen en amplias áreas húmedas. 3.9.2. INFECCIÓN POR QUISTES Los quistes, en las carnes de consumo habitual humano, resisten el paso por el estómago y liberan trofozoitos que desencadenan la infección. Estas formas evolutivas se destruyen a 60ºC. Las carnes de cerdo y de oveja son las que mayor porcentaje de quistes tisulares han demostrado, la carne de vacuno también está infectada, así como las aves domésticas. Los quistes permanecen viables hasta 1 mes en carnes guardadas a 4ºC. 3.9.3. INFECCIÓN TRANSPLACENTARIA Los trofozoitos son capaces de atravesar la barrera placentaria llegando a la placenta por vía hematógena. En primer lugar parasitan las células de la placenta para luego infectar al feto. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 72 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Esta transmisión puede ocurrir solo si la madre durante el embarazo adquiere la primo infección. La inmunidad proporcionada por infecciones pasadas no permite nuevas parasitemias y en caso de alguna reactivación de un quiste tisular materno esta parasitemia es escasa y muy poco probable que pueda causar daño. La primo infección materna en la mayor parte de los casos no produce un niño infectado. En otros da lugar a aborto, parto aparentemente prematura, mortinatos asintomáticos que o niños desarrollan problemas neurológicos o visuales más adelante. 3.9.4. PREVALENCIA DE LA INFECCIÓN No hay prevalecias diferentes en lo que respecta a sexo o características raciales, en diversas áreas geográficas varían de manera muy significativa, siendo la más alta en regiones tropicales donde más del 80% de los adultos ya han sido infectados. En las regiones más frías y de montaña el porcentaje oscila entre 20 a 40%. Las tasas se incrementan con la edad y los cuadros con sintomatología son muy escasos. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 73 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Los estudios de prevalencia son hechos en base a la titulación de anticuerpos por diversas técnicas serológicas, por la dificultad de aislar el parásito y la facilidad actual de la ejecución de la serología y el alto grado de sensibilidad y especificidad alcanzados. 3.9.5. PREVALENCIA DE LA ENFERMEDAD CONGÉNITA El riesgo de la infección congénita es exclusivo para mujeres nunca infectadas o sero-negativas y depende de la incidencia anual de la toxoplasmosis en esa población. En otros términos se refiere a cuantas nuevas personas son infectadas cada año en la comunidad y, por consiguiente, cual es la posibilidad de reunir las dos condiciones fundamentales de: mujer seronegativa embarazada y la infección en ese momento. En realidad el riesgo es pequeño y oscila entre 2.4 por mil a 4 por mil. En términos generales puede admitirse que a mayor número de mujeres infectadas antes del embrazo (adolescencia, niñez), menor es el riego de toxoplasmosis congénita. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 74 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 3.10. PREVENCIÓN La prevención de la toxoplasmosis está encaminada a evitar la infección de la mujer embarazada y sería aconsejable que los niños y núbiles se infecten antes de la edad gestacional como método de prevención. A las mujeres embarazadas o en edad de quedar embarazadas debe repetirse: “Evite contraer la toxoplasmosis, cocine bien la carne y lávese las manos frecuentemente, evite contacto con gatos y con tierra”. La práctica sistemática de serología durante el transcurso del embarazo es una buena pero muy cara medida y servirá para detectar las mujeres seronegativas que estarían en peligro de contraer la infección y aconsejarles en enunciado anterior. Otras medidas de control a nivel de transmisión por heces de gato y carnes de animales teóricamente son posibles, pero en realidad son impracticables. La búsqueda de una vacuna se hace con la finalidad de proteger grupos especiales de riesgo como pacientes MARIUXI MEDINA Q. CECILIA MUÑOZ P. 75 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA que se someten a trasplantes de órganos y otros con algún compromiso inmune. Figura 5. Toxoplasmosis congénita: hidrocefalia, ceguera, retrazo mental. 3.11. TRATAMIENTO La toxoplasmosis es sensible a los antifólicos. 3.11.1. Adulto inmunocompetente. Por lo general, el adulto inmunocompetente no requiere ningún tratamiento. 3.11.2. Embarazada. Desde que se diagnostica toxoplasmosis (seroconversión), se prescribe tratamiento con espiramicina (3g por día), que se sigue MARIUXI MEDINA Q. CECILIA MUÑOZ P. 76 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA sin interrupciones hasta el final del embarazo y se acompaña de ecografía mensual. En caso de signos directos y/o indirectos de toxoplasmosis congénita, se propone a la madre un tratamiento de un mes con la asociación sulfadoxina + pirimetamina en el curso del tercer trimestre. Se deben valorar los riesgos para el feto de este tratamiento respecto del beneficio potencial de menor riesgo de infección. La pirimetamina se absorbe por vía oral, penetra bien en el líquido cefalorraquídeo (LCR) y bloquea el paso del ácido fólico o folínico. Es depresor de la médula ósea y puede ocasionar trombocitopenia y a veces anemia y leucopenia, por lo que en el transcurso del tratamiento deben realizarse controles de sangre periférica 2 veces por semana. Para evitar su efecto tóxico, puede asociarse ácido fólico por vía oral o intramuscular. Es eficaz una combinación de pirimetamina y sulfadiacina para inhibir la replicación de trofozoitos y la posible diseminación durante los períodos en que se administran corticosteroides. Los corticoides no están recomendados, pues pueden favorecer la diseminación de taquizoides o reactivar focos latentes. Sin embargo, en los casos de MARIUXI MEDINA Q. CECILIA MUÑOZ P. 77 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA retinocoroiditis, en los que los fenómenos de hipersensibilidad son importantes en el desarrollo de las lesiones, está justificado su empleo Las sulfamidas impiden la síntesis de ácido fólico. Las más activas son: la sulfadiacina (existe la mejor experiencia por parte de los médicos debido a sus buenos resultados y es la más fácil de encontrar en el mercado); y las sulfonamidas triples (sulfadiacina, sulfameracina y sulfametacina). Se comporta de forma sinérgica con la pirimetamina. El sulfixosazol es ineficaz. La sulfadiacina puede sustituirse por sulfonamidas triples (triple sulfa).7 La espiramicina es menos tóxica, aunque menos activa que la pirimetamina. Puede emplearse asociada con ésta o con las sulfamidas y es el fármaco de elección para el tratamiento de la toxoplasmosis en el embarazo. Desafortunadamente, no atraviesa la placenta y por lo tanto, no trata al niño. Se puede usar en el niño recién nacido cuando tiene toxoplasmosis congénita. 3.11.3. Toxoplasmosis congénita. Sulfadiazina + pirimetamina durante 20 a 30 días. Los lactantes son MARIUXI MEDINA Q. CECILIA MUÑOZ P. 78 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA tratados durante un año con Sulfadiazina todos los días y pirimitamina cada 2 a 3 días. 3.11.4. TRATAMIENTO PLENO Para la infección fetal comprobada. ESQUEMA # 1: Ideal si se dispone de c/u de los medicamentos: SULFADIAZINA + PIRIMETAMINA + ÁCIDO FOLÍNICO SULFADIAZINA: 50- 100 mg/K peso/día (3 a 4mg/día), fraccionada en 4 dosis /día. PIRIMETAMINA: 1mg/K/día (máximo 75mg/día). ACIDO FOLINICO: 5 a 20 mg/día ó LEVADURA DE CERVEZA: 10 mg/día. Control semanal del cuadro hemático. ESQUEMA # 2: Sugerido en caso de intolerancia a las sulfas: ESPIRAMICINA O CLINDAMICINA + PIRIMETAMINA + ÁCIDO FOLÍNICO ESPIRAMICINA: 30 M UI VO c/8 horas ó CLINDAMICINA: 300mg VO c/8 horas + PIRIMETAMINA: 25 mg VO c/8 horas MARIUXI MEDINA Q. CECILIA MUÑOZ P. 79 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA + ÁCIDO FOLÍNICO: 10 a 20mg VO c/día. 3 En caso de inmunosupresión. Dosis de ataque de 200mg de pirimetamina, seguida de Sulfadiazina 4 – 6g/día + pirimetamina 50 a 75mg/día durante 4 a 6 semanas (hasta 3 a 6 meses en caso de SIDA). La administración concomitante de folato de calcio (15mg/día) previene la anemia megaloblástica causada por la pirimetamina. En caso de alergia a la sulfadiazina, se puede indicar clindamicina en dosis de 1.200 a 2.400mg/día. Los corticoides pueden ser útiles para tratar infecciones inflamatorias y el edema cerebral. Se deben efectuar hemogramas periódicos para controlar la toxicidad hematológica de la pirimetamina.13 NOTA: La seudotoxoplasmosis o síndrome de Sabin – Feldman, o toxoplasmosis seronegativa es un síndrome clínico análogo a la toxoplasmosis con serología negativa y ausencia de parásitos. Es MARIUXI MEDINA Q. CECILIA MUÑOZ P. 80 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA atribuida al virus de la rubéola o a los efectos de radiaciones ionizantes. Sólo deben tratarse las infecciones agudas. Tampoco necesitan tratamiento las formas de linfadenopatía en personas con capacidad inmunológica. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 81 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CAPITULO IV Enzimoinmunoensayo (ELISA) El estudio de los principios aplicados en los sistemas ELISA fue iniciado durante la década del’ 60 por investigadores que buscaban sustituir las técnicas de radioinmunoanálisis, marcados con que radioisótopos requieren y un sustratos instrumento complicado para contar la emisión radioactiva. Los sistemas básicos de detección por ELISA consisten en anticuerpos que están unidos a enzimas que mantienen la capacidad de catalizar una reacción cuyo producto final se visualizaba. Por otra parte los sitios de unión de los anticuerpos permanecen libres para combinarse con sus respectivos antígenos. El empleo de enzimas como marcadores tiene varias ventajas. La enzima que no modifica durante el proceso puede catalizar la reacción de gran número de moléculas del sustrato, amplificando la reacción y aumentando conjugados la posibilidad de detección. con enzimas son muy Los estables, a diferencia de los reactivos, y pueden conservarse MARIUXI MEDINA Q. CECILIA MUÑOZ P. 82 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA durante periodos relativamente prolongados. Además, la formación de un producto final coloreado permite la observación directa de la reacción o su medición con un instrumento sencillo. La mayoría de los sistemas ELISA desarrollados para la detección de agentes infecciosos consisten en un anticuerpo contra el agente en cuestión fijado firmemente a una matriz sólida, ya sea en la pared interior de las cavidades de una poli cubeta sobre la superficie de una esfera plástica o de metal o cualquier otra matriz sólida. Estos sistemas se denominan pruebas por inmunoadsorción en fase sólida (SPIA). Cuando se agrega a la matriz un líquido que contiene los antígenos correspondientes se forman complejos estables antígeno-anticuerpo. En estas pruebas son muy importantes las etapas de lavado para eliminar las moléculas adsorbidas en forma no específica. Luego se agrega un segundo anticuerpo contra el antígeno buscado. Este anticuerpo ha sido fijado a una enzima, como fosfatasa alcalina o peroxidasa que cataliza una reacción cuyo producto final es coloreado. Si el antígeno se ha unido a la matriz sólida, se unirá al MARIUXI MEDINA Q. CECILIA MUÑOZ P. 83 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA segundo anticuerpo, formándose un “sandwich” con el antígeno en el medio. Luego de un lavado para eliminar el anticuerpo marcado que no ha sido fijado, se agrega el sustrato correspondiente a la enzima con lo cual se completa la reacción. El producto final coloreado aparecerá en todos los puntos donde se encuentra la amplificación enzima. de la Dada reacción la capacidad pueden de detectarse cantidades muy pequeñas de antígeno (< 1 ng de antígeno/ml). El sistema descrito requiere un anticuerpo específico marcado con la enzima para cada antígeno que se desea investigar. Es más simple usar un ensayo indirecto que emplea un segundo anticuerpo no marcado que se une al complejo antígeno-anticuerpo fijado a la matriz. Un tercer anticuerpo, marcado con la enzima y dirigido contra la porción no variable Fc del segundo anticuerpo, se emplea entonces como marcador para la detección de numerosos complejos antígeno-anticuerpo diferentes. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 84 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA La prueba ELISA se basa en varias suposiciones: • Que el antígeno o anticuerpo puede enlazarse a una superficie portadora insoluble y retener su reactividad inmunológica. • Que las enzimas tienen actividad específica alta y convierten una cantidad relativamente grande del sustrato en producto detectable (relacionado con la amplificación de señal), lo que permite detectar concentraciones muy bajas del ligando. • Que la actividad enzimática o reactividad inmunológica de los conjugados se preserva y permanece estable durante el análisis y el almacenamiento y • Que las enzimas no están presentes en el líquido biológico que se va a analizar. 4.1. REACTIVOS Los anticuerpos que se emplean en el método ELISA son de origen monoclonal o son anticuerpos policlonales que se suministran como antisuero no fraccionado o fracciones de inmunoglobulina purificada. Los anticuerpos pueden ser solubles o estar inmóviles sobre un soporte sólido. Se emplean como conjugados no marcados o enzimáticos y por último MARIUXI MEDINA Q. CECILIA MUÑOZ P. 85 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA reaccionan con determinante antigénico específico de un antígeno o con un anticuerpo ligando-específico (anticuerpo primario), según el protocolo de análisis. Los estándares y controles son material liofilizado de origen humano, azida de sodio y determinada concentración de antígeno. Los conjugados enzimáticos son antígenos o anticuerpos unidos en forma covalente a la enzima de elección. El reactivo que se forma por enlace covalente de dos moléculas se denomina conjugado. También es posible marcar en forma no covalente anticuerpos o enzimas con biotina y agregar avidina. La avidina posee cuatro sitios de enlace para la biotina y no todos ellos participan en la interacción con el anticuerpo marcado con biotina. Los sitios de enlace libres restantes funcionan como aceptores para la enzima marcada con biotina. Este procedimiento se acorta utilizando anticuerpo marcado con biotina y avidina marcada con enzima. Se utilizan soluciones amortiguadoras para mantener el pH de la reacción y la concentración iónica, para diluir las muestras o como diluyente para reconstruir los reactivos liofilizados para el análisis. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 86 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Las combinaciones de enzima y sustrato que se emplean en los diversos métodos ELISA incluyen: • Peroxidasa de rábano y su sustrato, peróxido de hidrógeno, que en presencia de cromógeno ofenilendiamina producen un producto color amarillonaranja medible. • Galactosidasa beta y su sustrato o-nitrofenil-beta-D galactopiranósido que se transforma en un producto nitrofenolado amarillento medible o, • Fosfatasa alcalina y su sustrato p-nitrofenilfósfato que también se transforma en nitrofenolato. • El reactivo ácido sulfúrico 1-N, se utiliza para inhibir la actividad enzimática y estabilizar el producto final de reacción que tiene color. 4.2. ENSAYOS DE ENLACE COMPETITIVO Para detectar antígenos o haptenos con frecuencia se utiliza una reacción ELISA de enlace competitivo en fase sólida. En este tipo de análisis, el ligando no marcado compite con un ligando conjugado con enzimas por un número limitado de sitios de enlace con el anticuerpo inmovilizado. Tras una incubación MARIUXI MEDINA Q. CECILIA MUÑOZ P. 87 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA breve, se procede a separar el ligando enzimático conjugado enlazado y libre mediante la técnica de separación en fase sólida. Se agrega sustrato y la enzima presente en la fracción enlazada transforma el sustrato en un producto coloreado. La cantidad de producto que se forma se relaciona de manera inversa con la concentración del ligando no marcado en la muestra problema. estándares, controles Las y absorbancias muestras de problema los se determinan con un espectrofotómetro calibrado a la longitud de onda adecuada, en el lapso de dos horas que sigue a la adición del reactivo para detener la reacción. Las celdas de referencia que contienen únicamente ligando conjugado con enzima muestran mayor grado de color. La reducción de color en las celdas es proporcional a la cantidad de antígeno presente en los estándares, controles y muestras problema. La curva estándar se obtiene graficando en papel milimétrico el valor de la absorbancia promedio de cada conjunto de estándares por duplicado en el eje y, contra la concentración de antígeno que contiene cada MARIUXI MEDINA Q. CECILIA MUÑOZ P. 88 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA estándar en el eje x. El resultado es una línea recta. La concentración de antígeno en los controles y las muestras problema que se corrieron simultáneamente con los estándares se determina a partir de la curva estándar utilizando los valores promedio de absorbancia de las muestras por duplicado. Para determinar la concentración del control y de la muestra problema, se localiza la absorbancia promedio en el eje y de la curva estándar y se lee la concentración correspondiente en el eje x. Para detectar anticuerpos se utiliza el método ELISA de inhibición competitiva. En este tipo de análisis, el anticuerpo no marcado en la muestra problema compite con una concentración fija de anticuerpo conjugado-enzima para enlazarse a una cantidad limitada de antígeno inmovilizado sobre un soporte sólido. Después de la incubación, el material que no se enlaza se retira mediante lavado. Se añade el sustrato enzimático y tras incubar para que ocurra el cambio de color, se detiene la reacción enzimática añadiendo un reactivo. La actividad enzimática se reduce en presencia del anticuerpo de la muestra problema de manera que dentro del rango de detección del análisis MARIUXI MEDINA Q. CECILIA MUÑOZ P. 89 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA mientras mayor sea la concentración de anticuerpo, menor será la absorbancia de la muestra. 4.3. ENSAYOS NO COMPETITIVOS Los ensayos inmunoenzimétricos (IEMA), que también se denominan técnica del emparedado, son los métodos ELISA más empleados para detectar antígenos que tienen por lo menos dos determinantes antigénicos. Se adsorbe un exceso de anticuerpo específico para anticuerpos el antígeno monoclonales) (con sobre frecuencia perlas de poliestireno. Estos anticuerpos son específicos para un solo determinante antigénico en el antígeno de interés. Se incuban soluciones de la muestra problema con las perlas recubiertas de anticuerpo, de manera que todo el antígeno presente en la muestra problema se enlace con el anticuerpo inmóvil. Tras retirar el material que no se enlaza, la cantidad de antígeno que se enlazó con el anticuerpo anticuerpo segundo se cuantifica conjugado-enzima, determinante que antigénico añadiendo un reconoce un en el mismo antígeno. Después de la segunda incubación y el paso de separación, la actividad restante asociada con el MARIUXI MEDINA Q. CECILIA MUÑOZ P. 90 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA emparedado se determina añadiendo sustrato. La formación de producto se relaciona directamente con la cantidad de antígeno en los estándares, controles y muestras problema. Si el segundo anticuerpo es monoclonal pueden añadirse anticuerpos reactivos simultáneamente y sólo se requiere un paso de lavado. El cambio de color es proporcional a la cantidad de antígeno en la solución de prueba. La curva estándar se obtiene graficando en papel milimétrico el valor de absorbancia por medio de cada conjunto de estándares por duplicado, contra la concentración de antígeno que contiene cada estándar. El resultado es una línea recta. Las concentraciones de antígeno en el control y la muestra problema corridas por duplicado en forma simultánea con los estándares se definen a partir de la curva utilizando los valores de absorbancia promedio. La fosfatasa alcalina es la enzima de elección, ya que cataliza un solo paso de hidrólisis y se obtiene una curva de respuesta enzimática lineal. 4.4. APLICACIONES DE LABORATORIO Existen métodos ELISA disponibles para medir antígeno relacionado con el factor VIII, marcadores de MARIUXI MEDINA Q. CECILIA MUÑOZ P. 91 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA tumores, antígeno carcinoembriónico, fetoproteínas alfa, gonadotropina coriónica humana y anticuerpos (IgG e IgM) que produce el huésped como respuesta a diversas infecciones virales. Durante la última década, los análisis ELISA en fase sólida han constituido el método estándar para detectar anticuerpos al virus de inmunodeficiencia humana (HIV) (Electronucleonics Inc., o Biotech Laboratories, Rockville MD) y las muestras que presentan reactividad repetida se confirman mediante Recientemente se la prueba desarrolló un Westem método blot. ELISA (Dupont Corporation, Wilmington DE) para detectar antígenos al HIV en suero, plasma y líquido cefalorraquídeo, pero no es tan sensible como los demás métodos ELISA. Además de antígenos al HIV, se determinan otros antígenos virales con la prueba ELISA. La tendencia actual en detección de antígenos es utilizar anticuerpos monoclonales para identificar antígenos virales específicos, ya que estos anticuerpos se generan con más facilidad ante las proteínas virales de bajo peso molecular. Con frecuencia los métodos IEMA emplean anticuerpos monoclonales y permiten la detección de antígeno carcinoembriónico, fétoproteína MARIUXI MEDINA Q. CECILIA MUÑOZ P. 92 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA alfa, creatincinasa isoenzima (CK-MB), ferritina, hormona foliculoestimulante, gonadotropina coriónica humana, IgE, hormona luteinizante, prolactina, fosfatasa del ácido prostático, antígeno específico para próstata y hormona estimulante de la tiroides. 4.5. MUESTRA: La población estudiada corresponde a un número de 100 alumnas de la Escuela de Bioquímica y Farmacia de la Universidad de Cuenca, con un rango de edad comprendido entre los 17 a 26 años de los ciclos comprendidos entre primero y décimo; en estas se realizó un proceso de selección mediante una encuesta (ANEXOS), luego de revisar dichas encuestas se prefirieron las alumnas con las siguientes características: Características de inclusión: • Tener mascotas dentro de la casa especialmente gatos y pájaros. • Convivencia cercana con estos animales. • En las alumnas en estado de gestación. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 93 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA • La presencia de algún caso de toxoplasmosis en la familia. Luego de tomar en cuenta estos criterios se acudió a las alumnas seleccionadas y se les informo de la posibilidad de presentar toxoplasmosis y de la importancia del examen, dando a conocer a las mismas que el examen no era obligatorio. A las alumnas que decidieron realizarse el examen, la toma de la muestra fue de la siguiente manera: • Para realizar la toma de muestra se inició por primer ciclo, tomando en el día muestras a dos ciclos consecutivos, para evitar errores. • La toma se realizó en las primeras horas de la mañana en el Análisis Clínico, previo consentimiento de la doctora a cargo del laboratorio. • Paciente en ayunas, se toma 5ml de sangre cantidad suficiente para extraer la cantidad requerida de suero, dado que para cada MARIUXI MEDINA Q. CECILIA MUÑOZ P. 94 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA determinación necesitamos 10µl como la prueba se realizó por duplicado se necesito 20µl. • Luego se procedió a congelar los sueros previamente etiquetados. • Se informó a las pacientes el tiempo de realización de la prueba y que posteriormente se les entregaría el resultado. 4.6. ENSAYO: ELISA SÁNDWICH PARA LA DETECCIÓN DE ANTICUERPOS IgG ANTI-TOXOPLASMA GONDII EN SUERO HUMANO 4.6.1. PRINCIPIO: La prueba HUMAN ELISA TOXO IgG está basada en la clásica técnica ELISA. Los micropocillos ELISA son recubiertos con antígenos de Toxoplasma preparados con parásitos sonicados Toxoplasma gondii (taquizoítos). En la primera etapa de incubación, los anticuerpos anti-TOXO contenidos en la prueba o el control se fijan específicamente a los antígenos inmovilizados. Al final de la incubación, los MARIUXI MEDINA Q. CECILIA MUÑOZ P. 95 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA componentes excesivos son eliminados por lavado. En la segunda etapa de incubación, se añade un conjugado anti-IgG (anticuerpos anti-IgG-humana, marcados con peroxidasa) que se fija específicamente a los anticuerpos IgG. Se forman inmunocomplejos típicos. Después de eliminar el conjugado excesivo por lavado (segunda etapa de lavado) y añadir TMB/Sustrato (etapa tres), se forma un color azul que se transforma a amarillo después de parar la reacción. La intensidad de este color es directamente proporcional a la cantidad de anticuerpos anti-TOXO IgG en la muestra. 4.6.2. INTERPRETACIÓN DE RESULTADOS: La extinción de los colores y muestras se determina haciendo uso de un lector de micropocillos ELISA. Los resultados de los pacientes se obtienen por comparación con un valor de punto de corte (cut-off value) o por estimación cuantitativa en Unidades Internacionales por mililitro (UI/ml) basándose en una curva de calibración construida con el valor de control de punto de corte y tres controles positivos. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 96 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 4.6.3. REACTIVOS Y CONTENIDOS: • Micropocillos en porta tiras. • Tiras de ocho micropocillos cada uno, recubiertas con antígenos sonicados de T. gondii • Control TOXO IgG negativo. • Control TOXO IgG cut-off: 5UI/ml. • Control TOXO IgG positivo bajo: 30 UI/ml. • Control TOXO IgG positivo medio: 100 UI/ml. • Control TOXO IgG positivo alto: 200 UI/ml. • Buffer de dilución IgG: pH 6.5 +/- 0.2 Buffer Fosfato…………………………….. 10 mmol/l. Cloruro de sodio…………………………….... 8 g/l. Albúmina…………………………………….. 10 g/l. • Conjugado anti IgG Anti-IgG-Humano, marcado con peroxidasa (conejo). • Solución de lavado. Buffer TRIS pH 7.2 +/-* 0.2 • Reactivo substrato pH 3.7 +/- 0.2 3,3’, 5,5’-Tetrametilbenzidina (TMB)…. 1.2 mmol/l MARIUXI MEDINA Q. CECILIA MUÑOZ P. 97 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Peróxido de Hidrógeno…………………. 3 mmol/l. • Solución de parada Ácido Sulfúrico…………………………... 0.5 mmol/l. • Cintas adhesivas. 4.6.4. PREPARACIÓN DE REACTIVOS: • Solución de lavado de trabajo: diluir 1 porción de solución de lavado con 20 porciones de agua desyonizada fresca. Ejm., 50ml de solución de lavado más 1.000ml de agua igual 1.050ml. • Muestra: diluir el suero del paciente 1 + 100 con buffer de dilución IgG. Por ejemplo 10µl de suero + 1ml de buffer de dilución y mezclar vigorosamente. 4.6.5. PROCEDIMIENTO: 4.6.5.1. ETAPA 1: • Dejar el pocillo A1 para el blanco. • Pipetear 100µl de control cut-off 5UI/ml en B1/C1. • Pipetear 100µl de control positivo bajo 30UI/ml en D1/E1. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 98 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA • Pipetear 100µl de control positivo medio 100UI/ml en F1/G1. • Pipetear 100µl de control positivo alto 200UI/ml en H1/A2. • Pipetear 100µl de control negativo en B2/C2. • Pipetear las muestras diluidas desde D2 en adelante por duplicado. • Cubrir con cintas adhesivas. • Incubar por 30’ a temperatura ambiente. • Lavar 4 veces como se describe a continuación: - Remover las cintas adhesivas. Aspirar el contenido (en un envase con una Solución de Hipoclorito de Sodio al 5%). - Agregar 350ml de la solución de lavado de trabajo, aspirar después de aproximadamente 30 segundos y repetir el lavado 4 veces. 4.6.5.2. ETAPA 2: • Adicionar 100µl de conjugado Anti-IgG a todos los pocillo excepto al blanco A1. • Cubrir con cintas adhesivas. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 99 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA • Incubar por 30’ a temperatura ambiente. • Lavar 5 veces como se describe en la etapa 1. 4.6.5.3. ETAPA 3: • Adicionar 100µl de substrato a todos los posillos incluyendo el blanco. • Incubar por 15’ a temperatura ambiente, en la oscuridad. • Detener la reacción enzimática adicionando 100µl de la solución de parada a todos los pocillos. • Mezclar cuidadosamente. • Leer la absorbancia a 450nm, llevando a cero de absorbancia el instrumento lector de ELISA con el blanco de sustrato del pocillo A1. 4.6.6. CÁLCULO DE VALORES DE CONTROL Y PUNTO DE CORTE: Valores promedio de absorbancia tanto de los controles como del punto de corte. MCC = A450 (B1) + A450 (C1) 2 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 100 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA MCC: Media del punto de corto. A450: Absorbancia a 450nm 4.6.7. VALIDACIÓN DELA PRUEBA: La serie analítica puede considerarse válida si cumple con los siguientes criterios: • Blanco sustrato en pocillo A1 < 0.150. • La media del control negativo < a la media del cut-off. • La media del control positivo medio > 0.750. • La media del control positivo medio / la media del punto de corte > 5. 4.6.8 INTERPRETACIÓN DE LOS RESULTADOS: 4.6.8.1. CUALITATIVA: • Muestras con valores de absorbancia mayores o igual al cut-off son consideradas positivas. • Muestras con valores de absorbancia menores al cut-off son consideradas negativas. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 101 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 4.6.8.2. CUANTITATIVA: Para una estimación cuantitativa de los niveles de anticuerpos Anti-Toxoplasma IgG en muestras positivas UI/ml, el valor de el punto de corte y los controles se grafica en las ordenadas, este se grafica contra sus correspondientes concentraciones de Anti-T. gondii IgG de 5, 30, 100 y 200UI/ml en las absisas. La estimación de los niveles de anticuerpos de los pacientes se lee en el gráfico utilizando los valores individuales de absorbancia de las muestras. - Pacientes con valor mayor a 200 UI/ml deben ser reanalizadas con una dilución mayor antes de proceder definitivamente al cálculo del nivel de anticuerpos. 1 2 3 A Blanco200 M3 B 5UI Neg. M4 C 5UI Neg. M4 D 30 M1 etc.… E 30 M1 F 100 M2 G 100 M2 H 2OO M3 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 4 5 6 7 8 9 10 11 12 102 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA NOTA: M1…: muestra 1 M2…: muestra 2... 4.6.9. VALORES DE REFERENCIA: Se considera que una prueba de ELISA con un valor menor del punto de corte es negativa; con un valor mayor al punto de corte es positiva. Un valor de hasta 300UI/ml indica infección pasada o en evolución, y más de 300 UI/ml se refiere a enfermedad activa o reciente. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 103 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CAPITULO V RESULTADOS Curva Nº 1/set Nº 1 Blanco= 0.071 Greyzone= 0.150 Cutt-off= STD 1 (1) + DTD 1 (2) = 0.213 + 0.207 = 0.210 2 2 Estandares Absorbancia 450 nm Promedio absorbancia Desviación estándar 1. CC: Cuttoff 2. PCL 0.213 0.207 0.473 0.487 1.127 1.115 2.183 2.175 0.210 3. PCM 4. PCH Concentración UI/ml 0.004 Coeficiente de variación % 1.905 0.480 0.010 2.083 30 1.121 0.008 0.713 100 2.179 0.007 0.321 200 Coeficiente de variación % 0.054 Concentración UI/ml Control Absorbancia 450 nm Promedio absorbancia Desviación estándar Control negativo 0.201 0.201 0.201 0.000 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 5 ________ 104 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Paciente Edad Ciclo 20 1 20 1 19 1 20 1 19 1 20 1 17 1 19 1 18 1 23 9 19 2 18 2 18 2 19 2 19 2 18 2 19 2 19 2 20 2 21 4 20 4 20 4 19 4 21 4 1. Doris Saquisilí 2. María Cristina Torres 3. Maritza Tacuri 4. Janneth Campusano 5. Anita Bueno 6. Martha Amaya 7. Teresa Apuparo 8. Stephanie Cárdenas 9. Paulina Sánchez 10. Johann Guevara 11. Adriana Jara 12. Marcia Ávila 13. Veronica Maldonado 14. Sienna Peralta 15. Diana Juca 16. Adriana Perez 17. Johana Enriquez 18. Cristina Perez 19. Esthela Mora 20. Mayra García 21. Karla Ruiz 22. Tatina Becerra 23. Lucrecia Brito 24. Gabriela Zambrano MARIUXI MEDINA Q. CECILIA MUÑOZ P. Abs. 450 nm Media Abs. D. S. C. V. % Concent. (UI/ml) 1.346 1.447 0.418 0.392 Fuera de curva 0.200 0.186 0.660 0.684 0.873 0.791 0.572 0.498 0.435 0.416 1.396 0.072 5.142 123 0.405 0.018 4.444 25.5 ______ ______ _______ ___________ 0.193 0.009 5.181 5 0.672 0.017 2.529 52 0.832 0.058 6.973 67.5 0.535 0.053 9.906 38.5 0.427 0.015 3.513 28 0.302 0.025 8.568 15.5 0.281 0.015 5.265 13.5 0.336 0.011 3.274 19 0.122 0.009 7.226 0 0.277 0.008 2.889 14 0.206 0.009 4.133 6 0.400 0.001 0.141 25 0.181 0.011 6.077 3.5 0.295 0.012 4.067 9.5 0.198 0.007 3.535 5.5 0.159 0.007 4.133 0 0.204 0.020 9.804 5 ______ ______ _______ ___________ 0.409 0.012 2.934 26.5 0.494 0.047 5.515 34 0.901 0.015 1.665 74.5 0.320 0.283 0.270 0.291 0.344 0.328 0.114 0.126 0.383 0.271 0.212 0.200 0.401 0.400 0.189 0.173 0.304 0.286 0.203 0.193 0.155 0.164 0.218 0.190 Fuera de curva 0.418 0.400 0.527 0.461 0.911 0.890 105 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 25. Cecilia Durán 26. Diana Carpio 27. Johanna Inga 28. María Montaleza 29. Andrea Cabrera 30. Digna Sarmiento 31. Mónica Narváez 32. Soledad Yanque 33. Wilma Taxi 34. Sandra Chávez 35. Verónica Zapata 36. Diana Tapia 20 4 19 4 21 4 19 4 20 4 20 4 20 4 20 4 19 4 21 4 20 4 19 4 Fuera de curva 0.564 0.584 Fuera de curva Fuera de curva 0.252 0.264 1.290 1.387 0.292 0.299 0.349 0.335 0.423 0.439 1.170 1.090 0.360 0.331 0.398 0.342 ______ ______ _______ ___________ 0.574 0.014 2.939 42 ______ ______ _______ ___________ ______ ______ _______ ___________ 0.258 0.008 3.101 11.5 1.339 0.069 5.141 117 0.296 0.005 1.689 14.5 0.342 0.009 2.631 19 0.431 0.011 2.552 28.5 1.130 0.057 5.022 97 0.345 0.021 5.958 20 0.370 0.040 10.811 22.5 ABSORBANCIA Media Error típico Mediana Moda Desviación estándar Varianza de la muestra Curtosis Coeficiente de asimetría Rango Mínimo Máximo Suma Cuenta Nivel de confianza (95.0%) MARIUXI MEDINA Q. CECILIA MUÑOZ P. 0,4616129 0,05952332 0,345 #N/A 0,3314118 0,10983378 2,29927864 1,69897746 1,274 0,122 1,396 14,31 31 0,1215627 UI 31,0645161 5,8572968 20 5 32,6120484 1063,5457 2,26716494 1,69359729 123 0 123 963 31 11,9621836 106 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA HISTOGRAMA DE ABSORBANCIAS Clase Frecuencia Clase Frecuencia 0,122 0,3768 0,6316 0,8864 1,1412 Y mayor... 1 16 8 2 2 2 0,3768 0,6316 0,8864 1,1412 Y mayor... 0,122 16 8 2 2 2 1 Frecuencia Lectura de absorbancia 20 15 10 5 0 Frecuencia 0,3768 0,6316 0,8864 1,1412 y mayor... 0,122 Absorbancia Se observa mayor incidencia de las lecturas de absorbancia en la clase 0.3768 seguido de la clase 0.6316 lo que indica que en estas clases esta la mayor concentración de muestras. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 107 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA HISTOGRAMA DE UNIDADES INTERNACIONALES Clase Frecuencia Clase Frecuencia 0 24,6 49,2 73,8 98,4 y mayor... 2 15 8 2 2 2 24,6 49,2 0 73,8 98,4 Y mayor... 15 8 2 2 2 2 20 15 10 5 0 y mayor... 98,4 73,8 49,2 0 Frecuencia 24,6 Frecuencia Título de Anticuerpos UI/ml Este Histograma es equivalente al primero, este representa el observándose título al de igual Anticuerpos que el en anterior UI/ml mayor concentración de las muestras en las dos primeras clases. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 108 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Curva Nº 2/set Nº 2 Blanco: 0.067 Grey zone= 0.150 Cutt-off= STD 1 (1) + DTD 1 (2) = 0.323 + 0.339 = 0.331 2 2 Estándares Absorbancia Promedio Desviación 450 nm absorbancia estándar 1. CC: Cutt-off 2. PCL 3. PCM 4. PCH 0.323 0.339 0.490 0.510 1.199 1.237 2.153 2.073 0.331 0.011 Coeficiente de variación % 3.323 0.500 0.014 2.8 30 1.218 0.027 2.216 100 2.113 0.056 2.628 200 Coeficiente de variación % 18.412 Concentración UI/ml Control Absorbancia 450 nm Promedio absorbancia Desviación estandár Control negativo 0.066 0.086 0.076 0.014 MARIUXI MEDINA Q. CECILIA MUÑOZ P. Concentración UI/ml 5 _________ 109 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Paciente 3. Maritza Tacuri Edad Ciclo 19 1 20 4 20 4 20 4 20 4 20 4 19 4 19 4 19 4 19 4 19 4 22 4 21 4 26 6 23 6 25 6 22 6 21 6 22 6 21 6 21 6 22 6 21 6 20 6 22 22 6 6 21. Karla Ruíz 25. Cecilia Durán 27. Johana Inga 28. María Montaleza 37. Gabriela Valarezo 38. Karina Ulloa 39. Priscila Sánchez 39. Priscila Sánchez 40. Gabriela Astudillo 41. Diana Ávila 42. Noemí Cabrera 43. Julia González 44. Jessica Vega 45. Gabriela Ortega 46. Ruth Muñoz 47.Yenny Zhiña 48. María Guamán 49. Mayra Pesántez 50. Maritza Lamuelle 50. Maritza Lamuelle 51. Jenny Morocho 52. Mónica León 53. Yessica León 54. Gabriela Rodas 55. Cecibel Idrovo MARIUXI MEDINA Q. CECILIA MUÑOZ P. Abs 450 nm 1.325 1.194 0.723 0.637 0.654 0.610 Media Abs. 1.260 D.S. C.V% 0.093 7.348 0.680 0.061 8.971 0.632 0.031 4.906 1.485 1.443 0.551 0.577 0.261 0.244 1.520 1.699 Fuera de curva 1.368 1.314 0.416 0.418 0.167 0.157 0.699 0.683 0.551 0.575 0.505 0.475 0.480 0.468 0.217 0.201 0.351 0.305 0.626 0.648 0.614 0.531 Fuera de curva 1.376 1.444 1.913 2.001 1.299 1.383 1.232 1.186 1.813 1.797 0.386 0.490 0.029 1.981 0.564 0.018 3.191 0.253 0.012 4.743 32X4=128 (dilución ¼) 39X3=117 (dilución 1/3) 7 1.609 0.126 7.831 148 ______ ______ ___________ 1.341 0.038 ______ _ 3.580 0.417 0.001 0.291 121X2=242 (dilución ½) 25 0.163 0.008 4.908 0 1.690 0.012 0.725 156.5 0.563 0.016 2.841 39 0.490 0.021 4.294 32 0.477 0.012 2.515 31 0.209 0.011 5.263 3 0.328 0.033 15.5 0.637 0.015 10.06 1 2.354 0.573 0.059 40.5 ______ ______ 1.410 0.048 10.30 0 ______ _ 3.404 1.957 0.062 3.168 128X2=256 (dilución ½) 185 1.341 0.059 4.400 120 1.209 0.033 2.729 107 1.805 0.011 0.609 168.5 0.367 0.027 7.357 20 Concent. UI/ml 112X2=224 (dilución ½) 52X3=156 (dilución ½) 47X3=141 (dilución 1/3) 47 ___________ 110 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 56. Nube Tenezaca 57. Cecilia Tapia 10.60 6 2.333 55 31.5 0.101 11.33 1 10.94 5 6.352 146.5 0.262 0.013 4.961 8.5 0.289 0.039 11.5 0.256 0.011 13.61 4 4.296 1.313 0.034 2.589 117 0.208 0.008 3.486 3 0.710 0.075 0.687 0.016 0.485 0.055 3 0.698 0.676 0.446 0.523 0.994 0.109 20 3 1.071 0.917 3 20 3 1.667 1.523 0.271 0.253 0.261 0.317 1.595 20 0.248 0.264 1.289 1.337 0.202 0.214 21 6 24 6 58. María Luzuriaga 20 59. Mónica Matute 60. María Guachi 61. Patricia Coronel 0.348 0.763 0.657 62. Magali Chunchi 20 3 20 3 20 3 63. Sandra Fajardo 64. Eliana Baculima 65. Ana Carrión 22 5 ABSORBANCIA Media Error típico Mediana Moda Desviación estándar Varianza de la muestra Curtosis Coeficiente de asimetría Rango Mínimo Máximo Suma Cuenta Nivel de confianza (95.0%) MARIUXI MEDINA Q. CECILIA MUÑOZ P. 0,80188235 0,09212148 0,6025 0,49 0,53715591 0,28853647 -0,8526803 0,70513921 1,794 0,163 1,957 27,264 34 0,18742271 53 84 8 UI 86,0882353 12,9938192 54 117 75,7663344 5740,53743 -0,63277653 0,66779681 256 0 256 2927 34 26,4361448 111 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA HISTOGRAMA DE ABSORBANCIAS Clase Frecuencia Clase Frecuencia 0,163 0,5218 0,8806 1,2394 1,5982 y mayor... 1 13 8 2 6 4 0,5218 0,8806 1,5982 Y mayor... 1,2394 0,163 13 8 6 4 2 1 15 10 5 0 0,163 1,2394 y mayor... 1,5982 0,8806 Frecuencia 0,5218 Frecuencia Lectura de absorbancia Absorbancia Se observa mayor incidencia de las lecturas de absorbancia en la clase 0.5218 seguido de la clase 0.8806 lo que indica que en estas clases esta la mayor concentración de muestras. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 112 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA HISTOGRAMA DE UNIDADES INTERNACIONALES Clase Frecuencia Clase Frecuencia 0 51,2 102,4 153,6 204,8 Y mayor... 1 15 3 8 4 3 51,2 153,6 204,8 102,4 Y mayor... 0 15 8 4 3 3 1 20 15 10 5 0 0 y mayor... 102,4 204,8 153,6 Frecuencia 51,2 Frecuencia Título de anticuerpos UI/ml Este Histograma es equivalente al primero, representa el título de Anticuerpos en UI/ml observándose de igual que el anterior mayor concentración de las muestras en las dos primeras clases. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 113 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Curva Nº 3/set Nº 3 Blanco= 0.070 Greyzone= Cutt-off= 0.150 STD 1 (1) + DTD 1 (2) = 0.217 + 0.205 = 0.211 2 2 Estandares Absorbancia 450 nm Promedio absorbancia Desviació n estandár 1. CC: Cuttoff 2. PCL 0.217 0.205 0.436 0.404 1.082 1.158 2.159 2.073 0.211 3. PCM 4. PCH Concentración UI/ml 0.008 Coeficiente de variación % 3.791 0.420 0.023 5.467 30 1.120 0.054 4.821 100 2.116 0.056 2.628 200 Coeficiente de variación % 0.005 Concentración UI/ml Control Absorbancia 450 nm Promedio absorbancia Desviación estandár Control negativo 0.206 0.205 0.205 0.001 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 5 ________ 114 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Paciente Edad Ciclo 21 5 20 5 20 5 21 5 23 5 21 5 21 21 5 5 21 5 21 8 22 8 22 8 23 8 22 8 22 8 21 8 22 8 22 7 23 7 22 7 22 7 24 9 23 9 23 9 66. Cinthya Bravo 67. Carmen Ortega 68. Mayra Castro 69. Viviana Arévalo 70. Diana Deleg 71. Lourdes Ramón 72. Silvia Torres 73. Silvana Álvarez 74. Yessica Portillo 75. Margarita Esquivel 76. Fanny Gonzales 77.Yomaira Gutiérrez 78. Lourdes Pacheco 79. Veronica Trelles 80. Sandra Banegas 81. Yessica Nieto 82. Ines Baculima 83. Elizabeth C 84. Monica Pardo 85. Tania Zavala 86. Magali Obano 87. Fanny Zaruma 88. Verónica Espinoza 89. Eulalia Tenezaca MARIUXI MEDINA Q. CECILIA MUÑOZ P. Abs 450 nm Media Abs. D.S. C.V. % Concent. UI/ml 0.176 0.252 0.301 0.379 0.198 0.197 0.281 0.199 1.391 1.491 0.441 0.479 0.146 0.135 0.428 0.323 0.089 0.121 0.251 0.211 1.490 1.650 0.214 0.054 18.126 4.5 0.340 0.055 16.167 18 0.197 0.001 0.508 3 0.240 0.058 24.167 7.5 1.441 0.071 4.927 131 0.460 0.026 5.740 30 0.141 0.008 5.607 0 0.376 0.074 19.730 21 0.105 0.023 21.905 0 0.231 0.028 12.121 6.5 1.570 0.113 7.197 145X2=290 (dilución ½) 0.269 0.209 0.381 0.507 0.224 0.141 1.519 1.405 0.227 0.182 0.306 0.308 1.381 1.426 0.091 0.142 0.123 0.111 1.141 1.070 0.237 0.211 0.085 0.083 0.114 0.098 0.239 0.042 17.792 7 0.444 0.090 20.270 28 0.183 0.059 32.384 1 1.462 0.081 5.515 133.5 0.229 0.067 29.200 6.5 0.307 0.001 0.406 15 1.402 0.030 2.140 0.116 0.036 31.129 127X2=254 (dilución ½) 0 0.117 0.008 6.981 0 1.105 0.050 4.482 96.5 0.224 0.018 8.036 5.5 0.084 0.001 1.430 0 0.106 0.011 10.406 0 115 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 90. Karina Ormaza 91. Lady Gavilanez 92. María Cherrez 93. Janeth Campoverde 94. Fanny Gonzales 95. Monica Valarezo 96. Malena Iñiguez 97. Adriana Bermeo 98. Lorena Bravo 99. Diana Criollo 100. Malena Matamoros 23 9 22 9 22 7 24 7 20 3 23 7 20 3 25 9 23 10 22 7 26 10 0.140 0.112 0.175 0.151 0.128 0.137 0.102 0.080 0.267 0.257 0.104 0.073 0.072 0.078 0.238 0.195 1.746 1.848 0.141 0.092 0.206 0.180 0.126 0.020 15.874 0 0.163 0.017 10.429 0 0.132 0.006 4.676 0 0.091 0.016 17.582 0 0.262 0.008 2.876 10 0.088 0.022 24.609 0 0.075 0.004 5.610 0 0.216 0.030 13.994 5 1.797 0.072 4.007 168 0.117 0.035 29.613 0 0.193 0.018 9.326 2 ABSORBANCIA Media Error típico Mediana Moda Desviación estándar Varianza de la muestra Curtosis Coeficiente de asimetría Rango Mínimo Máximo Suma Cuenta Nivel de confianza (95.0%) MARIUXI MEDINA Q. CECILIA MUÑOZ P. 0,41694286 0,08443122 0,216 0,117 0,49950181 0,24950206 1,7821728 1,80125785 1,722 0,075 1,797 14,593 35 0,17158476 UI 35,5285714 12,2991074 5 0 72,7625007 5294,38151 5,47850043 2,45823172 290 0 290 1243,5 35 24,9947771 116 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA HISTOGRAMA DE ABSORBANCIAS Clase Frecuencia Clase Frecuencia 0,075 0,4194 0,7638 1,1082 1,4526 Y mayor... 1 26 2 1 2 3 0,4194 Y mayor... 0,7638 1,4526 0,075 1,1082 26 3 2 2 1 1 Frecuencia Lectura de absorbancia 30 20 10 0 Frecuencia 0,4194 y 0,7638 mayor... 1,4526 0,075 1,1082 Absorbancia Se observa mayor incidencia de las lecturas de absorbancia en la clase 0.4194 lo que indica que esta clase es la de mayor concentración de muestras. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 117 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA HISTOGRAMA DE UNIDADES INTERNACIONALES Clase Frecuencia Clase Frecuencia 0 58 116 174 232 Y mayor... 13 16 1 3 0 2 58 0 174 Y mayor... 116 232 16 13 3 2 1 0 Frecuencia Título de anticuerpos 20 15 10 5 0 Frecuencia 58 0 174 y mayor... 116 232 UI/ml Este Histograma es equivalente al primero, representa el título de Anticuerpos en UI/ml observándose de igual que el anterior mayor concentración de la muestra en la primera clase. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 118 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA PRUEBA F PARA VARIANZAS DE DOS MUESTRAS CURVAS DE CALIBRACION: 1-2 (ABSORBANCIAS) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) CURVA 1 0,8382 0,7016717 5 4 1,03130096 0,48844393 CURVA 2 0,8476 0,6803753 5 4 6,38823394 CURVAS DE CALIBRACION: 2-3 (ABSORBANCIAS) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) MARIUXI MEDINA Q. CECILIA MUÑOZ P. CURVA 2 0,8476 0,6803753 5 4 1,01602948 0,49403687 CURVA 3 0,8144 0,6696413 5 4 6,38823394 119 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CURVAS DE CALIBRACION: 1-3 (ABSORBANCIAS) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) CURVA 1 0,8382 0,7016717 5 4 1,04783218 0,48248508 CURVA 3 0,8144 0,6696413 5 4 6,38823394 NOTA: No se realiza la prueba F para varianzas de dos datos para la concentración de los patrones ya son las mismas. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 120 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA PRUEBA F PARA VARIANZAS DE DOS MUESTRAS MUESTRAS: SETS 1-2 (ABSORBANCIAS) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) SET 1 0,4616129 0,10983378 31 30 0,38065822 0,00449915 SET 2 0,80188235 0,28853647 34 33 0,54844129 MUESTRAS: SETS 2-3 (ABSORBANCIAS) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) MARIUXI MEDINA Q. CECILIA MUÑOZ P. SET 2 0,80188235 0,28853647 34 33 1,15644927 0,33754572 SET 3 0,41694286 0,24950206 35 34 1,77740844 121 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA MUESTRAS: SETS 1-3 (ABSORBANCIAS) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) SET 1 0,4616129 0,10983378 31 30 0,44021192 0,01249478 SET 3 0,41694286 0,24950206 35 34 0,55001692 MUESTRAS: SETS 1-2 (UNIDADES INTERNACIONALES) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) MARIUXI MEDINA Q. CECILIA MUÑOZ P. SET 1 31,0645161 1063,5457 31 30 0,18526936 5,5688E-06 SET 2 86,0882353 5740,53743 34 33 0,54844129 122 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA MUESTRAS: SETS 2-3 (UNIDADES INTERNACIONALES) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) SET 2 86,0882353 5740,53743 34 33 1,0842697 0,4074475 SET 3 35,5285714 5294,38151 35 34 1,77740844 MUESTRAS: SETS 1-3 (UNIDADES INTERNACIONALES) Prueba F para varianzas de dos muestras Media Varianza Observaciones Grados de libertad F P(F<=f) una cola Valor crítico para F (una cola) MARIUXI MEDINA Q. CECILIA MUÑOZ P. SET 1 31,0645161 1063,5457 31 30 0,20088195 1,2367E-05 SET 3 35,5285714 5294,38151 35 34 0,55001692 123 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA ANÁLISIS DE LAS PRUEBAS F PARA VARIANZAS DE DOS MUESTRAS Partimos de la hipótesis: S1 = S2 (varianza 1 = varianza 2) para que esta hipótesis se cumpla F de la prueba debe ser menor o igual (<) a F crítico. Para las curvas de calibración: F prueba < F crítico Curvas 1-2: 1,03130096 < 6,38823394 Curvas 2-3: 1,01602948 < 6,38823394 Curvas 1-3: 1,04783218 < 6,38823394 Para las muestras: F prueba < F crítico Absorbancias Muestras 1-2: 0,38065822 < 0,54844129 Muestras 2-3: 1,15644927 < 1,77740844 Muestras 1-3: 0,44021192 < 0,55001692 MARIUXI MEDINA Q. CECILIA MUÑOZ P. 124 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Unidades Internacionales Muestras 1-2: 0,18526936 < 0,54844129 Muestras 2-3: 1,0842697 Muestras 1-3: 0,20088195 < 0,55001692 < 1,77740844 Como la condición se cumple los tres sets de reactivos son iguales. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 125 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA CAPITULO VI CONCLUSIONES Y RECOMENDACIONES 6.1. CONCLUSIONES: De acuerdo a los objetivos planteados, que son: • Evaluar los resultados obtenidos con las muestras. • Determinar el índice de toxoplasmosis en las alumnas de la escuela de Bioquímica y Farmacia. • Dar a conocer los resultados obtenidos para concientizar al alumnado sobre el peligro de la enfermedad. Para el estudio de 100 personas pertenecientes a la Escuela de Bioquímica y Farmacia de la Universidad de Cuenca que corresponde a la población estudiada, se llegó a las siguientes conclusiones: • Se hizo una preselección de las alumnas para el respectivo análisis, mediante la realización de una encuesta escrita (Anexos). • La selección se hizo tomando en cuenta la convivencia de las alumnas con animales domésticos principalmente el gato, que es el huésped definitivo de Toxoplasma gondii. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 126 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA • Se efectuaron los análisis obteniéndose un título de anticuerpos Anti-Toxoplasma gondii menor a 300 UI/ml en todas muestras, lo que indica que ninguna de las alumnas sometidas al análisis es portadora de T. gondii, ya que la teoría nos indica que un título menor a este corresponde a una infección pasada y por lo tanto no se requiere de un tratamiento. • Según este resultado la hipótesis planteada no se cumple, habiendo un 0% de portadoras de T. gondii, pero se debe tener en cuenta que los títulos obtenidos de anticuerpos IgG-Anti T. gondii en la práctica nos muestran que se presenta una infección pasada o en proceso de evolución en un gran número de alumnas. • Sobre la técnica podemos decir, que es de fácil realización, y una de las más empleadas para el diagnóstico de la Toxoplasmosis, además mediante la determinación de la prueba F para varianzas de dos muestras se comprobó que los tres sets de MARIUXI MEDINA Q. CECILIA MUÑOZ P. 127 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA reactivos se trabajaron de igual manera, dando mayor seguridad a la prueba. 6.2. RECOMENDACIONES: Como se sabe la incidencia de Toxoplasmosis a nivel mundial es elevada, la infección por ooquistes predomina en países tropicales, en donde hay más contaminación fecal del suelo por heces del gato, con predominio mayor en la ciudades, por la más estrecha convivencia con estos animales. Lo contrario sucede en países no tropicales, en donde predomina la transmisión por carnes. Los factores económicos y sociales no tienen relación especial con este parásito, pero los culturales influyen, pues la costumbre de comer carne cruda o mal cocida y la de tener gatos en las casas favorecen la infección. Para prevenir la infección en el hombre se hacen las siguientes recomendaciones: a) Higiene personal y familiar para evitar la ingestión de ooquistes presentes en la tierra. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 128 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA b) Saneamiento ambiental y control de cucarachas, moscas, etc., por la posibilidad de actuar como vectores mecánicos. c) Buen cocimiento de las carnes y lavado de las manos después de manipularlas. d) Cuidados en relación con los gatos: evitar su alimentación con carne cruda, cuidados especiales con sus materias fecales, control de ratones y ratas que son fuente de infección para los gatos, evitar el contacto con ellos, especialmente los niños y las embarazadas. Basándonos en nuestro estudio recomendamos lo siguiente: • Que mediante extensión universitaria se llegue hacia los sectores en riesgo, con la finalidad de instruir sobre esta enfermedad, sus peligros, consecuencias y la manera de prevenirla. • Todas las mujeres en edad fértil deben realizarse un examen antes de la concepción para evitar daños al feto. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 129 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA • Fácil acceso y publicidad de prueba de laboratorio, en el Laboratorio de Atención al público de la Facultad para todas las estudiantes universitarias. • Mejorar nuestros hábitos alimenticios, comer en lugares con buena higiene. • Tener las mascotas fuera de la casa, con una buena higiene y manejar de manera adecuada sus excretas; y desparasitar permanentemente a las mismas. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 130 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA ANEXOS 1. FOTOGRAFÍAS DE LAS DIFERENTES FORMAS DEL PARÁSITO Figura 6. Detalle de la estructura quística ocupada totalmente por bradizoitos de Toxoplasma gondii. Figura 7. Taquizoitos de toxoplasma Toxoplasma gondii Note las características en forma curva. Aunque este es un estado intracelular, MARIUXI MEDINA Q. CECILIA MUÑOZ P. 131 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA las células contienen taquizoitos (macrogametos). Cada taquizoíto mide aproximadamente 10 µm de longitud. Figura 8.Otro ejemplo de Taquizoítos de Toxoplasma gondii. (Imagen Original de Oklahoma State University, College of Veterinary Medicine.) MARIUXI MEDINA Q. CECILIA MUÑOZ P. 132 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 9. Taquizoíto Intracelular de Toxoplasma gondii. (Imagen Original de "Parasites in Human Tissues," Department of Parasitology, Kyungpook National University School of Medicine, Korea.) Figura 10. Toxoplasma gondii bradizoítos (*) en una sección de tejido de cerebro de ratón infectado experimentalmente. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 133 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 11. Toxoplasma gondii bradizoitos (*) en una sección de tejido de cerebro de un ratón infectado experimentalmente. Esta fase de ciclo de vida se encuentra durante la fase crónica de la infección, y puede encontrarse en casi cualquier órgano del cuerpo. Figura 12. Un zoitocisto de Toxoplasma gondii junto con bradizoítos; este zoitocisto es en el músculo cardíaco. Figura 13. Un ooquiste esporulado de Toxoplasma gondii. El ooquiste contiene dos esporozoitos, cada uno contiene cuatro esporozoitos. Así, ellos se parecen el ooquistes de Isospora sp. Sólo gatos producirán y paso el oocquistes de Toxoplasma; el diámetro aproximado = 10µm. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 134 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 14. Un ooquiste esporulado de Toxoplasma gondii.4 4 INTERNET http://editorial.unab.edu.co/revistas/medunab/pdfs/r24rt_c3.html 2. FOTOGRAFÍAS TOMADAS EN LA REALIZACIÓN DE LA PRÁCTICA MARIUXI MEDINA Q. CECILIA MUÑOZ P. 135 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 15. SET de Reactivos IgG Anti -Toxoplasma gondii (HUMAN). Figura 16. Dilución de los suero 1 + 100 con Buffer de dilución. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 136 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 17. Sueros diluidos. Figura 18. Micropocillos con antígenos de Toxoplasma gondii. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 137 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 19. Primera Etapa: cargado de estándares y sueros diluidos en los micropocillos. Figura 20. Primera Etapa: micropocillos cargados, incubación por 30 minutos a temperatura ambiente. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 138 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 21. Lavador automático para el equipo de ELISA. Figura 22. Proceso de lavado: cinco ciclos. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 139 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 23. Segunda etapa: adición del conjugado Anti- IgG a todos los pocillos acepto el Blanco, incubación por 30 minutos a temperatura ambiente. Figura 24. Segundo lavado: cinco ciclos. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 140 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 25. Tercera Etapa: Adición de sustrato a todos los micropocillos con incubación en la oscuridad por 15 minutos. Figura 26. Adición de solución de parada a todos los micropocillos, mezclar cuidadosamente para proceder a la lectura. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 141 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Figura 27. Lector de micro-ELISA. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 142 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Encuesta: UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUIMICAS ESCUELA DE BIOQUIMICA Y FARMACIA ENCUESTA PREVIA LA REALIZACION DE LA TESIS: “Determinación de IgG Anti-Toxoplasma gondii en las alumnas de la Escuela de Bioquímica y Farmacia de la Universidad de Cuenca”. DATOS PERSONALES: NOMBRES Y APELLISOS: _________________________________________ EDAD: _____________________ CICLO: _____________________ ESTADO CIVIL: _____________ CUESTIONARIO: 1. TIENE UD. MASCOTAS EN SU CASA, CUALES SON? 2. SU MACOTA PERMANECE DENTRO O FUERA DE LA CASA? ___________________________________________________________________ 3. CUANTO TIEMPO TIENE SU MASCOTA? 4. PASA GRAN PARTE DE SU TIEMPO CON SU MASCOTA? 5. HAY ALGUN CASO DE TOXOPLASMOSIS EN SU FAMILIA? GRACIAS MARIUXI MEDINA Q. CECILIA MUÑOZ P. 143 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA Esquema de pipeteo: Los reactivos y las muestras deberán estar a temperatura ambiente antes del uso. Diluir el suero del paciente 1+ 100 con Buffer de dilución IgG, por ejemplo 10µl de suero + 1ml de Buffer de dilución IgG y mezclar vigorosamente. Las muestras diluidas se pueden almacenar hasta 48 horas entre 2 a 8°C. Los controles son listos para su uso. ETAPA 1 Pocillo (µl) A1 B1/C1 D1/C2 Blanco CN CP Muestra Control negativo en duplicado --- 100 --- --- Cut-off (5UI/ml) en duplicado, D1/E1 --- --- 100 --- CP bajo (30UI/ml) en duplicado, F1/G1 --- --- 100 --- CP medio (100UI/ml) en duplicado, H1/A2 --- --- 100 --- CP alto (200UI/ml) en duplicado, B2/C2 --- --- 100 --- --- --- 100 --- Muestra diluida D2… Cubrir los micropocillos en porta tiras con cintas adhesivas. Incubar por 30 minutos a 17 o 25°C. Lavar 5 veces: remover las cintas adhesivas. Aspirar el contenido en un envase con solución de Hipoclorito de Sodio al 5%, agregar solución de lavado aspirar después de aproximadamente 30’’ y repetir el lavado, remover el líquido remanente invirtiendo los micropocillos sobre papel absorbente. Solución de lavado de trabajo 350 350 350 350 ETAPA 2 Conjugado Anti-IgG --- 100 100 100 Cubrir los micropocillos en porta tiras con cintas adhesivas. Incubar por 30 minutos a 17 o 25°C. Lavar 5 veces: como se describió anteriormente. Solución de lavado de trabajo 350 350 350 350 100 100 100 100 100 100 ETAPA 3 Reactivo substrato 100 Incubar por 15’ a 17 o 25°C 5n la oscuridad. Solución de parada 100 Mezclar cuidadosamente Llevar a cero de absorbancia el instrumento lector de ELISA Con el blanco de substrato en el pocillo A1. Medir la absorbancia a 450nm lo más pronto posible o dentro de 30 minutos, después de terminar la reacción usando una longitud de onda de referencia de 630-690nm (si está disponible). MARIUXI MEDINA Q. CECILIA MUÑOZ P. 144 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA BIBLIOGRAFÍA: 1. ATLAS COLOR DE PARASITOLOGÍA CLÍNICA, Viqar ZAMAN, Editorial Panamericana, Segunda Edición, Buenos Aires, Mayo 1998. 2. DIAGNÓSTICO MICROBIOLÓGICO, Bailey/Scout; Finegold/Baron. Editorial Panamericana, Séptima edición Buenos Aires-Argentina 1.991. 3. FARMACOLOGÍA, H.P. Rang, M.M. Dale, Editorial CLAMEDES, S.L., Segunda Edición, España. 2001. 4. INTERNET http://editorial.unab.edu.co/revistas/medunab/pdfs/r24rt_c3.html 5. INTERNET http://www.bvs.sld.cu/revistas/mtr/vol53_3_01/mtr04301.htm 6. INTERNET http://www.infectio.org/upload/eve23.pdf 7. INTERNET http://www.bvs.sld.cu/revistas/mgi/vol12_4_96/mgi07496.htm 8. LECCIONES DE PARASITOLOGÍA HUMANA, Dr., José D. Rodríguez M., Departamento de publicaciones de la Universidad de Guayaquil, Cuarta Edición, 1969. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 145 UNIVERSIDAD DE CUENCA FACULTAD DE CIENCIAS QUÍMICAS ESCUELA DE BIOQUÍMICA Y FARMACIA 9. MEDICINA TROPICAL, Dr. Telmo Fernández Ronquillo, Imprenta Mariscal, Quito-Ecuador, 2004. 10. PARASITOSIS HUMANAS, David Botero, Marcos Restrepo, Tercera Edición, Medellín-Colombia, 1998. 11. QUIMICA CLINICA, Shauna C. Anderson, Ph.D., Susan Cockayne, Ph.D., Editorial Interamericana Mcgraw-Hill, 1993. 12. VADEMÉCUM CLÍNICO DEL DIAGNÓSTICO AL TRATAMIENTO, V. FATTORUSSO; O. RITTER, Editorial El Ateneo, Novena Edición, España, 2004. 13. Williams Obstetricia, Varios Autores, Editorial Médica Panamericana, 21° Edición; Estados Unidos, 2004. 14. Prueba ELISA para la detección de anticuerpos IgG AntiToxoplasma gondii en suero Humano (técnica proporcionada por la casa comercial) referencias: www.human.de/data/gb/vr/el- toxog.pdf. MARIUXI MEDINA Q. CECILIA MUÑOZ P. 146