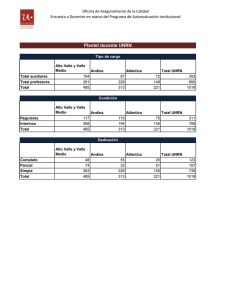
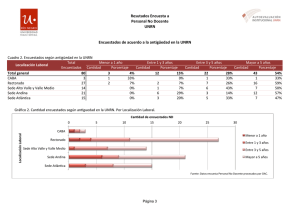
Reacciones quimicas
Anuncio

Reacciones químicas y principios de estequiometría Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS ¿Porqué estudiamos las reacciones? y Primero: examinarlas y familiarizarnos con las reacciones químicas y sus ecuaciones balanceadas. y Segundo: pensar en cómo podríamos predecir los productos de algunas de estas reacciones conociendo únicamente sus reactivos. La clave para predecir los productos formados por una combinación dada de reactivos es reconocer patrones generales de reactividad química. Reconocer un patrón de reactividad hace que nuestra comprensión sea más amplia que si nos limitamos a memorizar un gran número de reacciones sin relación entre sí. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Estequiometría y En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento o parte) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el transcurso de una reacción química (El primero que enunció los principios de la estequiometría fue Jeremias B. Richter en 1792) y La estequiometría de reacciones químicas es el estudio de los aspectos cuantitativos de las reacciones. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Ley de conservación de la Masa (Ley de Lavoisier, 1783) En una reacción química la masa total de los reactantes es igual a la masa total de los productos. Es decir, en la naturaleza nada se crea ni se destruye, sólo se transforma o se reordena. Masa de los Reactivos Dra. Patricia Satti, UNRN Masa de los Productos REACCIONES QUÍMICAS Ley de las proporciones definidas (Ley de Proust, 1799) “Cuando los elementos se combinan para formar compuestos lo hacen siempre en proporciones en peso definidas”. La ley de las proporciones definidas constituyó una poderosa arma en la búsqueda de la composición y las reacciones químicas. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Estequiometría y La estequiometría de reacciones químicas es el estudio de los aspectos cuantitativos de las reacciones. y Reacción química: proceso en el cual una o varias sustancias puras (REACTIVOS o REACTANTES) se transforman para formar una o más sustancias nuevas (PRODUCTOS). y Se representan mediante ecuaciones químicas. Dra. Patricia Satti, UNRN 6 REACCIONES QUÍMICAS y La reacción química es sólo un reordenamiento de átomos. y En la reacción química se conserva el número de átomos. y En la reacción química NO se interviene sobre los núcleos. y La REACCIÓN QUÍMICA se representa, en forma abreviada, mediante una ECUACIÓN QUÍMICA. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y Como toda ecuación, la ecuación química (e.q.), tiene dos miembros. y Las sustancias al lado izquierdo se denominan REACTANTES o REACTIVOS y las del lado derecho, PRODUCTOS. y El signo = se reemplaza por y su significado es “se transforma en”. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS La ecuación química Una Ecuación química es una representación simbólica de una Reacción química CH4 + 2 O2 → CO2 + 2 H2O y En la e.q. tanto los REACTANTES como PRODUCTOS se representan mediante la FÓRMULA del compuesto ó el SÍMBOLO del elemento. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y En la ecuación se trata de incorporar el máximo de información posible. y El estado en que participan reactantes y productos, se indica en forma abreviada y entre paréntesis inmediatamente después de la fórmula o del símbolo. y Ejemplos. H2O (l) CO (g) H2O (s) H2SO4(aq) donde (s) o con una flecha hacia abajo (↓) = sólido; (l)= líquido; (g) o con una flecha hacia arriba (↑) = gas (aq) ó (ac) = en solución acuosa Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y La ecuación debe escribirse en forma balanceada. Esto requiere que para cada elemento se cumpla: y El balance de una e.q. se logra anteponiendo a cada FÓRMULA un N° que permita cumplir con el requisito indicado en el punto anterior. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS ¿Qué información nos da la ecuación química? N2 (g) 1 moléc. de N2 2 át. de Nitróg 28 uma de N2 + 3 H2 (g)→ 3 moléc. de H2 6 át. de Hidróg 6 uma de H2 2 NH3 (g) 2 moléc. de NH3 2 át. de Nit y 6 át. de Hid 34 uma de NH3 y Se conserva la masa y la cantidad de átomos de cada tipo. y También puedo hacer “relaciones cruzadas”: y 28 uma de N2 reaccionan con 6 átomos de hidrógeno para dar 2 moléculas de NH3 y Todo esto es a nivel MICROSCÓPICO Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS A nivel macroscópico N2 (g) + 3 H2 (g)→ 2 NH3 (g) 1 mol de moléc. de N2 3 moles de moléc. de H2 2 moles de moléc. de NH3 6,022 x 1023 moléc. de N2 3 x 6,022 x 1023 moléc. de H2 28 g de N2 6 g de H2 22,4 L de N2 (en CNPT) 3 x 22,4 L de H2 (en CNPT) 2 x 6,022 x 1023 moléc. de NH3 34 g de NH3 2 x 22,4 L de NH3 (en CNPT) yTambién acá puedo hacer relaciones cruzadas y Lo que no puedo es mezclar el nivel micro con el nivel macro Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y El balance de una ecuación química se logra anteponiendo a cada FÓRMULA un N°que permita cumplir con el requisito del punto anterior. y Este número, en general, se determina “ensayando”(Por tanteo) y en casos más complicados se recurre a métodos específicos para balancear ecuaciones. y Una vez balanceada la ecuación es necesario saber INTERPRETARLA para poder realizar los cálculos cuantitativos. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS La ecuación química C4H10 (g) + O2 (g) → reactivos (o reactantes) H2O (g) + CO2 (g) productos Ecuación balanceada 2 C4H10 (g) + 13 O2 (g) → 10 H2O (g) + 8 CO2 (g) Coeficientes estequiométricos. Indican la proporción en moles o en moléculas, NO EN GRAMOS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Balanceo de ecuaciones (tanteo) monóxido de nitrógeno + oxígeno → dióxido de nitrógeno Paso 1: Escriba la reacción usando símbolos químicos. NO2 NO O2 NO NO2 2 NO + 1 O2 → 2 NO2 Paso 2: Balancee la ecuación química. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Recomendaciones para balancear y No introduzca átomos “extraños” para balancear. NO + O2 → NO2 + O y No cambie fórmulas tratando de balancear la ecuación. NO + O2 → NO23 y Balancee primero, los elementos que aparecen en sólo un compuesto en cada lado de la ecuación. y Balancee los elementos libres por último. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y Ej.1: escribir y equilibrar la reacción que muestre la combustión del gas propano (C3H8) en el aire. En esta reacción el propano reacciona con oxígeno y se produce agua y dióxido de carbono 5 O2 (g) → 48H2O (g) + 63 CO2 (g) 2 C3H8 (g) + 10 Interpretación cuantitativa de la ecuación anterior: 1 mol de C3H8(g) reaccionan completamente con 5 moles de O2(g) para producir: 3 moles de CO2(g) y 4 moles de H2O(g) Mientras no se especifique otra cosa, la reacción se supondrá COMPLETA , ES DECIR QUE OCURRE EN UN 100% Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Balance Ejemplo 2 y El óxido nítrico, NO, se forma a partir de N2 y de O2. y Esta reacción ocurre en motores de combustión, hornos de soplado, en tormentas eléctricas y cada vez que el aire se calienta fuertemente. y Para la reacción de formación del óxido nítrico: y a) identifique reactantes y producto y b) escriba la ecuación (balanceada) y c) interprétela en términos de: y y y partículas (moléculas o átomos) moles masa Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS c) Interpretación de la ecuación y Los números que preceden las fórmulas en la ecuación química se denominan COEFICIENTES ESTEQUIOMÉTRICOS. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Balance Ejemplo 3 y En el flash de una cámara fotográfica ocurre el siguiente cambio: un alambre de magnesio reacciona con oxígeno y produce óxido de magnesio. A consecuencia de este cambio se produce un calentamiento del sistema y una iluminación. Describa la ecuación completa de la reacción Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS c) Interpretación de la ecuación Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Reacciones químicas Dra. Patricia Satti, UNRN 25 REACCIONES QUÍMICAS Tipos de reacciones químicas y La clasificación de las reacciones químicas en general no es excluyente, por eso una reacción química puede a veces ser incluida en varios de los tipos de la clasificación. En la mayoría de los textos, las reacciones se clasifican en y Reacción de Simple Desplazamiento y Reacción de Doble Desplazamiento y Reacción de Combinación o Síntesis y Reacción de Descomposición Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Tipos de reacciones químicas Simple Desplazamiento Doble Desplazamiento Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Simple Desplazamiento y Un elemento desplaza a otro elemento en un compuesto: Zn + 2 HCl Dra. Patricia Satti, UNRN ZnCl2 + H2 REACCIONES QUÍMICAS Simple Desplazamiento y En las reacciones de simple desplazamiento un metal en estado fundamental o no combinado desplaza a otro metal de un compuesto debido a que tiene una mayor actividad química. y Serie de Actividad: y Es una serie de metales “acomodados” por orden de reactividad química. y Los metales por debajo del hidrógeno en la serie de actividad no reaccionan con ácidos. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Serie de actividad y Los elementos más activos desplazan de los compuestos a los menos activos. Zn(s) + CuCl2(ac) Cu(s) + ZnCl2(ac) Cu(s) + ZnCl2(ac) Zn(s) + CuCl2(ac) Zn(s) + HCl(ac) H2(g) + ZnCl2(ac) Más activo K Na Ca Mg Al Zn Fe Ni Sn Pb H Cu(s) + HCl(ac) Dra. Patricia Satti, UNRN H2(g) + CuCl2(ac) Cu Ag Au REACCIONES QUÍMICAS Aplicación del concepto de actividad y Metales activos: Incluye la mayoría de metales de los grupos I, II. Li> K> Ba> Sr> Ca> Na y Los metales activos reaccionan directamente con el agua: 2Na + 2H2O(l) → 2NaOH(ac) + H2(g) y Serie de actividad para no-metales: F Cl Br I Más activo Cl2(g) + 2NaBr(ac) Cl2(g) + NaF(ac) Dra. Patricia Satti, UNRN → 2NaCl(ac) + Br2(l) → No Reaccionan REACCIONES QUÍMICAS y Metal y una solución acuosa Cu(s) + metal1 2AgNO3(ac → solución acuosa1 2Ag(s) + metal2 Cu(NO3)2(ac) solución acuosa2 y Metal y ácido en solución acuosa Zn(s) + H2SO4(ac) → metal ácido acuoso ZnSO4(ac) + H2(g) solución acuosa hidrógeno gas y Metal activo y agua Ca(s) + 2H2O(l) metal Dra. Patricia Satti, UNRN agua → Ca(OH)2(ac) + hidróxido de metal H2(g) hidrógeno gas REACCIONES QUÍMICAS Ejemplo: sustitución del hidrógeno del ácido por hierro Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Sustitución de Ag por Cu Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Sustitución del hidrógeno del agua por el sodio Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Doble Desplazamiento y Hay un intercambio entre elementos de dos compuestos: H2SO4 + 2NaOH Dra. Patricia Satti, UNRN NaSO4 + 2H2O REACCIONES QUÍMICAS Reacciones de Neutralización y Una reacción de neutralización es un caso especial de reacción de doble desplazamiento. y En una reacción de neutralización, un ácido fuerte y una base fuerte reaccionan para formar un compuesto iónico (sal) y agua. y Según la definición original: ácido – sustancia que libera iones hidrógeno H+. y Según la definición original: base – sustancia que libera iones OH-. HCl(ac) + Dra. Patricia Satti, UNRN NaOH(ac) → NaCl(ac) + H2O(l) REACCIONES QUÍMICAS Reacciones de Neutralización y Una reacción de neutralización es un caso especial de reacción de doble desplazamiento HCl(ac) + NaOH(ac) → NaCl(ac) + H2O(l) Ecuación iónica completa H+(ac)+ Cl-(ac)+ Na+(ac)+ OH-(ac) → Na+(ac)+ Cl-(ac) + H2O(l) Ecuación iónica neta Iones no participantes o espectadores H+(ac)+ OH-(ac) → H2O(l) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Reacciones de Precipitación y Se produce cuando se mezclan soluciones de dos electrolitos fuertes que reaccionan para formar un sólido insoluble. y Si no se forma un precipitado no hay reacción. Esto se puede preveer de acuerdo a las reglas de solubilidad. AgNO3(ac) + NaCl(ac) → AgCl(s) + NaNO3(aq) Ecuación iónica completa Ag+(ac)+NO3-(ac)+Na+(ac)+ Cl-(ac) → Na+(ac)+NO-3(ac)+ AgCl(S)↓ Ecuación iónica neta Iones espectadores Ag+(ac)+ Cl-(ac) → AgCl(S) ↓ Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Reacciones de Formación de gas • Otro tipo de reacción de doble desplazamiento comprende la formación de sustancias no ionizadas, como el agua y el dióxido de carbono. Por ejemplo, cualquier carbonato, aún en estado sólido o en solución acuosa, reacciona con un ácido para formar agua y dióxido de carbono, más una sal, según la siguiente ecuación: CaCO3(ac) + 2HCl(ac) → CaCl2(s) + H2O (l) + CO2(g) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Tipos de reacciones químicas Combinación Descomposición Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Tipos de reacciones químicas y Reacción de Combinación o Síntesis A+Z → AZ y Reacción de Descomposición AZ → A+Z yReacción de oxidación-reducción y Ejemplo especial, reacciones de combustión Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Óxido Reducción y Hay un intercambio de electrones entre dos compuestos: gana electrones CuSO4 + Zn ZnSO4 + Cu pierde electrones Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Óxido Reducción o Redox y Un átomo de alguna de las sustancias que reaccionan cede electrones a un átomo de otra de las sustancias que reaccionan. y Se dice que una sustancia se oxida si pierde electrones. y Se dice que una sustancia se reduce si gana electrones. Fe 0 + 2 HCl → +1 -1 FeCl2 +2 -1 + H22 0 Perdió electrones = se oxidó Ganó electrones = se redujo Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Óxido Reducción o Redox 3 H2S + 4 HClO3 → 3 H2SO4 + 4 HCl +1 -2 +1 +5 -2→ +1 +6 -2 +1 -1 Perdió electrones = se oxidó Ganó electrones = se redujo Fe2O3 + 3 CO → 2 Fe + 3 CO2 5 H2O2 + 2 KMnO4 + 3 H2SO4 → →5 O2 + 2 MnSO4 + K K22SO SO44++ 8 H H22O O Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Óxido Reducción o Redox y El átomo o grupo de átomos que en una reacción redox cede electrones (se oxida) es el agente reductor ya que provoca la reducción de otra sustancia que toma esos electrones. y El átomo o grupo de átomos que en una reacción redox gana electrones (se reduce) es el agente oxidante ya que hace que otra sustancia se oxide al quitarle electrones. 2KMnO KMnO4 + +16 HCl → 2 MnCl2 + 5Cl Cl2 + 8H H2O +2KCl + KCl Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Reacciones de combustión y Son ejemplos particularmente importantes de reacciones redox y En una reacción de combustión, el oxígeno reacciona con otra sustancia, desprendiéndose gran cantidad de energía, a menudo en forma de luz y calor CH4 + 2 O2 ⇒ CO2 + 2 H2O El mechero se enciende cuando el gas que contiene reacciona con el oxígeno del aire La combustión completa de un compuesto orgánico siempre da dióxido de carbono y agua Dra. Patricia Satti, UNRN 47 REACCIONES QUÍMICAS y Durante nuestra vida estamos acostumbrados a utilizar cobre en monedas, plomería y cables.El cobre se obtiene de minerales sulfurados tales como sulfuro de cobre(I), mediante procesos de varias etapas. y Después de una etapa inicial de molienda, el mineral se tuesta (se calienta fuertemente con oxígeno) para formar un óxido de cobre(I) en polvo y dióxido de azufre gaseoso. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y 2 Cu2S(s) + 3 O2(g) → 2 Cu2O(s) + 2 SO2(g) y Para obtener cobre a partir del mineral mencionado, el óxido de cobre(I) obtenido se hace reaccionar con carbono. y Esta reacción produce cobre y monóxido de carbono. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Combinación y 2 sustancias (elementos o compuestos) se combinan para formar un compuesto: 2H2 + O2 Dra. Patricia Satti, UNRN 2H2O REACCIONES QUÍMICAS y Hay muchos ejemplos de estas reacciones, por ejemplo, el Mg metálico arde en aire con mucho brillo para producir óxido de magnesio, y Esta reacción es la que ocurre en el flash de una cámara fotográfica: un alambre de magnesio reacciona con oxígeno y produce óxido de magnesio. A consecuencia de este cambio se produce un calentamiento del sistema y una iluminación. Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y Cuando hay una reacción de combinación entre un metal y un no metal, como en esta ecuacion el producto es un sólido iónico. 2 Mg(s) + O2(g) → 2MgO(s) y En este caso cuando el magnesio reacciona con oxígeno, el magnesio pierde electrones y forma el ion magnesio, Mg2+. El oxígeno gana electrones y forma el ion óxido, O2-. y Además de una combinación es una reacción de óxido reducción Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y No-metal y oxígeno gaseoso: S(s) + O2(g) → SO2(g) no-metal + oxígeno gas → óxido de no-metal El producto es un compuesto binario. Otros ejemplos N2(g) + 3H2(g) → 2NH3(s) CaO(s) + H2O(l) → Ca(OH)2(s) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS Combinación de yodo con zinc yodo Dra. Patricia Satti, UNRN zinc Yoduro de zinc REACCIONES QUÍMICAS Descomposición y Un compuesto se descompone en partes 2H2O Dra. Patricia Satti, UNRN 2H2 + O2 REACCIONES QUÍMICAS Descomposición – Particularidades 1) DESCOMPOSICIÓN TÉRMICA (la energía absorbida se suministra mediante calor) 2 Ag2O (s) Î 4 Ag (s) + O2 (g) 2) DESCOMPOSICIÓN ELECTROLÍTICA (la energía absorbida se suministra mediante electricidad) 2 H2O (l) Î 2H2 (g) + O2 (g) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS DESCOMPOSICIÓN TÉRMICA y Muchos compuestos sufren reacciones de descomposición cuando se calientan. Por ejemplo, muchos carbonatos metálicos se descomponen por calor para formar óxidos metálicos y dióxido de carbono. CaCO3(s) → CaO(s) + CO2(g) Otros ejemplos 2KClO3(s) → 2KCl(s) + 3O2(g) PbCO3(s) → PbO(s) + CO2(g) Cu(OH)2(s) → CuO(s) + H2O(l) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS yLa descomposición del CaCO3 o caliza es un proceso comercial importante. Las conchillas de moluscos o la piedra caliza se calientan para preparar CaO. yEl consumo de cal viva se utiliza, por ejemplo, en la fabricación de vidrio que se obtiene por fusión a aprox. 1500°C de arena de sílice (SiO2), carbonato de sodio (NaCO3) y caliza Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS y La descomposición de azida de sodio desprende rápidamente nitrógeno gaseoso, por esto esta reacción se usa para inflar las bolsas de aire de seguridad de los automóviles. 2NaN3(s) → 2Na(s) + 3N2(g) yEl sistema está diseñado de forma que un impacto cause el encendido de un casquillo detonador, que a su vez hace que la azida se descomponga explosivamente. yUna cantidad pequeña de azida (aproximadamente 100 g) forma una cantidad grande de gas (unos 50 L) Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS DESCOMPOSICIÓN ELECTROLÍTICA Dra. Patricia Satti, UNRN REACCIONES QUÍMICAS