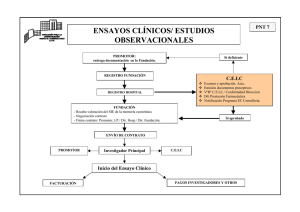
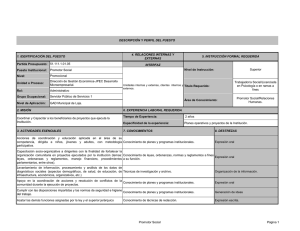
contrato estudio observ. pssjd
Anuncio

CONTRATO DE COLABORACIÓN ECONÓMICA REALIZACIÓN DE ESTUDIOS OBSERVACIONALES En Esplugues de Llobregat, a de PARA LA de 2012 REUNIDOS De una parte, PARC SANITARI SANT JOAN DE DÉU, domiciliado en Sant Boi de Llobregat, con CIF: R5800646A, en adelante denominado HOSPITAL, representado por su Director General Don Enric Mangas i Monje. El HOSPITAL es una entidad sin ánimo de lucro que tiene establecidos como objetivos entre otros, “las actividades de investigación y divulgación relacionadas con el ámbito de la salud”. FUNDACIÓ SANT JOAN DE DÉU con C.I.F. G62978689 y domicilio en C/ Santa Rosa 39-57, 3ª planta, 08950 Esplugues de Llobregat (Barcelona), (en adelante la FUNDACIÓ), representada por Don Emili Bargalló Angerri, en calidad de Director. Dr. , con NIF: , del Servicio de (en adelante el INVESTIGADOR PRINCIPAL), del Hospital Y de la otra, , con CIF: como promotor del estudio y domicilio:………………………………………………………………… (en adelante el PROMOTOR). EXPONEN Que el PROMOTOR está interesado en promover el Estudio titulado: “ ……………………………………………………………………………….”,de acuerdo al Protocolo nº en el cual se definen sus características. Que el Hospital ................................................................ tiene conocimiento del estudio mencionado y presta su conformidad para que se realice en sus instalaciones la investigación descrita en aquél, en los términos y condiciones que se pactan en este Contrato. Que el Dr. XXXXXXXXXXXX, como Investigador Principal, está interesado y ha prestado su compromiso en y para la realización del estudio, de acuerdo también con las estipulaciones pactadas en este Contrato. Que las partes tienen capacidad legal suficiente para suscribir el presente contrato de colaboración. De conformidad con lo precedente, los comparecientes convienen en otorgar el presente Contrato de Colaboración con arreglo a las siguientes ESTIPULACIONES Primera. Objeto del Contrato El objeto del contrato es la realización de la Investigación clínica a que se refieren los expositivos, descrita detalladamente en el protocolo del estudio. Segunda. Condiciones del Estudio a) Es aplicable el Real Decreto 1344/2007, de 11 de octubre, “por el que se regula la farmacovigilancia de medicamentos de uso humano”. La Orden SAS/3470/2009, de 16 de diciembre, “por la que se publican las directrices sobre estudios post-autorización de tipo observacional para medicamentos de uso humano”. Además será aplicable la legislación que con carácter general regula los estudios observacionales post-autorización. b) El Protocolo ha sido aprobado por el CEIC de la Fundació Sant Joan de Déu en fecha............................. y por la Dirección General de Farmacia de la Dirección General de Recursos Sanitarios de Catalunya en fecha.......................... c) El número de sujetos a incluir en el estudio es: XXX d) La duración prevista del estudio es de XXX meses a partir de la firma del presente contrato por todas las partes. e) La inclusión de pacientes en el estudio se realizará en la forma prevista y en el período de tiempo prefijado. Cualquier modificación requerirá mutuo acuerdo entre las partes. Tercera. Obligaciones a) Del Promotor: − Firmar con el investigador coordinador la descripción del estudio y cualquier modificación a la misma. − − − − − − − Suministrar a los investigadores la descripción del estudio y la ficha técnica de los medicamentos a estudiar. Remitir la descripción del estudio al Comité Ético de Investigación Clínica. Presentar la descripción del estudio y los informes de seguimiento y final, en los plazos establecidos y comunicar en su caso, la interrupción y las razones de la misma. Entregar copia de la descripción del estudio y de los documentos que acrediten el seguimiento de los procedimientos establecidos en las presentes directrices a los responsables de las entidades proveedoras de servicios de atención de salud donde se vaya a realizar el estudio. Comunicar las sospechas de reacciones adversas graves que surjan a lo largo del estudio al punto de contacto designado por el órgano competente en materia de farmacovigilancia en la Comunidad Autónoma donde haya ocurrido y a la Agencia Española del Medicamento. Identificar las fuentes de financiación del estudio. Designar al monitor del estudio. Además de todas las establecidas en la Orden SAS/3470/2009, de 16 de diciembre. b) Del Investigador : − − Recoger la información requerida por el estudio. Firmar un compromiso por el que se reconocen investigadores del estudio y afirman que conocen la descripción del estudio y están de acuerdo con ella en todos sus términos. Informar a los sujetos de investigación y obtener su consentimiento. Recoger, registrar y notificar los datos de forma correcta respondiendo de su utilización y calidad ante las auditorias e inspecciones oportunas. Notificar al promotor los acontecimientos adversos según se establezca en la descripción del estudio. Respetar la confidencialidad de los datos del sujeto. Facilitar las auditorias del promotor y las inspecciones de las autoridades sanitarias. Saber responder de los objetivos, metodología básica y significado de los resultados del estudio ante la comunidad científica y profesional. Informar de su participación en el estudio a los responsables de la dirección del centro al que pertenece. − − − − − − − Además de todas las establecidas en la Orden SAS/3470/2009, de 16 de diciembre. Cuarta. Compensación económica La realización del estudio supone unos gastos totales por paciente evaluable que complete el estudio de …….. €, según la memoria económica que se adjunta como anexo al presente contrato. El 25% del total de los importes facturados se destinará a cubrir los costes indirectos derivados de la realización del estudio. Si algún paciente tuviese que abandonar el estudio a consecuencia de un efecto Adverso Grave atribuible al fármaco en investigación, será considerado, a efectos de pago, evaluable, excepto si el Acontecimiento Adverso Grave se derivase de una negligencia o mal praxis del Investigador Principal o colaboradores. En caso de los pacientes que sean retirados a lo largo del estudio por razones de incumplimiento (inasistencia del paciente a alguna visita a control clínico del investigador, etc.), a excepción de los pacientes que hubieran sido incluidos en el estudio erróneamente (inobservancia de los criterios de inclusión y de exclusión del Protocolo, etc.), la cantidad a percibir será proporcional al número de visitas y/o pruebas diagnósticas y/o exploraciones complementarias efectuadas de conformidad con las que se definen en el Protocolo. El PROMOTOR hace constar, que en relación a este estudio en el HOSPITAL, no se han establecido, ni se establecerán acuerdos ajenos al presente contrato con el INVESTIGADOR principal, ni investigadores colaboradores de La FUNDACIÓN o del HOSPITAL, de los cuales se deriven compensaciones económicas adicionales u otro tipo de contraprestaciones. Se excluyen de la presente cláusula los gastos de reuniones para la organización del ESTUDIO, en el caso que este fuera multicéntrico, así como aquellas facilidades que en el futuro el PROMOTOR pueda disponer para la divulgación de los resultados obtenidos en el ESTUDIO en reuniones y publicaciones científicas. Una vez firmado el presente contrato, la FUNDACIÓ facturará al PROMOTOR, 400€ más el iva aplicable, en concepto de gastos de gestión del contrato. Dicha factura se emitirá a: Nombre PROMOTOR: Dirección: CIF: Y se enviará a: Quinta. Forma de pago El pago se realizará previa presentación de factura por la Fundació con la aplicación de los impuestos que legalmente correspondan. Los pagos serán realizados por transferencia bancaria a los 30 días de la recepción de la factura correctamente emitida a la cta. cte. Nº:21003887000100119999. Séxta. Suspensión del estudio El estudio podrá suspenderse a instancia del cualquiera de las partes, por las siguientes causas: 1. Por acuerdo de las partes contratantes. 2. Por incumplimiento por el Investigador, o por su equipo, de las obligaciones contraídas en el presente contrato. 3. Por impedir, directa o indirectamente, el centro, la normal realización del estudio. 4. Por no cumplirse, o cumplirse de forma deficiente, la descripción del estudio o por registrarse los datos reiteradamente, de modo inexacto o incompleto. 5. Si el Promotor quisiera finalizar o suspender el estudio por razones comerciales. 6. Si el Promotor tuviera razones justificadas y acreditadas para estimar que no se podrá completar el estudio satisfactoriamente. La suspensión del estudio se efectuará o establecerá siempre por escrito. Las partes intervinientes se comprometen, para el supuesto de suspensión y con reserva de sus acciones o reclamaciones y al margen de las mismas, a garantizar la seguridad del paciente, la conformidad del tratamiento y el cumplimiento de la normativa legal vigente. El Promotor estará obligado al pago de todas aquellas prestaciones que hubieren sido realizadas hasta el momento, además de todos aquellos gastos comprometidos, salvo aquellas prestaciones que, realizadas en forma defectuosa,, hubieren originado la suspensión del estudio, o que la suspensión derivase del incumplimiento de las funciones y obligaciones del Investigador.. Séptima. Propiedad Intelectual e Industrial Tanto la propiedad intelectual como la industrial de los datos, resultados, descubrimientos, invenciones, métodos e información, patentable o no, realizados, obtenidos o desarrollados durante la realización del estudio por el Investigador, por los colaboradores y cualquier persona implicada en el desarrollo del mismo, serán y permanecerán de la exclusiva propiedad del Promotor. El Investigador se obliga a facilitar al Promotor los resultados completos de las pruebas y de todos los datos obtenidos en el estudio y le informará inmediatamente de todos y cada uno de los descubrimientos y mejoras concebidas o realizadas en relación al fármaco en investigación objeto del estudio clínico. Cuando el Investigador sea requerido por el Promotor, aportará el testimonio necesario para solicitar y obtener los derechos de patente en cualquier país o para proteger los intereses del Promotor. Este último deberá compensar al Investigador por el tiempo y gastos invertidos en aquellas gestiones. Una vez finalizado el estudio y obtenidos los resultados positivos o negativos de éste, el promotor se compromete a divulgar el informe final con los resultados del estudio sean positivos o negativos. Octava. Confidencialidad Las partes se comprometen al tratamiento confidencial de toda información recibida del Promotor y de la obtenida durante la Investigación clínica, así como de los resultados de la misma. En consecuencia con ello, no facilitarán a terceros datos o contenidos de la información mencionada, sino con el consentimiento expreso y escrito y con las condiciones que establezca el Promotor o por prescripción legal. Cuando así lo requiera la descripción del estudio, y en todo caso en los términos establecidos en la Ley 15/1999 de 13 de Diciembre, de Protección de Datos de carácter personal, y demás legislación aplicable, los investigadores deberán asegurarse de que se mantenga el anonimato del paciente en todo momento. La autorización del Promotor será también necesaria para la divulgación general o publicación de datos, informaciones o resultados de la Investigación clínica. En todo caso, la divulgación o publicación deberá salvaguardar los derechos de propiedad industrial que correspondan al Promotor. Novena. Fuero Los litigios que pudieran derivarse del presente acuerdo se mantendrán siempre sometidos a la jurisdicción de los Tribunales y Juzgados de Esplugues de Llobregat, con sumisión expresa de ambas partes a este fuero y con renuncia de cualquier otro que pudiera corresponderle. Décima. Informes Las partes se comprometen a colaborar e informarse periódicamente en relación con la marcha del Estudio, su seguimiento y los resultados del mismo. Para la debida constancia de todo lo acordado, se firma este convenio por cuadruplicado en el lugar y fecha indicados al comienzo. Sr. Enric Mangas i Monje Director General HOSPITAL Sr. Emili Bargalló Director FUNDACIÓ Angerri Dr. INVESTIGADOR PRINCIPAL Sr. PROMOTOR